PHẠM ĐẶNG DUY QUANG*
NGUYỄN THANH HIỀN
*Khoa Tim mạch can thiệp BV Đại học Y Dược
I. ĐẶT VẤN ĐỀ
Trên thế giới, bệnh tim thiếu máu cục bộ là một trong những nguyên nhân gây tử vong hàng đầu. Bệnh nhân hội chứng vành cấp có biểu hiện lâm sàng, hình ảnh học và giải phẫu bệnh rất đa dạng [1]. Huyết khối trong lòng mạch vành từng được nghĩ hầu như do nứt vỡ mảng xơ vữa, tuy nhiên bệnh nhân hội chứng vành cấp thực tế có nhiều dạng sang thương đích khác nhau [2, 3, 4]. Cơ chế sinh bệnh học thường gặp thứ hai, xói mòn mảng xơ vữa, được mô tả ban đầu từ tử thiết bệnh nhân đột tử và bệnh nhân tử vong sau nhồi máu cơ tim cấp, sau đó được xác nhận nhiều hơn gần đây nhờ các phương tiện hình ảnh học nội mạch vành [2, 5, 6, 7].
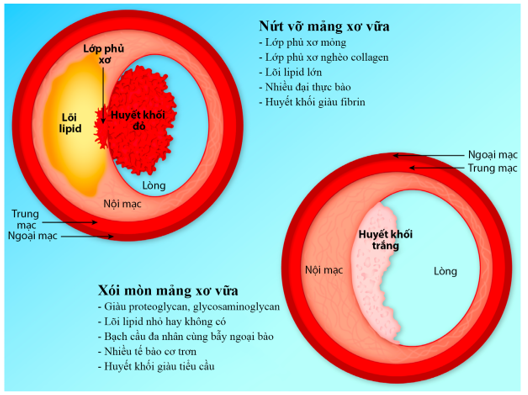
Về lý thuyết, có 3 cơ chế gây hội chứng vành cấp đã được đề xuất gồm: (1) Nứt vỡ mảng xơ vữa, cơ chế thường gặp nhất, thường là biến chứng của mảng xơ vữa có lõi giàu lipid, lớp phủ xơ bề mặt mỏng (Hình 1), khi vỡ gây hoạt hóa tiểu cầu và thành lập huyết khối, nhưng đôi khi xảy ra ở vị trí xơ vữa có nốt vôi hoá bên dưới, (2) Xói mòn mảng xơ vữa, trong đó huyết khối thành lập ở vùng nội mạc bị bóc mòn cạnh mảng xơ vữa, không có hiện tượng vỡ lớp phủ xơ bề mặt mảng xơ vữa, (3) Hội chứng vành cấp xảy ra không có hình thành huyết khối. Một số tác giả phân nốt vôi hoá là sang thương gây huyết khối cấp riêng, không thuộc nhóm nứt vỡ mảng xơ vữa – như vậy có 3 cơ chế tạo huyết khối cấp: nứt vỡ mảng xơ vữa, nốt vôi hoá, xói mòn mảng xơ vữa (Hình 1).
Mặc dù sinh lý bệnh của nứt vỡ mảng xơ vữa đã được tìm hiểu kỹ, cơ chế gây ra xói mòn mảng xơ vữa thì lại chưa [8]. Các biện pháp điều trị thuốc hiện nay đãchứng minh giúp “ổn định” mảng xơ vữa, vì vậy cơ chế của xói mòn mảng xơ vữa được tập trung tìm hiểu những năm gần đây do có thể góp phần ngày càng nhiều vào cơ chế gây hội chứng vành cấp.
II. DỊCH TỄ
Một trong những nghiên cứu đầu tiên được thực hiện bởi van der Walvà cộng sự [5] ghi nhận trên tử thiết 20 bệnh nhân nhồi máu cơ tim cấp: 12 bệnh nhân do vỡ mảng xơ vữa, 8 bệnh nhân do xói mòn mảng xơ vữa không vỡ. Một mô tả loạt ca 50 bệnh nhân đột tửsau đó cho thấy tỉ lệ xói mòn mảng xơ vữa chiếm 44%, nứt vỡ mảng xơ vữa chiếm 56% bệnh nhân[6]. Một trong những nghiên cứu lớn nhất thực hiện bởi Arbustini và cộng sự [7], trên 300 bệnh nhân nhồi máu cơ tim cấp, ghi nhận 98% bệnh nhân có hình thành huyết khối cấp, 25% bệnh nhân xói mòn mảng xơ vữa, trong đó nữ (37,4%) chiếm nhiều hơn nam (18,5%), không khác biệt đáng kể về vị trí hay phân bố vùng nhồi máu và huyết khối. Nhìn chung, có 11 nghiên cứu tử thiết cho đến nay đã mô tả về xói mòn mảng xơ vữa (Bảng 1), gộp chung lại, tần suất xói mòn mảng xơ vữa gây huyết khối mạch vành chiếm 31% [14].
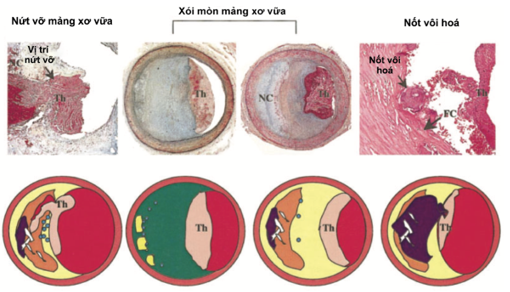
Hình 1: Trên, bên trái: Nứt vỡ mảng xơ vữa, cho thấy lớp phủ xơ bị vỡ kèm huyết khối (Th) lòng mạch, lõi hoại tử (NC) lớn thông với lòng mạch máu. Trên, ở giữa: Xói mòn mảng xơ vữa ở sang thương giàu proteoglycans và tế bào cơ trơn, huyết khối (Th) bám vào vùng bị mất nội mạc, những sang thương này có ít tế bào viêm, ít bạch cầu đơn nhân. Trên, bên phải: nốt vôi hoá chồi vào lòng mạch thông qua lớp phủ xơ bị nứt. Dưới: sơ đồ đặc điểm khác biệt giữa nứt vỡ mảng xơ vữa và xói mòn mảng xơ vữa. Theo Virmani và cs., Peter Libby và cs.[10]
Bảng 1: Các nghiên cứu dựa trên giải phẫu bệnh mảng xơ vữa xói mòn và đặc điểm bệnh nhân (theo White và cs. [14])
| Nghiên cứu | Cỡ mẫu | Tỉ lệ nữ | Tuổi trung bình | Nữt vỡ (%) | Xói mòn (%) |
| van der Wal và cs. | 20 huyết khối | (không có) | 63 | 60 | 40 |
| Farb và cs. | 96 đột tử/50 huyết khối | 32% | Nứt vỡ 53, Xói mòn 44 | 56 | 44 |
| Burke và cs. | 113 đột tử/59 huyết khối | 0% | 50 | 69 | 31 |
| Burke và cs. | 51 đột tử/26 huyết khối | 100% | Nứt vỡ 58, Xói mòn 45 | 31 | 69 |
| Arbustinin và cs. | 298 nhồi máu/291 huyết khối | 37% | Nứt vỡ 68, Xói mòn 70 | 75 | 25 |
| Kolodgie và cs. | 49 sang thương đích | 0% (Nứt vỡ), 45% (Xói mòn), 28% (Ổn định) | Nứt vỡ 46, Xói mòn 41, Ổn định 47 | 22 | 41 |
| Burke và cs. | 457 đột tử/224 huyết khối | (không có) | (không có) | 69 | 31 |
| Sato và cs. | 31 nhồi máu/23 huyết khối | 13% | Nứt vỡ 70, Xói mòn 68 | 78 | 22 |
| Schwartz và cs. | 44 đột tử | 14% | 51 | 57 | 43 |
| Kramer và cs. | 345 đột tử/181 huyết khối | 11% (Nứt vỡ), 26% (Xói mòn) | Nứt vỡ 52, Xói mòn 43 | 71 | 29 |
| Tavora và cs. | 314 đột tử/170 huyết khối | 19% | 50 | 70 | 30 |
III. SINH LÝ BỆNH
Không như nứt vỡ mảng xơ vữa, xói mòn mảng xơ vữa chưa được miêu tả kĩ [14]. Nhìn chung, xói mòn mảng xơ vữa xảy ra ở những sang thương giàu proteoglycans, cơ trơn mà mất đi lớp nội mạc. Quá trình xói mòn diễn tiến có thể theo 2 bước (hình 2). Bước đầu tiên, do xáo trộn dòng máu quanh mảng xơ vữa, thụ thể toll-like receptor 2 được hoạt hóa dẫn đến chết tế bào nội mạc, mất lớp nội mạc trên bề mặt mảng xơ vữa. Bước tiếp theo, bẫy ngoại bào bạch cầu đa nhân trung tính hình thành trên bề mặt lòng mạch bị mất nội mạc, hoạt hóa hình thành huyết khối, trong đó các tế bào miễn dịch thích ứng như T CD8+ có thể góp phần xói mòn. Cơ chế này khác với với cơ chế bệnh của nứt vỡ mảng xơ vữa, gồm kích hoạt quá trình viêm tại chỗ và toàn thân, huyết khối kích hoạt bởi yếu tố mô, tham gia chủ yếu của đại thực bào hơn bạch cầu đa nhân [1, 21].
Xói mòn mảng xơ vữa có vẻ có liên quan chủ yếu với huyết khối trắng giàu tiểu cầu, khác với nứt vỡ mảng xơ vữa kích hoạt dòng thác đông máu tạo huyết khối hỗn hợp đỏ (giàu fibrin/hồng cầu) và trắng (giàu tiểu cầu) [12,13]. Khảo sát trong lòng mạch ở những bệnh nhân tiêu sợi huyết thành công cho thấy thành phần chủ yếu của huyết khối tồn lưu đối với xói mòn mảng xơ vữa là tiểu cầu, đối với nứt vỡ mảng xơ vữa là hồng cầu [30]
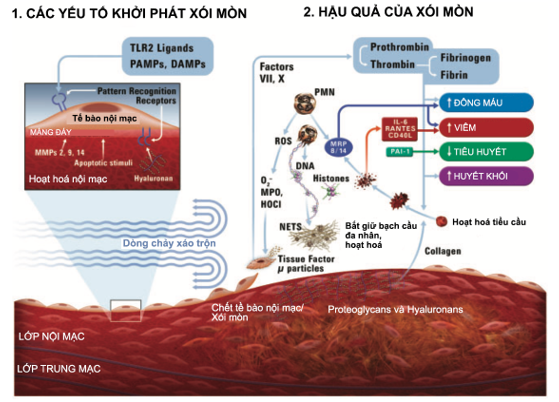
Hình 2: Hình biểu diễn các cơ chế sinh lý bệnh có thể gây xói mòn mảng xơ vữa (từ Quillard và cs. [21]).
PAMPs: pathogen-associated molecular patterns; DAMPs: danger-associated molecular patterns; TLR2: Toll-like receptor-2; MMP: matrix metalloproteinase; HOCl: hypochlorous acid; MPO: myeloperoxidase; NETs: bẫy ngoại bào bạch cầu đa nhân trung tính.
IV. Tiếp cận chẩn đoán
Nhờ sự tiến bộ của hình ảnh học nội mạch, ngày nay chúng ta có thể đánh giá chi tiết và hiểu bản chất giải phẫu nội mạch tốt hơn, giúp liên kết những ghi nhận hình ảnh thu được và biểu hiện lâm sàng.Hình ảnh cắt lớp quang kết mạch vành (OCT) có khả năng phân giải 10-20 micromet giúp chúng ta “nhìn thấy” được trực tiếp đặc điểm vi thể của mảng xơ vữa, gồm lớp phủ xơ, vi mạch, huyết khối, tế bào viêm, tinh thể cholesterol bên cạnh hình dạng mảng xơ vữa đại thể. Đôi khi huyết khối làm hạn chế đánh giá mảng xơ vữa tại sang thương đích, hút huyết khối hay dùng thuốc kháng huyết khối vài ngày có thể cải thiện khả năng đánh giá.
Vào 2005, Hayashi và cs. [31] báo cáo có 39% bệnh nhân hội chứng vành cấp có xói mòn mảng xơ vữa. Những bệnh nhân này thường biểu hiện đau ngực kiểu “tiền nhồi máu” và thường có vùng nhồi máu nhỏ hơn. Kubo và cs [32] nghiên cứu trên 30 bệnh nhân hội chứng vành cấp và báo cáo xói mòn mảng xơ vữa trên 23% ca nhờ vào khảo sát OCT. Kusama và cs [33] báo cáo có 37% bệnh nhân nhồi máu cơ tim cấp thành trước không tìm thấy sang thương đích là nứt vỡ mảng xơ vữa trên siêu âm nội mạch vành. Rất tiếc, những nghiên cứu này chưa dùng tiêu chuẩn chẩn đoán xói mòn mảng xơ vữa rõ ràng.
Khảo sát lớp nội mạc (1-5 micromet) vượt quá khả năng phân giải của OCT (10-15 micromet), do vậy cần phải có tiêu chuẩn mới cho OCT để chẩn đoán xói mòn mảng xơ vữa (Hình 3) [34]. Lớp phủ xơ còn nguyên vẹn ở sang thương đích giúp phân biệt xói mòn mảng xơ vữa với nứt vỡ mảng xơ vữa. Khác với các nghiên cứu tử thiết, chẩn đoán trên người cần cân nhắc đến ảnh hưởng của liệu pháp kháng huyết khối và giới hạn của OCT. OCT có khả năng cho thấy nứt vỡ lớp phủ xơ rõ ràng (Hình 4). Xói mòn mảng xơ vữa là chẩn đoán loại trừ. Bệnh nhân có hội chứng vành cấp không có hình ảnh nứt vỡ lớp phủ xơ và tạo khoang trong lòng mạch vành gợi ý nguyên nhân xói mòn mảng xơ vữa, đặc biệt nếu đi kèm huyết khối hoặc bề mặt gồ ghề. Một số nhóm đặt tên cho ghi nhận này là “lớp phủ xơ nguyên vẹn” hơn là xói mòn mảng xơ vữa.
Dựa trên tiêu chuẩn chẩn đoán mới trên OCT này, Jia và cs. [34] báo cáo có 31% bệnh nhân hội chứng vành cấp có xói mòn mảng xơ vữa. Những nghiên cứu tiếp theo sau đó bởi Higuma và cs. [35], Saia và cs. [36] và Kajander và cs. [39] báo cáo tỉ lệ xói mòn mảng xơ vữa lần lượt là 27%, 33%, 44% ở bệnh nhân nhồi máu cơ tim cấp. Niccoli và cs. [40], Yonetsu và cs. [39], và Kwon và cs. [41] báo cáo tỉ lệ xói mòn lần lượt 24%, 41%, 32% bệnh nhân hội chứng vành cấp. Gộp chung lại, tỉ lệ xói mòn mảng xơ vữa dựa trên OCT dao động từ 30% đến 40% bệnh nhân nhồi máu cơ tim cấp/hội chứng vành cấp (bàng 2).Do bệnh nhân có hội chứng vành cấp không được khảo sát hình ảnh học nội mạch thường quy, những nghiên cứu đề cập trên có thể đánh giá thấp tỉ lệ thật thực tế của xói mòn mạng xơ vữa [42].
Biểu hiện lâm sàng của bệnh nhân nứt vỡ mảng xơ vữa và xói mòn mảng xơ vữa khác nhau. Trong một phân tích gộp các nghiên cứu OCT,bệnh nhân xói mòn mảng xơ vữa thương có biểu hiện hội chứng vành cấp không ST chênh lên (61,5%), ngược lại, bệnh nhân nứt vỡ mảng xơ vữa thường biểu hiện nhồi máu cơ tim cấp ST chênh lên (70,9%) [34] (Bảng 3). Nghiên cứu trên tử thiết cũng ghi nhận bệnh nhân xói mòn mảng xơ vữa thường có hội chứng vành cấp không ST chênh lên. Xói mòn mảng xơ vữa ít gây mất liên tục nội mạc động mạch, có thể xảy ta ở vị trí đường kính mạch lớn, gây huyết khối bán phần hoặc huyết khối di chuyển làm lấp mạch đoạn xa của mạch vành.
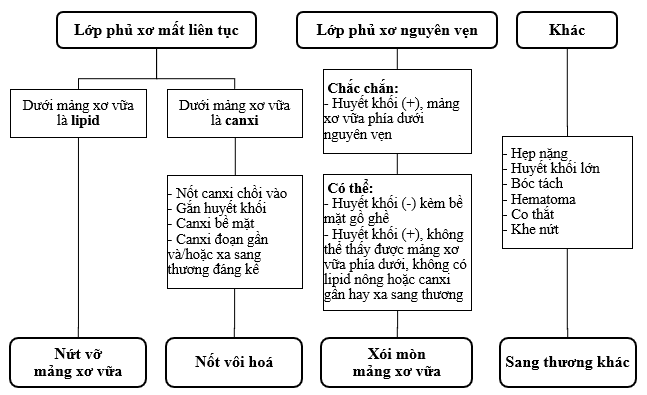
Hình 3: Hình ảnh lớp phủ xơ còn nguyên vẹn giúp phân biệt xói mòn mảng xơ vữa với nứt vỡ mảng xơ vữa hay nốt vôi hoá. Ở những sang thương không còn lớp phủ xơ còn nguyên vẹn, những đặc điểm khác ở lớp dưới giúp phân biệt mất liên tục lòng mạch do nứt vỡ hay nốt vôi xuyên qua (từ Jia và cs. [34]).
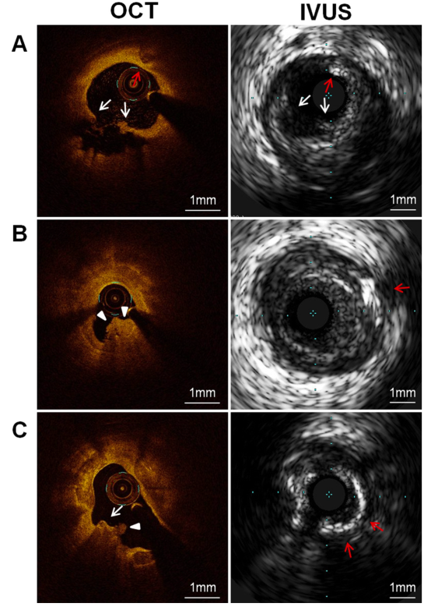
Hình 4: Hình ảnh cắt lớp quang kết mạch vành (OCT) và siêu âm nội mạch vành (IVUS) của các sang thương khác nhau. (A) Nứt vỡ mảng xơ vữa: mất liên tục lớp phủ xơ (mũi tên trắng), lõi lipid lớn (hướng 1-10 giờ), nốt canxi rải rác (mũi tên đỏ). (B) Xói mòn mảng xơ vữa: OCT cho thấy huyết khối trắng (đầu mũi tên trắng) ở bề mặt lòng mạch, không thấy hình ảnh mất liên tục lớp phủ xơ, IVUS cho thấy nốt canxi hoá ở xa (mũi tên đỏ). (C) Nốt vôi hoá: OCT cho thấy canxi hoá dạng lõm (mũi tên trắng) kèm huyết khối trắng (đầu mũi tên trắng), IVUS cho thấy mảng canxi lớn gần bề mặt lòng mạch (mũi tên đỏ) (35).
Bảng 2: Tỉ lệ nứt vỡ và xói mòn mảng xơ vữa ở bệnh nhân hội chứng vành cấp và nhồi máu cơ tim cấp dựa trên các nghiên cứu lâm sàng trên người (48)
| Tác giả | Lâm sàng | Cỡ mẫu | Phương pháp chẩn đoán | Mảng xơ vữa nứt vỡ (%) | Mảng xơ vữa không nứt vỡ (%) | Khác |
| Hayashi và cs. | AMI | 107 (72) | Nội soi | 61 | 39 | |
| Kubo và cs. | AMI | 30 | OCT | 73 | 23 | |
| Kusama và cs. | MI thành trước | 91 | IVUS | 59 | 41 | |
| Ozaki 2011 | ACS | 57 (35) | CT | 71 | 29 | |
| Jia và cs. | ACS | 126 (104) | OCT | 44 | 31 | 8% (CN) |
| Higuma và cs. | AMI | 112 | OCT | 64 | 27 | 8% (CN) |
| Saia và cs. | AMI | 140 (97) | OCT | 65 | 33 | 2% (SCAD) |
| Niccoli và cs. | ACS | 139 | OCT | 59 | 41 | |
| Yonetsu và cs. | ACS | 318 | OCT | 44 | 41 | 15% (huyết khối lớn) |
| Kajander và cs. [39] | AMI | 93 | OCT | 49 | 44 | 7% (CN) |
| Kwon và cs. | ACS | 133 | OCT | 68 | 32 |
Số trong ngoặc là số bệnh nhân được đưa vào phân tích. ACS: hội chứng vành cấp, AMI: nhồi máu cơ tim cấp, CN: nốt vôi hoá, IVUS: siêu âm nội mạch vành, OCT: cắt lớp quang kết mạch vành, SCAD: bóc tách tự phát mạch vành
Bảng 3: Tỉ lệ nhồi máu cơ tim ST chênh lên (STEMI) và hội chứng vành cấp không ST chênh lên/đau thắt ngực không ổn định (NSTE-ACS/UA) trên bệnh nhân có xói mòn mảng xơ vữa (48)
| STEMI (%) | NSTE-ACS/UA (%) | |
| Jia và cs. [34] | 38,5 | 61,5 |
| Niccoli và cs. [37] | 29,8 | 70,2 |
| Yonetsu và cs. [38] | 16 | 84 |
| Kwon và cs. [41] | 35 | 65 |
V. ĐIỀU TRỊ
Các khuyến cáo hiện tại điều trị bệnh nhân nhồi máu cơ tim cấp có hay không có ST chênh lên khuyến cáo chung cho can thiệp mạch vành qua da sớm để tái tưới máu cho bệnh nhân. Những tiến bộ về hình ảnh học giúp xác định cơ chế sinh lý bệnh của huyết khối, cho phép cá thể hoá điều trị.
V.1. Ảnh hưởng lên tiên lượng: xói mòn, nứt vỡ
Những tiến bộ về hình ảnh học nội mạch khảo sát sang thương đích đã giúp chúng ta biết đặc điểm lâm sàng của xói mòn khác với nứt vỡ mảng xơ vữa. Một nghiên cứu hồi cứu được thực hiện bởi Higuma và cs [35] cho thấy bệnh nhân hội chứng vành cấp do nứt vỡ mảng xơ vữa có diện tích vùng nhồi máu lớn hơn, thường gặp hiện tượng không có dòng (no-reflow) và chức năng tâm thu thất trái kém hơn sau đó. Một nghiên cứu gần đây thực hiện bởi Yonetsu và cs [38] cho thấy khi theo dõi trung vị 576 ngày, bệnh nhân hội chứng vành cấp do xói mòn mảng xơ vữa có tiên lượng lâu dài tốt hơn những bệnh nhân nứt vỡ mảng xơ vữa. Một nghiên cứu khác gồm 139 bệnh nhân hội chứng vành cấp lấy mẫu liên tiếp, theo dõi trong vòng 3 năm cũng cho kết luận tương tự: ít biến cố tim mạch chính hơn ở nhóm bệnh nhân có lớp phủ xơ nguyên vẹn (xói mòn mảng xơ vữa) hơn so với nhóm bệnh nhân bị nứt vỡ mảng xơ vữa [37]. Cơ chế làm nứt vỡ mạng xơ vữa có tiên lượng xấu hơn còn dừng ở mức giả thuyết và cần nhiều nghiên cứu chứng minh.
V.2. Đáp ứng mạch máu khi đặt stent:
Cho tới nay, chúng ta vẫn chưa biết rõ đáp ứng sau can thiệp mạch vành tại sang thương xói mòn có khác biệt như thế nào so với sang thương nứt vỡ. Higuma và cs.[35] nghiên cứu trên 112 bệnh nhân nhồi máu cơ tim cấp ST chênh lên ghi nhận rằng, bệnh nhân xói mòn mảng xơ vữa ít bị tổn thương vi mạch hơn và có xu hướng ít bị tổn thương cơ tim hơn sau can thiệp. Saia và cs. [36] đánh giá 140 bệnh nhân nhồi máu cơ tim cấp ST chênh lên được khảo sát OCT trước, ngay sau và sau 9 tháng đặt stent.Tác giả ghi nhận không khác biệt về hình thái mảng xơ vữa khi theo dõi giữa hai nhóm có nứt vỡ và xói mòn mảng xơ vữa. Cả hai nhóm đều có tỉ lệ tái hẹp, diện tích nội mạc tạo mới, tỉ lệ stent áp thành kém tương tự nhau. Một nghiên cứu khác ghi nhận tiên lượng ngắn hạn sau đặt stent do xói mòn mảng xơ vữa tốt hơn [44]. Tỉ lệ stent áp sát kém, huyết khối, hiện tượng no-reflow và huyết lấp đoạn xa ở xói mòn mảng xơ vữa thấp hơn so với nứt vỡ mảng xơ vữa [44]. Tuy nhiên, một nghiên cứu khác khảo sát OCT 6 tháng sau đặt stent cho thấy xói mòn mảng xơ vữa lành mạch máu kém hơn nứt vỡ mảng xơ vữa [45]. Tỉ lệ được phủ lớp nội mạc mới thấp hơn và tỉ lệ thân stent không được phủ chia cho được phủ nội mạc cao hơn ở nhóm xói mòn mảng xơ vữa [45]. Tuy cơ chế cho những ghi nhận này còn chưa rõ ràng, gánh nặng huyết khối do nứt vỡ mảng xơ vữa lớn hơn, giải phóng nhiều hơn yếu tố tăng trưởng từ tiểu cầu (platelet-derived growth factor) có thể góp phần làm lành sang thương tốt hơn.
V.3. Các nghiên cứu tiến cứu mới
Do có những sự khác biệt về đáp ứng mạch máu sau can thiệp giữa nứt vỡ mạng và xói mòn mảng xơ vữa, cũng như xói mòn mảng xơ vữa có kết cục lâm sàng tốt hơn,chúng ta có thể cân nhắc tập trung vào liệu pháp kháng huyết khối hơn là can thiệp mạch vành ở những bệnh nhân xói mòn mảng xơ vữa [42]. Lợi ích có thể gồm tránh biến chứng huyết khối và tái hẹp trong stent, tránh dùng kháng kết tập tiểu cầu kép lâu dài. Một nghiên cứu quan sát hồi cứu cho thấy các bệnh nhân xói mòn mảng xơ vữa (chẩn đoán nhờ OCT) được hút huyết khối không tái phát triệu chứng sau hơn 2 năm. Trong nghiên cứu này, 31 bệnh nhân trong đó 40% được điều trị bằng kháng kết tập tiểu cầu kép mà không đặt stent, 60% bệnh nhân được dùng kháng kết tập tiểu cầu kép kèm đặt stent, sau 2 năm theo dõi, tất cả đều không triệu chứng [46].
Nghiên cứu EROSION là nghiên cứu đầu tiên tiên phong nhằm cá thể hoá điều trị bệnh nhân hội chứng vành cấp theo sang thương đích. Nghiên cứu này cho thấy rằng việc dùng kháng kết tập tiểu cầu mà không đặt stent ở bệnh nhân xói mòn mảng xơ vữa là khả thi và an toàn trong ngắn hạn [47]. Nếu hình ảnh OCT cho thấy xói mòn mảng xơ vữa với tỉ lệ hẹp mạch máu dưới 70%, dòng chảy TIMI 3, bệnh nhân sẽ được sử dụng thuốc kháng huyết khối mà không đặt stent (heparin trong 3 ngày kèm aspirin và ticagrelor). Trong tổng số các ca, có 25,4% trường hợp do xói mòn mảng xơ vữa, hình ảnh OCT theo dõi sau một tháng sau đó cho thấy 78,3% trường hợp giảm được >50% thể tích huyết khối (kết cục chính) và chỉ có 2 bệnh nhân có biến cố tim mạch khi theo dõi. Tuy chỉ là nghiên cứu nhỏ đơn trung tâm, dữ liệu từ nghiên cứu giúp cung cấp dữ liệu đánh giá thêm về các cách tiếp cận cá thể hoá theo cơ chế gây hội chứng vành cấp [29].
VI. THÔNG ĐIỆP CHÍNH: ẢNH HƯỞNG LÊN THỰC HÀNH LÂM SÀNG THƯỜNG NGÀY
Những bằng chứng hiện tại gợi ý điều trị nội khoa có thể là lựa chọn điều trị tối ưu cho xói mòn mảng xơ vữa, thay vì can thiệp mạch vành. Một nghiên cứu dẫn đường (pilot study) cho thấy kết quả tuyệt vời với điều trị chống huyết khối không đặt stent khi chỉ là xói mòn mảng xơ vữa, không phải do nứt mảng xơ vữa xác định bằng kỹ thuật chụp cắt lớp quang học nội mạch vành (OCT: optical coherence tomography), bất chấp bệnh nhân có nhồi máu cơ tim cấp (49). Tuy nhiên cần có thêm nghiên cứu ngẫu nhiên lớn, theo dõi dài hạn để củng cố việc tiếp cận điều trị này. Tối ưu nhất, một nghiên cứu lớn đánh giá cách tiếp cận dựa trên phối hợp dấu ấn sinh học và hình ảnh học nội mạch phân giải cao để chẩn đoán xói mòn mảng xơ vữa, có thể giúp thực hành điều trị y học chính xác dựa trên sinh lý bệnh hội chứng vành cấp. Với hàng triệu bệnh nhân có hội chứng vành cấp hằng năm, việc tiếp cận này có thể giúp tiết kiệm chi phí cho y tế đáng kể.
VII. TÀI LIỆU THAM KHẢO
- Crea F, Libby P. Acute coronary syndromes: the way forward from mechanismsto precision treatment. Circulation 2017;136:1155–1166.
- Falk E. Plaque rupture with severe pre-existing stenosis precipitating coronarythrombosis. Characteristics of coronary atherosclerotic plaques underlying fatalocclusive thrombi. Br Heart J 1983;50:127–134.
- Davies MJ, Thomas AC. Plaque fissuring—the cause of acute myocardial infarction,sudden ischaemic death, and crescendo angina. Br Heart J 1985;53:363–373.
- Falk E, Nakano M, Bentzon JF, Finn AV, Virmani R. Update on acute coronarysyndromes: the pathologists’ view. Eur Heart J 2013;34:719–728.
- van der Wal AC, Becker AE, van der Loos CM, Das PK. Site of intimal ruptureor erosion of thrombosed coronary atherosclerotic plaques is characterized byan inflammatory process irrespective of the dominant plaque morphology.Circulation 1994;89:36–44.
- Farb A, Burke AP, Tang AL, Liang Y, Mannan P, Smialek J, Virmani R. Coronaryplaque erosion without rupture into a lipid core: a frequent cause of coronarythrombosis in sudden coronary death. Circulation 1996;93:1354–1363.
- Arbustini E, Dal Bello B, Morbini P, Burke AP, Bocciarelli M, Specchia G, VirmaniR. Plaque erosion is a major substrate for coronary thrombosis in acutemyocardialinfarction. Heart 1999;82:269–272.
- Libby P. Mechanisms of acute coronary syndromes and their implications fortherapy. N Engl J Med 2013;368:2004–2013.
- Falk E, Shah PK, Fuster V. Coronary plaque disruption. Circulation 1995;92:657–671.
- Virmani R, Kolodgie FD, Burke AP, Farb A, Schwartz SM. Lessons from suddencoronary death: a comprehensive morphological classification scheme for atheroscleroticlesions. ArteriosclerThrombVasc Biol 2000;20:1262–1275.
- Kolodgie FD, Burke AP, Farb A, Weber DK, Kutys R, Wight TN, Virmani R.Differential accumulation of proteoglycans and hyaluronan in culprit lesions: insightsinto plaque erosion. ArteriosclerThrombVasc Biol 2002;22:1642–1648.
- Sato Y, Hatakeyama K, Yamashita A, Marutsuka K, Sumiyoshi A, Asada Y.Proportion of fibrin and platelets differs in thrombi on ruptured and eroded coronaryatherosclerotic plaques in humans. Heart 2005;91:526–530.
- Schwartz RS, Burke A, Farb A, Kaye D, Lesser JR, Henry TD, Virmani R.Microemboli and microvascular obstruction in acute coronary thrombosis andsudden coronary death: relation to epicardial plaque histopathology. J Am CollCardiol 2009;54:2167–2173.
- White SJ, Newby AC, Johnson TW. Endothelial erosion of plaques as a substratefor coronary thrombosis. ThrombHaemost 2016;115:509–519.
- Durand E, Scoazec A, Lafont A, Boddaert J, Hajzen AA, Addad F, Mirshahi M,Desnos M, Tedgui A, Mallat Z. In vivo induction of endothelial apoptosis leads tovessel thrombosis and endothelial denudation: a clue to the understanding of themechanisms of thrombotic plaque erosion. Circulation 2004;109:2503–2506.
- Warner SJ, Friedman GB, Libby P. Regulation of major histocompatibility gene expressionin human vascular smooth muscle cells. Arteriosclerosis 1989;9:279–288.
- Sugiyama S, Kugiyama K, Aikawa M, Nakamura S, Ogawa H, Libby P.Hypochlorous acid, a macrophage product, induces endothelial apoptosis and tissuefactor expression: involvement of myeloperoxidase-mediated oxidant in plaqueerosion and thrombogenesis. ArteriosclerThrombVasc Biol 2004;24:1309–1314.
- Ferrante G, Nakano M, Prati F, Niccoli G, Mallus MT, Ramazzotti V, MontoneRA, Kolodgie FD, Virmani R, Crea F. High levels of systemic myeloperoxidaseare associated with coronary plaque erosion in patients with acute coronary syndromes:a clinicopathological study. Circulation 2010;122:2505–2513.
- Niccoli G, Dato I, Crea F. Myeloperoxidase may help to differentiate coronaryplaque erosion from plaque rupture in patients with acute coronary syndromes.Trends Cardiovasc Med 2010;20:276–281.
- Villanueva E, Yalavarthi S, Berthier CC, Hodgin JB, Khandpur R, Lin AM, RubinCJ, Zhao W, Olsen SH, Klinker M, Shealy D, Denny MF, Plumas J, Chaperot L,Kretzler M, Bruce AT, Kaplan MJ. Netting neutrophils induce endothelial damage,infiltrate tissues, and expose immunostimulatory molecules in systemic lupus erythematosus.J Immunol 2011;187:538–552.
- Quillard T, Arau jo HA, Franck G, Shvartz E, Sukhova G, Libby P. TLR2 and neutrophilspotentiate endothelial stress, apoptosis and detachment: implications forsuperficial erosion. Eur Heart J 2015;36:1394–1404.
- Burke AP, Farb A, Malcom GT, Liang YH, Smialek J, Virmani R. Coronary RiskFactors and Plaque Morphology in Men with Coronary Disease Who DiedSuddenly. N Engl J Med 1997;336:1276–1282.
- Burke AP, Farb A, Malcom GT, Liang Y, Smialek J, Virmani R. Effect of RiskFactors on the Mechanism of Acute Thrombosis and Sudden Coronary Death inWomen. Circulation 1998;97:2110–2116.
- Burke AP, Farb A, Pestaner J, Malcom GT, Zieske A, Kutys R, Smialek J, VirmaniR. Traditional Risk Factors and the Incidence of Sudden Coronary Death Withand Without Coronary Thrombosis in Blacks. Circulation 2002;105:419–424.
- Kramer MC, Rittersma SZ, de Winter RJ, Ladich ER, Fowler DR, Liang YH, KutysR, Carter-Monroe N, Kolodgie FD, van der Wal AC, Virmani R. Relationship ofThrombus Healing to Underlying Plaque Morphology in Sudden CoronaryDeath. J Am Coll Cardiol 2010;55:122–132.
- Tavora F, Cresswell N, Li L, Ripple M, Fowler D, Burke A. Sudden coronarydeath caused by pathologic intimal thickening without atheromatous plaqueformation.Cardiovasc Pathol 2011;20:51–57.
- Do ring Y, Soehnlein O, Weber C. Neutrophil extracellular traps in atherosclerosisand atherothrombosis. Circ Res 2017;120:736–743.
- Franck G, Mawson T, Sausen G, Salinas M, Masson GS, Cole A, Beltrami-MoreiraM, Chatzizisis Y, Quillard T, Tesmenitsky Y, Shvartz E, Sukhova GK,Swirski FK,Nahrendorf M, Aikawa E, Croce KJ, Libby P. Flow perturbation mediates neutrophilrecruitment and potentiates endothelial injury via TLR2 in mice: implicationsfor superficial erosion. Circ Res 2017;121:31–42.
- Libby P. Superficial erosion and the precision management of acute coronarysyndromes: not one-size-fits-all. Eur Heart J 2017;38:801–803.
- Hu S, Yonetsu T, Jia H, Karanasos A, Aguirre AD, Tian J, Abtahian F, Vergallo R,Soeda T, Lee H, McNulty I, Kato K, Yu B, Mizuno K, Toutouzas K, Stefanadis C, JangIK. Residual thrombus pattern in patients with ST-segment elevation myocardialinfarction caused by plaque erosion versus plaque rupture after successful fibrinolysis:an optical coherence tomography study. J Am Coll Cardiol 2014;63:1336–1338.
- Hayashi T, Kiyoshima T, Matsuura M, Ueno M, Kobayashi N, Yabushita H,Kurooka A, Taniguchi M, Miyataka M, Kimura A, Ishikawa K. Plaque erosion inthe culprit lesion is prone to develop a smaller myocardial infarction size comparedwith plaque rupture. Am Heart J 2005;149:284–290.
- Kubo T, Imanishi T, Takarada S, Kuroi A, Ueno S, Yamano T, Tanimoto T,Matsuo Y, Masho T, Kitabata H, Tsuda K, Tomobuchi Y, Akasaka T. Assessmentof culprit lesion morphology in acute myocardial infarction. Ability of optical coherencetomography compared with intravascular ultrasound and coronaryangioscopy. J Am Coll Cardiol 2007;50:933–939.
- Kusama I, Hibi K, Kosuge M, Nozawa N, Ozaki H, Yano H, Sumita S, TsukaharaK, Okuda J, Ebina T, Umemura S, Kimura K. Impact of plaque rupture on infarctsize in ST-segment elevation anterior acute myocardial infarction. J Am CollCardiol 2007;50:1230–1237.
- Jia H, Abtahian F, Aguirre AD, Lee S, Chia S, Lowe H, Kato K, Yonetsu T,Vergallo R, Hu S, Tian J, Lee H, Park S-J, Jang Y-S, Raffel OC, Mizuno K, UemuraS, Itoh T, Kakuta T, Choi S-Y, Dauerman HL, Prasad A, Toma C, McNulty I,Zhang S, Yu B, Fuster V, Narula J, Virmani R, Jang IK. In Vivo Diagnosis of PlaqueErosion and Calcified Nodule in Patients With Acute Coronary Syndromeby Intravascular Optical Coherence Tomography. J Am Coll Cardiol 2013;62:1748–1758.
- Higuma T, Soeda T, Abe N, Yamada M, Yokoyama H, Shibutani S, Vergallo R,Minami Y, Ong DS, Lee H, Okumura K, Jang I-K. A Combined optical coherencetomography and intravascular ultrasound study on plaque rupture, plaque erosion,and calcified nodule in patients with ST-segment elevation myocardial infarction.JACC Cardiovasc Interv 2015;8:1166–1176.
- Saia F, Komukai K, Capodanno D, Sirbu V, Musumeci G, Boccuzzi G, Tarantini G,Fineschi M, Tumminello G, Bernelli C, Niccoli G, Coccato M, Bordoni B, BezerraH, Biondi-Zoccai G, Virmani R, Guagliumi G. Eroded versus ruptured plaques atthe culprit site of STEMI: in vivo pathophysiological features and response to primaryPCI. JACC Cardiovasc Imaging 2015;8:566–575.
- Niccoli G, Montone RA, Vito L Di, Gramegna M, Niccoli G, Montone RA, Vito LDi, Gramegna M, Refaat H, Scalone G, Leone AM, Trani C, Burzotta F, Porto I,Aurigemma C, Prati F, Crea F. Plaque rupture and intact fibrous cap assessed byoptical coherence tomography portend different outcomes in patients with acutecoronary syndrome. Eur Heart J 2015;36:1377–1384.
- Yonetsu T, Lee T, Murai T, Suzuki M, Matsumura A, Hashimoto Y, Kakuta T.Plaque morphologies and the clinical prognosis of acute coronary syndromecaused by lesions with intact fibrous cap diagnosed by optical coherence tomography.Int J Cardiol 2016;203:766–774.
- Kajander OA, Pinilla-Echeverri N, Jolly SS, Bhindi R, Huhtala H, Niemela K, FungA, Vijayaraghavan R, Alexopoulos D, Sheth T. Culprit plaque morphology inSTEMI—an optical coherence tomography study: insights from the TOTALOCTsubstudy. EuroIntervention 2016;12:716–723.
- Niccoli G, Montone RA, Cataneo L, Cosentino N, Gramegna M, Refaat H, PortoI, Burzotta F, Trani C, Leone AM, Severino A, Crea F. Morphological-biohumoralcorrelations in acute coronary syndromes: pathogenetic implications. Int J Cardiol2014;171:463–466.
- Kwon JE, Lee WS, Mintz GS, Hong YJ, Lee SY, Kim KS, Hahn JY, Kumar KS, WonH, Hyeon SH, Shin SY, Lee KJ, Kim TH, Kim CJ, Kim SW. MultimodalityIntravascular Imaging Assessment of Plaque Erosion versus Plaque Rupture inPatients with Acute Coronary Syndrome. Korean Circ J 2016;46:499–506.
- Ozaki Y, Okumura M, Ismail TF, Motoyama S, Naruse H, Hattori K, Kawai H,Sarai M, Takagi Y, Ishii J, Anno H, Virmani R, Serruys PW, Narula J. Coronary CTangiographic characteristics of culprit lesions in acute coronary syndromes notrelated to plaque rupture as defined by optical coherence tomography andangioscopy. Eur Heart J 2011;32:2814–2823.
- Braunwald E. Coronary plaque erosion: recognition and management. JACCCardiovasc Imaging 2013;6:288–289.
- Hu S, Zhu Y, Zhang Y, Dai J, Li L, Dauerman H, Soeda T, Wang Z, Lee H, WangC, Zhe C, Wang Y, Zheng G, Zhang S, Jia H, Yu B, Jang IK. Management and outcomeof patients with acute coronary syndrome caused by plaque rupture versusplaque erosion: an intravascular optical coherence tomography study. J AmHeart Assoc 2017;6:e004730.
- Hu S, Wang C, Zhe C, Zhu Y, Yonetsu T, Jia H, Hou J, Zhang S, Jang IK, Yu B.Plaque erosion delays vascular healing after drug eluting stent implantation in patientswith acute coronary syndrome: an in vivo optical coherence tomographystudy. Catheter Cardiovasc Interv 2017;89:592–600.
- Prati F, Uemura S, Souteyrand G, Virmani R, Motreff P, Vito L, Di Biondi-ZoccaiG, Halperin J, Fuster V, Ozaki Y, Narula J. OCT-based diagnosis and management ofSTEMI associated with intact fibrous cap. JACC Cardiovasc Imaging 2013;6:283–287.
- Jia H, Dai J, Hou J, Xing L, Ma L, Liu H, Xu M, Yao Y, Hu S, Yamamoto E, Lee H,Zhang S, Yu B, Jang I-K. Effective anti-thrombotic therapy without stenting: intravascularoptical coherence tomography-based management in plaque erosion(the EROSION study). Eur Heart J 2017;38:792–800.
- Ramon A Partida, Peter Libby, Filippo Crea, Ik-Kyung Jang, Plaque erosion: a new in vivo diagnosis and a potential major shift in the management of patients with acute coronary syndromes, European Heart Journal, Volume 39, Issue 22, 07 June 2018, 2070–2076, https://doi.org/10.1093/eurheartj/ehx786
- Roh. JW et al: Successful Primary Percutaneous Coronary Intervention without Stenting: Insight from Optimal Coherence Tomography. Yonsei Med J 2022 Apr;63(4):399-404.







