BS. NGUYỄN XUÂN VINH*
BS. NGUYỄN THANH HIỀN
BS. PHẠM ĐẶNG DUY QUANG*
* Khoa Tim mạch can thiệp, BV ĐHYD TP Hồ Chí Minh
1. Mở đầu
Can thiệp mạch vành qua da (PCI) đã phát triển đáng kể trong bốn thập kỷ qua. Các stent trần kim loại (bare mental stent – BMS) khắc phục những mặt hạn chế của can thiệp bằng bóng làm giảm nguy cơ vỡ mạch vành, bóc tách, tái hẹp và tái cấu trúc mạch máu. Tuy nhiên can thiệp mạch vành với stent trần kim loại là nguyên nhân của tổn thương mạch máu và khởi phát sự gia tăng của quá trình sợi hóa, tăng sinh nội mô mạch máu mới. Các yếu tố này là nền tảng của quá trình tái hẹp trong stent (ISR: in-stent restenosis). Stent phủ thuốc (drug eluting stent- DES) là công nghệ đột phá trong can thiệp bệnh động mạch vành. So sánh với stent trần kim loại, DES là khung kim loại phủ lớp polymer phóng thích thuốc chống tăng sinh, DES có ý nghĩa cải thiện hiệu quả của can thiệp bằng cách ức chế hiện tượng tăng sinh lớp nội mạc và giảm nguy cơ ISR. Đổi lại, các stent phủ thuốc thế hệ đầu tiên lại làm tăng nguy cơ xuất hiện biến cố huyết khối trong stent (ST: stent thrombosis) muộn sau 1 năm. Tuy nhiên, những stent phủ thuốc thế hệ gần đây đã cho thấy tính an toàn dài hạn vượt trội về các biến cố liên quan huyết khối, loại bỏ sự cần thiết phải sử dụng kháng kết tập tiểu cầu kép kéo dài, đồng thời giảm thêm tần suất tái hẹp trong stent. Tuy nhiên, mặc dù có sự cải thiện ở stent phủ thuốc thế hệ mới nhưng tỷ lệ tái hẹp trong stent và tỷ lệ cần phải tái can thiệp tổn thương đích (target lesion revascularization- TLR) vẫn còn xấp xỉ 1-2%/năm (hình 1). Hằng năm trên thế giới có hàng triệu trường hợp can thiệp mạch vành bằng stent phủ thuốc, do đó, ISR có thể xem là một vấn đề sức khỏe cộng đồng quan trọng (1-4,).
Hiểu biết về cơ chế cũng như đặc tính của hiện tượng ISR đã có nhiều thay đổi theo thời gian. Từ cách phân loại ISR ban đầu theo chụp mạch vành, sự ra đời của hình ảnh học nội mạch giúp sáng tỏ thêm cơ chế và bản chất của ISR. Các phương pháp điều trị ISR cũng từ đó được cải tiến theo thời gian. Hiện tại, điều trị ISR được khuyến cáo nên cá thể hóa tùy thuộc vào bản chất sang thương ISR và nguy cơ lâm sàng của từng trường hợp (5-7). Trong bài viết này, chúng tôi tổng quan y văn về tần suất, cơ chế, sinh lý bệnh và các đặc điểm khác của ISR và đề xuất một cách tiếp cận điều trị cá thể hóa dựa trên bản chất sang thương ISR, sử dụng các liệu pháp đương đại.
2. Tần suất và biểu hiện lâm sàng của ISR
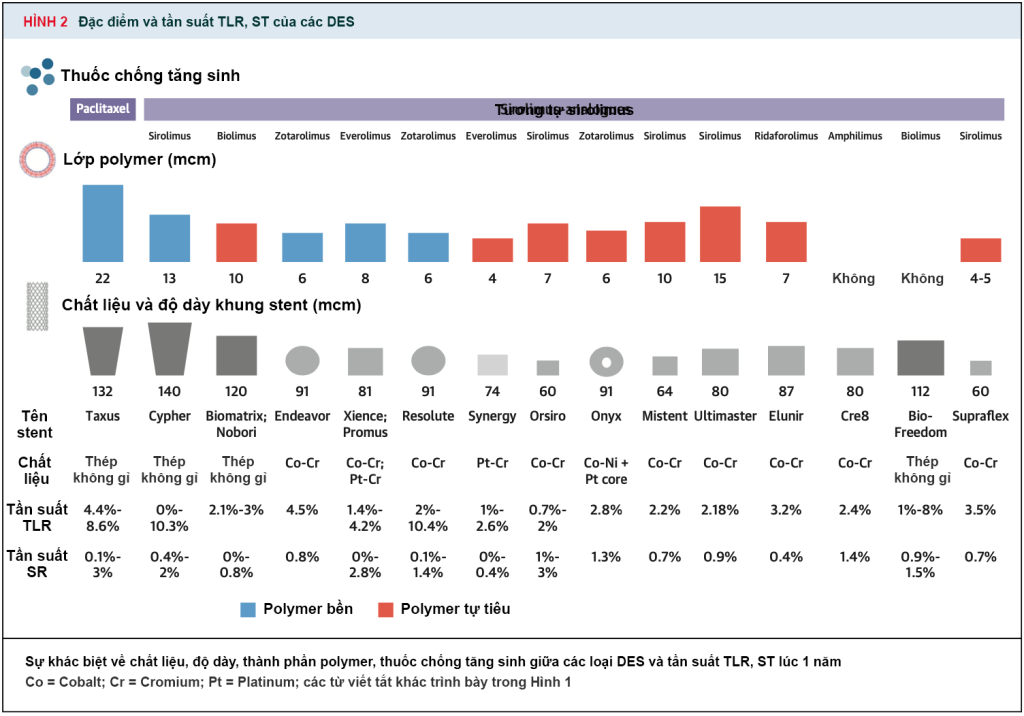
Tần suất của ISR ngày càng giảm trong 2 thập kỷ qua do sự phát triển của các stent thế hệ mới, kỹ thuật đặt stent và thuốc điều trị. ISR của BMS thường đạt đỉnh trong 1 năm đầu sau đặt stent, trong khi các DES thế hệ mới vẫn còn có tỉ lệ TLR vì thiếu máu cục bộ vào khoảng 2% mỗi năm. Trong một phân tích gộp dữ liệu bệnh nhân từ các nghiên cứu RCT về tần suất TLR do thiếu máu cục bộ trong 1 năm của BMS, DES thế hệ đầu và DES thế hệ mới lần lượt là 14.7%, 4.9% và 2.5%. Từ 1 đến 5 năm sau đặt stent, tần suất tích lũy của TLR vì thiếu máu cục bộ là 6.1%, 5.9% và 4.4%. Tần suất của TLR qua các RCT của một số DES thế hệ cũ và mới được tóm tắt ở (hình 2) (1,3,4).
Hệ quả bệnh sinh của ISR là sự hình thành bệnh mạch vành tắc nghẽn gây giảm tưới máu cơ tim và xuất hiện triệu chứng thiếu máu cục bộ. Dù ISR ban đầu được xem là tình trạng lâm sàng lành tính với triệu chứng đau thắt ngực, ISR cũng thường biểu hiện thành hội chứng vành cấp. Trong một nghiên cứu lớn từ dữ liệu sổ bộ U.S Cath PCI, 542.112 bệnh nhân thực hiện PCI vì ISR, phần lớn bệnh nhân có triệu chứng không ổn định và khoảng 25% có nhồi máu cơ tim cấp. Đáng lưu ý, biểu hiện lâm sàng là hội chứng vành cấp là một yếu tố tiên lượng độc lập về biến cố tim mạch bất lợi và ISR tái phát về sau (8-10).

(A) Tiến bộ trong công nghệ DES, kĩ thuật PCI và dược học trong hơn 4 thập kỷ (B) song hành cùng giảm đáng kể tỉ lệ TLR (C) Tỉ lệ tái tưới máu sang thương đích và thất bại sang thương đích với stent kim loại (xanh), stent phủ thuốc thế hệ đầu (đỏ) và stent phủ thuốc thế hệ mới (xám), từ Madhavan và cs. BA: balloon angioplasty, nong bóng mạch vành; BMS: bare-metal stent, stent kim loại; BVS: bioresorbable vascular scaffold, stent tự tiêu; DAPT: dual antiplatelet therapy, liệu pháp kháng kết tập tiểu cầu kép; DES: drug-eluting stent, stent phủ thuốc; ELCA: excimer laser atherectomy, cắt mảng xơ vữa bằng laser excimer; FDA: Food and Drug Administration, Cục Quản lý Thực phẩm và Dược Hoa Kỳ; ISR: in-stent restenosis, tái hẹp trong stent; IVBT: intravascular brachytherapy, xạ trị nội mạch; IVUS: intravascular ultrasound, siêu âm nội mạch; PCI: percutaneous coronary intervention, can thiệp mạch vành; PES: paclitaxel-eluting stent, stent phóng thích paclitaxel; RA: rotational atherectomy, khoan cắt mảng xơ vữa; SES: sirolimus-eluting stent, stent phóng thích sirolimus; ST: stent thrombosis, huyết khối stent; TLR: target lesion revascularization, tái tưới máu sang thương đích (3)

3. Cơ chế bệnh sinh của tái hẹp trong stent
Các cơ chế khác nhau được liệt kê như sự tiến triển của bệnh, và bao gồm yếu tố sinh học, bệnh nhân, giải phẫu, thủ thuật, stent (hình 3)
3.1. Yếu tố liên quan đến bệnh nhân hay sinh học
Các dự đoán lâm sàng của tái hẹp trong stent bao gồm đái tháo đường, bệnh thận mạn, lớn tuổi, giới nữ, BMI cao, và các yếu tố khác. Ở nhóm bệnh nhân đái tháo đường chuyển hóa biến đổi xảy ra và kết quả tăng đường huyết hoặc tăng insulin máu có gia tăng sự hình thành của tăng sinh nội mạc.
Các yếu tố sinh học tái hẹp trong stent bao gồm đề kháng thuốc và độ nhạy cảm cao. Đề kháng thuốc có thể tiên phát hoặc thứ phát, theo sau bởi tiếp xúc với thuốc chống tăng sinh (anti-prolifeative). Tăng độ nhạy cảm và phản ứng viêm có thể xúc tiến và có thể là yếu tố khởi kích của tăng sinh nội mạc ở stent khung kim loại và stent DES polymer. Qúa trình can thiệp mạch máu có thể dẫn đến thay đổi áp lực tại vị trí đó, tác động lên lớp nội mạc và lần lượt hoạt hóa các yếu tố viêm của cơ thể đối với các yếu tố ngoại lai. Phản ứng viêm kéo dài sau 90 ngày có liên quan đến nguy cơ của cao trì hoãn sự nội mạc hóa (endothelialization), tái hẹp trong stent, huyết khối trong stent muộn và rất muộn (5,6).
3.2. Yếu tố liên quan đến thủ thuật
Tối ưu hóa can thiệp là chìa khóa để giảm nguy cơ của cả tái hẹp trong stent và huyết khối sau khi can thiệp. Yếu tố liên quan đến thủ thuật ảnh hưởng đến nguy cơ của tái hẹp trong stent bao gồm: stent nở không hết (underexpansion), stent không áp sát (malapposition), khoảng trống stent (stent gap), và một số yếu tố khác. Stent nở không hết là kết quả của nở không trọn vẹn khi can thiệp. Stent không áp sát thường liên quan đến các mắc cáo của stent không áp được vào thành mạch máu và để lại khoảng trống chiếm bởi máu giữa mắc cáo stent và nội mô mạch máu. Stent không áp sát có thể được nhận biết bởi sử dụng hình ảnh siêu âm nội mạch và thường xảy ra với những stent có kích thước nhỏ hơn mạch máu hoặc ở những động mạch xoắn vặn và thường ảnh hưởng đến đường kính lòng mạch (lumen diameter). Stent không áp sát và stent nở không hết có thể xảy ra đồng thời trên một stent được đặt. Khoảng trống stent (stent gap) có thể được định nghĩa là độ bao phủ không liên tục của sang thương mạch vành giữa hai stent và có sự liên quan với tăng nguy cơ của ISR và cần thiết phải lặp lại việc can thiệp. Khoảng trống giữa 2 stent DES là vùng mà tổn thương mạch vành không được tiếp xúc với sự phóng thích thuốc chống tăng sinh và mắc cáo stent (5,10-14).
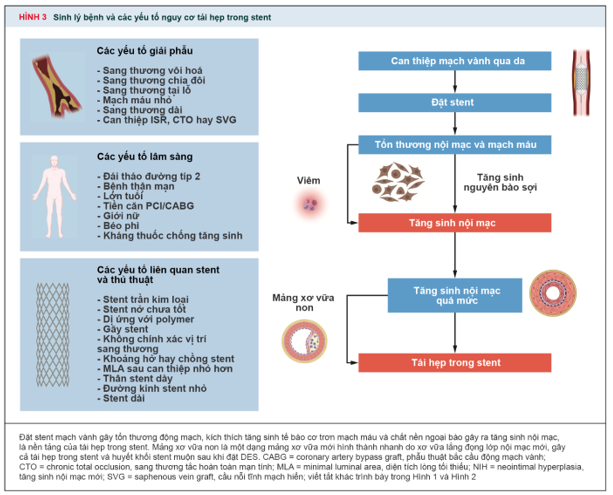
Hình 3. Sinh lý bệnh và các yếu tố nguy cơ ISR (3)
3.4. Yếu tố về giải phẫu
Các yếu tố giải phẫu có thể giúp nhận định được yếu tố của tái hẹp trong stent bao gồm: kích thước mạch máu, đặc điểm tổn thương, đặc biệt là vị trí biến dạng. Kích thước mạch máu là yếu tố dự đoán mạch của tái hẹp trong stent sau khi đặt stent trần kim loại và stent phủ thuốc (mạch máu nhỏ, nguy cơ tái hẹp cao hơn). Hệ mạch vành vôi hóa nặng liên quan mạnh đến nguy cơ TLR (target lessionrevasculation) và ST (stent thrombosis). Sang thương vôi hóa nặng có thể kết quả stent nở không tối ưu và áp không sát (15-17).
3.5. Yếu tố stent.
Liên quan đến các yếu tố về stent ảnh hưởng đến ISR bao gồm: loại stent, độ phân phối thuốc (drug distribution), loại thuốc, bề dày mắt cáo (stent strut thickness), gãy stent (stent fracture). Có sự khác biệt về thời gian hình thành, kiểu xuất hiện, cơ chế xảy ra của ISR giữa BMS và DES. Thời điểm hình thành tích tụ của lớp nội mô thì khác nhau giữa 2 loại stent. Với BMS sự mất giảm lòng mạch đạt định ở thời điểm 6-8 tháng sau can thiệp và sau đó giảm dần theo thời gian. Trái ngược với DES thì sự giảm lòng mạch chậm hơn nhưng vẫn xảy ra tịch tụ của nội mạc mạch máu ở thời điểm 5 năm sau can thiệp. BMS-ISR thường xảy ra hơn liên quan với lan tỏa hoặc tăng sinh, trong khi DES-ISR thì thường có mối liên quan đến khu trú hoặc tăng sinh nội mạc mới ở rìa. Cuối cùng mảng xơ vữa mới (neo-atherosclerosis) là cơ chế của tái hẹp trong stent thường gặp với DES, đặc biệt xung quanh 1 năm, và có thể sớm hơn so với BMS. Gãy stent (stent fracture) được định nghĩa là sự tách biệt hoàn toàn hoặc một phần của stent kề cận nhau sau khi đặt stent. Gãy stent phủ thuốc dẫn tới suy giảm khả năng vận chuyển của thuốc và mất sự hỗ trợ của khung stent. Nguy cơ của gãy stent bao gồm đặt stent ở động mạch vành phải, mạch máu xoắn vặn hoặc gấp khúc, đặt stent dài hoặc chồng stent nhiều (overlaping). Trái ngược, những sent được thiết kế với đường kính lớn hoặc mắt cáo mở thì có nguy cơ gãy stent thấp hơn (6,18-20).
4. Đặc điểm hình dạng và hình ảnh của tái hẹp trong stent
4.1. Chụp mạch vành I
SR xuất hiện làm hẹp lòng trong đoạn mạch máu đã được đặt stent trước đó. Chụp mạch vành vẫn có tiêu chuẩn để đánh giá mức độ nặng và ý nghĩa chức năng của sang thương tái hẹp trong stent. Dựa trên hình ảnh học xuất hiện, những kiểu tái hẹp có hình ảnh học khác nhau từ đó liên quan đến tiên lượng và điều trị khác nhau. Một trong những phân loại được chấp nhận của tái hẹp trong stent được đề xuất bởi Mehran và cs. Trước khi giới thiệu bảng phân loại này, hình ảnh phân loại được sử dụng rộng rãi là: khu trú (chiều dài sang thương trong stent < 10 mm) hoặc lan tỏa (chiều dài sang thương trong stent >10 mm). Phân loại của Mehran, được mô tả ở thời kì stent trần kim loại, đã làm nổi bật hơn nữa bảng phân loại đơn giản này bằng việc mô tả mối tương quan hình ảnh học giữa NIH (neointimal hyperplasia) và stent (bảng 2). Gần đây, định nghĩa về tái hẹp được sử dụng rộng rãi nhất là của Academic Research Consortium. Theo định nghĩa này, được coi là tái hẹp khi hoặc hẹp lòng ít nhất 50% đường kính mạch máu liên quan đến bằng chứng chức năng có ý nghĩa (triệu chứng thiếu máu hoặc FFR) hoặc đường kính lòng hẹp ít nhất 70% khi không có biểu hiện của triệu chứng thiếu máu trong 5 mm hai đầu stent được đặt. (21, 22).
4.2. Siêu âm nội mạch (intrvascular ultrasound -IVUS).
Siêu âm nội mạch cung cấp hình ảnh bên trong lòng mạch giúp hiểu được tái cấu trúc mạch máu sau khi đặt stent, vai trò của stent không nở trọn, và góp phần của hình thành mảng xơ vữa mới ở bệnh nhân tái hẹp trong stent. Trong thực hành lâm sàng, sử dụng IVUS có vai trò đánh giá cơ chế của tái hẹp trong stent hướng dẫn cho việc điều trị và đo kích thước mạch máu chính xác. IVUS có thể mô tả màng đàn hồi bên ngoài (external elastic lamina) theo sau các mắc cáo stent (đánh giá đường kính lòng mạch), cung cấp thông tin thực sự về kích thước mạch máu và tối ưu hóa stent nở trọn vẹn. Hệ thống phân loại của DES-ISR dưới sự hướng dẫn của IVUS được đề xuất ở thế hệ stent phủ thuốc sớm (bảng 2). Trong một nghiên cứu được báo cáo stent không nở trọn được xem là tác nhân của 21% trường hợp tái hẹp trong stent, và tăng sinh lớp nội mạc 88% trường hợp. Tái hẹp trong stent khu trú là hầu hết hình ảnh được phát hiện (47%). Một điểm chú ý với các bệnh nhân tái hẹp trong stent lan tỏa trên IVUS có tổng chiều dài stent dài hơn và tỷ lệ cao hơn của stent không nở trọn (39%) tại vị trí đường kính lòng mạch tối thiểu so sánh giữa tái hẹp điểm hay khu trú (6%) và nhiều vị trí (22%) (3, 23).
4.3. Chụp cắt lớp quang học nội mạch (OCT)
OCT cho phép xem các đặc điểm tốt hơn, rõ nét về lòng mạch, bề mặt của lớp nội mạc, và phân bổ của các mắt cáo stent. Tái hẹp trong stent BMS nhìn chung được thể hiện bởi đồng nhất tín hiệu mô trên OCT, phản ảnh NIH giàu các tế bào cơ trơn. Trái ngược lại, DES-ISR đặc trưng bởi sự đồng nhất hoặc các lớp xuất hiện trên OCT, phản ảnh giàu tế bào nội mạc với nhiều proteoglycan hoặc mô sợi. Gonzalo và cs mô tả hình ảnh đặc điểm cấu trúc của BMS và DES-ISR theo số lượng và chất lượng trên OCT và đánh giá mối quan hệ giữa đặc điểm hình ảnh học trên mạch vành với đặc điểm trên OCT (bảng 1)
Gần đây, phân loại mới sắp xếp các đặc điểm và cơ chế của ISR, hướng dẫn mục đích điều trị. Trong phân loại này có sự khác biệt giữa cơ chế (type 1, bao gồm stent nở không hết [1a], và gãy stent [1b]), sinh học (type II, bao gồm NIH [2a], xơ vữa nội mạc không có can xi hóa [2b], và xơ vữa nội mạc có can xi hóa [2c], trộn các nguyên nhân [type III], tắc mạn tính [type IV], 2 lớp ISR (type 5). Ví dụ của hình ảnh học chụp mạch vành, IVUS, OCT sự khác nhay về loại và cơ chế được thể hiện ở hình 4 (3, 24,25).
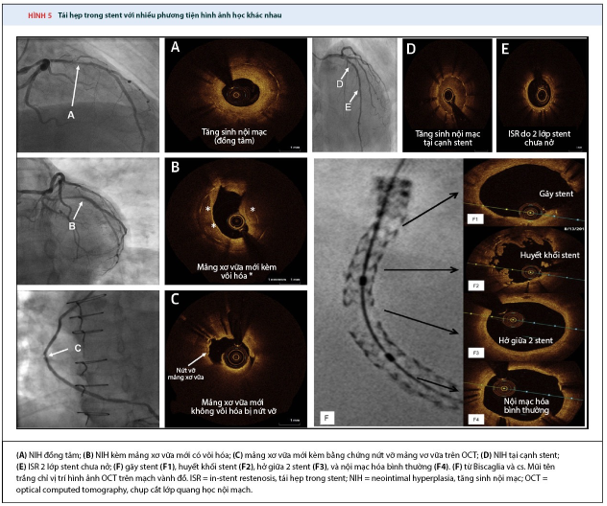
Hình 4. ISR với nhiều phương tiện hình ảnh học khác nhau (3)
| Bảng 1. Đặc điểm hình ảnh học của tái hẹp trong stent | |||
| Loại/Nhóm | Mô tả | ||
| Chụp mạch vành | |||
| Phân loại Mehran | Nhóm I (ISR khu trú) | (Type IA) Sang thương với chiều dài ≤ 10 mm và tại vị trí không có stent (chỗ ghép hoặc nối), (type IB) trong thân stent, (type IC) gần hoặc mép xa, (type ID) phối hợp cả 3 vị trí trên | |
| Nhóm II (ISR lan tỏa) | San thương với chiều dài > 10 mm và được giới hạn trong đoạn đặt stent, không lan ra ngoài mép stent | ||
| Nhóm III (tăng sinh lan tỏa) | Sang thương với chiều dài > 10 mm và vượt quá mức các mép stent của đoạn được đặt stent | ||
| Nhóm IV (tắc hoàn toàn) | Tổn thương với TIMI 0 | ||
| IVUS | |||
| Kang và cs | ISR khu trú (focal ISR) | Được định nghĩa diện tích lòng < và chiều dài ≤ 10 mm, và điểm khác nhau bởi vị trí:
+ “loại khu trú trong thân stent” (focal body type) được giới hạn trong thân stent + “loại khu trú tại vị trí mép” (focal marginal type) vượt quá mép của stent |
|
| ISR nhiều điểm (mutifocal ISR) | Được định nghĩa bởi sự hiện diện của nhiều tổn thương khu trú, với điểm khác nhau:
+ “Loại nhiều điểm trong thân stent” (multifocal body type) giới hạn trong thân stent + “Loại nhiều điểm ở mép stent” liên quan đến mép stent |
||
| ISR lan tỏa (diffuse ISR) | Định nghĩa MLA < và chiều dài > 10 mm, với điểm khác nhau:
+ “Loại lan tỏa trong thân stent” (diffuse body type) giới hạn trong thân stent + “Loại lan tỏa tại mép stent” liên quan đến mép stent |
||
| OCT | |||
| Ali et al
(phân loại OCT của xơ vữa động mạch mới) |
Type I | vữa động mạch mới với lớp xơ mỏng: được định nghĩa ≥ 1 vùng lóp mỏng, xơ vữa động mạch mới khu trú giữa lòng mạch và mắt cáo stent | |
| Type II | vữa động mạch mới với lớp xơ dày: được định nghĩa không có lớp xơ mỏng, mảng xơ vữa khu trú giữ lòng mạch và mắt cáo stent | ||
| Type III | vữa động mạch mới quanh mắt cáo: được định nghĩa là vữa động mạch mới khu trú xung quanh các mắt cáo stent | ||
| Type IV | Mảng xơ sợi xuất hiện từ trước: được định nghĩa xơ vữa động mạch tồn tại từ trước biểu hiện bằng vùng tín hiện kém với đường viên lan tỏa giữa các mắt cáo stent và lớp áo ngoài | ||
5. Chiến lược điều trị
Quản lý bệnh nhân tái hẹp trong stent là thách thức lớn bởi vì các cơ chế không đồng nhất và tốc độ tái phát tương đối cao. Hầu hết bệnh nhân ISR biểu hiệu của đau ngực không ổn định, hình thức và thời điểm can thiệp cần được lên kế hoạch hết sức cẩn thận. Khi chụp mạch vành mức độ của tái hẹp trong stent là không chắc chắn, hướng dẫn sinh lý với sử dụng FFR hoặc chỉ số không cần dùng thuốc dãn mạch để xác định mức độ hẹp của tổn thương mạch vành về mặt huyết động. Chúng ta cần đánh giá một cách hệ thống bao gồm mức độ phức tạp của tổn thương, loại stent sử dụng, kỹ thuật can thiệp nên được đánh giá cẩn trọng và nhận định vấn đề kỹ thuật tiềm ẩn có thể có nguy cơ là nguyên nhân của ISR và lập kế hoạch tối ưu điều trị. IVUS hoặc OCT là những công cụ cần thiết để đánh giá cơ chế và đặc điểm của ISR và nên xem xét đươc sử dụng thường quy.
Cách tiếp cận thực hành trong quản lý ISR được tóm tắt tại hình trung tâm, và cho đến hiện tại, cũng đã có nhiều bằng chứng từ RCT. Hội tim mạch châu Âu khuyến cáo, với nhóm I, hoặc DES hoặc DCBs để điều trị ISR. Tuy nhiên, DCB (drug coated balloon: bong phủ thuốc) không được phép sử dụng cho mục đích thương mại trong can thiệp mạch vành tại Mỹ. Gần đây hiệp hội AHA/ACC, xếp DES thành phân loại nhóm IA khi thực hiện can thiệp ở bệnh nhân tái hẹp trong stent. Cả 2 hướng dẫn ở châu Âu và tại Mỹ, khuyến cáo chỉ định Class IIa khi sử dụng hình ảnh IVUS hoặc OCT để giải thích cơ chế cuả ISR (26,27)
Chuẩn bị sang thương nhằm mục địch tối ưu hóa điều trị tái hẹp trong stent. Bóng Cutting hoặc Scoring nên được sử dụng ưu tiên khi lên bóng để làm giảm trượt bóng ra bên ngoài vị trí không có stent. Lên bóng nong áp lực cao khi đặt stent nên được sử dụng, cụ thể nếu stent không nở trọn là cơ chế ưu thế chính của tái hẹp trong stent. Dựa trên các bằng chứng lâm sàng từ nhiều RCT và phân tích các dữ liệu, sau khi chuẩn bị đủ sang thương và stent nở trọn thì PCI lần thứ 2 nên được thực hiện với DES hoặc DCB. Hướng dẫn chọn lựa DES hay DCB được tóm tắt tại bảng 2. Ở một số trường hẹp stent không nở trọn được, sử dụng bóng nong áp lực rất cao (OPN), IVL (intravascular lithotripsy), ELCA (excimer laser atherectomy), RA (rotational atherectomy) nên được xem xét thực hiện (xem phần dưới). Ở các bệnh nhân có nhiều lớp ISR (>2 lớp), phẫu thuật bắc cầu mạch vành nên được xem xét (CABG). Ngoài ra, nếu PCI của nhiều lớp ISR không thành công, thì việc thêm DES nên được tránh, thay vào đó nong bóng phủ thuốc và bóng cutting hoặc scoring áp lực cao kết hợp với IVBT (itravascular brachytherapy: xạ trị trong lòng mạch) có thể được xem thực hiện để cải thiện tiên lượng dài hạn (28-30).
5.1. Bóng nong mạch vành (BA)
BA vẫn giữ vai trò trong điều trị tái hẹp trong stent DES-ISR và BMS-ISR. Tuy nhiên ngày nay phương thức này đã được chứng minh là kém hiệu qua hơn các phương thức điều trị ISR gần đây. Tuy nhiên, sử dụng bóng nong mạch vành áp lực cao vẫn giữ vai trò quan trọng trong điều trị DES-ISR không nở trọn vẹn. Sử dụng bong nong vành áp lực cao được thực hiện bằng bóng cứng ngắn (bóng cứng ngắn: short-noncompliant). Bóng cứng dài hơn có thể được sử dụng để làm giảm trượt bóng, cụ thể ở những sang thương dài. Sau khi nong bóng nên tiếp tục sử dụng DES thứ 2 (nếu 1 lớp stent) hoặc DCB nếu (2 lớp stent) (28,30).
| Bảng 2 Các yếu tố ủng hộ sử dụng bóng phủ thuốc với sử dụng DES trong điều trị tái hẹp trong stent (3) | |
| Ủng hộ sử dụng bóng phủ thuốc | Ủng hộ sử dụng đặt lại DES |
| Tái hẹp trong stent với kiểu tái hẹp ít tích cực hơn (ví dụ: khu trú) với đường kính lòng mạch nở tốt sau khi dùng bóng nong | Tái hẹp trong stent với kiểu tái hẹp cần phải tích cực hơn (ví dụ: lan tỏa hoặc tắc) nguy cơ cao của tái hẹp trở lại |
| Tái hẹp trong stent sau khi đặt stent trần kim loại (BMS) | Tái hẹp ở stent phủ thuốc |
| Tái hẹp trong stent với nhiều lớp stent | Tái hẹp trong stent với 1 lớp stent |
| Bệnh nhân có nguy cơ chảy máu cao mà người này không dung nạp với DAPT | Biểu hiện của cơ chế tái hẹp liên quan đến stent (ví dụ: stent fracture hoặc stent gap) |
| Nhánh bên lớn phức tạp, cần tránh việc mất nhánh bên do nhiều lớp stent. | Đường kính lòng không tối ưu sau khi sử dụng bóng nong |
5.2. Bóng Cutting (bóng cắt) hoặc Scoring balloon (bóng tạo hình)
Là bóng được giới thiệu từ những năm 1990 với ý nghĩa cải thiện hiệu quả hơn của bóng nong mạch vành ở nhưng mạch vành có sang thương phức tạp. Bóng Cutting được thiết kế với 3-4 lưỡi dao (μm) riêng biệt gắn vào thân bóng dùng để cắt hoặc rạch các mảng xơ vữa, mô sợi, hoặc vôi hóa. Khi dùng bóng Cutting có thể đạt được đường kính lớn hơn ở áp lực thấp hơn làm giảm hiện tượng co lại ở các sang thương. Bóng Scoring như là AngioSculpt device (Phillip Healthcare) bao gồm ống thông 2 nòng, với với bóng nylon bán đàn hồi được bao bên ngoài bởi rìa xoắn ốc được làm bằng nitinol. Hầu hết gần đây, thường sử dụng bóng Scoring để chuẩn bị trước khi sử dụng DCB ở bệnh nhân tái hẹp trong stent, một số giả thuyết cho rằng việc dùng bóng scoring ở sang thương NIH có thể tăng hiệu quả khi dùng bóng phủ thuốc. Trong thử nghiệm ISAR-DESIRE 4 (Intracononary Stenting and Angiographic Results: Optimizing Treatment Of Drug-Eluting Stent In-Stent Restenosis) 252 bệnh nhân với DES-ISR được ngẫu nhiên dùng bóng nong mạch vành hoặc bóng Scoring trước khi dùng bóng phủ thuốc điều trị. Chụp mạch vành theo dõi tại thời điểm 6-8 tháng, bệnh nhân được sử dụng bóng Scoring và bóng phủ thuốc có tỷ lệ thấp hơn có ý nghĩa của tỷ lệ phần trăm đường kính trong stent tại vị trí hẹp so với nong bóng tiêu chuẩn và bóng phủ thuốc. Bóng Scoring phủ thuốc paclitaxel cũng có sự phát triển và sử dụng thuận lợi hơn bóng scoring không được phủ thuốc trong điều trị tái hẹp trong stent (31,32).
5.3. Can thiệp đặt lại DES.
Lặp lại can thiệp DES hầu hết có hiệu quả điều trị nhất khi do stent không nở trọn (hình 5). Trong hệ thông dữ liệu liên kết phân tích của các RCT trong việc đánh giá chiến lược điều trị của tái hẹp trong stent, everolimus-eluting stent (EES) hiệu quả nhất trong điều trị cải thiện tỷ lệ phần trăm đường kính tại vị trí tái hẹp theo dõi bằng chụp mạch vành, sau đó là dùng bóng phủ thuốc. Cũng như, ISR-PCI với EES có mối liên quan có ý nghĩa nguy cơ thấp hơn của TLR so sánh với tất cả các chiến lược điều trị khác, với làm giảm 64% (so sánh với DCB) đến 99% (so sánh với dùng bóng nong vành tiêu chuẩn). Đề kháng với thuốc chống tăng sinh là cơ chế tiềm năng của DES-ISR. Tuy nhiên, không có bằng chứng rõ ràng hoặc sự đồng thuận rằng nên sử dụng một loại DES khác khi sử dụng DES-ISR. Trong thử nghiệm ISAR-DESIRE 2, trong đó bệnh nhân với sirolimus DES-ISR được ngẫu nhiên lặp lại đặt stent phủ thuốc sirolimus hoặc chuyển sang stent phủ thuốc paclitaxel, hiệu quả chống tái hẹp tương tự nhau giữa 2 loại DES (30,33).

Hình 5. Phân tích gộp so sánh chiến lược điều trị ISR
5.4. Bóng phủ thuốc.
Bóng phủ thuốc mạch vành, mặc dù không có sẵn tại Mỹ, nhưng có sẵn rộng rãi trên toàn thế giới tạo thành một phương thức điều trị quan trong cho ISR. Bóng phủ thuốc bao gồm bóng bán đàn hồi được phủ chất chống tăng sinh nội mạc được phóng thích vào thành mạch sau khi bơm căng bóng. Một số loại bóng phủ thuốc có sẵn để sử dụng thương mại bên ngoài nước Mỹ, chủ yếu sử dụng thuốc Paclitaxel vì nó ưa mỡ hơn và hấp thu vào tế bào nhanh hơn so với các loại thuốc limus khác. Các bóng phủ thuốc Sirolimus sử dụng kỹ thuật vận chuyển khác nhau để tăng cường sự hấp của thuốc vào mô đã được phát triển và chứng minh kết quả đầy hứa hẹn. Bóng phủ thuốc đã được chứng mình là có hiệu quả và an toàn trong điều trị tái hẹp trong stent ở các nghiên cứu sổ bộ và nhiều RCT (34.35).
5.5. Khi nào dùng DES và khi nào dùng DCB
Bảng tóm tắt khi nào dùng DES, khi nào dùng DCB trên bệnh nhân tái hẹp trong stent (bảng 2). Lặp lại đặt DES là phương pháp điều trị có hiệu quả nhất cho DES-ISR và nên được ưu tiên để cải thiện thông thoáng lâu dài của tổn thương tái hẹp khi chụp mạch vành có hình ảnh có nguy cơ tái hẹp cao (ví dụ hẹp lan tỏa hoặc tắc) hoặc ở những trường hợp liên quan đến cơ chế của stent (ví dụ gãy stent hoặc khỏang trống stent). DCB mang lại nhiều lợi thế là giải phóng một loại thuốc chống tăng sinh trong khi tránh đặt lại thêm một stent nữa. Bóng phủ thuốc có thể sử dụng trong các tổn thương ít phức tạp hơn (ví dụ như khu trú hoặc rìa stent), nhiều lớp tái hẹp nên tránh can thiệp thêm lớp DES nữa, BMS-ISR, bệnh nhân có nguy cơ chảy máu cao và không dung nạp khi sử dụng DAPT kéo dài. Khi điều trị ISR, DCB có liên quan đến đường kính lòng mạch tối thiểu cuối cùng nhỏ hơn so sánh với việc đặc lại DES, do đó liên quan đến nguy cơ TLR cao hơn khi theo dõi. Vì vậy để đảm bảo rằng bóng nở trọn vẹn với lòng mạch thì việc sử dụng IVUS là điều quan trọng. Trong một số trường hợp kết quả chưa tối ưu lòng mạch nở không tốt, việc lặp lại đặc DES có thể được xem xét (3,5,6 36,37).
5.6. Atheroablative therapy.
RA (khoan cắt mảng xơ vữa) và ELCA (khoan cắt động mạch bằng laser) hoạt động bằng cách loại bỏ mô bị vôi hóa, thường là để hỗ trợ cho nong bóng và đặt stent. RA đã được sử dụng trong thực hành lâm sàng hơn 3 thập kỷ qua. RA tạo ra sử mở rộng lòng mạch bằng cách loại bỏ vật lý mảng xơ vữa động mạch bằng cách sử dụng mũi khoan hình elip tráng kim cương quay ở tốc độ cao (140.000 – 180.000 vòng/phút) trên một guide wire. Mũi khoan ưu tiên cắt bỏ mô cứng không đàn hồi trong khi tránh mô thành động mạch khỏe mạnh (khác với cutting). Trong tái hẹp trong stent lan tỏa, RA cắt bỏ mô NIH tạo điều kiện có stent được nở tốt bằng cách sử dụng bóng nong áp lực cao. Tuy nhiên liệu việc cắt bỏ mảng xơ vữa với RA có cải thiện kết cục lâm sàng hay không kết quả so với BA đơn thuần là không chắc chắn do các kết quả mâu thuẫn từ RCT. Mặc dù mũi khoan RA có khả năng cắt bỏ kim loại trong stent nhưng nó nên được sử dụng cẩn thận trong các trường hợp stent nở không tốt để tránh làm kẹt mũi khoan. Do đó, điều quan trọng là phải mô tả cơ chế cơ cản và bản chất của ISR bằng IVUS hoặc OCT trước khi sử dụng RA trong tái hẹp trong stent (3,38).
ELCA đã được sử dụng trong thực hành lâm sàng hơn 20 năm. Laser excimer tạo ra năng lượng ánh sáng đơn sắc được mảng bám hấp thụ và thông qua việc tạo ra nhiệt và sóng xung kích, để phá vỡ các mảng bám. Trong giai đoạn đầu, kết quả của ELCA trong các tổn thương mạch vành mới không thuận lợi hơn so với BA đơn thuần, do tỷ lệ tái hẹp cao hơn và các biến cố bất lợi nghiêm trọng. Hiện tại ELCA được đề xuất như một chọn lựa điều trị trên một số nhóm tổn thương khó nhất định, như các tổn thương vôi hóa nặng hoặc tái hẹp lan tỏa. Trong bối cảnh tái hẹp trong stent, ELCA cắt bỏ NIH và đã được chứng minhtrong các nghiên cứu quan sát có liên quan đến tỷ lệ thành công thủ thuật cao và tỷ lệ biến chứng quanh thủ thuật thấp so với chỉ dùng bóng nong đơn thuần. Trong một nghiên cứu quan sát khác ở những bệnh nhân mắc BMS-ISR, ELCA cộng với BA có kết quả tương tự về đường kính lòng sau can thiệp trên IVUS so sánh với RA cộng với BA; Tuy nhiên trong trường hợp stent nở không trọn, ELCA nên được sử dụng thận trọng do có thể có nguy có thủng mạch máu và hiện tượng no-reflow (hiện tượng không dòng chảy) nghiêm trọng (39,40).
5.7. Intravascular brachytherapy (xạ trị trong lòng mạch IVBT).
IVBT ức chế sự hình thành nội mạc trong stent bằng cách cung cấp bức xạ strontium-90/yttrium-90 β phóng xạ cực bộ để ngăn chặn sự tăng sinh nguyên bào sợ i. IVBT đã được phê duyệt cho sự dụng thương mại cách đây 20 năm như một phương pháp điều trị BMS-ISR. Trong thử nghiệm Gamma-One ban đầu chiếu xạ cực bộ mạch vành bằng iridium-192 dẫn đến tỷ lệ tái hẹp mạch vành trên lâm sàng và chụp mạch vành thấp hơn so với giả dược, nhưng tỷ lệ huyết khối muộn cao hơn, đặc biệt ở những bệnh nhân đặt stent thứ hai và những người này đã ngưng sử dụng DAPT. IVBT sau đó đã được thay thế bằng DES để điều trị BMS-ISR dựa trên kêt quả của SISR và TAXUS V, thử nghiệm đã chứng minh rằng stent phủ thuốc sirolimus và paclitaxel tốt hơn IVBT trong điều trị BMS-ISR. Hiện tại IVBT thường được lựa chọn điều trị cho những tái hẹp trong stent có 2 lớp stent hoặc tái phát tái hẹp của DES với khuyến cáo Class IIb (27).
5.8. Intravascular lithotripsy (tán vôi hoá nội mạch IVL).
IVL là một công nghệ mới trong đó nhiều bộ phát lithotripsy được gắn lên một hệ thống cung cấp các sóng âm, áp xung cục bộ giải phóng các đợt năng lượng làm biến đổi mảng xơ vữa động mạch vành bị vôi hóa mới xuất hiện. IVL đã được chứng là an toàn và hiệu quả trong việc gây vỡ mảng bám vôi hóa và xơ vữa động mạch. Trong tình huống ISR, IVL đã được báo cáo giới hạn trong một loạt các trường hợp về tính an toàn và hiệu quả. Đặc biệt IVL có thể được sử dụng cho chiến lược điều trị trong những trường hợp stent không nở được tại vị trí vôi hóa hoặc NIH vôi hóa, khi mà RA hoặc BA áp lực cao có thể liên quan đến nguy cơ thủng mạch hoặc vỡ mạch cao hơn và kết quả dưới mức tối ưu. Trong các tổn thương bị vôi hóa nghiêm trọng, có thể hữu ích khi thực hiện một số chuẩn bị các tổn thường bằng bóng NC áp lực cao hoặc bóng Cutting để cải thiện khả năng phân phối của IVL và tránh khả năng làm hỏng bóng IVL (41,42).
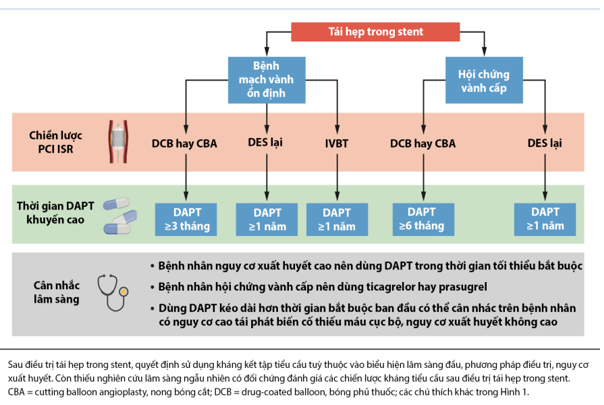
Hình 6. Đề xuất dùng kháng tiểu cầu sau PCI điều trị ISR
5.9. Điều trị nội khoa.
Một số điều trị đã được đánh giá ngăn ngừa ISR, với kết quả âm tính. Sau khi điều trị ISR, liệu pháp kháng kết tập tiểu cầu có thể được điều chỉnh dựa trên hình thực điều trị tái hẹp trong stent được sử dụng (hình 6), nhưng các RCT đánh giá thời gian tối ưu hóa của điều trị DAPT sau khi can thiệp tái hẹp trong stent hiện nay còn thiếu. Trong một phân tích của thử nghiệm PRODIGY (Prolonging Dual Antiplatelet Treatment After Grading Stent-Induced Intimal Hyperplasisa), khoảng 224 bệnh nhân được PCI-ISR, điều trị DAPT trong 24 tháng tỷ lệ tử vong thấp hơn, nhồi máu và tai biên mạch máu não so với điều trị DAPT 6 tháng, trong khi đó không có sự khác biệt đáng kể nào ở những bệnh nhân trải qua PCI các tổn thương mới. Trong nghiên cứu đó, tất cả các bệnh nhân được điều trị bằng đặt lại DES và hầu hết bệnh nhân biểu hiện hội chứng mạch vành cấp. Ở những bệnh nhân được điều trị ISR bằng DCB, các RCT khuyến cáo thời gian dùng DAPT từ 3-12 tháng và phù hợp với hướng dẫn gần đây của hiệp hội tim mạch Châu Âu và ACC/AHA, sau PCI cho ISR ở những bệnh nhân có hội chứng mạch vành cấp tính, DAPT với 75-100 mg aspirin mỗi ngày cộng với thuốc ức chế thụ thể P2Y12 trong ít nhất một năm nên được xem xét. Bệnh nhân mắc ISR có các triệu chứng của bệnh mạch vành mạn ổn định được điều trị bằng DES cũng sẽ dùng DAPT ít nhất 1 năm. Thời gian DAPT ngắn hơn có thể được xem xét nếu bệnh nhân được điều trị bằng DCB hoặc bằng bóng cutting, đặc biệt nếu có nguy cơ chảy máu cao. IVBT nên được điều trị với thời gian DAPT kéo dài nếu không có nguy cơ chảy máu cao. Mặc dù không có bằng chứng chắn chắn rằng liệu máu hạ lipid máu mạnh sẽ làm giảm nguy cơ của DES-ISR, nhưng nếu LDL-C trước PCI kiểm soát kém có liên quan đến nguy cơ xơ vữa động mạch sớm cao hơn. Ngoài ra trong một phân tích gần đây từ thử nghiệm FOURIER (Futher cardiovascular Outcomes Research With PCSK9 Inhibition in Subjects With Elavated Risk) liệu pháp hạ lipid máu với chức ức chế PCSK9 evolocumab dẫn đến nguy cơ tái thông mạch máu lại thấp hơn đáng kể do ISR hoặc ST ở những bệnh nhân có tiền sử đặt stent (36.43,44).
5.10. Phẫu thuật bắt cầu mạch vành (CABG).
Phẫu thuật bắt cầu mạch vành có liên quan đến tỷ lệ tái thông mạch vành trở lại thấp hơn so với PCI do tác dụng bảo vệ của mảnh ghép phẫu thuật đối với xơ vữa động mạch tiến triển gần đoạn mạch vành được nối. Trong số những bệnh nhân đã được can thiệp, ISR tiến triển và tái phát ở các mạch máu thượng tâm mạc lớn, chẳng hạn như LM, hoặc bệnh nhiều nhánh mạch vành, CABG nên được xem xét sau khi thảo luận với phẫu thuật tim mạch thay vì cố gắng lặp lại PCI, cụ thể ở trường hợp tái hẹp có 2 lớp. Mặc dù các PCI trước đây có thể ảnh hưởng hoặc làm tổn hại đến việc chọn lựa mạch máu mục tiêu cho việc nối thông, nhưng trong một nghiên cứu lớn, tiền sử PCI trước đó không liên quan đến kết quả trung hạn hoặc dài hạn trầm trọng hơn sau CABG (26,27,45).
KẾT LUẬN
Gánh nặng toàn bộ của ISR vẫn là một vấn đề lâm sàng quan trọng ngay cả với các thế DES ngày nay. Trên thực tế nhu cầu về TLR sau khi được đặt DES tiếp tục xảy ra với tỷ lệ tuyệt đối là 1% đến 2% mỗi năm và 10-20% bệnh nhân có tiến triển biến cố tái hẹp trong stent đầu tiên sẽ phát triển tái hẹp trong stent tái phát. Cơ chế của ISR không đồng nhất và việc quản lý vẫn còn nhiều thách thức. Đặc điểm và xác định các cơ chế và bản chất của tái hẹp trong stent bằng việc sử dụng hình ảnh siêu âm trong lòng mạch để hướng dẫn cho quản lý lâm sàng. Việc đặt lại DES là phương pháp điều trị hiệu quả nhất đối với ISR một lớp trong việc giảm nhu cầu lặp lại TLR. DCB là một lựa chọn điều trị hấp dẫn cho ISR nhiều lớp và tái hẹp trong các mạch máu nhỏ. Cuối cùng heart team là phương pháp tiếp cận được khuyên dùng cho những bệnh nhân ISR tái phát khi phẫu thuật được chỉ định, đặc biệt là khí có bệnh động mạch vành nhiều nhánh. Bảng 3 và hình 7 tóm tắt nhửng điểm chính trong điều trị ISR.
Bảng 3. Những điều nên và không nên làm ở bệnh nhân ISR

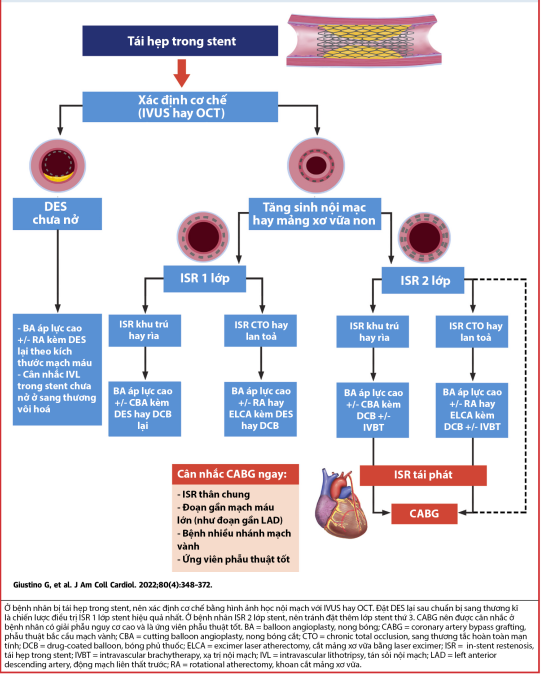
Hình 7. Đề xuất chiến lược điều trị ISR
TÀI LIỆU THAM KHẢO
- Piccolo R, Giustino G, Mehran R, Windecker S. Stable coronary artery disease: revascularisation and invasive strategies. Lancet. 2015;386:702–713.
- Stefanini GG, Holmes DR Jr. Drug-eluting coronary-artery stents. N Engl J Med. 2013;368: 254–265
- G, Colombo. A, Camaj. A et al: Coronary In-Stent Restenosis. J Am Coll Cardiol 2022;80:348–372
- Madhavan MV, Kirtane AJ, Redfors B, et al. Stent-related adverse events >1 year after percutaneous coronary intervention. J Am Coll Cardiol. 2020;75:590–604
- Dangas GD, Claessen BE, Caixeta A, Sanidas EA, Mintz GS, Mehran R. In-stent restenosis in the drug-eluting stent era. J Am Coll Cardiol. 2010;56: 1897–1907
- Alfonso F, Byrne RA, Rivero F, Kastrati A. Current treatment of in-stent restenosis. J Am Coll Cardiol. 2014;63:2659–2673.
- Stefanini GG, Alfonso F, Barbato E, et al. Management of myocardial revascularisation failure: an expert consensus document of the EAPCI. EuroIntervention. 2020;16:e875–e890
- Magalhaes MA, Minha S, Chen F, et al. Clinical presentation and outcomes of coronary in-stent restenosis across 3-stent generations. Circ Cardiovasc Interv. 2014;7:768–776.
- Assali AR, Moustapha A, Sdringola S, et al. Acute coronary syndrome may occur with in-stent restenosis and is associated with adverse outcomes (the PRESTO trial). Am J Cardiol. 2006;98: 729–733.
- Otsuka F, Vorpahl M, Nakano M, et al. Pathology of second-generation everolimus-eluting stents versus first-generation sirolimus- and paclitaxel-eluting stents in humans. Circulation. 2014;129:211–223
- Mintz GS. Features and parameters of drugeluting stent deployment discoverable by intravascular ultrasound. Am J Cardiol. 2007;100:26m– 35m.
- Tsunoda T, Nakamura M, Wada M, et al. Chronic stent recoil plays an important role in restenosis of the right coronary ostium. Coronary Artery Dis. 2004;15:39–44
- Raber L, Mintz GS, Koskinas KC, et al. Clinical use of intracoronary imaging. Part 1: Guidance and optimization of coronary interventions. An expert consensus document of the European Association of Percutaneous Cardiovascular Interventions. EuroIntervention. 2018;14:656–677
- Hecht HS, Polena S, Jelnin V, et al. Stent gap by 64-detector computed tomographic angiography relationship to in-stent restenosis, fracture, and overlap failure. J Am Coll Cardiol. 2009;54: 1949–1959
- Camaj A, Giustino G, Claessen BE, et al. Effect of stent diameter in women undergoing percutaneous coronary intervention with early- and newgeneration drug-eluting stents: from the WIN-DES Collaboration. Int J Cardiol. 2019;287:59–61.
- Elezi S, Dibra A, Mehilli J, et al. Vessel size and outcome after coronary drug-eluting stent placement: results from a large cohort of patients treated with sirolimus- or paclitaxel-eluting stents. J Am Coll Cardiol. 2006;48:1304–1309.
- Giustino G, Mastoris I, Baber U, et al. Correlates and impact of coronary artery calcifications in women undergoing percutaneous coronary intervention with drug-eluting stents: from the Women in Innovation and Drug-Eluting Stents (WIN-DES) Collaboration. J Am Coll Cardiol Intv. 2016;9:1890–1901.
- Otsuka F, Byrne RA, Yahagi K, et al. Neoatherosclerosis: overview of histopathologic findings and implications for intravascular imaging assessment. Eur Heart J. 2015;36:2147–2159
- Bangalore S, Toklu B, Patel N, Feit F, Stone GW. Newer-generation ultrathin strut drugeluting stents versus older second-generation thicker strut drug-eluting stents for coronary artery disease. Circulation. 2018;138:2216–2226.
- Teeuwen K, van der Schaaf RJ, Adriaenssens T, et al. Randomized multicenter trial investigating angiographic outcomes of hybrid sirolimus-eluting stents with biodegradable polymer compared with everolimus-eluting stents with durable polymer in chronic total occlusions: the PRISON IV trial. J Am Coll Cardiol Intv. 2017;10: 133–143.
- Mehran R, Dangas G, Abizaid AS, et al.Angiographic patterns of in-stent restenosis:classification and implications for long-termCirculation. 1999;100:1872–1878.
- Cutlip DE, Windecker S, Mehran R, et al. Clinical end points in coronary stent trials: a case for standardized defi Circulation. 2007;115: 2344–2351
- Kang SJ, Mintz GS, Park DW, et al. Mechanisms of in-stent restenosis after drug-eluting stent implantation: intravascular ultrasound analysis. Circ Cardiovasc Interv. 2011;4:9–
- Gonzalo N, Serruys PW, Okamura T, et al. Optical coherence tomography patterns of stent Am Heart J. 2009;158:284–293.
- Adriaenssens T, Joner M, Godschalk TC, et al. Optical coherence tomography findings in patients with coronary stent thrombosis: a report of the PRESTIGE Consortium (Prevention of Late Stent Thrombosis by an Interdisciplinary Global European Effort). Circulation. 2017;136:1007–
- Neumann FJ, Sousa-Uva M, Ahlsson A, et al. 2018 ESC/EACTS guidelines on myocardial revascularization. Eur Heart J. 2019;40:87–
- Lawton JS, Tamis-Holland JE, Bangalore S, et al. 2021 ACC/AHA/SCAI guideline for coronary artery revascularization: a report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol. 2022;79:e21–
- Albiero R, Silber S, di Mario C, et al. Cutting balloon versus conventional balloon angioplasty for the treatment of in-stent restenosis: results of the Restenosis Cutting Balloon Evaluation Trial (RESCUT). J Am Coll Cardiol. 2004;43:943–
- Varghese MJ, Bhatheja S, Baber U, et al. Intravascular brachytherapy for the management of repeated multimetal-layered drug-eluting coronary stent restenosis. Circ Cardiovasc Interv. 2018;11:e006832
- Giacoppo D, Gargiulo G, Aruta P, Capranzano P, Tamburino C, Capodanno D. Treatment strategies for coronary in-stent restenosis: systematic review and hierarchical bayesian network meta-analysis of 24 randomised trials and 4880 patients. BMJ. 2015;351:h5392.
- Kufner S, Joner M, Schneider S, et al. Neointimal modification with scoring balloon and efficacy of drug-coated balloon therapy in patients with restenosis in drug-eluting coronary stents: a randomized controlled trial. J Am Coll Cardiol Intv. 2017;10:1332–
- Scheller B, Fontaine T, Mangner N, et al. A novel drug-coated scoring balloon for the treatment of coronary in-stent restenosis: results from the multi-center randomized controlled PATENT-C first in human trial. Catheter Cardiovasc Interv. 2016;88:51–59
- Mehilli J, Byrne RA, Tiroch K, et al. Randomized trial of paclitaxel- versus sirolimus-eluting stents for treatment of coronary restenosis in sirolimus-eluting stents: the ISAR-DESIRE 2 (Intracoronary Stenting and Angiographic Results: Drug Eluting Stents for In-Stent Restenosis 2) J Am Coll Cardiol. 2010;55:2710–2716.
- Yerasi C, Case BC, Forrestal BJ, et al. Drugcoated balloon for de novo coronary artery disease: JACC state-of-the-art review. J Am Coll Cardiol. 2020;75:1061–
- Scheller B. One-year outcomes of two parallel randomized trials of sirolimus-coated and paclitaxel-coated balloons in coronary in-stent restenosis lesions. Paper presented at: TCT 2021; November 6, 2021. https://www.tctmd.com/slide/one-year-outcomes-two-parallel-randomized-trialssirolimus-coated-and-paclitaxel-coated
- Shlofmitz E, Iantorno M, Waksman R. Restenosis of drug-eluting stents: a new classification
system based on disease mechanism to guide treatment and state-of-the-art review. Circ Cardiovasc Interv. 2019;12:e007023 - Giacoppo D, Alfonso F, Xu B, et al. Drug coated balloon angioplasty versus drug-eluting
stent implantation in patients with coronary stent restenosis. J Am Coll Cardiol. 2020;75:2664–2678 - Sharma SK, Tomey MI, Teirstein PS, et al. North American expert review of rotational atherectomy. Circ Cardiovasc Interv. 2019;12:e007448
- Mehran R, Mintz GS, Satler LF, et al. Treatment of in-stent restenosis with excimer laser coronary angioplasty: mechanisms and results compared with PTCA alone. Circulation. 1997;96: 2183–
- Mehran R, Dangas G, Mintz GS, et al. Treatment of in-stent restenosis with excimer laser coronary angioplasty versus rotational atherectomy: comparative mechanisms and results. Circulation. 2000;101:2484–2489
- Brinton TJ, Ali ZA, Hill JM, et al. Feasibility of shockwave coronary intravascular lithotripsy for the treatment of calcified coronary stenoses. Circulation. 2019;139:834–
- Brunner FJ, Becher PM, Waldeyer C, et al. Intravascular lithotripsy for the treatment of calcium-mediated coronary in-stent restenoses. J Invasive Cardiol. 2021;33:E25–E31
- Campo G, Tebaldi M, Vranckx P, et al. Shortversus long-term duration of dual antiplatelet therapy in patients treated for in-stent restenosis: a PRODIGY trial substudy (Prolonging Dual Antiplatelet Treatment After Grading Stent-Induced Intimal Hyperplasia). J Am Coll Cardiol. 2014;63: 506–
- Furtado RHM, Fagundes AA Jr, Oyama K, et al. Effect of evolocumab in patients with prior percutaneous coronary intervention. Circ Cardiovasc Interv. 2022;15:e011382
- Biancari F, Dalen M, Ruggieri VG, et al. Prognostic impact of multiple prior percutaneous coronary interventions in patients undergoing coronary artery bypass grafting. J Am Heart Assoc. 2018;7:e010089.







