TS. PHẠM HỮU VĂN
Phức hợp thất sớm (Premature Ventricular Complexes – PVCs) hay thường gọi là ngoại tâm thu thất là rối loạn nhịp phổ biến và xảy ra trong một phổ rộng trong dân số. Điều này gồm những bệnh nhân không có bệnh tim cấu trúc rõ ràng cũng như những người mắc bất kỳ dạng bệnh tim nào, không phụ thuộc vào mức độ nghiêm trọng của bệnh. Khi nào cần điều trị và điều trị như thế nào? Đây là một vấn đề rất quan trọng thực hành lâm sàng, không những cần thiết ở các bác sỹ chuyên về rồi loạn nhịp, các các bác sỹ tim mạch, mà cần cho cả các bác sỹ tổng quát và nhiều bác sỹ chuyên khoa khác.
Trong chuyên đề này, chúng tôi đi sâu vào cách tiếp cận để đánh giá nguy cơ, điều trị PVC và các thông tin về tiên lượng.
- Đánh giá nguy cơ
Điều chỉnh bệnh nhân có PVCs phụ thuộc vào:
Việc quản lý bệnh nhân mắc PVC phụ thuộc vào việc đánh giá ban đầu có chỉ ra bệnh nhân có nguy cơ biến chứng cao hay thấp gồm bệnh cơ tim, đợt cấp suy tim và nhịp nhanh thất. Các đặc điểm nguy cơ cao sẽ chỉ định điều trị và theo dõi chuyên sâu hơn.
Cách tiếp cận của chúng ta, được phác thảo dưới đây, nói chung là phù hợp với các khuyến cáo đã được công bố của nhiều hiệp hội nghề nghiệp [1-3].
- Triệu chứng
Hầu hết bệnh nhân PVC không có triệu chứng; chỉ một số ít mô tả các triệu chứng khó chịu (thường là đánh trống ngực). Những triệu chứng liên quan đến PVC này được chúng tôi trình bầy trong các chuyên đề trước đây.
- Bệnh nhân không có hoặc có các triệu chứng PVC nhẹ và không có yếu tố nguy cơ nào khác được mô tả dưới đây thường có thể chỉ cần trấn an, PVC thường tự giới hạn, hiếm khi đe dọa tính mạng và trong hầu hết các trường hợp không cần điều trị.
- Bệnh nhân có các triệu chứng liên quan đến PVC đáng kể và/hoặc dai dẳng nên được điều trị để giảm gánh nặng PVC; phương pháp điều trị sẽ phụ thuộc vào có hay không có các yếu tố nguy cơ khác.
- Các triệu chứng ngất (đặc biệt là không có tiền triệu hoặc đánh trống ngực trước đó), đau ngực hoặc khó thở được thông báo ít gặp ở những bệnh nhân có PVC và là tín hiệu bệnh tiềm ẩn về cấu trúc tim hoặc hệ thống dẫn điện. Những triệu chứng này có thể xác định bệnh nhân có nguy cơ cao hơn và cần được đánh giá cụ thể.
- Tiền sử gia đình
Cần khai thác chi tiết tiền sử gia đình về bệnh tim mạch vành, đột tử hoặc rối loạn nhịp tim và bệnh cơ tim.
Tiền sử gia đình có người bị đột tử hoặc ngừng tim hoặc hội chứng rối loạn nhịp tim di truyền xác định bệnh nhân có nguy cơ mắc bệnh tim cấu trúc hoặc điện học cao hơn, do đó cần phải đánh giá cụ thể hơn.
- Gánh nặng phức bộ thất sớm
Ở tất cả các bệnh nhân, điều quan trọng là phải đánh giá và sau đó tiếp tục theo dõi để giảm gánh nặng PVC trong suốt quá trình điều trị. gánh nặng PVC cao là một yếu tố dự báo bệnh cơ tim do PVC, suy tim và tử vong, do đó cần điều trị tích cực hơn [4].
Việc theo dõi thường có thể được thực hiện bằng cách theo dõi điện tâm đồ liên tục trong 24 đến 48 giờ. Trong điều kiện Việt Nam đặc biệt ở nhiều cơ sở không có máy ghi điện tâm đồ 24h hoặc hơn, cấn áp dụng phương pháp thực hành, chúng tôi có trình bày ở dưới.
Gánh nặng PVC được phân loại như sau:
- Thấp: <1 phần trăm hoặc 1000 PVC/ngày
- Gánh nặng trung bình: >1 đến <15% PVC/ ngày
- Cao: >15% hoặc 15.000 PVC/ngày
- Đặc điểm phức hợp thất sớm (PVC)
Các đặc điểm PVC như nguồn gốc và hình thái có thể được xem xét khi xác định liệu bệnh nhân có nguy cơ cao hay thấp mắc bệnh cơ tim hoặc rối loạn nhịp tim ác tính. Ngay cả khi PVC dường như nguyên phát ở bệnh nhân có tim bình thường trước đó, một số PVC vẫn có thể có khả năng ác tính (tức là gây ra bệnh cơ tim hoặc gây tử vong đột ngột) [5-7]. Hình thái PVC cũng có giá trị vì nó có thể dự đoán đích triệt phá và đáp ứng với việc triệt phá PVC qua catheter.
Các đặc điểm liên quan đến nguy cơ cao hơn gồm thời gian QRS tăng [8,9] (thường có nguồn gốc thượng tâm mạc [10-12]), PVC xen kẽ [13], PVC liên quan đến hệ thống Purkinje (có thể kích hoạt rung thất và có khoảng thời gian ghép ngắn [14-16]), và PVC đa hình [17]. PVC có khoảng thời gian ghép nối rất thay đổi (>60 ms) đã được xác định là có nguồn gốc ở những vùng bất thường (xoang động mạch chủ Valsalva, tĩnh mạch tim lớn) và có liên quan đến nguy cơ biến cố tim cao hơn [18]. Trong cùng bối cảnh, khoảng ghép PVC không đồng nhất lớn hơn có liên quan đến cả việc giảm chức năng LV và tăng nguy cơ phát triển suy tim [19]. Hình thái PVC đường ra thất phải và trái cũng có liên quan đến rối loạn nhịp thất ác tính [5,20,21]
Ở những bệnh nhân không có bệnh tim rõ ràng, PVC thường xuyên, phức tạp và đa hình có liên quan đến tiên lượng xấu hơn [22-24]. Các nghiên cứu trước đây cho thấy những PVC này có liên quan đến sự gia tăng gấp đôi tỷ lệ nhồi máu cơ tim hoặc tử vong ở nam giới [22,24]. Một nghiên cứu mới hơn ở người Đài Loan cho thấy mức độ ảnh hưởng nhỏ hơn; PVC đa dạng có liên quan đến nguy cơ tử vong tăng 20% và nguy cơ nhập viện tăng 10% [17].
- Bệnh tim tiềm ẩn hoặc liên quan
PVC có thể là biểu hiện đầu tiên của bệnh tim, gồm bệnh động mạch vành, bệnh cơ tim và hội chứng rối loạn nhịp tim di truyền (ví dụ hội chứng QT kéo dài, bệnh cơ tim thất phải gây rối loạn nhịp).
Ngoài ra, những bệnh nhân có gánh nặng PVC cao có thể mắc bệnh cơ tim. Ở một số người mắc hội chứng rối loạn nhịp tim di truyền, PVC có thể gây ra chứng nhịp nhanh thất.
Nếu bệnh nhân có phân suất tống máu thất trái (LVEF) <50% (bất kể triệu chứng) và gánh nặng PVC cao, việc giảm LVEF được cho là có liên quan đến PVC thường xuyên (còn gọi là bệnh cơ tim do PVC [25,26]). Trong một loạt 245 bệnh nhân mắc bệnh cơ tim do PVC, các yếu tố dự báo độc lập cho sự phát triển bệnh cơ tim do PVC là nam giới, gánh nặng PVC cao, thiếu triệu chứng và nguồn gốc PVC thượng tâm mạc [27].
- Đánh giá ở hầu hết bệnh nhân
Để đánh giá gánh nặng PVC và sự hiện diện của bệnh tim cấu trúc, tất cả bệnh nhân phải trải qua:
- Điện tâm đồ 12 chuyển đạo (ECG).
- Theo dõi Holter 24 giờ.
- Nên thực hiện siêu âm tim nếu có các triệu chứng nguy cơ cao, PVC thường xuyên hoặc nếu có bất kỳ nghi ngờ nào về bệnh tim cấu trúc tiềm ẩn hoặc mới (gồm bệnh cơ tim PVC) và/hoặc thông tin nguy cơ cao từ các đánh giá nguy cơ khác như bất thường điện tâm đồ 12 chuyển đạo hoặc tiền sử gia đình mắc bệnh tim và đặc biệt là đột tử do tim.
Khi chỉ định theo dõi ECG lưu động, thời gian theo dõi từ 24 đến 48 giờ thường đủ để xác định PVC và định lượng gánh nặng PVC tổng thể. Hiện có nhiều kỹ thuật theo dõi ECG lưu động, nhưng đối với hầu hết bệnh nhân, theo dõi Holter hoặc theo dõi bằng miếng dán có vi mạch ghi điện tâm đồ liên tục, thậm chí đến 7 ngày sẽ là phương pháp được ưu tiên hơn.
- Các test tiếp theo ở các bệnh nhân được lựa chọn
Các triệu chứng cụ thể và/hoặc các đặc điểm có nguy cơ cao là lý do để tiến hành xét nghiệm tim thêm.
Nếu nghi ngờ bệnh mạch vành tắc nghẽn (dựa trên các triệu chứng hoặc yếu tố nguy cơ), hoặc PVC liên quan đến gắng sức, bệnh nhân cũng nên được thực hiện:
8.1. Test gắng sức – Trong số những bệnh nhân có các triệu chứng liên quan đến gắng sức và nghi ngờ mắc bệnh mạch vành tắc nghẽn, test gắng sức có thể đánh giá tình trạng thiếu máu cục bộ [28] và cung cấp thông tin tiên lượng hữu ích.
PVC xảy ra trong khi gắng sức có thể là thứ phát do nền thiếu máu cục bộ hoặc có thể biểu hiện rối loạn nhịp tim nhạy cảm với adrenergic hoặc catecholamine (ví dụ, bệnh kênh di truyền) [29]. Đối với những bệnh nhân có PVC được tạo ra do gắng sức, test gắng sức kết hợp với theo dõi lưu động có thể được sử dụng để đánh giá hiệu quả của việc điều trị bằng thuốc chống loạn nhịp.
Đối với những bệnh nhân có PVC liên quan đến gắng sức, nên thực hiện thêm xét nghiệm tim tiếp theo để phát hiện bệnh tim mạch tiềm ẩn, có thể gồm các xét nghiệm tim bổ sung, chẳng hạn như kiểm tra gắng sức bằng hình ảnh, chụp cộng hưởng từ tim (CMR) và nghiên cứu điện sinh lý (Eps) [30-32].
Tuy nhiên, thông thường hơn, PVC bị ức chế trong quá trình tập luyện và xuất hiện trở lại trong giai đoạn phục hồi sau đó.
8.2. Chụp cộng hưởng từ tim – Những bệnh nhân được lựa chọn (tức là những người có đặc điểm PVC có nguy cơ cao, tiền sử gia đình đột tử hoặc bệnh cơ tim và / hoặc bệnh cơ tim không rõ nguyên nhân) có thể yêu cầu CMR [33]. CMR có thể đặc biệt hữu ích trong chẩn đoán bệnh cơ tim phì đại, bệnh sacoid tim, bệnh cơ tim thất phải gây rối loạn nhịp tim và bệnh cơ tim amyloid. CMR thường thu được nếu nghi ngờ những tình trạng này dựa trên các đặc điểm ECG cơ bản và/hoặc siêu âm tim, tiền sử gia đình và tiền sử gắng sức. Người ta không thường xuyên sử dụng hình ảnh CMR cho tất cả các bệnh nhân có PVC thường xuyên do xét nghiệm này hạn chế, chi phí cao, thiếu chuyên môn về hình ảnh MRI tim và thiếu các thử nghiệm ngẫu nhiên tiền cứu chứng minh chiến lược dựa trên CMR cải thiện kết quả, gồm tử vong. CMR được sử dụng có chọn lọc và có thể phụ thuộc vào trung tâm, dựa trên sự sẵn có và chuyên môn của địa phương. Sàng lọc bằng CMR có thể hữu ích trước khi thực hiện đánh giá điện sinh lý xâm lấn và ra quyết định điều trị. Ví dụ, CMR có thể đóng vai trò đánh giá nhu cầu cấy máy khử rung tim (ICD) ở bệnh nhân mắc bệnh cơ tim PVC.
Các nghiên cứu quan sát ở những bệnh nhân PVC thường xuyên đã chỉ ra những bất thường về cơ tim trên CMR thường được thấy (tức là ở 15 đến 35% những bệnh nhân như vậy) và có liên quan đến các kết quả bất lợi về tim [34-36]. Trong số một đoàn hệ quốc tế gồm 518 bệnh nhân (tuổi trung bình 44) có PVC thường xuyên (>1000/24 giờ) và các xét nghiệm chẩn đoán âm tính khác, các bất thường về cơ tim được tìm thấy ở 85 bệnh nhân (16%) [34]. Trong một nghiên cứu quan sát ở một trung tâm, 255 bệnh nhân có PVC thường xuyên (>5% mỗi 24 giờ) có CMR tăng cường độ tương phản khi xử lý PVC được theo dõi về kết cục tổng hợp (tử vong, rung thất, nhịp nhanh thất dai dẳng, hoặc giảm phân suất tống máu thất trái ≥10 phần trăm) [35]. Ba mươi lăm phần trăm bệnh nhân có bất thường về cơ tim trên CMR và kết quả tổng hợp xảy ra ở 5,9%. Sau thời gian theo dõi trung bình 36 tháng, tỷ lệ mắc kết quả tổng hợp cao hơn ở những bệnh nhân có bất thường về cơ tim so với CMR bình thường (20 so với 3,6%; tỷ lệ nguy cơ 4,35, KTC 95% 1,34-14,15).
8.3. Nghiên cứu điện sinh lý – Nghiên cứu điện sinh lý chỉ được sử dụng ở những bệnh nhân được lựa chọn có các đặc điểm PVC có nguy cơ cao hơn như một công cụ phân tầng nguy cơ để hướng dẫn điều trị hoặc ở những bệnh nhân trải qua thủ thuật triệt phá qua catheter (tức là điều trị cho các PVC có triệu chứng thường xuyên kháng trị với điều trị nội khoa hoặc ở những bệnh nhân có PVC đã gây ra bệnh cơ tim).
- Điều chỉnh các yếu tố khởi kích và nguy cơ
Trước khi bắt đầu trị liệu, cần xác định các nguyên nhân hoặc tác nhân có thể khắc phục được và nếu có thể thì điều chỉnh (xem bảng A).
Bệnh nhân tăng huyết áp thường có PVC và nếu bị phì đại thất trái, kết quả thường nặng hơn. Những bệnh nhân này nên được kiểm soát huyết áp, tốt nhất là bằng thuốc chẹn beta và/hoặc thuốc ức chế men chuyển angiotensin hoặc thuốc chẹn thụ thể angiotensin II, đồng thời được điều trị đồng thời rối loạn chức năng thất trái/suy tim nếu có. Cần nỗ lực để tránh hạ kali máu, có thể xảy ra do nhóm thuốc hạ huyết áp thuộc nhóm lợi tiểu [37].
Bảng A. Các yếu tố khởi kích ngoại tâm thu thất
| Khởi kích | Nhóm bệnh nhân | Test |
| Alcohol | Bệnh nhân khai báo sử dụng rượu, khám thực thể có dấu hiệu sử dụng rượu | Sàng lọc rượu, độc chất nước tiểu |
| Caffeine (như, coffee hoặc uống trà) | Patients reporting caffeine use | |
| Thuốc giải trí/kích thích | Bệnh nhân nghi ngờ sử dụng chất kích thích | Sàng lọc ma túy (ví dụ như cocaine, amphetamine) |
| Bất thường về điện giải (ví dụ kali hoặc magiê) | Bệnh nhân nghi ngờ có rối loạn chuyển hóa (ví dụ như nôn mửa, tiêu chảy, sử dụng thuốc lợi tiểu, v.v.) | Điện giải huyết thanh |
| Tình trạng thiếu oxy | Bệnh nhân mắc COPD hoặc bệnh phổi mãn tính khác | Đo độ bão hòa oxy trong mạch, khí máu động mạch |
| Tăng huyết áp không kiểm soát | Bệnh nhân có tiền sử tăng huyết áp hoặc có yếu tố nguy cơ tăng huyết áp | Đo huyết áp |
| Cường/suy giáp | Bệnh nhân có triệu chứng/dấu hiệu cường hoặc suy giáp | TSH |
| Nồng độ digoxin cao | Bệnh nhân đang dùng thuốc | Nồng độ digoxin |
| Suy tim trầm trọng hơn | Bệnh nhân có triệu chứng suy tim hoặc khám thực thể có dấu hiệu quá tải thể tích | Brain-type natriuretic peptide |
| Thiếu máu | Bệnh nhân có triệu chứng/dấu hiệu thiếu máu | Công thức máu toàn phần |
| Căng thẳng/lo lắng tâm lý | Bệnh nhân cho biết có sự gia tăng các yếu tố gây căng thẳng trong cuộc sống, lo lắng | |
| Giai đoạn chuyển tiếp mãn kinh | Phụ nữ trong thời kỳ tiền mãn kinh |
COPD: bệnh phổi tắc nghẽn mạn tính; TSH: thyroid-stimulating hormone.
- Điều chỉnh các bệnh nhân nguy cơ cao
Bệnh nhân có nguy cơ cao có bất kỳ tình trạng nào sau đây: gánh nặng PVC cao (> 10 đến 15%), bệnh cơ tim do PVC, bệnh cấu trúc tim hoặc hệ thống dẫn điện từ trước, tiền sử ngất và các bất thường trên hình ảnh cộng hưởng từ tim (CMR) ngay cả khi LVEF bình thường [34,38,39].
Cần phải điều trị ở những bệnh nhân này để đảo ngược hoặc giảm nguy cơ phát triển bệnh cơ tim và giảm nguy cơ rối loạn nhịp thất và đột tử do tim.
- Bệnh cơ tim do ngoại tâm thu thất
Nếu bệnh nhân có LVEF <50% (bất kể triệu chứng) và gánh nặng PVC cao, việc giảm LVEF được cho là có liên quan đến PVC thường xuyên và chẩn đoán là bệnh cơ tim do PVC [25,26].
Ở những bệnh nhân như vậy, việc điều trị nhằm mục đích giảm gánh nặng PVC, từ đó có thể ngăn ngừa hoặc đảo ngược bệnh cơ tim. Ngay cả những bệnh nhân đã được cấy máy khử rung tim (ICD) cũng được hưởng lợi từ việc giảm và triệt phá PVC.
Một số bệnh nhân mắc bệnh cơ tim do PVC sẽ biểu hiện các dấu hiệu và triệu chứng của suy tim và có thể cần điều trị bằng thuốc điều trị suy tim. Tuy nhiên, cách điều trị dứt điểm là ngăn chặn hoặc loại bỏ PVC.
Nói chung nên tránh dùng thuốc chẹn kênh canxi ở bệnh nhân mắc bệnh cơ tim.
- Beta blockers
Điều trị hàng đầu để giảm gánh nặng PVC là thuốc chẹn beta. Một ngoại lệ có thể là những người bị suy tim có thể tiến hành triệt phá trực tiếp qua catheter.
Thuốc chẹn beta thường được sử dụng để điều trị PVC gồm metoprolol và carvedilol. Liều khởi đầu điển hình, các lựa chọn thay thế và liều tối đa để điều trị PVC được trình bày trong bảng. Sau khi dùng thuốc, bệnh nhân cần được theo dõi để biết mức độ giảm các triệu chứng tương ứng với việc giảm PVC, điều chỉnh liều thuốc khi cần thiết. Lặp lại việc theo dõi ECG lưu động thường được thực hiện sau ba tháng điều trị để xác định xem bệnh nhân có đáp ứng với thuốc chẹn beta hay không. Nếu các triệu chứng và gánh nặng PVC đã giảm và không cao thì nên tiếp tục dùng thuốc chẹn beta.
Nếu sau một tháng điều trị bằng thuốc chẹn beta tối đa mà không giảm triệu chứng hoặc giảm gánh nặng PVC, thì việc triệt phá qua catheter thường được xem xét (đặc biệt nếu PVC là đơn hình, khiến chúng dễ dàng triệt phá hơn). Ngoài ra, một số bệnh nhân được điều trị bằng thuốc chống loạn nhịp.
12.1. Hiệu quả của thuốc chẹn beta – Thuốc chẹn beta có hiệu quả trong việc giảm các triệu chứng PVC. Điều này do thuốc chẹn beta làm giảm điện thế sau ngoại tâm thu thông qua cơ chế Starling (tăng sức co bóp cơ tim liên quan đến tăng thể tích nhát bóp) liên quan đến PVC. Thuốc chẹn beta cũng có thể ngăn ngừa tái phát PVC. Tuy nhiên, cần phải thừa nhận chúng không có tác dụng trực tiếp lên cơ tâm thất. Do đó, thuốc chẹn beta có nhiều khả năng ngăn chặn PVC do kích thích giao cảm quá mức hoặc nhạy cảm với catecholamine.
Trong một nghiên cứu quan sát, thuốc chẹn beta đã được báo cáo là làm giảm gánh nặng PVC ở 1/3 số bệnh nhân dùng chúng [40]. Những phát hiện tương tự (giảm PVC từ 21 đến 36%) đã được các nghiên cứu khác báo cáo [41,42].
12.2. Cai thuốc – Đôi khi, bệnh nhân sẽ muốn dừng thuốc chẹn beta sau khi đã giảm triệu chứng. Trong trường hợp này, người ta có thể thử cai thuốc chẹn beta sau 6 đến 12 tháng điều trị bằng thuốc. Liều có thể giảm dần và ghi Holter 24 giờ có thể được lặp lại định kỳ. Tốt nhất nên cho bệnh nhân sử dụng ít nhất thuốc chẹn beta liều thấp nếu họ sẵn lòng, vì điều này có thể ngăn ngừa tái phát PVC.
- Triệt phá qua catheter — Triệt phá qua catheter là một lựa chọn hiệu quả để giảm hoặc loại bỏ PVC ở những bệnh nhân không đáp ứng với liệu pháp chẹn beta [41,43-49] và có thể là phương pháp điều trị đầu tay ở những người bị suy tim. Trong một nghiên cứu đa trung tâm trên 1185 bệnh nhân được triệt phá bằng PVC, 85% không cần sử dụng thuốc chống loạn nhịp trong hai năm sau khi triệt phá [27].
Ở những bệnh nhân mắc bệnh cơ tim do PVC, triệt phá PVC có thể giúp phục hồi chức năng thất trái. Trong một nghiên cứu đa trung tâm trên 245 bệnh nhân mắc bệnh cơ tim do PVC đã được triệt phá, LVEF tăng từ 38 lên 50% sau khi triệt phá [27].
Quyết định khuyến cáo triệt phá qua catheter bằng năng lượng tần số radio so với điều trị chống loạn nhịp ở một bệnh nhân cụ thể sẽ phụ thuộc vào các yếu tố lâm sàng (tức là các yếu tố dự đoán thành công của thủ thuật) và tùy theo sở thích của bệnh nhân. Một số bệnh nhân sẽ không muốn trải qua thủ thuật triệt phá qua catheter xâm lấn. Không phải tất cả các trung tâm đều có chuyên môn triệt phá qua catheter. Cần thực hiện những nỗ lực hợp lý để giới thiệu bệnh nhân thích hợp đến các trung tâm có chuyên môn triệt phá qua catheter.
13.1. Các yếu tố dự báo thành công của thủ thuật – Các biến số lâm sàng xác định bệnh nhân có nhiều khả năng đáp ứng nhất với triệt phá qua catheter và / hoặc ít có khả năng gặp biến chứng gồm [37]:
- PVC đơn ổ.
- Gánh nặng PVC cao.
- Nguồn gốc đường ra thất phải (RVOT). PVC có nguồn gốc thất phải (block nhánh trái trục dưới) sẽ có hình thái trục dưới bó nhánh trái trên ECG 12 chuyển đạo. Đối với những bệnh nhân như vậy, chúng ta có ngưỡng thấp hơn để thực hiện triệt phá qua catheter, vì việc triệt phá PVC ở tâm thất phải chỉ cần tiếp cận tĩnh mạch. Ngược lại, PVC phát sinh trong đường ra thất trái (LV) hoặc LV yêu cầu tiếp cận động mạch chủ ngược hoặc xuyên vách và có nguy cơ thủ thuật liên quan cao hơn. Trong một phân tích tổng hợp năm 2014 của các nghiên cứu nhỏ không ngẫu nhiên trên bệnh nhân PVC nguyên phát có nguồn gốc từ RVOT, triệt phá qua catheter có liên quan đến việc giảm gánh nặng PVC (giảm trung bình 97%) cùng với cải thiện LVEF (tăng trung bình 10%) [50]. Tính không đồng nhất giữa các nghiên cứu đã hạn chế tính chắc chắn của những ước tính hiệu quả này.
Phần lớn bệnh nhân rối loạn chức năng LV do PVC gây ra sẽ hồi phục chức năng LV trong vòng bốn tháng. Ở một số bệnh nhân, việc phục hồi chức năng LV có thể mất nhiều thời gian hơn; nguồn gốc PVC thượng tâm mạc và / hoặc độ rộng PVC – QRS dài hơn đáng kể thường xuất hiện ở những bệnh nhân phục hồi chức năng LV chậm hơn so với những bệnh nhân phục hồi chức năng LV sớm. Trong một nghiên cứu trên 75 bệnh nhân có PVC nguyên phát thường xuyên và bệnh cơ tim do PVC đã được triệt phá thành công bằng PVC, phần lớn (68%) đã hồi phục chức năng LV trong vòng bốn tháng [48]. Những bệnh nhân phục hồi chức năng LV chậm có nhiều khả năng có nguồn gốc PVC ngoại tâm mạc (54 so với 4%) và độ rộng PVC-QRS dài hơn (170±21 so với 159±16 ms) so với những bệnh nhân hồi phục sớm hơn. Tương tự, trong một nghiên cứu trên 114 bệnh nhân, PVC-QRS trung bình là 173 ms đối với những người có rối loạn chức năng LV không hồi phục so với 158 ms đối với những người có rối loạn chức năng LV có thể đảo ngược (tỷ lệ chênh lệch 5) [51].
Các yếu tố dự báo triệt phá thất bại gồm nhiều hình thái PVC, nguồn gốc cơ thượng tâm mạc hoặc nhú và thời gian kích hoạt khu vực sớm nhất giảm/ngắn [27,52].
13.2. Biến chứng triệt phá PVC – Bất kể cần tiếp cận tĩnh mạch hay động mạch, các biến chứng mạch máu đều là nguy cơ tiềm ẩn của thủ thuật. Việc triệt phá PVC có nguồn gốc từ LV đòi hỏi phải tiếp cận động mạch và do đó, có thể xảy ra các biến chứng tuần hoàn của đột quỵ, nhồi máu cơ tim và tổn thương van hai lá hoặc van động mạch chủ. Thủng cơ tim và chèn ép tim hoặc tổn thương động mạch vành là những biến chứng có khả năng gây tử vong [53,54].
Trong một nghiên cứu trên 1185 bệnh nhân được triệt phá PVC qua catheter, tỷ lệ biến chứng chính là 2,4%, với các biến chứng phổ biến nhất liên quan đến đường vào mạch máu [27]. Chín bệnh nhân (0,8%) bị chèn ép màng ngoài tim cần chọc dịch màng ngoài tim và một bệnh nhân bị block nhĩ thất vĩnh viễn. Không có bệnh nhân tử vong hoặc bị đột quỵ. Trong một nghiên cứu khác, trong số 1231 bệnh nhân được triệt phá PVC, tỷ lệ biến chứng chung là 2,7%, trong đó chèn ép tim là biến chứng phổ biến nhất (27% trong tổng số các biến chứng hoặc tỷ lệ chung là 0,7%) [54]. Hai trường hợp tử vong liên quan đến triệt phá đã xảy ra; một bệnh nhân chết vì chấn thương động mạch vành trong quá trình thủ thuật, và một bệnh nhân chết vì viêm nội tâm mạc nhiễm trùng. Vị trí (LV và thượng tâm mạc) là yếu tố dự đoán chính về biến chứng, đường ra thất phải (RVOT) dự đoán ít biến chứng hơn. Những nguy cơ tiềm ẩn của việc triệt phá qua catheter được trỉnh bày riêng.
13.3. Khung thời gian dự kiến để phục hồi LVEF – Nên thực hiện theo dõi tim lặp lại sau thủ thuật trong khoảng ba tháng để đánh giá gánh nặng PVC. Ngoài ra, siêu âm tim lặp lại nên được thực hiện ba tháng sau khi triệt phá PVC để đánh giá sự phục hồi chức năng LV.
Hầu hết bệnh nhân đều hồi phục LVEF hoàn toàn sau ba đến sáu tháng sau triệt phá [55]. Ở khoảng một phần ba số bệnh nhân, quá trình hồi phục bị trì hoãn và có thể mất tới ba đến bốn năm [48]. Các yếu tố dự báo phục hồi chậm bao gồm PVC có nguồn gốc từ thượng tâm mạc [27] và thời gian QRS nội tại tăng [56].
- Liệu pháp chống loạn nhịp tim – Nếu bệnh nhân không phải là ứng cử viên tối ưu cho hoặc không muốn thực hiện thủ thuật triệt phá xâm lấn, có thể thử dùng thuốc chống loạn nhịp tim.
Ở những bệnh nhân mắc bệnh tim cấu trúc, gồm cả những người mắc bệnh cơ tim PVC, thuốc chống loạn nhịp an toàn và hiệu quả còn hạn chế [37,50].
Các thuốc được ưu tiên cho bệnh nhân có bệnh tim tiềm ẩn là amiodarone và ranolazine:
14.1. Amiodarone – Amiodarone là tác nhân ít gây rối loạn nhịp tim nhất ở bệnh nhân mắc bệnh tim cấu trúc, mặc dù có nguy cơ đáng kể về độc tính của cơ quan khi sử dụng lâu dài.
Các thử nghiệm sử dụng amiodarone ở bệnh nhân mắc PVC và có tiền sử nhồi máu cơ tim hoặc suy tim đã chứng minh giảm PVC và tỷ lệ tử vong do loạn nhịp tim (6,9 so với 4,5%; nguy cơ tương đối 0,49; KTC 95% 0,05-0,72) nhưng không phải là tỷ lệ tử vong chung (hình 1) [57]. Tuy nhiên, điều trị amiodarone thường quy ở những bệnh nhân không có triệu chứng không được khuyến khích vì lợi ích hạn chế và tác dụng phụ tiềm ẩn [57-59].
Có thể sử dụng liều nạp bằng đường uống từ 400 đến 1200 mg/ngày chia làm nhiều lần (tổng liều nạp từ 6 đến 10 gam). Liều duy trì thông thường phải là liều thấp nhất có hiệu quả; con số này thường là 200 mg mỗi ngày nhưng có thể thấp tới 100 mg mỗi ngày.
14.2. Ranolazine – Ranolazine, một loại thuốc chống đau thắt ngực dạng uống có đặc tính ngăn chặn INa- và IKr, được chấp thuận cho bệnh nhân bị đau thắt ngực ổn định mãn tính. Các nghiên cứu quan sát [60] và các báo cáo/loạt trường hợp [61-63] cho thấy ranolazine có thể là phương pháp điều trị an toàn và hiệu quả đối với PVC; tuy nhiên, không có thử nghiệm ngẫu nhiên nào được thực hiện để xác nhận những kết quả này. Trong một nhóm thuần tập gồm 59 bệnh nhân bị ngoại vị thất (ventricular ectopy) có hoặc không có bệnh tim, ranolazine làm giảm PVC tới 71% (từ 13.329 xuống 3837 mỗi ngày) [60]. Ngoại tâm thu thất nhịp đôi (bigeminy) và ngoại tâm thu thất liên tiếp (couplets) đều giảm 80% và nhịp nhanh thất giảm 90%.
Tính an toàn và hiệu quả của ranolazine đối với nhịp nhanh thất đã được nghiên cứu trong thử nghiệm MERLIN-TIMI 36 (nhịp nhanh thất kéo dài ≥3 nhịp, 52 so với 61%; nguy cơ tương đối 0,86, KTC 95% 0,82-0,90) [64] mà không gây ra chứng loạn nhịp tim đáng kể [65].
Liều khởi đầu là 500 mg uống hai lần mỗi ngày; liều tối đa hàng ngày 1000 mg hai lần mỗi ngày.
Thuốc nhóm IC có thể gây loạn nhịp ở bệnh nhân mắc bệnh động mạch vành và/hoặc rối loạn chức năng cơ tim đáng kể; do đó, chúng không nên được sử dụng ở những bệnh nhân này [66,67]. Ở những bệnh nhân bị nhồi máu cơ tim trước đó, việc sử dụng flecainide và các thuốc chống loạn nhịp nhóm IC khác (bảng 3) cho PVC có liên quan đến việc tăng tỷ lệ tử vong do rối loạn nhịp tim (hình 2 và hình 3) [66,67]. Flecainide và propafenone (thuốc chống loạn nhịp nhóm IC (bảng 3)) đã được sử dụng thành công ở những bệnh nhân nghi ngờ bệnh cơ tim do PVC gây ra đã thất bại trong các nỗ lực triệt phá qua catheter trước đó [68], nhưng chúng thường không nên được sử dụng trong bối cảnh này do lo ngại về an toàn. Việc sử dụng các loại thuốc này ở những bệnh nhân có nguy cơ thấp hơn sẽ được thảo luận dưới đây.
- Máy khử rung tim có thể cấy – Ở những bệnh nhân mắc bệnh cơ tim do PVC và LVEF rất thấp (<35%) đáp ứng các tiêu chí phòng ngừa tiên phát cho ICD, việc loại bỏ PVC nói chung có thể phục hồi chức năng LV và loại bỏ nhu cầu cấy ICD [69 ].
Tuy nhiên, khi nguyên nhân của bệnh cơ tim không do thiếu máu cục bộ không rõ ràng, có thể xảy ra trước khi PVC được loại bỏ và LVEF trở về bình thường, vẫn còn mối lo ngại về nguy cơ đột tử do tim. Do đó, CMR trước thủ thuật sau đó là nghiên cứu điện sinh lý với kích thích tâm thất được lập trình, đặc biệt ở những bệnh nhân dương tính với CMR, có thể được xem xét [30]. Trong trường hợp không có xơ hóa/sẹo cơ tim được xác định bằng CMR và/hoặc nhịp nhanh thất được tạo ra trong quá trình nghiên cứu điện sinh lý, người ta có thể đợi cải thiện LVEF sau khi loại bỏ PVC, giữ lại ICD và đánh giá lại bệnh nhân trong vòng sáu tháng kể từ khi triệt phá.
- Bệnh tim từ trước – Bệnh nhân mắc bệnh động mạch vành, bệnh cơ tim hoặc bệnh hệ thống dẫn điện có PVC được coi là có nguy cơ cao. Các đặc tính của PVC có nguy cơ cao, gồm hình thái và nguồn gốc, đã được thảo luận ở trên.
Đối với những bệnh nhân có bệnh tim cấu trúc tiềm ẩn, điều quan trọng là giảm gánh nặng PVC nếu nó cao (tức là >15% hoặc 15.000 PVC/ngày) để giảm nguy cơ phát triển bệnh cơ tim do PVC.
Liệu pháp đầu tiên cho những bệnh nhân này là giảm gánh nặng PVC bằng thuốc chẹn beta. Nếu sau hai đến bốn tuần điều trị bằng thuốc chẹn beta, không giảm gánh nặng PVC và/hoặc giảm LVEF kéo dài, triệt phá qua catheter thường được xem xét tiếp theo [27,37,41,43-50].
Nói chung, việc điều trị tình trạng cơ bản thường cải thiện và có thể giảm gánh nặng PVC. Đối với bệnh cơ tim di truyền hoặc hội chứng rối loạn nhịp tim, việc giới thiệu đến chuyên gia tư vấn di truyền cũng phù hợp.
16.1. Suy tim – Bệnh nhân mắc bệnh cơ tim giãn hoặc suy tim được báo cáo có tỷ lệ mắc PVC từ 70 đến 95% [70]. Việc đánh giá và quản lý PVC ở những bệnh nhân này sẽ được thảo luận riêng.
16.2. Bệnh động mạch vành – Việc quản lý PVC khác nhau ở những bệnh nhân mắc hội chứng mạch vành cấp tính và mãn tính.
16.3. Hội chứng mạch vành cấp tính – Đối với những người có PVC trong bối cảnh hội chứng mạch vành cấp tính, phương pháp chống loạn nhịp tốt nhất là sử dụng các liệu pháp chống thiếu máu cục bộ (tái tưới máu/tái tạo mạch máu) kết hợp với thuốc chẹn beta. Như đã đề cập, điều trị bằng ranolazine có thể làm giảm đáng kể tỷ lệ rối loạn nhịp thất ở những bệnh nhân mắc hội chứng mạch vành cấp tính không ST chênh lên, như thể hiện trong thử nghiệm MERLIN-TIMI 36 [64].
16.4. Hội chứng mạch vành mạn tính – Ở những bệnh nhân đã từng bị nhồi máu cơ tim, PVC, đặc biệt nếu thường xuyên (hơn 10 nhịp mỗi giờ) hoặc phức tạp (tức là các dạng lặp đi lặp lại, chủ yếu là nhịp nhanh thất tạm thời), dường như có liên quan đến tiên lượng xấu hơn.
Hầu hết bệnh nhân bị nhồi máu cơ tim trước đó sẽ dùng thuốc chẹn beta như một phần của liệu pháp tiêu chuẩn cho bệnh lý tiềm ẩn của họ, điều này có thể liên quan đến việc giảm PVC [71,72].
Amiodarone là thuốc chống loạn nhịp được ưu tiên ở những bệnh nhân PVC có triệu chứng mặc dù đã điều trị bằng thuốc chẹn beta. Nỗ lực ức chế PVC bằng thuốc chống loạn nhịp nhóm IC ở bệnh nhân mắc bệnh động mạch vành có liên quan đến việc tăng tỷ lệ tử vong (hình 2).
Trong trường hợp rối loạn nhịp thất phức tạp và/hoặc có triệu chứng, nghiên cứu điện sinh lý với kích thích tâm thất được lập trình có thể hướng dẫn điều trị tốt hơn. Ở những bệnh nhân có nhịp nhanh thất dai dẳng có thể tạo ra, ICD sẽ được cần thiết [73].
16.5. Bệnh nhân được điều trị bằng liệu pháp tái đồng bộ tim (CRT) – Bệnh nhân có thiết bị CRT cần có tạo nhịp hai thất hiệu quả lớn hơn 98% tổng số nhịp thất để giảm tỷ lệ tử vong [74]. PVC thường xuyên làm ảnh hưởng đến hiệu quả tạo nhịp hai thất và làm giảm đáp ứng lâm sàng với CRT [75]. Do đó, một cách tiếp cận tích cực hơn để ức chế PVC được khuyến nghị ở những bệnh nhân này.
16.6. Tăng huyết áp – Điều này sẽ được thảo luận riêng.
16.7. Hội chứng QT kéo dài – Điều này được thảo luận riêng.
16.8. Hội chứng Brugada – Điều này được thảo luận riêng.
16.9. Bệnh cơ tim phì đại – Điều này sẽ được thảo luận riêng.
16.10. Bệnh cơ tim thất phải gây rối loạn nhịp tim – Điều này sẽ được thảo luận riêng.
16.11. Sarcoidosis tim – Điều này sẽ được thảo luận riêng.
16.12. Bệnh cơ tim dạng amyloid – Vấn đề này sẽ được thảo luận riêng.
- Điều chỉnh các bệnh nhân có nguy cơ thấp
Bệnh nhân có nguy cơ thấp là những bệnh nhân bệnh cơ tim và/hoặc hội chứng rối loạn nhịp tim di truyền đã được loại trừ một cách hợp lý.
Cách tiếp cận điều trị của chúng ta ở những bệnh nhân có nguy cơ thấp khác nhau tùy theo việc có các triệu chứng đáng kể liên quan đến PVC hay không. Các triệu chứng cụ thể liên quan đến PVC sẽ được thảo luận ở phần khác.
Bệnh nhân không có triệu chứng với gánh nặng tâm thu thất thấp — Đối với những bệnh nhân có gánh nặng PVC thấp (<1 phần trăm hoặc 1000 PVC/ngày), không có bệnh tim cấu trúc rõ ràng tiềm ẩn và không có triệu chứng, không cần điều trị nội khoa cũng như triệt phá qua catheter; theo dõi và trấn an cùng với việc loại bỏ các yếu tố kích hoạt có thể là phù hợp (thuật toán 2 và thuật toán 3) [49].
Trong khi PVC có liên quan đến việc tăng nguy cơ tử vong do tim mạch và các kết quả bất lợi khác, không có bằng chứng rõ ràng nào cho thấy việc ức chế hoặc loại bỏ PVC bằng thuốc chẹn beta, thuốc chẹn kênh canxi không dihydropyridine, thuốc chống loạn nhịp hoặc triệt phá qua catheter giúp cải thiện khả năng sống sót chung ở những bệnh nhân không có triệu chứng, không có bệnh tim và không có rối loạn nhịp thất dai dẳng.
Bệnh nhân có các triệu chứng và/hoặc gánh nặng ngoại tâm thu thất cao — Hầu hết các bệnh nhân có nguy cơ thấp với các triệu chứng đáng kể do PVC của họ sẽ cần điều trị nội khoa hoặc triệt phá nhằm nỗ lực giảm hoặc loại bỏ các triệu chứng (thuật toán 2 và thuật toán 3). Bệnh nhân có gánh nặng PVC cao (>15% hoặc 15.000 PVC/ngày) cũng được hưởng lợi từ việc điều trị ngay cả khi không có các triệu chứng khó chịu để giảm nguy cơ mắc bệnh cơ tim do PVC.
Bệnh cơ tim do PVC gây ra thường mất vài tháng hoặc vài năm để phát triển. Trong một nghiên cứu trên 240 bệnh nhân được chỉ định triệt phá PVC, thời gian triệu chứng từ 30 đến 60 tháng, cũng như thời gian triệu chứng > 60 tháng, suy giảm chức năng LV được dự đoán độc lập (tỷ lệ chênh 4,0, KTC 95% 1,1-14,4 và 20,1, KTC 95% 6.3-64.1 tương ứng) [76].
Ở những bệnh nhân có nguy cơ thấp có các triệu chứng dễ nhận thấy hơn trong môi trường yên tĩnh, chẳng hạn như vào ban đêm khi nằm trên giường, việc khuyên họ di chuyển xung quanh và tăng nhịp tim có thể làm giảm các triệu chứng và mang lại sự yên tâm cho bệnh nhân.
Quyết định đề nghị dùng thuốc chống loạn nhịp hoặc triệt phá qua catheter bằng tần số radio ở một bệnh nhân cụ thể sẽ phụ thuộc vào nhiều yếu tố lâm sàng và cũng tùy vào sở thích của bệnh nhân. Một số bệnh nhân sẽ không muốn trải qua thủ thuật triệt phá qua catheter xâm lấn. Những nguy cơ tiềm ẩn của việc triệt phá qua catheter sẽ được thảo luận ở phần khác.
- Trị liệu khởi đầu – Trước khi bắt đầu trị liệu, cần xác định và điều chỉnh có thể các nguyên nhân hoặc các khởi kích có thể khắc phục được (bảng A).
18.1. Thuốc chẹn beta – Đối với những bệnh nhân có nguy cơ thấp có triệu chứng và/hoặc gánh nặng PVC cao, chúng ta đề xuất liệu pháp đầu tay bằng thuốc chẹn beta.
18.2. Thuốc chẹn kênh canxi không dihydropyridine – Ở những bệnh nhân không có LVEF giảm, thuốc chẹn kênh canxi không dihydropyridine có thể được thay thế nếu thuốc chẹn beta không được dung nạp hoặc không thành công trong việc giảm triệu chứng. Một bảng liệt kê các thuốc cụ thể với liều lượng (bảng 2).
Thuốc chẹn kênh canxi không dihydropyridine có thể đặc biệt hiệu quả ở những bệnh nhân không có bệnh tim cấu trúc rõ ràng khi PVC thường do hoạt động của các cơ chế phụ thuộc canxi được kích hoạt. Một ví dụ về điều này là PVC có nguồn gốc bó (QRS tương đối hẹp, giống khối nhánh phải, lệch trục trái) (dạng sóng 6). Thuốc chẹn kênh canxi cũng có thể được ưu tiên hơn thuốc chẹn beta nếu cần điều trị tăng huyết áp.
Bệnh nhân nên được đánh giá về gánh nặng PVC bằng khám định kỳ và theo dõi ECG liên tục, thường trong 24 đến 48 giờ.
Nếu các triệu chứng và gánh nặng PVC đã giảm và không cao thì nên tiếp tục điều trị. Nếu bệnh nhân muốn ngừng hoặc giảm thuốc, việc thử cai thuốc và/hoặc ngừng thuốc có thể được thực hiện sau 6 đến 12 tháng.
Một nghiên cứu thuần tập tiền cứu trên 100 bệnh nhân trưởng thành không được điều trị (tuổi trung bình 51,8 tuổi, 57% là nữ) có gánh nặng PVC trung bình là 18,4% cho thấy rằng việc giảm xuống <1% PVC xảy ra ở 44% trong thời gian theo dõi trung bình là 15,4 tháng. Tái phát là không phổ biến (9,1 phần trăm) [77]. Do đó, các tác giả gợi ý chiến lược giám sát tích cực có thể phù hợp với phần lớn bệnh nhân có PVC nguyên phát thường xuyên kết hợp với LVEF bảo tồn. Người ta có thể ngoại suy từ những nghiên cứu này ở một số bệnh nhân đáp ứng với điều trị nội khoa, người ta có thể thử điều trị bằng thuốc chống loạn nhịp, có thể sau một đến hai năm, và quan sát chặt chẽ tình trạng tái phát rối loạn nhịp tim.
- Liệu pháp tiếp theo – Đối với những bệnh nhân có các triệu chứng liên quan đến PVC và/hoặc gánh nặng cao sau khi điều trị nội khoa ban đầu bằng thuốc chẹn beta và/hoặc thuốc chẹn kênh canxi không dihydropyridine, hoặc cho những người không dung nạp liệu pháp nội khoa do tác dụng phụ, thuốc chống loạn nhịp tim hoặc triệt phá qua catheter là những bước tiếp theo hợp lý.
Ở những bệnh nhân không có bệnh tim cấu trúc hoặc bệnh động mạch vành, việc bắt đầu điều trị chống loạn nhịp nhóm 1C là hợp lý hơn theo đuổi triệt phá qua catheter nếu có một hoặc nhiều dấu hiệu sau:
19.1. Nhiều hình thái PVC.
19.2. Tần suất PVC thấp (<3 phần trăm hoặc 500 PVC/ngày).
19.3. Bệnh nhân được coi là đối tượng có nguy cơ cao để cắt bỏ qua ống thông, chẳng hạn như những bệnh nhân có vị trí ổ PVC khó khăn có thể hạn chế thủ thuật thành công (ví dụ: thượng tâm mạc, đỉnh LV, vị trí trong thành, cơ nhú và vị trí cận Hisian) [ 78].
19.4. Bệnh nhân có xu hướng tránh triệt phá qua catheter.
Việc sử dụng thuốc chống loạn nhịp tim (ví dụ, flecainide và các thuốc chống loạn nhịp nhóm IC khác) (bảng 3) cho PVC là cách sử dụng ngoài hướng dẫn. Trong khi tình trạng thúc đẩy rồi loạn nhịp do các thuốc này là mối lo ngại ở những bệnh nhân mắc bệnh tim cấu trúc, thì có rất ít hoặc không có mối lo ngại ở những bệnh nhân không có bệnh tim tiềm ẩn [79]. Điều quan trọng là không nên sử dụng thuốc chống loạn nhịp nhóm IC để điều trị bệnh nhân mắc bệnh cơ tim do PVC và rối loạn chức năng LV do lo ngại nghiêm trọng về chứng loạn nhịp tim [66,80]. Tuy nhiên, thuốc IC đã được sử dụng ở những bệnh nhân này với kết quả khả quan. Tuy nhiên, những thuốc này chỉ nên được kê đơn ở những bệnh nhân có ICD để điều trị chứng rối loạn nhịp thất đe dọa tính mạng [68].
Các lựa chọn chống loạn nhịp điển hình ở những bệnh nhân không có bệnh tim cấu trúc rõ ràng bao gồm:
19.5. Flecainide, liều khởi đầu 50 đến 100 mg uống hai lần mỗi ngày; liều tối đa hàng ngày là 150 mg hai lần mỗi ngày (mặc dù hiếm khi sử dụng liều cao hơn 100 mg hai lần mỗi ngày).
19.6. Propafenone 150 mg ba lần mỗi ngày; liều tối đa hàng ngày 300 mg ba lần mỗi ngày.
Trong một nghiên cứu quan sát trên 120 bệnh nhân có PVC thường xuyên không có bệnh tim cấu trúc, thuốc chống loạn nhịp có hiệu quả vượt trội trong việc giảm PVC so với thuốc chẹn beta và thuốc chẹn kênh canxi và liệu pháp bảo tồn [40]. Gánh nặng PVC ban đầu trung bình dao động từ 16 đến 21%. Mức giảm tương đối trung bình của PVC trong liệu pháp điều trị bảo tồn, thuốc chẹn beta/thuốc chẹn kênh canxi và nhóm dùng thuốc chống loạn nhịp lần lượt là 33, 31 và 81%. Mức giảm PVC xuống <1% là tương tự giữa các nhóm này ở mức tương ứng là 35, 17, 33%. Bốn bệnh nhân (3%) bị rối loạn chức năng LV: Một bệnh nhân đang điều trị bảo tồn, hai bệnh nhân dùng bisoprolol và một bệnh nhân dùng flecainide. Tỷ lệ phản ứng có hại của thuốc và tỷ lệ ngừng thuốc là tương tự nhau giữa các nhóm và không có tác dụng phụ nghiêm trọng nào được ghi nhận.
Nếu bệnh nhân vẫn còn triệu chứng và/hoặc có gánh nặng PVC cao, việc triệt phá qua catheter nên được thực hiện tiếp theo.
- Tiên lượng
Sự hiện diện của PVC sẽ cảnh báo bác sĩ lâm sàng về bệnh tim tiềm tàng cùng tồn tại, có thể cần đánh giá lâm sàng hoặc điều trị bổ sung. Ở những bệnh nhân không có tiền sử bệnh tim, PVC có liên quan đến việc tăng tỷ lệ tử vong. Tuy nhiên, điều trị dự phòng PVC không có triệu chứng ở bệnh nhân không có bệnh cơ tim chưa được chứng minh là cải thiện tỷ lệ tử vong. Một cảnh báo quan trọng liên quan đến những bệnh nhân có PVC có khả năng gây ra vấn đề.
- Không có bệnh tim rõ ràng
21.1. Tử vong – Dữ liệu được trộn lẫn về việc liệu sự hiện diện của PVC ở bệnh nhân có tim bình thường có liên quan đến tăng tỷ lệ tử vong hay không. Trong một phân tích tổng hợp của 5 nghiên cứu đoàn hệ tiền cứu (3629 người) không có bệnh tim rõ ràng, sự hiện diện của PVC không liên quan đến tử vong do mọi nguyên nhân (tỷ lệ chênh lệch 1,34, KTC 95% 0,85-2,12) [81]. Tuy nhiên, chỉ có một nghiên cứu sử dụng xét nghiệm nâng cao (tức là siêu âm tim hoặc kiểm tra gắng sức) để loại trừ bệnh tim cấu trúc tiềm ẩn. Trong một đoàn hệ Đài Loan gồm 5778 người, tần số PVC >12 nhịp mỗi ngày có liên quan đến tỷ lệ tử vong (tỷ lệ rủi ro 1,4, KTC 95% 1,28-1,59) [82]. Về hình thái PVC, một nghiên cứu quan sát chỉ ra rằng trong số 3351 cá nhân có tim dường như bình thường, những người có PVC đa dạng có tỷ lệ tử vong tăng lên (HR 1,6, KTC 95% 1,32-2,03) trong thời gian theo dõi trung bình là 10 năm [17].
21.2. Giảm LVEF và suy tim – Tần suất PVC cao hơn có liên quan đến giảm LVEF và suy tim. Trong số 1139 bệnh nhân không mắc bệnh tim trong Nghiên cứu Sức khỏe Tim mạch, phần tư trên của PVC khi theo dõi Holter 24 giờ (> 0,12% tổng nhịp tim) có liên quan đến giảm LVEF (tỷ lệ chênh lệch 3,1, KTC 95% 1,4-6,8) hoặc suy tim (tỷ lệ chênh lệch 1,5, KTC 95% 1,1-2,0) trong 10 năm tới [4].
21.3. Đột quỵ – PVC có liên quan đến việc tăng nguy cơ đột quỵ. Trong một đánh giá tiến cứu với 14.783 người tham gia đoàn hệ quan sát ARIC, 6,1% có PVC trên ECG hai phút và 729 (4,9%) bị đột quỵ [83]. Đột quỵ sự cố ở những người có bất kỳ PVC nào là 6,6% so với 4,1% ở những người không có PVC (HR 1,7, KTC 95% 1,3-2,2). Những phát hiện tương tự đã được báo cáo bởi nghiên cứu REGARDS [84]. Liệu mối liên quan này có liên quan đến xu hướng gia tăng hình thành huyết khối hoặc tắc mạch do tái cấu trúc tim hay có thể là rung nhĩ hoặc lý do khác hay không, vẫn chưa được biết.
- Suy tim hoặc bệnh cơ tim
22.1. Suy tim – Trong một nghiên cứu của Đan Mạch trên 850 bệnh nhân bị suy tim tâm thu không do thiếu máu cục bộ (LVEF <35%), 350 bệnh nhân có gánh nặng PVC cao ( ≥ 30 PVC trong máy theo dõi Holter 24 giờ, 352 bệnh nhân) đã tăng tỷ lệ tử vong (HR 1,38; CI 95% 1,00-1,90) và bệnh tim mạch (HR 1,78, CI 1,19-2,66). Tuy nhiên, họ không có lợi ích sống sót từ việc cấy ICD [85].
22.2. Bệnh nhân cần điều trị tái đồng bộ hóa – Theo một nghiên cứu phụ của MADIT-CRT, trong số 698 bệnh nhân được điều trị bằng máy khử rung tim bằng liệu pháp tái đồng bộ tim (CRT) (với bệnh cơ tim do thiếu máu cục bộ và không do thiếu máu cục bộ), những người có >10 PVC mỗi giờ, có nguy cơ mắc bệnh cơ tim cao hơn đáng kể trong ba năm. suy tim/tử vong (25 so với 7%) và nhịp nhanh thất / rung thất (24 so với 8%) so với những người có gánh nặng ngoại tâm thu thấp hơn [86]. Những bệnh nhân có gánh nặng >10 PVC mỗi giờ có nguy cơ mắc cả suy tim / tử vong (HR 2,8) và nhịp nhanh thất / rung thất tăng khoảng ba lần (HR 2,8).
22.3. Bệnh cơ tim khác – Ở những bệnh nhân mắc bệnh cơ tim phì đại, PVC là phổ biến, nhưng không giống như nhịp nhanh thất không kéo dài, PVC không liên quan đến việc tăng nguy cơ tử vong do tim đột ngột.
Ở những bệnh nhân bị loạn sản thất phải gây loạn nhịp, PVC thường xuyên và / hoặc sự hiện diện của nhịp nhanh thất không kéo dài là dấu hiệu của nguy cơ rối loạn nhịp tăng lên [87].
Ở những bệnh nhân mắc bệnh sacoidosis tim, PVC có thể giúp xác định những bệnh nhân mà nghiên cứu điện sinh lý sẽ hữu ích trong việc ra quyết định về việc cấy ghép máy khử rung tim/ngăn ngừa tử vong do tim đột ngột.
- Phức hợp thất sớm được gắng sức tạo ra
Ý nghĩa tiên lượng của PVC được tạo ra khi gắng sức được trình bầy riêng.
- Thai nghẽn
PVC xảy ra trong thời kỳ mang thai tạo thành một tình huống đặc biệt, trong đó nên tránh dùng thuốc chống loạn nhịp nếu có thể, đặc biệt là trong ba tháng đầu, do những nguy cơ gây ra cho phôi thai [88].
Đối với các yếu tố kích hoạt: một số chuyên gia tư vấn cho bệnh nhân bị đánh trống ngực nên ngừng các yếu tố thúc đẩy tiềm ẩn như hút thuốc, uống cà phê, uống rượu và các chất kích thích khác [89]. Tuy nhiên, vai trò của việc hạn chế caffeine vẫn chưa được xác định. Tiếp xúc với caffeine vừa phải chưa được chứng minh là làm tăng PVC ở bệnh nhân có hoặc không có bệnh tim cấu trúc [90,91], và việc hạn chế caffeine không được chứng minh là cải thiện triệu chứng hoặc giảm tần suất PVC trong một thử nghiệm nhỏ [92].
Tuy nhiên, PVC thường xuyên và/hoặc có triệu chứng có thể cần điều trị, chủ yếu bằng cách sử dụng thuốc chẹn beta (ví dụ metoprolol hoặc bisoprolol). Việc triệt phá, nếu cần thiết, nên được hoãn lại cho đến thời kỳ hậu sản. Việc kiểm tra chất điện giải (ví dụ kali, magie) ở bệnh nhân mang thai có PVC thường xuyên và có triệu chứng là hợp lý, vì đây không phải là một phần của các phép đo thường quy trong phòng thí nghiệm trước khi sinh và có thể điều trị được mức độ bất thường.
Sự hiện diện của PVC trong thai kỳ chưa được chứng minh là gây ra tiên lượng xấu hơn. Trong số một nhóm thuần tập gồm 49 phụ nữ mang thai có cấu trúc tim bình thường và gánh nặng PVC “cao” (gánh nặng PVC trung bình khoảng 9%), kết quả chung của bà mẹ là thuận lợi [93]. Mặc dù 11% trường hợp mang thai gặp biến chứng do biến cố tim mạch nhưng tất cả đều được quản lý thành công bằng liệu pháp nội khoa, chủ yếu bằng thuốc chẹn beta. Ngoại trừ một bệnh nhân cần triệt phá nhịp nhanh thất sau sinh, không cần điều trị thêm trong giai đoạn sau sinh, và gánh nặng PVC được nhận thấy đã giảm. Tỷ lệ các kết quả bất lợi về sản khoa và thai nhi/trẻ sơ sinh ở nhóm PVC tương đương với dân số mang thai bình thường.
- Một số hình ảnh ngoại tâm thu thất:
25.1. Các phức hợp thất sớm thượng tâm mạc trên ECG 12 chuyển đạo điện tâm đồ (Hình 1)

Hình 1. Các phức hợp thất sớm thượng tâm mạc trên ECG 12 chuyển đạo điện tâm đồ
25.2. ECG chuyển đạo đơn cho thấy nhắt bóp thất xen kẽ (interpolated ventricular premature beat: VPB)

Hình 2. ECG chuyển đạo đơn cho thấy nhắt bóp thất xen kẽ
Nhát bóp thứ 3 là nhát bóp thất. Người ta gọi là nhát bóp thất xen kẽ – The third beat is a ventricular premature beat (VPB). Nó được gọi là nhát bóp thất xen kẽ vì nó không làm thay đổi khoảng RR của nhịp xoang cơ bản (Hình 2).
25.3. Nhịp xoang

Hình 3. Nhịp xoang
Sóng P bình thường trong nhịp xoang hơi chẽ nhẹ do hoạt động của tâm nhĩ phải trước hoạt động của tâm nhĩ trái. Sóng P theo chiều dương ở chuyển đạo I và II. Sóng P có hình thái đồng nhất xuất hiện trước mỗi phức bộ QRS. Tần số nằm trong khoảng từ 60 đến 100 nhịp mỗi phút và độ dài chu kỳ là đồng đều giữa các sóng P tuần tự và phức bộ QRS. Ngoài ra, hình thái sóng P và khoảng PR giống hệt nhau theo từng nhịp.
25.4. Các phức hợp thất sớm đa hình (Hình 3)
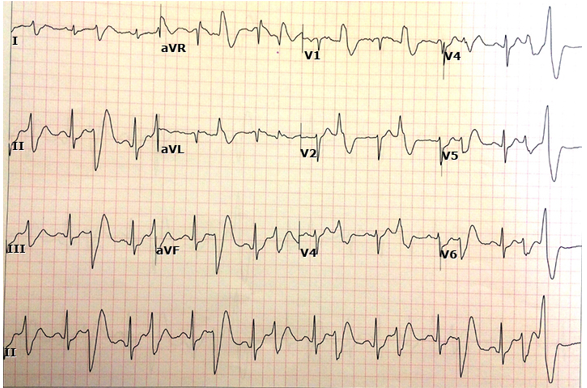
Hình 3. Các phức hợp thất sớm đa hình
(Còn nữa…)
Tài liệu tham khảo
- Priori SG, Blomström-Lundqvist C, Mazzanti A, et al. 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: The Task Force for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death of the European Society of Cardiology (ESC). Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC). Eur Heart J 2015; 36:2793.
- Lip GY, Heinzel FR, Gaita F, et al. European Heart Rhythm Association/Heart Failure Association joint consensus document on arrhythmias in heart failure, endorsed by the Heart Rhythm Society and the Asia Pacific Heart Rhythm Society. Europace 2016; 18:12.
- Al-Khatib SM, Stevenson WG, Ackerman MJ, et al. 2017 AHA/ACC/HRS guideline for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: Executive summary: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society. Heart Rhythm 2018; 15:e190.
- Dukes JW, Dewland TA, Vittinghoff E, et al. Ventricular Ectopy as a Predictor of Heart Failure and Death. J Am Coll Cardiol 2015; 66:101.
- Ip JE, Lerman BB. Idiopathic malignant premature ventricular contractions. Trends Cardiovasc Med 2018; 28:295.
- Dabbagh GS, Bogun F. Predictors and Therapy of Cardiomyopathy Caused by Frequent Ventricular Ectopy. Curr Cardiol Rep 2017; 19:80.
- Supple GE. Editorial commentary: Malignant PVCs: Revising the ‘idiopathic’ label. Trends Cardiovasc Med 2018; 28:303.
- Carballeira Pol L, Deyell MW, Frankel DS, et al. Ventricular premature depolarization QRS duration as a new marker of risk for the development of ventricular premature depolarization-induced cardiomyopathy. Heart Rhythm 2014; 11:299.
- Park KM, Im SI, Lee SH, et al. Left Ventricular Dysfunction in Outpatients with Frequent Ventricular Premature Complexes. Tex Heart Inst J 2022; 49.
- Yokokawa M, Kim HM, Good E, et al. Impact of QRS duration of frequent premature ventricular complexes on the development of cardiomyopathy. Heart Rhythm 2012; 9:1460.
- Yamada T. Twelve-lead electrocardiographic localization of idiopathic premature ventricular contraction origins. J Cardiovasc Electrophysiol 2019; 30:2603.
- Park KM, Kim YH, Marchlinski FE. Using the surface electrocardiogram to localize the origin of idiopathic ventricular tachycardia. Pacing Clin Electrophysiol 2012; 35:1516.
- Olgun H, Yokokawa M, Baman T, et al. The role of interpolation in PVC-induced cardiomyopathy. Heart Rhythm 2011; 8:1046.
- Viskin S, Lesh MD, Eldar M, et al. Mode of onset of malignant ventricular arrhythmias in idiopathic ventricular fibrillation. J Cardiovasc Electrophysiol 1997; 8:1115.
- Leenhardt A, Glaser E, Burguera M, et al. Short-coupled variant of torsade de pointes. A new electrocardiographic entity in the spectrum of idiopathic ventricular tachyarrhythmias. Circulation 1994; 89:206.
- Sadek MM, Benhayon D, Sureddi R, et al. Idiopathic ventricular arrhythmias originating from the moderator band: Electrocardiographic characteristics and treatment by catheter ablation. Heart Rhythm 2015; 12:67.
- Lin CY, Chang SL, Lin YJ, et al. Long-term outcome of multiform premature ventricular complexes in structurally normal heart. Int J Cardiol 2015; 180:80.
- Bradfield JS, Homsi M, Shivkumar K, Miller JM. Coupling interval variability differentiates ventricular ectopic complexes arising in the aortic sinus of valsalva and great cardiac vein from other sources: mechanistic and arrhythmic risk implications. J Am Coll Cardiol 2014; 63:2151.
- Limpitikul WB, Dewland TA, Vittinghoff E, et al. Premature ventricular complexes and development of heart failure in a community-based population. Heart 2022; 108:105.
- Shimizu W. Arrhythmias originating from the right ventricular outflow tract: how to distinguish “malignant” from “benign”? Heart Rhythm 2009; 6:1507.
- Noda T, Shimizu W, Taguchi A, et al. Malignant entity of idiopathic ventricular fibrillation and polymorphic ventricular tachycardia initiated by premature extrasystoles originating from the right ventricular outflow tract. J Am Coll Cardiol 2005; 46:1288.
- Abdalla IS, Prineas RJ, Neaton JD, et al. Relation between ventricular premature complexes and sudden cardiac death in apparently healthy men. Am J Cardiol 1987; 60:1036.
- Sajadieh A, Nielsen OW, Rasmussen V, et al. Ventricular arrhythmias and risk of death and acute myocardial infarction in apparently healthy subjects of age >or=55 years. Am J Cardiol 2006; 97:1351.
- Bikkina M, Larson MG, Levy D. Prognostic implications of asymptomatic ventricular arrhythmias: the Framingham Heart Study. Ann Intern Med 1992; 117:990.
- Gopinathannair R, Etheridge SP, Marchlinski FE, et al. Arrhythmia-Induced Cardiomyopathies: Mechanisms, Recognition, and Management. J Am Coll Cardiol 2015; 66:1714.
- Lee AK, Deyell MW. Premature ventricular contraction-induced cardiomyopathy. Curr Opin Cardiol 2016; 31:1.
- Latchamsetty R, Yokokawa M, Morady F, et al. Multicenter Outcomes for Catheter Ablation of Idiopathic Premature Ventricular Complexes. JACC Clin Electrophysiol 2015; 1:116.
- Giles K, Green MS. Workup and management of patients with frequent premature ventricular contractions. Can J Cardiol 2013; 29:1512.
- Manolis AA, Manolis TA, Apostolopoulos EJ, et al. The role of the autonomic nervous system in cardiac arrhythmias: The neuro-cardiac axis, more foe than friend? Trends Cardiovasc Med 2021; 31:290.
- Yokokawa M, Siontis KC, Kim HM, et al. Value of cardiac magnetic resonance imaging and programmed ventricular stimulation in patients with frequent premature ventricular complexes undergoing radiofrequency ablation. Heart Rhythm 2017; 14:1695.
- Yamada T. Idiopathic ventricular arrhythmias: Relevance to the anatomy, diagnosis and treatment. J Cardiol 2016; 68:463.
- Oebel S, Dinov B, Arya A, et al. ECG morphology of premature ventricular contractions predicts the presence of myocardial fibrotic substrate on cardiac magnetic resonance imaging in patients undergoing ablation. J Cardiovasc Electrophysiol 2017; 28:1316.
- Brunetti G, Cipriani A, Perazzolo Marra M, et al. Role of Cardiac Magnetic Resonance Imaging in the Evaluation of Athletes with Premature Ventricular Beats. J Clin Med 2022; 11.
- Muser D, Santangeli P, Castro SA, et al. Risk Stratification of Patients With Apparently Idiopathic Premature Ventricular Contractions: A Multicenter International CMR Registry. JACC Clin Electrophysiol 2020; 6:722.
- Hosseini F, Thibert MJ, Gulsin GS, et al. Cardiac Magnetic Resonance in the Evaluation of Patients With Frequent Premature Ventricular Complexes. JACC Clin Electrophysiol 2022; 8:1122.
- Pellegrino PL, Casavecchia G, Gravina M, et al. Concealed structural heart disease discovered at cardiac magnetic resonance in patients with ventricular extrasystoles from ventricular outflow tract and apparently normal hearts. J Interv Card Electrophysiol 2021; 61:45.
- Lip GYH, Coca A, Kahan T, et al. Hypertension and cardiac arrhythmias: a consensus document from the European Heart Rhythm Association (EHRA) and ESC Council on Hypertension, endorsed by the Heart Rhythm Society (HRS), Asia-Pacific Heart Rhythm Society (APHRS) and Sociedad Latinoamericana de Estimulación Cardíaca y Electrofisiología (SOLEACE). Europace 2017; 19:891.
- Muser D, Tritto M, Mariani MV, et al. Diagnosis and Treatment of Idiopathic Premature Ventricular Contractions: A Stepwise Approach Based on the Site of Origin. Diagnostics (Basel) 2021; 11.
- Ghannam M, Siontis KC, Kim MH, et al. Risk stratification in patients with frequent premature ventricular complexes in the absence of known heart disease. Heart Rhythm 2020; 17:423.
- Tang JKK, Andrade JG, Hawkins NM, et al. Effectiveness of medical therapy for treatment of idiopathic frequent premature ventricular complexes. J Cardiovasc Electrophysiol 2021; 32:2246.
- Zhong L, Lee YH, Huang XM, et al. Relative efficacy of catheter ablation vs antiarrhythmic drugs in treating premature ventricular contractions: a single-center retrospective study. Heart Rhythm 2014; 11:187.
- Chandraratna PA. Comparison of acebutolol with propranolol, quinidine, and placebo: results of three multicenter arrhythmia trials. Am Heart J 1985; 109:1198.
- Hasdemir C, Ulucan C, Yavuzgil O, et al. Tachycardia-induced cardiomyopathy in patients with idiopathic ventricular arrhythmias: the incidence, clinical and electrophysiologic characteristics, and the predictors. J Cardiovasc Electrophysiol 2011; 22:663.
- Baman TS, Lange DC, Ilg KJ, et al. Relationship between burden of premature ventricular complexes and left ventricular function. Heart Rhythm 2010; 7:865.
- Takemoto M, Yoshimura H, Ohba Y, et al. Radiofrequency catheter ablation of premature ventricular complexes from right ventricular outflow tract improves left ventricular dilation and clinical status in patients without structural heart disease. J Am Coll Cardiol 2005; 45:1259.
- Wijnmaalen AP, Delgado V, Schalij MJ, et al. Beneficial effects of catheter ablation on left ventricular and right ventricular function in patients with frequent premature ventricular contractions and preserved ejection fraction. Heart 2010; 96:1275.
- Yarlagadda RK, Iwai S, Stein KM, et al. Reversal of cardiomyopathy in patients with repetitive monomorphic ventricular ectopy originating from the right ventricular outflow tract. Circulation 2005; 112:1092.
- Yokokawa M, Good E, Crawford T, et al. Recovery from left ventricular dysfunction after ablation of frequent premature ventricular complexes. Heart Rhythm 2013; 10:172.
- Marcus GM. Evaluation and Management of Premature Ventricular Complexes. Circulation 2020; 141:1404.
- Lamba J, Redfearn DP, Michael KA, et al. Radiofrequency catheter ablation for the treatment of idiopathic premature ventricular contractions originating from the right ventricular outflow tract: a systematic review and meta-analysis. Pacing Clin Electrophysiol 2014; 37:73.
- Deyell MW, Park KM, Han Y, et al. Predictors of recovery of left ventricular dysfunction after ablation of frequent ventricular premature depolarizations. Heart Rhythm 2012; 9:1465.
- Im SI, Voskoboinik A, Lee A, et al. Predictors of long-term success after catheter ablation of premature ventricular complexes. J Cardiovasc Electrophysiol 2021; 32:2254.
- Oomen AWGJ, Dekker LRC, Meijer A. Catheter ablation of symptomatic idiopathic ventricular arrhythmias : A five-year single-centre experience. Neth Heart J 2018; 26:210.
- Wang JS, Shen YG, Yin RP, et al. The safety of catheter ablation for premature ventricular contractions in patients without structural heart disease. BMC Cardiovasc Disord 2018; 18:177.
- Cojocaru C, Penela D, Berruezo A, Vatasescu R. Mechanisms, time course and predictability of premature ventricular contractions cardiomyopathy-an update on its development and resolution. Heart Fail Rev 2022; 27:1639.
- Penela D, Jáuregui B, Fernández-Armenta J, et al. Influence of baseline QRS on the left ventricular ejection fraction recovery after frequent premature ventricular complex ablation. Europace 2020; 22:274.
- Cairns JA, Connolly SJ, Roberts R, Gent M. Randomised trial of outcome after myocardial infarction in patients with frequent or repetitive ventricular premature depolarisations: CAMIAT. Canadian Amiodarone Myocardial Infarction Arrhythmia Trial Investigators. Lancet 1997; 349:675.
- Julian DG, Camm AJ, Frangin G, et al. Randomised trial of effect of amiodarone on mortality in patients with left-ventricular dysfunction after recent myocardial infarction: EMIAT. European Myocardial Infarct Amiodarone Trial Investigators. Lancet 1997; 349:667.
- Singh SN, Fletcher RD, Fisher SG, et al. Amiodarone in patients with congestive heart failure and asymptomatic ventricular arrhythmia. Survival Trial of Antiarrhythmic Therapy in Congestive Heart Failure. N Engl J Med 1995; 333:77.
- Murray GL. Ranolazine is an Effective and Safe Treatment of Adults with Symptomatic Premature Ventricular Contractions due to Triggered Ectopy. Int J Angiol 2016; 25:247.
- Yeung E, Krantz MJ, Schuller JL, et al. Ranolazine for the suppression of ventricular arrhythmia: a case series. Ann Noninvasive Electrocardiol 2014; 19:345.
- Nanda S, Levin V, Martinez MW, Freudenberger R. Ranolazine–treatment of ventricular tachycardia and symptomatic ventricular premature beats in ischemic cardiomyopathy. Pacing Clin Electrophysiol 2010; 33:e119.
- Murdock DK, Kaliebe JW. Suppression of frequent ventricular ectopy in a patient with hypertrophic heart disease with ranolazine: a case report. Indian Pacing Electrophysiol J 2011; 11:84.
- Scirica BM, Morrow DA, Hod H, et al. Effect of ranolazine, an antianginal agent with novel electrophysiological properties, on the incidence of arrhythmias in patients with non ST-segment elevation acute coronary syndrome: results from the Metabolic Efficiency With Ranolazine for Less Ischemia in Non ST-Elevation Acute Coronary Syndrome Thrombolysis in Myocardial Infarction 36 (MERLIN-TIMI 36) randomized controlled trial. Circulation 2007; 116:1647.
- Polytarchou K, Manolis AS. Ranolazine and its Antiarrhythmic Actions. Cardiovasc Hematol Agents Med Chem 2015; 13:31.
- Echt DS, Liebson PR, Mitchell LB, et al. Mortality and morbidity in patients receiving encainide, flecainide, or placebo. The Cardiac Arrhythmia Suppression Trial. N Engl J Med 1991; 324:781.
- Waldo AL, Camm AJ, deRuyter H, et al. Effect of d-sotalol on mortality in patients with left ventricular dysfunction after recent and remote myocardial infarction. The SWORD Investigators. Survival With Oral d-Sotalol. Lancet 1996; 348:7.
- Hyman MC, Mustin D, Supple G, et al. Class IC antiarrhythmic drugs for suspected premature ventricular contraction-induced cardiomyopathy. Heart Rhythm 2018; 15:159.
- Penela D, Acosta J, Aguinaga L, et al. Ablation of frequent PVC in patients meeting criteria for primary prevention ICD implant: Safety of withholding the implant. Heart Rhythm 2015; 12:2434.
- Podrid PJ, Fogel RI, Fuchs TT. Ventricular arrhythmia in congestive heart failure. Am J Cardiol 1992; 69:82G.
- Chadda K, Goldstein S, Byington R, Curb JD. Effect of propranolol after acute myocardial infarction in patients with congestive heart failure. Circulation 1986; 73:503.
- Lichstein E, Morganroth J, Harrist R, Hubble E. Effect of propranolol on ventricular arrhythmia. The beta-blocker heart attack trial experience. Circulation 1983; 67:I5.
- Manolis AS. The clinical challenge of preventing sudden cardiac death immediately after acute ST-elevation myocardial infarction. Expert Rev Cardiovasc Ther 2014; 12:1427.
- Hayes DL, Boehmer JP, Day JD, et al. Cardiac resynchronization therapy and the relationship of percent biventricular pacing to symptoms and survival. Heart Rhythm 2011; 8:1469.
- Lakkireddy D, Di Biase L, Ryschon K, et al. Radiofrequency ablation of premature ventricular ectopy improves the efficacy of cardiac resynchronization therapy in nonresponders. J Am Coll Cardiol 2012; 60:1531.
- Yokokawa M, Kim HM, Good E, et al. Relation of symptoms and symptom duration to premature ventricular complex-induced cardiomyopathy. Heart Rhythm 2012; 9:92.
- Lee AKY, Andrade J, Hawkins NM, et al. Outcomes of untreated frequent premature ventricular complexes with normal left ventricular function. Heart 2019; 105:1408.
- Latchamsetty R, Bogun F. Premature Ventricular Complex-Induced Cardiomyopathy. JACC Clin Electrophysiol 2019; 5:537.
- Podrid PJ, Lampert S, Graboys TB, et al. Aggravation of arrhythmia by antiarrhythmic drugs–incidence and predictors. Am J Cardiol 1987; 59:38E.
- Madias C, Estes NAM 3rd. Class IC antiarrhythmic agents in structural heart disease: Is nothing CAST in stone? Heart Rhythm 2018; 15:164.
- Lee V, Hemingway H, Harb R, et al. The prognostic significance of premature ventricular complexes in adults without clinically apparent heart disease: a meta-analysis and systematic review. Heart 2012; 98:1290.
- Lin CY, Chang SL, Lin YJ, et al. An observational study on the effect of premature ventricular complex burden on long-term outcome. Medicine (Baltimore) 2017; 96:e5476.
- Agarwal SK, Heiss G, Rautaharju PM, et al. Premature ventricular complexes and the risk of incident stroke: the Atherosclerosis Risk In Communities (ARIC) Study. Stroke 2010; 41:588.
- Agarwal SK, Chao J, Peace F, et al. Premature ventricular complexes on screening electrocardiogram and risk of ischemic stroke. Stroke 2015; 46:1365.
- Boas R, Thune JJ, Pehrson S, et al. Prevalence and prognostic association of ventricular arrhythmia in non-ischaemic heart failure patients: results from the DANISH trial. Europace 2021; 23:587.
- Ruwald AC, Aktas MK, Ruwald MH, et al. Postimplantation ventricular ectopic burden and clinical outcomes in cardiac resynchronization therapy-defibrillator patients: a MADIT-CRT substudy. Ann Noninvasive Electrocardiol 2018; 23:e12491.
- Bhonsale A, James CA, Tichnell C, et al. Incidence and predictors of implantable cardioverter-defibrillator therapy in patients with arrhythmogenic right ventricular dysplasia/cardiomyopathy undergoing implantable cardioverter-defibrillator implantation for primary prevention. J Am Coll Cardiol 2011; 58:1485.
- Manolis TA, Manolis AA, Apostolopoulos EJ, et al. Cardiac arrhythmias in pregnant women: need for mother and offspring protection. Curr Med Res Opin 2020; 36:1225.
- Cox JL, Gardner MJ. Treatment of cardiac arrhythmias during pregnancy. Prog Cardiovasc Dis 1993; 36:137.
- Newcombe PF, Renton KW, Rautaharju PM, et al. High-dose caffeine and cardiac rate and rhythm in normal subjects. Chest 1988; 94:90.
- Myers MG. Caffeine and cardiac arrhythmias. Ann Intern Med 1991; 114:147.
- Newby DE, Neilson JM, Jarvie DR, Boon NA. Caffeine restriction has no role in the management of patients with symptomatic idiopathic ventricular premature beats. Heart 1996; 76:355.
- Tong C, Kiess M, Deyell MW, et al. Impact of frequent premature ventricular contractions on pregnancy outcomes. Heart 2018; 104:1370.







