TS. PHẠM HỮU VĂN
(…)
- QUẢN LÝ NHỊP NHANH THẤT TRONG SUY TIM
7.1. Điều trị bằng thuốc
Ở hầu hết các bệnh nhân bị HF, các phức bộ thất sớm (PVC) không có triệu chứng, ở những bệnh nhân này, chỉ định điều chỉnh các bất thường về điện giải (đặc biệt là kali và magie huyết thanh thấp), ngừng các thuốc có thể gây loạn nhịp tim và tối ưu hóa liệu pháp dược lý HF được chỉ định; ngược lại, điều trị loạn nhịp tim thường không được chỉ định [79].
VT tạm thời thường được phát hiện trong quá trình theo dõi Holter 24-48 giờ ở bệnh nhân HF mắc cả bệnh cơ tim thiếu máu cục bộ và không thiếu máu cục bộ. Trong một tỷ lệ nhỏ bệnh nhân, VT tạm thời có thể tạo ra các triệu chứng, và trong những trường hợp này, điều trị bằng thuốc chống loạn nhịp là thích hợp. Liệu pháp chống loạn nhịp đầu tay cho bệnh nhân có triệu chứng gồm tối ưu hóa thuốc chẹn β; nếu phương pháp này không kiểm soát được các triệu chứng, amiodarone hoặc sotalol được chỉ định [80]. Mục tiêu của điều trị cấp tính của VT dai dẳng (được xác định trong khoảng thời gian ≥30 s) là nhanh chóng khôi phục nhịp ổn định với tần số thất thích hợp về mặt sinh lý và do đó ngăn ngừa tổn thương cơ quan hoặc suy giảm huyết động thêm. Bệnh nhân bị hạ huyết áp nặng, đau ngực, hoặc có dấu hiệu giảm tưới máu nên được coi là huyết động không ổn định, và phương pháp trợ tim bằng chuyển nhịp bằng điện một chiều là phương pháp nhanh chóng nhất để chấm dứt rối loạn nhịp tim [81].
Tuy nhiên, ở nhiều bệnh nhân, nhịp tim nhanh không đe dọa đến tính mạng ngay lập tức và bệnh nhân còn tỉnh và không bị nguy kịch nặng, ở những bệnh nhân này, chuyển nhịp tim bằng thuốc là phương pháp được lựa chọn. Chuyển nhịp bằng dược lý của một đợt VT kéo dài chưa được nghiên cứu trong các thử nghiệm ngẫu nhiên có đối chứng lớn; Tuy nhiên, dữ liệu thử nghiệm quan sát và có đối chứng hạn chế chỉ ra lidocain tiêm tĩnh mạch (100–150 mg tiêm tĩnh mạch sau đó truyền tĩnh mạch chậm với liều 2-4 mg / phút) thường được coi là thuốc chống loạn nhịp đầu tay và có thể hữu ích trong VT kéo dài liên quan đến thiếu máu cục bộ hoặc nhồi máu cơ tim [82].
Procainamide tiêm tĩnh mạch (10 mg / kg iv) là liệu pháp thích hợp ở những bệnh nhân này, vì nó nhanh chóng làm chậm và chấm dứt VT kéo dài; tuy nhiên, mặc dù procainamide thành công trong việc chấm dứt rối loạn nhịp cấp tính ở khoảng 75% bệnh nhân bị VT dai dẳng đơn hình, việc sử dụng nó có thể bị hạn chế do hạ huyết áp, xảy ra ở khoảng 20% những người này [83].
Amiodarone (150–300 mg trong 5 phút iv, sau đó là truyền 1050 mg / ngày) cũng hữu ích, nhưng tác dụng bắt đầu chậm hơn lidocaine hoặc procainamide, và kết quả của các nghiên cứu cắt cơn cấp tính đã thay đổi [84] .
Liệu pháp thuốc cũng được chỉ định để phòng ngừa thứ phát VT / VF kéo dài. Cùng với việc tối ưu hóa liệu pháp điều trị HF, amiodarone hoặc sotalol phải được sử dụng để giảm tái phát [85]. Người ta khuyên dùng amiodarone (200 mg / ngày) như là liệu pháp đầu tay và dự trữ việc sử dụng sotalol (240–480 mg / ngày chia làm ba lần), cùng với thuốc chẹn beta, chỉ ở những bệnh nhân có chống chỉ định / tác dụng phụ với amiodarone hoặc ở những bệnh nhân với sự tồn tại của SVT mặc dù điều trị bằng amiodarone. Trong trường hợp VT dai dẳng tái phát trơ với các thuốc chống loạn nhịp khác, có thể sử dụng mexiletine (600 mg / ngày chia 3 lần) (không có bán trên thị trường ở một số nước châu Âu như Hy Lạp hoặc Ý). Các thuốc chống loạn nhịp trên trừ amiodarone đều không có mặt chính thức tại Việt Nam.
7.2. Triệt phá qua catheter
Tài liệu đồng thuận của Hiệp hội Nhịp tim Châu Âu và Hiệp hội Nhịp tim về triệt phá VA qua catheter [86] liệt kê các chỉ định hiện tại cho thủ thuật này là VT dai dẳng đơn hình có triệu chứng tái phát mặc dù điều trị bằng thuốc chống loạn nhịp hoặc ở những bệnh nhân không mong muốn hoặc không dung nạp thuốc chống loạn nhịp. thuốc men. Triệt phá qua catheter cũng được chỉ định cho những bệnh nhân có PVC thường xuyên, VT tạm thời hoặc VT dai dẳng dẫn đến rối loạn chức năng cơ tim (do bệnh cơ tim liên quan đến nhịp tim nhanh), và cho những bệnh nhân có VT do bó nhánh hoặc VT nội bó và VT đa hình kéo dài tái phát hoặc VF trơ với thuốc chống loạn nhịp khi nghi ngờ có yếu tố kích hoạt (hình thái PVC đơn) có thể được nhắm mục tiêu để triệt phá.
7.2.1. Triệt phá phức bộ thất sớm và nhịp nhanh thất tạm thời
PVC thường gặp ở bệnh nhân HF và bệnh tim cấu trúc. PVC cũng có thể đi kèm với thời gian ngắn của VT tạm thời. Có nhiều tài liệu cho rằng PVC thường xuyên có thể là nguyên nhân gây ra bệnh cơ tim có thể hồi phục. Thông thường rất khó để phân biệt liệu PVCs là vấn đề chính hay thứ phát của bệnh cơ tim. Các trường hợp trong đó PVC chiếm hơn 10% nhịp tim trên điện tâm đồ 24 giờ, với hầu hết PVC có cùng hình thái QRS, có nhiều khả năng gây ra bệnh cơ tim nhanh [87]. Triệt phá PVC ở những bệnh nhân này có thể giúp phục hồi đáng kể chức năng thất trái của họ.
7.2.2. Triệt phá ở bệnh nhân bệnh cơ tim thiếu máu cục bộ
Cơ chế của VT ở bệnh nhân bị nhồi máu cơ tim trước đó thường là vào lại xung quanh sẹo cơ tim, nhưng cơ chế ổ có thể xảy ra ở 5% –10% bệnh nhân. Các chiến lược tái tưới máu sớm đã tạo ra các ổ nhồi máu nhỏ hơn và ít hình thành túi phình hơn nhưng ở những bệnh nhân bị bệnh cơ tim thiếu máu cục bộ mãn tính, nguy cơ rối loạn nhịp tim vẫn đáng kể. Mặc dù kích thích theo chương trình có thể gây ra VT ở gần 90% bệnh nhân cơ tim thiếu máu cục bộ và VT dai dẳng trên lâm sàng, tỷ lệ và hình thái thường khác với VT tự phát [88]. Những yếu tố này đã dẫn đến việc sử dụng ngày càng nhiều triệt phá dựa trên chất nền, sử dụng lập bản đồ điện thể và tạo nhịp trong quá trình nhịp xoang để xác định các đích cho triệt phá. Điều này giảm thiểu các đợt VT không ổn định trong quá trình thủ thuật và được dung nạp tốt hơn ở những bệnh nhân bị giảm chức năng tâm thu thất trái. Hầu hết các VT có thể được triệt phá từ phương pháp nội tâm mạc, nhưng một số VT, thường gặp hơn sau nhồi máu vùng dưới, có thể yêu cầu phương pháp tiếp cận ngoại tâm mạc [89]. Kết quả của việc triệt phá thay đổi đáng kể tùy thuộc vào dân số nghiên cứu. Triệt phá thành công đạt 38% –72%, với tỷ lệ tử vong do thủ thuật là 0,5% –8% trong 12 tháng; Theo dõi 50% –88% bệnh nhân sẽ không còn VT [90].
7.2.3. Triệt phá trong bệnh cơ tim không do thiếu máu
VT đơn hình dai dẳng ít gặp ở bệnh cơ tim không do thiếu máu cục bộ, nhưng cơ chế thường là vào lại. Các vùng sẹo trong bệnh cơ tim không do thiếu máu cục bộ có xu hướng nhỏ hơn và thường nằm ở giữa cơ tim hoặc lớp thượng tâm mạc. Thường gây ra nhiều hình thái VT ở nhóm bệnh nhân này và chỉ triệt phái nội tâm mạc thì ít thành công hơn [91]. Lập bản đồ và triệt phá ngoại tâm mạc làm tăng khả năng thành công ở nhóm bệnh nhân này, nhưng thời điểm tối ưu của triệt phá thượng tâm mạc vẫn chưa được xác định [92].
- ĐỘT TỬ DO TIM
8.1. Đột tử do tim ở các bệnh nhân HFrEF
Đột tử có thể do rồi loạn nhịp, có lẽ chiếm một tỷ lệ đáng kể trong tổng số tử vong ở bệnh nhân HF với NYHA II – III, trong khi thoái hóa huyết động tiến triển và suy bơm là những nguyên nhân chính gây tử vong ở bệnh nhân NYHA IV. Nhiều yếu tố nguy cơ tái phát loạn nhịp tim và SCD đã được xác định ở những bệnh nhân bị bệnh tim cấu trúc; tuy nhiên, việc phát triển một chiến lược phân tầng nguy cơ toàn diện vẫn là một thách thức. Ở đây, chúng tôi minh họa ngắn gọn thông số được sử dụng trong thực hành lâm sàng để phân tầng nguy cơ SCD ở bệnh nhân HF.
8.1.1. Rối loạn chức năng tâm thu thất trái
Phân suất tống máu giảm còn lại, theo các hướng dẫn quốc tế (Bảng 2), là yếu tố tiên lượng phù hợp nhất của SCD ở những bệnh nhân bị bệnh tim cấu trúc, bất kể căn nguyên. Các bệnh nhân trong Thử nghiệm cấy máy khử rung tim tự động đa trung tâm (MADIT-II) theo dõi có phân suất tống máu dưới 30% có tỷ lệ SCD khoảng 9,4% sau 20 tháng [93]. Tuy nhiên, trong một quần thể bệnh nhân tương tự, phân suất tống máu lớn hơn 35% và tiền sử nhồi máu cơ tim chỉ làm tăng 1,8% nguy cơ SCD [94].
Bảng 2. Chỉ định ICD ở bệnh nhân HF.
| Hướng dẫn cho điều trị bằng dụng cụ các bất thường nhịp tim của ACC/AHA/HRS 2012 | COR-LOE |
| DCM thiếu máu cục bộ (ít nhất 40 ngày sau MI), LVEF nhỏ hơn hoặc bằng 35%, NYHA class chức năng II hoặc III | I-A |
| DCM không do thiếu máu cục bộ, LVEF nhỏ hơn hoặc bằng 35%, NYHA class chức năng II hoặc III | I-B |
| DCM thiếu máu cục bộ (ít nhất 40 ngày sau MI) LVEF nhỏ hơn hoặc bằng 35%, NYHA class chức năng I | I-A |
| Hướng dẫn quản lý suy tim ACCF/AHA 2013 | |
| HFrEF (không phân biệt căn nguyên, nhưng trong trường hợp căn nguyên thiếu máu cục bộ ít nhất 40 ngày sau MI), LVEF thấp hơn hoặc bằng 35%, NYHA class II hoặc III | I-A |
| HFrEF (không phân biệt căn nguyên, nhưng trong trường hợp căn nguyên thiếu máu cục bộ ít nhất 40 ngày sau MI), LVEF nhỏ hơn hoặc bằng 30%, NYHA Class I | I-B |
| Hướng dẫn ESC 2015 về quản lý bệnh nhân rối loạn nhịp thất và phòng ngừa đột tử do tim | |
| HFrEF do thiếu máu cục bộ (ít nhất 6 tuần sau nhồi máu cơ tim), LVEF thấp hơn hoặc bằng 35%, NYHA class II hoặc III | I-A |
| HFrEF không do thiếu máu cục bộ, LVEF nhỏ hơn hoặc bằng 35%, NYHA class II hoặc III | I-B |
| Bệnh nhân được liệt kê để ghép tim | IIa-C |
| Hướng dẫn ESC 2016 về chẩn đoán và điều trị suy tim cấp và mạn. | |
| HFrEF thiếu máu cục bộ, LVEF nhỏ hơn hoặc bằng 35%, NYHA class II hoặc III | I-A |
| HFrEF không do thiếu máu cục bộ, LVEF nhỏ hơn hoặc bằng 35%, NYHA class II hoặc III | I-B |
DCM: bệnh cơ tim giãn; HFrEF: suy tim phân suất tống máu giảm; COR: class khuyến cáo LOE: Mức độ bằng chứng; LVEF: Phân suất tống máu thất trái; NYHA: Hội Tim New York.
8.1.2. Sự thay đổi luân phiên song T
Sự thay đổi luân phiên sóng T hoặc sự thay đổi hình thái sóng T từ nhịp này sang nhịp khác được tin là do rồi loạn khu vực trong khoảng thời gian điện thế hoạt động đưa đến sự phân tán trong tái cực và có xu hướng phát triển loạn nhịp [95]. Sự thay đổi sóng T ở mức Microvolt (MTWA) đo những thay đổi microvolt trong biên độ sóng T trong sự thay đổi các nhịp và cũng được phát hiện là một yếu tố dự báo đáng kể các biến cố VT / VF [96]. Việc áp dụng xét nghiệm MTWA cho những bệnh nhân phù hợp với tiêu chí MADIT-II đã chứng minh [97] những bệnh nhân có xét nghiệm MTWA bất thường có tỷ lệ tử vong trong 2 năm tăng lên đáng kể (17,8%) so với những bệnh nhân có MTWA bình thường (3,8%) ; tuy nhiên, một hạn chế lớn của test MTWA là tỷ lệ kết quả không xác định cao.
8.1.3. Điện tâm đồ tín hiệu trung bình
Điện tâm đồ trung bình tín hiệu (SAECG) là một kỹ thuật điện tâm đồ có độ phân giải cao được thiết kế để xác định nguy cơ phát triển VT bằng cách đo các tín hiệu điện tâm đồ bề mặt tần số thấp, biên độ thấp trong phần kết thúc phức hợp QRS khi máy điện tâm đồ tiêu chuẩn không thể phát hiện được. [98]. Những điện thế muộn này có tương quan với các khu vực khu trú của quá trình kích hoạt nội tâm mạc chậm ở người và phản ánh chất nền cho việc vào lại thất [99]. Ở những bệnh nhân bị bệnh mạch vành, điện tâm đồ trung bình tín hiệu có giá trị tiên đoán dương tính tổng thể thấp, từ 7% đến 27%, trong khi nó có giá trị tiên đoán âm tính rất cao từ 96% đến 99%. Tiện ích của nó như một công cụ tiên lượng vẫn còn gây tranh cãi ở những bệnh nhân bị bệnh cơ tim không do thiếu máu cục bộ vô căn [100].
Tóm lại, đa số các tác giả đồng tình với tuyên bố khoa học của Hiệp hội Tim mạch Hoa Kỳ (AHA) / Trường Môn Tim mạch Hoa Kỳ (ACC) / Hiệp hội Nhịp tim (HRS) về phân tầng nguy cơ không xâm lấn [101], kết luận SAECG có thể hữu ích để xác định bệnh nhân có nguy cơ mắc SCD thấp, nhưng việc sử dụng nó thường quy để xác định bệnh nhân HF có nguy cơ cao mắc SCD vẫn chưa được hỗ trợ đầy đủ.
8.1.4. Nghiên cứu về trương lực tự động
Sự thay đổi nhịp tim và độ nhạy cảm áp lực (baroreflex sensitivity: BRS) là hai xét nghiệm không xâm lấn được sử dụng để ước tính chức năng của hệ thần kinh tự chủ. Sự thay đổi nhịp tim giảm đã được chứng minh là một yếu tố dự báo mạnh mẽ về tỷ lệ tử vong và có lẽ là các biến cố loạn nhịp ở những bệnh nhân bị Nhồi máu cơ tim [102]. Trương lực tự chủ và phản xạ sau thử nghiệm Nhồi máu cơ tim được thiết kế để đánh giá tiện ích tiên lượng của BRS và sự biến thiên nhịp tim ở bệnh nhân sau nhồi máu cơ tim [103]. BRS bị giảm (được định nghĩa là <3 ms / mmHg) dự đoán đáng kể tỷ lệ tử vong do tim trong thời gian theo dõi trung bình 21 tháng.
8.1.5. Nghiên cứu điện sinh lý
Các giá trị chẩn đoán và tiên lượng của một nghiên cứu điện sinh lý phụ thuộc vào cơ sở bệnh lý cơ bản và các biểu hiện rối loạn nhịp tim tự phát. Sự cảm ứng của VT đơn hình là một dấu hiệu nguy cơ mạnh đối với SCD, đặc biệt ở những bệnh nhân có tiền sử nhồi máu cơ tim trước đó và giảm phân suất tống máu hoặc ngất. Kích thích điện theo chương trình có độ nhạy khoảng 97% ở những người có VT dai dẳng đơn hình tự phát và giá trị tiên đoán dương tính là 65% [104]. Ở những bệnh nhân có bệnh cơ tim không do thiếu máu cục bộ, khả năng gây VA thấp hơn nhiều. Mặc dù độ nhạy tổng thể của kích thích theo chương trình tương tự như ở bệnh nhân bệnh mạch vành, nhưng tính không cảm ứng ở bệnh nhân bệnh cơ tim giãn không do thiếu máu cục bộ không mang lại tiên lượng tốt [105].
8.2. Đột tử tim ở bệnh nhân suy tim phân suất tống máu bảo tồn
Tỷ lệ mắc và cơ chế của SCD ở bệnh nhân HFrEF đã được đặc trưng rõ ràng, ngược lại, dữ liệu hạn chế có sẵn để khám phá bối cảnh của SCD ở bệnh nhân suy tim phân suất tống máu bảo tồn (HFpEF) [106]. HFpEF là một tình trạng lâm sàng không đồng nhất với tỷ lệ hiện mắc và tỷ lệ tử vong ngày càng tăng và tỷ lệ mắc bệnh tương đương với HFrEF. Bảng 3 tóm tắt các dữ liệu dịch tễ học, các yếu tố dự báo lâm sàng cũng như các chiến lược để ngăn ngừa SCD ở nhóm dân số này.
Bảng 3. Khía cạnh lâm sàng của đột tử do tim trong Suy tim phân suất tống máu bảo tồn.
| Bệnh căn của SCD trong HFpEF | 39,4% tổng số ca tử vong do tim mạch trong thử nghiệm được bảo tồn CHARM |
| 43,4% tổng số tử vong do tim mạch trong thử nghiệm I-PRESERVE | |
| 38,1% tổng số ca tử vong do tim mạch trong thử nghiệm TOPCAT | |
| Các yếu tố kết hợp với nguy cơ SCD trong HFpEF | Tuổi * |
| Giới nữ * | |
| Bệnh sử tiểu đường * | |
| Bệnh sử nhồi máu cơ tim trước đó * | |
| Block phân nhánh trái * | |
| Natriuretic peptides * | |
| Các chỉ dấu sinh học khác (Galectin 3, soluble ST-2) ** | |
| Chiến lược dự phòng | Các thử nghiệm lâm sàng đánh giá các liệu pháp được thiết lập cho bệnh nhân HFrEF ở bệnh nhân HFpEF không dẫn đến cải thiện kết quả lâm sàng. Thử nghiệm với ARNI đang diễn ra (PARAGON-HF). Việc xác định kiểu hình cụ thể (ví dụ, bệnh cơ tim phì đại) là bắt buộc để điều trị phù hợp |
* Dữ liệu được lấy ra từ I-PRESERVE; ** Có khả năng bằng chứng hạn chế; SCD: Đột tử do tim; HFpEF: Suy tim phân suất tống máu bảo tồn; ARNI: ức chế thụ thể angiotensin /Neprilysin; CHARM: Candesartan trong đánh giá suy tim giảm tử suất và bệnh suất; I-PRESERVE: Irbesartan trong nghiên cứu suy tim phân suất tống máu bảo tồn; TOPCAT: Điều trị suy tim chức năng bảo tồn với kháng aldosterone PARAGON-HF: Hiệu quả và an toàn của LCZ696 so sánh với Valsartan về tử suất và bệnh suất ở bệnh nhân suy tim với phân suất bảo tồn.
- ĐIỀU CHỈNH RỐI LOẠN NHỊP CHẬM TRONG SUY TIM
Việc quản lý loạn nhịp chậm trong dân số HF phản ánh điều đó trong dân số nói chung, nhưng cần phải đưa ra quyết định cẩn thận cho từng cá nhân trong việc lựa chọn chế độ tạo nhịp tối ưu ở bệnh nhân HF (Hình 2). Ở những bệnh nhân bị rối loạn chức năng nút xoang nhưng dẫn truyền nhĩ-thất còn nguyên vẹn, có thể cân nhắc tạo nhịp nhĩ đơn thuần (chế độ AAI); mặt khác, những bệnh nhân bị block AV (thực sự hoặc đe dọa) sẽ yêu cầu tạo nhịp thất. Không có bằng chứng chắc chắn nào từ các thử nghiệm lâm sàng cho thấy tạo nhịp hai buồng (DDD hoặc DDDR) vượt trội hơn tạo nhịp thất một buồng (VVI hoặc VVIR), ngay cả trong dân số HF. Tuy nhiên, có nhiều bằng chứng cho thấy tạo nhịp thất phải có hại ở những bệnh nhân bị rối loạn chức năng thất trái [107]; vì lý do này, tạo nhịp nhĩ- hai thất thường được xem xét ở bệnh nhân HF và rối loạn chức năng thất trái nặng, những người có khả năng cần tạo nhịp thất lâu dài [108].
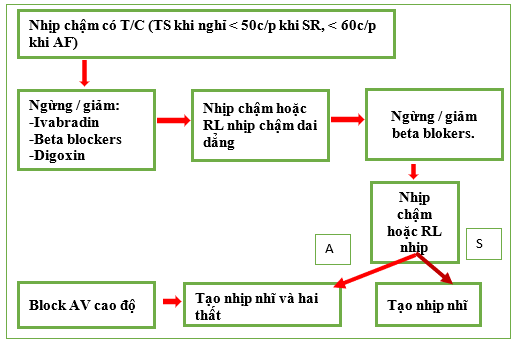
Hình 2. Lưu đồ quản lý rồi loạn nhịp chậm trong HF.
AF: Rung tâm nhĩ; SR: Nhịp xoang.
- KẾT LUẬN
Quản lý lâm sàng HF cần xem xét nguy cơ loạn nhịp tim cao ở những bệnh nhân này. Điều trị bằng thuốc chống loạn nhịp vẫn chưa tối ưu, nhưng điều quan trọng là ở những bệnh nhân loạn nhịp có triệu chứng và loạn nhịp nhĩ, và những bệnh nhân được chọn lọc với HF tiến triển. Liệu pháp cấy máy khử rung tim có hiệu quả làm giảm tỷ lệ tử vong ở những bệnh nhân bị giảm phân suất tống máu nghiêm trọng; tuy nhiên, vì chỉ một số ít bệnh nhân được cấy ghép sẽ trải qua VA có liên quan về mặt lâm sàng, việc đánh giá nguy cơ được cải thiện trong điều trị dự phòng ban đầu cần có các nghiên cứu sâu hơn, bao gồm phân tầng nguy cơ trong HFpEF.
TÀI LIỆU THAM KHẢO
- Mosterd A., Hoes A.W. Clinical epidemiology of heart failure. Heart. 2007;93:1137–1146.
- Hunt S.A., Abraham W.T., Chin M.H., Feldman A.M., Francis G.S., Ganiats T.G., Jessup M., Konstam M.A., Mancini D.M., Michl K., et al. 2009 Focused Update Incorporated Into the ACC/AHA 2005 Guidelines for the Diagnosis and Management of Heart Failure in Adults: A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines: Developed in Collaboration With the International Society for Heart and Lung Transplantation. Circulation. 2009;119:391–479.
- Ehrlich J.R., Nattel S., Hohnloser S. Atrial fibrillation and congestive heart failure: Specific considerations at the intersection of two common and important cardiac disease sets. J. Cardiovasc. Electrophysiol. 2009;13:399–405.
- Olsson L.G., Swedberg K., Ducharme A., Granger C.B., Michelson E.L., McMurray J.J.V., Puu M., Yusuf S., Pfeffer M.A. Atrial Fibrillation and Risk of Clinical Events in Chronic Heart Failure with and Without Left Ventricular Systolic Dysfunction: Results from the Candesartan in Heart failure-Assessment of Reduction in Mortality and morbidity (CHARM) Program. J. Am. Coll. Cardiol. 2006;47:1997–2004.
- Pozzoli M., Cioffi G., Traversi E., Pinna G.D., Cobelli F., Tavazzi L. Predictors of primary atrial fibrillation and concomitant clinical and hemodynamic changes in patients with chronic heart failure: A prospective study in 344 patients with baseline sinus rhythm. J. Am. Coll. Cardiol. 1998;32:197–204.
- Luu M., Stevenson W.G., Stevenson L.W., Baron K., Walden J. Diverse mechanisms of unexpected cardiac arrest in advanced heart failure. Circulation. 1989;80:1675–1680.
- The Digitalis Investigation Group The effect of digoxin on mortality and morbidity in patients with heart failure. N. Engl. J. Med. 1997;336:525–533.
- Stevenson W.G., Ellison K.E., Sweeney M.O., Epstein L.M., Maisel W.H. Management of arrhythmias in heart failure. Cardiol. Rev. 2002;10:8–14.
- Krishnan S., Schuger C.D., Goldstein S. Sudden death in heart failure: Underlying electrophysiologic mechanisms. Heart Fail. Rev. 2002;7:255–260.
- De Bakker J.M., Van Capelle F.J., Janse M.J. Myocardial infarction: Slow conduction in the infarcted human heart: “Zigzag” course of activation. Circulation. 1998;88:915–992.
- Stevenson W.G., Khan H., Sager P., Saxon L.A., Middlekauff H.R., Natterson P.D., Wiener I. Identification of reentry circuit sites during catheter mapping and radiofrequency ablation of ventricular tachycardia late after myocardial infarction. Circulation. 1993;88:1647–1670.
- Pye M.P., Cobbe S.M. Arrhythmogenesis in experimental models of heart failure: The role of increased load. Cardiovasc. Res. 1996;32:248–257.
- Zipes D.P., Jalife J. Cardiac Electrophysiology: From Cell to Bedside.6th ed. Saunders Company; Philadelphia, PA, USA: 2013. [Google Scholar]
- Zabel M., Koller B., Sachs F., Franz M. Stretch-induced voltage changes in the isolated beating heart: Importance of the timing of stretch and implication for stretch-activated ion channels. Cardiovasc. Res. 1996;32:120–130.
- MERIT-HF Study Group Effect of metoprolol CR/XL in chronic heart failure: Metoprolol CR/XL Randomized Interventional Trial in Congestive Heart Failure (MERIT-HF) Lancet. 1999;353:2001–2007.
- Schwartz P.J., La Rovere M.T., Vanoli E. Autonomic nervous system and sudden cardiac death: Experimental basis and clinical observations for post-myocardial risk stratification. Circulation. 1992;85:77–91.
- Meredith I.T., Eisenhofer G., Lambert G.W., Dewar E.M., Jennings G.L., Esler M.D. Cardiac sympathetic nervous activity in congestive heart failure: Evidence for increased neuronal norepinephrine release. Circulation. 1993;88:136–145.
- Cao J.M., Fishbein M.C., Han J.B., Lai W.W., Lai A.C., Wu T.J., Czer L., Wolf P.L., Denton T.A., Shintaku I.P., et al. Relationship between regional cardiac hyper innervation and ventricular arrhythmias. Circulation. 2000;101:1960–1969.
- Gettes L.S. Electrolyte abnormalities underlying lethal ventricular arrhythmias. Circulation. 1992;85:70–76.
- Hoss S., Elizur Y., Luria D., Keren A., Lotan C., Gotsman I. Serum Potassium Levels and Outcome in Patients With Chronic Heart Failure. Am. J. Cardiol. 2016;118:1868–1874.
- Tomaselli G.F., Zipes D.P. What causes sudden death in heart failure? Circ. Res. 2004;95:754–763.
- Urso C., Brucculeri S., Caimi G. Acid-base and electrolyte abnormalities in heart failure: Pathophysiology and implications. Heart Fail. Rev. 2015;20:493–503.
- Heist E.K., Ruskin J.N. Drug induced arrhythmia. Circulation. 2010;122:1426–1435.
- Ebinger M.W., Krishnan S. Mechanisms of Ventricular Arrhythmias in Heart Failure. Curr. Heart Fail. Rep. 2005;2:111–117.
- Janse M.J., Vermeulen J.T., Opthof T. Arrhythmogenesis in heart failure. J. Cardiovasc. Electrophysiol. 2001;12:496–499.
- Yeh Y.H., Wakili R., Qi X.Y., Chartier D., Boknik P., Kääb S., Ravens U., Coutu P., Dobrev D., Nattel S. Calcium-handling abnormalities underlying atrial arrhythmogenesis and contractile dysfunction in dogs with congestive heart failure. Circ. Arrhythm. Electrophysiol. 2008;1:93–102.
- Prestle J., Quinn F.R., Smith G.L. Ca2+-handling proteins and heart failure: Novel molecular targets? Curr. Med. Chem. 2003;10:967–981.
- Lou Q., Janardhan A., Efimov I.R. Remodeling of calcium handling in human heart failure. Adv. Exp. Med. Biol. 2012;740:1145–1174.
- Luo M., Anderson M.E. Mechanisms of altered Ca2+handling in heart Failure. Circ. Res. 2013;113:690–708.
- Verkerk A.O., Tan H.L., Baartscheer T., Ravesloot J.H. Limited role of Ca2+-activated Cl−current in early afterdepolarisations. Neth. Heart J. 2002;10:506–511.
- DeSantiago J., Ai X., Islam M., Acuna G., Ziolo M.T., Bers D.M., Pogwizd S.M. Arrhythmogenic effects of β2-adrenergic stimulation in the failing heart are due to enhanced SR Ca load. Circ. Res. 2008;102:1389–1397.
- Ginsburg K.S., Weber C.R., Bers D.M. Cardiac Na+–Ca2+exchanger: Dynamics of Ca2+-dependent activation and deactivation in intact myocytes. J. Physiol. 2013;591:2067–2086.
- Kho C., Lee A., Hajjar R.J. Altered sarcoplasmic reticulum calcium cycling—Targets for heart failure therapy. Nat. Rev. Cardiol. 2012;9:717–733. doi: 10.1038/nrcardio.2012.145.
- Wang Y., Hill J.A. Electrophysiological remodeling in heart failure. J. Mol. Cell. Cardiol. 2010;48:619–632.
- Beuckelmann D.J., Näbauer M., Erdmann E. Alterations of K+currents in isolated human ventricular myocytes from patients with terminal heart failure. Circ. Res. 1993;73:379–385. doi: 10.1161/01.RES.73.2.379.
- De Marneffe M., Gregoire J.M., Waterschoot P., Kestemont M.P. The sinus node function: Normal and pathological. Eur. Heart J. 1993;1993:649–654. doi: 10.1093/eurheartj/14.5.649.
- Deal N. Evaluation and management of bradydysrhythmias in the emergency department. Emerg. Med. Pract. 2013;15:1–15.
- McVay M.R. Atrioventricular block a review. S D J. Med. 1984;37:21–26.
- Barold S.S., Hayes D.L. Second-degree atrioventricular block: A reappraisal. Mayo Clin. Proc. 2001;76:44–57.
- Rosen K.M., Dhingra R.C., Loeb H.S., Rahimtoola S.H. Chronic heart block in adults. Clinical and electrophysiological observations. Arch. Intern. Med. 1973;131:663–669.
- Puech P., Wainwright R.J. Clinical electrophysiology of atrioventricular block. Cardiol. Clin. 1983;1:209–215.
- Kearney K., Ellingson S., Stout K., Patton K.K. From Bradycardia to Tachycardia: Complete Heart Block. Am. J. Med. 2015;128:702–706.
- Maisel W.H., Stevenson L.W. Atrial fibrillation in heart failure: Epidemiology, pathophysiology, and rationale for therapy. Am. J. Cardiol. 2003;91:2–8.
- Hugh S.S., Havmoeller R., Narayanan K., Singh D., Rienstra M., Benjamin E.J., Gillum R.F., Kim Y.H., McAnulty J.H., Jr., Zheng Z.J., et al. Worldwide epidemiology of atrial fibrillation: A Global Burden of Disease 2010 Study. Circulation. 2014;129:837–847.
- Van Deursen V.M., Urso R., Laroche C., Damman K., Dahlstrom U., Tavazzi L., Maggioni A.P., Voors A.A. Co-morbidities in patients with heart failure: An analysis of the European Heart Failure Pilot Survey. Eur. J. Heart Fail. 2014;16:103–111.
- Gupta S., Figueredo V.M. Tachycardia mediated cardiomyopathy: Pathophysiology, mechanisms, clinical features and management. Int. J. Cardiol. 2014;172:40–46.
- Kotecha D., Lam C.S., Van Veldhuisen D.J., Van Gelder I.C., Voors A.A., Rienstra M. Heart Failure with Preserved Ejection Fraction and Atrial Fibrillation: Vicious Twins. J. Am. Coll. Cardiol. 2016;68:2217–2228. doi: 10.1016/j.jacc.2016.08.048.
- Agarwal M., Apostolakis S., Lane D.A., Lip G.Y. The impact of heart failure and left ventricular dysfunction in predicting stroke, thromboembolism, and mortality in atrial fibrillation patients: A systematic review. Clin. Ther. 2014;36:1135–1144.
- Kjekshus J. Arrhythmias and mortality in congestive heart failure. Am. J. Cardiol. 1990;65:42–48.
- Lo R., Hsia H. Ventricular arrhythmias in heart failure patients. Cardiol. Clin. 2008;26:381–403. doi: 10.1016/j.ccl.2008.03.009.
- Hsia H.H., Jessup M.L., Marchlinski F.E. Debate: Do all patients with heart failure require implantable defibrillators to prevent sudden death? Curr. Control Trials Cardiovasc. Med. 2000;65:98–101.
- Stevenson W.J., Stevenson L.W. Sudden death in heart failure: Bradyarrhythmias and secondary causes. Cardiol. Rev. 1994;33:546–555.
- Lu H.T., Kam J., Nordin R.B., Khelae S.K., Wang J.M., Choy C.N., Lee C.Y. Beta-blocker use and risk of symptomatic bradyarrhythmias: A hospital-based case-control study. J. Geriatr. Cardiol. 2016;13:749–759. [PMC free article] [PubMed] [Google Scholar]54. Camm A.J., Kirchhof P., Lip G.Y., Schotten U., Savelieva I., Ernst S., Van Gelder I.C., Al-Attar N., Hindricks G., Prendergast B., et al. Guidelines for the management of atrial fibrillation: The Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC) Eur. Heart J. 2010;31:2369–2429.
- Kotecha D., Holmes J., Krum H., Altman D.G., Manzano L., Cleland J.G., Lip G.Y., Coats A.J., Andersson B., Kirchhof P., et al. Efficacy of β blockers in patients with heart failure plus atrial fibrillation: An individual-patient data meta-analysis. Lancet. 2014;384:2235–2243.
- Bhuriya R., Singh M., Sethi A., Molnar J., Bahekar A., Singh P.P., Khosla S., Arora R. Prevention of recurrent atrial fibrillation with angiotensin-converting enzyme inhibitors or angiotensin receptor blockers: A systematic review and meta-analysis of randomized trials. J. Cardiovasc. Pharmacol. Ther. 2011;16:178–184.
- Abraham J.M., Connolly S.J. Atrial fibrillation in heart failure: Stroke risk stratification and anticoagulation. Heart Fail. Rev. 2014;19:305–313.
- Kirchhof P., Benussi S., Kotecha D., Ahlsson A., Atar D., Casadei B., Castella M., Diener H.C., Heidbuchel H., Hendriks J., et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur. Heart J. 2016;37:2893–2962.
- Kotecha D., Piccini J.P. Atrial fibrillation in heart failure: What should we do? Eur. Heart J. 2015;36:3250–3257.
- Van Gelder I.C., Groenveld H.F., Crijns H.J., Tuininga Y.S., Tijssen J.G., Alings A.M., Hillege H.L., Bergsma-Kadijk J.A., Cornel J.H., Kamp O., et al. Lenient versus strict rate control in patients with atrial fibrillation. N. Engl. J. Med. 2010;362:1363–1373.
- Lip G.Y., Heinzel F.R., Gaita F., Juanatey J.R., Le Heuzey J.Y., Potpara T., Svendsen J.H., Vos M.A., Anker S.D., Coats A.J., et al. European Heart Rhythm Association/Heart Failure Association joint consensus document on arrhythmias in heart failure, endorsed by the Heart Rhythm Society and the Asia Pacific Heart Rhythm Society. Europace. 2016;18:12–36.
- Crijns H.J., Weijs B., Fairley A.M., Lewalter T., Maggioni A.P., Martín A., Ponikowski P., Rosenqvist M., Sanders P., Scanavacca M., et al. Contemporary real life cardioversion of atrial fibrillation: Results from the multinational RHYTHM-AF study. Int. J. Cardiol. 2014;172:588–594.
- Nair M., George L.K., Koshy S.K. Safety and efficacy of ibutilide in cardioversion of atrial flutter and fibrillation. J. Am. Board Fam. Med. 2011;24:86–92.
- Deedwania P.C., Singh B.N., Ellenbogen K., Fisher S., Fletcher R., Singh S.N. Spontaneous conversion and maintenance of sinus rhythm by amiodarone in patients with heart failure and atrial fibrillation: Observations from the veterans affairs congestive heart failure survival trial of antiarrhythmic therapy (CHF-STAT). The Department of Veterans Affairs CHF-STAT Investigators. Circulation. 1998;98:2574–2579.
- Zimetbaum P. Antiarrhythmic drug therapy for atrial fibrillation. Circulation. 2012;125:381–389.
- Wyse D.G., Waldo A.L., DiMarco J.P., Domanski M.J., Rosenberg Y., Schron E.B., Kellen J.C., Greene H.L., Mickel M.C., Dalquist J.E., et al. A comparison of rate control and rhythm control in patients with atrial fibrillation. N. Engl. J. Med. 2002;347:1825–1833.
- Roy D., Talajic M., Nattel S., Wyse D.G., Dorian P., Lee K.L., Bourassa M.G., Arnold J.M., Buxton A.E., Camm A.J., et al. Rhythm control versus rate control for atrial fibrillation and heart failure. N. Engl. J. Med. 2008;25:2667–2677.
- Haeusler K.G., Laufs U., Endres M. Chronic heart failure and ischemic stroke. Stroke. 2011;42:2977–2982.
- Melgaard L., Gorst-Rasmussen A., Lane D.A., Rasmussen L.H., Larsen T.B., Lip G.Y. Assessment of the CHA2DS2-VASc score in predicting ischemic stroke, thromboembolism, and death in patients with heart failure with and without atrial fibrillation. JAMA. 2015;314:1030–1038.
- January C.T., Wann L.S., Alpert J.S., Calkins H., Cigarroa J.E., Cleveland J.C., Jr., Conti J.B., Ellinor P.T., Ezekowitz M.D., Field M.E., et al. 014 AHA/ACC/HRS guideline for the management of patients with atrial fibrillation: Executive summary: A report of the American College of Cardiology/American Heart Association Task Force on practice guidelines and the Heart Rhythm Society. Circulation. 2014;130:2071–2104.
- Boos C.J., Brown L. Anticoagulation in atrial fibrillation and chronic heart failure: The risk and drug of choice. Curr. Opin. Cardiol. 2016;31:229–234.
- Hsu L.F., Jaïs P., Sanders P., Garrigue S., Hocini M., Sacher F., Takahashi Y., Rotter M., Pasquié J.L., Scavée C., et al. Catheter ablation for atrial fibrillation in congestive heart failure. N. Engl. J. Med. 2004;351:2373–2383.
- Khan M.N., Jaïs P., Cummings J., Di Biase L., Sanders P., Martin D.O., Kautzner J., Hao S., Themistoclakis S., Fanelli R., et al. Pulmonary-vein isolation for atrial fibrillation in patients with heart failure. N. Engl. J. Med. 2008;359:1778–1785.
- Patel D., Daoud E.G. Atrioventricular junction ablation for atrial fibrillation. Heart Fail. Clin. 2016;12:245–255.
- Alboni P., Scarfò S., Fucà G., Paparella N., Mele D. Atrial and ventricular pressures in atrial flutter. Pacing Clin. Electrophysiol. 1999;22:600–604.
- Peyrol M., Sbragia P., Bonello L., Lévy S., Paganelli F. Characteristics of isolated atrial flutter versus atrial flutter combined with atrial fibrillation. Arch. Cardiovasc. Dis. 2011;104:530–535.
- Glover B.M., Chen J., Hong K.L., Boveda S., Baranchuk A., Haugaa K.H., Dorian P., Potpara T.S., Crystal E., Mitchell B., et al. Catheter ablation for atrial flutter: A survey by the European Heart Rhythm Association and Canadian Heart Rhythm Society. Europace. 2017.
- Roberts-Thomson K.C., Kistler P.M., Kalman J.M. Atrial tachycardia: Mechanisms, diagnosis, and management. Curr. Probl. Cardiol. 2005;30:529–543.
- Rubart M., Zipes D.P. Arrhythmias, sudden death and syncope. In: Libby P., Bonow R.O., Mann D.L., Zipes D., editors. Braunwald’s Heart Disease.10th ed. Saunders Elsevier; Philadelphia, PA, USA: 2014. pp. 909–921.
- Rai V., Agrawal D.K. Role of risk stratification and genetics in sudden cardiac death. Can. J. Physiol. Pharmacol. 2016;16:1–14.
- Link M.S., Atkins D.L., Passman R.S., Halperin H.R., Samson R.A., White R.D., Cudnik M.T., Berg M.D., Kudenchuk P.J., Kerber R.E. Part 6: Electrical therapies: Automated external defibrillators, defibrillation, cardioversion, and pacing: 2010 American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation. 2010;122:706–719.
- Soar J., Nolan J.P., Böttiger B.W., Perkins G.D., Lott C., Carli P., Pellis T., Sandroni C., Skrifvars M.B., Smith G.B., et al. European Resuscitation Council Guidelines for Resuscitation 2015: Section 3. Adult advanced life support. Resuscitation. 2015;95:100–147.
- Roberts-Thomson K.C., Lau D.H., Sanders P. The diagnosis and management of ventricular arrhythmias. Nat. Rev. Cardiol. 2011;8:311–321.
- Srivathsan K., Ng D.W., Mookadam F. Ventricular tachycardia and ventricular fibrillation. Expert Rev. Cardiovasc. Ther. 2009;7:801–809.
- Priori S.G., Blomström-Lundqvist C., Mazzanti A., Blom N., Borggrefe M., Camm J., Elliott P.M., Fitzsimons D., Hatala R., Hindricks G., et al. 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: The Task Force for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death of the European Society of Cardiology (ESC). Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC) Eur. Heart J. 2015;36:2793–2867.
- Aliot E.M., Stevenson W.G., Almendral-Garrote J.M., Bogun F., Calkins C.H., Delacretaz E., Della Bella P., Hindricks G., Jaïs P., Josephson M.E., et al. EHRA/HRS Expert Consensus on Catheter Ablation of Ventricular Arrhythmias: Developed in a partnership with the European Heart Rhythm Association (EHRA), a Registered Branch of the European Society of Cardiology (ESC), and the Heart Rhythm Society (HRS); in collaboration with the American College of Cardiology (ACC) and the American Heart Association (AHA) Heart Rhythm. 2009;6:886–933.
- Lee G.K., Klarich K.W., Grogan M., Cha Y.M. Premature ventricular contraction-induced cardiomyopathy: A treatable condition. Circ. Arrhythm. Electrophysiol. 2012;5:229–236.
- Komatsu Y., Daly M., Sacher F., Cochet H., Denis A., Derval N., Jesel L., Zellerhoff S., Lim H.S., Jadidi A., et al. Endocardial ablation to eliminate epicardial arrhythmia substrate in scar-related ventricular tachycardia. J. Am. Coll. Cardiol. 2014;63:1416–1426.
- Yamada T., Kay G.N. Optimal ablation strategies for different types of ventricular tachycardias. Nat. Rev. Cardiol. 2012;9:512–525.
- John R.M., Stevenson W.G. Catheter-based ablation for ventricular arrhythmias. Curr. Cardiol. Rep. 2011;13:399–406.
- Mathuria N., Tung R., Shivkumar K. Advances in ablation of ventricular tachycardia in nonischemic cardiomyopathy. Curr. Cardiol. Rep. 2012;14:577–583.
- Tung R., Shivkumar K. Epicardial Ablation of Ventricular Tachycardia. Methodist. Debakey Cardiovasc. J. 2015;11:129–134.
- Cygankiewicz I., Gillespie J., Zareba W., Brown M.W., Goldenberg I., Klein H., Mcnitt S., Polonsky S., Andrews M., Dwyer E.M., et al. Predictors of long-term mortality in Multicenter Automatic Defibrillator Implantation Trial II (MADIT II) patients with implantable cardioverterdefibrillators. Heart Rhythm. 2009;6:468–473. doi: 10.1016/j.hrthm.2008.12.023.
- Solomon S.D., Zelenkofske S., Mcmurray J.J., Finn P.V., Velazquez E., Ertl G., Harsanyi A., Rouleau J.L., Maggioni A., Kober L., et al. Sudden death in patients with myocardial infarction and left ventricular dysfunction, heart failure, or both. N. Engl. J. Med. 2005;352:2581–2588.
- Nieminen T., Verrier R.L. Usefulness of T-wave alternans in sudden death risk stratification and guiding medical therapy. Ann. Noninvasive Electrocardiol. 2010;15:276–288.
- Verrier R.L., Klingenheben T., Malik M., El-Sherif N., Exner D.V., Hohnloser S.H., Ikeda T., Martínez J.P., Narayan S.M., Nieminen T., et al. Microvolt T-wave alternans physiological basis, methods of measurement, and clinical utility—Consensus guideline by International Society for Holter and Noninvasive Electrocardiology. J. Am. Coll. Cardiol. 2011;58:1309–1324. doi: 10.1016/j.jacc.2011.06.029.
- Verrier R.L., Klingenheben T., Malik M., El-Sherif N., Exner D.V., Hohnloser S.H., Ikeda T., Martínez J.P., Narayan S.M., Nieminen T., et al. Microvolt T-wave alternans testing has a role in arrhythmia risk stratification. J. Am. Coll. Cardiol. 2012;59:1572–1573. doi: 10.1016/j.jacc.2012.03.008.
- Graham A.A., Handelsman H. Signal-averaged electrocardiography. Health Technol. Assess. 1998;11:1–15.
- Stein K.M. Noninvasive risk stratification for sudden death: Signal-averaged electrocardiography, non sustained ventricular tachycardia, heart rate variability, baroreflex sensitivity, and QRS duration. Prog. Cardiovasc. Dis. 2008;51:106–117.
- Mancini D.M., Wong K.L., Simson M.B. Prognostic value of an abnormal signal-averaged electrocardiogram in patients with nonischemic congestive cardiomyopathy. Circulation. 1993;87:1083–1092.
- Zipes D.P., Camm A.J., Borggrefe M., Buxton A.E., Chaitman B., Fromer M., Gregoratos G., Klein G., Moss A.J., Myerburg R.J., et al. American College of Cardiology, American Heart Association Task Force, European Society of Cardiology Committee for Practice Guidelines guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: A report of the American College of Cardiology/American Heart Association Task Force and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Develop Guidelines for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death) J. Am. Coll. Cardiol. 2006;48:247–288.
- Singer D.H., Martin G.J., Magid N., Weiss J.S., Schaad J.W., Kehoe R., Zheutlin T., Fintel D.J., Hsieh A.M., Lesch M. Low heart rate variability and sudden cardiac death. J. Electrocardiol. 1988;21:46–55.
- Rovere M.T., Bigger J.T., Jr., Marcus F.I., Mortara A., Schwartz P.J. Baroreflex sensitivity and heart-rate variability in prediction of total cardiac mortality after myocardial infarction. ATRAMI (Autonomic Tone and Reflexes after Myocardial Infarction) Investigators. Lancet. 1998;351:478–484.
- Thomas K.E., Josephson M.E. The role of electrophysiology study in risk stratification of sudden cardiac death. Prog. Cardiovasc. Dis. 2008;51:97–105.
- Gatzoulis K.A., Vouliotis A.I., Tsiachris D., Salourou M., Archontakis S., Dilaveris P., Gialernios T., Arsenos P., Karystinos G., Sideris S., et al. Primary prevention of sudden cardiac death in a non ischemic dilated cardiomyopathy population: Reappraisal of the role of programmed ventricular stimulation. Circ. Arrhythm. Electrophysiol. 2013;6:504–512.
- Vaduganathan M., Patel R.B., Shah S.J., Butler J. Sudden cardiac death in heart failure with preserved ejection fraction: A target for therapy? Heart Fail. Rev. 2016;21:455–462.
- Nahlawi M., Waligora M., Spies S.M., Bonow R.O., Kadish A.H., Goldberger J.J. Left ventricular function during and after right ventricular pacing. J. Am. Coll. Cardiol. 2004;44:1883–1888.
- Dilaveris P., Pantazis A., Giannopoulos G., Synetos A., Gialafos J., Stefanadis C. Upgrade to biventricular pacing in patients with pacing-induced heart failure: Can resynchronization do the trick? Europace. 2006;8:352–357.







