NGUYỄN DƯƠNG KHANG
NGUYỄN THANH HIỀN
Mở đầu
Thuyên tắc phổi (Pulmonary Embolism – PE) gặp trong khoảng 600,000 – 1 triệu người mỗi năm và đứng hàng thứ 3 trong số các nguyên nhân tử vong do tim mạch, với tử suất 1 năm tại Hoa Kỳ là 15% [21]. Khoảng 1/3 số bệnh nhân sau đợt PE cấp tính sẽ tiến triển các triệu chứng giảm gắng sức và khó thở dai dẳng. Tuy vậy, khó thở sau PE vẫn còn chưa được hiểu rõ do các nghiên cứu hồi cứu sử dụng các tiêu chuẩn khác nhau, không đồng nhất và không sử dụng các test chẩn đoán đầy đủ, cũng như thiếu đánh giá triệu chứng trước PE. Vì lý do này, một số chuyên gia còn băn khoăn rằng liệu các triệu chứng sau đợt PE là một thể lâm sàng riêng biệt hay là liên quan với các bệnh lý nền của bệnh nhân.
“Hội chứng sau thuyên tắc phổi” được dùng để mô tả triệu chứng khó thở, giảm gắng sức và suy giảm chất lượng cuộc sống dai dẳng kéo dài > 3 tháng sau khi đã được dùng kháng đông đầy đủ cho đợt PE cấp. Dù vậy, một định nghĩa chuyên biệt, được chấp thuận rộng rãi vẫn chưa được thiết lập. Hội chứng này bao gồm 3 nhóm bệnh nhân: tăng áp phổi do thuyên tắc huyết khối mạn tính (chronic thromboembolic pulmonary hypertension – CTEPH), bệnh lý thuyên tắc huyết khối mạn tính (chronic thromboembolic disease – CTED), hoặc khó thở với giới hạn chức năng sống không có bệnh lý mạch máu phổi được xác định. Tiêu chuẩn này loại ra những bệnh nhân có triệu chứng trước đợt PE cấp, hoặc các triệu chứng giải thích được bằng một chẩn đoán phân biệt không liên quan PE, và những bệnh nhân không triệu chứng có bệnh lý thuyên tắc huyết khối dai dẳng trên hình ảnh học.
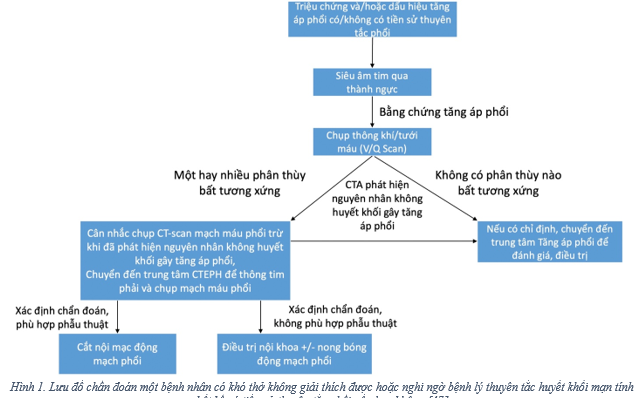
- CTEPH
CTEPH được định nghĩa là áp lực động mạch phổi trung bình >= 25 mmHg với áp lực động mạch phổi bít =< 15 mmHg, bất tương xứng tưới máu trên phim thông khí – tưới máu (VQ scan), và các dấu hiệu đặc hiệu trên chụp mạch máu qua CT nhiều đầu dò, cộng hưởng từ, hoặc chụp mạch máu phổi; dù đã dùng kháng đông hiệu quả ít nhất 3 tháng [16]. CTEPH gặp trong khoảng 3 – 4% số bệnh nhân sau đợt cấp PE đầu tiên, với tần suất hàng năm khoảng 5 trong 1 triệu người [16]. Độ nặng của triệu chứng trải dài từ khó thở nhẹ khi gắng sức cho đến khó thở nặng khi nghỉ. Tất cả những bệnh nhân CTEPH đều cần kháng đông suốt đời. Phẫu thuật lấy huyết khối (PTE) có tiềm năng chữa dứt bệnh và được cân nhắc là trị liệu đầu tay với những bệnh nhân phù hợp. Điều trị dùng thuốc và nong bóng động mạch phổi có thể cải thiện huyết động và triệu chứng ở những bệnh nhân không phù hợp cho phẫu thuật hoặc có tăng áp phổi dai dẳng sau PTE[50].
1.1. Chẩn đoán
Chẩn đoán CTEPH sẽ bao gồm đánh giá mức độ bệnh lý thuyên tắc huyết khối, đánh giá lợi ích về huyết động của việc lấy huyết khối bằng phẫu thuật, khả năng tiếp cận huyết khối qua phẫu thuật, và đánh giá nguy cơ tiền phẫu và hậu phẫu. Hai nhóm bệnh nhân nên được tầm soát CTEPH là: những người có tăng áp phổi không giải thích được và những bệnh nhân tiền sử có PE và hiện có suy chức năng thất Phải sau 6 tháng dùng kháng đông. Ở những bệnh nhân có tăng áp phổi không giải thích được, việc đánh giá đầy đủ CTEPH là tối quan trọng vì phẫu thuật có thể chữa khỏi bệnh, khác với những loại tăng áp phổi khác. Những bệnh nhân PE cấp và suy thất Phải nên được siêu âm tim kiểm tra sau 6 – 12 tuần dùng kháng đông để xem liệu mPAP đã về bình thường hay chưa [71]. Tuy vậy, suy chức năng thất Phải không phải luôn luôn gặp trong giai đoạn sau thuyên tắc. Do đó cũng cần sự hỗ trợ của các công cụ chẩn đoán khác.
Phân biệt CTEPH và PE tái phát còn là thách thức vì các yếu tố nguy cơ là như nhau. Điều quan trọng cần lưu ý là những bệnh nhân CTEPH sẽ không đáp ứng với kháng đông sau 6 tháng và biểu hiện tăng nặng triệu chứng suy chức năng thất Phải và tăng áp phổi. Những bệnh nhân có PE tái phát thường có khó thở cấp tính, đau ngực và mệt mỏi. Đánh giá kỹ lưỡng triệu chứng lâm sàng và các yếu tố nguy cơ có thể giúp xác định công cụ nào hữu ích nhất để chẩn đoán chính xác CTEPH.
- Siêu âm tim
Siêu âm tim qua thành ngực là một trong những cận lâm sàng nên được dùng để xác định bất thường vận động vùng thất Phải và sự hiện diện của tăng áp lực mạch máu phổi ở những bệnh nhân nghi ngờ CTEPH. Siêu âm tim thường quy trong vòng 6 tháng sau PE cấp có thể giúp xác định bệnh nhân có nguy cơ cao của CTEPH [11].
Tuy vậy, dù siêu âm Doppler tim có độ nhạy cao trong phát hiện rối loạn vận động vùng và tăng áp phổi thì nó lại không đặc hiệu trong chẩn đoán CTEPH. Các dấu hiệu thường thấy trên siêu âm tim ở bệnh nhân CTEPH gồm phì đại thất Phải, lớn cả nhĩ Phải và thất Phải, giảm chức năng tâm thu, hở van 3 lá, và lệch vách liên thất về phía thất Trái do quá tải thế tích thất Phải [52]. Hạn chế của siêu âm tim trong đánh giá độ nặng ở bệnh nhân CTEPH là kém chính xác trong đánh giá công thất Phải, phân suất tống máu thất Phải, và chức năng thất Phải nói chung, đặc biệt ở những bệnh nhân có cửa sổ siêu âm kém.
- Phim thông khí tưới máu
Phim V/Q là một trong những công cụ được dùng rộng rãi nhất và có độ nhạy cao nhất trong phát hiện CTEPH. Mặc dù đã có những tiến bộ trong CT và MRI thì phim V/Q vẫn là công cụ tầm soát được ưa chuộng trong chẩn đoán CTEPH. Phim V/Q là một kỹ thuật hình ảnh được dùng để phân biệt giữa CTEPH và các nguyên nhân gây tăng áp phổi khác bằng cách phát hiện những khiếm khuyết trong tưới máu. Một phim V/Q bình thường có thể được dùng để loại trừ CTEPH. Phim V/Q khi so sánh với CTPA thì có lợi thế ở điểm ít phơi nhiễm tia X hơn và tránh các biến chứng có thể có từ việc dùng cản quang đường tĩnh mạch [15]. Trong một nghiên cứu gồm 227 bệnh nhân nghi ngờ CTEPH, phim V/Q có độ nhạy 96 – 97.4% và độ đặc hiệu 90 – 95%; trong khi đó CTPA có độ nhạy và độ đặc hiệu lần lượt là 51% và 99% [69]. Phim V/Q không xác định được về mặt giải phẫu mức độ lan rộng của bệnh, và do đó không thể sử dụng để xác định liệu sang thương đó có thể phẫu thuật được hay không. Lợi ích của phim V/Q nằm ở điểm dễ dàng phân tích kết quả (hoặc bình thường hoặc bất thường), từ đó làm cho phương tiện này là phương tiện tầm soát được ưa chuộng trong đánh giá bệnh nhân CTEPH.
- Chụp mạch máu phổi qua catheter
Chụp mạch máu phổi xóa nền qua catheter là tiêu chuẩn vàng để xác định chẩn đoán CTEPH. Kỹ thuật này có thể giúp quan sát rõ ràng giường mạch máu phổi với khả năng đánh giá huyết động chính xác qua thông tim Phải. Mặc dù thuốc cản quang sẽ đưa đến nguy cơ tổn thương thận và phản vệ ở một số bệnh nhân thì lượng cản quang được dùng có thể được hạn chế tối đa dựa vào cung lượng tim của từng người bệnh. Khi so sánh với PE cấp, 5 dấu hiệu trên chụp mạch gợi ý chẩn đoán CTEPH là: khuyết thuốc, mạng mạch và dải động mạch phổi, bất thường lớp nội mạc, cắt cụt mạch máu, và tắc mạch thùy hay phân thùy tại nơi xuất phát [3]. Ở đa số bệnh nhân CTEPH đều có từ 2 dấu hiệu bất thường kể trên trở lên [50]. Lợi ích của chụp mạch máu phổi xóa nền qua catheter là phương tiện chẩn đoán này đưa đến cách đánh giá tiền phẫu, chính xác vị trí huyết khối và khả năng phẫu thuật.
Thông tim Phải đánh giá huyết động nên được tiến hành cùng thời điểm chụp mạch máu phổi để đánh giá độ nặng của tăng áp phổi, và thử nghiệm đáp ứng với việc dùng dãn mạch. mPAP giảm sau hít NO có thể là chỉ điểm sống còn dài hạn ở những bệnh nhân CTEPH sau PTE [63]. Phân biệt giữa tăng áp lực động mạch phổi do PAH có trước đó với tăng áp lực do PE cấp vẫn còn là một thách thức với các nhà tim mạch học. Sự thay đổi dần dần của triệu chứng và mPAP thường là dấu hiệu của bệnh lý mạn tính. PAH gặp khi gắng sức nhưng không ghi nhận lúc nghỉ có thể là một dấu hiệu sớm của bệnh lý thuyên tắc huyết khối mạn tính [34]. Ở những bệnh nhân nghi ngờ CTEPH nhưng có tăng áp phổi chỉ ở mức độ nhẹ trên thông tim Phải nên được đo lại sau khi thực hiện gắng sức ngắn. Gắng sức có thể gây tăng không đồng bộ mPAP ở những bệnh nhân CTEPH do mất sự trương dãn bù trừ của động mạch phổi.
- CTPA (CHụp mạch máu phổi bằng CT)
CTPA có một số lợi ích vượt trội hơn chụp mạch máu phổi thông thường qua catheter. CTPA là một công cụ tầm soát không xâm lấn giúp tránh việc phải tiếp cận đường mạch máu qua catheter. Hơn nữa, với những tiến bộ trong kỹ thuật CT, CTPA có thể cho kết quả những hình ảnh có độ phân giải cao tập trung vào độ dày thành mạch máu phổi và các thông tin về các cấu trúc xung quanh mà không thể khảo sát được bằng chụp mạch máu thông thường [37]. Hình ảnh CT cũng được dùng để tầm soát các bệnh lý trung thất nền tảng và giúp ghi nhận hình ảnh mạch máu và các nhánh bàng hệ động mạch phế quản mà các dạng chụp mạch máu không phải lúc nào cũng thấy được [5]. Khi so sánh với phim V/Q, CTPA có giới hạn ở độ nhạy trong phát hiện CTEPH chỉ là 51% so với độ nhạy của V/Q là > 96% [69]. Do vậy, CTPA được sử dụng tốt nhất ở những trung tâm có thể phẫu thuật để phát hiện CTEPH ở những mạch máu có thể tiếp cận để phẫu thuật. CTPA cũng có lợi trong phát hiện bệnh lý thuyên tắc huyết khối động mạch phổi đoạn gần. Tuy vậy, CTPA có thể không phát hiện được các huyết khối ở đoạn động mạch phổi xa. So với tiêu chuẩn vàng trong chẩn đoán CTEPH là chụp mạch máu phổi kỹ thuật số xóa nền (PDSA) thì độ nhạy và độ đặc hiệu của CTPA trong phát hiện CTEPH ở nhánh mạch máu chính/thùy lần lượt là 97.0% và 97.1% [66]. CTPA đa đầu dò chất lượng cao có thể là phương pháp thay thế cho chụp mạch máu phổi truyền thống ở những trung tâm có kinh nghiệm về CTEPH. Với những tiến bộ trong hình ảnh học CT thì vai trò của CTPA trong tầm soát CTEPH có thể sẽ tăng lên trong tương lai.
- Đánh giá chức năng
Đánh giá gắng sức tim phổi (CPX) là một công cụ không xâm lấn giúp đánh giá chức năng tim – hô hấp, bao gồm thông khó thở ra, carbon dioxide thở ra và oxy hít vao, cùng với ECG và đo huyết áp. Những bệnh nhân CTEPH thường sẽ có giảm oxy máu nặng lên khi gắng sức. Đây là hậu quả của tình trạng bất tương xứng thông khí/tưới máu và đáp ứng cung lượng tim không đầy đủ khi gắng sức. Do đó, ở những bệnh nhân CTEPH, CPX thường bất thường với kết quả ghi nhận là giảm oxy máu tĩnh mạch trộn và giảm VO2 đỉnh [28]. Ở một số bệnh nhân có siêu âm tim khi nghỉ bình thường sau PE, CPX có thể là một test giúp đánh giá thêm mức độ ảnh hưởng trên tim phổi và thông khí khoảng chết. Trong một nghiên cứu gồm 42 bệnh nhân CTEPH, có 1 phần 3 có siêu âm tim bình thường nhưng có kết quả CPX bất thường [18]. Những kết quả này cũng tương tự một nghiên cứu trước đây dùng CPX để đánh giá những bệnh nhân có triệu chứng mà kết quả siêu âm tim bình thường. Và một lần nữa, kết quả khoảng 1 phần 3 số bệnh nhân có kết quả siêu âm tim bình thường thì có CPX bất thường, và khoảng 25% trong số này có bất thường tưới máu phổi trên phim V/Q [19]. Các kết quả này gợi ý rằng CPX là một công cụ bổ trợ hữu hiệu để chẩn đoán CTEPH, nhưng phải tiến hành sau V/Q hoặc chụp mạch máu phổi.
Một công cụ bổ trợ khác có thể giúp đánh giá bệnh nhân CTEPH là nghiệm pháp đi bộ 6 phút (6MWT). 6MWT có giá trị chẩn đoán nhất định trong những bệnh nhân CTEPH vì đã được chứng minh là thể hiện được độ nặng về mặt lâm sàng và huyết động [55]. Ở một số trung tâm, 6MWT được thực hiện thường quy trước và sau PTE, và quãng đường đi bộ 6 phút được dùng để đánh giá tiên lượng và đáp ứng với điều trị. Trong một nghiên cứu tiến cứu gồm 116 bệnh nhân, các chỉ số mPAP, kháng lực mạch máu phổi (PVR), tần số tim, VO2 đỉnh và quãng đường đi bộ 6 phút được ghi nhận ở 37 bệnh nhân trước và sau PTE. Tần số tim nền thay đổi trong khi tiến hành 6MWT có liên quan có ý nghĩa thống kê với PVR 1 năm sau PTE, và phân tích đa biến cho thấy mối liên quan giữa % dự trữ tần số tim (Heart Rate Reserve – HRR) trong 6MWT với tăng áp phổi tồn dư [56].
- Chụp cộng hưởng từ
MRI hiện không được khuyến cáo là công cụ tầm soát CTEPH ở những bệnh nhân tăng áp phổi. Trong nhiều năm qua, MRI truyền thống đã phát triển thành một công cụ hình ảnh học có thể đánh giá được cả giường mạch máu phổi và chức năng sống của tim. MRI tim có thể đo lường khối lượng, thể tích nhát bóp và phân suất tống máu với độ chính xác tương đối cao; và hiện đã được sử dụng để đánh giá suy chức năng thất Phải và công thất Phải [44]. Những tiến bộ gần đây trong kỹ thuật cộng hưởng từ bao gồm chụp dòng chảy 4D có thể định vị cả hướng và tốc độ dòng máu. Phân tích sự thay đổi dòng máu trong động mạch phổi gần đây đã cho thấy dòng máu động mạch phổi bình thường qua phim MRI 4D ở một bệnh nhân bị CTEPH sau PTE [46]. Tuy vậy, vai trò của MRI 4D trong tầm soát phát hiện CTEPH vẫn còn chưa được nghiên cứu rộng rãi. Cũng như vậy, việc dùng MRI tưới máu phổi có 3D cản quang trong chẩn đoán CTEPH còn hạn chế. Trong một nghiên cứu gồm 132 bệnh nhân từ dữ liệu ASPIRE, chụp MR tưới máu có độ nhạy 97% và độ đặc hiệu 92% trong chẩn đoán CTEPH, so với CTPA có độ nhạy 94% và độ đặc hiệu 98% [53].
1.2. Điều trị
- Phẫu thuật
Phẫu thuật là trị liệu triệt để duy nhất cho CTEPH. Tiêu chuẩn vàng trong điều trị bệnh nhân CTEPH có huyết khối có thể tiếp cận phẫu thuật được là PTE. Tuy vậy phải đánh giá khả năng phẫu thuật trước khi tiến hành. Với những tiến bộ trong dùng thuốc trúng đích và nong bóng động mạch phổi (BPA), vai trò của phẫu thuật như PTE đang giảm xuống so với trước đây. Dù vậy, PTE vẫn là phương thức điều trị nền tảng những bệnh nhân CTEPH có thể phẫu thuật vì làm giảm tỉ lệ tử vong với kết cục tốt và cải thiện huyết động, nhất là khi được tiến hành tại các trung tâm có kinh nghiệm.
Đánh giá tiền phẫu nên gồm có: xác định vị trí huyết khối, mức độ tắc nghẽn mạch máu, tình trạng huyết động hiện tại của bệnh nhân, và ảnh hưởng của bệnh lý nền của bệnh nhân trên nguy cơ phẫu thuật [4]. Cụ thể, những bệnh nhân có tăng áp phổi nặng và những người có suy tim Phải mất bù do CTEPH sẽ có nguy cơ cao có kết cục phẫu thuật không tốt [40]. Một bệnh nhân có bệnh phổi tắc nghẽn hay hạn chế nặng nền tảng sẽ không phù hợp để PTE vì tái tưới máu nhu mô phổi trong trường hợp này sẽ cải thiện triệu chứng của bệnh nhân một cách rất giới hạn. Chống chỉ định trực tiếp PTE bao gồm bệnh lý mạch máu nhỏ với kháng lực mạch máu phổi không tương đồng mức độ tắc nghẽn, giảm PVR hậu phẫu dự kiến < 50%, và nguy cơ quanh phẫu thuật cao. Dù tuổi cao không phải là chống chỉ định của phẫu thuật thì một nghiên cứu tiền cứu cho thấy cả thời gian nằm viện và thời gian trong ICU đều cao hơn ở những bệnh nhân > 70 tuổi với tử suất nội viện là 4,6% ở nhóm < 70 tuổi và là 7,8% ở nhóm > 70 tuổi [7].
Đánh giá tiền phẫu còn bao gồm đánh giá trên hình ảnh học về mức độ nặng của bệnh bên cạnh việc đánh giá về huyết động. Việc ứng dụng các phương tiện hình ảnh như CTPA và siêu âm tim trong đánh giá độ nặng của bệnh và ảnh hưởng trên huyết động chủ yếu dựa trên các kinh nghiệm lâm sàng. RHC với chụp động mạch phổi không chỉ cho phép thấy được huyết khối mà còn giúp đo lường mPAP và PVR. Trị số PVR < 1000 – 1200 dyn/s/cm-5 là một dấu hiệu của kết cục hậu phẫu tốt [9]. Trong một nghiên cứu đơn trung tâm ở hơn 2700 bệnh nhân, nhóm San Diego báo cáo tỉ lệ tử vong chu phẫu chung là 2,2%; với tử suất ở nhóm bệnh nhân có PVR tiền phẫu > 1000 dyn/s/cm-5là 4,1% và nhóm PVR < 1000 dyn/s/cm-5là 1,6% [39]. Trong một nghiên cứu tương tự khác, tử suất nội viện chung sau PTE là 4% ở nhóm bệnh nhân có PVR tiền phẫu > 1200 dyn/s/cm-5 và suy tim Phải mất bù [12]. Mặc dù một số trung tâm có báo cáo tỉ lệ tử vong cao ở nhóm bệnh nhân PVR > 1000 – 1200 dyn/s/cm-5 thì giá trị này không phải là một chống chỉ định trực tiếp của PTE. Một nỗ lực để làm giảm PVR tiền phẫu là dùng thuốc dãn mạch. Khi so sánh đáp ứng ngắn hạn với hít NO, việc dùng lâu dài dãn mạch như bosentan hay sildenafil cho thấy không có lợi ích trong dự đoán tình trạng huyết động hậu phẫu hay kết cục hậu phẫu sau PTE [24].
PTE sẽ gồm có mở xương ức, chạy tim phổi nhân tạo và hạ thân nhiệt sâu với ngừng tim ngắt quãng [38]. Mở ngực sẽ giúp tiếp cận các động mạch phổi, lấy bỏ hoàn toàn các huyết khối mạn tính, và tránh ảnh hưởng dòng chảy của bàng hệ động mạch phế quản. Bóc tách các động mạch phổi xảy ra trong màng ngoài tim mà không cần vào đến khoang màng phổi. Chạy tim phổi nhân tạo với ngừng tim tạm thời (giới hạn trong khoảng 20 phút) được tiến hành để có thể lấy huyết khối từ mạch máu phổi và để quan sát rõ hơn phẫu trường. Về lý thuyết, mục đích của việc ngừng tuần hoàn hạ thân nhiệt sâu là để giảm PVR. Gần đây, có những cách tiếp cận thay thế đã được triển khai để làm giảm các biến chứng về thần kinh của việc ngừng tim và hạ thân nhiệt. Những kỹ thuật thay thế này dùng hạ thân nhiệt trung bình thay vì sâu, tưới máu động mạch não hai bên có và không có ngừng tuần hoàn toàn bộ, và tắc thông chủ – phổi bằng bóng [27, 41]. Dù đã có nhiều nghiên cứu thì vẫn chưa có phương pháp nào được chứng minh là tốt hơn phẫu thuật PTE truyền thống.
Những bệnh nhân được PTE có thể có 2 biến chứng lớn có thể ảnh hưởng trên trao đổi khí. Hội chứng cướp máu động mạch phổi, tức tái phân bố dòng máu động mạch phổi hậu phẫu đến các phần phổi mới được thông thoáng sẽ gây ra bất tương xứng V/Q. Biến chứng này có thể gặp trong đến 70% số bệnh nhân được lấy huyết khối [45]. Điều trị trường hợp này là điều trị nâng đỡ và tình trạng này sẽ cải thiện ở đau số bệnh nhân mà không cần thở oxy hỗ trợ trong khoảng 2 tuần sau khi xuất viện [43]. Phù phổi tái tưới máu là một biến chứng khác có thể gặp trong 30% số bệnh nhân sau PTE, biểu hiện bằng dịch tích tụ ở các vùng phổi được lấy huyết khối đoạn gần [36]. Biến chứng này có thể gặp trong 72 giờ sau phẫu thuật với nhiều mức độ và điều trị tình trạng này chủ yếu là điều trị nâng đỡ. Thời gian nằm ICU trung bình do biến chứng phù phổi tái tưới máu là 4 ngày với thời gian nằm viện hậu phẫu là 14 ngày [35]. Phù phổi tái tưới máu và hội chứng cướp máu động mạch phổi có thể xảy ra đồng thời. Trong tình huống này, có thể có hạ oxy máu nặng và cần đến chạy hỗ trợ tuần hoàn ngoài cơ thể (ECMO) để nâng đỡ bệnh nhân. ECMO tĩnh-động là cần thiết trong một số trường hợp huyết động không ổn định, còn ECMO tĩnh-tĩnh thì có hiệu quả ở những bệnh nhân có tổn thương tái tưới máu là chính [20]. Ở những bệnh nhân có suy thất Phải, ECMO là một công cụ hỗ trợ tuần hoàn với thời gian điều trị trung bình là 5 ngày với tỉ lệ sống còn được báo cáo lên đến 57% [8].
Những báo cáo gần đây cho thấy tử suất nội viện của PTE là 2,2% trong một series đơn trung tâm tại Hoa Kỳ [39] và 4,7% ở nhiều trung tâm phẫu thuật của Châu Âu [40]. Tiên lượng dài hạn sau PTE vẫn tốt khi so sánh với điều trị nội khoa đơn thuần. Trong một nghiên cứu tiến cứu 679 bệnh nhân, tỉ lệ sóng còn 3 năm ước tính ở những bệnh nhân được phẫu thuật là 89% (95% CI, 86-92) và ở những người không phẫu thuật chỉ là 70% (95% CI, 64-76) [13]. Hơn nữa, cũng đã có bằng chứng cho thấy ở cả nhóm phẫu thuật và không phẫu thuật thì điều trị nội khoa nhắm vào PAH cũng không ảnh hưởng đáng kể đến tỉ lệ sống còn. Những nghiên cứu gần đây tại Châu Âu cho thấy tỉ lệ sống còn 5 năm là khoàng 90% [61].
Trong thời gian hậu phẫu, cải thiện về mặt huyết động sẽ giúp hồi phục tình trạng tái cấu trúc thất Phải, từ đó đưa đến hồi phục cả chức năng tâm thu và tâm trương thất Phải. Trong một nghiên cứu hồi cứu 72 bệnh nhân, sự hồi phục tái cấu trúc thất Phải được ghi nhận sau 3 tháng ở những bệnh nhân được PTE [6]. Sự cải thiện về tình trạng huyết động hậu phẫu cũng được ghi nhận qua đánh giá chức năng sống: cả quãng đường đi bộ 6 phút và phân độ chức năng NYHA cũng cải thiện đáng kể sau PTE và những tác động có lợi này còn tiếp tục được ghi nhận nhiều năm sau phẫu thuật [10].
Tuy vậy, không phải bệnh nhân nào cũng sẽ cải thiện huyết động lâu dài sau PTE. Những tác dụng phụ muộn của PTE bao gồm tăng tồn dư mPAP và tăng áp phổi tái phát đã được ghi nhận ở những bệnh nhân Có cải thiện ban đầu sau PTE. Ước tính tăng áp phổi tồn dư gặp khoảng 5 – 35% số bệnh nhân sau PTE [9]. Giảm PVR hậu phẫu ít nhất 50% xuống còn < 500 dyn/s/cm-5 đưa đến kết cục tốt hơn. Trong một nghiên cứu ở 500 bệnh nhân, những người có PVR > 500 dyn/s/cm-5 có tử suất nội viện là 10.3% so với 0.9% ở những người có PVR < 500 dyn/s/cm-5[39]. Cần có thêm những nghiên cứu dài hạn để xác định mức độ nào của tăng áp phổi tồn dư sẽ ảnh hưởng xấu lên chức năng sống của bệnh nhân sau phẫu thuật. Những người có tăng áp phổi tái phát với suy chức năng kéo dài có thể có lợi từ việc điều trị dùng thuốc.
- Nong bóng động mạch phổi (PTPA)
b.1. Chỉ định
Đa số các trung tâm sử dụng các chỉ định sau để PTPA: 1) CTEPH không thể phẫu thuật được vì tuổi cao, nhiều bệnh lý nền, và tổn thương ngoại biên không điều trị bằng PEA được theo đánh giá của một nhóm chuyên gia (bao gồm chuyên gia PEA, 2) CTEPH có triệu chứng (NYHA II trở lên), áp lực động mạch phổi trung bình (mPAP) >= 25 – 30 mmHg, hoặc kháng lực mạch máu phổi (PVR) > 300 dynes/cm5, 3) hẹp phổi do hẹp mạch máu phổi ngoại biên, hội chứng viêm mạch động mạch chủ và các bệnh lý khác [72], 4) không có chống chỉ định như bệnh lý thận hay dị ứng với cản quang [2], [65], [29]. Tuy vậy, nếu những trung tâm thực hiện được PTPA với tỉ lệ biến chứng rất thấp thì những tiêu chí này hiện được mở rộng ra các bệnh nhân có những triệu chứng nhất định hay giảm oxy máu không có tăng áp phổi.
b.2. Kỹ thuật
Hình ảnh sang thương CTEPH được quan sát rõ trên OCT (optical coherence tomography) [25]. OCT 3 chiều cho hình ảnh flap và meshwork[64] và nhiều sợi với cấu trúc giống tổ ong [60], [59].Sang thương được chia thành nhiều loại dựa trên hình thái: hẹp kiểu vòng nhẫn, lưới và vòng, cắt cụt và tắc hoàn toàn [4], [67]. Sang thương dạng lưới và vòng thường không được phát hiện vì không thấy hẹp rõ rệt [67]. Do đó, độ chính xác trong xác định bất thường trên chụp mạch máu phổi là vấn đề chính yếu đầu tiên của PTPA. Khác với hẹp mạch vành, sang thương lưới và vòng trên chụp mạch phổi hiện ra rất mờ ảo trên chụp mạch phổi chọn lọc. Đã có nhiều phương thức được sử dụng để giải quyết vấn đề này. Đầu tiên là xác định dòng chảy động mạch và tĩnh mạch phổi, trong đó dòng động mạch phổi bị chậm dòng (grade 1) hoặc dòng tĩnh mạch phổi bị chậm dòng (grade 3) khi có sang thương [22]. Dây áp lực sẽ có ích trong trường hợp này vì sẽ dễ đo áp lực đầu xa vượt qua sang thương mà không phải đánh giá chủ quan vận tốc dòng máu.Dây áp lực cũng được thiết kế để quyết định khi nào dừng nong bóng [22], [58]. Một công cụ quan trọng khác để xác định sang thương trước khi điều trị là CT. CT có thể giúp dự đoán vị trí xuất hiện sang thương dạng lưới và vòng [67].
Vị trí mạch máu được tiếp cận thương xuyên nhất là tĩnh mạch đùi, sau đó là tĩnh mạch cảnh trong [2], [65], [42]. Tĩnh mạch đùi được ưa chuộng hơn vì ít đau hơn, tránh phơi nhiễm không cần thiết với tia xạ, đường vào ổn dịnh hơn và dễ đi dây hơn; nhưng lại kém ưa chuộng hơn trong việc đưa catheter vào mạch máu đích. Một sheath dài khoảng 7 – 9F (Bright Tip Sheath Introducer; Cordis/Johnson & Johnson, New Brunswick, NJ, hay Supre Arrow-Flex Sheath; Teleflex, Ireland) được đưa vào động mạch phổi thùy để dẫn đường cho catheter. Guidewire dùng để dẫn đường cho bóng là dây ưa nước 0,014 inch, cũng là dụng cụ thường dùng trong can thiệp mạch vành qua da (PCI). Một microcatheter khác được dùng để đưa qua guidewire vượt sang thương. Kỹ thuật PTPA gần như tương tự PCI, bao gồm đưa bóng qua guidewire và nong bóng tại nơi huyết khối tổ chức hóa dày nhất. Áp lực và thời gian nong bóng gần như tương tự PCI. Stent thường không cần dùng vì hiếm gặp tắc cấp tính của động mạch phổi; nhưng nếu thủng mạch máu phổi thì cần phải dùng đến bóng quá cỡ [42], [29].
Khi bất thường huyết động học mạch máu phổi nặng nề thì nên tối thiểu nhất có thể các nhánh động mạch cần điều trị; cũng như hạn chế điều trị các nhánh cùng thùy hoặc cùng bên để tránh phù phổi do tái tưới máu. Để tránh phù phổi ở một vùng tái tưới máu nhất định của động mạch phổi, điều quan trọng là cần chọn lựa kích cỡ bóng nhỏ hơn tương đối so với kích thước mạch máu đo được [22]. Đây là điểm tiến bộ của PTPA, khiến PTPA là một kỹ thuật an toàn trong điều trị CTPEH vì giúp giảm đi 1 trong 2 biến chứng quan trọng nhất (phù phổi tái tưới máu và tổn thương phổi do điều trị). Nong bóng nhiều lần có thể và nên được thực hiện trong vòng 1 tuần sau khi dùng cản quang lượng nhiều cũng như tổn thương mạch máu do đi catheter trước đó [42], [29]. Khi bất thường huyết động học mạch máu phổi không nặng nề, như mPAP < 35 mmHg, việc ngưng thủ thuật nong bóng được xác định qua thời gian phơi nhiễm với tia X hoặc lượng cản quang mà không giới hạn số lượng nhánh mạch máu phổi đã được can thiệp.
Thành mạch máu phổi mỏng hơn thành mạch hệ thống nên cần đưa guidewire nhẹ nhàng và cẩn thận để tránh thủng hay tổn thương mạch máu phổi. Do vậy, phẫu thuật này cần được thực hiện ở trung tâm có kinh nghiệm. Cũng vì lý do tương tự mà bóng có kích thước tương đối lớn hơn mạch máu phổi không nên dùng, ngay cả khi không nong được hiệu quả. Trong các trường hợp này, huyết khối cấu trúc hóa sẽ nằm chặt trong cấu trúc dạng lưới của huyết khối và khó vỡ hơn [23].
b.3. Quản lý sau thủ thuật
Coumadin thường được dùng làm kháng đông lâu dài trong CTEPH. Gần đây, coumadin được ngưng dùng và chuyển sang heparin để có thể dễ dàng đảo ngược hoạt tính kháng đông trong trường hợp tổn thương mạch máu hay ho ra máu[2], [65], [29].Tuy nhiên, ở một số trung tâm khác, coumadin vẫn được dùng tiếp tục để tránh các huyết khối mới thành lập [42]. Các cách điều trị khác gồm prednisone thường quy hoặc thông khí áp lực dương không xâm lấn để giảm biến chứng phù phổi cấp có thể xảy ra thường không được khuyến cáo.
- Điều trị dùng thuốc
Thuốc được dùng phổ biến nhất trong CTEPH gồm kháng đông, lợi tiểu và hỗ trợ oxy. Kháng đông được chỉ định ở đa số bệnh nhân CTEPH để ngăn ngừa VTE tái phát. Kháng đông lâu dài với kháng vitamin K mục tiêu INR = 2 – 3 cũng được khuyến cáo, và hiện nay không có khuyến cáo vào về việc dùng NOAC trong CTEPH. Mặc dù nhiều nghiên cứu đã chứng minh rằng kháng đông kéo dài làm giảm nguy cơ VTE tái phát ở những bệnh nhân PE không kích gợi hay tự phát [30, 57] thì vẫn còn thiếu dữ liệu để sử dụng rộng rãi kháng đông lâu dài trong CTEPH.
Vai trò của điều trị dùng thuốc trong CTEPH ngày càng tăng lên khi có nhiều nghiên cứu về điều trị trúng đích PAH được báo cáo. Thuốc dãn mạch phổi và tái cấu trúc làm giảm PVR và mPAP, từ đó cải thiện khả năng gắng sức và oxy hóa máu. Do vậy, các thuốc dãn mạch phổi nên được cân nhắc sử dụng ở những bệnh nhân CTEPH không thể phẫu thuật hoặc ở những người có PAH kéo dài sau PTE. Các thuốc trúng đích PAH không được khuyến cáo sử dụng ở những bệnh nhân CTEPH có thể phẫu thuật.
Thuốc dùng trong CTEPH tương tự như trong PAH vô căn, bao gồm: prostanoids, đối kháng thụ thể endothelin, ức chế phosphodiesterase-5, và kích thích guanylate cyclase. Cũng giống như PAH, nồng độ endothelin-1 trong máu tương quan chặt chẽ với độ nặng của bệnh và tình trạng huyết động ở những bệnh nhân CTEPH [54]. Hơn nữa, đặc tính về mô bệnh học của các động mạch đoạn xa của bệnh nhân CTEPH tương đồng như ở những bệnh nhân PAH vô căn [43].
- CTED
Những bệnh nhân CTED có dấu hiệu trên hình ảnh học tương tự như những bệnh nhân CTEPH và cũng có giảm khả năng gắng sức, nhưng không đủ tiêu chuẩn về huyết động học khi nghỉ để xếp vào nhóm PH [31].
Các test chức năng tim phổi (Cardiopulmonary exercise testing – CPET) cho kết quả hạn chế gắng sức tương đồng với bệnh lý mạch máu phổi: giảm khả năng gắng sức (tiêu thụ oxy đỉnh Vo2peak), tăng thông khí khoảng chết, thông khí không hiệu quả (tăng độ dốc thông khí phút/sản xuất CO2), và giảm Oxy trong mạch đập (tức giảm thể tích nhát bóp) [17]. Những bệnh nhân CTED thường có khả năng gắng sức còn bảo tồn so với những người CTEPH, và những bệnh nhân này thường không tiến triển suy tim phải [68]. Thông tim phải (RHC) có thể biểu hiện hoặc các thông số huyết động khi nghỉ bình thường hoặc tăng áp phổi ở mức rìa (mPA 20 – 24 mmHg với kháng lực mạch máu phổi 2 – 3 đơn vị Wood). Khi gắng sức, có sự tăng độ dốc mPA/cung lượng tim, tăng đáng kể mPA lên đến hơn 30 – 35 mmHg và kháng lực mạch máu phổi không giảm hoặc giảm không tương xứng [17].
Tần suất của CTED là chưa rõ. Y văn cho thấy CTED thường không tiến triển thành CTEPH, do đó không có bằng chứng để hướng dẫn cách theo dõi những bệnh nhân này [68]. Quan trọng hơn là chúng ta không có những nghiên cứu về cách điều trị những bệnh nhân này. Những dữ liệu từ các trung tâm PTE lớn gợi ý rằng phẫu thuật có thể có lợi trong cải thiện huyết động, khả năng gắng sức và phân loại chức năng [17, 68]. Nong bóng động mạch phổi cũng đã được sử dụng trong một số bệnh nhân nhất định và cải thiện được huyết động cũng như khả năng gắng sức [70]. Cũng như CTEPH, kháng đông lâu dài được khuyến cáo ở tất cả bệnh nhân CTED, và tập luyện thể lực cũng đóng một vai trò quan trọng trong điều trị bệnh nhân CTED và CTEPH [14].
- Khó thở sau PE
Mặc dù một phần nhỏ số bệnh nhân PE cấp sẽ tiến triển CTED hoặc CTEPH, thì triệu chứng khó thở dai dẳng và hạn chế khả năng chức năng sau khi được điều trị vẫn là một vấn đề khá phổ biến [62]. Chúng ta có định nghĩa “khó thở sau PE” là triệu chứng khó thở mới hoặc nặng lên, hạn chế khả năng gắng sức mạn tính, và ảnh hưởng chất lượng cuộc sống kéo dài ít nhất 3 tháng sau khi dùng kháng đông hiệu quả cho đợt PE cấp trước đó, và không ghi nhận bằng chứng của bệnh lý mạch máu phổi (như CTED hoặc CTEPH) trên các test chẩn đoán.
Nghiên cứu PEITHO (Pulmonary Embolism Thrombolysis Study) là một thử nghiệm lâm sàng ngẫu nhiên, có nhóm chứng đánh giá tiêu sợi huyết toàn thân ở những bệnh nhân PE nguy cơ trung bình. Nghiên cứu này thu nhận 1006 bệnh nhân và theo dõi dài hạn trung vị 37 tháng với phân nhóm 709 bệnh nhân [33]. Một phần ba số bệnh nhân trong mỗi nhóm ngẫu nhiên (tiêu sợi huyết so với kháng đông đơn độc) có khó thở dai dẳng; trung bình 12% số bệnh nhân xếp vào nhóm NYHA III hoặc IV. Hơn 35% số bệnh nhân mõi nhóm có ít nhất 1 dấu hiệu PH và/hoặc suy chức năng thất Phải trên siêu âm tim [33], nhưng chỉ 2 – 3% số bệnh nhân mỗi nhóm đủ tiêu chuẩn chẩn đoán CTEPH. Mối liên quan giữa khó thở và suy chức năng thất Phải không được đánh giá. Nghiên cứu này gợi ý rằng việc dùng tiêu sợi huyết cho PE cấp nguy cơ trung bình không làm giảm được tần suất của hội chứng sau PE. CPET, RHC và các phương tiện hình ảnh học không được thực hiện thường quy để xác định liệu có bệnh nhân nào trong số này bị CTED hay không. Theo các Hướng dẫn, việc tầm soát CTEPH bao gồm tiến hành các cận lâm sàng ở những bệnh nhân “có triệu chứng và/hoặc dấu hiệu siêu âm tim gợi ý PH”, do vậy có thể nhiều trường hợp CTEPH nhẹ hơn hoặc CTED đã bị bỏ qua.
Kahn và cộng sự [26] đã tiến hành CPET và hình ảnh học hàng loạt trên 100 bệnh nhân sau đợt PE cấp và cho thấy gần một nửa số này có Vo2peak giảm tại thời điểm 1 năm. Gần như tất cả những bệnh nhân có suy giảm V02 cũng có hạn chế vận động thể lực; và 60% số bệnh nhân có hạn chế thể lực có phim tưới máu bình thường. Tình trạng suy giảm chức năng nhưng không có bằng chứng của bệnh mạch máu phổi này cũng được ghi nhận trong một đoàn hệ nhỏ hơn gồm những bệnh nhân sau PE lớn hoặc trung bình, dù phân nửa số bệnh nhân có bất thường chức năng thất Phải trên siêu âm tim [1]. Mặc dù không có nghiên cứu nào đánh giá thường quy THC để chắc chắn loại trừ bệnh mạch máu phổi thì kết quả âm tính trên CPET cũng khiến việc chẩn đoán bệnh mạch máu phổi là rất ít nghĩ đến [17].
Điều quan trọng là cả 2 nghiên cứu này đều không ghi nhận tương quan giữa tắc nghẽn tồn dư trên phim tưới máu hoặc các thông số chức năng thất Phải trên siêu âm tim với suy giảm khả năng gắng sức; điều này càng ủng hộ giả thuyết rằng suy chức năng mạch máu phổi dai dẳng không phải là cơ chế chính gây triệu chứng. Mặc dù tắc nghẽn mạch máu phổi tồn dư (RPVO) sau PE cấp là phổ biến (lên đến khoảng 50% số bệnh nhân) và liên quan với PE không kích gợi, PE tái phát và CTEPH [48, 49] thì RPVO đơn độc không phải là bệnh mạch máu phổi. Giải thích cho sự bất tương xứng này qua việc RPVO thường được đánh giá qua phim V/Q, mà phim V/Q có độ nhạy cao và ghi nhận ngay cả những tắc nghẽn mạch máu mức độ nhỏ mà có thể không có ý nghĩa về lâm sàng hoặc sinh lý. Trong nghiên cứu của Kahn và cộng sự, vào thời điểm 1 năm sau PE cấp, 46% số bệnh nhân có bất thường trên phim tưới máu, nhưng tần suất tắc nghẽn mạch máu trung bình chỉ là 5% ở những bệnh nhân có Vo2peak bình thường hoặc giảm [26].
Những nghiên cứu này cho thấy khó thở dai dẳng và suy chức năng thất Phải mạn tính sau PE cấp khi không có CTEPH cũng tương đồng với nhiều nghiên cứu quan sát trước đó [62]. Do vậy, để phân biệt rõ ràng CTED và khó thở sau PE là một thách thức vì cả 2 nhóm bệnh nhân đều có bất thường tưới máu trên phim V/Q và/hoặc bất thường thất Phải nhẹ trên siêu âm tim. Cả 2 nhóm thường được phân định trong các nghiên cứu lâm sàng bằng giới hạn mạch máu phổi khi gắng sức trên CPET. Cần thêm các cận lâm sàng đánh giá chức năng khác trên những bệnh nhân khó thở sau PE, như MRI tim gắng sức và/hoặc RHC gắng sức, để hiểu rõ hơn liệu những bệnh nhân này có bất thường trên tương hợp RV/mạch máu phổi hoặc các chỉ số mạch máu phổi kín đáo hơn mà chưa được phát hiện ở CPET hay không.
Một điểm hạn chế trong các nghiên cứu về sinh lý ở các bệnh nhân sau PE đó là họ loại phần lớn những bệnh nhân có bệnh tim phổi đáng kể trước đó, và do vậy có lẽ không thể hiện được “thế giới thực” khi số bệnh nhân PE cấp có bệnh nền chiếm một phần không nhỏ. Klok và cộng sự [32] ghi nhận ít nhất 1 bệnh nền trong 185/189 bệnh nhân có khó thở sau PE cấp, mặc dù 60% số bệnh nhân này không có khó thở trước đây; và các tác giả cũng không thể xác định liệu có phải bệnh nền mới là nguyên nhân chính gây khó thở hay không. Hay phức tạp hơn nữa, là bệnh nền và tình trạng suy giảm chức năng liên quan với PE cấp đã cùng đưa đến triệu chứng khó thở ở các bệnh nhân này.
Hiện chưa có điều trị thống nhất nào cho hội chứng khó thở sau PE. Mặc dù suy giảm chức năng có thể là cơ chế chính gây triệu chứng thì vẫn chưa có nghiên cứu ngẫu nhiên nào đánh giá hiệu quả của tập luyện thể lực sau PE cấp. Các nghiên cứu về phục hồi chức năng hô hấp cho những bệnh nhân có khó thở sau PE cấp hiện đang được tiến hành (ID: NCT03405480).
- Tiếp cận bệnh nhân khó thở dai dẳng sau PE cấp
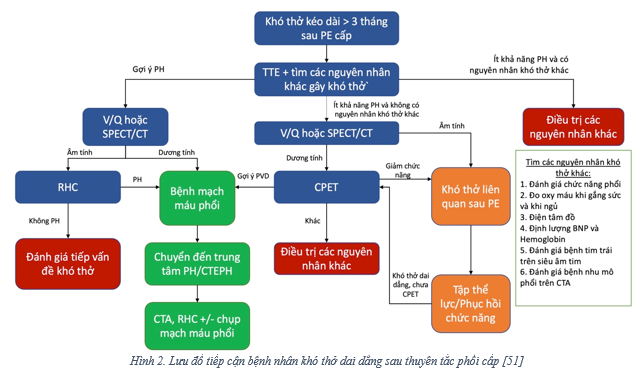
Đánh giá một bệnh nhân nghi ngờ bị hội chứng sau PE nên được bắt đầu sau khi bệnh nhân đã kết thúc ít nhất 3 tháng dùng kháng đông hiệu quả [21, 31]. Những bệnh nhân than phiền khó thở sau 3 tháng điều trị PE cần được tiến hành xác định chẩn đoán (Lưu đồ 1). Nên tiếp tục kháng đông điều trị ở tất cả các bệnh nhân có triệu chứng cho đến khi nguyên nhân gây triệu chứng được xác định, bất kể yếu tố kích gợi là gì. Các Hướng dẫn hiện nay khuyến cáo nên siêu âm tim và chụp V/Q cũng như RHC cùng với CT hoặc chụp mạch máu phổi xâm lấn nếu siêu âm tim cho kết quả gợi ý [16]. Điều quan trọng là những bệnh nhân không triệu chứng không nên tầm soát CTEPH hay CTED sau PE cấp [16, 21, 31].
Với những bệnh nhân có triệu chứng mặc dù đã đủ 3 tháng điều trị kháng đông và có bản siêu âm tim ghi nhận khả năng PH thấp, chúng ta sẽ loại trừ các nguyên nhân gây khó thở khác bằng các cận lâm sàng đánh giá chức năng phổi, bão hòa oxy khi gắng sứng, điện tâm đồ, định lượng BNP và hemoglobin, đồng thời đánh giá lại bệnh tim trái trên siêu âm tim và các hình ảnh chụp mạch máu phổi trên CT trước đó (từ lúc chẩn đoán PE cấp) để đánh giá bệnh nhu mô phổi. Nếu các cận lâm sàng trên chưa đưa ra được kết luận về nguyên nhân khó thở thì cần kiểm tra đến bệnh mạch máu phổi. Một bản “siêu âm tim bình thường” không loại trừ CTEPH hay CTED mức độ nhẹ, trong khi đó bệnh nhân có dãn nhẹ thất Phải có thể không có bằng chứng bệnh mạch máu phổi khi đánh giá sâu hơn. Vì lý do này, chúng ta nên đề nghị hoặc phim V/Q hoặc SPECT/CT, vì một kết quả tưới máu bình thường sẽ loại trừ CTED và CTEPH và thường ít nghĩ RHC. Chụp CPET trước chụp phim tưới máu phổi cũng là một cách tiếp cận thay thế vì CPET cũng nhạy với cả CTED và CTEPH; tuy vậy, CPET cần chuyên gia để phân tích phim chính xác, và cũng không phải trung tâm nào cũng có sẵn [31], [71]. Đo áp lực riêng phần CO2 máu động mạch trong khi test cũng được khuyến cáo để đo lường chính xác sự thay đổi của khoảng chết trong CPET.
Một bệnh nhân có khả dĩ PH thấp trên siêu âm tim qua thành ngực, một bản V/Q âm tính, và không có nguyên nhân ây khó thở khác thì được xem là có khó thở liên quan sau PE. Với những bệnh nhân có phim V/Q dương tính, chúng ta tiếp tục tiến hành CPET vì bằng chứng của bệnh mạch máu phổi trên CPET sẽ cần các phương pháp xâm lấn để đánh giá CTEPH/CTED và/hoặc chuyển đến trung tâm PH/CTEPH. Ngược lại, những bệnh nhân có siêu âm tim ghi nhận khả dĩ thấp và V/Q dương tính mà CPET gợi ý suy giảm chức năng thì cũng được xem là có khó thở liên quan sau PE. Với những bệnh nhân có chẩn đoán khó thở liên quan sau PE, khuyến cáo trên thực hành của chúng tôi là chọn giữa chương trình phục hồi chức năng tim phổi, hoặc tự thay đổi chế ăn và sinh hoạt thể lực; tùy vào khả năng chi trả của bảo hiểm và yêu cầu của bệnh nhân. Nếu khó thở còn kéo dài dù đã qua 3 tháng tập luyện thể lực/phục hồi chức năng, và họ chưa được làm CPET thì chúng ta sẽ tiến hành CPET để đánh giá lần cuối.
- Kết luận
Khó thở dai dẳng và hạn chế khả năng gắng sức sau PE cấp là một vấn đề phổ biến và ngày càng được ghi nhận là một nguyên nhân tàn tật. Thuật ngữ “hội chứng sau PE” đã được sử dụng để ghi nhận một nhóm bệnh nhân tương đồng, bao gồm CTEPH, CTED, và một nhóm lớn nhưng chưa được phân loại, gồm những bệnh nhân có khó thở, đa số có suy chức năng thất Phải, nhưng không có bệnh lý mạch máu phổi trên các test chẩn đoán. Trong thực tế, chúng tôi nghi ngờ có sự liên tục từ bệnh lý mạch máu phổi nặng cho đến giường mạch máu phổi bình thường có suy chức năng để trở nên hồi phục hoàn toàn sau PE. Hội chứng sau PE vẫn còn là chủ đề gây tranh cãi, một phần vì định nghĩ còn mơ hồ và nguyên nhân không rõ ràng. Cần thêm các nghiên cứu để định nghĩa rõ hơn và xác lập chẩn đoán cho nhóm bệnh nhân này.
TÀI LIỆU THAM KHẢO
- Albaghdadi, M.S., et al., (2018), “Cardiopulmonary Exercise Testing in Patients Following Massive and Submassive Pulmonary Embolism”.J Am Heart Assoc, 7(5).
- Andreassen, A.K., et al., (2013), “Balloon pulmonary angioplasty in patients with inoperable chronic thromboembolic pulmonary hypertension”.Heart, 99(19): p. 1415-20.
- Auger, W.R., et al., (1992), “Chronic major-vessel thromboembolic pulmonary artery obstruction: appearance at angiography”.Radiology, 182(2): p. 393-8.
- Auger, W.R., et al., (2012), “Evaluation of patients with chronic thromboembolic pulmonary hypertension for pulmonary endarterectomy”.Pulm Circ, 2(2): p. 155-62.
- Bailey, C.L., et al., (2000), “”High probability” perfusion lung scans in pulmonary venoocclusive disease”.Am J Respir Crit Care Med, 162(5): p. 1974-8.
- Berman, M., et al., (2014), “Right ventricular reverse remodeling after pulmonary endarterectomy: magnetic resonance imaging and clinical and right heart catheterization assessment”.Pulmonary circulation, 4(1): p. 36-44.
- Berman, M., et al., (2012), “Pulmonary endarterectomy: outcomes in patients aged >70”.Eur J Cardiothorac Surg, 41(6): p. e154-60.
- Berman, M., et al., (2008), “Successful extracorporeal membrane oxygenation support after pulmonary thromboendarterectomy”.Ann Thorac Surg, 86(4): p. 1261-7.
- Bonderman, D., et al., (2007), “Predictors of outcome in chronic thromboembolic pulmonary hypertension”.Circulation, 115(16): p. 2153-8.
- Corsico, A.G., et al., (2008), “Long-term outcome after pulmonary endarterectomy”.Am J Respir Crit Care Med, 178(4): p. 419-24.
- de Perrot, M., et al., (2007), “Evaluation of persistent pulmonary hypertension after acute pulmonary embolism”.Chest, 132(3): p. 780-5.
- de Perrot, M., et al., (2015), “Pulmonary endarterectomy in severe chronic thromboembolic pulmonary hypertension”.J Heart Lung Transplant, 34(3): p. 369-75.
- Delcroix, M., et al., (2016), “Long-Term Outcome of Patients With Chronic Thromboembolic Pulmonary Hypertension”.Circulation, 133(9): p. 859-871.
- Ehlken, N., et al., (2016), “Exercise training improves peak oxygen consumption and haemodynamics in patients with severe pulmonary arterial hypertension and inoperable chronic thrombo-embolic pulmonary hypertension: a prospective, randomized, controlled trial”.Eur Heart J, 37(1): p. 35-44.
- Freeman, L.M., (2008), “Don’t bury the V/Q scan: it’s as good as multidetector CT angiograms with a lot less radiation exposure”.J Nucl Med, 49(1): p. 5-8.
- Galiè, N., et al., (2016), “2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT)”.Eur Heart J, 37(1): p. 67-119.
- Guth, S., et al., (2018), “Exercise right heart catheterisation before and after pulmonary endarterectomy in patients with chronic thromboembolic disease”.Eur Respir J, 52(3).
- Held, M., et al., (2014), “Cardiopulmonary Exercise Testing to Detect Chronic Thromboembolic Pulmonary Hypertension in Patients with Normal Echocardiography”.Respiration, 87(5): p. 379-387.
- Held, M., et al., (2014), “A symptom-related monitoring program following pulmonary embolism for the early detection of CTEPH: a prospective observational registry study”.BMC Pulm Med, 14: p. 141.
- Hou, X., et al., (2012), “Venoarterial extracorporeal membrane oxygenation support for two patients after pulmonary thromboendarterectomy”.Canadian journal of anaesthesia = Journal canadien d’anesthésie, 59: p. 622-3.
- Huisman, M.V., et al., (2018), “Pulmonary embolism”.Nat Rev Dis Primers, 4: p. 18028.
- Inami, T., et al., (2014), “Pressure-wire-guided percutaneous transluminal pulmonary angioplasty: a breakthrough in catheter-interventional therapy for chronic thromboembolic pulmonary hypertension”.JACC Cardiovasc Interv, 7(11): p. 1297-306.
- Ishiguro, H., et al., (2016), “Diversity of Lesion Morphology in CTEPH Analyzed by OCT, Pressure Wire, and Angiography”.JACC Cardiovasc Imaging, 9(3): p. 324-5.
- Jensen, K.W., et al., (2009), “Pulmonary hypertensive medical therapy in chronic thromboembolic pulmonary hypertension before pulmonary thromboendarterectomy”.Circulation, 120(13): p. 1248-54.
- Jorge, E., et al., (2016), “Optical coherence tomography of the pulmonary arteries: A systematic review”.J Cardiol, 67(1): p. 6-14.
- Kahn, S.R., et al., (2017), “Functional and Exercise Limitations After a First Episode of Pulmonary Embolism: Results of the ELOPE Prospective Cohort Study”.Chest, 151(5): p. 1058-1068.
- Kamenskaya, O.V., et al., (2015), “Efficiency of Various Cerebral Protection Techniques Used during the Surgical Treatment of Chronic Pulmonary Thromboembolism”.J Extra Corpor Technol, 47(2): p. 95-102.
- Kapitan, K.S., et al., (1989), “Mechanisms of hypoxemia in chronic thromboembolic pulmonary hypertension”.Am Rev Respir Dis, 139(5): p. 1149-54.
- Kataoka, M., et al., (2012), “Percutaneous transluminal pulmonary angioplasty for the treatment of chronic thromboembolic pulmonary hypertension”.Circ Cardiovasc Interv, 5(6): p. 756-62.
- Kearon, C., et al., (2003), “Comparison of low-intensity warfarin therapy with conventional-intensity warfarin therapy for long-term prevention of recurrent venous thromboembolism”.N Engl J Med, 349(7): p. 631-9.
- Kim, N.H., et al., (2019), “Chronic thromboembolic pulmonary hypertension”.Eur Respir J, 53(1).
- Klok, F.A., et al., (2010), “Prevalence and potential determinants of exertional dyspnea after acute pulmonary embolism”.Respir Med, 104(11): p. 1744-9.
- Konstantinides, S.V., et al., (2017), “Impact of Thrombolytic Therapy on the Long-Term Outcome of Intermediate-Risk Pulmonary Embolism”.J Am Coll Cardiol, 69(12): p. 1536-1544.
- Kovacs, G., et al., (2009), “Pulmonary arterial pressure during rest and exercise in healthy subjects: a systematic review”.Eur Respir J, 34(4): p. 888-94.
- Lee, K.C., Y.L. Cho, and S.Y. Lee, (2001), “Reperfusion pulmonary edema after pulmonary endarterectomy”.Acta Anaesthesiol Sin, 39(2): p. 97-101.
- Levinson, R.M., D. Shure, and K.M. Moser, (1986), “Reperfusion pulmonary edema after pulmonary artery thromboendarterectomy”.Am Rev Respir Dis, 134(6): p. 1241-5.
- Ley, S., et al., (2012), “Diagnostic performance of state-of-the-art imaging techniques for morphological assessment of vascular abnormalities in patients with chronic thromboembolic pulmonary hypertension (CTEPH)”.Eur Radiol, 22(3): p. 607-16.
- Madani, M., et al., (2016), “Pulmonary Endarterectomy. Patient Selection, Technical Challenges, and Outcomes”.Ann Am Thorac Soc, 13 Suppl 3: p. S240-7.
- Madani, M.M., et al., (2012), “Pulmonary endarterectomy: recent changes in a single institution’s experience of more than 2,700 patients”.Ann Thorac Surg, 94(1): p. 97-103; discussion 103.
- Mayer, E., et al., (2011), “Surgical management and outcome of patients with chronic thromboembolic pulmonary hypertension: results from an international prospective registry”.J Thorac Cardiovasc Surg, 141(3): p. 702-10.
- Mikus, P.M., et al., (2006), “Pulmonary endarterectomy: is there an alternative to profound hypothermia with cardiocirculatory arrest?”.Eur J Cardiothorac Surg, 30(3): p. 563-5.
- Mizoguchi, H., et al., (2012), “Refined balloon pulmonary angioplasty for inoperable patients with chronic thromboembolic pulmonary hypertension”.Circ Cardiovasc Interv, 5(6): p. 748-55.
- Moser, K.M., et al., (1993), “Resolution of vascular steal after pulmonary thromboendarterectomy”.Chest, 104(5): p. 1441-4.
- Ohira, H., et al., (2015), “The role of nuclear imaging in pulmonary hypertension”.J Nucl Cardiol, 22(1): p. 141-57.
- Olman, M.A., et al., (1990), “Pulmonary vascular steal in chronic thromboembolic pulmonary hypertension”.Chest, 98(6): p. 1430-4.
- Ota, H., et al., (2015), “Four-dimensional flow magnetic resonance imaging visualizes drastic change in vortex flow in the main pulmonary artery after percutaneous transluminal pulmonary angioplasty in a patient with chronic thromboembolic pulmonary hypertension”.Eur Heart J, 36(25): p. 1630.
- Papamatheakis, D.G., et al., (2020), “Chronic Thromboembolic Pulmonary Hypertension: JACC Focus Seminar”.J Am Coll Cardiol, 76(18): p. 2155-2169.
- Pesavento, R., et al., (2017), “Impact of residual pulmonary obstruction on the long-term outcome of patients with pulmonary embolism”.Eur Respir J, 49(5).
- Planquette, B., et al., (2016), “Residual pulmonary vascular obstruction and recurrence after acute pulmonary embolism. A single center cohort study”.Thromb Res, 148: p. 70-75.
- Poch, D.S. and W.R. Auger, (2016), “Chronic thromboembolic pulmonary hypertension: detection, medical and surgical treatment approach, and current outcomes”.Heart Fail Rev, 21(3): p. 309-22.
- Pugliese, S.C. and S.M. Kawut, (2019), “The Post-Pulmonary Embolism Syndrome: Real or Ruse?”.Ann Am Thorac Soc, 16(7): p. 811-814.
- Raisinghani, A. and O. Ben-Yehuda, (2006), “Echocardiography in chronic thromboembolic pulmonary hypertension”.Semin Thorac Cardiovasc Surg, 18(3): p. 230-5.
- Rajaram, S., et al., (2013), “3D contrast-enhanced lung perfusion MRI is an effective screening tool for chronic thromboembolic pulmonary hypertension: results from the ASPIRE Registry”.Thorax, 68(7): p. 677-8.
- Reesink, H.J., et al., (2006), “Hemodynamic and clinical correlates of endothelin-1 in chronic thromboembolic pulmonary hypertension”.Circ J, 70(8): p. 1058-63.
- Reesink, H.J., et al., (2007), “Six-minute walk distance as parameter of functional outcome after pulmonary endarterectomy for chronic thromboembolic pulmonary hypertension”.J Thorac Cardiovasc Surg, 133(2): p. 510-6.
- Richter, M.J., et al., (2016), “Heart rate response during 6-minute walking testing predicts outcome in operable chronic thromboembolic pulmonary hypertension”.BMC Pulmonary Medicine, 16(1): p. 96.
- Ridker, P.M., et al., (2003), “Long-term, low-intensity warfarin therapy for the prevention of recurrent venous thromboembolism”.N Engl J Med, 348(15): p. 1425-34.
- Roik, M., et al., (2016), “Refined balloon pulmonary angioplasty driven by combined assessment of intra-arterial anatomy and physiology – Multimodal approach to treated lesions in patients with non-operable distal chronic thromboembolic pulmonary hypertension – Technique, safety and efficacy of 50 consecutive angioplasties”.International Journal of Cardiology, 203: p. 228-235.
- Roik, M., et al., (2014), “Optical coherence tomography of inoperable chronic thromboembolic pulmonary hypertension treated with refined balloon pulmonary angioplasty”.Pol Arch Med Wewn, 124(12): p. 742-3.
- Sánchez-Recalde, Á., S. Alcolea, and J.J. Ríos-Blanco, (2015), “Optical Coherence Tomography in Thromboembolic Pulmonary Hypertension”.Revista Española de Cardiología (English Edition), 68(5): p. 437.
- Saouti, N., et al., (2009), “Long-term outcome after pulmonary endarterectomy for chronic thromboembolic pulmonary hypertension: a single institution experience”.Eur J Cardiothorac Surg, 35(6): p. 947-52; discussion 952.
- Sista, A.K., et al., (2017), “Persistent right ventricular dysfunction, functional capacity limitation, exercise intolerance, and quality of life impairment following pulmonary embolism: Systematic review with meta-analysis”.Vasc Med, 22(1): p. 37-43.
- Skoro-Sajer, N., et al., (2009), “Pulmonary Vascular Reactivity and Prognosis in Patients With Chronic Thromboembolic Pulmonary Hypertension”.Circulation, 119(2): p. 298-305.
- Sugimura, K., et al., (2013), “Three-dimensional-optical coherence tomography imaging of chronic thromboembolic pulmonary hypertension”.Eur Heart J, 34(28): p. 2121.
- Sugimura, K., et al., (2012), “Percutaneous transluminal pulmonary angioplasty markedly improves pulmonary hemodynamics and long-term prognosis in patients with chronic thromboembolic pulmonary hypertension”.Circ J, 76(2): p. 485-8.
- Sugiura, T., et al., (2013), “Role of 320-slice CT imaging in the diagnostic workup of patients with chronic thromboembolic pulmonary hypertension”.Chest, 143(4): p. 1070-1077.
- Sugiyama, M., et al., (2014), “Organized thrombus in pulmonary arteries in patients with chronic thromboembolic pulmonary hypertension; imaging with cone beam computed tomography”.Jpn J Radiol, 32(7): p. 375-82.
- Taboada, D., et al., (2014), “Outcome of pulmonary endarterectomy in symptomatic chronic thromboembolic disease”.Eur Respir J, 44(6): p. 1635-45.
- Tunariu, N., et al., (2007), “Ventilation-perfusion scintigraphy is more sensitive than multidetector CTPA in detecting chronic thromboembolic pulmonary disease as a treatable cause of pulmonary hypertension”.J Nucl Med, 48(5): p. 680-4.
- Wiedenroth, C.B., et al., (2018), “Balloon pulmonary angioplasty for inoperable patients with chronic thromboembolic disease”.Pulm Circ, 8(1): p. 2045893217753122.
- Wilkens, H., et al., (2018), “Chronic thromboembolic pulmonary hypertension (CTEPH): Updated Recommendations from the Cologne Consensus Conference 2018”.Int J Cardiol, 272s: p. 69-78.
- Yanagisawa, R., et al., (2016), “Intravascular imaging-guided percutaneous transluminal pulmonary angioplasty for peripheral pulmonary stenosis and pulmonary Takayasu arteritis”.J Heart Lung Transplant, 35(4): p. 537-40.







