BS. CAO NGỌC MAI HÂN*
BS. NGUYỄN THANH HIỀN
*Khoa nội tim mạch, BV Đại học y dược tp Hồ Chí Minh
- Mở đầu
Suy tim tiến triển hay suy tim giai đoạn cuối (giai đoạn D) theo AHA được xem là giai đoạn cuối của hội chứng suy tim với những triệu chứng lâm sàng nặng xảy ra cả khi nghỉ ngơi mặc dù bệnh nhân đã được điều trị nội khoa tối ưu, cũng như đã được các điều trị dụng cụ hỗ trợ thất và phẫu thuật. Mặc dù chúng ta thường chỉ nghĩ đến suy tim phân suất tống máu giảm khi nhắc đến suy tim tiến triển, nhưng trên thực tế lâm sàng thì ngay cả những ca suy tim tim phân suất tống máu bảo tồn vẫn thỏa các tiêu chuẩn của suy tim tiến triển.
Việc nhận diện trễ suy tim tiến triển có thể làm giới hạn các lựa chọn điều trị cho bệnh nhân, vì khả năng đáp ứng với các điều trị nâng cao như ghép tim hay hỗ trợ tuần hoàn cơ học phụ thuộc vào tình trạng sinh lý, dinh dưỡng và tâm lý của bệnh nhân.
- Dịch tễ học
Dữ liệu về dịch tễ của suy tim giai đoạn D cho đến nay vẫn còn rất hạn chế, với báo cáo từ Olmstead cho thấy tỉ lệ suy tim giai đoạn D chiếm 0.2% dân sốsuy tim (~13,000 người), trong khi dữ liệu từ nghiên cứu ADHERE tỉ lệ này xấp xỉ 5% trong số các bệnh nhân nhập viện (~23,000 người) [2]. Khi một bệnh nhân suy tim với phân suất tống máu giảm tiến triển đến giai đoạn D thì nguy cơ tử vong sẽ gia tăng một cách đáng kể. Theo nghiên cứu REMATCH, tỉ lệ tử vong của các bệnh nhân được điều trị nội khoa trong nhóm này lên tới 75% trong một năm và gần như không có ai sống sót qua hai năm [1]. Trong nghiên cứu từ dân số của Olmstead, tỉ lệ sống sau 5 năm của suy tim giai đoạn D chỉ có 20% [1]. Những bệnh nhân phụ thuộc các thuốc tăng co bóp cơ tim có tỉ lệ sống thấp nhất với chỉ 6% sau 1 năm [1].
- Biểu hiện lâm sàng
- Triệu chứng suy tim nặng với khó thở và/hoặc mệt mỏi khi nghỉ ngơi hoặc với khi gắng sức nhẹ (NYHA III hoặc IV). Test đi bộ 6 phút <300 m hoặc ít hơn ở nữ và/hoặc bệnh nhân ≥75 tuổi.
- Nhiều đợt sung huyết (sung huyết phổi và/hoặc hệ thống, phù ngoại biên) và/hoặc giảm cung lượng tim lúc nghỉ (giảm tưới máu ngoại biên).
- Sụt cân không rõ nguyên nhân (suy mòn do tim).
- Tiền căn ≥ 1 lần nhập viện vì suy tim trong vòng 6 tháng gần đây.
- Máy ICD phải sốc điện thường xuyên.
- Không dung nạp ức chế men chuyển do tụt huyết áp và/hoặc suy thận tiến triển.
- Không dung nạp chẹn beta do suy tim nặng lên hoặc tụt huyết áp.
- Gần đây phải tăng liều lợi tiểu để duy trì cân bằng dịch, với liều furosemide mỗi ngày >160 mg và/hoặc phải bổ sung metolazone.
- Các xét nghiệm sinh hóa máu có thể giúp gợi ý suy tim tiến triển mặc dù đã điều trị nội khoa tối ưu. Tăng peptide lợi niệu natri típ B (BNP) lúc nhập viện hoặc trong thời gian theo dõi và/hoặc không giảm BNP trong quá trình điều trị gợi ý nguy cơ tử vong cao. Hạ natri máu (≤134 mEq/L) kéo dài làm tăng nguy cơ tử vong gấp hai lần sau 6 tháng. Tăng BUN >30 mg/dL là một thông số tiên lượng mạnh nguy cơ tử vong nội viện và tử vong sau xuất viện một năm
- Chẩn đoán
Nhiều hệ thống phân loại đã được đưa ra dựa trên các đặc điểm chung của bệnh nhân (Hình 1), trong đó hệ thống phân loại INTERMACS có mục đích phân tầng nguy cơ các bệnh nhân suy tim tiến triển nhằm tiên lượng và có can thiệp khẩn cấp cho người bệnh [3]. Cả 3 hệ thống phân loại này có thể được dùng song song để mô tả chính xác hơn một bệnh nhân đang ở giai đoạn nào của suy tim.
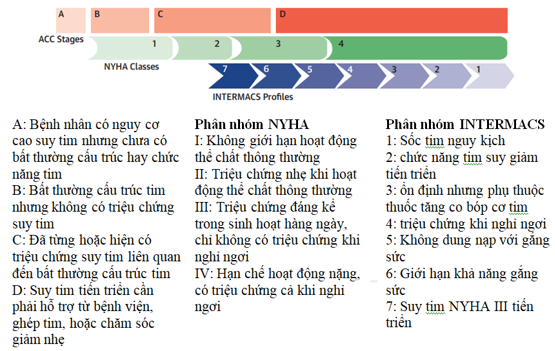
Hình 1. Các giai đoạn của suy tim qua nhiều hệ thống phân loại. Nguồn: Truby, L.K. et al. J Am Coll Cardiol HF. 2020
Có những điểm giống và khác nhau trong tiêu chuẩn chẩn đoán suy tim tiến triển giữa các hiệp hội (Hình 2). Không có một tiêu chuẩn đơn lẻ nào có thể xác định được suy tim tiến triển mà thay vào đó, cần tập hợp nhiều đặc điểm lâm sàng để gợi ý một bệnh nhân đã trở nên kháng trị với những điều trị tiêu chuẩn. Hội tim mạch châu Âu 2021 và hội tim mạch Mỹ (AHA) đưa tiêu chuẩn chẩn đoán như sau (box).
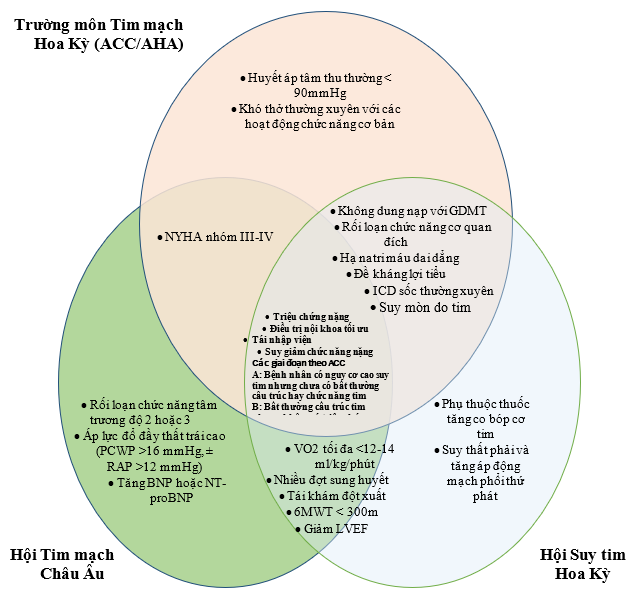
Hình 2. Định nghĩa suy tim tiến triển theo các hiệp hội. 6MWT, nghiệm pháp đi bộ 6 phút; BNP, peptide lợi niệu natri típ B; GDMT, điều trị nội khoa theo khuyến cáo; ICD, máy khử rung cấy dưới da; LVEF, phân suất tống máu thất trái; PCWP, áp lực động mạch phổi bít; RAP, áp lực nhĩ phải. Nguồn: Truby, L.K. et al. J Am Coll Cardiol HF. 2020
Tiêu chuẩn chẩn đoán suy tim tiến triển [13, 14].
| 1. Triệu chứng suy tim nặng và dai dẳng (suy tim NYHA III nặng hay IV) |
| 2. Rối loạn chức năng tim mức độ nặng được định nghĩa bởi ít nhất một trong các tiêu chuẩn sau đây:
• Phân suất tống máu thất trái (LVEF) ≤ 30% (hoặc 25%) • Suy thất phải đơn độc (ví dụ: bệnh cơ tim thất phải gây loạn nhịp) • Bất thường van tim nặng không thể phẫu thuật được • Bất thường bẩm sinh nặng không phẫu thuật được • BNP hoặc NT-proBNP cao (hoặc tăng) kéo dài, giảm natri máu và rối loạn chức năng tâm trương thất trái nặng hoặc bất thường cấu trúc mức độ nặng (theo định nghĩa STPXTM bảo tồn) |
| 3. Nhiều đợt suy tim sung huyết phổi hoặc hệ thống nặng cần truyền tĩnh mạch thuốc lợi tiểu liều cao (hay phối hợp nhiều loại lợi tiểu), hay nhiều đợt suy tim cung lượng tim thấp cần thuốc vận mạch ( phụ thuộc vận mạch) hoặc loạn nhịp ác tính gây >1 lần khám bệnh không lên kế hoạch hoặc nhập viện trong 12 tháng qua. Phải ngưng ACE inhibitor/ARB/ARNI vì tụt HA hay không dung nạp. Không đáp ứng với điều trị tái đồng bộ |
| 4. Suy giảm khả năng vận động nghiêm trọng – không thể tập thể dục hoặc đi quãng đường khi test đi bộ trong 6 phút thấp (< 300m) hoặc pVO2 <12mL/kg/ph hoặc <50% 50% giá trị dự đoán, ước tính có nguồn gốc từ tim |
- Chiến lược điều trị
Bước đầu tiên là xác định bệnh nhân đã thực sự được điều trị nội khoa tối ưu hay chưa và các yếu tố có thể can thiệp được (như thiếu máu cục bộ cơ tim, rượu). Điều trị nội khoa tối ưu theo khuyến cáo nên được chỉnh liều thuốc thích hợp, tối ưu cân bằng dịch, kiểm soát các rối loạn nhịp và xem xét khả năng điều trị máy tái đồng bộ cơ tim (CRT). Các bệnh đồng mắc như đái tháo đường, ngưng thở khi ngủ, tăng huyết áp, rung nhĩ và bệnh phổi tắc nghẽn mạn tính cũng nên được chú ý điều trị. Các điều trị can thiệp thủ thuật hoặc phẫu thuật như sửa hoặc thay van, bắc cầu động mạch vành, và cắt bỏ túi phình nên được chú ý nếu bệnh nhân có chỉ định và có khả năng can thiệp. Trong phần lớn các trường hợp thì những quyết định điều trị cần sự phối hợp của các chuyên gia trong nhiều lĩnh vực để thống nhất về những nguy cơ và lợi ích của các biện pháp can thiệp như phẫu thuật hay hỗ trợ tuần hoàn cơ học hay ghép tim. Bệnh càng diễn tiến nặng, mức độ can thiệp càng cao (hình 3).
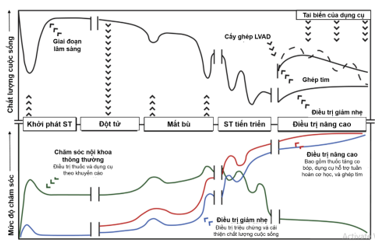
Hình 3. Diễn tiến tự nhiên của suy tim tiến triển và mức độ can thiệp điều trị. LVAD (left ventricular assist device), thiết bị hỗ trợ thất trái; ST, suy tim. Nguồn: Truby, L.K. et al. J Am Coll Cardiol HF. 2020
5.1. Điều trị các nguyên nhân có thể hồi phục
– Thiếu máu cơ tim
Vai trò của tái thông mạch vành (CABG) so với điều trị nội khoa trên bệnh nhân suy tim tiến triển đã được khảo sát qua nghiên cứu STITCH, với kết quả không khác biệt về tử vong do mọi nguyên nhân giữa hai chiến lược (41% ở nhóm CABG so với 36% ở nhóm điều trị nội khoa, p = 0,12) [2]. Tuy nhiên, tái thông mạch vành lại ưu thế hơn điều trị nội khoa trên các biến cố tử vong do nguyên nhân tim mạch và kết cục gộp của tử vong do mọi nguyên nhân hoặc nhập viện. Gần đây, báo cáo theo dõi 10 năm của nghiên STITCH đã xác nhận lại lợi ích về giảm tỷ lệ tử vong ở nhóm bệnh nhân được phẫu thuật CABG bên cạnh điều trị nội khoa tối ưu. Khuyết điểm của nghiên cứu này là số lượng bệnh nhân có suy tim tiến triển còn hạn chế, trong khi nguy cơ phẫu thuật của nhóm đối tượng này lại rất cao. Một nghiên cứu khác được công bố gần đây là AWESOME đã cho thấy PCI tương đương với CABG về tỷ lệ sống còn. Trong một số trường hợp cần đánh giá tính sống còn cơ tim để hỗ trợ quyết định điều trị, mặc dù bản thân các xét nghiệm đánh giá tính sống còn không cho thấy khả năng dự đoán các kết cục. Thang điểm SYNTAX II phối hợp các biến số giải phẫu và lâm sàng có thể có ích cho việc đưa ra quyết định chiến lược tái thông mạch vành.
– Các nguyên nhân khác
Các nguyên nhân có thể hồi phục quan trọng khác bao gồm rối loạn nhịp nhanh, bệnh lý tuyến giáp, rượu, thuốc gây nghiện (cocaine, amphetamines), hóa chất (như trastuzumab), và bệnh lý van tim [2]. Trong trường hợp bệnh van tim, cần xác định đây có phải bệnh van tim nguyên phát hay không (tổn thương ngay tại van hoặc bộ máy dưới van), vì các can thiệp sửa chữa có thể giúp hồi phục hoàn toàn chức năng thất. Ngược lại, nếu hở van hai lá là thứ phát do dãn thất trái thì ít có bằng chứng về hiệu quả của sửa chữa van, và nguy cơ có thể nhiều hơn lợi ích. Ngoài ra, điều trị nội khoa với những tác động lợi ích trên tái cấu trúc thất trái có thể làm giảm hoặc hồi phục hiện tượng hở van tim.
5.2. Điều trị nội khoa
Hòn đá tảng trong điều trị nội khoa suy tim hiện nay bao gồm ức chế hệ RAA (renin-angiotensinogen-aldosterone), hệ thần kinh giao cảm và mới đây là thuốc ức chế SGLT2. Điều trị chính đến thời điểm hiện tại vẫn bao gồm Sacubitril-Valsartan
(ARNI)/ức chế men chuyển (hoặc chẹn thụ thể nếu không dung nạp ức chế men chuyển), chẹn beta giao cảm, kháng aldosterone và ức chế SGLT2 được tăng dần đến liều đích. Cả bốn nhóm thuốc trên đều cho thấy lợi ích tử vong trong suy tim có phân suất tống máu giảm. Tuy nhiên, trong suy tim tiến triển, việc tối ưu các thuốc điều trị gặp nhiều khó khăn do giảm khả năng dung nạp vì tình trạng tụt huyết áp, tăng kali máu, và suy thận (2,13). Do đó việc phải giảm liều hoặc ngưng điều trị các nhóm thuốc trên được xem là dấu chỉ điểm cho tiên lượng xấu.
- Ức chế men chuyển
Ức chế men chuyển ngăn quá trình chuyển đổi angiotensin I thành angiotensin II, do đó giúp làm giảm tình trạng ứ muối, co mạch, hoạt hóa hệ giao cảm và tái cấu trúc cơ tim gây ra bởi sự hoạt hóa hệ RAA. Ức chế men chuyển có lợi ích đã được chứng minh trong tất cả các phân nhóm suy tim bao gồm cả các bệnh nhân rối loạn chức năng thất trái không có triệu chứng. Tuy nhiên lợi ích có được lớn nhất gặp ở nhóm có triệu chứng nặng (NYHA IV) với bằng chứng giảm 31% tử vong sau một năm trong nghiên cứu CONSENSUS [2]. Tác động này có được nhờ giảm quá trình tiến triển của suy tim, cải thiện chức năng và đường kính thất trái, nhờ đó ngăn ngừa tái cấu trúc thất và cải thiện tiên lượng lâu dài.
Các tác dụng phụ như hạ huyết áp, tăng azot và tăng kali máu thường nhẹ. Tuy nhiên, trong suy tim tiến triển, những tác dụng phụ này có thể trở nên nặng hơn đòi hỏi phải giảm liều thuốc, thậm chí phải ngưng thuốc. Nhìn chung, chế độ ăn ít kali cùng với chế độ theo dõi sát chức năng thận và nồng độ kali có thể giúp ngăn ngừa tăng kali máu. Tụt huyết áp có thể được hạn chế bằng việc dùng các thuốc có dạng phóng thích chậm (như lisinopril) vào buổi tối. Bên cạnh ức chế con đường RAA, thuốc ức chế men chuyển còn giảm chuyển hóa bradykinin và có thể gây phù mạch (1%) hoặc ho khan (10-15%) [2].
- Chẹn thụ thể Angiotensin
Thuốc ngăn chặn kết nối giữa angiotensin II và thụ thể angiotensin típ 1 (AT-1), do đó không ảnh hưởng đến sự thoái giáng bradykinin và không gây ra ho khan như thuốc ức chế men chuyển. Lợi ích của nhóm thuốc này đã được thể hiện trong nghiên cứu CHARM-Alternative và Val-HeFT. Tuy nhiên có rất ít bệnh nhân nhóm NYHA IV được đưa vào trong hai nghiên cứu trên.
- Chẹn thụ thể beta giao cảm
Sau những lo ngại ban đầu về giảm cung lượng tim (do tác động trên nhịp tim và sức co bóp cơ tim) thì lợi ích của nhóm thuốc chẹn beta trên tử vong triệu chứng và tái cấu trúc cơ tim thất trái đã được chứng minh. Các kết quả này được mở rộng hơn cho nhóm dân số suy tim tiến triển trong nghiên cứu COPERNICUS (NYHA III-IV, LVEF <25%), với tỷ lệ tử vong giảm 38% sau 12 tháng, và tác dụng phụ hạ áp cũng không khác biệt so với giả dược ngay cả ở nhóm có huyết áp tâm thu cơ bản 85-95 mmHg [2, 10]. Đáng chú ý là lợi ích của chẹn beta không phải là hiệu ứng nhóm, với tác động có lợi chỉ thấy ở carvedilol, bisoprolol, và metoprolol XL. Lợi ích giảm tử vong của chẹn beta không chỉ từ khả năng giảm tiến triển suy tim mà còn giảm nguy cơ đột tử do tim [2]. Trong thực hành lâm sàng, chẹn beta chỉ nên được khởi động ở những bệnh nhân đã bình dịch, và nên tăng liều chậm. Thuốc chẹn beta không nên ngưng đột ngột trong đợt suy tim mất bù cấp trừ trường hợp bệnh nhân vào choáng tim [2].
- Chẹn thụ thể mineralcorticoid
Không giống như ức chế men chuyển, chẹn thụ thể và chẹn beta, lợi ích của nhóm chẹn thụ thể mineralcorticoid được thể hiện lần đầu trong nhóm suy tim tiến triển và sau đó được mở rộng ra các nhóm suy tim nhẹ hơn. Trong nghiên cứu RALES, spironolactone giảm được 30% tỷ lệ tử vong và 35% tỷ lệ nhập viện vì suy tim ở nhóm dân số suy tim NYHA III-IV và LVEF <35% [2]. Tác động này có được trên nền bệnh nhân đã được điều trị tối ưu với ức chế men chuyển hoặc chẹn thụ thể, vì nồng độ aldosterone sẽ nhanh chóng trở về bình thường sau khi khởi động một trong các nhóm thuốc trên. Chẹn thụ thể aldosterone đóng vai trò quan trọng trong ngăn ngừa tái cấu trúc chất nền ngoại bào. Vì nó ngăn chặn bài tiết kali ở ống lượn xa, thuốc không nên được khởi động ở nhóm bệnh nhân có độ thanh thài creatinin <30 ml/phút hoặc kali máu >5,0 mmol/L [2]. Bệnh nhân nên được tư vấn tầm quan trọng của chế độ ăn ít kali, chức năng thận và kali máu nên được kiểm tra sau 1 tuần và thường xuyên sau đó cho đến khi đạt được nồng độ ổn định. Các thuốc thải kali qua đường tiêu hóa như patiromer hay kayexalate đã được chứng minh có hiệu quả ổn định nồng độ kali máu khi phối hợp lâu dài trên các bệnh nhân có tiền căn không dung nạp với thuốc chẹn thụ thể aldosterone vì tác dụng phụ tăng kali máu [8]. Tác dụng phụ phì đại vú gặp khoảng 10% các bệnh nhân nam uống spironolactone và có thể khắc phục bằng cách chuyển qua eplerenone [2].
- Sacubitril-Valsartan (ARNI)
Nghiên cứu PARADIGM-HF là một bước tiến mới trong điều trị nội khoa suy tim có phân suất tống máu giảm khi sự kết hợp chất ức chế neprilysin và chẹn thụ thể giúp giảm thêm 16% tử vong do mọi nguyên nhân so với enalapril [2]. Neprilysin làm bẻ gãy các peptide lợi niệu, vốn là chất đối trọng với hệ RAA, trong khi valsartan ngăn chặn hậu quả của hệ RAA thông qua ức chế thụ thể AT1, do đó duy trì được sự điều hòa và tạo khả năng ức chế liên tục hệ RAA hoạt động trong suy tim. Cần chú ý trong nghiên cứu này, các bệnh nhân cần trải qua thời kỳ dung nạp với liều đích enalapril 10mg hai lần mỗi ngày, điều này làm hạn chế số lượng các bệnh nhân suy tim tiến triển được tham gia trong nghiên cứu. Thực tế có <1% các bệnh nhân có NYHA IV, trong khi đa số là NYHA II. Ngoài ra, tác dụng phụ chính của nhóm thuốc này là tụt huyết áp, một triệu chứng vốn đã khá phổ biến ở những đối tượng suy tim tiến triển.
– Ức chế SGLT2
Mặc dù vốn là nhóm thuốc ban đầu được dùng để điều trị cho những bệnh nhân đái tháo đường, qua nhiều công trình nghiên cứu thì các thuốc trong nhóm ức chế kênh đồng vận chuyển natri-glucose 2 (SGLT2) đã chứng minh được lợi ích vượt trội của mình trên nhóm đối tượng suy tim có phân suất tống máu giảm, cho dù bệnh nhân có hay không có kèm đái tháo đường. Trong đó, empaglifozin là thuốc đầu tiên cho thấy lợi ích trên cả nhóm những bệnh nhân suy tim tiến triển qua nghiên cứu EMPEROR-Reduced, với kết quả giảm 25% nguy cơ gộp của tử vong do tim mạch hoặc nhập viện vì suy tim [5]. Nhóm thuốc này có tác dụng hạ áp nhẹ trên bệnh nhân suy tim (1-4 mmHg), và nên đánh giá lại tình trạng dịch để điều chỉnh liều lợi tiểu trước khi dùng thuốc ức chế SGLT2 vì nó cũng có khả năng lợi tiểu nhẹ [8].
5.3. Điều trị nội khoa bổ sung
– Lợi tiểu và hạn chế dịch
Trung tâm trong điều trị suy tim tiến triển là cân bằng thể tích dịch nhằm kiểm soát triệu chứng và ngăn ngừa các đợt mất bù. Tình trạng bình thể tích được duy trì bằng hạn chế dịch nhập (1.5-2 L/ngày) và lợi tiểu quai, mà phổ biến là furosemide. Tuy nhiên, sinh khả dụng đường uống của furosemide thấp hơn các thuốc khác trong cùng nhóm như bumetanide và torsemide. Torsemide là thuốc lợi tiểu quai có thời gian bán hủy dài nhất, và trong một phân tích gộp thì thuốc này giúp giảm tỷ lệ nhập viện, tử vong tim mạch, và cải thiện tình trạng chức năng tốt hơn furosemide [8]. Trong trường hợp đề kháng lợi tiểu, phối hợp thêm metolazone hoặc chlorthiazide có thể làm tăng tác dụng lợi tiểu ở vị trí ống lượn xa [2]. Liều lợi tiểu quai thấp nhất có hiệu quả nên được duy trì để giữ trạng thái bình dịch, từ đó cho phép tối ưu liều các thuốc trong nhóm “hòn đá tảng” trong suy tim [8].
– Digoxin
Digoxin là một glycoside tim có tác dụng tăng co bóp nhẹ do khả năng ức chế bơm Na/K-ATPase làm tăng nồng canxi nội bào. Trong nghiên cứu DIG, digoxin không cho thấy được lợi ích về mặt tử vong nhưng có thể làm giảm tỷ lệ nhập viện vì suy tim [2]. Đáng chú ý là cửa sổ điều trị của digoxin khá hẹp với nồng độ tối ưu trong suy tim chỉ từ 0,5-0,9 ng/mL, và một vài nghiên cứu quan sát đã báo cáo thuốc có thể làm tăng nguy cơ tử vong [2]. Do đó, dùng liều thuốc thấp nhất hoặc chiến lược dùng cách ngày thường được áp dụng kèm với theo dõi sát chức năng thận.
– Hydralazine/ISDN
Tầm quan trọng của các thuốc dãn mạch trong suy tim đã được chú ý từ rất sớm trong lịch sử điều trị suy tim. Nghiên cứu V-HeFT (1986) đã cho thấy lợi ích trên tỷ lệ tử vong của bộ đôi Hydralazine/ISDN chưa đạt được ý nghĩa thống kê, nhưng kết quả này nhanh chóng bị lu mờ bởi lợi ích vượt trội của enalapril trong nghiên cứu V-HeFT-2 [2]. Tuy nhiên, trong suy tim tiến triển thì tình trạng suy thận khá phổ biến, và hydralazine/ISDN có thể được sử dụng khi nhóm thuốc ức chế men chuyển hoặc chẹn thụ thể không thể dung nạp được.
- Ivabradine
Ivabradine là chất ức chế chọn lọc dòng If trong nút xoang với tác dụng làm chậm nhịp tim. Ivabradine làm giảm biến cố gộp của tử vong do tim mạch hoặc nhập viện vì suy tim ở những bệnh nhân suy tim có triệu chứng với LVEF <35% và có nhịp xoang với tần số >70 lần/phút mặc dù đã được điều trị nội khoa chuẩn với liều tối đa có thể dung nạp được (bao gồm cả chẹn beta) [2]. Đáng chú ý là lợi ích trên chủ yếu đến từ giảm tỷ lệ nhập viện mà không cho thấy được lợi ích rõ ràng trên tỷ lệ tử vong. Mặc dù LVEF trung bình trong nghiên cứu là 29% và một nửa bệnh nhân có NYHA III, nhóm đối tượng thực sự là suy tim tiến triển, thì nhịp tim nhanh là một cơ chế bù trừ để duy trì cung lượng tim và do đó việc lựa chọn cẩn thận bệnh nhân là cần thiết. Khuyến cáo của ACC/AHA 2016 về suy tim gợi ý xem xét dùng ivabradine chỉ cho các bệnh nhân NYHA II hoặc III có LVEF <35%, nhịp xoang với tần số >70 lần/phút khi đã dùng liều chẹn beta tối đa có thể dung nạp được [2]. Tuy nhiên trong nghiên cứu CARVIVA HF thì cho thấy phối hợp sớm ivabradine với chẹn beta cho phép đạt được liều đích cao hơn ở cả hai nhóm so với tăng liều riêng từng nhóm [10].
5.4. Can thiệp điện sinh lý
- Máy khử rung cấy trong tim (ICD, Implantable Cardioverter Defibrillator)
Máy ICD có thể ngăn ngừa đột tử nhưng không có tác dụng cải thiện triệu chứng, và cũng không thay đổi được tiến trình bệnh giống như CRT [1]. Do đó các khuyến cáo đều không ủng hộ việc cấy ICD nếu tiên lượng sống của bệnh nhân dưới một năm. Ở những bệnh nhân suy tim giai đoạn cuối, tùy thuộc vào mong muốn của bệnh nhân mà có thể hoặc không thích hợp để tắt máy ICD. Trong một vài trường hợp, máy khử rung mang bên ngoài (Lifevest) có thể được xem xét [2]. Lợi ích của ICD ở những bệnh nhân được cấy ghép LVAD vẫn còn tranh cãi nhưng nó có thể có ích trên nhóm những người có tiền căn rối loạn nhịp thất [2].
– Điều trị tái đồng bộ tim (CRT, cardiac resynchronization therapy)
Không giống ICD, điều trị CRT có thể giúp cải thiện hình thái thất trái, đảo ngực quá trình tái cấu trúc, giảm hở van hai lá thứ phát, và tăng LVEF, từ đó tăng khả năng gắng sức cho người bệnh và có lợi ích trên tử vong ở những bệnh nhân suy tim có triệu chứng, LVEF <35% mà vẫn còn nhịp xoang, với blốc nhánh trái và QRS >150ms [2]. Mặc dù CRT có bằng chứng mạnh mẽ về lợi ích trong suy tim có phân suất tống máu giảm, số lượng bệnh nhân suy tim tiến triển chỉ chiếm khoảng 4% trong các nghiên cứu ngẫu nhiên có nhóm chứng [1]. Những khuyết điểm của đặt CRT là nguy cơ của thủ thuật, nhiễm trùng máy, khả năng trì hoãn việc chuyển đến trung tâm ghép tim, và chi phí. Tỉ lệ sống của các bệnh nhân được đặt CRT sau 1 và 3 năm lần lượt là 92% và 77%, bằng hoặc cao hơn tiên lượng sau ghép tim [1]. Những bệnh nhân không có đáp ứng với điều trị CRT được xác định khi có đường kính thất trái cuối tâm trương tăng hoặc chức năng tim giảmso với trước khi đặt máy. Ngoài ra, những bệnh nhân không cho thấy sự hồi phục của tái cấu trúc thất trái sau 6 tháng đặt CRT cũng có nhiều biến cố hơn (tử vong vì suy tim, phải cấy ghép dụng cụ hỗ trợ thất, hoặc vào danh sách ghép tim) [1].
Tuy nhiên, lợi ích của CRT trên những bệnh nhân phụ thuộc vào thuốc tăng co bóp cơ tim thì không chắc chắn. Trong một báo cáo 10 ca phụ thuộc vào thuốc tăng co bóp thì sau đặt CRT có 9 ca ngưng được thuốc này và 7 ca vẫn còn sống sau ba năm mà không cần ghép tim. Ngược lại, một báo cáo khác cũng gồm 10 ca phụ thuộc thuốc tăng co bóp ghi nhận có tới 50% bệnh nhân tử vong dù triệu chứng được cải thiện nhanh chóng sau CRT, với thời gian trung vị đến lúc tử vong chỉ có 6 tháng. Những dữ liệu này tạo ra mối lo ngại về tỉ lệ giá cả/lợi ích và khả năng cứu sống của CRT trên nhóm dân số này [1].
- Điều trị các bệnh lý kết hợp
Suy tim thường đi kèm với rất nhiều bệnh lý đồng mắc có thể tác động vào sinh bệnh học của suy tim cũng như tình trạng lâm sàng của bệnh nhân, và thường liên quan đến kết cục xấu. Các bệnh lý đã tồn tại trước đó có thể bị nặng lên do hậu quả của suy tim tiến triển, làm suy giảm nặng chức năng cơ quan đích.
– Ngưng thở khi ngủ
Rối loạn đường thở khi ngủ (cả trung ương và ngoại biên) thường phổ biến trong suy tim và có mối liên quan với mức độ NYHA cao [2]. Đáng chú ý là điều trị ngưng thở khi ngủ do tắc nghẽn giúp giảm đường kính thất trái cuối tâm trương và cải thiện LVEF [2].
– Rung nhĩ
Tỷ lệ rung nhĩ chiếm tới 40% trong các bệnh nhân suy tim mức độ NYHA IV. Kiểm soát nhịp hoặc tần số bằng thuốc chẹn beta là cách tiếp cận chủ yếu ban đầu, trong khi amiodarone hoặc sốc điện chuyển nhịp là chiến lược điều trị sau đó được ưa thích lựa chọn [2]. Một số bệnh nhân có triệu chứng suy tim nặng hơn khi xuất hiện rung nhĩ bất kể tần số tim, và với những đối tượng này nên có chiến lược duy trì nhịp xoang. Các thuốc chẹn canxi không phải dihydropyridine không nên được sử dụng. Vì suy tim là một yếu tố nguy cơ cho các biến cố thuyên tắc ở những bệnh nhân rung nhĩ, kháng đông được khuyến cáo dùng cho những bệnh nhân dung nạp được [2].
– Suy thất phải
Suy thất phải là một biến chứng quan trọng của suy tim tiến triển làm tăng tỉ lệ tử vong, đặc biệt khi có kèm theo tăng áp phổi. Khi so sánh những bệnh nhân suy tim có tăng áp lực động mạch phổi (ALĐMP) và chức năng thất phải bảo tồn thì những bệnh nhân có tăng ALĐMP kèm suy thất phải có tỉ lệ tử vong cao gấp 4,3 lần [1]. Suy thất phải thường gặp ở bệnh cơ tim không do thiếu máu cục bộ và có thể phản ánh bản chất bệnh cơ tim của tim phải, cũng như phản ánh hậu quả tải huyết động của suy tim trái. Suy tim phải mức độ trung bình đến nặng có thể làm giảm hiệu quả của điều trị thiết bị hỗ trợ thất trái, do đó chức năng thất phải được tối ưu hóa trước khi cấy ghép thiết bị hỗ trợ thất trái và là yếu tố quan trọng để đạt được thành công trong điều trị.
Suy tim phải trong suy tim tiến triển là hậu quả của quá tải áp lực (do tăng áp lực tĩnh mạch phổi và tăng kháng lực mạch máu phổi), quá tải thể tích (tăng áp lực tĩnh mạch trung tâm), và rối loạn chức năng co bóp (rối loạn hoạt động vách liên thất, bệnh lý cơ thất phải) và bị làm nặng hơn bởi hở van ba lá. Tăng áp phổi do suy tim trái có thể đảo ngược được trong giai đoạn sớm, ngược lại theo thời gian thì sự mất điều hòa của nitric oxít, endothelin và prostaglandin sẽ dần dần làm tái cấu trúc mạch máu phổi. Khi đó thì tăng áp lực phổi tiền mao mạch không thể đảo ngược một cách nhanh chóng với điều trị suy tim do sự gia tăng kháng lực mạch máu phổi và chênh áp xuyên phổi. Giá trị chênh áp phổi thì tâm trương (DPG) >5 mmHg gợi ý có kèm theo bệnh lý mạch máu phổi góp phần gây tăng áp phổi trong suy tim. Tăng áp phổi hỗn hợp được định nghĩa khi DPG ≥7 mmHg và chênh áp phổi tổng cộng (hoặc chênh áp xuyên phổi – TPG) >12 mmHg, đây là nhóm bệnh nhân có tiên lượng tử vong cao, tương tự như những bệnh nhân tăng áp phổi tiền mao mạch.Ở những bệnh nhân có kháng lực mạch máu phổi > 3-4 đơn vị Wood, điều trị LVAD trước khi ghép tim, phối hợp với các thuốc dãn mạch phổi có thể cải thiện được tình trạng tăng áp phổi đề kháng với điều trị nội khoa đơn thuần và có thể cho kết quả tốt sau ghép tim.Việc xác định khả năng hồi phục của tình trạng tăng áp phổi trong suy tim giai đoạn D là rất quan trọng trong chiến lược điều trị. Những bệnh nhân có tăng áp phổi tiền mao mạch không thể hồi phục, có thể tiến triển suy tim phải sau khi đã ghép tim và do đó không phải là lựa chọn tối ưu trong danh sách ghép [1].
– Tương tác tim thận
Hội chứng tim thận là tập hợp các bệnh lý thận liên quan đến giảm hoạt động chức năng của tim, có thể xảy ra khi có rối loạn chức năng tim cấp tính hoặc sốc tim dẫn đến tổn thương thận cấp, hay bệnh tim mạn tính dẫn đến suy giảm chức năng thận tiến triển và mạn tính. Hơn 60% bệnh nhân nhập viện vì suy tim cấp có bệnh thận mạn mức độ từ trung bình trở lên (nghĩa là độ lọc cầu thận uớc tính <60 ml/phút) [1].
Sinh bệnh học bao gồm giảm tưới máu thận và/hoặc tăng sung huyết có kèm hoặc không bệnh lý tại thận [2]. Những thay đổi về huyết động trong suy tim tiến triển có thể gây ra sự mất điều hòa của hệ thần kinh thể dịch và mất đi cân bằng huyết động giữa thận và tim [1]. Co tiểu động mạch thận xảy ra khi có tình trạng giảm cung lượng tim có thể dẫn đến vòng xoắn tăng áp lực tĩnh mạch trung tâm do thận, càng làm nặng hơn tình trạng giảm tưới máu thận. Hậu quả là hoạt hóa hệ thần kinh giao cảm và hệ thống RAA, tăng sản xuất adenosin và các cytokine gây viêm, giữ muối và tăng thể tích tuần hoàn. Tăng áp lực tĩnh mạch trung tâm là biến số độc lập liên quan đến tỉ lệ suy thận và kết cục xấu. Chức năng thận sẽ giảm dần theo tuổi, nhưng tốc độ giảm sẽ nhanh hơn gấp nhiều lần trên bệnh nhân suy tim (2–3 mL/ph/1,73 m2/năm), và suy tim kèm đái thái đường (5 mL/ph/1,73 m2/năm) [10, 17].
Vì những lợi ích đã được chứng minh qua nhiều nghiên cứu của nhóm chẹn RAA, cần hạn chế việc ngưng nhóm thuốc này trong quá trình tăng liều thuốc (do hiện tượng “giả giảm chức năng thận”), và chỉ tạm ngưng nếu creatinin huyết thanh tăng >100% hoặc kali máu > 5,5 mmol/L, và dùng lại sau khi các yếu tố bất lợi đã được giải quyết [10]. Mức độ giảm dung nạp với các thuốc điều trị suy tim cũng như xác định các nguyên nhân gây suy thận vẫn còn là những thách thức phổ biến chưa được giải quyết trong quản lý suy tim tiến triển [1]. Bên cạnh đó, eGFR<30 mL/phút/1,73 m2là một trong những chống chỉ định tương đối của ghép tim [9].
– Tương tác tim gan
Bất thường chức năng gan hiện diện trong 46% những bệnh nhân suy tim tiến triển cần hỗ trợ thuốc tăng co bóp cơ tim. Cả hai dạng tổn thương tế bào gan (tăng AST và ALT) và ứ mật (tăng ALP, bilirubin) đều phổ biến. Tăng phosphatase kiềm thường hay gặp khi có tình trạng sung huyết hệ thống và tăng áp lực đổ đầy, trong khi tăng transaminase dường như có liên quan với tình trạng giảm tưới máu. Tương tác tim-gan có thể được phân thành 3 nhóm: 1) bệnh gan do sung huyết, 2) tổn thương gan cấp do tim (viêm gan do thiếu máu), và 3) xơ hóa tiến triển (xơ gan tim). Viêm gan do thiếu máu thường có nồng độ aminotransferases tăng nhanh đến đỉnh trong 1-3 ngày (có thể gấp 250 lần giới hạn trên), còn bilirubin hiếm khi tăng quá 4 lần giới hạn trên, và alkaline phosphatese thường trong khoảng 2 lần giới hạn trên [9]. Nồng độ các hoạt chất trên thường trở về giới hạn bình thường sau 7-10 ngày điều trị hỗ trợ [9].Sinh thiết gan có thể được thực tình hiện một cách an toàn để xác định mức độ không hồi phục của tổn thương gan và nên được thực hiện trước khi có kế hoạch điều trị phẫu thuật [1].
Bên cạnh thang điểm MELD (bao gồm bilirubin, creatinin, INR) đã được quen dùng để đánh giá mức độ bệnh lý gan trước ghép gan, gần đây thang điểm MELD-XI (không bao gồm yếu tố INR) đã được dùng để đánh giá tiên lượng ở những bệnh nhân suy tim tiến triển. Thang điểm mới này giúp đánh giá cả những bệnh nhân suy tim có rung nhĩ đang dùng thuốc kháng đông, vốn sẽ ảnh hưởng đến giá trị INR, do đó MELD-XI có thể dùng cho dân số rộng hơn. Các nghiên cứu cũng đã chứng minh MELD-XI là biến số độc lập làm tăng các biến cố tim mạch, kết quả không phụ thuộc vào tuổi, giới tính, và các yếu tố tiên lượng khác như NYHA, tiền căn nhập viện vì suy tim, BNP và LVEF [4]. Các bệnh nhân có suy gan và rối loạn đông máu nên được bù vitamin K [9].
– Thiếu sắt và thiếu máu
Có tới 50% bệnh nhân suy tim tiến triển bị thiếu máu, yếu tố làm tăng tỷ lệ nhập viện và giảm khả năng sống còn [2]. Hậu quả của tình trạng thiếu máu là giảm cung lượng tim và giảm tưới máu thận, kích hoạt hệ RAA và dòng thác phản ứng viêm, giảm đáp ứng của tủy xương với erythropoietin (EPO), và giảm sản xuất EPO do bệnh thận mạn.
Thiếu sắt được định nghĩa là ferritin <100 µg/L, hoặc ferritin <300 µg/L và độ bão hòa transferin <20% [9]. Sau khi loại trừ các nguyên nhân khác (như ung thư đại tràng), các bệnh nhân có thiếu sắt nên được bổ sung sắt truyền tĩnh mạch để cải thiện khả năng gắng sức và chất lượng cuộc sống [2]. Việc bổ sung EPO chỉ nên áp dụng cho các bệnh nhân có bệnh thận mạn mà không nên sử dụng thường quy, do thiếu các bằng chứng về lợi ích cũng như tăng nguy cơ các biến chứng thuyên tắc [2].
– Hạ natri máu
Hạ natri máu, với nguyên nhân một phần do tăng arginine vasopressin, là một chỉ điểm cho tiên lượng xấu trong suy tim tiến triển và có thể dẫn đến suy giảm nhận thức [2]. Tolvaptan, một chất đối kháng chọn lọc thụ thể V2, đã không cho thấy được sự cải thiện thiện tiên lượng lâu dài ở những bệh nhân nhập viện vì suy tim, nhưng có thể giúp cải thiện nồng độ natri máu, triệu chứng khó thở và giảm được cân nặng [2]. Do đó thuốc được khuyến cáo cho các trường hợp hạ natri máu, có triệu chứng quá tải dịch mặc dù đã hạn chế dịch nhập và điều trị nội khoa tối ưu [2, 15, 16].
- Điều trị tăng cường
Sau khi đã điều trị các nguyên nhân có thể hồi phục, tối ưu điều trị nội khoa/ CRT, và quản lý các bệnh đồng mắc, nếu bệnh nhân suy tim vẫn còn triệu chứng thì tiếp cận điều trị tiếp theo sẽ bao gồm ghép tim, thiết bị hỗ trợ thất và/hoặc giảm nhẹ.
– Ghép tim
Ước tính có khoảng 6300 ca ghép tim được thực hiện mỗi năm trên toàn thế giới với thời gian sống trung vị là 12,2 năm và >90% bệnh nhân có lại được khả năng gắng sức bình thường, do đó đây là biện pháp điều trị hiệu quả cho những bệnh nhân suy tim giai đoạn D. Tuy nhiên, điều trị này chỉ giới hạn với số lượng ít do không có sẵn nguồn tạng hiến, nên tiêu chuẩn chọn lựa bệnh nhân là rất quan trọng (Hình 4).
Theo khuyến cáo của Hội ghép tim phổi quốc tế năm 2016 [12], các tiêu chuẩnvào danh sách ghép tim bao gồm:
+ VO2 tối đa trên CPET ≤14 ml/kg/phút (không dung nạp chẹn beta) hoặc ≤12 ml/kg/phút (có dùng chẹn beta)hoặc ≤10 ml/kg/phút (có cấy ghép ICD hoặc CRT) hoặc ≤50% giá trị dự đoán (bệnh nhân <50 tuổi và giới nữ).
+ Bệnh nhân có thể được xem xét vào danh sách ghép nếu tiên lượng sống sau 1 năm theo mô hình suy tim của Seattle (Seattle Heart Failure Model – SHFM) <80% hoặc thang điểm sống còn suy tim (Heart Failure Survival Score – HFSS) trong mức nguy cơ trung bình-cao.
+ Thông tim phải nên được thực hiện ở tất cả các bệnh nhân người lớn trước khi chuẩn bị vào danh sách ghép và định kỳ mỗi 3-6 tháng cho đến khi được ghép.
+ Bệnh nhân nên được xem xét vào danh sách ghép nếu ≤70 tuổi, ngược lại phải lựa chọn một cách cẩn thận ở nhóm >70 tuổi.
+ Vì chỉ số khối cơ thể (BMI) >35 kg/m2 có liên quan đến kết cục xấu sau ghép nên những bệnh nhân béo phì được khuyến cáo giảm cân để đạt được BMI ≤35 kg/m2 trước khi vào danh sách ghép.
+ Với những bệnh nhân có tiền căn ung thư cần phải hội chẩn với bác sĩ ung bướu để xác định khả năng tái phát ung thư là thấp trước khi ghép tim.
+ Đái tháo đường có biến chứng cơ quan đích (ngoại trừ bệnh lý võng mạc không tăng sinh) hoặc kiểm soát đường huyết kém (HbA1c>7.5% hoặc 58 mmol/mol) mặc dù đã điều trị tối ưu là chống chỉ định tương đối của ghép tim.
+ Chức năng thận nên được đánh giá qua độ lọc cầu thận ước tính (eGFR) hoặc độ thanh thải creatinin trong điều kiện điều trị nội khoa tối ưu. Khi có bất thường chức năng thận thì cần làm thêm siêu âm mạch máu thận, ước tính đạm niệu và khảo sát bệnh lý động mạch thận để loại trừ bệnh lý thận nội tại. Suy thận không hồi phục với eGFR <30 ml/phút/1,73 m2 là chống chỉ định tương đối cho ghép tim.
+ Bệnh lý mạch máu não có triệu chứng nặng có thể được xem là một chống chỉ định của ghép tim. Bệnh mạch máu ngoại biên làm giới hạn khả năng vận động mà không thể được tái tưới máu cũng là một chống chỉ định tương đối của ghép tim.
+ Đánh giá mức độ suy yếu (3 trong 5 triệu chứng bao gồm sụt cân không chủ ý ≥10 pao trong năm qua, mất khối cơ, mệt mỏi, tốc độ đi bộ chậm và mức độ hoạt động thể chất thấp) có thể được xem xét khi xét chọn ứng cử viên ghép tim.
+ Tiền căn hút thuốc lá trong vòng 6 tháng trước là yếu tố tiên lượng kết cục xấu sau ghép, do đó là chống chỉ định tương đối của ghép tim.
+ Những bệnh nhân đang dùng các chất gây nghiện (bao gồm cả rượu) không nên nhận tim ghép.
+ Hỗ trợ tuần hoàn cơ học nên được xem xét cho những bệnh nhân có các bệnh lý đi kèm có thể điều trị khỏi như ung thư, béo phì, suy thận, hút thuốc lá, và tăng áp phổi không hồi phục với điều trị nội khoa, với sự đánh giá lại sau đó để xét chọn vào danh sách ghép.
+ Đánh giá tâm lý xã hội nên được thực hiện trước khi vào danh sách ghép tim, bao gồm đánh giá khả năng đưa ra sự đồng thuận của bệnh nhân và tuân thủ theo hướng dẫn điều trị, cũng như khảo sát hệ thống hỗ trợ tại nhà hoặc trong cộng đồng.Thiếu sự hỗ trợ sau xuất viện làm ảnh hưởng đến tuân trị có thể được xem là một chống chỉ định tương đối với ghép tim. Lợi ích của ghép tim trên những bệnh nhân khiếm khuyết nặng về hành vi-nhận thức hoặc sa sút trí tuệ chưa được nghiên cứu và có thể có hại, do đó ghép tim không thể được khuyến cáo cho nhóm đối tượng này.
Với một số bệnh lý cơ tim có đáp ứng kém với điều trị nội khoa lẫn các thiết bị hỗ trợ như bệnh cơ tim thâm nhiễm thì ghép tim là phương thức điều trị duy nhất giúp cải thiện tiên lượng sống còn. Điều trị triệu chứng trên những đối tượng này thường không hiệu quả do các bệnh nhân bệnh cơ tim thâm nhiễm dễ bị ngộ độc digoxin, dễ bị tụt huyết áp khi dùng các thuốc dãn mạch, dễ bị suy thận khi dùng các thuốc lợi tiểu do mối quan hệ thể tích – áp lực tâm trương theo đường dốc. Các nghiên cứu quan sát cho thấy những bệnh nhân bệnh cơ tim thâm nhiễm sau nhận tim ghép có tỷ lệ sống còn sau 1, 5 và 10 năm cũng tương tự các bệnh nhân không phải bệnh cơ tim thâm nhiễm, ngoại trừ phân nhóm bệnh cơ tim thâm nhiễm dạng bột (amyloidosis) và bệnh cơ tim thâm nhiễm do điều trị phóng xạ.
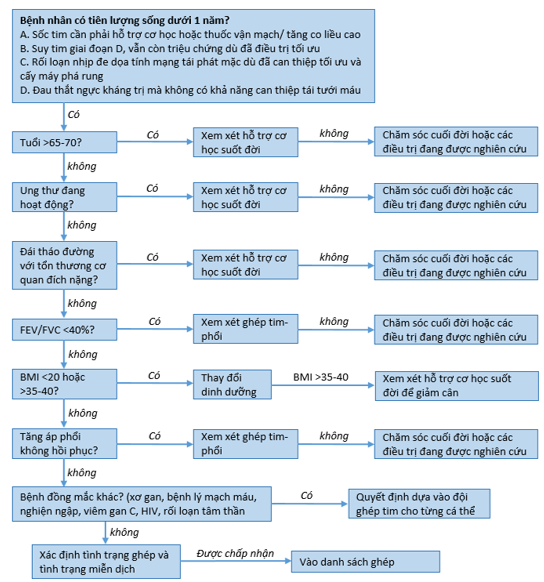
Hình 4. Đánh giá khả năng vào danh sách người nhận ghép tim (12)
Vì truyền máu nhiều lần làm tăng nguy cơ tạo các kháng thể chống lại kháng nguyên trên bạch cầu (allosensitization) và ảnh hưởng đến việc đánh giá khả năng phù hợp tạng ghép, do đó cần hạn chế truyền máu trước ghép tim. Trong trường hợp cần thiết nên truyền chế phẩm máu đã lọc bạch cầu, nhưng không cần máu có xét nghiệm cytomegalovirus âm tính [9].
- Hỗ trợ tuần hoàn cơ học
Các dụng cụ như máy hỗ trợ thất liên tục cấy dưới da (VAD, ventricular assist device), tim nhân tạo hoàn toàn (TAH, total artificial heart), và ECMO đã và đang được ứng dụng ngày càng nhiều do tính sẵn có của phương tiện, thời gian sử dụng trong vài năm và cải thiện được tiên lượng sống. Thiết bị này có thể là cầu nối trong thời gian đợi ghép tim để cải thiện chất lượng sống cũng như khả năng sống của những bệnh nhân trong danh sách ghép, và đây cũng có thể là điều trị cuối cùng cho những bệnh nhân không đủ tiêu chuẩn vào danh sách ghép, hoặc hỗ trợ cho đến khi cơ tim có cơ hội hồi phục lại sức co bóp (trong viêm cơ tim cấp, bệnh cơ tim chu sinh, thải ghép tim gây rối loạn huyết động, hoặc sốc sau mổ tim) [1]. Đối với trường hợp làm cầu nối, các máy hỗ trợ tuần hoàn cơ học thường được dùng ở những bệnh nhân sốc tim cần ổn định nhanh huyết động để hồi phục tình trạng sốc và/hoặc cải thiện chức năng cơ quan đích. Lựa chọn loại thiết bị sẽ phụ thuộc độ nặng của tình trạng rối loạn huyết động, suy một thất hay hai thất, nhu cầu hỗ trợ huyết động một phần hay hoàn toàn và thời gian dự kiến dùng thiết bị. Trong phần lớn các trường hợp thì ECMO thường được sử dụng. Những tác động tích cực trên huyết động của các thiết bị hỗ trợ tuần hoàn cơ học thường giúp cải thiện chức năng cơ quan đích, giảm áp lực động mạch phổi, cho phép bệnh nhân phục hồi vận động và dinh dưỡng trước khi đánh giá khả năng ghép tim.
Theo EACTS 2019 [11], tiêu chuẩn cho các trường hợp cấy ghép vĩnh viễn thiết bị hỗ trợ tuần hoàn cơ học bao gồm phân suất tống máu ≤ 25% kèm triệu chứng NYHA IIIb hoặc IV và ít nhất một trong các tiêu chuẩn sau:
- INTERMACS 2–4
- Phụ thuộc thuốc tăng co bóp cơ tim
- Suy chức năng cơ quan đích tiến triển
- Trị số oxy tiêu thụ tối đa(Peak VO2)<12 ml/kg/min
- Phụ thuộc các thiết bị hỗ trợ tuần hoàn cơ học tạm thời
Dữ liệu từ các thử nghiệm lâm sàng cho thấy tỉ lệ sống ước đoán của các bệnh nhân có LVAD có thể lên 85% sau 1 năm với thời gian sống trung bình khoảng 3 năm [1]. Hiện đã có hơn 24000 ca được cấy ghép LVADs loại dòng chảy liên tục. Biến chứng của phương pháp này bao gồm tán huyết, xuất huyết, sự di lệch của ống thông làm tổn thương van động mạch chủ hoặc van hai lá, thuyên tắc huyết khối (đột quỵ, tắc máy bơm), nhiễm trùng và suy thất phải.
Nguyên tắc chung để chọn các đối tượng được cấy ghép LVAD bao gồm bệnh nhân không đáp ứng với các điều trị khác, tình trạng bệnh đủ nặng khiến bệnh nhân chấp nhận nguy cơ và mong muốn với điều trị này, ước tính về khả năng sống và kết cục sau cấy ghép còn tốt (tình trạng bệnh đồng mắc cho phép bệnh nhân sống ít nhất 2-3 năm), và khả năng tuân trị tốt để hạn chế các biến chứng sau đặt máy. Khi bệnh nhân có tiên lượng sống sau 1 năm dưới 85% thì có thể xem xét dùng các thiết bị hỗ trợ tuần hoàn cơ học. Thang điểm nguy cơ HeartMate II (HMRS) có thể giúp tiên lượng kết cục sau thủ thuật cấy ghép, nhưng không nên chỉ dựa vào nó để thay đổi quyết định lâm sàng, vì có những bệnh nhân có thang điểm HMRS xấu nhưng lại có kết cục tốt. Chống chỉ định của LVAD bao gồm hẹp van động mạch chủ nặng, huyết khối trong buồng tim, bệnh gan/ thận/ não/ thần kinh cơ không thể hồi phục, không tuân thủ điều trị, rối loạn tâm thần [1].
Một trong những yếu tố quan trọng để thành công trong việc cấy ghép dụng cụ hỗ trợ thất là mong muốn của bệnh nhân và gia đình phải đủ mạnh để vượt qua nỗi sợ hãi về biến chứng của phẫu thuật và học cách sống cùng thiết bị chạy bằng pin mang trong người. Để làm được điều này cần có một nhóm chăm sóc giảm nhẹ để hỗ trợ cho bệnh nhân suy nghĩ kỹ về quyết định của họ và mục tiêu trong cuộc sống [1].
- Truyền thuốc tăng co bóp liên tục
Truyền thuốc tăng co bóp liên tục có thể được áp dụng tại nhà để cải thiện chất lượng cuộc sống của bệnh nhân ở cuối cuộc đời. Những bệnh nhân cải thiện được triệu chứng rõ ràng với thuốc tăng co bóp nhưng không cai được thuốc, khi xuất viện về có thể có mức hoạt động chức năng ban đầu còn tốt nhưng tiên lượng sống rất kém (khoảng 3,4 tháng trong một nghiên cứu), và phần lớn các bệnh nhân này tử vong tại nhà mà không nhập viện lại [1,2]. Việc dùng thuốc tăng co bóp cơ tim tại nhà đối với những bệnh nhân trong danh sách ghép có thể giúp tiết kiệm khoảng 70% thời gian nằm viện, do đó tiết kiệm được chi phí chăm sóc. Trong một số ít trường hợp, thuốc tăng co bóp cơ tim có thể dùng làm cầu nối trước khi đưa ra quyết định đưa bệnh nhân vào danh sách hỗ trợ tuần hoàn cơ học hay các điều trị chuyên sâu khác [1, 18].
Tiêu chuẩn để truyền thuốc tăng co bóp cơ tim tại nhà [1]:
- Bệnh nhân có cung lượng tim thấp (thông tim xác định chỉ số tim <2 L/ph/m2)và cải thiện rõ cả về triệu chứng và huyết động nhờ truyền thuốc tăng co bóp cơ tim (cải thiện 20% chỉ số tim hoặc giảm 20% áp lực mao mạch phổi bít)
- Cố gắng tối ưu các thuốc khác bao gồm dùng thuốc dãn mạch và tối ưu tình trạng dịch
- Cố gắng ngưng thuốc tăng co bóp làm nặng hơn triệu chứng bệnh
- Bệnh nhân đã được xác định không phải là ứng viên hoặc không mong muốn cấy ghép dụng cụ hỗ trợ tuần hoàn cơ học hoặc ghép tim
Bệnh nhân phải được giải thích rõ rằng truyền thuốc tăng co bóp liên tục tại nhà là phương tiện hỗ trợ giúp bệnh nhân xuất viện và cải thiện chức năng sống nhưng không cải thiện được tiên lượng sống [1].
Tuy nhiên phương thức này có thể không khả thi ở những nơi chưa có hệ thống y tế theo dõi tại nhà, với ít nhất một điều dưỡng phải đến nhà bệnh nhân để thay thuốc truyền tĩnh mạch mỗi ngày [7].
- Chăm sóc giảm nhẹ cuối đời
Tìm hiểu mong muốn và nguyện vọng của bệnh nhân về mặt tinh thần, các mối quan hệ cá nhân, nghĩa vụ gia đình hoặc xã hội có thể giúp đưa ra các quyết định đúng đắn cho mỗi người bệnh. Các chuyên gia về chăm sóc giảm nhẹ có thể hỗ trợ trong cuộc thảo luận với những bệnh nhân mong muốn chất lượng cuộc sống hơn là tuổi thọ, để giúp họ chuẩn bị tốt nhất cho hành trình chăm sóc ít xâm lấn [1].
Lý tưởng nhất là những cuộc trao đổi này nên được thực hiện trước khi chuyển qua giai đoạn cuối cùng của suy tim tiến triển, khi bệnh nhân còn có thể hiểu những thông tin được cung cấp và phản hồi lại được. Tuy nhiên, sự xuất hiện của các biến cố lâm sàng làm mất khả năng hoạt động hàng ngày hoặc thất bại khi tăng liều thuốc có thể ảnh hưởng đến quan điểm của người bệnh, từ đó ảnh hưởng đến kế hoạch chăm sóc và điều trị. Do vậy, quá trình thảo luận với bệnh nhân cần được lặp đi lặp lại để có thể đưa ra các quyết định ở các thời điểm khác nhau của diễn tiến bệnh [1].
Phần lớn các bệnh nhân suy tim tiến triển đã được tư vấn chăm sóc giảm nhẹ sẽ giảm số lần nhập viện vào các cơ sở y tế, giảm tỷ lệ thông khí cơ học xâm lấn và đặt các thiết bị như ICD, từ đó giảm chi phí chăm sóc sức khỏe [6]. Nên xem xét chăm sóc cuối đời ở các bệnh nhân suy tim sau [13]:
– Suy giảm chức năng tiến triển (thể chất và tinh thần) và cần được giúp đỡ trong hầu hết hoạt động sinh hoạt hàng ngày.
-Triệu chứng suy tim nặng với chất lượng cuộc sống kém dù dược điều trị dược lí và không dược lí tối ưu.
-Nhập viện thường xuyên hoặc các đợt mất bù nặng dù đã điều trị tối ưu. Loại trừ MCS và ghép tim.
-Suy mòn do tim.
-Được đánh giá về mặt lâm sàng là gần cuối đời.
- Các vấn đề quan trọng khác
- Suy dinh dưỡng
Tuổi già cùng với tình trạng suy kiệt và suy dinh dưỡng là những yếu tố quan trọng ảnh hưởng đến đáp ứng điều trị và kết cục của suy tim. Suy kiệt là hội chứng phản ánh sự suy giảm hoạt động của nhiều hệ cơ quan dẫn đến giảm dự trữ nội mô và cơ thể dễ tổn thương hơn với stress. Mặc dù thường được đánh giá qua “kiểm tra nhãn cầu”, suy kiệt được định nghĩa khi có sự hiện diện của ít nhất 3 trong các tiêu chuẩn sau: sụt cân hơn 10 pao (tương đương 4,5kg) trong một năm; tự đánh giá bản thân kiệt sức; kết quả đo sức cầm nắm yếu; giảm tốc độ đi bộ; và giảm hoạt động thể chất. Suy nhược được định nghĩa khi khối nạc thấp hơn 2 độ lệch chuẩn giá trị trung bình theo giới tính của dân số khỏe mạnh, đây là nguyên nhân chính của tình trạng suy kiệt. Suy mòn là một hiện tượng có liên quan và có những đặc điểm chính tương tự với suy kiệt như mệt mỏi, yếu cơ, và suy nhược; tuy nhiên, suy mòn thì được đặc trưng bởi tình trạng sụt cân và teo cơ [1].
Ngay cả khi đã điều chỉnh theo tuổi và bệnh đồng mắc thì suy kiệt vẫn là yếu tố nguy cơ dự đoán kết cục tử vong, tàn tật và nhập viện ở những bệnh nhân có bệnh tim và những bệnh nhân mới được phẫu thuật tim. Trong dân số suy tim tiến triển, việc đánh giá mức độ suy kiệt trước cấy ghép LVAD có thể giúp cung cấp thêm thông tin tiên lượng. So với những người không có tình trạng suy kiệt thì nguy cơ tử vong ở những bệnh nhân suy kiệt trung bình tăng 1,7 lần và suy kiệt nặng gấp 3,08 lần. Việc xác định tình trạng suy kiệt, suy mòn và suy nhược có cải thiện sau các điều trị chuyên sâu như ghép tim hay hỗ trợ tuần hoàn cơ học vẫn là một thách thức, nhưng cuối cùng có thể quyết định quá trình điều trị. Tuy nhiên đến nay vẫn chưa có phương thức tối ưu để đánh giá mức độ suy kiệt cũng như khả năng phân biệt những trường hợp suy kiệt còn nhạy với điều trị hay kháng với điều trị [1].
ISHLT 2013 khuyến cáo định lượng nồng độ albumin và pre-albumin trước phẫu thuật tim để đánh giá tình trạng dinh dưỡng bên cạnh các chỉ số trên. Luyện tập kháng lực là biện pháp can thiệp chủ yếu để cải thiện tình trạng suy nhược, cùng với các bài tập thể dục nhịp điệu được khuyến cáo trước và sau ghép tim. Vấn đề bổ sung testosterone hiện vẫn còn đang tranh cãi [9].
- Tâm lý xã hội
Tỉ lệ trầm cảm ở những bệnh nhân suy tim được ước tính khoảng 22%, nhưng tỉ lệ này tăng cao hơn khi triệu chứng suy tim trầm trọng hơn (tăng từ 11% ở những bệnh nhân suy tim NYHA I lên 42% ở các trường hợp suy tim NYHA IV). So với những bệnh nhân suy tim không bị trầm cảm thì nhóm có vấn đề tâm lý sẽ giảm tuân thủ điều trị, tình trạng sức khỏe nặng hơn, thường xuyên phải sử dụng các dịch vụ y tế và tử vong cao hơn [1]. Do đó trầm cảm thực sự là một thách thức với các nhà lâm sàng điều trị cho các bệnh nhân suy tim tiến triển.
Tương tự như vậy, những bất ổn về mặt xã hội như giảm thu nhập, mất khả năng lao động, bảo hiểm y tế, hôn nhân không hạnh phúc, sống một mình hoặc xa bệnh viện, tiền căn nghiện rượu hoặc ma túy, đều là những yếu tố nguy cơ độc lập trog các mô hình tiên lượng cho suy tim tiến triển và kết cục xấu. Suy giảm nhận thức cũng là một yếu tố dự báo tử vong trong suy tim và có thể ảnh hưởng đến khả năng tự chăm sóc của bệnh nhân và giới hạn các biện pháp điều trị trong suy tim giai đoạn D [1].
- Cân bằng giữa khả năng sống và chất lượng cuộc sống
Tiên lượng cho những bệnh nhân suy tim tiến triển thường chỉ quan tâm đến cải thiện tỉ lệ tử vong và tăng thời gian sống, tuy nhiên bệnh nhân có thể sẽ quan tâm về chất lượng cuộc sống nhiều hơn là số lượng. Hiện nay việc xác định các yếu tố tiên lượng giúp đưa ra lựa chọn chất lượng hay số lượng cuộc sống vẫn còn chưa chắc chắn. Bản thân việc lựa chọn cũng là một vấn đề phức tạp, vì một số người có thể kiên định với quyết định của mình nhưng một số đối tượng có thể thay đổi lựa chọn theo thời gian, đặc biệt trong khoảng giữa những đợt mất bù và hồi phục [1].
- Suy tim có hồi phục hay không
Trong một vài trường hợp suy tim giai đoạn D, các thiết bị hỗ trợ tuần hoàn cơ học có thể đóng vai trò là cầu nối để cơ tim hồi phục. Nhờ vào sự ổn định huyết động và cải thiện lâm sàng ở những bệnh nhân được dùng thiết bị hỗ trợ tuần hoàn cơ học, các thuốc mới hoặc các điều trị sinh học có thể phát huy tác dụng cho quá trình hồi phục. Những ca lâm sàng đầu tiên đã hồi phục tự nhiên chức năng thất trái sau khi nhận thiết bị hỗ trợ tuần hoàn cơ học đã cho phép khái niệm suy chức năng thất trái nặng và suy tim tiến triển có thể ít nhất là hồi phục tạm thời với cải thiện rõ rệt khả năng co bóp của thất trái. Tỉ lệ hồi phục cơ tim khi dùng các dụng cụ hỗ trợ tuần hoàn cơ học dao động khá lớn trong các báo cáo (từ 22/271(8%) bệnh nhân trong một nghiên cứu đa trung tâm đến 11/15 (73%) trường hợp trong một nghiên cứu ở Anh), nhưng thường xảy ra trong khoảng 5-10% ở hầu hết các trung tâm [1]. Nguyên nhân của sự khác biệt này là do sự khác nhau về đối tượng nghiên cứu (suy tim do thiếu máu cục bộ hay không do thiếu máu cục bộ,..), thực hành lâm sàng ở mỗi trung tâm (lựa chọn thuốc, dụng cụ…), và định nghĩa sự hồi phục cơ tim. Mặc dù sự hồi phục cơ tim chỉ xảy ra với tỉ lệ nhỏ nhưng nhiều trung tâm vẫn cố gắng tối ưu thuốc điều trị suy tim sau cấy ghép dụng cụ và định kỳ đánh giá hồi phục cơ tim, đồng thời có những phác đồ giảm dần hoạt động của máy hoặc cai máy để tối ưu cơ hội hồi phục của cơ tim.
Mặc dù lâm sàng khó phân biệt giữa thuyên giảm và hổi phục cơ tim, cả hai đều có đặc điểm cải thiện về sinh học, cấu trúc, và chức năng. Dấu hiệu trực tiếp phản ánh sự hồi phục cơ tim có lẽ là hình ảnh thất trái trên siêu âm tim, với sự cải thiện phân suất tống máu đến > 40%, giảm kích thước buồng thất và khối lượng thất trái. Sự cải thiện có thể được thấy rất sớm sau 30 ngày cấy ghép, đạt tối đa sau 6 tháng và được duy trì sau 1 năm [1]. Sự cải thiện về cấu trúc và chức năng đi đôi với cải thiện về môi trường thần kinh thể dịch, mặc dù không đủ để trở về giá trị bình thường cũng như không phản ánh được thay đổi ở mức độ tế bào.
Những câu hỏi chưa thể giải quyết bao gồm xác định nguyên nhân gây ra bệnh cơ tim nguyên phát, định nghĩa thuyên giảm so với hồi phục cơ tim xác định trên phân tử, cấu trúc và đặc điểm sinh học, thời gian và bản chất của các dụng cụ hỗ trợ, sự cần thiết và bản chất của các điều trị hỗ trợ đặc hiệu (gồm tế bào gốc, yếu tố tăng trưởng, điều trị gen). Loại máy hỗ trợ tuần hoàn cơ học nào là tối ưu vẫn chưa được xác định chắc chắn, và hiện tại vẫn lưu hành các loại máy bơm dạng xung, bơm liên tục và bóng dội ngược [1].
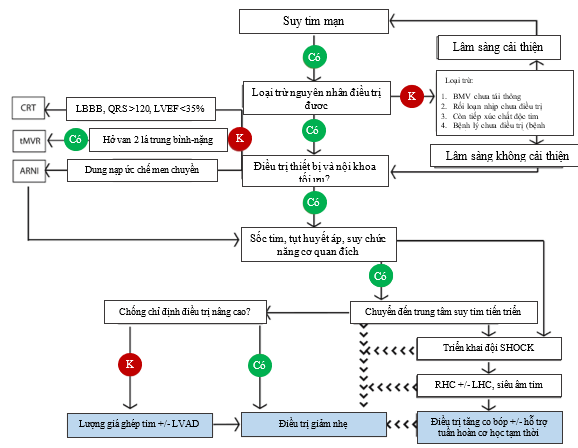
Hình 5. Tiếp cận chẩn đoán và điều trị suy tim tiến triển. ARNI (angiotensin receptor-neprilysin inhibitor), ức chế neprilysin-thụ thể angiotensin; CRT (cardiac resynchronization therapy), điều trị tái đồng bộ tim; LBBB (left bundle branch block), blốc nhánh trái; LHC/RHC (left/right heart catheterization), thông tim trái/phải; LVEF (left ventricular ejection fraction), phân suất tống máu thất trái; tMVR (transcatheter mitral valve replacement), thay van 2 lá qua catheter.Nguồn: Truby, L.K. et al. J Am Coll Cardiol HF. 2020
Những quyết định lâm sàng thường dựa trên những nghiên cứu ngẫu nhiên lớn, tuy nhiên rất nhiều bệnh nhân suy tim giai đoạn D lại không đủ tiêu chuẩn chọn mẫu vào nghiên cứu do lớn tuổi và các bệnh đồng mắc. Một số can thiệp như hỗ trợ tuần hoàn cơ học là một sự lựa chọn giữa chiến lượng điều trị có nguy cơ ngắn hạn thấp nhưng kết cục dài hạn xấu (tức là điều trị nội khoa đến lúc chết) hay chiến lược có nguy cơ ngắn hạn cao hơn do can thiệp xâm lấn nhưng có thể cải thiện được kết cục dài hạn (tức là phẫu thuật cấy dụng cụ hỗ trợ tuần hoàn cơ học). Với mỗi biện pháp can thiệp, các nhà lâm sàng cần hiểu rõ những nguy cơ cũng như lợi ích và thảo luận với bệnh nhân và gia đình để đưa ra quyết định tối ưu. Bên cạnh đó cũng cần một nhóm những chuyên gia về suy tim tiến triển, phẫu thuật tim và chăm sóc giảm nhẹ để cùng đưa ra quyết định hướng điều trị.
- Kết luận
Với nhiều tiến bộ trong phương pháp điều trị ngắn hạn cũng như dài hạn, thời gian sống của những bệnh nhân suy tim tiến triền đã được kéo dài đáng kễ. Tuy nhiên, những phương pháp trên chưa có tác dụng nhiều trong việc làm giảm triệu chứng bệnh cũng như những căng thẳng trong khía cạnh tâm lý xã hội. Do đó điều trị nhóm, bao gồm cả điều trị giảm nhẹ rất quan trọng nhằm nâng cao chất lượng cuộc sống cho người bệnh suy tim giai đoạn cuối.
TÀI LIỆU THAM KHẢO
- James CF, et al. Advanced (stage D) heart failure: a statement from the Heart Failure Society of America Guidelines Committee. (2015) J Card Fail 21(6):519-34.
- Habal MV, Reshad Garan A. Long-term management of end-stage heart failure. (2017) Best Practice & Research Clinical Anaesthesiology, doi: 10.1016/j.bpa.2017.07.003
- Truby LK, et al. Advanced Heart Failure: Epidemiology, Diagnosis, and Therapeutic Approaches. (2020) JACC Heart Fail 8(7):523-536.
- Okano T, Motoki H, Minamisawa M, Kimura K, Kanai M, Yoshie K, et al. Cardiorenal and cardio-hepatic interactions predict cardiovascular events in elderly patients with heartfailure. (2020) PLoS ONE 15(10): e0241003.
- Anita Slomski. Empagliflozin Cuts Cardiovascular Deaths in Advanced Heart Failure. (2020) JAMA. 324, (24): 2476.
- Diop MS, Bowen GS, Jiang L, Wu WC, Cornell PY, Gozalo P, Rudolph JL. Palliative Care Consultation Reduces Heart Failure Transitions: A Matched Analysis. (2020) J Am Heart Assoc 9(11):e013989.
- Martens P, Vercammen J, et al. Effects of intravenous home dobutamine in palliative end-stage heart failure on quality of life, heart failure hospitalization, and cost expenditure. (2018) ESC Heart Fail 5(4):562-569.
- Neal M Dixit, Shivani Shah, et al. Optimizing Guideline-directed Medical Therapies for Heart Failure with Reduced Ejection Fraction During Hospitalization. (2021) US Cardiology Review 15:e07.
- Caitlin C, Catriona JB, Sai KB. A review of the management of patients with advanced heartfailure in the intensive care unit. (2020) Ann Transl Med 8 (13): 828.
- Rosano GMC, Moura B, et al. Patient profiling in heart failure for tailoring medical therapy. A consensus document of the Heart Failure Association of the European Society of Cardiology. (2021) Eur J Heart Fail 23(6): 872-881.
- Potapov EV, Antonides C, Crespo-Leiro MG, et al. 2019 EACTS Expert Consensus on long-term mechanical circulatory support. (2019) Eur J Cardiothorac Surg 56(2): 230-270.
- Mehra MR, Canter CE, Hannan MM, et al. International Society for Heart Lung Transplantation (ISHLT) Infectious Diseases, Pediatric and Heart Failure and Transplantation Councils. The 2016 International Society for Heart Lung Transplantation listing criteria for heart transplantation: A 10-year update. (2016) J Heart Lung Transplant 35, (1): 1-23.
- McDonagh TA, Metra M, Adamo M et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021 Sep 21;42(36):3599-3726. doi: 10.1093/eurheartj/ehab368.
- Morris. AA et al: Guidance for Timely and Appropriate Referral of Patients With Advanced Heart Failure A Scientific Statement From the American Heart Association. 2021;144:e238–e250. DOI: 10.1161/CIR.0000000000001016.
- Mullens W, Damman K, Harjola VP, et al. The use of diuretics in heart failure with congestion: a position statement from the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail 2019; 21:137–55.
- GM et a: Diuretic Therapy for Patients With Heart Failure. JACC VOL. 75, NO. 10, 2020: 1178 – 9 5.
- Rangaswami et al: Cardiorenal Syndrome: Classification, Pathophysiology, Diagnosis, and Treatment Strategies. A Scientific Statement From the American Heart Association. Circulation. 2019; 139:00–00. DOI: 10.1161/CIR.0000000000000664.
- Martens. P et al: Effects of intravenous home dobutamine in palliative end-stage heart failure on quality of life, heart failure hospitalization, and cost expenditure. ESC Heart Failure 2018; 5: 562–569







