I) ĐẶT VẤN ĐỀ:
Trong số các các bệnh nhân (BN) đau ngực nghi ngờ bệnh tim thiếu máu cục bộ (BTTMCB) được chụp mạch vành (CMV), tỷ lệ BN có mạch vành bình thường hoặc bệnh mạch vành (BMV) không tắc nghẽn chiếm tỷ lệ 30% ở nam và 40-60% ở nữ. Tỷ lệ này ngày càng nhiều và được chú ý trong các nghiên cứu đoàn hệ lớn.
BS NGUYỄN THANH HIỀN,
BS NGUYỄN THỊ LỆ TRANG*,
BS VŨ HOÀNG VŨ**
*Khoa TM tổng quát BV Nhân dân 115, ** TK TM Can thiệp BV ĐHYD TP HCM
Sau rất nhiều năm tập trung vào bệnh lý hẹp mạch vành do tắc nghẽn, gần đây chúng ta đã quan tâm nhiều hơn đến cơ chế tổn thương vi mạch máu mạch vành cả về chức năng và cấu trúc hơn là sự giới hạn của dòng chảy ở những BN có triệu chứng hoặc chẩn đoán BTTMCB.
Thuật ngữ “hội chứng X” và “đau thắt ngực do bệnh vi mạch vành” (hoặc “đau thắt ngực do vi mạch”) thường được sử dụng thay thế nhau (hình 1). Đau thắt ngực do bệnh vi mạch vành là một phân nhóm BN chuyên biệt của hội chứng X có rối loạn chức năng vi mạch và/hoặc rối loạn chức năng nội mô. Hệ vi mạch vành gồm tiền tiểu động mạch, tiểu động mạch và mao mạch. Các mạch máu này không được thấy trực tiếp trên chụp mạch vành hoặc chụp cắt lớp điện toán. Vì vậy để tiếp cận và chẩn đoán hội chứng X là một khó khăn trên lâm sang. Qua bài viết này chúng tôi muốn giúp làm rõ hơn về cơ chế sinh lý bệnh, tiếp cận chẩn đoán và điều trị có gì khác biệt với BMV có tắc nghẽn.
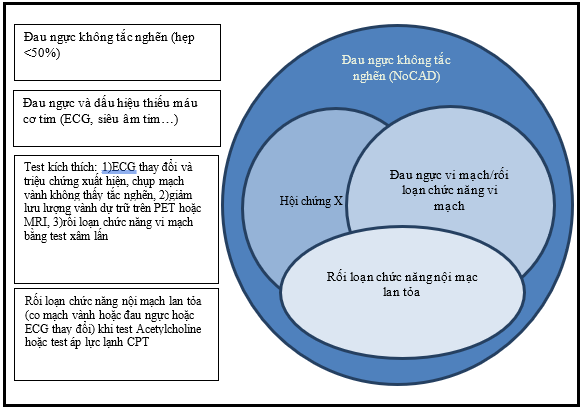
Hình 1:Định nghĩa về các thuật ngữ đau ngực
II) CƠ CHẾ ĐAU NGỰC VI MẠCH:
II.1) Nhắc lại giải phẫu và sinh lý bệnh mạch vành:
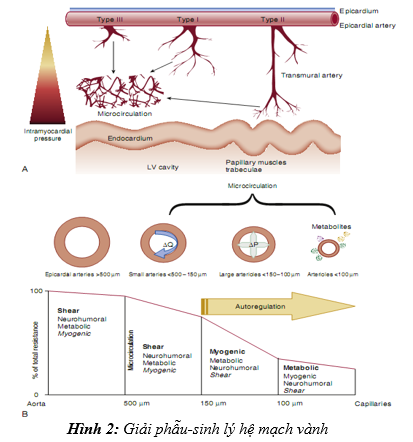
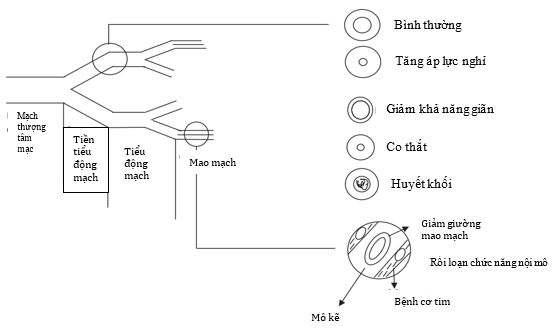
Hình 2: Giải phẫu-sinh lý hệ mạch vành
Hệ thống động mạch vành bao gồm 3 phần với chức năng khác nhau, mặc dù ranh giới giữa chúng không được phân chia rõ ràng (hình 2).
Phần các động mạch đoạn gần (proximal compartment) gồm những động mạch vành ngoại tâm mạc lớn, vai trò như mạch máu cung cấp. Được bao quanh bởi lượng lớn mô mỡ, thành dầy, 3 lớp áo (áo ngoài, áo giữa, áo trong), mạch nuôi mạch máu, có đường kính khoảng 500um cho tới 2-5mm. Những động mạch này có chức năng dự trữ và có một ít sức cản tạo lưu lượng vành (CBF: coronary blood flow) và chia thành 3 types. Type 1 có dạng nhánh, gồm những nhánh nhỏ giảm dần đường kính khi chúng đi sâu đến nội tâm mạc. Type 2 có dạng các nhánh gần xuyên cơ tim đến cung cấp máu cho mô cơ tim và cơ nhú, các vùng dưới nội tâm mạc. Type 3 là dạng các mạch máu ngoại tâm mạc, các nhánh gần nhỏ cung cấp máu cho mô dưới ngoại tâm mạc. Trong thì tâm thu, động mạch ngoại tâm mạc tăng lượng máu dự trữ khoảng 25%, tạo một dạng năng lượng loại thế năng đàn hồi. Năng lượng này khi tới thì tâm trương sẽ bơm máu làm mở các mạch máu trong cơ, những mạch máu mà đã bị đóng lại trong thì tâm thu. Các động mạch đoạn gần đảm nhận 90% CBF cho tim trong thì tâm trương. Càng ra xa các động mạch gần này, chúng sẽ đi sâu vào lớp cơ, khi đó sẽ không còn các động mạch nuôi mạch nữa.
Phần các động mạch trung gian (intermedia compartment) bao gồm các mạch máu tiền mao mạch, chúng có đường kính khoảng 100 – 500 um, áp lực máu giảm dần khi đi càng xa, và chúng không chịu ảnh hưởng trực tiếp bởi các chất vận mạch do chuyển hóa. Chức năng chính của chúng là duy trì áp lực từ động mạch chính khi mà áp lực khuếch tán và lưu lượng máu thay đổi. Các động mạch đường kính khoảng 500 – 150 um thì nhạy cảm với lưu lượng máu, trong khi các mạch máu 150 – 100 um thì nhạy cảm với thay đổi áp lực.
Phần các động mạch xa (distal compartment) gồm các mao mạch, đường kính < 100 um và áp lực rất nhỏ. Các mao mạc này đáp ứng với các chất chuyển hóa tác động lên lưu lượng máu, áp lực mạch chịu tác động bởi hoạt động chuyển hóa từ mô cơ tim xung quanh chúng.
Chức năng chính của vi tuần hoàn là tối ưu hóa việc cung cấp dinh dưỡng và oxy trong mô để đáp ứng vớinhững thay đổi nhu cầu cơ thể. Chức năng quan trọng thứ hai là tránh sự dao động lớn của áp suất thủy tĩnh ở mức độ của các mao quản gây ra sự xáo trộn trong trao đổi mao quản. Do đó, vi tuần hoàn là cực kỳ quan trọng trong việc xác định toàn bộ sức cản mạch máu ngoại vi.
Thiếu máu cục bộ cơ tim xảy ra khi lưu lượng máu mạch vành không thể cung cấp đầy đủ oxy nhu cầu chuyển hóa cơ tim. Đối với BMVvi mạch, việc cản trở cung cấp máu cho mô cơ tim trong những tình huống tăng nhu cầu chuyển hóa dẫn đến thiếu máu cục bộ cơ tim và đau thắt ngực.Có thể phối hợp theo đó là các tổn thương trong các nhánh động mạch vành lớn ảnh hưởng lưu lượng máu ở vùng được cấp máu bởi động mạch thượng tâm mạc, dẫn đến các thay đổi thiếu máu cục bộ có thể phát hiện được như thay đổi đoạn ST trên ECG, rối loạn vận động vùng trên siêu âm tim, khiếm khuyết tưới máu khi gắng sức trên MRI tim hoặc xạ hình tưới máu cơ tim và mảng xơ vữa gây tắc nghẽn trên chụp cắt lớp điện toán mạch vành.
II.1.1) Một số khái niệm (hình 3,4):
CBF lưu lượng vành, là thể tích máu lưu chuyển trên giường mạch trong một thời gian nhất định (ml/phút)
MBF (myocardial blood flow): là thể tích máu lưu chuyển trên một đơn vị cơ tim trong thời gian nhất định (ml/phút/gam)
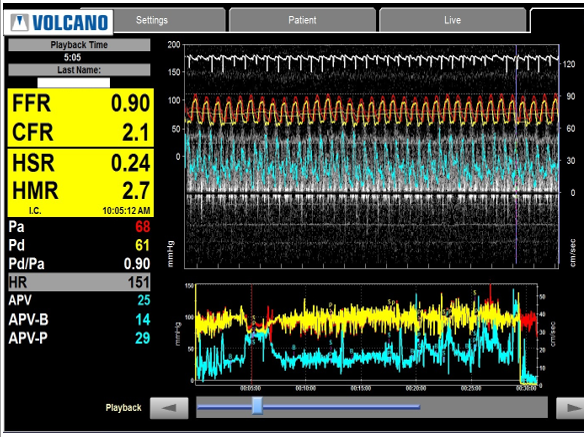
CFR (Coronay Flow Reserve): lưu lượng vành dự trữ, là Tỷ số giữa lưu lượng mạch vành tối đa (bằng thuốc như Adenosine hay Dipyridamole)và lưu lượng mạch vành khi nghỉ (giá trị cao nhất trong thời kỳ tâm trương).CFR đánh giá toàn bộ hệ mạch vành. Trị số bình thường 3-4.Điểm cắt: 2-2.5. CFR đánh giá cả động mạch lớn và vi mạch.
FFR(Fractional Flow Reserve): Phân suất dự trữ mạch vành. Điểm cắt: 0.8. FFR đánh giá động mạch thượng tâm mạc.Cách làm: đo áp lực trong thời kỳ tâm trương động mạch chủ và sau chỗ hẹp với thuốc dãn mạch tối đa.
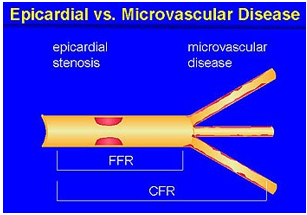
Hình 3. Ý nghĩa của FFR và CFR.
IMR (Index of Microcirculatory Resistance): Tỉ số kháng lực vi mạch – được tính bằng tích số của áp lực mạch vành đoạn xa và thời gian lưu chuyển trung bình (dùng dây dẫn nhiệt và áp lực kết hợp)
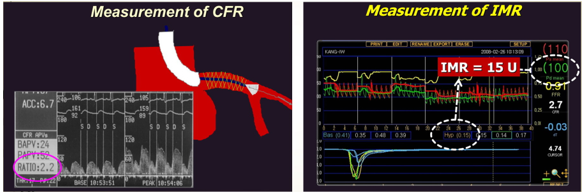
Hình 4.Minh họa cách tính CFR va IMR.
Kháng lực vi mạch vành với thuốc dãn mạch (HMR: Doppler wire-derived
hyperemiamicrocascular resistance).
II.2) Cơ chế đau ngực vi mạch do thay đổi cấu trúc
Bất thường cấu trúc thường gặp trên bệnh cơ tim phì đại và tăng huyết áp. Hình thái cấu trúc thay đổi là do tái cấu trúc vi mạch xuyên thành xảy ra bởi dầy thành mạch, phì đại tế bào cơ tim và tăng collagen lớp áo giữa với nhiều mức độ dầy khác nhau. Tái cấu trúc và dầy thành mạch làm tăng kích thước thành mạch, làm giảm kích thước lòng mạch. Thay đổi này nặng nề hơn trên bệnh cơ tim phì đại. BN tăng huyết áp, và tái cấu trúc mạch máu có tính lan tỏa, không chỉ riêng phần cơ tim phì đại, mà còn lan toàn thất trái và một phần thất phải. Lưu lượng vành trên một đơn vị cơ tim (MBF) và lưu lượng dự trữ vành (CFR: coronary flow reserve) giảm trong toàn thất trái. Tái cấu trúc này cũng gặp trong bệnh vi mạch vành, bao gồm cả đau ngực mạch vành nguyên phát. Cuối cùng các thay đổi cấu trúc tưới máu xuyên thành thường gặp trong bệnh amyloidosis và bệnh Fabry.
II.3) Cơ chế đau ngực vi mạch do thay đổi chức năng
Do nhiều cơ chế tác động gây nên giảm giãn nở vành và tăng co mạch vành.
II.3.1) Thay đổi chức năng tế bào nội mô
Thay đổi này làm giảm lưu lượng vành ngay khi nghỉ hay trong khi cơ tim tăng co bóp (khi đang hoạt động thể lực), liên quan đến chất gây co mạch, NO từ tế bào nội mô làm giãn mạch, do đó sẽ rất nguy hại khi chức năng tế bào nội mô bị thay đổi. NO là chất dễ bay hơi, thời gian bán thải ngắn (56s) nên khó có thể đo được. Việc xác định bất thường NO thông qua việc đo CBF, sử dụng chất gây tăng tiết NO nhưng lưu lượng vành vẫn giảm hoặc không đổi. Dùng acetylcholine kích hoạt thụ thể muscarinic, sau đó dùng máy Doppler ghi lại CBF là phương pháp thường sử dụng tuy có nhiều giới hạn so với nghiệm pháp đo xâm lấn. Một phương pháp khác được sử dụng để đoCBF trên một đơn vị cơ tim là test áp lực lạnh (CPT: cold pressure testing) thông qua PET (Position emission tomography)
Nếu tế bào nội mô bất thường, mạch vành sẽ không giãn với kích thích, thậm chí còn co mạch do bất thường nội mô tăng lên do tác động bởi test áp lực lạnh CPT. Nguyên nhân giảm sản sinh NO là do giảm hoạt động của men eNOs, loại men xúc tác cho quá trình tổng hợp NO từ L-arginine, gây ra do các chất tác động gây hại trên receptor acetylcholine/muscarinic, bradykinin, histamine, hoặc tăng lực vặn xé (shear stress). Trong một số trường hợp, chất tổng hợp tương tự NO BH4 có thể cải thiện và làm chức năng tế bào nội mô về bình thường, vì thế việc giảm BH4 cũng góp phần làm giảm sự dãn mạch. Việc suy giảm chức năng nội mô không chỉ ở việc giảm sản xuất NO, mà còn ở việc tăng thoái hóa NO. NO có thể bị ức chế hoạt động bởi các chất oxy hóa cao có gốc O2-. Quá nhiều chất oxy hóa ROS làm giảm hoạt tính sinh học của NO vì chúng biến NO thành peroxynitrite ONOO- và làm thay đổi men eNOS. Khi không thể tổng hợp NO, eNOS sản xuất chất oxy hóa cao ROS, chất bão hòa oxy ROS-mediated oxidation này lại là cơ chế chính khiến men eNOS không thực hiện xúc tác tổng hợp NO. Quá trình này có trong nhiều bệnh như: đái tháo đường, béo phì, hút thuốc lá, và với một số yếu tố nguy cơ tim mạch khác. Một số chất chống oxy hóa như glutathione và những vitamin có tác dụng cải thiện chức năng nội mạch giúp giãn mạch vành tốt hơn. NO kéo dài hiệu quả giãn mạch bằng cách thấm vào ty thể tế bào cơ trơn và kích hoạt guanylyl cyclase GC bằng việc gắn vào gốc heme của enzyme. Trong một số trường hợp, rối loạn chức năng giãn mạch cũng xảy ra khi lượng NO bình thường. Điều này có thể do sự oxy hóa gốc heme của GC khiến cho enzyme không thể đáp ứng với NO. Rối loạn chức năng nội mô cũng có thể do giảm hoạt hóa của EDHF và prostacyclin PGI2. Chất oxy hóa mạnh có thể ức chế tổng hợp prostacyclin. Điều này khiến cho tiền chất PGH2 không thể thành PGI2 mà phải tổng hợp thành thromboxane A2 (TXA2), một chất gây co mạch mạnh.
II.3.2) Thay đổi tính giãn mạch không phụ thuộc tế bào nội mô:
Sự bất thường giãn mạch không phụ thuộc nội mô thường có sự giảm CBF và/ hoặc kháng lực vành giảm đáp ứng với chất gây giãn động mạch vành và tiền mao mạch vành (adenosine, dipyridamole, papaverine). Có2 con đường chính làm giãn cơ trơn: thứ nhất dựa vào sự hoạt động men adenylyl cyclase tạo cAMP, làm mở kênh KATP và ức chế kênh canxi vào tế bào, con đường này thường do kích hoạt receptor purinergic A2 và thụ thể β2; thứ hai là con đường trong tế bào kích hoạt GC guanylyl cyclase, tạo cGMP, được kích hoạt bởi NO. Vì thế sự bất thường cơ trơn gây rối loạn giãn mạch thường liên quan đến bất thường thụ thể chuyên biệt, hoặc bất thường trong một hoặc hai con đường làm giãn cơ trong tế bào. Bất thường vi mạch không do nội mô thường có bất thường mở kênh KATP. Việc kích hoạt cAMP và cGMP làm mở kênh KATP, làm tăng phân cực màng và đóng kênh Ca. Thay đổi kênh K khác, như KCa và KV, có thể làm rối loạn chức năng giãn vi mạch. Tóm lại rối loạn sự giãn cơ trơn làm giảm sự giãn mạch vành, giảm CBF.
II.3.3) Co mạch:
Co vi mạch có thể do tăng các chất gây co mạch (hệ thống hay cục bộ) và/hoặc tăng kích thích của tế bào cơ trơn với các chất này. Một số chất gây co vi mạch mạnh nhưng với tác dụng tương đối ít trên mạch vành ngoại tâm mạc. Trên người, khi tiêm neuropeptide Y hoặc liều cao acetylcholine có thể gây đau ngực và thiếu máu cơ tim trên BN có mạch vành bình thường và không có thay đổi gì trên mạch vành ngoại tâm mạc. Trên BN có hẹp động mạch vành, tiêm serotonin làm co vi mạch lan tỏa và giảm tưới máu vi mạch, nhưng không làm nặng tình trạng tắc nghẽn trước đó, điều này có thể do đáp ứng của nội mô và thụ thể 5HT trên cơ trơn với serotonin. Co thắt vi mạch vành có thể thấy trên BN tắc nghẽn vành mạn hoặc không hề có tắc nghẽn trước đó. Co thắt vi mạch nặng cũng có thể gặp trên một sốBNnhồi máu cơ tim ST chênh đã PCI trước đó.
II.3.4) Tắc nghẽn lòng mạch:
Gây nên bởi xơ vữa và huyết khối thường xảy ra trong khi thực hiện PCI và do quá trình nghiền nhỏ mảng thuyên tắc, hoặc là những mảng thành mạch bong tróc. Điều này thường gây nên những mảng nhồi máu nhỏ (infarctlet), men tim tăng cao thường có tiên lượng xấu hơn. Thuyên tắc huyết khối vi mạch gây ra bởi vi huyết khối và kết tập tiểu cầu kèm bạch cầu cộng gộp vào các thành phần thuyên tắc trước đó trên BN nhồi máu ST chênh lên. Thuyên tắc vi mạch là một quá trình liên quan tới biến cố sau tái tưới máu mạch vành, bao gồm rối loạn chức năng nội mô khiến vi mạch không giãn, và sự co mạch thông qua kích hoạt tiểu cầu, sự phóng thích TX2 và 5HT, và phản ứng viêm.
II.4) Đau ngực vi mạch do cơ chế bên ngoài mạch máu
II.4.1) Chèn ép mô quanh thành mạch:
Trong một chu chuyển tim, CBF ảnh hưởng bởi nhiều yếu tố, sức ép trong cơ tim và áp lực trong buồng thất thì tâm thu và tâm trương. Khoảng 90% CBF xảy ra trong thì tâm trương, do đó bất thường thì tâm trương ảnh hưởng lớn đến tưới máu cơ tim. Tăng áp lực vi mạch trong thì tâm thu làm cản trở sự tưới máu dưới nội tâm mạc khi thì tâm trương, dẫn tới làm giảm tưới máu nội tâm mạcCBF giảm khi áp lực trong buồng thất thì tâm trương tăng. Điều này gặp trong phì đại thất trái nguyên phát và thứ phát, và cũng gặp trong xơ hóa mô kẽ và xơ hóa quanh mạch. Giảm CBF thì tâm trương nặng thêm khi áp lực mạch vành thì tâm trương nhỏ hơn áp lực trong buồng thất, ví dụ như trên bệnh nhân hẹp chủ nặng, hẹp vành nặng, co thắt mạch vành, hoặc huyết áp thấp.
II.4.2) Phù mô kẽ:
Thay đối tính thấm mao mạch gây nên phù mô kẽ cơ tim và rối loạn tưới máu vi mạch vành. Phù mô kẽ không làm giảm lưu lượng đỉnh CFR, nhưng lại làm giảm lưu lượng vành CBF trên những BN thuyên tắc vi mạch sau STEMI. Phù mô kẽ do phối hợp nhiều cơ chế: (1) tăng áp lực thẩm thấu, tăng chuyển hóa dị hóa lan tỏa trong mô kẽ thời kì thiếu máu, làm hút nước vào mô kẽ khi được tái thông; (2) tăng tính thấm thành mạch đối với nước và protein, cũng như bất thường các kênh vận chuyển ion, hậu quả làm tổn thương tế bào nội mô thời kì tái tưới máu, (3) hiện tượng viêm liên quan tới tái tưới máu. Tăng chèn ép vi mạch làm nặng thêm tình trạng thuyên tắc vi mạch do kết tập tiểu cầu.
II.4.3) Thời gian tâm trương:
Như chúng ta đã biết, kéo dài thời gian tâm trương đóng vai trò quan trọng đối với tưới máu cơ tim. Vì thế, giảm thời gian tâm trương có thể giảm tưới máu cơ tim, khi mà áp lực trong buồng thất lớn hơn áp lực trong lòng mạch vành, ví dụ trong trường hợp hẹp chủ.
Hình 5: tóm tắt các cơ chế sinh lý bệnh đau ngực vi mạch.
III) Tiếp cận lâm sàng và các biện pháp chẩn đoán:
III.1) Phân loại lâm sàng:
Dựa vào cơ chế bệnh sinh ta phân loại lâm sàng theo rối loạn vi mạch vành theo 4 type
Type 1 không có tắc nghẽn mạch vành mạn và bệnh cơ tim; type 2 có bệnh lý cơ tim; type 3 có tắc nghẽn mạch vành mạn; type 4 liên quan tới các thủ thuật như phẫu thuật bắc cầu, tái thông vành qua da. Những thể lâm sàng này có thể phối hợp nhiều yếu tố về bất thường cấu trúc và chức năng vi mạch, cũng như các vùng mô quanh vi mạch. Đau ngực vi mạch có thể đơn độc hoặc phối hợp các cơ chế tắc nghẽn vành và bệnh cơ tim dẫn đến thiếu máu cơ tim. Trong chuyên đề này chúng tôi tập trung vào type 1,3,4 vì có liên quan nhiều đến các rối loạn liên quan đến vi mạch vành vẫn chưa được hiểu rõ.
III.1.1) Type 1: không có bệnh cơ tim và không có tắc nghẽn:
Type này gây ra do tiếp xúc các yếu tố nguy cơ và gây nên đau ngực nguyên phát, không liên quan đến các triệu chứng thiếu máu cơ tim, nhưng làm giảm CFR. Sự giảm này không làm giới hạn hoạt động của cơ tim trong sinh hoạt hằng ngày. CFR giảm nặng tỉ lệ thuận với tiếp xúc yếu tố nguy cơ càng nhiều. Giảm yếu tố nguy cơ làm cải thiện CFR. Các yếu tố nguy cơ lbao gồm: hút thuốc lá, tăng mỡ máu, tăng huyết áp, đái tháo đường và đề kháng insulin, các bệnh lý viêm như viêm khớp dạng thấp, lupus hệ thống, xơ hóa hệ thống là những yếu tố nguy cơ làm nặng thiếu máu cơ tim, tăng nguy cơ tử vong tim và bệnh lý tim, và giảm lưu lượng vành.
III.1.2) Type 3:
Rối loạn chức năng vi mạch có trong cả bệnh mạch vành ổn định và hội chứng vành cấp. Trong hội chứng vành cấp, rối loạn chức năng vi mạch đóng vai trò tạo huyết khối, gặp trong STEMI khi đã được tái tưới máu thành công động mạch vành thủ phạm, qua đó BN giảm CBF và có hình ảnh thuyên tắc vi mạc, cho thấy có nguy cơ cao của biến chứng tim mạch sau can thiệp. Rối loạn chức năng vi mạch làm đau ngực nặng kéo dài trên BN BMV mạn, và có tắc hoàn toàn một động mạch vành lớn, mà không có nhồi máu cơ tim trước đó. BN có những cơn đau ngực dao động và giảm ngưỡng gắng sức. Trên holter đau ngực thường xuất hiện khi nhịp tim chậm, và bớt hoặc hết khi nhịp tim tăng. Mặc dù BN không có tắc mạch lớn – co thắt vùng tắc hẹp làm giảm tưới máu nặng, và cơ chế đau ngực này được giải thích là do thay đổi lớn kháng lực vi mạch vành. Các test chẩn đoán cho thấy giảm CFR, nhưng động mạch vành lớn thì bình thường.
Bên cạnh việc điều trị nội, PCI kết hợp giúp cải thiện triệu chứng, nhưng không giảm tỉ lệ tử vong, đột tử do tim, nhồi máu cơ tim, hay các biện pháp can thiệp trong tương lai. Ngoài ra, tỉ lệ đau ngực sau đó vẫn cao mặc dù đã PCI thành công. Trong nghiên cứu Courage có hơn 30% vẫn còn đau ngực trong 1 năm sau PCI, và sau 5 năm không có sự khác biệt tỉ suất đau ngực giữa type BN có và không làm PCI. Mặc dù trong trường hợp PCI thành công, loại bỏ được tắc nghẽn và biến chứng huyết động, nhưng những cơ chế cơ học bao gồm cả rối loạn chức năng vi mạch làm góp phần gây nên thiếu máu cơ tim và đau ngực.
III.1.3) Type 4:
Trên những BN BMV mạn có rối loạn chức năng vi mạch vành tái thông bằng PCI hoặc CABG có thể làm giảm CFR trên vùng chi phối của động mạch tái thông. Co thắt mạch liên quan receptor-α của những vi mạch gây nên hạn chế dòng chảy, và điều này có thể phòng ngừa bằng thuốc kháng α-adrenergic dùng trước khi tái thông. Hiện tượng này gây nên việc chậm đáp ứng với gắng sức sau can thiệp thành công.
Co thắt mạch, huyết khối vi mạch có thể gây nên rối loạn chức năng vi mạch trên những BN được PCI và CABG. Những mảng xơ vữa lớn được nghiền nhỏ đẩy đến các vi mạch nhỏ, gây nên nhồi máu vùng nhỏ, và làm tăng các marker hoại tử. Nghiên cứu trên 7500 BN, có khoảng 29% BN tăng troponin sau PCI, và 15% tăng thỏa tiêu chuẩn nhồi máu cơ tim. BN có nhồi máu sau PCI (type 4a) tăng nguy cơ tử vong và tái thông mạch lại. PCI.
Khi PCI cho mô tĩnh mạch hiển thông nối, nên dùng dụng cụ bảo vệ để giảm huyết khối đoạn xa nhằm giúp giảm nhồi máu và các biến cố tim mạch. Dùng statin trên cả BN PCI cấp cứu và chọn lọc. Tương tự PCI, tăng men tim đánh giá sau 2 đến 24 giờ sau CABG cũng có khả năng tiên lượng. Tổn thương sau phẫu thuật và tuần hoàn ngoài cơ thể góp phần vào tình trạng viêm hệ thống, tăng cytokines, gây nên rối loạn chức năng vi mạch.
III.2) Các biện pháp chẩn đoán:
Không giống như các động mạch vành thượng tâm mạc, đánh giá chức năng vi tuần hoàn mạch vành không thể xác định được bằng chụp động mạch vành.Các động mạch vành nhỏ có thể được đánh giá bằng sinh thiết nội mô, nhưng đây là thủ thuật rất xâm lấn và không cho phép để đánh giá chức năng của vi tuần hoàn. Một số phép đo dựa trên định lượng lưu lượng máu qua tuần hoàn mạch vành đã được sử dụng để mô tả chức năng của vi mạch vành. CFR được đo trong phòng thông tim là tỉ số giữa vận tốc đỉnh trung bình lúc tăng tưới máu so với ban đầu. CFR < 2,5 giúp chẩn đoán bệnh vi mạch vành. Hiện tại đây là tiêu chuẩn vàng để chẩn đoán bệnh.
Có thể dùng kỹ thuật xâm lấn hay không xâm lấn để đánh giá CBF, MBF và CFR như: siêu âm màu đánh giá dòng chảy nội mạch vành, SAT qua thành ngực, PET hay MRI tim mạch. Tuy nhiên mỗi biện pháp đánh giá luôn có mặt hạn chế riêng.
III.2.1) Các kỹ thuật chẩn đoán không xâm lấn:
III.2.1.1) Siêu âm tim:
Siêu âm tim qua thành ngực có thể đánh giá CFR thông qua đo Doppler xung.Các chỉ số Doppler xung có thể ước đoán CFR không xâm lấn chính xác, tiên lượng các BN bệnh vi mạch vành và đánh giá đáng tin cậy đáp ứng điều trị tiếp theo mà không cho BN phơi nhiễm với bức xạ ion hóa; tuy nhiên, siêu âm tim qua thành ngựccó cửa sổ siêu âm đầy đủ chỉ ở 70-80% bệnh nhân.
Siêu âm tim có thể nhìn thấy được LAD, khi dùng phổ Doppler màu, đánh giá CFR bằng cách tính tỉ lệ giữa lưu lượng máu vành đỉnh thì tâm trương CBF khi đã dùng giãn mạch tối đa (vd: adenosine) so với lưu lượng máu vành lúc nghỉ CBF baseline. Tỉ lệ này CFR < 2.0 (bình thường từ 2.5 – 5.0) thì được coi là có bất thường chức năng vi mạch, và có giá trị tiên đoán khoảng 85% – 97%.
III.2.1.2) Cộng hưởng từ
Với chất cản từ gadolinium cho phép đánh giá lưu lượng máu xuyên thành và dưới nội mạc. MRI tim là test đáng tin cậy để đánh giá rối loạn chức năng vi mạch thông qua các chỉ số CFR, CBF. Ngoài ra MRI tim còn giúp đánh giá giải phẫu tim, chức năng mạch máu nói chung. Các chất gadolinium giúp để tăng khả năng nhìn thấy được vùng dưới nội tâm mạc. Thay đổi độ tương phản gadolinium cho thấy có bất thường lưu lượng vành và rối loạn chức năng vi mạch. Tuy nhiên, MRI timkhá đắt tiền, có xảo ảnh khi có cử động của bệnh nhân, khó thực hiện trên bệnh nhân có hội chứng sợ khoảng trống và gắn các dụng cụ trợ tim.
III.2.1.3) PET và CT
PET cũng là một test tin cậy cao để đánh giá chức năng vi mạch. Nó dùng một chất chỉ điểm cho phép đánh giá lưu lượng máu tại một vùng cơ tim khi nghỉ và sau khi giãn mạch tối đa. Tuy nhiên, PET rất mắc, không được dùng rộng rãi, chỉ được sử dụng hạn chế trong một vài trung tâm chuyên biệt.
CT cũng là một trong những phương pháp không xâm lấn mới để chẩn đoán rối loạn chức năng vi mạch. Sau khi tiêm chất cản quang, động học của chất cản quang sẽ cho thấy các vùng giải phẫu chuyên biệt. Lưu lượng và áp lực vành sẽ được tính toán, và sau đó cho phép đánh giá chức năng vi mạch.
III.2.1.4) Các nghiệm pháp gắng sức:
Các stress test thông thường thì không đủ để xác định đau ngực vi mạch không tắc nghẽn. Test bình thường không thể loại trừ được đau ngực không tắc nghẽn cũng như vai trò của các test xâm lấn khác.
Ở BN đau thắt ngực do bệnh vi mạch vành có thể có hoặc không bất thường; tuy nhiên, kết quả nghiệm pháp gắng sức bất thường ở các BN với động mạch vành bình thường hoặc gần bình thường cho thấy họ có thể có bệnh vi mạch vành. Trên nghiệm pháp ECG gắng sức, đoạn ST chênh xuống có thể xảy ra ở các bệnh nhân bệnh vi mạch mành, có thể siêu âm tim Doppler qua thành ngực có CFR giảm.
III.2.2) Đánh giá bằng các biện pháp xâm lấn trong phòng thông tim:
III.2.2.1) Đánh giá chức năng nội mô
Xét nghiệm chức năng nội mô cần sử dụng acetylcholine nội mạch vành. Acetylcholine gây ra dãn mạch ở nội mô bình thường thông qua sản xuất nitric oxide, dẫn đến tăng tín hiệu cGMP ở các tế bào cơ trơn. Ngược lại, acetylcholine không gây dãn mạch ở BN rối loạn chức năng nội mô và thậm chí gây ra co mạch nghịch thường vì tác dụng lên các thụ thể muscarinic ở cơ trơn động mạch. Chỉ số dãn mạch qua trung gian nội mô đáp ứng với acetylcholine được đánh giá bằng cách sử dụng chụp mạch vành định lượng. Chức năng nội mô thượng tâm mạc được đặc trưng bởi đáp ứng mạch máu với acetylcholine nội mạch vành: đáp ứng bình thường nếu tăng đường kính, rối loạn chức năng nếu không thay đổi hoặc giảm đường kính; và co thắt mạch vành nếu giảm ≥75% đường kính đáp ứng với acetylcholine so với ban đầu. Các BN co thắt mạch mạch vành nặng có thể hồi phục nhanh với nitroglycerine.
Rối loạn chức năng nội mô vi mạch vành cũng có thể được đánh giá qua test acetylcholine nội mạch vành. Rối loạn chức năng được xác định bởi giảm CBF khi được xác định bởi chụp mạch vành phối hợp với dây dẫn vận tốc Doppler,và co thắt mạch vành nếu có triệu chứng hoặc thay đổi ECG thiếu máu cơ tim với giảm <75% đường kính động mạch vành đáp ứng với acetylcholine. Trong khi giảm dãn mạch thượng tâm mạc đáp ứng với tiêm acetylcholine nội mạch vành là tiêu chuẩn chẩn đoán rối loạn chức năng nội mô, có sự khác nhau đáng kể trong mức độ rối loạn chức năng trong các nhánh động mạch vành thượng tâm mạc. Các đoạn động mạch có thể co thắt, dãn hoặc vẫn không thay đổi đáp ứng với acetylcholine ở cùng một bệnh nhân, cho thấy rằng mức độ rối loạn chức năng nội mô động mạch vành thượng tâm mạc biến thiên ở cùng một hệ động mạch vành.Trong khi tiêu chuẩn hiện tại là đo chỉ số đường kính ở phần xa catheter 5 mm và vuông góc với đường trung tâm của động mạch, điều này sẽ có thể thay đổi khi các chỉ số phức tạp hơn có thể thực hiện bởi các chương trình chụp mạch vành định lượng bán tự động.
III.2.2.2) Đánh giá chức năng vi mạch vành
Chức năng vi mạch phụ thuộc nội mô có thể đánh giá thông qua tiêm acetylcholine nội mạch vành như đã thảo luận ở trên. Đánh giá chức năng vi mạch không phụ thuộc nội mô được thực hiện với adenosine để giảm sung huyết, dẫn đến dãn tế bào cơ trơn và dãn mạch của hệ vi mạch. Một số chỉ số được đưa ra để đánh giá chức năng vi mạch ở các BN có hoặc không có bệnh động mạch vành thượng tâm mạc. CFR phản ánh chỉ số kết hợp của dung tích động mạch thượng tâm mạc và giường vi mạch để đạt lưu lượng máu tối đa đáp ứng với kích thích tăng tưới máu. Trong trường hợp không mắc bệnh động mạch vành thượng tâm mạc có ý nghĩa huyết động (FFR > 0,8), CFR có thể được sử dụng là chỉ số xơ vữa vi mạch vành đơn thuần, CFR < 2,5 chỉ điểm bất thường hệ vi mạch vành.
Với sự tiến bộ của các dây dẫn chuyên dụng có thể đo cả vận tốc và áp lực trong các động mạch vành, ngày nay CFR có thể được đánh giá trực tiếp bằng dây dẫn vận tốc Doppler trong phòng thông tim. Các chỉ số mới hơn bao gồm IMR và HMR. IMR có vẻ đánh giá chức năng vi mạch có thể lặp lại ở các BN có hoặc không có hẹp động mạch thượng tâm mạc và có thể được sử dụng phối hợp với FFR để đánh giá sinh lý động mạch vành thượng tâm mạc và vi mạch với một dây dẫn áp lực; tuy nhiên, không có dữ liệu bình thường của IMR và cần nhiều dữ liệu trước khi khuyến cáo tiêu chuẩn tham khảo. HMR cũng là một chỉ số hấp dẫn để đánh giá chức năng vi mạch không phụ thuộc vào hẹp động mạch vành thượng tâm mạc, nhưng phụ thuộc vào dây dẫn phối hợp áp lực và vận tốc và không tính dự trữ tuần hoàn bàng hệ.Mặc dù FFR đã được thừa nhận sử dụng chủ đạo, nhưng đánh giá vi mạch với IMR hoặc HMR cũng được sử dụng trong các tình huống nghiên cứu.
III.3. Cách tiếp cận chẩn đoán:
Hình 6 và 7 giới thiệu sơ đồ hướng dẫn tiếp cận BN đau ngực có dấu hiệu thiếu máu cục bộ cơ tim, cách lựa chọn test chẩn đoán. Hình 8 minh họa một số test chẩn đoán
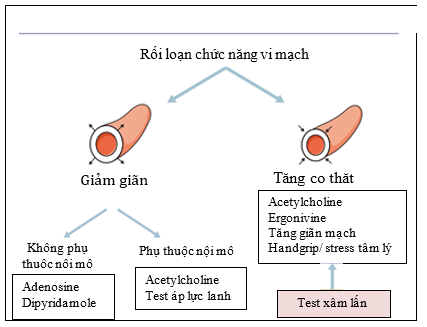
Hình 6. Các test chẩn đoán rối loạn chức năng vi mạch tùy theo cơ chế sinh bệnh
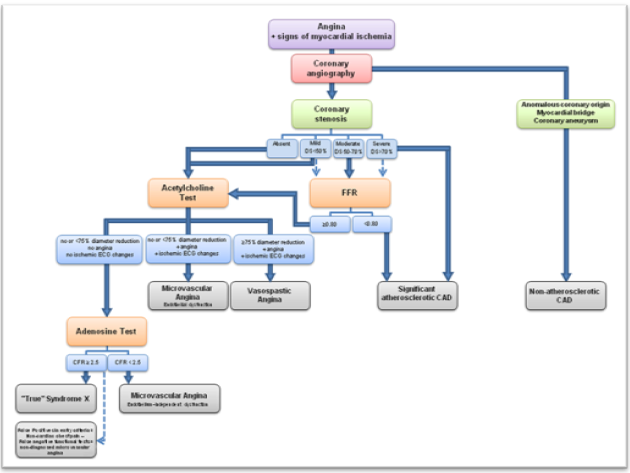
Hình 7: Sơ đồ chẩn đoán đau ngực không tắc nghẽn. theo sơ đồ này, hiện chúng ta chưa thực hiện làm test Acetylcholine và test adenosine đo CFR
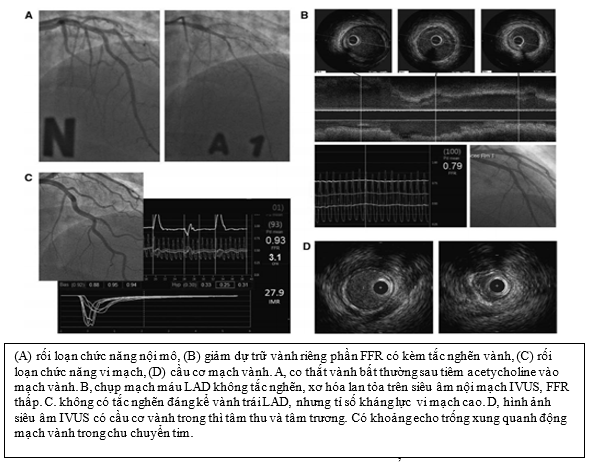
Hình 8:Hình ảnh minh họa các test chẩn đoán
IV) Tiên lượng:
Khoảng 20% đến 30% BN có rối loạn vi mạch ổn định trải qua các triệu chứng tiến triển xấu đi dẫn đến suy giảm chất lượng cuộc sống có ý nghĩa.Trong số các BN bị đau thắt ngực và chụp động mạch bình thường, nhóm có nguy cơ cao thường là những người bị thiếu máu cục bộ, bệnh mạch vành mạn nhẹ và rối loạn chức năng vi mạch. Các BN đau thắt ngực do rối loạn chức năng vi mạch tăng hơn 2 lần nguy cơ biến cố tim mạch nặng trong thời gian hơn 3 năm.
V) Điều trị
Hướng dẫn điều trị dựa trên chứng cứ của hội chứng X vẫn chưa có vì chúng ta vẫn còn thiếu những hiểu biết rõ ràng về cơ chế sinh bệnh học của hội chứng này. Hơn nữa, chúng ta thiếu các thực nghiệm ngẫu nghiên có đối chứng đủ mạnh được thực hiện ở những BN này.
Trước đây, tiên lượng của BN có hội chứng X thường được xem là lành tính. Nhưng NC WISE (Đánh giá hội chứng thiếu máu cơ tim ở phụ nữ) nhận thấy ở phụ nữ có đau thắt ngực dai dẳng: có tỷ lệ biến cố tim mạch kết hợp, bao gồm NMCT không tử vong, đột quỵ, suy tim sung huyết, và tử vong tim mạch gấp đôi so với nhóm phụ nữ không có đau thắt ngực. Nên chúng ta cần quan tâm trong thực hành
V.1) Nguyên tắc chung:
Nhằm đạt mục tiêu điều trị là giảm đau ngực và cải thiện tiên lượng sống còn cho BN thì việc điều trị toàn diện là mấu chốt quan trọng trong điều trị đau ngực vi mạch. Chiến lược điều trị bao gồm quản lý các bệnh đồng mắc, điều chỉnh tích cực yếu tố nguy cơ và thay đổi lối sống bằng cách khuyến khích tập thể dục, tránh thuốc lá và sử dụng chế độ ăn lành mạnh cho tim. Tất cả các yếu tố nguy cơ tim mạch (đặc biệt hút thuốc lá và tăng huyết áp) tạo ra nồng độ oxy phản ứng gây bệnh, có tác dụng gây hại cho chức năng nội mô. Điều trị các yếu tố nguy cơ của bệnh vi mạch có cải thiện các kết cục tim mạch hay không còn chưa rõ; điều này ngược lại với các biện pháp đã được xác định điều trị các bệnh đồng mắc và cải thiện sống còn ở các bệnh nhân bệnh động mạch vành do tắc nghẽn. Statin dùng cho mọi bệnh nhân.
Ngoài các thuốc điều trị đã được nghiên cứu và sử dụng rất nhiều trên lâm sàng, các thuốc mới cũng như các liệu pháp điều trị mới cũng nên được nghiên cứu và ứng dụng trong điều trị. Tóm tắt các biện pháp điều trị nêu ở hình 9.
V.2) Các thuốc điều trị giảm đau ngực:
· Dùng nitroglycerin NDL lúc mới khởi phát cơn đau, vừa để giảm thời gian của triệu chứng lẫn giảm thiếu máu cơ tim (Mặc dù cơn đau có thể tự hết).
· Nitrate và ức chế calcium (Nifedipine, Diltiazem và Verapamil) là lựa chọn đầu tay để điều trị đau thắt ngực do co thắt. Những thuốc này phòng ngừa co thắt mạch máu và tăng dãn mạch vành nhỏ, nhờ vậy làm giảm triệu chứng. Chúng ta có thể sử dụng đơn độc hay phối hợp.
· Ức chế men chuyển giúp kiểm soát huyết áp hiệu quả, chức năng nội mô và thiếu máu cơ tim do gắng sức, cũng như có thể làm giảm tăng hoạt động của hệ RAA, đặc biệt ở phụ nữ sau mãn kinh.
· Ức chế beta có thể giảm tần suất và độ nặng của đau thắt ngực và cải thiện khả năng gắng sức ở BN hội chứng X. Những ức chế beta thế hệ mới với tác dụng tích cực trong phóng thích NO, như Carvedilol và Nebivolon, có thể hiệu quả hơn trong điều trị hội chứng X.
· Tất cả BN đau ngực vi mạch nên khởi dùng statin, đặc biệt ở BN có bằng chứng XVĐM trên chụp mạch máu.
· Hoạt chất xanthine: thường sử dụng điều trị hen dựa trên tác dụng ức chế men phosphodiesterase, aminophylline cũng là chất đối vận không chọn lọc receptor adenosine, có thể sử dụng trên bệnh nhân đau ngực liên quan đến adenosine. Aminophylline giúp cải thiện tình trạng đau ngực do gắng sức.
V.3) Những phương thức khác:
Trên những bệnh nhân đau ngực không do tắc nghẽn vành, đồng vận alpha clonidine (0.1 mg dùng 2 lần/ngày trong 3 tuần) không giảm đau ngực quá rõ rệt. Nicorandil làm giảm đau ngực và cải thiện tình trạng gắng sức, những mạch máu và tăng ngưỡng kích thích đau ngực. Chất đối kháng men phosphodiesterase chống dùng chung với nitrate và nicorandil vì nguy cơ tụt huyết áp. Perhexiline ức chế men palmitoyltransferase và tăng sử dụng carbohydrate, được sử dụng như chất gây giãn mạch, nhưng có nguy cơ độc thần kinh và độc gan, cải thiện đau ngực và tăng khả năng gắng sức được sử dụng đầu tiên tại Úc và New Zealand. Trimetazidine ức chế sử dụng acid béo tự do và kích thích sử dụng oxy mô, giảm toan hóa mô, giúp tích trữ năng lượng mô, tuy rằng có cải thiện đau ngực trên bệnh nhân đau ngực tắc nghẽn mạn, nhưng hiệu quả trên bệnh nhân đau ngực do dây X cần được nghiên cứu thêm.
V.3.1) Liệu pháp xung nhịp tăng cường ngoài cơ thể (EECP):
EECP là một phương pháp không xâm lấn, được FDA công nhận, điều trị nhiều lần trong tuần để đạt hiệu quả tốt nhất. Trên những bệnh nhân CAD, EECP cải thiện thời gian đổ đầy, giảm đau ngực, và thời gian thay đổi ST.
V.3.2) Liệu pháp tế bào gốc:
Đang được sử dụng trên BN CAD và rối loạn chức năng thất trái sau nhồi máu. Biện pháp này đang được nghiên cứu và cho thấy có hồi phục việc giảm chức năng mạch vành. Trên động vật đã cho thấy tiêm tế bào gốc giúp làm tăng trở lại số lượng các vi mạch vành.
V.3.3) Thuốc kháng trầm cảm 3 vòng liều thấp:
Imipramine, amitriptyline có hiệu quả trong trường hợp đau ngực kéo dài. Cơ chế vẫn chưa được đầy đủ, có thể tái hấp thu norepinephrine, nó cũng ngăn ngừa kháng cholinergic và đối vận α, do đó có thể có tác dụng giảm đau.
V.3.4) Đốt hạch giao cảm ngực:
Làm tăng lưu lượng vành lúc nghỉ, làm giảm tần suất và mức độ đau ngực, thông qua việc giảm tiêu thụ oxy, có hiệu quả trên những bệnh nhân đau ngực không có tắc hẹp.
V.3.5) Liệu pháp hormone thay thế giai đoạn mãn kinh:
Đau ngực tăng lên sau giai đoạn mãn kinh, cùng với tăng đái tháo đường, tăng huyết áp, rối loạn lipid máu. Giảm lượng estrogen, thay đổi tỉ lệ estrogen/testosterone làm tăng nguy cơ đau ngực. Hầu hết BN đau ngực vi mạch vành ở độ tuổi trong và sau mãn kinh. Estrogen thay thế có lợi trên những BN thiếu máu cơ tim, cải thiện chức năng mạch vành khi không có hẹp vành. 17-β-estradiol giảm co mạch vành. Tuy nhiên, không có hiệu quả trên nhồi máu hay những bệnh tim thực thể, ngoài ra thuốc làm tăng nguy cơ huyết khối tĩnh mạch sâu và thuyên tắc phổi. Khi phối hợp estrogen và progestin thì cải thiện tiên lượng. Thay thế hormone làm giảm tình trạng co mạch, nhưng không giảm tình trạng vôi hóa mạch vành. Estrogen đường uống được chuyển hóa qua gan, miếng dán estrogen thì tránh được giai đoạn chuyển hóa lần đầu. Khuyến cáo cho rằng nên sử dụng trong thời gian ngắn để điều trị triệu chứng co thắt mạch, và không dùng để điều trị dự phòng bệnh mạch vành mạn.

Hình 9: Chiến lược điều trị cho BN đau ngực vi mạch nguyên phát ổn định
VI) Minh họa ca lâm sàng:
Case 1: Đánh giá chức năng vi mạch và nội mô
-
Không đặc hiệu
Provocative Coronary Spasm Testing – Test gây co mạch
-
Chất kích hoạt mạch máu được dùng trước test 48 giờ.
-
Dây dẫn tạm thời sẽ được đưa vào sau khi đã đánh giá mạch máu ban đầu.
-
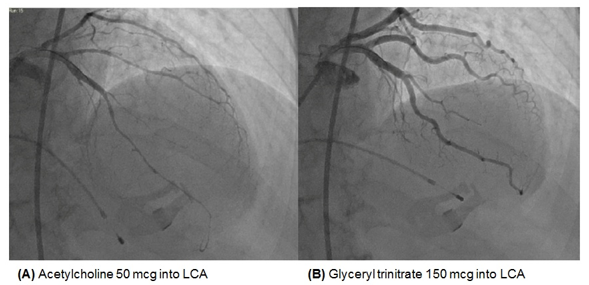
Tiêm acetylcholine tăng dần vào mạch vành (LCA: 25, 50 và 100 mcg; RCA: 25 và 50 mcg) trong 20s cùng lúc với đánh giá đau ngực, thay đổi ECG, và hình ảnh mạch máu.
-
Acetylcholine chloride (thường dùng trên mắt liều 20 mg) thì chưa được chấp nhận.
-
Ngưng test sau khi tiêm 50 mcg vào LCA, hoặc khi bệnh nhân đau ngực, ST chênh xuống ở V5-6, và tắc nghẽn đoạn xa LAD.
-
Tiêm vào mạch vành 150 mcg glyceryl trinitrate để kiểm soát LCA.
Chẩn đoán
-
Đau ngực co thắt.
Điều trị
-
Khuyến cáo dùng diltiazem 240 mg/ngày
Case 2:Rối loạn chức năng vi mạch
|
Bệnh sử
Test không xâm lấn
Chụp mạch vành
Coronary Microvascular Function Testing – Test đánh giá chức năng vi mach vành
Biểu đồ thể hiện thay đổi đường kính mạch máu ở liều tối đa. Endothelial Function Assessment – đánh giá chức năng nội mô
Provocative Coronary Spasm Testing. Test gây co mạch
Chẩn đoán
Điều trị
|
Case 3. Rối loạn chức năng nội mô
|
Bệnh sử
Noninvasive Investigations – test không xâm lấn
Coronary Angiography – chụp mạch vành CTA
Coronary Microvascular Function Testing – test đánh giá chức năng vi mạch
Endothelial Function Assessment – đánh giá chức năng nội mô
Provocative Coronary Spasm Testing – test gây co mạch
Chẩn đoán · Suy giảm dãn mạch phụ thuộc nội mô Điều trị
|
VII) Kết luận:
Rối loạn chức năng vi mạch hay là hội chứng X hay còn gọi là bệnh mạch vành không tắc nghẽn đều có nguy cơ tiên lượng sống còn tương đương bệnh mạch vành có tắc nghẽn. Tuy nhiên hiện nay cơ chế bệnh sình và các biện pháp chẩn đoán vẫn còn nhiều điều chưa được hiểu rõ. Việc thực hiện các biện pháp chẩn đoán xâm lần để phát hiện những thay đổi phụ thuộc chức năng nội mô sẽ giúp tiếp cận chẩn đoán và đưa ra các giải pháp điều trị. Các thuốc giảm đau ngực mới hoặc các biện pháp mới như liệu pháp tế bào gốc, đốt hạch giao cảm ngực cần có thêm nhiều thời gian và nghiên cứu để áp dụng trong lâm sàng.
TÀI LIỆU THAM KHẢO
1. Pargaonkar.VA et al: Accuracy of non-invasive stress testing in women and men with angina in the absence of obstructive coronary artery disease. International Journal of Cardiology 2018. doi:10.1016/j.ijcard.2018.10.073
2. Camici. GP et al: Coronary Microvascular Dysfunction. IN de Lemos.JA & Omland. T: CHRONIC CORONARY ARTERY DISEASE: A Companion to Braunwalds Heart Disease . 2018: 55-66
3. Sellke. FW et al: Coronary artery endothelial dysfunction: Basic concepts. Uptodate 2018
4. Lanza1. GA, De Vita1. A and Kaski. JK: Primary Microvascular Angina: Clinical Characteristics, Pathogenesis and Management. Interventional Cardiology Review 2018;13 (3):108–11
5. Alrifai. A et al: Microvascular Coronary Artery Disease: Review Article. US Cardiology Review 2018;12(1):41–5.. https://doi.org/10.15420/usc.2017:27:1
6. Vancheri. S et al: Angina In Patients with Non-Obstructive Coronary Angiograms: Six-Years Follow-up. International Cardiovascular Forum Journal 2017;11:55-59.
7. Radico. F et al: Angina Pectoris and Myocardial Ischemia in the
Absence of Obstructive Coronary Artery Disease: Practical Considerations for Diagnostic Tests. J Am Coll Cardiol Intv 2014; 7:453–63.
8. Shaw. J et Anderson. T: Coronary endothelial dysfunction in
non-obstructive coronary artery disease: Risk, pathogenesis, diagnosis and therapy. Vascular Medicine 2016, Vol. 21(2) 146–155.
9. Lee. JE et al: Coronary Flow Reserve and Microcirculatory Resistance in Patients
With Intermediate Coronary Stenosis. J Am Coll Cardiol 2016;67:1158–69
10. Corcoran. D et al: Coronary microvascular dysfunction in patients with stable coronary artery disease: The CE-MARC 2 coronary physiology sub-study. International Journal of Cardiology 266 (2018) 7–14
11. Marinescu. MA et al: Coronary Microvascular Dysfunction, Microvascular Angina, and Treatment Strategies. J Am Coll Cardiol Img 2015;8:210–20
12. Shah . SM and Pfau. SE: Coronary Physiology in the Cardiac Catheterization
Laboratory. J. Clin. Med. 2019, 8, 255; doi:10.3390/jcm8020255
13. Mittal. SR: Diagnosis of coronary microvascular
dysfunction – Present status. i n d i a n h e a r t j o u r n a l 6 7 ( 2 0 1 5 ) 5 5 2 – 5 6 0.
14. Guidelines 2016: The Current State of Invasive Coronary Evaluation and Management of Patients With Angina and Nonobstructive Coronary Arteries
15. Ong. P et al: High Prevalence of a Pathological Response to Acetylcholine Testing in Patients With Stable Angina Pectoris and Unobstructed Coronary Arteries
The ACOVA Study (Abnormal COronary VAsomotion in patients with stable angina and unobstructed coronary arteries). J Am Coll Cardiol 2012;59:655–62
16. Lee. BK et al: Invasive Evaluation of Patients With Angina in the Absence of Obstructive Coronary Artery Disease. Circulation. 2015;131:1054-1060.
17. Lindahl. B et al: Medical Therapy for Secondary Prevention and Long-Term Outcome in Patients With Myocardial Infarction With Nonobstructive Coronary Artery Disease. Circulation. 2017;135:1481–1489.
18. Safdar.B et al: Ranolazine and Microvascular Angina by PET in the Emergency Department: Results From a Pilot Randomized Controlled Trial. Clinical Therapeutics/Volume 39, Number 1, 2017: 55-63.