Tóm tắt:
Cơ sở nghiên cứu:Phối hợp thuốc ức chế men chuyển Angiotensin và chẹn kênh calci được khuyến cáo rộng rãi trong các hướng dẫn điều trị tăng huyết áp. Với việc lợi ích của viên phối hợp cố địnhngày càng được nhìn nhận, người ta đã điều chế ra viên phối hợp perindopril và amlodipine theo hàm lượng thích hợp để khởi trị tăng huyết áp (THA).
Neil R.Poulter1, Eamon Dolan2, Ajay K.Gupta3, Eoin O’Brien4, Andrew Whitehouse5, Peter S.Sever6.
American Journal of Cardiovascular Drugs. https://doi.org/10.1007/s40256-018-00314-4. Đăng tải online: 28-03-2019
Người dịch: ThS. BS. Võ Quý Vinh
Khoa Phòng khám, Viện Tim thành phố Hồ Chí Minh
Mục tiêu nghiên cứu:Thử nghiệm phân nhóm ngẫu nhiên này nhằm đánh giá hiệu quả hạ huyết áp của 4 hàm lượng tăng dần perindopril/amlodipine trong một viên phối hợp cố định trên bệnh nhân tăng huyết áp mức độ từ nhẹ tới nặng.
Phương pháp: Những bệnh nhân đủ tiêu chuẩn nghiên cứu (N=1617) được phân nhóm ngẫu nhiên dùng viên phối hợp cố định perindopril 3.5mg/amlodipine 2.5mg (gọi tắt là 3.5/2.5mg) hằng ngày, tăng liều dần hàng tháng khi cần tới liều tối đa 14/10mg để đạt huyết áp <140/90 mmHg (<130/80 mmHg đối với bệnh nhân đái tháo đường). Tiêu chí đánh giá chính (tỷ lệ bệnh nhân được kiểm soát huyết áp sau mỗi lần tăng liều) được đánh giá lúc 6 tháng, và tính an toàn được đánh giá lúc 9 tháng; huyết áp Holter 24h độ dao động của huyết áp cũng được khảo sát. Nhóm chứng (n=1653) được chọn ngẫu nhiên để dùng irbesartan 150mg/ngày, tăng liều dần trong 3 tháng tới liều irbesartan/hydrochlorothiazide 300/25mg.
Kết quả:Mỗi lần tăng hàm lượng perindopril/amlodipine đều được dung nạp tốt, và kéo theo sự gia tăng tỷ lệ bệnh nhân được kiểm soát huyết áp, với tỷ lệ tăng dần từ 21% (3.5/2.5mg) tới 30% (7/5mg), 37% (14/5mg), và 42% (14/10mg) sau lần lượt 1, 2, 3 và 6 tháng. Huyết áp tâm thu và tâm trương trung bình đều giảm sau mỗi lần tăng hàm lượng perindopril/amlodipine. Sau 6 tháng, huyết áp trung bình đã giảm 24.8/10.8mHg. Nhánh điều trị khởi đầu bằng irbesartan giảm huyết áp đo tại cơ sở y tế và huyết áp Holter 24h tương đương với perindopril/amlodipine, nhưng perindopril/amlodipine làm giảm độ dao động huyết áp nhiều hơn.
Kết luận:Tăng dần liều với viên phối hợp cố định perindopril/amlodipine phối hợp theo hàm lượng thích hợp là chiến lược an toàn và hiệu quả để quản lý bệnh THA.
Thử nghiệm đã đăng ký với chương trình EudraCT (Số 2006-005799-42)
Điểm chính yếu:
Ở bệnh nhân bị THA mức độ nhẹ tới nặng, điều trị bằng viên phối hợp perindopril/amlodipine giúp cải thiện đáng kể việc kiểm soát huyết áp, đáp ứng huyết áp, và huyết áp trung bình. Tất cả những sự cải thiện này gia tăng khi tăng liều.
Hiệu quả giảm huyết áp của viên phối hợp perindopril/amlodipine so với irbesartan/hydrochlorothazide tương đương nhau.
Độ dung nạp của viên phối hợp perindopril/amlodipine chính là do đặc tính an toàn nổi tiếng của từng hoạt chất thành tố.
1/ Dẫn nhập:
Tăng huyết áp (THA) là một yếu tố đơn lẻ đóng góp nhiều nhất vào tỷ lệ tử vong chung [1]. Tuy nhiên, đa số các khảo sát trên thế giới đã chỉ ra rằng mức huyết áp của đa số bệnh nhân THA chưa được kiểm soát đến mức huyết áp đích được khuyến cáo hiện nay [2,3]. Việc ít dùng phối hợp thuốc hạ áp là yếu tố góp phần gây ra tình trạng trên [4].
Vào thời điểm của thử nghiệm này, các hướng dẫn từ Hoa kỳ, Canada, Âu châu, ngoại trừ Vương quốc Anh [5-8], đều khuyến cáo với đa số bệnh nhân THA nên khởi trị với 2 thuốc hạ áp, trái ngược với 1 thuốc theo cách tiếp cận truyền thống theo từng bậc [9]. Các khuyến cáo này đều được nhấn mạnh hơn nữa trong các hướng dẫn gần đây của Hoa kỳ và Âu châu [10,11]. Các hướng dẫn gần đây có khuyến cáo khác nhau về cách phối hợp thuốc hạ áp [5-8], nhưng theo hướng dẫn mới nhất của Vương quốc Anh [8], phối hợp thuốc chẹn hệ renin-angiotensin (RAS) với thuốc chẹn kênh calci (CCB) là phối hợp thuốc độc nhất tối ưu, trong khi đó lại là một trong những phối hợp thuốc được “ưa thích” theo hướng dẫn của Âu châu [7,11]. Các dữ liệu từ nghiên cứu quan sát và thử nghiệm lâm sàng [12,13] cũng như các phân tích về kinh tế y tế [14] đã cho thấy viên phối hợp cố địnhgiúp cải thiện tuân thủ điều trị, kiểm soát huyết áp tốt hơn và cải thiện cán cân hiệu quả-chi phí và vì vậy viên phối hợp cố định được khuyến cáo trong các hướng dẫn mới đây của Âu châu [7] và được nhấn mạnh như là lựa chọn mặc định trong các hướng dẫn cập nhật gần đây nhất [11]. Nhiều dữ liệu rộng khắp từ các thử nghiệm lâm sàng ngẫu nhiên có đối chứng cho thấy perindopril và amlodipine, dùng riêng rẽ hay phối hợp, đều được dung nạp tốt và có hiệu quả trong việc dự phòng bệnh suất và tử suất tim mạch [15-17]. Các dữ liệu khác từ các nghiên cứu quan sát trong đời thực cũng xác nhận hiệu quả của phối hợp này [18,19]. Do đó, viên phối hợp cố định kết hợp 2 thuốc trên đã ra đời, trong đó có perindopril dưới dạng công thức mới và hàm lượng mới, thích hợp cho việc khởi trị và tăng lều nhanh chóng [20].
Do đó, một thử nghiệm ngẫu nhiên đã được thiết kế để đánh giá hiệu quả hạ áp của công thức phối hợp mới của perindopril và amlodipine với 4 bước tăng liều để điều trị THA ở người lớn, theo các yêu cầu về đăng ký thuốc của Cục Quản lý Dược phẩm Âu châu (European Medicines Agency-EMA) [21].
2/ Phương pháp:
Một thử nghiệm quốc tế, đa trung tâm, phân nhóm song song, ngẫu nhiên, pha III và mù đôi đã được thiết kế để đánh giá hiệu quả hạ áp của 4 hàm lượng tăng dần của viên phối hợp cố định perindopril/amlodipine trên hơn 1000 bệnh nhân bị THA từ nhẹ đến nặng.
Nam và nữ từ 18 tuổi trở lên được cho là có tiềm năng đủ điều kiện để phân nhóm ngẫu nhiên vào thử nghiệm nếu: 1/bác sĩ của họ cho rằng thay đổi thuốc là cần thiết (vì thuốc đang dùng không hiệu quả hay kém dung nạp) và có huyết áp tâm thu < 165 mmHg và huyết áp tâm trương <105 mmHg hoặc 2/ họ chưa được điều trị và có huyết áp tâm thu 150-179 mmHg và/hoặc huyết áp tâm trương 95-114 mmHg. Bệnh nhân trở nên đủđiều kiện để phân nhóm ngẫu nhiên vào thử nghiệm sau thời kỳ “khởi động” (run-in) với giả dược kéo dài 2 tuần nếu huyết áp tâm thu từ 150 đến 199 mmHg và/hoặc huyết áp tâm trương từ 95 đến 114 mmHg. Bệnh nhân bị loại nếu có thai, suy chức năng thận (độ lọc cầu thận ước tính eGFR < 30 ml/phút), tăng kali/máu (>5,5 mmol/l), hoặc bị THA dạng thứ phát, ác tính, hoặc có triệu chứng lâm sàng.
Bệnh nhân đủ tiêu chí nhận bệnh được phân nhóm ngẫu nhiên hoặc là dùng viên phối hợp cố định perindopril/amlodipine, khởi đầu bằng hàm lượng 3.5/2.5mg/ngày hoặc là được điều trị dựa vào irbesartan, khởi đầu với liều 150mg/ngày (nhóm chứng) (h.1b) theo đúng bảng tóm tắt của Âu châu về các đặc tính của hoạt chất irbesartan và irbesartan/hydrochlorothiazide. Hàm lượng thuốc được tăng dần sau 3 lần cách nhau 1 tháng (h.1), nếu huyết áp không được kiểm soát (được định nghĩa là huyết áp tâm thu <140mmHg và huyết áp tâm trương <90mmHg đối với bệnh nhân không bị đái tháo đường, và huyết áp tâm thu <130mmHg và huyết áp tâm trương <80mmHg đối với bệnh nhân bị đái tháo đường). Bệnh nhân không đạt mức huyết áp tâm thu <160 mmHg sau 3 tháng sẽ được tái đánh giá sau 4 tháng, lúc đó nếu huyết áp tâm thu vẫn không kiểm soát được, họ sẽ bị loại khỏi thử nghiệm. Tất cả bệnh nhân đều được tái đánh giá váo 6 tháng và 9 tháng sau thời điểm phân nhóm ngẫu nhiên.
Bốn hàm lượng có thể được dùng cho nhóm perindopril/amlodipine là 3.5/2.5, 7/5, 14/5, và 14/10mg (xem h.1a). Bốn hàm lượng có thể được dùng cho nhóm điều trị dựa vào irbesartan là irbesartan 150mg hay irbesartan/hydrochlorothiazide 150/12.5mg, 300/12.5mg, và 300/25mg (xem h.1b) theo đúng bảng tóm tắt của Âu châu về các đặc tính của hoạt chất irbesartan và irbesartan/hydrochlorothiazide.
Tiêu chí đánh giá chính của thử nghiệm là tỷ lệ bệnh nhân trong mỗi nhóm liều perindopril/amlodipine có huyết áp được kiểm soát sau mỗi lần tăng liều, đối chiếu với tỷ lệ bệnh nhân được kiểm soát huyết áp ở liều trước đó.
Tiêu chí đánh giá phụ bao gồm việc so sánh nhóm perindopril/amlodipine với nhóm điều trị dựa vào irbesartan (h.1b) sau 6 tháng theo dõi về các tiêu chí đạt kiểm soát huyết áp theo chỉ số huyết áp mục tiêu trong các khuyến cáo điều trị vào thời điểm nghiên cứu [5-8], có đáp ứng huyết áp (tỷ lệ bệnh nhân đạt kiểm soát huyết áp và/hoặc giảm huyết áp tâm thu so với trị số nền >20mmHg hoặc giảm huyết áp tâm trương so với trị số nền >10mmHg) và các trị số huyết áp trung bình (huyết áp tâm thu, huyết áp tâm trương, hiệu áp, và huyết áp trung bình). Ngoài ra, các tiêu chí về tim mạch, chuyển hóa carbon hydrat và thận xuất hiện trong suốt thử nghiệm cũng được đánh giá trong nhóm perindopril/amlodipine và có so sánh với nhóm điều trị dựa vào irbesartan bằng cách dùng mô hình Cox không hiệu chỉnh (phép kiểm tỷ lệ khả năng xảy ra biến cố).
Dựa vào các dữ liệu được đăng tải sau khi thử nghiệm được hoàn thành [22], chúng tôi quyết định phân tích hậu định để so sánh giao động huyết áp qua từng lần thăm khám giữa 2 nhóm điều trị.
Tính an toàn chung của phối hợp perindopril/amlodipine được đánh giá bằng cách kéo dài thời gian theo dõi của tất cả bệnh nhân lên 9 tháng sau khi phân nhóm ngẫu nhiên, điều này cho phép mỗi hàm lượng phối hợp perindopril/amlodipine được theo dõi ít nhất 6 tháng. Nghiên cứu phụ bao gồm việc đo huyết áp Holter 24h (ABPM) càng thường xuyên càng tốt tại mỗi giai đoạn của thử nghiệm (tháng thứ 1, 3, và 6; h.1) cho tất cả những người tình nguyện.
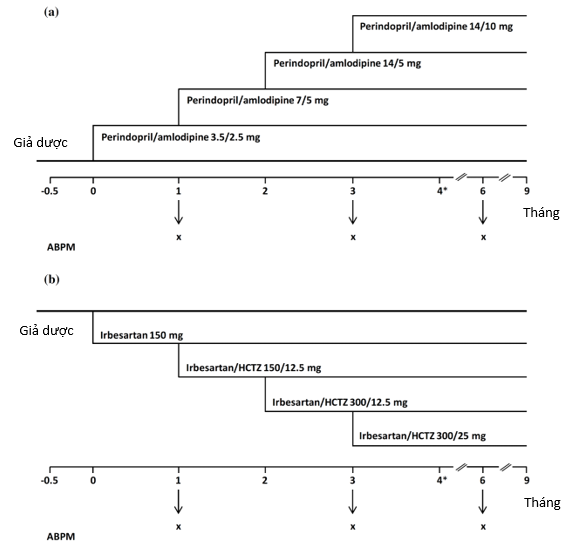
H.1: Thiết kế nghiên cứu của a/ nhóm perindopril/amlodipine; b/ nhóm điều trị dựa vào irbesartan/HCTZ. ABPM: đo huyết áp Holter 24h, HCTZ: hydrochlorothiazide. *lần thăm khám không bắt buộc vào thời điểm 3 tháng dành cho bệnh nhân có huyết áp tâm thu >160mmHg
Bệnh nhân đủ tiêu chí nhận bệnh trải qua 2 tuần “khởi động” với giả dược để bảo đảm sự tuân thủ là thỏa đáng (>70% và <130%) và mức huyết áp là phù hợp (huyết áp tâm thu: 150-199mmhg và huyết áp tâm trương: 95-114mmHg). Sau đó những bệnh nhân phù hợp được phân nhóm ngẫu nhiên để nhận liều khởi đầu của perindopril/amlodipine hoặc irbesartan (h.1). Tại mỗi lần thăm khám, huyết áp được đo 3 lần cách nhau 1 phút ở tư thế nằm ngửa với máy OMRON đã được phê chuẩn (HEM705CP) ở cùng một cánh tay trước khi uống thuốc (trị số “đáy”). Trị số trung bình của 2 lần đo cuối trong tổng số 3 lần đo được dùng cho việc phân tích số liệu. Tại lúc khởi điểm, bệnh nhân đủ tiêu chí ký tên vào mẫu đồng ý tham gia thử nghiệm, được hỏi bệnh sử, và được thăm khám thực thể trong đó có đo chiều cao, cân nặng, và xem có phù chân không. Tại thời điểm này, bệnh nhân cũng được đo ECG, cũng như xét nghiệm máu thường quy và lấy nước tiểu tại chỗ (tìm vi đạm niệu). Bệnh nhân tự điền bảng câu hỏi về tình trạng sức khỏe chung EuroQoL-5 Dimensions (EQ-5D) [23].
Sau đó, vào mỗi kỳ thăm khám, bệnh nhân sẽ được tái khám thực thể; được lượng giá về mức độ tuân thủ dựa vào việc đếm số viên thuốc còn lại; được đánh giá về các tác dụng phụ, trong đó có phù chân; được lấy máu tĩnh mạch để xét nghiệm huyết học và sinh hóa thường quy; được lấy nước tiểu tại chỗtìm vi đạm niệu. Tại lần thăm khám cuối, bệnh nhân được đo ECG và được điền lần nữa bảng câu hỏi EQ-5D.
Tổng cộng có 195 bệnh nhân được đo huyết áp Holter 24h vào lúc khởi điểm, sau đó lần lượt 144, 132, và 145 bệnh nhân được đo huyết áp Holter 24hvào tháng thứ 1, 3, và 6.
Cỡ mẫu nghiên cứu được xác định chủ yếu dựa vào tiêu chí đánh giá chính, theo đó nghiên cứu có 80% khả năng phát hiện được sự khác biệt được định trước về tỷ lệ kiểm soát huyết áp giữa mỗi lần tăng hàm lượng perindopril/ amlodipine. Điều này được đánh giá dựa vào phép kiểm 2 đuôi McNemar với sai lầm loại I là 5%, dựa trên giả thuyết mức tăng tỷ lệ bệnh nhân có huyết áp kiểm soát lần lượt là 30, 50, 30, và 15% cho 4 loại hàm lượng khảo sát (h.1a). Chúng tôi dự kiến là tại mỗi thời điểm thăm khám, huyết áp có lẽ sẽ không còn được kiểm soát trong số 1% số bệnh nhân đã từng được kiểm soát huyết áp ở lần khám trước. Cỡ mẫu cũng được hiệu chỉnh phù hợp với các yêu cầu của khuyến cáo về dữ liệu an toàn thuốc của Liên minh Châu Âu [21], trong đó quy định phải theo dõi ít nhất 6 tháng số lượng 300-600 bệnh nhân đã được phân ngẫu nhiên dùng mỗi hàm lượng. Với việc ước lượng tỷ lệ bệnh nhân rút khỏi nghiên cứu là 5% thì khoảng 1500 bệnh nhân phải được cho dùng viên phối hợp perindopril/amlodipine.
Độ lệch chuẩn (standard deviations-SD) và hệ số biến thiên của huyết áp tâm thu giữa bốn lần thăm khám (tháng 2,3, 6, và 9 sau phân nhóm ngẫu nhiên) được tính toán cho mỗi bệnh nhân, và trị số trung bình của những con số này trong 2 nhóm điều trị được so sánh với nhau bằng phép kiểm t sau khi đã qua phép biến đổi logarithm, do sự phân phối của biến số là đối xứng lệch. Chúng tôi cũng tính sự biến thiên huyết áp tâm thu tại cùng thời điểm khám cho từng bệnh nhân (3 lần đo huyết áp cho mỗi lần khám). Các số đo này của 4 lần thăm khám kể từ 2 tháng trở đi được lấy trị số trung bình và sự phân phối của chúng được so sánh theo từng nhóm điều trị.
Tất cả bệnh nhân đều được giải thích và ký tên vào bảng đồng ý tham gia thử nghiệm, điều mà Tuyên bố Helsinki bắt phải tuân thủ. Thử nghiệm được đăng ký với chương trình cơ sở dữ liệu của Âu châu về thử nghiệm lâm sàng gọi là EudraCT (Số 2006-005799-42). Cơ quan quốc gia về y đức trong nghiên cứu y học đặt tại London (MREC) chấp thuận khía cạnh y đức của thử nghiệm vào ngày 30 tháng 9 năm 2007, và Cục Quy định về thuốc và sản phẩm phục vụ sức khỏe (MHRA) chấp thuận tính hợp quy của thử nghiệm vào ngày 30 tháng 11 năm 2007. Ủy ban Y đức và Nghiên cứu Y học tại Dublin chấp nhận tính hợp y đức tại Ireland của thử nghiệm vào ngày 4 tháng 10 năm 2007, và Y sỹ đoàn Ireland chấp thuận tính hợp quy của thử nghiệm vào ngày 23 tháng 11 năm 2007.
3/ Kết quả:
Từ tháng 1-2008, tổng cộng 5249 bệnh nhân từ 87 bệnh viện hoặc phòng khám y học gia đình tại Anh quốc, Scotland, Bắc Ireland, và Hà lan đã được chính thức rà soát xem thỏa mãn điều kiện nhận bệnh không (H.2). 4501 bệnh nhân đã được xác định có khả năng được chọn để phân nhóm ngẫu nhiên vào thử nghiệm, trong đó 3270 bệnh nhân đã được phân nhóm ngẫu nhiên vào thử nghiệm vào tháng 11-2008 (h.2). Trong số 1617 bệnh nhân đã được phân ngẫu nhiên vào nhóm perindopril/amlodipine, có 73% (n=1177) hoàn thành điều trị với ít nhất 6 tháng dùng phối hợp thuốc này, trong đó nguyên nhân thường nhất gây rút khỏi thử nghiệm (19%) là tác dụng phụ của thuốc.
Tại thời điểm khởi đầu, ở nhóm perindopril/amlodpine, tuổi trung bình bệnh nhân là 63 tuổi, nam chiếm 63%. Huyết áp trung bình là 163,7/91,4 mmHg, phân nửa số bệnh nhân có THA độ 2. Trước giai đoạn khởi động 2 tuần với giả dược, chỉ 17% bệnh nhân mới được chẩn đoán THA và hơn 2/3 mắc hội chứng chuyển hóa theo định nghĩa của Hiệp hội Đái tháo đường thế giới (bảng 1) [24]. Nhóm bệnh nhân được điều trị dựa vào irbesartan cũng có các đặc điểm gần tương đồng (bảng 1).
Trong nhóm perindopril/amlodipine, tỷ lệ bệnh nhân đạt kiểm soát huyết áp (được định nghĩa là <140/90 mmHg) gia tăng đáng kể theo mỗi lần tăng hàm lượng thuốc trong viên phối hợp cố định (p<0,005), từ 21% lên 30%, 37%, và 42% lần lượt tại thời điểm 1, 2, 3, và 6 tháng (bảng 2). Tương tự, tỷ lệ bệnh nhân có đáp ứng huyết áp tăng đáng kể sau mỗi lần tăng hàm lượng thuốc, từ 47% lên 62%, 68%, và 73% lần lượt sau 1, 2, 3, và 6 tháng.
Huyết áp tâm thu và huyết áp tâm trương giảm rất đáng kể sau mỗi nấc tăng hàm lượng trong viên phối hợp perindopril/amlodipine (bảng 3), với mức huyết áp trung bình của nhóm lúc khởi trị là 163,7/91,4 mmHg giảm xuống còn 138,9/80,6 mmHg sau 6 tháng (dữ liệu không được thể hiện trên bảng). Tuy nhiên, mức giảm huyết áp giữa nấc thứ 2 và thứ 3 của quá trình tăng liều (h.1a) là tương đối ít. Huyết áp trung bình cũng có mức giảm tương tự đối vói nhóm irbesartan sau 6 tháng (bảng 4).
Tất cả 4 hàm lượng của viên phối hợp perindopril/amlodipine đều được dung nạp tốt, tuy rằng, như đã dự trù trước, phù mắt cá chân (n=88 [5,4%]) và ho (n=94 [5,8%]) là các tác dụng phụ liên quan đến thuốc thử nghiệm thường khiến bệnh nhân phải ngưng thuốc nhất. Nhìn chung, điều trị dựa trên irbesartan có độ dung nạp tương đương phối hợp perindopril /amlodipine, nhưng ít phù mắt cá chân và ho hơn.
Đi vào cụ thể hơn, không có tai biến phù mạch nào xảy ra trong thời gian thử nghiệm. Chín trường hợp tăng kali máu xảy ra trên 9 bệnh nhân của nhóm 1617 bệnh nhân (0,6%) dùng phối hợp perindopril/amlodipine, và 19 trường hợp như vậy xảy ra trên 17 bệnh nhâncủa nhóm 1653 bệnh nhân dùng irbesartan/hydrochlorothiazide (1,0%).
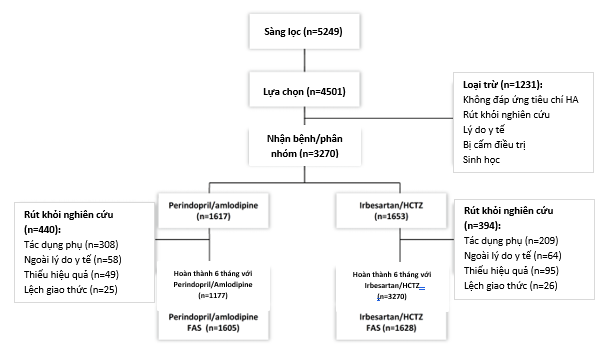
H.2: Sơ đồ phân bổ bệnh nhân nghiên cứu. HCTZ hydrochlorothiazide, FAS full analysis set (nhóm bệnh nhân được phân tích thống kê đầy đủ).
Phản ứng phụ nghiêm trọng được ghi nhận ở 124 bệnh nhân (7,7%) trong nhóm perindopril/amlodipine, và ở 127 bệnh nhân (7,7%) trong nhóm irbesartan/ hydrochloro – thiazide.
Tại thời điểm 6 tháng, các bệnh nhân được đo huyết áp Holter 24h cho thấy có huyết áp giảm đáng kể và tương đồng ở cả 2 nhóm điều trị (bảng 6). Độ giảm huyết áp trung bình trong 24h lần lượt là 18,2/10,6 mmHg và 17,2/9,7 mmHg đối với nhóm sử dụng phối hợp perindopril và phối hợp irbesartan. Tuy nhiên, không ngạc nhiên là sau 1 tháng, huyết áp trung bình 24h giảm 11,0/6,2 mmHg trong nhóm perindopril 3,5mg/amlodipine 2,5mg so với 6,9/3,7 mmHg trong nhóm irbesartan 150mg (p=0,0083). Không có nhóm điều trị nào có tác động trên kiểu trũng huyết áp về đêm tại thời điểm 6 tháng.
Bảng 1: Các đặc điểm lúc khởi đầu của 2 nhóm ngẫu nhiên
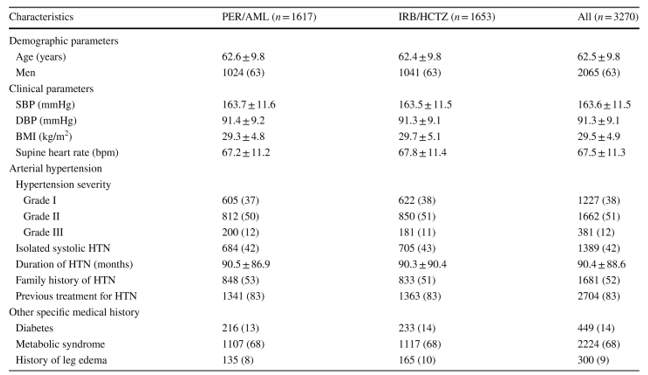
Dữ liệu được trình bày dưới dạng N (%) hoặc Trung bình + độ lệch chuẩn
AML amlodipine, BMI chỉ số khối cơ thể, bpm số nhịp đập/phút, DBPhuyết áp tâm trương, HCTZ hydrochlorothiazide, HTN: tăng huyết áp, IRB irbesartan, PER perindopril, SBPhuyết áp tâm thu, Characteristics: các đặc điểm, Demographic parameters: các thông số nhân chủng học, Clinical parameters: thông số lâm sàng, Supine heart rate: nhịp tim khi nằm ngửa, Arterial hypertension: tăng huyết áp động mạch, Hypertension severity: độ nặng của tăng huyết áp, Isolated systolic HTN: tăng huyết áp tâm thu đơn độc, Duration of hypertension: thời gian mắc tăng huyết áp, Family history of hypertension: tiền căn gia đình bị tăng huyết áp, Previous treatment for hypertension: điều trị tăng huyết áp trước đó, Other specific medical history: tiền sử nội khoa cụ thể khác, Diabetes: đái tháo đường, Metabolic syndrome: hội chứng chuyển hóa, History of leg edema: tiền sử bị phù chân.
Bảng 2: Tỷ lệ bệnh nhân có huyết áp kiểm soáta và huyết áp đáp ứngb sau khi điều trị với chiến lược tăng dần liềuperindopril/amlodipine.
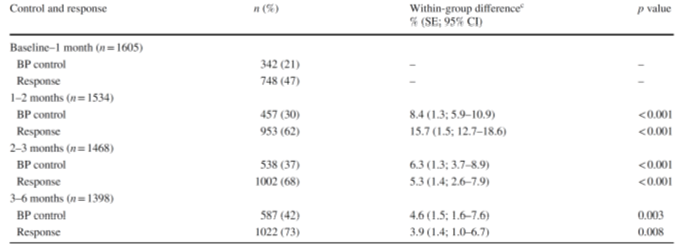
BP huyết áp, CI khoảng tin cậy, SE sai số chuẩn
ahuyết áp tâm thu<140 [<130] mmHg và huyết áp tâm trương<90 [<80] mmHg ở bệnh nhân không mắc [mắc] đái tháo đường.
bHuyết áp được kiểm soát và/hoặc giảm huyết áp tâm thu>20 mmHg hoặc huyết áp tâm trương>10 mmHg.
cTỷ lệ bệnh nhân (%) giữa lúc khởi đầu và kết thúc mỗi giai đoạn tăng liều.
Bảng 3: Tác động của việc tăng liều trên huyết áp tâm thu trung bình và huyết áp tâm trương trung bình (xét trong từng nấc thang nâng liều) trong nhóm perindopril/amlodipine.
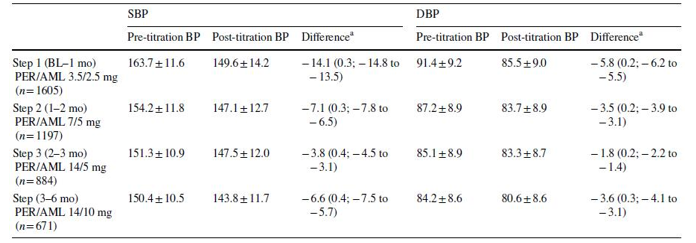
Dữ liệu được trình bày theo đơn vị mmHg. Pre-titration: trước tăng liều. Post-titration: sau tăng liều.
AML amlodipine, BL lúc khởi trị, BP huyết áp, CI khoảng tin cậy, huyết áp tâm trương, huyết áp tâm thu, SE sai số chuẩn.
aDữ liệu được trình bày dưới dạng độ sai biệt (SE, 95% CI)
Bảng 4: Huyết áp đo tại phòng khám và mức thay đổi sau 6 tháng điều trị xếp theo từng nhóm điều trị.

AML amlodipine, BL lúc khởi trị, DBP huyết áp tâm trương, SBP huyết áp tâm thu, HCTZ hydrochlorothiazide, IRB irbesartan, PER perindopril, SD độ lệch chuẩn, mo: tháng
Trong số 2956 bệnh nhân có ít nhất 2 lần đo huyết áp trong thời gian 2 tháng trở lên, những bệnh nhân dùng irbesartan/hydrochlorothiazide có độ biến thiên huyết áp giữa các lần thăm khám cao hơn đáng kể so với nhóm dùng perindopril/amlodipine (bảng 7). Trị số trung bình của độ lệch chuẩn trong một lần thăm khám (lấy trung bình qua các lần thăm khám) của nhóm irbesartan/hydrochlorothiazide cũng cao hơn nhóm perindopril/amlodipin (4.22 so với 3.80; p<0,001).
Các biến cố lâm sàng đáng quan tâm (biến cố gộp của các tiêu chí đánh giá về tim mạch, thận, chuyển hóa carbon hydrat) không thường gặp ở cả 2 nhóm điều trị (h.3), nhưng ít hơn đáng kể (p=0,036) ở nhóm perindopril/amlodipine (n=179 [11,2%]) so với nhóm điều trị dựa vào irbesartan (n=225 [13,8%]) trong suốt thời gian từ lúc khởi trị đến khi kết thúc thử nghiệm.
Bảng 5: Các phản ứng phụ xuất hiện có liên quan tới thuốc nghiên cứu và khiến phải ngưng thuốc nghiên cứu.
|
Các phản ứng phụ xuất hiện có liên quan tới thuốc nghiên cứu và khiến phải ngưng thuốc nghiên cứu ở ít nhất 0,2% bệnh nhân |
PER/AML (N=1617) |
IRB/HCTZ (N=1653) |
||
|
NEAE |
N (%) |
NEAE |
N (%) |
|
|
Tất cả |
300 |
293(18,1) |
179 |
168(10,2) |
|
Ho |
94 |
94(5,8) |
9 |
9(0,5) |
|
Phù ngoại biên |
88 |
88(5,4) |
6 |
6(0,4) |
|
Choáng váng |
13 |
13(0,8) |
38 |
38(2,3) |
|
Đau chi |
6 |
6(0,4) |
1 |
1(0,1) |
|
Đau đầu |
5 |
5(0,3) |
18 |
18(0,1) |
|
Mệt mỏi |
5 |
5(0,3) |
3 |
3(0,2) |
|
Hạ huyết áp tư thế |
5 |
5(0,3) |
5 |
5(0,3) |
|
Viêm mô tế bào |
3 |
3(0,2) |
0 |
0(0) |
|
Mê man |
3 |
3(0,2) |
2 |
2(0,1) |
|
Khó ở |
3 |
3(0,2) |
5 |
5(0,3) |
|
Nổi mẩn |
3 |
3(0,2) |
3 |
3(0,2) |
|
Rối loạn cương dương |
3 |
3(0,2) |
3 |
3(0,2) |
|
Nổi mẩn ngứa |
3 |
3(0,2) |
1 |
1(0,1) |
|
Co cứng cơ |
2 |
2(0,1) |
4 |
4(0,2) |
|
Cảm giác nặng đầu |
2 |
2(0,1) |
3 |
3(0,2) |
|
Chóng mặt theo tư thế |
1 |
1(0,1) |
3 |
3(0,2) |
|
Buồn nôn |
2 |
2(0,1) |
3 |
3(0,2) |
|
Suy thận |
1 |
1(0,1) |
3 |
3(0,2) |
|
Giảm độ thanh thải creatinine |
1 |
1(0,1) |
9 |
9(0,5) |
|
Gout |
1 |
1(0,1) |
3 |
3(0,2) |
|
Tụt huyết áp |
1 |
1(0,1) |
6 |
6(0,4) |
|
Ói |
0 |
0(0) |
4 |
4(0,2) |
AML amlodipine, EAE phản ứng phụ xuất hiện, HCTZ hydrochlorothiazide, IRB irbesartan, N số bệnh nhân bị, NEAE số phản ứng phụ xuất hiện, PER perindopril.
Bảng 6: Sự thay đổi huyết áp Holter 24h sau 6 tháng ở mỗi nhóm điều trị.
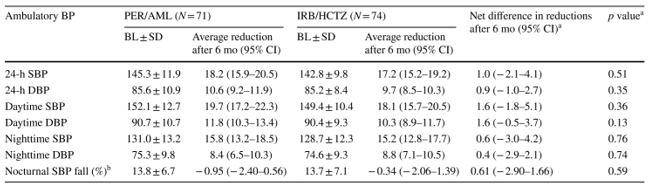
AML amlodipine, Average reduction after 6 mo: độ giảm trung bình sau 6 tháng, BL lúc khởi trị, BP huyết áp, CI khoảng tin cậy, DBP huyết áp tâm trương, HCTZ hydrochlorothiazide, IRB irbesartan, mo: tháng, PER perindopril, SBP huyết áp tâm thu, SD độ lệch chuẩn, Daytime: ban ngày, Nighttime ban đêm, Nocturnal SBP fall: độ giảm huyết áp tâm thu ban đêm, Net differences in reductions after 6 mo: sự khác biệt chung cuộc về độ giảm huyết áp sau 6 tháng.
a Sự khác biệt chung cuộc về độ giảm huyết áp giữa 2 nhóm điều trị sau 6 tháng và giá trị p.
b Phần trăm độ giảm huyết áp tâm thu ban đêm so với huyết áp tâm thu ban ngày.
Bảng 7: Sự biến thiên huyết áp giữa các lần khám, phân theo nhóm điều trị.
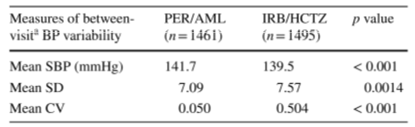
AML amlodipine, BP huyết áp, CV hệ số biến thiên, HCTZ hydrochlorothiazide, IRB irbesartan, PER perindopril, SBP huyết áp tâm thu, SD độ lệch chuẩn, Mean: trung bình,
aSố đo giữa các lần khám vào các thời điểm tháng thứ 2,3,6 và 9.
4/ Bàn luận:
Trong số các bệnh nhân được cho dùng viên phối hợp mới (viên phối hợp cố định) của perindopril/amlodipine, có sự cải thiện đáng kể về kiểm soát huyết áp, đáp ứng huyết áp, và huyết áp trung bình sau mỗi lần tăng hàm lượng viên phối hợp, như đã được đánh giá qua các lần thăm khám vào tháng thứ 1, 2, 3, và 6 tháng. Nhìn chung, sau 6 tháng, phác đồ điều trị trên giúp 42% bệnh nhân kiểm soát được huyết áp, và thêm 31% nữa hoặc có huyết áp tâm thu giảm > 20mmhg, hoặc có huyết áp tâm trương giảm > 10mmHg. Hơn 50% tác dụng hạ áp đạt được sau 1 tháng điều trị (bảng 2). Phác đồ này được dung nạp tốt và trung tính về mặt chuyển hóa (dữ liệu không được thể hiện ở đây). Tuy nhiên, ho và/hoặc phù mắt cá chân được cho là có liên quan tới thuốc nghiên cứu (theo các số liệu công bố trước đây [15-17]) và khiến phải ngưng thuốc xảy ra lần lượt ở 5,8% và 5,4% bệnh nhân. Nhìn chung, sau 6 tháng, nhóm được điều trị theo từng bậc dựa vào irbesartan có hiệu quả hạ áp tương tự với nhóm perindopril/amlodipine, và được dung nạp tốt.
Theo một khảo sát mới đây trên dân số Anh, khoảng 63% trường hợp điều trị tăng huyết áp có mức huyết áp được kiểm soát <140/90 mmHg [25]. Tuy nhiên, nghiên cứu trong bài này gồm những bệnh nhân bị tăng huyết áp có nguy cơ cao, trong đó 14% bị đái tháo đường và do vậy có đích kiểm soát huyết áp nghiêm ngặt hơn (<130/80 mmHg). Ngoài ra, huyết áp lúc khởi trị ở mức cao, tuy rằng 83% đã được điều trị trước đó. Do đó, với một quần thể dân số như vậy, việc đạt được tỷ lệ 42% có huyết áp kiểm soát chỉ sau 6 tháng với chỉ một viên thuốc là một bằng chứng yên tâm về hiệu quả của phác đồ điều trị. Theo các khuyến cáo mới nhất của Âu châu và Hoa kỳ [10-11], kiểm soát huyết áp lý tưởng được định nghĩa là <130/80 mmHg, do đó tỷ lệ kiểm soát huyết áp ở thử nghiệm này nên được giảm bớt (ít nhất là đối với dân số không bị đái tháo đường) nếu những tiêu chí mới nhất về đích huyết áp được áp dụng.
Mức giảm huyết ápchung 25/11 mmHgđạt được trong nhóm perindopril/amlodipine là tương tự so với cùng phối hợp thuốc trong thử nghiệm ASCOT[17], tuy rằng các thuốc thuộc hàng thứ 3 hay hàng thứ 4 phải được thêm vào trong thử nghiệm ASCOT.
Điều ngạc nhiên là mức giảm huyết áp chung đạt được bằng chiến lược khởi trị với viên thuốc phối hợp 2 trong 1 rồi tăng dần hàm lượng nếu cần, lại không tỏ ra hiệu quả hơn về phương diện hạ áp so với chiến lược điều trị theo từng bậc dựa vào irbesartan. Đây có lẽ một phần là do thuốc thứ hai (lợi tiểu) đã được nhanh chóng thêm vào thay vì tăng liều irbesartan tới liều tối đa trước rối mới thêm thiazide như cách thực hành thông thường vốn thấy trong cách điều trị theo từng bậc. Tuy nhiên, thử nghiệm ACCELERATE [26] so sánh hiệu quả hạ áp của việc khởi trị với 2 thứ thuốc so với đơn trị (rồi sau đó mới bắt đầu dùng phối hợp thuốc) đã chỉ ra rằng việc khởi trị theo cách thứ nhất không duy trì mức giảm huyết áp tốt hơn cách thứ hai sau 24 tuần theo dõi.
Điều có lẽ cũng gây ngạc nhiên nữa là nhìn chung, xét về khía cạnh hạ áp, thử nghiệm này cho thấy bất chấp với chiến lược khởi trị bằng một hay hai thứ thuốc thì chiến lược dựa vào ức chế thụ thể angiotensin/thiazide có cùng hiệu quả so với chiến lược ức chế men
chuyển/chẹn kênh calci. Điều này có lẽ một phần cho thấy hiệu quả hạn chế của nấc hàm
lượng thứ ba của phối hợp perindopril/amlodipine (bảng 3). Do đó, nấc hàm lượng thứ ba này (perindopril/amlodipine 14/5 mg) sẽ không còn được đưa vào chiến lược phát triển của dạng viên phối hợp mới này trong thực hành lâm sàng điều trị THA. Nói chung, mức hạ áp tương đồng tại phòng khámlẽ ra có thể được kỳ vọng với ức chế men chuyển/ức chế thụ thể, thiazide và chẹn kênh Calci [27,28]. Tuy nhiên, tùy vào việc dùng dược chất cụ thể nào mà hiệu quả khác nhau trên việc kiểm soát huyết áp Holter 24h có thể được lường trướcđược [29].
Trị số huyết áp dùng cho các phép phân tích trong thử nghiệm này khác với trị số huyết áp thường dùng trong thực hành lâm sàng ở chỗ chúng được đo ở tư thế nằm ngửa và lấy trị số “đáy”, tuy rằng khó để nhận biết bằng cách nào cách đo huyết áp này có thể ảnh hưởng khác nhau lên hai nhóm điều trị.
Tuy mức huyết áp đo tại phòng khám và huyết áp Holter 24h là tương đồng khi so sánh 2 nhóm với nhau sau 6 tháng điều trị, có sự khác biệt đáng kể về sự biến thiên huyết áp (qua từng lần thăm khám và trong 24h đo huyết áp Holter) giữa 2 nhóm điều trị với các số liệu có lợi cho phối hợp perindopril/amlodipine. Trong loạt bài báo đăng tải năm 2010 [22, 30, 31], Rothwell và cộng sự nêu ra khả năng chính sự biến thiên huyết áp qua thời gian dài mới là yếu tố tiên đoán các kết cục tim mạch quan trọng (đặc biệt là đột quỵ) tốt hơn trị số tuyệt đối của huyết áp trung bình. Họ cũng chỉ ra trong thử nghiệm ASCOT rằng sự biến thiên huyết áp của 3 lần đo tại mỗi lần thăm khám có giá trị tiên đoán đột quỵ tốt hơn trị số huyết áp trung bình chung đạt được trong thử nghiệm. Do đó, chúng tôi quyết định phân tích hậu định để kiểm định bất cứ sự khác biệt nào của sự biến thiên huyết áp (trong cùng lần thăm khám và giữa các lần thăm khám) giữa 2 nhóm điều trị trong cơ sở dữ liệu PREMIUM. Các khám phá có lợi này (cho nhóm perindopril/amlodipine) tỏ ra phù hợp hơn với hiệu quả có vẻ khác biệt giữa 2 nhóm điều trị lên tiêu chí gộp của số lượng ít ỏi các biếncố lâm sàng đáng quan tâm trong thử nghiệm này (h.3). Yếu tố góp phần lớn nhất vào sự khác biệt của các biến cố giữa 2 nhóm điều trị là “rối loạn về thận”, với nguyên nhân chủ yếu là tình trạng hạ kali máu, có lẽ do việc dùng hydrochlorothiazide hơn là do cách tiếp cận theo từng bậc. Khả năng phối hợp thuốc chẹn hệ renin-angiotensin (RAS) và chẹn kênh calci (CCB) nhóm dihydropyridine có thể gây nên hiệu quả bảo vệ tim mạch tốt hơn thuốc chẹn hệ RAS phối hợp với lợi tiểu nhóm thiazide với cùng mức độ giảm huyết áp đo tại phòng khám được rút ra từ thử nghiệm ACCOMPLISH [28].
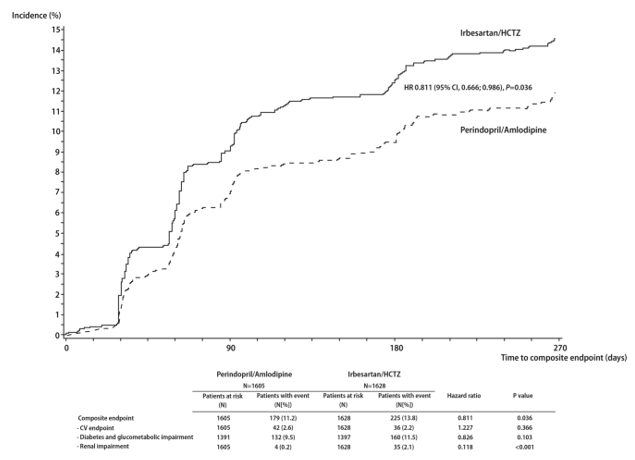
Hình 3: Các biến cố lâm sàng đáng quan tâm xuất hiện (tiêu chí gộp của biến cố tim mạch + thận + chuyển hóa carbon hydrat) trong thời gian 9 tháng điều trị. CV endpoint: tiêu chí tim mạch, HCTZ hydrochlorothiazide, HR hazard ratio (tỷ số nguy cơ), Diabetes and glucometabolic impairment: đái tháo đường và rối loạn chuyển hóa carbon hydrate, Renal impairment: rối loạnvề thận, Time to composite endpoint: thời gian tới lúc tiêu chí gộp, Patients at risk: số bệnh nhân phơi nhiễm nguy cơ, Patients with event [N(%)]: bệnh nhân bị biến cố [số bệnh nhân (tỷ lệ %)].
Dựa trên cơ sở của hai bài báo [32,33] cho thấy viên phối hợp perindopril/amlodipine giúp giảm huyết áp sớm tốt hơn so với cách tiếp cận điều trị theo từng bậc, chúng tôi đánh giá ảnh hưởng của việc kiểm soát huyết áp tại thời điểm 1 tháng lên tần suất các biến cố lâm sàng đáng quan tâm (bất kể theo phác đồ điều trị nào). Hình 4 cho thấy tần suất các biến cố này giảm đáng kể trong số những bệnh nhân có huyết áp kiểm soát được sau 1 tháng so với những bệnh nhân mà huyết áp không được kiểm soát sau 1 tháng. Các số liệu này phù hợp với nhiều báo cáo khác vốn đã chỉ ra rằng sự hạ huyết áp sớm và hiệu quả có thể là một thành phần quan trong trong việc điều trị tốt THA.
Tóm lại, tất cả bốn hàm lượng của viên phối hợp perindopril/amlodipine giúp gia tăng đáng kể tỷ lệ bệnh nhân bị THA từ nhẹ đến nặng đạt huyết áp kiểm soát. Nhìn chung, các hàm lượng khác nhau của viên phối hợp này giúp giảm huyết áp khoảng 25/11 mmHg trong khoảng thời gian 6 tháng, và dạng phối hợp này được dung nạp tốt.
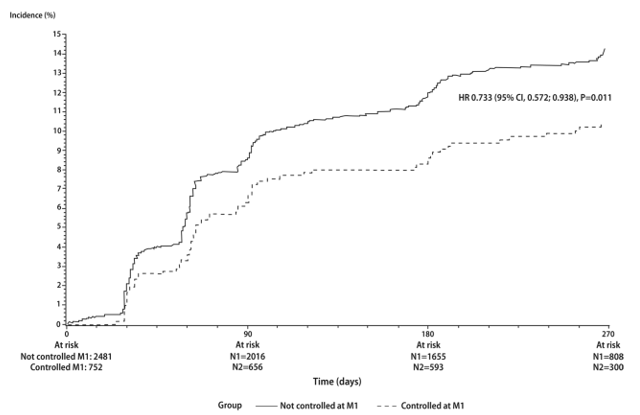
Hình 4: Tần suất mới mắc của tiêu chí gộp của các biến cố lâm sàng đáng quan tâm theo thời gian ở những bệnh nhân có huyết áp được kiểm soát và không được kiểm soát tại thời điểm 1 tháng.
CI: khoảng tin cậy, HR hazard ratio (tỷ số nguy cơ), M1: 1 tháng, Not controlled: không được kiểm soát, Controlled: được kiểm soát, At risk: phơi nhiễm nguy cơ, Incidence: tần suất mới mắc.
Tuân thủ các tiêu chuẩn đạo đức:
Tài trợ:Nghiên cứu này được tài trợ bởi Servier. Dưới sự hướng dẫn của các tác giả, hỗ trợ viết y khoa và biên tập được cung cấp bởi John Plant
Xung đột lợi ích:Neil Poulter đã nhận được hỗ trợ tài chính từ một số công ty dược phẩm sản xuất thuốc hạ HA, để tư vấn (Servier), dự án nghiên cứu và nhân viên (Pfizer, Servier), và sắp xếp và nói chuyện tại các cuộc họp giáo dục (Astra Zeneca,Lri Therapharma, Napi, Servier và Pfizer). Anh ta không có cổ phiếu
hoặc cổ phần trong bất kỳ công ty như vậy. Trong 3 năm qua, Ajay Gupta có nhận được hỗ trợ tài chính để tham dự một hội nghị và một phòng danh dự cho một bài thuyết trình từ Servier, nhưng những khoản tiền này dành cho các hoạt động không liên quan đến bản thảo này. Trong quá trình thực hiện nghiên cứu này, ông đã là một thành viên của ủy ban xét xử và an toàn độc lập và đã nhận được phí tư vấn cho công việc đó. Andrew Whitehouse đã được thanh toán phí di chuyển trong quá trình thực hiện nghiên cứu để tới các nơi nghiên cứu và văn phòng của nhà tài trợ. Eamon Dolan, Eoin O’Brien và Peter Sever không có xung đột lợi ích nào liên quan trực tiếp đến nội dung của bài báo này.
Phê duyệt đạo đức:Tất cả các thủ tục được thực hiện trong các nghiên cứu liên quan đến sự tham gia của con người đã tuân thủ các tiêu chuẩn đạo đức của ủy ban nghiên cứu quốc gia và với tuyên bố Helsinki.
Sự đồng thuận tham gia:có được từ tất cả các cá nhântham gia nghiên cứu.
Chú thích (tên các tác giả):
1-Đơn vị thử nghiệm lâm sàng Hoàng gia, Đại học Y tế công cộng, Đại học Hoàng gia London, lầu 1 Stadium House, 68 Wood Lane, London W12 7TA, Vương quốc Anh. E-mail: n.poulter@imperial.ac.uk
2-Đơn vị Đột quị và Tăng huyết áp, Bệnh viện Connolly, Blanchardstown, Dublin, Ireland.
3-Viện nghiên cứu William Harvey, Đại học Queen Mary tại London, London, Vương quốc Anh.
4-Viện Conway, Đại học Dublin, Dublin, Ireland.
5-Viện Tim Phổi Quốc gia, Đại học Hoàng gia London, London, Vương quốc Anh.
Tài liệu tham khảo
1. GBD 2015 Risk Factors Collaborators. Global, regional, and national comparative risk assessment of 79 behavioural, environmental and occupational, and metabolic risks or clusters of risks, 1990–2015: a systematic analysis for the Global Burden of Disease Study 2015. Lancet. 2016;388:1659–724.
2. Wolf-Maier K, Cooper RS, Kramer H, Banegas JR, Giampaoli S, Joffres MR, et al. Hypertension treatment and control on five European countries, Canada, and the United States. Hypertension. 2004;43:10–7.
3. Chow CK, Teo KK, Rangarajan S, Islam S, Gupta R, Avezum A, et al. Prevalence, awareness, treatment and control of hypertension in rural and urban communities in high-, middle-, and low-income countries. JAMA. 2013;310:959–68.
4. Falaschetti E, Chaudhury M, Mindell J, Poulter NR. Continued improvement in hypertension management in England: results from the Health Survey for England 2006. Hypertension. 2009;53:480–6.
5. Weber MA, Schiffrin EL, White WB, Mann S, Lindholm LH, Kenerson JG et al. Clinical practice guidelines for the managementof hypertension in the community. A statement by the AmericanSociety of Hypertension and the International Society of Hypertension.Hypertension. 2014; 32:3-15.
6. Leung AA, Nerenberg K, Daskalopoulou SS, McBrien K, Zarnke KB, Dasgupta K, et al. Hypertension Canadas 2016 Canadian hypertension education program guidelines for blood pressure measurement, diagnosis, assessment of risk, prevention, and treatment of hypertension. Can J Cardiol. 2016;32:569–88.
7. Mancia G, Fagard R, Narkiewicz K, Redón J, Zanchetti A, Böhm M et al. ESH/ESC Guidelines for the management of arterial hypertension. The Task Force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). J Hypertension. 2013; 31:1281–1357.
8. NICE Guidelines in Hypertension 2011: Clinical management of primary hypertension in adults. https ://www.nice.org.uk/guidance/cg127/resou rces/hyper tensi on-in-adult s-diagn osis-and-management -pdf-35109 45494 1637. Accessed 2 June 2017.
9. Williams B, Poulter N, Brown M, Davies M, McInnnes G, Potter J, Sever P, Thom S. Guidelines for the management of hypertension: report of the fourth working party of the British Hypertension Society 2004—BHS IV. J Hum Hypertens. 2004;18:139–85.
10. Whelton PK, Whelton PK, Carey RM, Aronow WS, Casey DE Jr, Collins KJ, Dennison Himmelfarb C, et al. 2017 ACC/AHA/ AAPA/ABC/ACPM/AGS/APhA/ASH/ASPC/NMA/PCNA guideline for the prevention, detection, evaluation, and management of high blood pressure in adults. JACC. 2018;71:127–248.
11. Williams B, Mancia G, Spiering W, Agabiti Rosei E, Azizi M, Burnier M, et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension. Eur Heart J. 2018;39:3021–104.
12. Egan BM, Bandyopadhyay D, Shaftman SR, Wagner CS, Zhao Y, Yu-Isenberg KS. Initial monotherapy and combination therapy and hypertension control the first year. Hypertension. 2012;59:1124–31.
13. Gupta AK, Arshad A, Poulter NP. Compliance, safety and effectiveness of fixed dose combinations of antihypertensive agents: a
meta-analysis. Hypertension. 2010;55:399–407.
14. Baser O, Andrews LM, Wang L, Xie L. Comparison of real-world adherence, healthcare resource utilization and costs for newly initiated
valsartan/amlodipine single-pill combination versus angiotensin receptor blocker/calcium channel blocker free-combination therapy. J Med Econ. 2011;14:576–83.
15. PROGRESS Collaborative Group. Randomised trial of a perindopril- based blood-pressure-lowering regimen among 6,105 individuals with previous stroke or transient ischaemic attack. Lancet. 2001;358:1033–41.
16. Julius S, Kjeldsen SE, Weber M, Brunner HR, Ekman S, Hansson L, et al. Outcomes in hypertensive patients at high cardiovascular risk treated with regimens based on valsartan or amlodipine: the VALUE randomised trial. Lancet. 2004;363:2022–31.
17. Dahlof B, Sever PS, Poulter NR, Wedel H, Beevers DG, Caulfield M, et al. Prevention of cardiovascular events with an antihypertensive regimen of amlodipine adding perindopril as required versus atenolol adding bendroflumethiazide as required, in the Anglo-ScandinavianCardiac Outcomes Trial-Blood Pressure LoweringArm (ASCOT-BPLA): a multicentre randomised controlled trial.Lancet. 2005;36:895–906.
18. Bahl VK, Jadhav UM, Thacker HP. Management of hypertensionwith the fixed combination of perindopril and amlodipinein daily clinical practice: results from the STRONG prospective,observational, multicenter Study. Am J Cardiovasc Drugs.2009;9:135–42.
19. Zhang Y, Ly C,Yannoutsos A, Agnoletti D, Mourad JJ, Safar ME,et al. Effect of a fixed combination of Perindopril and Amlodipineon blood pressure control in 6256 patients with not-at-goalhypertension: the AVANTAGE study. J Am Soc Hypertens.2013;7:163–9.
20. Health Products Regulatory Authority. Summary of product characteristics,Viacoram 3.5 mg/2.5 mg. https ://www.hpra.ie/img/uploa ded/swedo cumen ts/Licen seSPC PA056 8-027-001_2305201511 5329.pdf. Accessed 2 June 2017.
21. European Medicines Agency. Guideline on clinical investigationof medicinal products in the treatment of hypertension. London,18November 2010. EMA/238/1995/Rev. 3.
22. Rothwell PM, Howard SC, Dolan E, OBrien E, Dobson JE,Dahlof B, Sever PS, Poulter NR. Prognostic significance of visitto-visit variability, maximum systolic blood pressure, and episodichypertension. Lancet. 2010;375:895–905.
23. EuroQol. EQ5D Questionnaire. http://www.euroq ol.org. Accessed2 June 2017.
24. International Diabetes Federation. The IDF consensus worldwidedefinition of the metabolic syndrome. https ://www.idf.org/e-libra
ry/conse nsus-state ments /60-idfco nsens us-world wide-defin ition ofthe-metab olic-syndr ome. Accessed 2 June 2017.
25. Falaschetti E, Mindell J, Knott C, Poulter N. Hypertension managementin England: a serial cross-sectional study from 1994–2011. Lancet. 2014;383:1912–9.
26. Brown MJ, McInnes GT, Papst CC, Zhang J, MacDonald TM.Aliskiren and the calcium channel blocker amlodipine combinationas an initial treatment strategy for hypertension control(ACCELERATE): a randomised, parallel-group trial. Lancet.2011;377:312320.
27. ONTARGET Investigators, Yusuf S, Teo KK, Pogue J, Dyal L,Copland I, Schumacher H, Dagenais G, Sleight P, Anderson C.Telmisartan,remipril, or both in patients at high risk of vascularevents. N Engl J Med. 2008; 358:1547–59.
28. Jamerson K, Weber MA, Bakris GL, Dahlöf B, Pitt B, Shi V,Hester A, Gupte J, Gatlin M, Velazquez EJ; ACCOMPLISHTrial Investigators. Benazepril plus amlodipine or hydroclorothiazidefor hypertension in high-risk patients. N Engl J Med. 2008;359:2417–28.
29. Messerli FH, Makani H, Benjo A, Romero J, Alviar C, BangaloreS. Antihypertensive efficacy of hydrochlorothiazide as evaluatedby ambulatory blood pressure monitoring: a meta-analysis of randomizedtrials. J Am Coll Cardiol. 2011;57:590–600.
30. Rothwell PM, Howard SC, Dolan E, OBrien E, Dobson JE,Poulter NR, Sever PS on behalf of the ASCOT-BPLA and MRCTrial Investigators. Effects of β-blockers and calcium-channelblockers on within-individual variability in blood pressure andrisk of stroke. Lancet Neurol 2010;9(5):469–480.
31. Rothwell PM, et al. Limitations of the usual blood-pressurehypothesis and importance of variability, instability, and episodichypertension. Lancet. 2010;375:938–48.
32. Mancia G, Asmar R, Amodeo C, Mourad JJ, Taddei S, GambaMA, Chazova IE, Puig JG. Comparison of single-pill strategiesfirst line inhypertension: perindopril/amlodipine versus valsartan/amlodipine. J Hypertens. 2015;33:401–11.
33. Laurent S, Parati G, Chazova I, Sirenko Y, Erglis A, LauceviciusA, Farsang C. Randomized evaluation of a novel, fixed-dose combination
of perindopril 3.5 mg/amlodipine 2.5 mg as a first-steptreatment in hypertension. J Hypertens. 2015; 33:653–661.







