Scott D.Solomon, Rudolf A. de Boer và cộng sự
Đã đăng trên tạp chí European Journal of Heart Failure 09/06/2020
Lược dịch và hiệu đính: ThS.BS. Lê Võ Kiên
Viện Tim mạch Việt Nam, Bệnh viện Bạch Mai
TÓM TẮT
Mục tiêu nghiên cứu:
Các thuốc ức chế kênh đồng vận natri-glucose 2 (SGLT2) ban đầu được nghiên cứu để điều trị đái tháo đường (ĐTĐ) typ 2, tuy nhiên, qua nhiều thử nghiệm lâm sàng (TNLS), các thuốc này đã được chứng minh không những giúp giảm đường huyết mà còn làm giảm tỷ lệ nhập viện vì suy tim ở những bệnh nhân ĐTĐ typ 2 chưa có tiền sử suy tim và giảm tỷ lệ nhập viện do suy tim cấp ở cả những bệnh nhân có tiền sử suy tim có hoặc không có mắc kèm ĐTĐ typ 2. Tuy nhiên, hiện tại chưa có bằng chứng nào cho thấy hiệu quả của các thuốc ức chế SGLT2 ở nhóm bệnh nhân suy tim với phân suất tống máu (PSTM) thất trái giảm nhẹ và PSTM thất trái bảo tồn.
Phương pháp nghiên cứu:
DELIVER là một TNLS quốc tế, đa trung tâm, hai nhóm nghiên cứu song song, phân tích dữ liệu dựa vào số biến cố, ngẫu nhiên, mù đôi, tiến hành trên những bệnh nhân suy tim mạn tính với PSTM thất trái (EF) > 40%. Thử nghiệm này nhằm mục tiêu so sánh hiệu quả của dapagliflozin 10 mg uống một lần mỗi ngày so với giả dược, trên nền điều trị thường quy. Các bệnh nhân được tuyển vào thử nghiệm bao gồm: bệnh nhân có hoặc không có mắc kèm ĐTĐ, có triệu chứng cơ năng và thực thể của suy tim, EF > 40%, nồng độ peptide lợi niệu natri cao và có bệnh tim cấu trúc. Tiêu chí chính của nghiên cứu là khoảng thời gian từ khi bắt đầu tham gia nghiên cứu cho tới lần đầu tiên bệnh nhân gặp biến cố suy tim nặng hơn (nhập viện nội trú vì suy tim cấp hoặc đến khám tại phòng khám vì suy tim cấp nhưng không phải nhập viện) hoặc tử vong do tim mạch. Tiêu chí chính của nghiên cứu sẽ được kiểm định song song ở 2 nhánh phân tích: (1) trên toàn bộ dân số nghiên cứu và (2) trên nhóm bệnh nhân có EF < 60%. Nghiên cứu được tiến hành theo phương pháp phân tích dữ liệu dựa tổng số biến cố mục tiêu là 1117. Tổng cộng 6263 bệnh nhân đã được phân nhóm ngẫu nhiên.
Kết luận:
Thử nghiệm DELIVER sẽ xác định hiệu quả và tính an toàn của dapagliflozin – một chất ức chế SGLT2 khi thêm vào phác đồ điều trị suy tim truyền thống ở những bệnh nhân suy tim có PSTM thất trái bảo tồn hoặc giảm nhẹ.
ĐẶT VẤN ĐỀ
Các chất ức chế SGLT2 vốn dĩ ban đầu được nghiên cứu và phát triển nhằm làm giảm nồng độ glucose máu cho bệnh nhân ĐTĐ typ 2, tuy nhiên, sau nhiều nghiên cứu, các chất này cho thấy có thêm vai trò làm giảm tỷ lệ nhập viện vì suy tim ở những bệnh nhân ĐTĐ typ 2, kể cả những bệnh nhân không có tiền sử suy tim từ trước 1-3. Ngoài ra, ở những bệnh nhân suy tim với PSTM thất trái giảm (HFrEF) (EF ≤ 40%), bất kể có hoặc không có mắc kèm ĐTĐ, dapagliflozin và empagliflozin đều có tác dụng làm giảm rõ rệt tỷ lệ tử vong do nguyên nhân tim mạch và tỷ lệ suy tim tiến triển khi được thêm vào điều trị thường quy 4-5. Hiện nay, bản chất cơ chế vì sao các thuốc ức chế SGLT2 giúp cải thiện tiên lượng cho bệnh nhân suy tim vẫn đang tiếp tục được nghiên cứu. Tuy nhiên, các thuốc ức chế SGLT2 đã được chứng minh có các tác động tích cực về mặt huyết động 6,7, tăng mức năng lượng cho cơ tim và khả năng tải dịch của tim, cải thiện chức năng nội mạc, chống viêm nội mạc và làm chậm tiến triển bệnh thận mạn8. Các tác động về mặt bệnh sinh này phối hợp với nhau và chính là nền tảng cơ bản giúp cải thiện những thông số trực quan đo lường được trên lâm sàng, đó là giảm áp lực đổ đầy thất và làm chậm quá trình tái cấu trúc cơ tim từ rất sớm, đồng thời duy trì hiệu quả bền vững lâu dài 7,9 – 11.
Nhóm bệnh nhân có PSTM thất trái giảm nhẹ hoặc bảo tồn (EF > 40%) chiếm phần lớn trong tổng số bệnh nhân suy tim. Nhóm bệnh nhân này vẫn có khả năng gặp phải các biến cố cấp tính tương tự như nhóm suy tim EF < 40%, dẫn đến tiên lượng kém, ví dụ như biến cố tử vong, nhập viện vì suy tim và các triệu chứng suy tim nặng nề. Ngoài ra, hiện nay còn thiếu các bằng chứng khoa học về các thuốc và phương pháp điều trị có hiệu quả nhóm bệnh nhân này. Các bệnh nhân suy tim PSTM giảm nhẹ hoặc bảo tồn đang có nhu cầu rất lớn về phương pháp điều trị hiệu quả và an toàn nhưng các điều trị trong thực hành lâm sàng hiện tại chưa đáp ứng được. Các nhà nghiên cứu vẫn chưa biết liệu các chất ức chế SGLT2, vốn đã được chứng minh có hiệu quả ở nhóm suy tim PSTM thất trái giảm, có tiếp tục mang lại lợi ích cho nhóm bệnh nhân EF > 40% hay không. Trong nghiên cứu DAPA-HF, hiệu quả của dapagliflozin là tương tự nhau trên toàn bộ phổ EF < 40% 12. Các dữ liệu từ 2 TNLS của chất ức chế cả SGLT1 và SGLT2, trong đó có một thử nghiệm lựa chọn cả các bệnh nhân có ĐTĐ và suy tim vừa mới nhập viện, cho thấy những kết quả tích cực ở nhóm bệnh nhân EF > 40% 13-14. Tuy nhiên, hầu hết các thuốc điều trị có tác dụng hiệu quả đối với suy tim EF < 40% dường như không có hiệu quả hoặc hiệu quả giảm rõ rệt đối với bệnh nhân EF cao hơn. Kết quả một số nghiên cứu đã cho thấy sự giảm sút hiệu quả điều trị khi EF tăng dần về mức bình thường 15 – 18. Nguyên nhân chủ yếu dẫn đến việc chưa thể tìm được thuốc điều trị có hiệu quả rõ rệt để giảm bệnh suất và tử suất của suy tim PSTM thất trái bảo tồn có thể do sự đa dạng về bệnh nguyên và bệnh sinh suy tim ở những bệnh nhân có PSTM thất trái bảo tồn. Suy tim PSTM thất trái giảm cũng có bệnh nguyên và diễn biến rất đa dạng, nhưng cách thức đáp ứng điều trị khá đồng nhất, với một loạt các thuốc đã được chứng minh giúp cải thiện rõ rệt bệnh suất và tử suất. Các thuốc này dường như vẫn có tác dụng đối với nhóm suy tim PSTM thất trái giảm nhẹ (HFmrEF – EF: 40-50%), nhưng đối với nhóm EF > 50% thì không. Tuy nhiên, có những cơ sở để tin rằng các chất ức chế SGLT2 có thể có tác dụng rộng rãi trên cả nhóm suy tim PSTM thất trái bảo tồn mặc dù bệnh nguyên của hội chứng suy tim này khá đa dạng về mặt bản chất. Tất cả các loại hình suy tim đều dẫn đến tình trạng ứ trệ dịch và suy giảm chức năng tâm thất, kể cả suy tim PSTM thất trái bảo tồn, và tình trạng này có thể được cải thiện khi dùng các chất ức chế SGLT2. Ngoài ra, suy thận mạn tính là một trong các yếu tố nguy cơ chính dẫn đến các biến cố ở bệnh nhân suy tim PSTM bảo tồn, do đó, khi các chất ức chế SGLT2 có hiệu quả cải thiện chức năng thận, có thể đem lại các lợi ích lâm sàng cho nhóm bệnh nhân suy tim với PSTM bảo tồn. Các chất ức chế SGLT2 còn có vai trò cải thiện chức năng tâm trương, làm giảm mỡ tạng (tính cả mỡ ở thượng tâm mạc), giảm độ xơ cứng thành mạch và có tác dụng đáng kể trong cải thiện khả năng chống viêm và cải thiện chức năng nội mạc mạch máu. Đây là các cơ chế quan trọng trong bệnh sinh của suy tim PSTM bảo tồn.
Thử nghiệm DELIVER được thiết kế nhằm mục đích đánh giá vai trò của thuốc ức chế SGLT2 dapagliflozin trong giảm tỷ lệ tử vong tim mạch và tỷ lệ nhập viện vì suy tim ở những bệnh nhân có EF > 40% (bao gồm bệnh nhân suy tim PSTM thất trái giảm và PSTM thất trái bảo tồn). Thiết kế của TNLS DELIVER dựa trên bài học kinh nghiệm của nhiều TNLS trước đây ở nhóm bệnh nhân suy tim EF > 40%. Kết quả của thử nghiệm này cùng với thử nghiệm DAPA-HF cung cấp đầy đủ các bằng chứng về hiệu quả điều trị suy tim của dapagliflozin ở bệnh nhân suy tim với mọi dải PSTM thất trái.
THIẾT KẾ VÀ PHƯƠNG PHÁP NGHIÊN CỨU
Thiết kế nghiên cứu và cơ quan tiến hành/giám sát nghiên cứu
DELIVER là một TNLS quốc tế, đa trung tâm, ngẫu nhiên, mù đôi, hai nhóm song song, phân tích dữ liệu dựa trên số biến cố, ở những bệnh nhân suy tim mạn tính và EF > 40%, đánh giá hiệu quả của dapaglifolzin 10 mg một lần mỗi ngày so với giả dược, trên nền điều trị thường quy. Sơ đồ thiết kế nghiên cứu được trình bày trong Hình 1. Nghiên cứu DELIVER được thiết kế bởi Ban chỉ đạo nghiên cứu học thuật phối hợp với Nhà tài trợ. Nghiên cứu được giám sát bởi Ban điều hành nghiên cứu phối hợp với Nhà tài trợ và các nghiên cứu viên hàng đầu quốc gia, và được đăng ký trên Mạng lưới Cơ sở dữ liệu Quốc gia ClinicalTrials.gov với mã số NCT03619213.

Hình 1. Thiết kế nghiên cứu DELIVER
Đối tượng tham gia nghiên cứu
Tiêu chuẩn lựa chọn bệnh nhân tham gia nghiên cứu được trình bày trong Bảng 1 (tham khảo trên website). Các bệnh nhân tham gia nghiên cứu thỏa mãn các tiêu chuẩn sau: bệnh nhân có hoặc không có ĐTĐ, ≥ 40 tuổi, EF > 40% (xác định bằng siêu âm tim hoặc chụp cộng hưởng từ tim trong vòng 12 tháng trước khi tuyển bệnh mà không có biến cố nào sau thời điểm đó có khả năng gây giảm EF hơn), có bệnh tim cấu trúc (giãn nhĩ trái hoặc phì đại thất trái), có tăng nồng độ peptide lợi niệu natri trong máu (NT-proBNP) ≥ 300 pg/ml (hoặc ≥ 600 pg/ml đối với bệnh nhân rung nhĩ hoặc cuồng nhĩ). Bệnh nhân suy tim điều trị ngoại viện, suy tim cấp cứu hoặc bệnh nhân suy tim đang nằm viện nội trú đều có thể được tuyển vào nghiên cứu.
Tiêu chuẩn loại trừ chủ yếu: các bệnh nhân đã được kê đơn thuốc ức chế SGLT2 trong vòng 4 tuần trước giai đoạn chia ngẫu nhiên, bệnh nhân có tiền sử không dung nạp với thuốc ức chế SGLT2; ĐTĐ typ 1; mức lọc cầu thận ước tính (eGFR) < 25 ml/phút/1,73 m2 da khi khám sàng lọc; huyết áp tâm thu ≥ 160 mmHg với điều điện đang không uống ≥ 3 loại thuốc hạ huyết áp, hoặc ≥ 180 mmHg bất kể đang dùng bao nhiêu loại thuốc hạ áp; bệnh nhân có triệu chứng giống như suy tim nhưng có thể do bệnh lý khác (ví dụ thiếu máu, suy giáp, tăng áp động mạch phổi tiên phát, huyết khối động mạch phổi mạn tính, phải dùng liệu pháp oxy dài hạn tại nhà); bệnh van tim từ trước mà chưa được can thiệp hoặc phẫu thuật sửa chữa; tiền sử bệnh cơ tim thâm nhiễm, bao gồm cả tiền sử rõ ràng hoặc đang nghi ngờ bệnh cơ tim amyloid; viêm cơ tim hoặc viêm màng ngoài tim; bệnh cơ tim phì đại.
TNLS DELIVER tuyển bệnh bắt đầu từ 27 tháng 8 năm 2018 sau khi đã được Hội đồng Đạo đức chấp thuận. Tất cả các bệnh nhân đều được ký cam kết đồng ý tham gia nghiên cứu. Bệnh nhân cuối cùng được phân nhóm ngẫu nhiên vào ngày 18 tháng 1 năm 2021. Có 353 trung tâm ở 20 quốc gia trên khắp các miền địa lý tham gia vào nghiên cứu. Nghiên cứu DELIVER tuân thủ Bộ nguyên tắc Thực hành nghiên cứu lâm sàng tốt (Good Clinical Practice) và Tuyên bố Helsinki về vấn đề đạo đức trong nghiên cứu y khoa.
Quy trình nghiên cứu
Phân nhóm ngẫu nhiên và phân tầng
Sau khi ký chấp thuận tham gia nghiên cứu, khám sàng lọc và nếu bệnh nhân đạt đủ các tiêu chuẩn để vào giai đoạn phân nhóm ngẫu nhiên, các bệnh nhân sẽ được phân loại ngẫu nhiên vào nhóm sử dụng thuốc hoặc giả dược. Quy trình phân nhóm này được thực hiện thông qua một hệ thống phản hồi tương tác thoại/ trình duyệt (IxRS). Việc phân loại ngẫu nhiên sẽ đảm bảo cân đối giữa nhóm dùng dapagliflozin và nhóm dùng giả dược với tỷ lệ 1:1. Việc phân nhóm ngẫu nhiên trên hệ thống IxRS được phân tầng dựa trên cơ sở bệnh nhân có hay không có tiền sử ĐTĐ ở thời điểm phân nhóm ngẫu nhiên (chẩn đoán dựa vào tiền sử đã biết ĐTĐ hoặc HbA1c ≥ 6,5% ở thời điểm tuyển bệnh). Bệnh nhân sẽ được phân chia với tỷ lệ 1:1 vào nhóm sử dụng dapagliflozin 10 mg hoặc giả dược, uống một lần mỗi ngày. Hệ thống IxRS cũng giám sát các yếu tố khác của bệnh nhân như mức EF, độ NYHA, tình trạng “bán cấp” của bệnh (phân ngẫu nhiên đối tượng bệnh nhân phải nhập viện hoặc bệnh nhân trong vòng 30 ngày sau ra viện), có rung nhĩ hay không. Việc phân tầng bệnh nhân dựa trên các yếu tố này khi phân nhóm ngẫu nhiên giúp cân bằng các thông số nền của bệnh nhân, tránh việc có quá nhiều hoặc quá ít bệnh nhân có các triệu chứng hoặc tình trạng lâm sàng nào đó ở mỗi quốc gia.
Các thuốc phối hợp
Tất cả bệnh nhân được điều trị tổng thể các bệnh đồng mắc, bao gồm cả tăng huyết áp và đái tháo đường theo phác đồ thường quy của các cơ sở y tế tham gia vào nghiên cứu, ngoại trừ thuốc ức chế SGLT2.
Thăm khám định kỳ và theo dõi theo lịch trình của nghiên cứu
Sau khi phân nhóm ngẫu nhiên, bệnh nhân được tái khám vào ngày thứ 30, 120, 240, 360 và 480. Sau đó, tiếp tục tái khám mỗi 120 ngày. Nếu cần thiết, nghiên cứu viên sẽ chủ động tái khám thêm các lần khám ngoài kế hoạch tùy từng bệnh nhân. Kế hoạch tái khám chi tiết được trình bày ở Bảng S2 – phần phụ lục của nghiên cứu được công bố trên mạng internet. Các nghiên cứu viên sẽ kiểm tra sự tuân thủ điều trị của bệnh nhân theo quy trình nghiên cứu bằng cách đề nghị bệnh nhân trả lại cho nghiên cứu viên tất cả các viên thuốc chưa uống hết và các vỏ lọ thuốc rỗng đã sử dụng hết mỗi lần đến khám lại. Các bệnh nhân không tuân thủ điều trị theo quy trình nghiên cứu sẽ được tư vấn và thuyết phục về ý nghĩa của nghiên cứu và tầm quan trọng của dùng thuốc.
Mục tiêu của nghiên cứu
Mục tiêu chính và mục tiêu phụ của nghiên cứu
Mục tiêu chính của nghiên cứu nhằm đánh giá liệu dapagliflozin có vượt trội hơn giả dược khi thêm vào điều trị thường quy trên tiêu chí làm giảm các biến cố gộp liên quan đến suy tim nặng hơn (các đợt phải nhập viện vì suy tim mà không tiên liệu được trước, hoặc các lần đến khám vì suy tim cấp phải truyền thuốc đường tĩnh mạch tại phòng khám nhưng chưa đến mức độ phải nhập viện dài ngày), hoặc tử vong do tim mạch. Việc đo lường các tiêu chí chính được lượng hóa bằng cách tính thời gian từ khi bắt đầu phân nhóm ngẫu nhiên cho tới thời điểm gặp biến cố tim mạch đầu tiên (Bảng 2 – Tham khảo trên wesite). Tiêu chí chính sẽ đồng thời được đánh giá chung trên toàn bộ dân số tham gia nghiên cứu, và được đánh giá riêng trên nhóm bệnh nhân EF < 60% (phân tích tiêu chí chính đồng thời ở 2 tập hợp đối tượng).
Có 4 tiêu chí phụ chủ yếu của nghiên cứu. Thứ nhất là xác định liệu dapagliflozin có vượt trội hơn giả dược trong giảm tổng số đợt cấp suy tim (bao gồm các lần suy tim cấp phải nhập viện hoặc các lần khám khẩn cấp vì suy tim nhưng không cần phải nhập viện dài ngày) và tỷ lệ tử vong do tim mạch trong: (1) toàn bộ đối tượng nghiên cứu và (2) trong phân nhóm bệnh nhân EF < 60%. Tiêu chí phụ thứ hai là xem xét sự cải thiện hiệu quả điều trị do bệnh nhân tự đánh giá dựa theo Tổng điểm triệu chứng (TSS) của Bộ câu hỏi KCCQ. Các tiêu chí phụ còn lại bao gồm tỷ lệ tử vong do tim mạch và tỷ lệ tử vong chung do mọi nguyên nhân.
Ngoài ra, các nhà nghiên cứu cũng muốn đánh giá thêm một số tiêu chí thăm dò khác như: liệu dapagliflozin khi so sánh với giả dược có tác dụng trên độ dốc mức lọc cầu thận ước tính không (eGFR) (so sánh eGFR ở thời điểm bắt đầu phân nhóm ngẫu nhiên với thời điểm sau 1 năm và thời điểm sau 2 năm; đồng thời chọn một thời điểm nhất định nào đó trong quá trình nghiên cứu sau khi đã phân nhóm ngẫu nhiên để so sánh độ dốc eGFR với thời điểm 1 năm và 2 năm). Các nhà nghiên cứu cũng muốn đánh giá lợi ích của dapagliflozin trong cải thiện triệu chứng cơ năng của bệnh nhân ở các khía cạnh riêng rẽ trong bộ câu hỏi KCCQ, phân tầng dựa trên bệnh nhân có hay không có ĐTĐ typ 2 ở thời điểm phân nhóm ngẫu nhiên và hiệu chỉnh giá trị nền.
Kiểm toán kết quả
Một Ủy ban đánh giá kết quả nghiên cứu độc lập sẽ phân loại tất cả các trường hợp tử vong và phân tích các trường hợp biến cố tim mạch mà không tử vong dựa trên Bộ Tiêu chuẩn 2017 về Kết cục Tim mạch và Đột quỵ trong TNLS. Bộ tiêu chuẩn này được xây dựng bởi Tổ chức Chuẩn hóa dữ liệu cho TNLS Tim mạch.
Thích ứng trong bối cảnh dịch COVID-19
Do diễn biến dịch COVID-19 lan rộng trong thời gian tiến hành nghiên cứu, các đơn vị tổ chức nghiên cứu đã có các phương án thích ứng với bối cảnh đại dịch để đảm bảo chất lượng, tính chính xác và đầy đủ của các dữ liệu. Trong các trường hợp bắt buộc, các nghiên cứu viên đã phải chuyển hình thức thăm khám từ trực tiếp sang hỏi bệnh qua điện thoại và các ứng dụng truyền tải hình ảnh để giao tiếp với bệnh nhân. Các nghiên cứu viên cũng phỏng vấn qua mạng internet để thu thập các câu trả lời về triệu chứng cơ năng trong bộ câu hỏi về chất lượng cuộc sống KCCQ. Các trường hợp nhiễm COVID-19 trong thời gian tham gia nghiên cứu đều được báo cáo và theo dõi các biến cố liên quan đến COVID-19 và phân tích kỹ các trường hợp phải nhập viện điều trị vì COVID-19 và các trường hợp tử vong vì COVID-19.
Phân tích thống kê
Cách tính cỡ mẫu và phương pháp thống kê
Mục tiêu chính của nghiên cứu là đánh giá liệu dapagliflozin có vượt trội hơn so với giả dược không khi thêm vào điều trị thường quy. Đánh giá mục tiêu này dựa trên tiêu chí giảm biến cố gộp do suy tim nặng hơn (đợt cấp suy tim phải nhập viện điều trị hoặc có triệu chứng suy tim cấp phải đi khám nhưng chưa cần nhập viện), hoặc giảm tử vong do tim mạch. Cách thức lượng giá các tiêu chí này là tính thời gian từ khi bắt đầu phân nhóm ngẫu nhiên cho đến thời điểm xuất hiện biến cố đầu tiên. Các kiểm định thống kê phục vụ xác định tiêu chí chính được tiến hành đồng thời trên 2 tập hợp đối tượng (dual primary analysis): (1) trên tổng dân số nghiên cứu, và (2) trên phân nhóm bệnh nhân có EF < 60%. Xác suất sai sót α sẽ được chọn trước trong từng phép kiểm định tiêu chí chính để đảm bảo kiểm soát được sai lầm loại 1. Xác suất sai sót α cụ thể sẽ được quyết định trước giai đoạn phân tích dữ liệu sơ bộ.
Đề cương nghiên cứu được điều chỉnh vào ngày 12 tháng 11 năm 2020 với quyết định sẽ chuyển sang kiểm định đồng thời các tiêu chí nghiên cứu ở 2 tập hợp đối tượng như trình bày ở trên. Các tiêu chí chính của nghiên cứu (tử vong do tim mạch và suy tim nặng hơn) sẽ được phân tích ở 2 tập hợp đối tượng: (1) trên toàn bộ dân số nghiên cứu, và (2) trên phân nhóm bệnh nhân EF < 60%. Nếu theo hướng phân tích thống kê dự định ban đầu, nghiên cứu dự kiến thu thập 844 biến cố chính để đạt độ mạnh thống kê 90% cho tiêu chí chính. Khi quyết định chuyển sang hướng phân tích đồng thời 2 tập hợp, số lượng bệnh nhân có biến cố chính cần phải tăng lên 1117 để đạt đủ độ mạnh thống kê. Do đó, cỡ mẫu ước tính ban đầu là 4700 bệnh nhân đã phải tăng lên 6100 bệnh nhân. Các nhà nghiên cứu dự đoán rằng có ít nhất 70% biến cố chính (khoảng 780 biến cố) sẽ xảy ra ở nhóm bệnh nhân EF < 60%. Cỡ mẫu 6100 bệnh nhân được dự đoán sẽ mang lại độ mạnh thống kê 93% cho kết quả giảm 20% nguy cơ tương đối gặp biến cố chính khi thực hiện phép kiểm định hai phía với sai lầm loại 1, α = 0,024.
Quá trình tuyển bệnh kết thúc ngày 21 tháng 1 năm 2021 với tổng số 6263 bệnh nhân được tuyển chọn vào tới giai đoạn phân nhóm ngẫu nhiên. Thời gian trung vị theo dõi được ước tính là 27 tháng. Tất cả các phép phân tích thống kê tuân thủ nguyên tắc đặt ra từ ban đầu (ITT). Phương pháp phân tích thống kê cho nghiên cứu đã được lập kế hoạch chi tiết sẵn để tuân thủ thực hiện từ trước khi công khai dữ liệu nghiên cứu.
Phương pháp phân tích thống kê
Chúng tôi sử dụng quy trình kiểm định giả thiết khép kín với cách kiểm định phân cấp theo thứ bậc đã được chỉ định từ trước đối với các tiêu chí chính và tiêu chí phụ. Ý nghĩa thống kê của các tiêu chí lâm sàng được đánh giá trên hai tập hợp đối tượng nghiên cứu (2 nhánh phân tích) theo thứ tự đã được phân cấp và hoạch định sẵn (Hình 2). Sau khi đánh giá tiêu chí lâm sàng chính (thời gian tới biến cố gộp đầu tiên bao gồm tử vong do tim mạch và suy tim nặng lên) trên tập hợp toàn bộ đối tượng nghiên cứu và tập hợp phân nhóm có EF < 60%, chúng tôi tiến hành các bước kiểm định tiếp theo như trình bày trên sơ đồ Hình 2.
Nếu giả thiết không (H0) bị bác bỏ khi kiểm định trên tập hợp toàn bộ đối tượng nghiên cứu bằng mô hình hồi quy Cox, bước tiếp theo sẽ kiểm định các biến cố tái phát trên tập hợp toàn bộ bệnh nhân nghiên cứu bằng phương pháp LWYY. Tiếp đó là kiểm định so sánh sự thay đổi tổng điểm triệu chứng KCCQ-TSS giữa thời điểm mới tham gia nghiên cứu với thời điểm sau 8 tháng bằng phương pháp ANCOVA (để kiểm định khác biệt trong phân bố) và kiểm định tỷ lệ thắng (win ratio test) (để ước tính hiệu quả điều trị). Bước tiếp theo là phân tích thời gian tới khi gặp biến cố tử vong do tim mạch và cuối cùng là thời gian tới khi gặp biến cố tử vong do mọi nguyên nhân bằng mô hình hồi quy Cox.
Nếu giả thiết Ho bị bác bỏ ở phân nhóm EF < 60%, tổng số các biến cố và số biến cố tái phát sẽ được phân tích ở phân nhóm EF < 60% trước rồi sau đó đến tập hợp toàn bộ đối tượng nghiên cứu, với xác suất α được gán cho mỗi kiểm định kế tiếp. Nếu tất cả giả thiết H0 bị bác bỏ tại một nhánh nào đó, xác suất α sẽ được chuyển sang nhánh kia và giả thiết sẽ được kiểm định với α tối đa.
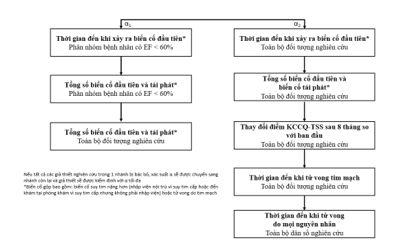
Hình 2. Sơ đồ phân tích thống kê thứ bậc cho tiêu chí chính và phụ của nghiên cứu
Phân tích các chỉ tiêu lâm sàng phụ
Các tổng điểm thành phần từng mục của Bộ câu hỏi KCCQ và điểm tổng chung (OSS) sẽ được phân tích bằng phương pháp ANOVA và kiểm định tỷ lệ thắng (win ratio test) giống như cách kiểm định tổng điểm triệu chứng (TSS). Các chỉ số thống kê mô tả và các thay đổi so với tình trạng ban đầu sẽ được trình bày với mọi thang điểm.
Phân tích dưới nhóm
Chúng tôi liệt kê sau đây các phân nhóm được xác định từ trước để tiến hành kiểm định nhằm xác định tiêu chí chính trên cả 2 tập hợp đối tượng: tuổi tại trung vị so với trên và dưới trung vị; giới tính; chủng tộc; khu vực địa lý; mức độ NYHA (II so với III/IV) tại thời điểm tuyển bệnh; phân nhóm EF khi bắt đầu nghiên cứu (41-49%, 50-59%, ≥ 60%); NT-proBNP khi bắt đầu tham gia nghiên cứu (bằng, trên, hoặc dưới trung vị); phân nhóm ngẫu nhiên: đang nằm điều trị nội trú, hay trong vòng 30 ngày sau xuất viện với các trường hợp khác; eGFR khi bắt đầu tham gia nghiên cứu (< 60 và ≥ 60 mL/phút/1.73m2); BMI khi bắt đầu tham gia nghiên cứu (< 30 và ≥ 30 kg/m2); tình trạng ĐTĐ; huyết áp tâm thu tại thời điểm phân nhóm ngẫu nhiên (tại, trên, hoặc dưới trung vị); rung nhĩ/cuồng nhĩ với các rối loạn nhịp khác khi bắt đầu tham gia nghiên cứu. Hiệu quả của điều trị cũng được đánh giá bằng một hàm số mô tả EF và HbA1c dưới dạng biến liên tục.
Ngoài việc phân tích các dữ liệu trong nội bộ TNLS DELIVER, chúng tôi đã lên kế hoạch từ trước thời điểm công khai dữ liệu của thử nghiệm DAPA-HF là sẽ kết hợp số liệu từ hai thử nghiệm của dapagliflozin trên bệnh nhân suy tim (DAPA-HF và DELIVER) để tiến hành phân tích số liệu tổng hợp nhằm đánh giá tác động của dapagliflozin trên toàn bộ các dải EF của bệnh nhân suy tim.
Hội đồng giám sát số liệu và giai đoạn phân tích sơ bộ
Một Hội đồng đánh giá số liệu sẽ giám sát nghiên cứu và tiến hành phân tích số liệu sơ bộ khi đạt được khoảng 67% tổng số biến cố chính so với mục tiêu. Khi đó, tiêu chí lâm sàng chính sẽ được kiểm định trên toàn bộ đối tượng nghiên cứu với mức ý nghĩa thống kê là 0.2%. Nếu giả thiết H0 bị bác bỏ, chúng tôi sẽ kiểm định tính vượt trội của dapagliflozin so với giả dược trên tiêu chí tử vong do tim mạch với mức ý nghĩa thống kê tương tự.
BÀN LUẬN
Trong số các bệnh nhân suy tim, suy tim với EF > 40% (bao gồm suy tim PSTM thất trái bảo tồn hoặc giảm nhẹ) chiếm một tỷ lệ lớn, trong khi chưa có một phương pháp trị liệu nào đặc hiệu cho tình trạng này cho thấy một nhu cầu lớn mà chưa được đáp ứng. Thuốc ức chế SGLT2 là các thuốc đầu tiên được thử nghiệm cho điều trị suy tim EF > 40% mà không phải là các thuốc có cơ chế tác động trên thần kinh – thể dịch như các thuốc đã nghiên cứu trước đây. Đây là một điểm lợi thế hơn so với các thuốc được nghiên cứu trước đây trên cả khía cạnh đánh giá về tính hiệu quả và tính an toàn. Mặc dù các thuốc có tác dụng giãn mạch đã được chứng minh có vai trò rõ ràng đối với suy tim PSTM giảm nhưng tác dụng giãn mạch ngoại biên của các thuốc này trên bệnh nhân có EF cao hơn có thể ít mang lại lợi ích điều trị và có thể gây tác dụng phụ tụt huyết áp nhiều hơn. Mặt khác, một vài cơ chế tác động trên sinh bệnh học suy tim của các thuốc ức chế SGLT2 được kỳ vọng sẽ mang lại hiệu quả lâm sàng trên nhóm suy tim với EF cao hơn tương tự như trên nhóm suy tim PSTM giảm, ví dụ như cải thiện áp lực đổ đầy thất trái, chống tái cấu trúc thất trái 9-10-11 và bảo vệ thận 8. Thêm vào đó, các thuốc ức chế SGLT2 được chứng minh cải thiện chức năng tâm trương ở bệnh nhân ĐTĐ typ 2 có EF ≥ 50% 20, giảm béo phì, làm mỏng lớp mỡ thượng tâm mạc hoặc tiết chế lớp mỡ này tiết ra adipokine – là các cytokine có hại 21. Thuốc ức chế SGLT2 còn có tác dụng bảo vệ chức năng nội mạc mạch máu và giảm phản ứng viêm nội mạc – là các cơ chế cơ học có quan hệ mật thiết với tình trạng tiến triển suy tim ở bệnh nhân có EF cao hơn. Thực tế, các nhà nghiên cứu DELIVER nhận thấy không có sự khác biệt trong cách đáp ứng điều trị với dapagliflozin ở các mức EF khác nhau trong nhóm bệnh nhân suy tim PSTM giảm. Kết quả của thử nghiệm SOLOIST-WHF và SCORED gần đây cho thấy sotagliflozin có mang lại kết quả tích cực cho nhóm bệnh nhân mới nhập viện vì suy tim có PSTM thất trái bảo tồn 13-14.
Các TNLS về suy tim PSTM thất trái bảo tồn vốn không dễ để tiến hành. Rất khó để tuyển chọn bệnh nhân phù hợp với các tiêu chuẩn của nghiên cứu vì việc xác định đúng bệnh nhân thực sự có các triệu chứng của hội chứng suy tim không hề dễ dàng. Ngoài ra, các bệnh nhân suy tim PSTM bảo tồn rất đa dạng về mặt kiểu hình, sinh lý bệnh và các thuốc và phương pháp điều trị cũng tương đối không đồng bộ. Các TNLS trước đây trên nhóm bệnh nhân suy tim PSTM bảo tồn chưa thành công trong việc chứng minh lợi ích điều trị trên tiêu chí chính một cách thuyết phục. Gần nhất là nghiên cứu PARAGON-HF so sánh sacubitril/valsartan với valsartan đơn trị, cho thấy, kết quả trên tiêu chí chính bao gồm giảm tỷ lệ suy tim phải nhập viện và giảm tỷ lệ tử vong do tim mạch cho nhóm suy tim PSTM bảo tồn vẫn chưa đạt được ý nghĩa về mặt thống kê, dù xu hướng có lợi nghiêng về nhóm điều trị 17. Tuy nhiên, các dữ liệu từ PARAGON-HF cho thấy các bệnh nhân có EF ở mức bằng hoặc thấp hơn 57% có kết quả điều trị tốt hơn so với nhóm có EF cao hơn. Kết quả này tiếp tục được khẳng định lại trong quá trình theo dõi liên tiếp EF. Hai TNLS khác cũng có chung kết luận rằng hiệu quả điều trị sẽ càng giảm dần ở nhóm bệnh nhân có EF tăng dần. Đó là thử nghiệm TOPCAT so sánh spironolactone với giả dược, và thử nghiệm CHARM-Preserved so sánh candesartan với giả dược 15-16. Hiện tại, các nhà nghiên cứu vẫn chưa rõ hiện tượng hiệu quả điều trị càng giảm khi EF càng cao là tình trạng chung của nhóm bệnh nhân suy tim EF > 40% hay hiện tượng này chỉ quan sát thấy ở các TNLS trước đây do các bệnh nhân khi đó được sử dụng các nhóm thuốc có cơ chế tác động trên hệ thần kinh – thể dịch. Chính vì kết quả nhiều TNLS trước đây cho thấy, mặc dù sử dụng rộng rãi nhiều phương thức điều trị, hiệu quả điều trị càng giảm sút khi EF càng tăng, nên trong thử nghiệm DELIVER, các nhà nghiên cứu quyết định cần phải sử dụng phương pháp phân tích thống kê các tiêu chí nghiên cứu đồng thời trên 2 tập hợp đối tượng .
Thiết kế nghiên cứu DELIVER có một số điểm đặc biệt. Đầu tiên, nghiên cứu DELIVER được tiến hành để bổ sung cho nghiên cứu DAPA-HF – là nghiên cứu chỉ đánh giá hiệu quả điều trị của dapagliflozin ở nhóm suy tim PSTM thất trái giảm. Kết quả của cả 2 nghiên cứu được phối hợp lại với nhau để đánh giá tác dụng của dapagliflozin trên toàn bộ các dải EF. Tiêu chuẩn thu nhận vào nghiên cứu bao gồm các bệnh nhân suy tim có tăng nồng độ peptide lợi niệu natri và có bằng chứng của tổn thương cấu trúc tim, phù hợp với thực hành lâm sàng hiện tại (Bảng 3- tham khảo trên website)17, 22-26. Nếu như nghiên cứu PARAGON-HF và TOPCAT chỉ tuyển các bệnh nhân có EF ≥ 45% và chưa từng bị giảm EF xuống dưới 40% thì nghiên cứu DELIVER tuyển chọn các bệnh nhân EF > 40% và cho phép cả các bệnh nhân từng có tiền sử suy tim EF ≤ 40% trước đây nhưng hiện tại đã cải thiện lên > 40%. Cách thiết kế tiêu chuẩn chọn lựa này sẽ cho phép một phổ rộng các bệnh nhân có suy tim PSTM thất trải giảm nhẹ được tham gia nghiên cứu.
Đặc điểm thứ 2 của nghiên cứu DELIVER là tiêu chí chính của nghiên cứu bao gồm cả nhóm bệnh nhân suy tim cấp mất bù phải nhập viện và nhóm bệnh nhân đến khám vì triệu chứng suy tim cấp nhưng chưa đến mức đòi hỏi nhập viện dài ngày. Một vài thử nghiệm trước đây, ví dụ như DAPA-HF, cũng tuyển các bệnh nhân có triệu chứng suy tim cấp, phải đến phòng khám và dùng thuốc lợi tiểu đường tĩnh mạch nhưng chưa đến mức phải nhập viện điều trị. Thử nghiệm DAPA-HF và một vài thử nghiệm khác cho thấy, nhóm bệnh nhân này có tiên lượng tương tự như nhóm bệnh nhân suy tim phải nhập viện và có sự khác biệt về hiệu quả điều trị ở một vài TNLS 27, 28. Hơn nữa, do thực tế nhu cầu điều trị ngoại trú ngày càng tăng, do sự thay đổi dần cách tiếp cận điều trị sao cho thuận tiện hơn cho bệnh nhân và lắng nghe sự lựa chọn của bệnh nhân, hình thức tiêm truyền lợi tiểu đường tĩnh mạch ngay tại phòng khám cho các trường hợp có triệu chứng suy tim cấp giúp hạn chế phải nhập viện nội trú dài ngày cho bệnh nhân, và do đó, việc tuyển thêm nhóm bệnh nhân này tham gia nghiên cứu bên cạnh nhóm bệnh nhân nội trú là hợp lý.
Các nghiên cứu trước đây ở nhóm bệnh nhân suy tim PSTM bảo tồn và giảm nhẹ sử dụng các thuốc có cơ chế tác động lên thần kinh – thể dịch đã cho thấy hiệu quả điều trị giảm đi rõ khi EF càng tăng. Tuy nhiên, hiện nay, cơ chế dược lý riêng biệt của các thuốc ức chế SGLT2 cũng như các dữ liệu nghiên cứu thu thập được từ thử nghiệm DECLARE-TIMI 58 và DAPA-CKD gợi ý tiềm năng rất lớn của nhóm thuốc này trong việc mang lại lợi ích lâm sàng cho bệnh nhân suy tim ở mọi dải PSTM thất trái 3,29.
Tuy nhiên, phương pháp phân tích đồng thời các tiêu chí nghiên cứu cho 2 tập hợp đối tượng trong nghiên cứu DELIVER với các kỹ thuật bảo đảm tránh so sánh đa biến sẽ cho phép khả năng tạo sự khác biệt hiệu quả dựa trên các mức EF, trong khi đó vẫn đảm bảo một cách thỏa đáng độ mạnh của thống kê về kết quả phân tích cả 2 tập hợp đối tượng nghiên cứu (tập hợp chứa toàn bộ đối tượng tham gia nghiên cứu và tập hợp chứa phân nhóm có EF < 60%).
Việc phân tích tiêu chí chính của nghiên cứu DELIVER dựa trên thời gian tới khi xuất hiện biến cố đầu tiên (tử vong do tim mạch hoặc suy tim cấp phải nhập viện hoặc triệu chứng suy tim cấp phải điều trị ở phòng khám nhưng chưa cần nhập viện). Việc kiểm định phân cấp theo thứ bậc các tiêu chí phụ cho phép đánh giá biến cố đầu tiên và các biến cố tái lại ở cả tập hợp phân nhóm EF < 60% và tiếp đó là tập hợp toàn bộ đối tượng nghiên cứu (nếu giả thiết vô hiệu H0 của phân nhóm EF < 60% bị bác bỏ) để xác định tiêu chí chính. Trong một số TNLS của suy tim (nhưng không phải tất cả), các biến cố tái lại thường có vai trò giúp tăng thêm độ mạnh thống kê của phép kiểm định 30, 31 và nó có thể đặc biệt có ý nghĩa trong các nghiên cứu liên quan đến suy tim PSTM thất trái bảo tồn vì ở nhóm đối tượng này, thường ít khi có tử vong liên quan đến biến cố suy tim. Hơn nữa, khi tiến hành kiểm định, nếu giả thiết H0 bị bác bỏ cho từng tiêu chí bao gồm: tiêu chí chính ở nhóm EF < 60%, biến cố tái phát ở nhóm EF < 60% và biến cố tái phát ở toàn bộ đối tượng nghiên cứu, khi đó, tiêu chí chính ở tập hợp toàn bộ đối tượng nghiên cứu có thể được kiểm định lại với mức xác suất α tối đa. Phương pháp kiểm định đồng thời các tiêu chí nghiên cứu ở 2 tập hợp đối tượng hữu ích trong các trường hợp không chắc chắn liệu nhóm đối tượng nào sẽ có lợi ích nhiều nhất và cách kiểm định nào (thời gian tới biến cố đầu tiên so với biến cố tái phát) có thể có kết quả tốt nhất cho nhóm đối tượng cụ thể nào (toàn bộ đối tượng hay nhóm EF < 60%) và với cách điều trị cụ thể nào (thuốc hay giả dược).
Kế hoạch kiểm định phân cấp theo thứ bậc các tiêu chí phụ trong nghiên cứu DELIVER còn đưa tiêu chí đánh giá tổng điểm triệu chứng TSS theo Bộ câu hỏi KCCQ được lên trước tiêu chí tỷ lệ tử vong tim mạch và tỷ lệ tử vong do mọi nguyên nhân. Lý do là vì các nhà nghiên cứu xác định tiêu chí phụ nào là ưu tiên hơn cho đối tượng bệnh nhân cụ thể của nghiên cứu (suy tim PSTM bảo tồn hoặc chỉ giảm nhẹ), đồng thời, các dữ liệu trước đây cho thấy tỷ lệ tử vong tương đối thấp ở nhóm bệnh nhân có chức năng tim trong khoảng này và khó mang lại lợi ích điều trị trên tiêu chí này
Nghiên cứu DELIVER và nghiên cứu EMPEROR-Preserved – một nghiên cứu khác về thuốc ức chế SGLT2 đang được tiến hành, có cả điểm giống và điểm khác nhau 32. Cả hai nghiên cứu đều có tiêu chuẩn tuyển bệnh giống nhau, bao gồm những bệnh nhân suy tim EF > 40%, có tăng nồng độ peptide niệu natri trong máu, có bằng chứng tổn thương cấu trúc tim (mặc dù có những bệnh nhân không có tổn thương cấu trúc tim nhưng vẫn có thể được tuyển vào nghiên cứu EMPEROR-Preserved nếu như họ có một đợt cấp suy tim phải nằm viện trong vòng 12 tháng trước đó). Sự khác biệt chính giữa hai nghiên cứu này là cách thiết kế phương pháp thống kê. Phép phân tích đồng thời các tiêu chí nghiên cứu ở 2 tập hợp bệnh nhân của nghiên cứu DELIVER sẽ giúp cho kiểm định giả thiết về tính hiệu quả trong điều trị của dapagliflozin ở cả phương diện toàn bộ đối tượng nghiên cứu và phương diện phân nhóm EF < 60%. Đây là một điểm ưu việt hơn đáng kể so với các TNLS trước đó về vấn đề nghiên cứu này. Ngoài ra, một số TNLS khác như EMPULSE (NCT04157751)33 và DAPA ACT HF-TIMI 68 (NCT04363697) đang được tiến hành nhằm đánh giá vai trò của các thuốc ức chế SGLT2 ở bệnh nhân nhập viện vì suy tim cấp tính và ổn định.
Tóm lại, nghiên cứu DELIVER sẽ đưa ra câu trả lời liệu dapagliflozin khi so sánh với giả dược có làm giảm nguy cơ tử vong do tim mạch và nguy cơ suy tim tiến triển nặng hơn ở bệnh nhân suy tim PSTM thất trái giảm nhẹ và PSTM thất trái bảo tồn hay không. Nghiên cứu DELIVER sẽ bổ khuyết kết quả cho nghiên cứu DAPA-HF – là nghiên cứu riêng cho đối tượng bệnh nhân suy tim PSTM thất trái giảm. Thiết kế của nghiên cứu DELIVER là một thiết kế mới riêng biệt, rút ra từ các bài học kinh nghiệm đúc kết từ cách thức tiến hành và kết quả của các TNLS trước đây, với mục đích tìm ra một phương pháp điều trị mới cho nhóm bệnh nhân suy tim PSTM thất trái bảo tồn hoặc giảm nhẹ – là nhóm bệnh nhân có nhu cầu rất lớn về một phương pháp điều trị hiệu quả rõ ràng mà hiện tại chưa được đáp ứng như kỳ vọng.
Từ viết tắt: ĐTĐ (đái tháo đường), PSTM: phân suất tống máu, TNLS: Thử nghiệm lâm sàng, SGLT2: kênh đồng vận natri-glucose 2
Bảng 1. Tiêu chuẩn lựa chọn và tiêu chuẩn loại trừ bệnh nhân của TNLS DELIVER
Tiêu chuẩn tuyển bệnh
– Bệnh tim cấu trúc được định nghĩa là: + Nhĩ trái giãn với ít nhất một trong các thông số đo đạc sau: chiều rộng nhĩ trái (đường kính) ≥ 3,8 cm, hoặc đường kính dài nhĩ trái ≥ 5,0 cm, hoặc diện tích nhĩ trái ≥ 20 cm2, hoặc thể tích nhĩ trái ≥ 55 ml, hoặc chỉ số thể tích nhĩ trái ≥ 29 ml/m. + Phì đại thất trái với độ dày vách liên thất hoặc thành sau thất trái ≥ 1,1 cm.
|
Tiêu chuẩn loại trừ
|
| CKD-EPI: Chronic Kidney Disease Epidemiology Collaboration. COPD: chronic obstructive pulmonary disease. NTproBNP: N-terminal pro-B-typ natriuretic peptide. NYHA: New York Heart Association. SGLT2: sodium-glucose co-transporter 2. |
Bảng 2. Mục tiêu, tiêu chí chính và tiêu chí phụ của nghiên cứu
| Mục tiêu nghiên cứu | Tiêu chí nghiên cứu tương ứng |
| Mục tiêu chính
Xác định liệu dapagliflozin khi thêm vào điều trị thường quy có vượt trội hơn giả dược trong giảm tỷ lệ biến cố gộp của tử vong tim mạch và suy tim (bao gồm suy tim cấp phải nhập viện và suy tim cấp xử trí tại phòng khám mà không cần nhập viện) ở những bệnh nhân suy tim với PSTM thất trái bảo tồn, trên 2 tập hợp đối tượng: (1) toàn bộ bệnh nhân tham gia nghiên cứu, và (2) phân nhóm bệnh nhân có EF < 60%. |
Thời gian cho tới khi xuất hiện biến cố bất kỳ:
|
| Mục tiêu phụ
+ Xác định liệu dapagliflozin có vượt trội hơn giả dược trong giảm tổng số đợt cấp suy tim (suy tim cấp phải nhập viện và suy tim cấp xử trí tại phòng khám) và giảm tỷ lệ tử vong tim mạch ở 2 tập hợp đối tượng: (1) toàn bộ bệnh nhân tham gia nghiên cứu, và (2) phân nhóm bệnh nhân có EF < 60%. + Xác định liệu dapagliflozin có vượt trội hơn giả dược trong cải thiện hiệu quả điều trị được đánh giá chủ quan từ phía bệnh nhân dựa trên Bộ câu hỏi Suy tim Kansas City (KCCQ). + Xác định liệu dapagliflozin có vượt trội hơn giả dược trong giảm tỷ lệ tử vong do nguyên nhân tim mạch. + Xác định liệu dapagliflozin có vượt trội hơn giả dược trong giảm tỷ lệ tử vong do mọi nguyên nhân. |
+ Tổng số lần có biến cố suy tim cấp (bao gồm cả lần suy tim cấp đầu tiên và các lần suy tim cấp tái lại sau đó) và số tử vong do nguyên nhân tim mạch.
+ Mức thay đổi của tổng điểm triệu chứng theo bộ câu hỏi KCCQ ở thời điểm 8 tháng so với thời điểm bắt đầu tham gia nghiên cứu.
+ Thời gian tới khi xuất hiện biến cố tử vong do nguyên nhân tim mạch. + Thời gian tới khi xuất hiện biến cố tử vong do bất kỳ nguyên nhân nào. |
| Đánh giá tính an toàn | |
| Đánh giá tính an toàn và khả năng dung nạp của dapagliflozin so với giả dược trên đối tượng bệnh nhân suy tim PSTM thất trái bảo tồn. | Thu thập dữ liệu về các phản ứng bất lợi nghiêm trọng, các phản ứng bất lợi khiến phải ngừng thuốc dapagliflozin, các trường hợp cắt cụt chi, các phản ứng bất lợi dẫn đến cắt cụt chi và các yếu tố nguy cơ tiềm tàng dẫn đến các phản ứng bất lợi khiến phải cắt cụt chi dưới. |
Bảng 3. So sánh nghiên cứu DELIVER với các thử nghiệm lâm sàng khác trong điều trị suy tim PSTM thất trái > 40%
| CHAMRM-Preserved22 | PEP-CHF23 | I-PRESERVE24 | TOPCAT25 | PARAGON-HF17 | EMPEROR-Preserved26 | DELIVER | |
| Bệnh nhân, n | 3023 | 850 | 4128 | 3445 | 4800 | 5988 | 6200 |
| Điều trị | Candesartan với giả dược | Perindopril với giả dược | Irbersartan với giả dược | Spironolacton với giả dược | Sacubitril/ valsartan với valsartan | Empagliflozin với giả dược | Dapagliflozin với giả dược |
| Tiêu chuẩn lựa chọn | NYHA độ II-IV, có nhập viện do bệnh lý tim mạch trước đó | Bệnh nhân được chẩn đoán suy tim tâm trương với triệu chứng/ hội chứng suy tim, ≥2 tiêu chí sau: giãn buồng nhĩ trái/ phì đại thất trái/ suy giảm chức năng đổ đầy thất trái/ rung nhĩ | NYHA độ II-IV + bằng chứng xác thực (dấu hiệu suy tim) + phì đại thất trái hoặc giãn buồng nhĩ trái như bằng chứng xác thực thêm, nhập viện do suy tim trừ trường hợp NYHA độ III-IV | ≥1 triệu chứng suy tim + ≥1 dấu hiệu suy tim, tăng peptid lợi niệu hoặc nhập viện do suy tim | NYHA độ II-IV, tăng NT-proBNP (điều chỉnh nếu bệnh nhân có rung nhĩ và cao hơn nếu bệnh nhân có tiền sử nhập viện do suy tim gần đây) | NYHA độ II-IV, tăng NT-proBNP | NYHA độ II-IV, tăng NT-proBNP (điều chỉnh cho rung nhĩ), bệnh tim cấu trúc (giãn buồng nhĩ trái hoặc phì đại tâm thất trái) |
| LVEF | >40% | >40% | ≥45% | ≥45% | ≥45% | >40% | >40% |
| Tiêu chí chính | Tủ vong tim mạch hoặc nhập viện lần đầu do suy tim | Tử vong do mọi nguyên nhân hoặc nhập viện lần đầu do suy tim | Tử vong do mọi nguyên nhân hoặc nhập viện lần đầu do nguyên nhân tim mạch | Tử vong tim mạch hoặc nhập viện lần đầu do suy tim | Tử vong tim mạch hoặc tổng số lần nhập viện do suy tim (lần đầu và tái phát) | Tử vong tim mạch hoặc nhập viện do suy tim | Tử vong tim mạch hoặc nhập viện do suy tim trên cả dân số chung và phân nhóm bệnh nhân có LVEF <60% |
“Cảm ơn AstraZeneca đã hỗ trợ vì mục đích cập nhật và giáo dục y khoa”
TÀI LIỆU THAM KHẢO
- Zinman B, Wanner C, Lachin JM, Fitchett D, Bluhmki E, Hantel S, Mattheus M, Devins T, Johansen OE, Woerle HJ, Broedl UC, Inzucchi SE; EMPA-REG OUT- COME Investigators. Empagliflozin, cardiovascular outcomes, and mortality in typ 2 diabetes. N EnglJ Med 2015;373:2117–2128.
- Neal B, Perkovic V, Mahaffey KW, de Zeeuw D, Fulcher G, Erondu N, Shaw W, Law G, Desai M, Matthews DR; CANVAS Program Collaborative Group. Canagliflozin and cardiovascular and renal events in typ 2 diabetes. N EnglJ Med 2017;377:644 – 657.
- Wiviott SD, Raz I, Bonaca MP, Mosenzon O, Kato ET, Cahn A, Silverman MG, Zelniker TA, Kuder JF, Murphy SA, Bhatt DL, Leiter LA, McGuire DK, Wilding JPH, Ruff CT, Gause-Nilsson IAM, Fredriksson M, Johansson PA, Langkilde AM, Sabatine MS; DECLARE– TIMI 58 Investigators. Dapagliflozin and cardiovascular outcomes in typ 2 diabetes. N EnglJ Med 2019;380:347 – 357.
- McMurray JJV, Solomon SD, Inzucchi SE, Køber L, Kosiborod MN, Martinez FA, Ponikowski P, Sabatine MS, Anand IS, Beˇlohlávek J, Böhm M, Chiang CE, Chopra VK, de Boer RA, Desai AS, Diez M, Drozdz J, Dukát A, Ge J, Howlett JG, Katova T, Kitakaze M, Ljungman CEA, Merkely B, Nicolau JC, O’Meara E, Petrie MC, Vinh PN, Schou M, Tereshchenko S, Verma S, Held C, DeMets DL, Docherty KF, Jhund PS, Bengtsson O, Sjöstrand M, Langkilde AM; DAPA-HF Trial Committees and Investigators. Dapagliflozin in patients with heart failure and reduced ejection fraction. N EnglJ Med 2019;381:1995 – 2008.
- Packer M, Anker SD, Butler J, Filippatos G, Pocock SJ, Carson P, Januzzi J, Verma S, Tsutsui H, Brueckmann M, Jamal W, Kimura K, Schnee J, Zeller C, Cotton D, Bocchi E, Böhm M, Choi DJ, Chopra V, Chuquiure E, Giannetti N, Janssens S, Zhang J, Gonzalez Juanatey JR, Kaul S, Brunner-La Rocca HP, Merkely B, Nicholls SJ, Perrone S, Pina I, Ponikowski P, Sattar N, Senni M, Seronde MF, Spinar J, Squire I, Taddei S, Wanner C, Zannad F; EMPEROR-Reduced Trial Investigators. Cardiovascular and renal outcomes with empagliflozin in heart failure. N Engl J Med 2020;383:1413– 1424.
- Serenelli M, Böhm M, Inzucchi SE, Køber L, Kosiborod MN, Martinez FA, Ponikowski P, Sabatine MS, Solomon SD, DeMets DL, Bengtsson O, Sjöstrand M, Langkilde AM, Anand IS, Chiang CE, Chopra VK, de Boer RA, Diez M, Dukát A, Ge J, Howlett JG, Katova T, Kitakaze M, Ljungman CEA, Verma S, Docherty KF, Jhund PS, McMurray JJV. Effect of dapagliflozin according to baseline systolic blood pressure in the Dapagliflozin And Prevention (DAPA-HF). Eur Heart J 2020;41:3402 – 3418.
- Nassif ME, Qintar M, Windsor SL, Jermyn R, Shavelle DM, Tang F, Lamba S, Bhatt K, Brush J, Civitello A, Gordon R, Jonsson O, Lampert B, Pelzel J, Kosiborod M. Empagliflozin effects on pulmonary artery pressure in patients with heart failure: results from the EMBRACE-HF trial. Circulation 2021;143:1673 – 1686.
- Neuen BL, Young T, Heerspink HJL, Neal B, Perkovic V, Billot L, Mahaffey KW, Charytan DM, Wheeler DC, Arnott C, Bompoint S, Levin A, Jardine MJ. SGLT2 inhibitors for the prevention of kidney failure in patients with typ 2 diabetes: a systematic review and meta-analysis. Lancet Diabetes Endocrinol 2019;7:845 – 854.
- Santos-Gallego CG, Vargas-Delgado AP, Requena-Ibanez JA, Garcia-Ropero A, Mancini D, Pinney S, Macaluso F, Sartori S, Roque M, Sabatel-Perez F, Rodriguez-Cordero A, Zafar MU, Fergus I, Atallah-Lajam F, Contreras JP, Varley C, Moreno PR, Abascal VM, Lala A, Tamler R, Sanz J, Fuster V, Badimon JJ; EMPA-TROPISM (ATRU-4) Investigators. Randomized trial of empagliflozin in nondiabetic patients with heart failure and reduced ejection fraction. J Am Coll Cardiol 2021;77:243 – 255.
- Lee MMY, Brooksbank KJM, Wetherall K, Mangion K, Roditi G, Campbell RT, Berry C, Chong V, Coyle L, Docherty KF, Dreisbach JG, Labinjoh C, Lang NN, Lennie V, McConnachie A, Murphy CL, Petrie CJ, Petrie JR, Speirits IA, Sourbron S, Welsh P, Woodward R, Radjenovic A, Mark PB, McMurray JJV, Jhund PS, Petrie MC, Sattar N. Effect of empagliflozin on left ventricular volumes in patients with typ 2 diabetes, or prediabetes, and heart failure with reduced ejection fraction (SUGAR-DM-HF). Circulation
- Omar M, Jensen J, Ali M, Frederiksen PH, Kistorp C, Videbæk L, Poulsen MK, Tuxen CD, Möller S, Gustafsson F, Køber L, Schou M, Møller JE. Associations of empagliflozin with left ventricular volumes, mass, and function in patients with heart failure and reduced ejection fraction: a substudy of the Empire HF randomized clinical trial. JAMA Cardiol 2021 Jan 6. https://doi.org/10.1001/ jamacardio.2020.6827 [Epub ahead of print].
- Dewan P, Solomon SD, Jhund PS, Inzucchi SE, Køber L, Kosiborod MN, Martinez FA, Ponikowski P, DeMets DL, Sabatine MS, Bengtsson O, Sjöstrand M, Langkilde AM, Anand IS, Beˇlohlávek J, Chopra VK, Dukát A, Kitakaze M, Merkely B, O’Meara E, Schou M, Vinh PN, McMurray JJV; DAPA-HF Investigators and Committees. Efficacy and safety of sodium-glucose co-transporter 2 inhibition according to left ventricular ejection fraction in DAPA-HF. Eur J Heart Fail 2020;22:1247 – 1258.
- Bhatt DL, Szarek M, Steg PG, Cannon CP, Leiter LA, McGuire DK, Lewis JB, Riddle MC, Voors AA, Metra M, Lund LH, Komajda M, Testani JM, Wilcox CS, Ponikowski P, Lopes RD, Verma S, Lapuerta P, Pitt B; SOLOIST-WHF Trial Investigators. Sotagliflozin in patients with diabetes and recent 2021;384:117– 128.
- Bhatt DL, Szarek M, Pitt B, Cannon CP, Leiter LA, McGuire DK, Lewis JB, Riddle MC, Inzucchi SE, Kosiborod MN, Cherney DZI, Dwyer JP, Scirica BM, Bailey CJ, Díaz R, Ray KK, Udell JA, Lopes RD, Lapuerta P, Steg PG; SCORED Investigators. Sotagliflozin in patients with diabetes and chronic kidney disease. N Engl J Med 2021;384:129 – 139.
- Solomon SD, Claggett B, Lewis EF, Desai A, Anand I, Sweitzer NK, O’Meara E, Shah SJ, McKinlay S, Fleg JL, Sopko G, Pitt B, Pfeffer MA; TOPCAT Investi- gators. Influence of ejection fraction on outcomes and efficacy of spironolac- tone in patients with heart failure with preserved ejection fraction. Eur Heart J 2016;37:455 – 462.
- Lund LH, Claggett B, Liu J, Lam CS, Jhund PS, Rosano GM, Swedberg K, Yusuf S, Granger CB, Pfeffer MA, McMurray JJV, Solomon SD. Heart failure with mid-range ejection fraction in CHARM: characteristics, outcomes and effect of candesartan across the entire ejection fraction spectrum. Eur J Heart Fail 2018;20:1230 – 1239.
- Solomon SD, McMurray JJV, Anand IS, Ge J, Lam CSP, Maggioni AP, Mar- tinez F, Packer M, Pfeffer MA, Pieske B, Redfield MM, Rouleau JL, van Veld- huisen DJ, Zannad F, Zile MR, Desai AS, Claggett B, Jhund PS, Boytsov SA,
- Solomon SD, Vaduganathan M, Claggett B, Packer M, Zile M, Swedberg K, Rouleau J, Pfeffer M, Desai A, Lund LH, Kober L, Anand I, Sweitzer N, Linssen G, Merkely B, Luis Arango J, Vinereanu D, Chen CH, Senni M, Sibulo A, Boytsov S, Shi V, Rizkala A, Lefkowitz M, McMurray JJV. Sacubitril/valsartan across the spectrum of ejection fraction in heart failure. Circulation 2020;141:352 – 361.
- Hicks KA, Mahaffey KW, Mehran R, Nissen SE, Wiviott SD, Dunn B, Solomon SD, Marler JR, Teerlink JR, Farb A, Morrow DA, Targum SL, Sila CA, Hai MTT, Jaff MR, Joffe HV, Cutlip DE, Desai AS, Lewis EF, Gibson CM, Landray MJ, Lincoff AM, White CJ, Brooks SS, Rosenfield K, Domanski MJ, Lansky AJ, McMurray JJV, Tcheng JE, Steinhubl SR, Burton P, Mauri L, O’Connor CM, Pfeffer MA, Hung HMJ, Stockbridge NL, Chaitman BR, Temple RJ; Standardized Data Collection for Cardiovascular Trials Initiative (SCTI). 2017 cardiovascular and stroke endpoint definitions for clinical
- Shim CY, Seo J, Cho I, Lee CJ, Cho IJ, Lhagvasuren P, Kang SM, Ha JW, Han G, Jang Y, Hong GR. Randomized, controlled trial to evaluate the effect of dapagliflozin on left ventricular diastolic function in patients with typ 2 diabetes mellitus: the IDDIA trial. Circulation 2021;143:510–512.
- Díaz-Rodríguez E, Agra RM, Fernández ÁL, Adrio B, García-Caballero T, González-Juanatey JR, Eiras S. Effects of dapagliflozin on human epicardial adipose tissue: modulation of insulin resistance, inflammatory chemokine production, and differentiation ability. Cardiovasc Res 2018;114:336 – 346.
- Yusuf S, Pfeffer MA, Swedberg K, Granger CB, Held P, McMurray JJ, Michelson EL, Olofsson B, Ostergren J; CHARM Investigators and Committees. Effects of candesartan in patients with chronic heart failure and preserved left-ventricular ejection fraction: the CHARM-Preserved Trial. Lancet 2003;362:777 – 781.
- Cleland JG, Tendera M, Adamus J, Freemantle N, Polonski L, Taylor J; PEP-CHF Investigators. The perindopril in Elderly People with Chronic Heart Failure (PEP-CHF) study. Eur Heart J 2006;27:2338 – 2345.
- Massie BM, Carson PE, McMurray JJ, Komajda M, McKelvie R, Zile MR, Ander- son S, Donovan M, Iverson E, Staiger C, Ptaszynska A; I-PRESERVE Investigators. Irbesartan in patients with heart failure and preserved ejection fraction. N Engl J Med 2008;359:2456 – 2467.
- Pitt B, Pfeffer MA, Assmann SF, Boineau R, Anand IS, Claggett B, Clausell N, Desai AS, Diaz R, Fleg JL, Gordeev I, Harty B, Heitner JF, Kenwood CT, Lewis EF, O’Meara E, Probstfield JL, Shaburishvili T, Shah SJ, Solomon SD, Sweitzer NK, Yang S, McKinlay SM; TOPCAT Investigators. Spironolactone for heart failure with preserved ejection fraction. N EnglJ Med 2014;370:1383 – 1392.
- Anker SD, Butler J, Filippatos G, Shahzeb Khan M, Ferreira JP, Bocchi E, Böhm M, Brunner-La Rocca HP, Choi DJ, Chopra V, Chuquiure E, Giannetti N, Gomez-Mesa JE, Janssens S, Januzzi JL, Gonzalez-Juanatey JR, Merkely B, Nicholls SJ, Perrone SV, Piña IL, Ponikowski P, Senni M, Seronde MF, Sim D, Spinar J, Squire I, Taddei S, Tsutsui H, Verma S, Vinereanu D, Zhang J, Jamal W, Schnaidt S, Schnee JM, Brueckmann M, Pocock SJ, Zannad F, Packer M; EMPEROR-Preserved Trial Committees and Investigators. Baseline characteristics of patients with heart failure with preserved ejection fraction in the EMPEROR-Preserved trial. Eur J Heart Fail 2020;22:2383 – 2392.
- Skali H, Dwyer EM, Goldstein R, Haigney M, Krone R, Kukin M, Lichstein E, McNitt S, Moss AJ, Pfeffer MA, Solomon SD. Prognosis and response to therapy of first inpatient and outpatient heart failure event in a heart failure clinical trial: MADIT-CRT. Eur J Heart Fail 2014;16:560 – 565.
- Okumura N, Jhund PS, Gong J, Lefkowitz MP, Rizkala AR, Rouleau JL, Shi VC, Swedberg K, Zile MR, Solomon SD, Packer M, McMurray JJ; PARADIGM-HF Investigators and Committees. Importance of clinical worsening of heart failure treated in the outpatient setting: evidence from the Prospective Comparison of ARNI with ACEI to Determine Impact on Global Mortality and Morbidity in Heart Failure trial (PARADIGM-HF). Circulation 2016;133:2254 – 2262.
- Heerspink HJL, Stefánsson BV, Correa-Rotter R, Chertow GM, Greene T, Hou FF, Mann JFE, McMurray JJV, Lindberg M, Rossing P, Sjöström CD, Toto RD, Langkilde AM, Wheeler DC; DAPA-CKD Trial Committees and Inves- tigators. Dapagliflozin in patients with chronic kidney disease. N Engl J Med 2020;383:1436 – 1446.
- Rogers JK, Pocock SJ, McMurray JJ, Granger CB, Michelson EL, Östergren J, Pfeffer MA, Solomon SD, Swedberg K, Yusuf S. Analysing recurrent hospital- izations in heart failure: a review of statistical methodology, with application to CHARM-Preserved. Eur J Heart Fail 2014;16:33 – 40.
- Ponikowski P, Kirwan BA, Anker SD, McDonagh T, Dorobantu M, Drozdz J, Fabien V, Filippatos G, Göhring UM, Keren A, Khintibidze I, Kragten H, Martinez FA, Metra M, Milicic D, Nicolau JC, Ohlsson M, Parkhomenko A, Pascual-Figal DA, Ruschitzka F, Sim D, Skouri H, van der Meer P, Lewis BS, Comin-Colet J, von Haehling S, Cohen-Solal A, Danchin N, Doehner W, Dargie HJ, Motro M, Butler J, Friede T, Jensen KH, Pocock S, Jankowska EA; AFFIRM-AHF investi- gators. Ferric carboxymaltose for iron deficiency at discharge after acute heart failure: a multicentre, double-blind, randomised, controlled trial. Lancet 2020;396: 1895 – 1904.
- Anker SD, Butler J, Filippatos GS, Jamal W, Salsali A, Schnee J, Kimura K, Zeller C, George J, Brueckmann M, Zannad F, Packer M; EMPEROR-Preserved Trial Committees and Investigators. Evaluation of the effects of sodium-glucose co-transporter 2 inhibition with empagliflozin on morbidity and mortality in patients with chronic heart failure and a preserved ejection fraction: rationale for and design of the EMPEROR-Preserved trial. Eur J Heart Fail 2019;21: 1279 – 1287.
- Tromp J, Ponikowski P, Salsali A, Angermann CE, Biegus J, Blatchford J, Collins SP, Ferreira JP, Grauer C, Kosiborod M, Nassif ME, Psotka MA, Brueckmann M, Teerlink JR, Voors AA. Sodium-glucose co-transporter 2 inhibition in patients hospitalized for acute decompensated heart failure: rationale for and design of the EMPULSE trial. Eur J Heart Fail 2021;23: 826 – 834.







