ThS.BS. LÊ THỊ LAN HƯƠNG,
BS. CKI. TRẦN CÔNG TRÌNH,
PGS.TS.BS. PHẠM NGUYỄN VINH1
Bệnh viện đa khoa Tâm Anh Thành phố Hồ Chí Minh
(…)
Cùng với sự phát triển về các phương tiện kỹ thuật, cộng hưởng từ với hình ảnh động (cine) có thể dễ dàng xác định sa van cũng như định lượng chính xác mức độ hở van, và là công cụ hình ảnh không xâm lấn duy nhất đánh giá bản chất xơ hóa cơ tim dựa trên bắt thuốc tương phản muộn (LGE). Nhiều nghiên cứu đã chứng minh có mối tương quan giữa tổn thương bắt thuốc trên LGE dạng giữa thành (mid-wall) của cơ trụ hoặc dạng đốm (patchy) ở vùng đáy thành dưới với tình trạng loạn nhịp phức tạp [12, 13]. Tùy theo thiết kế nghiên cứu, mà tỉ lệ LGE ở bệnh nhân sa van hai lá dao động từ 28 – 93% [12, 14, 15]. Năm 2021, trong một phân tích gộp của tác giả Oliveri ghi nhận tổn thương trên hình LGE làm tăng nguy cơ loạn nhịp lên 4.38 lần so với nhóm không kèm LGE (p = 0.001). Tổn thương LGE tương quan với tổn thương xơ sẹo trên mô học và liên quan với nguồn gốc gây loạn nhịp thất khi thăm dò điện sinh lý [16]. Năm 2018, nghiên cứu của tác giả Kitkungvan trên 356 bệnh nhân chia làm hai nhóm: 177 bệnh nhân sa van hai lá và 179 bệnh ở nhóm chứng, theo dõi trung bình trong 3,7 năm. Kết quả ghi nhận tần suất xơ hóa cơ tim ở nhóm sa van hai lá nhiền gấp 6 lần nhóm chứng, với giá trị lần lượt là 36,7% và 6.7% (p < 0.001). Sau khi hiệu chỉnh với các yếu tố gây nhiễu như tái cấu trúc thất trái, mức độ hở van, LGE làm tăng nguy cơ loạn nhịp lên 6.8 lần so với nhóm chứng và khác biệt này cũng có ý nghĩa thống kê (OR = 6.82, p < 0.001).
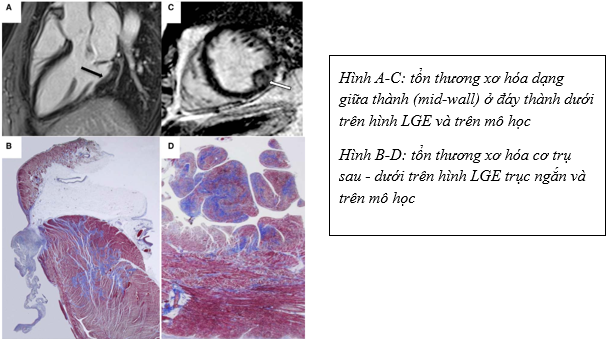
Hình 7. Tổn thương xơ hóa cơ tim trên cộng hưởng từ tim và mô học [17]
Ngoài ra cộng hưởng từ còn có thể đánh giá xơ hóa lan tỏa cơ tim dựa trên các giá trị trên bản đồ T1, cũng được chứng minh làm tăng nguy cơ loạn nhịp ở bệnh nhân sa van hai lá. Năm 2017, tác giả An Bui và cộng sự thực hiện nghiên cứu trên 41 bệnh nhân sa van hai lá được chụp cộng hưởng từ tim so sánh với 30 trường hợp ở nhóm chứng. Nghiên cứu theo dõi trong 5 năm từ 2006 đến 2011, đánh giá xơ hóa trên giá trị T1 sau tiêm thuốc tương phản tại vùng vách liên thất dựa trên chuỗi xung T1 Look – Locker. Kết quả ghi nhận như sau: xơ hóa cơ tim lan tỏa (dựa trên thời gian thư giãn cơ tim sau tiêm thuốc) làm tăng nguy cơ loạn nhịp thất nguy hiểm ở bệnh nhân sa van hai lá[18].
Tóm lại, chúng tôi xin tóm tắt các đặc điểm hình ảnh và các dấu hiệu nguy cơ cao trên siêu âm và cộng hưởng từ của sa van hai lá gây loạn nhịp như ở Bảng 2 + 3:
Bảng 2. Một số đặc điểm hình ảnh trên siêu âm và cộng hưởng từ của phức hợp sa van hai lá gây loạn nhịp bao gồm
| – Sa cả hai lá van
– Mức độ hở van hai lá trung bình trở lên – Tăng vận tốc đỉnh tâm thu ở thành bên van hai lá (Dấu Picklehaube) – Dấu curling – Mất liên tục vòng van hai lá – cơ tim – Xơ hóa cơ tim với tổn thương bắt thuốc muộn (LGE) |
Bảng 3. Các dấu hiệu nguy cơ cao loạn nhịp ở bệnh nhân sa van hai lá [2]
| – Sóng T âm ở các chuyển đạo thành dưới trên điện tâm đồ bề mặt
– Ngoại tâm thu thất đa dạng – Mất liên tục vòng van hai lá – cơ tim – Thừa mô van hai lá – Dãn nhĩ trái – Chức năng tâm thu thất trái LVEF < 50% – Tổn thương bắt thuốc Gadolinium muộn (LGE) trên cộng hưởng từ tim |
Minh họa trường hợp lâm sàng:
Trường hợp lâm sàng 1: Bệnh nhân nữ 32 tuổi, nghề nghiệp nội trợ. Bệnh nhân (BN) không ghi nhận tiền căn bệnh lý tim mạch, không tiền căn đột tử trong gia đình. BN than hồi hộp kéo dài khoảng 4 – 5 ngày trước khi đến khám. Khám lâm sàng nghe âm thổi tâm thu 2/6 ở mỏm, các cơ quan khác không ghi nhận bất thường. Điện tim ghi nhận sóng T âm ở các chuyển đạo thành dưới DII-DIII-aVF và ngoại tâm thu thất đa ổ. (Hình 8)
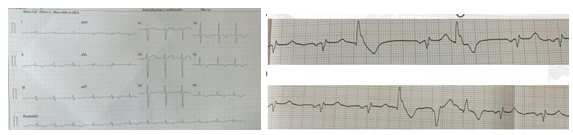
Hình 8
Siêu âm tim ghi nhận như sau (Hình 9):
Hình 9
Như trên hình, chúng tôi ghi nhận đây là trường hợp MAD điển hình với khoảng cách d # 15mm, với dấu hiệu Picklehaube và dấu curling. Các đặc điểm này đều gia tăng nguy cơ cao dẫn đến loạn nhịp. Do đó, bệnh nhân được gắn Holter ECG 24 giờ để theo dõi và tư vấn chụp MRI tim. Tuy nhiên, rất tiếc bệnh nhân từ chối MRI.
Trường hợp lâm sàng 2: BN nữ, 17 tuổi, tiền căn ngưng tim do rung thất được cứu sống. Kết quả ECG ghi nhận loạn nhịp nguy hiểm với ngoại tâm thu thất đa ổ và cơn nhịp nhanh thất ngắn. (Hình 10)
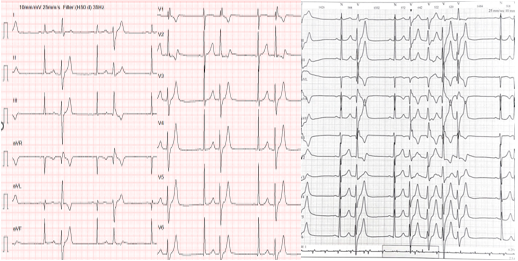
Hình 10
Siêu âm tim ghi nhận sa toàn bộ A2 lá trước van hai lá. (Hình 11)
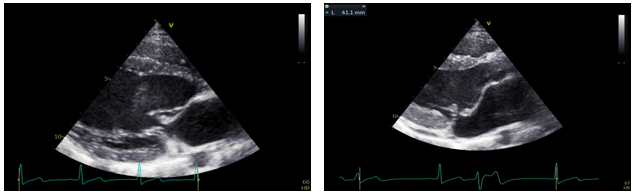
Hình 11
Bệnh nhân được chụp cộng hưởng từ để đánh giá tổn thương cơ tim. Kết quả ghi nhận xơ hóa cơ trụ trước bên và cơ trụ sau dưới, xơ hóa. (Hình 12)
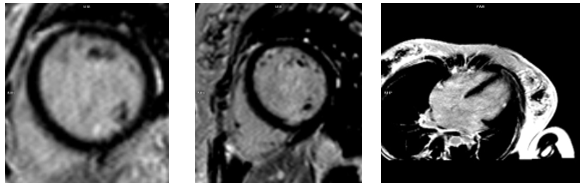
Hình 12
Trường hợp lâm sàng 3:
BN nam, 62 tuổi, khám vì hồi hộp, ECG ghi nhận ngoại tâm thu thất
Holter ECG 24 giờ ghi nhận: nhịp xoang tần số từ 47 – 112 lần/ phút, ngoại tâm thu thất đa dạng và ghi nhận có 5 cơn nhanh thất ngắn, cơn dài nhất kéo dài 1.7 giây, tần số 111 lần/phút. (Hình 13)

Hình 13
Siêu âm tim ghi nhận hở van hai lá trung bình với ERO : 0.29cm2, thể tích dòng hở 68ml (Hình 14)

Hình 14
Bệnh nhân được chụp MSCT mạch vành: không ghi nhận hẹp các nhánh mạch vành (Hình 15)
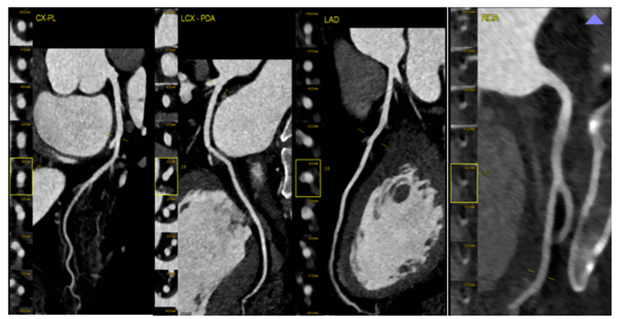
Hình 15
Bệnh nhân được chỉ định MRI tim để đánh giá bệnh lý cơ tim. Kết quả ghi nhận: tăng thể tích thất trái với LVEDVi = 97ml/m2, giảm động đồng đều vùng giữa – mỏm vách, thành dưới, thành bên. Phân suất tống máu thất trái giảm với LVEF 44%. Ghi nhận mất liên tục vòng van hai lá – cơ thất với khoảng cách d # 7mm, dấu curling kèm tổn thương LGE xơ hóa cơ tim vùng đáy thành dưới – bên. (Hình 16)
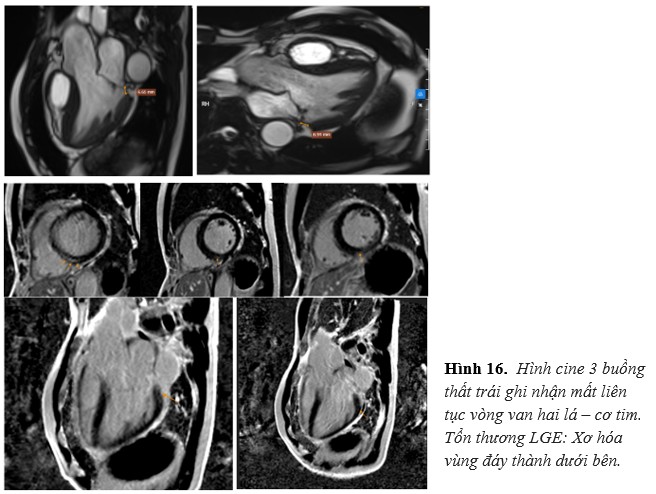
Kết luận:
Sa van hai lá là tình huống thường gặp trong thực hành lâm sàng. Cho đến hiện tại, các nghiên cứu và các bằng chứng lâm sàng cho thấy vẫn còn nhiêu tranh cãi về mức độ hở van, tổn thương loạn nhịp và tiên lượng. Các nghiên cứu vẫn đang tiếp tục để làm rõ hơn cũng như đưa ra các hướng dẫn cụ thể cho thực hành lâm sàng. Phức hợp loạn nhịp do van hai lá, chiếm tỉ lệ thấp, nhưng gia tăng các biến cố lâm sàng bất lợi nếu không kịp thời phát hiện và điều trị. Đặc biệt, nguy cơ tăng cao trên các đối tương sa van kèm mất liên tục vòng van hai lá – cơ thất kèm/ không kèm tổn thương cơ chất.
TÀI LIỆU THAM KHẢO:
- Nalliah, C.J., et al., Mitral valve prolapse and sudden cardiac death: a systematic review and meta-analysis. 2019. 105(2): p. 144-151.
- Sabbag, A., et al., EHRA expert consensus statement on arrhythmic mitral valve prolapse and mitral annular disjunction complex in collaboration with the ESC Council on valvular heart disease and the European Association of Cardiovascular Imaging endorsed cby the Heart Rhythm Society, by the Asia Pacific Heart Rhythm Society, and by the Latin American Heart Rhythm Society. 2022. 24(12): p. 1981-2003.
- Vahanian, A., et al., 2021 ESC/EACTS Guidelines for the management of valvular heart disease: developed by the Task Force for the management of valvular heart disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). 2022. 43(7): p. 561-632.
- Essayagh, B., et al., Presentation and outcome of arrhythmic mitral valve prolapse. 2020. 76(6): p. 637-649.
- Miller, M.A., et al., Arrhythmic mitral valve prolapse: JACC review topic of the week. 2018. 72(23 Part A): p. 2904-2914.
- Hutchins, G.M., G.W. Moore, and D.K.J.N.E.J.o.M. Skoog, The association of floppy mitral valve with disjunction of the mitral annulus fibrosus. 1986. 314(9): p. 535-540.
- Dejgaard, L.A., et al., The mitral annulus disjunction arrhythmic syndrome. 2018. 72(14): p. 1600-1609.
- Perazzolo Marra, M., et al., Morphofunctional abnormalities of mitral annulus and arrhythmic mitral valve prolapse. 2016. 9(8): p. e005030.
- Lee, A.P.-W., et al., Functional implication of mitral annular disjunction in mitral valve prolapse: a quantitative dynamic 3D echocardiographic study. 2017. 10(12): p. 1424-1433.
- Konda, T., et al., The analysis of mitral annular disjunction detected by echocardiography and comparison with previously reported pathological data. 2017. 15: p. 176-185.
- Muthukumar, L., et al., The Pickelhaube sign: novel echocardiographic risk marker for malignant mitral valve prolapse syndrome. 2017. 10(9): p. 1078-1080.
- Kitkungvan, D., et al., Myocardial fibrosis in patients with primary mitral regurgitation with and without prolapse. 2018. 72(8): p. 823-834.
- Han, Y., et al., Cardiovascular magnetic resonance characterization of mitral valve prolapse. 2008. 1(3): p. 294-303.
- Basso, C., et al., Arrhythmic mitral valve prolapse and sudden cardiac death. 2015. 132(7): p. 556-566.
- Constant Dit Beaufils, A.-L., et al., Replacement myocardial fibrosis in patients with mitral valve prolapse: relation to mitral regurgitation, ventricular remodeling, and arrhythmia. 2021. 143(18): p. 1763-1774.
- Oliveri, F., et al., Arrhythmic mitral valve prolapse: Diagnostic parameters for high‐risk patients: A systematic review and meta‐analysis. 2021. 44(10): p. 1746-1755.
- Basso, C., et al., Mitral Valve Prolapse, Ventricular Arrhythmias, and Sudden Death. 2019. 140(11): p. 952-964.
- Bui, A.H., et al., Diffuse myocardial fibrosis in patients with mitral valve prolapse and ventricular arrhythmia. 2017. 103(3): p. 204-209.







