ThS.BS. TRẦN CÔNG DUY1
NGUYỄN CHÂU TUẤN2
1Giảng viên Bộ môn Nội Tổng Quát
2Bác sĩ nội trú Bộ môn Lão Khoa
Đại học Y Dược TP. Hồ Chí Minh
- DỊCH TỄ HỌC
Bệnh cơ tim dãn nở (BCTDN) đặc trưng bởi sự dãn lớn của buồng thất và rối loạn chức năng tâm thu khi không có các tình trạng bất thường về tải hoặc bệnh mạch vành có ý nghĩa [69]. Đây là một trong những nguyên nhân hàng đầu của suy tim có phân suất tống máu giảm (HFrEF) trên toàn thế giới [61]. Tiếp cận chẩn đoán BCTDN được trình bày qua lưu đồ ở hình 1. Tỉ lệ hiện mắc của BCTDN được ghi nhận ở Châu Âu và Bắc Mỹ là khoảng 36 ca trên 100.000 người, và tỉ lệ mới mắc hằng năm trong khoảng từ 5 đến 7,9 ca trên 100.000 người [17],[92]. Tỉ lệ hiện mắc của BCTDN thấp hơn rõ rệt ở Đông Á (14 ca trên 100.000 người ở Nhật Bản) [60], và có thể cao hơn ở Châu Phi và Châu Mỹ Latinh khi so sánh với Châu Âu [9], [26].
Việc xác định tỉ lệ mới mắc của suy tim do BCTDN là một thách thức vì sự khác biệt trong việc chọn lựa bệnh nhân và nguyên nhân suy tim được báo cáo không đầy đủ trong nhiều thử nghiệm lâm sàng và các nghiên cứu quan sát. Một nghiên cứu gần đây cho thấy ở những bệnh nhân mới khởi phát BCTDN (< 6 tháng), 32% nhập viện do suy tim và 66% có ít nhất một lần nhập viện do suy tim trước ghi được đưa vào nghiên cứu [51]. Tương tự, trong một nghiên cứu đoàn hệ với 881 bệnh nhân có BCTDN, suy tim là biểu hiện lâm sàng thường gặp với tần suất ở nữ cao hơn so với nam (64% với 54%) [39]. Khi so sánh với nam, nữ thường nhập viện với tình trạng suy tim nặng hơn được thể hiện qua tỉ lệ cao hơn theo phân độ triệu chứng NYHA III – IV (25% và 16%) và có tần suất cao hơn của block nhánh trái (LBBB) tại thời điểm chẩn đoán (43% với 23%) [39]. Trong một nghiên cứu khác, chủng tộc Da Đen có liên quan với tuổi trẻ hơn và triệu chứng suy tim nặng hơn tại thời điểm chẩn đoán so với chủng tộc Da Trắng [56]. Hơn nữa, trong một đoàn hệ với 3.078 bệnh nhân nhập viện do suy tim ở Đan Mạch và Thuỵ Điển, những người có BCTDN thường trẻ hơn khoảng 10 năm (tuổi trung bình 64 tuổi), và có triệu chứng nặng nề hơn và có phân suất tống máu thất trái thấp hơn (LVEF trung bình 24%) khi so với những bệnh nhân suy tim khác [68].
Tỉ lệ hiện mắc của BCTDN có sự dao động lớn ở những bệnh nhân suy tim. Trong thử nghiệm về suy tim phân suất tống máu giảm (HFrEF), BCTDN được ghi nhận khoảng 12 – 35% bệnh nhân [1], [18], [105]. Trong các nghiên cứu quan sát ở bệnh nhân suy tim, tỉ lệ hiện mắc của BCTDN trong khoảng 8% và 47% [4], [68], [91]. Trong một nghiên cứu đoàn hệ với 156.013 bệnh nhân nhập viện do suy tim ở Hoa Kỳ, BCTDN là nguyên nhân của 31% trường hợp [84]. Những ước tính này thường là gần đúng vì chẩn đoán chính xác của BCTDN có thể thiếu ở nhiều bệnh nhân không được đánh giá chẩn đoán đầy đủ.
Suy tim tiến triển ở BCTDN chiếm > 40% bệnh nhân có hỗ trợ tuần hoàn cơ học dài hạn, một biện pháp bắc cầu để ghép tim hoặc là điều trị cuối cùng [78], [102]. BCTDN là chỉ định thường gặp nhất cho ghép tim ở cả dân số người lớn và trẻ em có suy tim tiến triển và là chỉ định thường gặp đứng hàng thứ ba cho ghép tim và phổi ở người trưởng thành [79], [103], [104]. Tỉ lệ bệnh nhân được ghép tim do BCTDN so với những nguyên nhân gây suy tim khác đã tăng trong những năm gần đây. Những người trẻ (18 – 39 tuổi) và trung niên (40 – 59 tuổi) có lần lượt 64% và 51% các trường hợp ghép tim do BCTDN [104]. Sau 60 tuổi, BCTDN là chỉ định thường gặp đứng hàng thứ hai cho ghép tim sau nguyên nhân bệnh tim thiếu máu cục bộ, và chiếm 39% các trường hợp ghép tim. Sau ghép tim, bệnh nhân BCTDN nhìn chung có tiên lượng ngắn hạn và dài hạn tốt, với thời gian sống trung bình là 12,2 năm [104].
- SINH LÝ BỆNH
Sinh lý bệnh của suy tim do BCTDN bao gồm các nguyên nhân do gen, cũng như tổn thương trực tiếp cơ tim do các tác nhân nhiễm trùng hoặc độc chất, các bất thường về nội tiết và chuyển hoá, bệnh cơ tim chu sinh và qua trung gian miễn dịch [69] (Hình 2). Các thay đổi hình thái học quan trọng trong sinh lý bệnh của suy tim trong BCTDN được tóm tắt trong hình 3.
Tiền căn gia đình có thể phát hiện trong 30 – 50% trường hợp [75] và yếu tố gen được xác định trong 40% bệnh nhân BCTDN [46], [69]. Tuy nhiên, tỉ lệ này có thể bị ước lượng thấp do sự biến thiên độ thấm của bệnh và biểu hiện lâm sàng. Cho đến hiện tại, hơn 60 gen mã hóa cho các protein sacromere, cơ xương, bao nhân, cơ tương, các kênh ion và/hoặc các phân tử gắn kết liên bào có liên quan bệnh sinh của BCTDN [45], [46]. Gen phổ biến nhất là đột biến titin liên quan bệnh sinh trong lần lượt khoảng 13% và 25% các trường hợp BCTDN không có tính gia đình và có tính gia đình [41], [77]. Hầu hết các đột biến di truyền kiểu nhiễm sắc thể trội, nhưng cũng có thể liên kết với nhiễm sắc thể X, di truyền gen lặn hoặc truyền qua mẹ (như các rối loạn ty thể). Các xét nghiệm về gen thường quy được thực hiện với tỉ lệ tương đối thấp (30 – 35%) và, cho đến nay có ít ứng dụng cho điều trị suy tim trong BCTDN. Các ngoại lệ là các đột biến gen lamin A/C và phospholamban gây nguy cơ cao loạn nhịp và đột tử do tim [93], [94], có thể làm giảm ngưỡng đặt máy khử rung chuyển nhịp [72]. Loạn dưỡng cơ Duchenne là một rối loạn liên kết nhiễm sắc thể X gây ra do thiếu protein cơ tương, dystrophin, trong cơ xương và cơ tim, làm ảnh hưởng đến mối gắn kết giữa khung xương tế bào và chất nền ngoại bào dẫn đến teo cơ tiến triển, thoái hoá tế bào cơ tim và sự thay thế bởi mô xơ [29]. Xơ hoá cơ tim liên quan đến giảm chức năng tâm thu thất trái và có khuynh hướng làm tăng các biến cố bất lợi [85]. Suy tim là một trong những nguyên nhân chính gây tử vong ở những bệnh nhân loạn dưỡng cơ Duchenne; điều trị với perindopril và eplerenone được chứng minh có khả năng làm chậm tiến trình bệnh cơ tim [21], [73].
Kích hoạt (tự) miễn dịch trong cơ tim sau nhiễm virus có thể đóng vai trò quan trọng trong việc tiến triển của suy tim do BCTDN [15]. Dựa vào các nghiên cứu trên động vật nhỏ, mô hình ba pha của bệnh cơ tim do viêm đã được đề xuất. Khởi đầu, các ảnh hưởng do độc tế bào trực tiếp có thể xảy ra trong vòng vài ngày sau khi nhiễm virus (như enterovirus), dẫn đến hoại tử cơ tim và kích hoạt hệ miễn dịch bẩm sinh (như các tế bào giết tự nhiên và đại thực bào) và miễn dịch mắc phải (như lympho T). Sau đó, các phản ứng (tự) miễn dịch có thể xảy ra trong pha bán cấp, kéo dài đến vài tháng. Sự tăng hoạt động của tế bào lympho T đã được miêu tả, nhắm đến cả virus và các thành phần của tế bào (protein shock nhiệt, protein ty thể, myosin tim, v.v.) bằng cơ chế bắt chước phân tử (molecular mimicry) [52]. Bên cạnh tổn thương cơ tim do viêm, tự kháng thể kháng lại chất mang ADP/ATP có thể góp phần gây rối loạn chức năng thất trái [83]. Gần đây, quá trình viêm cơ tim được đặc trưng bởi sự hiện diện của lympho T gây độc tế bào có perforin dương đã được cho thấy có thể tiên lượng sự suy giảm chức năng thất trái qua một quá trình theo dõi dài hạn [24]. Những quá trình bệnh học này có thể gây mất tế bào cơ tim đáng kể và khởi phát quá trình tái cấu trúc thất và thay thế bằng mô xơ, thậm chí dẫn đến sự hình thành BCTDN và suy tim. Vào cùng thời điểm, hệ gen virus được phát hiện trong mô tim không có BCTDN [63], điều này nhấn mạnh vai trò quan trọng của đáp ứng miễn dịch ký chủ. Tăng tính nhạy cảm trong việc hình thành BCTDN có liên kết với việc điều hoà lên gen matrix metalloproteinase-9 và procollagen type-1 trong dưỡng bào, điều này dẫn đến quá trình viêm và hoại tử cơ tim, sau đó là sự thay thế bởi mô xơ [49].
Các nguyên nhân nhiễm trùng khác của BCTDN có sự phân bố theo vùng địa lý. Các ví dụ đáng chú ý nhất bao gồm nhiễm virus gây suy giảm miễn dịch ở người (HIV) ở Châu Phi cận Sahara, và bệnh Chagas (nhiễm Trypanosoma cruzi) ở Nam Mỹ [57]. Sinh bệnh học của BCTDN và suy tim do HIV vẫn chưa được hiểu biết đầy đủ, trong khi tổn thương cơ tim trong bệnh Chagas là hậu quả của việc xơ hoá lan toả do nhiễm ký sinh trùng, tổn thương vi tuần hoàn và cơ chế tự miễn [81].
BCTDN có thể xảy ra trong các bệnh hệ thống qua trung gian tự miễn (systemic
immune-mediated diseases) bao gồm các rối loạn tự viêm và tự miễn [14]. Trong các bệnh hệ thống qua trung gian tự miễn, các tự kháng thể có thể thúc đẩy quá trình viêm qua việc hình thành các phức hợp miễn dịch hoặc có thể gây ra trực tiếp tổn thương cơ tim, cũng có thể qua trung gian bởi miễn dịch tế bào lệch hướng, hậu quả là gây mất tế bào cơ tim, xơ hoá và hình thành nên BCTDN. Tính nhạy cảm về gen có thể đóng vai trò quan trọng trong tiến triển của suy tim sau viêm cơ tim tự miễn, vì các bằng chứng cho thấy tự kháng thể đặc hiệu theo cơ quan có thể dự đoán được sự hình thành BCTDN ở những n gười thân không triệu chứng của bệnh nhân được chẩn đoán BCTDN [12], [13].
Sinh bệnh học của bệnh cơ tim chu sinh vẫn chưa được làm sáng tỏ nhưng một số yếu tố góp phần đã được tìm ra [8],[87]. Các stress oxy hoá quá nhiều trong tam cá nguyệt cuối của thai kỳ, có thể gây ra do các cơ chế bảo vệ không thích hợp, có thể thúc đẩy hoạt hoá cathepsin D và hình thành các đoạn prolactin gây độc trực tiếp lên tế bào cơ tim [43]. Quá trình viêm cơ tim, nhiễm virus, mất cân bằng yếu tố sinh mạch trong thai kỳ và các đáp ứng tự miễn dịch đặc trưng bởi hiệu giá kháng thể cao chống lại các protein cơ tim cũng có liên quan [33], [67], [76], [97]. Tính nhạy cảm với bệnh cơ tim chu sinh cao hơn rõ rệt ở những người mang đột biến gen sarcomere gây BCTDN, điều này hỗ trợ cho khái niệm về khuynh hướng di truyền ở một số bệnh nhân [96].
Độc tính trực tiếp trên tim kèm với sự góp phần của hoạt hoá hệ thần kinh thể dịch, thay đổi cân bằng canxi, và các stress oxy hoá có liên quan với sự tiến triển của suy tim trong bối cảnh hoá trị (như anthracyclines, trastuzumab,…), nghiện rượu mạn (bệnh cơ tim do rượu), và việc tiếp xúc với một số độc chất và thuốc nhất định [5], [25], [28], [32], [66], [106] (Hình 2). Độc tính trên tim là một biến chứng khá thường gặp trong điều trị ung thư được biểu hiện với rối loạn chức năng thất trái và suy tim (thường là HFrEF) [106]. Những yếu tố nguy cơ cho độc tính trên tim bao gồm có tiền căn suy tim hoặc rối loạn chức năng thất trái (bao gồm có bệnh cơ tim phì đại/BCTDN), bệnh mạch vành, tăng huyết áp hoặc bệnh van tim, cũng như việc tiếp xúc trước đó với các thuốc có độc tính trên tim (như anthracyclines) hoặc xạ trị. Tuỳ thuộc vào tác nhân gây độc trên tim hoặc độ nhạy cảm của bệnh nhân, độc tính trên tim có thể xuất hiện sớm sau tiếp xúc, hoặc có thể xuất hiện rõ trên lâm sàng nhiều năm sau điều trị (BCTDN muộn), là hậu quả của tổn thương cơ tim tiến triển (như 23% bệnh nhân điều trị với anthracycline xuất hiện độc tính trên tim muộn sau khoảng thời gian theo dõi trung bình 7 năm) [88]. Việc dự đoán kết cục dài hạn ở những bệnh nhân ung thư thường bị cản trở bởi thực tế nhiều bệnh nhân điều trị với nhiều loại thuốc và xạ trị, các điều trị này đều có khả năng ảnh hưởng độc tính trên tim. Một điều quan trọng là việc đảo ngược rối loạn chức năng thất trái và phục hồi suy tim có thể xảy ra nếu ngưng kịp thời các tác nhân và điều trị suy tim thích hợp.
- DIỄN TIẾN TỰ NHIÊN VÀ KẾT CỤC
Diễn tiến tự nhiên của suy tim do BCTDN được đặc trưng qua ba con đường tách biệt bao gồm: (i) sự phục hồi cấu trúc và chức năng sau suy tim; (ii) giảm triệu chứng suy tim và cải thiện/ổn định chức năng tâm thu thất trái; và (iii) tiến triển đến suy tim nặng và ghép tim/tử vong [99]. Sự phục hồi hoàn toàn về cấu trúc và chức năng không thường gặp và có thể xảy ra nếu một biến cố cấp tính không gây mất cơ tim quá nhiều, cho phép sự bình thường hoá chức năng thất trái một khi biến cố được hồi phục. Diễn tiến lâm sàng của suy tim trong BCTDN có thể đa dạng, nhưng việc phục hồi chức năng và đảo ngược quá trình tái cấu trúc thất trái có thể đạt được, đặc biệt với việc điều trị theo hướng dẫn (guideline-directed medical therapy) [44],[101].
Các dữ liệu quan sát trước khi có các hướng dẫn điều trị suy tim cho thấy sự cải thiện về lâm sàng có ý nghĩa xảy ra ở ít hơn 20% bệnh nhân suy tim có BCTDN, trong khi 77% tử vong trong vòng 2 năm sau chẩn đoán, hầu hết là do suy bơm tiến triển [36]. Đột tử do tim và thuyên tắc hệ thống, hầu hết do rung nhĩ, chiếm phần còn lại tử vong do tim mạch [36].
Trong vòng ba thập kỉ qua, kết cục đã được cải thiện với các tiến bộ trong điều trị suy tim. Trong một nghiên cứu đoàn hệ ở những bệnh nhân BCTDN ở Nhật Bản được ghi nhận từ năm 1982 đến năm 1989, tỉ lệ sống còn 5 năm và 10 năm lần lượt là 61% và 35% [54]. Ở những bệnh nhân được đánh giá từ năm 1990 đến 2002, tỉ lệ sống còn 5 năm và 10 năm đã tăng, lần lượt là 81% và 65% [54]. Tiên lượng khả quan hơn được ghi nhận với điều trị nội khoa theo hướng dẫn, cho thấy tỉ lệ sống còn của bệnh nhân không ghép tại thời điểm theo dõi 1 năm, 2 năm và 4 năm lần lượt là 94%, 92% và 88% [56]. Trong cùng thời điểm, sống còn không nhập viện do suy tim lần lượt là 88%, 82% và 78% [56]. ICD, điều trị tái đồng bộ tim (CRT), cũng như hỗ trợ tuần hoàn cơ học và ghép tim trong suy tim nặng đã có những cải thiện trong kết cục, và CRT và hỗ trợ tuần hoàn cơ học có liên quan đến đảo ngược tái cấu trúc và phục hồi.
Tuy nhiên, một thử nghiệm ngẫu nhiên gần đây (TRED-HF) với 51 bệnh nhân có BCTDN và phục hồi chức năng thất trái cho thấy việc ngưng điều trị nội khoa theo hướng dẫn cho suy tim liên quan với 40% tái phát rối loạn chức năng thất trái trong vòng 6 tháng [40]. Điều này ủng hộ mạnh cho việc tiếp tục điều trị suy tim ngay cả những bệnh nhân BCTDN đã hồi phục.
Bên cạnh điều trị theo hướng dẫn, một vài yếu tố tiên đoán của việc đảo ngược tái cấu trúc thất trái đã được phát hiện trong BCTDN, liên quan đến tiên lượng dài hạn khả quan hơn. Trong nghiên cứu IMPROVE-HF với 3.994 bệnh nhân suy tim (32% có nguyên nhân không do thiếu máu cục bộ), khoảng 30% có tăng > 10% phân suất tống máu thất trái trong hơn 2 năm theo dõi. Giới nữ, nguyên nhân suy tim không do thiếu máu cục bộ và không sử dụng digoxin là những yếu tố tiên đoán trong mô hình đa biến của phục hồi chức năng thất trái [100]. Một vài nghiên cứu đoàn hệ cho thấy phục hồi chức năng thất trái trong BCTDN mới khởi phát và nhận thấy tăng > 10% trong phân suất tống máu thất trái ở 30 – 70% bệnh nhân [51], [56], [58]. LVEF nền cao và đường kính cuối tâm trương thất trái thấp là các yếu tố tiên đoán của việc đảo ngược được tái cấu trúc thất trái [56]. Ngoài ra, bắt thuốc gadolinium muộn (LGE) trên cộng hưởng từ tim (CMR), cho thấy việc thay thế bằng mô xơ ở mô kẽ thấp, được cho thấy có giá trị tiên đoán cho việc đảo ngược tái cấu trúc thất trái trong BCTDN mới khởi phát [51]. Điều quan trọng là đảo ngược tái cấu trúc thất trái có liên quan với việc giảm thấp tỉ lệ tử vong khoảng 50% tạ thời điểm theo dõi 10 năm độc lập với các yếu tố khác ở bệnh nhân BCTDN [58].
Mặt khác, giới nam và tuổi cao (> 60 tuổi) có liên quan với tiên lượng xấu hơn ở những bệnh nhân BCTDN và suy tim [53], [56], [40]. Chủng tộc Da Đen cũng có liên quan với suy tim nặng hơn tại thời điểm nhập viện, mức độ đảo ngược tái cấu trúc thất trái thấp hơn, và có tỉ lệ tử vong cao hơn gần 2 lần trong thời gian theo dõi [56]. Các yếu tố tiên đoán khác của kết cục xấu bao gồm: LVEF nền thấp, phân độ NYHA cao (III-IV), hở hai lá nặng [58], có blốc nhánh trái và nồng độ peptide bài natri niệu cao [38], [51]. Hở van hai lá cơ năng nặng có liên quan đến tử vong cao gấp 2 lần hoặc suy tim nặng ở BCTDN [80]. Sự dai dẳng của hở van hai lá cơ năng nặng hoặc nặng lên của hở van hai lá cơ năng không nặng dù điều trị tối ưu dự đoán tiên lượng xấu ở những bệnh nhân HFrEF, bất kể nguyên nhân suy tim [62]. Ngoài ra, bắt thuốc cản từ chậm ở vùng giữa cơ tim trên MRI tim liên quan với tử vong do suy tim và do mọi nguyên nhân cao hơn và nhập viện do suy tim cao hơn ở BCTDN [38].
Suy tim trong BCTDN vẫn còn có nguy cơ tử vong tương tự, hoặc cao hơn tử vong do các nguyên nhân suy tim không do thiếu máu cục bộ khác (như van tim hoặc tăng huyết áp) [68]. Suy tim nặng vẫn còn là nguyên nhân tử vong thường gặp nhất trong BCTDN, trong khi đột tử do tim chiếm < 30% tử vong [38], [39]. Điều quan trọng là BCTDN cũng có nguy cơ cao tử vong do các nguyên nhân không do tim mạch ở khoảng 1/3 bệnh nhân tử vong do ung thư, nhiễm trùng, bệnh lý phổi, hoặc xuất huyết [39], [50]. Nguy cơ của tử vong không do tim mạch tăng theo tuổi và độ nặng của suy tim [39], [50].
- ĐIỀU TRỊ
Điều trị suy tim do bệnh cơ tim dãn nở bao gồm cả điều trị đặc hiệu suy tim và điều trị nguyên nhân.
- Điều trị suy tim
Điều trị nội khoa theo hướng dẫn và các thiết bị có thể cấy được làm cải thiện kết cục có lợi cho bệnh nhân suy tim mạn có BCTDN (Bảng 1) [2], [3], [7], [10], [37], [48], [50], [55], [70], [71], [90], [95], [105], [107]. Trong suy tim cấp/tiến triển, điều trị nội viện với lợi tiểu tĩnh mạch, dãn mạch, hoặc vận mạch có thể cần thiết, mặc dù không có bằng chứng cho thấy những can thiệp này có cải thiện kết cục [71].
Những lo ngại đã được đặt ra về hiệu quả của một số biện pháp điều trị ở bệnh nhân BCTDN so với các nguyên nhân khác của suy tim. Những khuyến cáo từ các nghiên cứu quan sát về tăng tỉ lệ tử vong với amiodarone và digoxin trong BCTDN có suy tim [54], [100] chưa được xác nhận bởi các thử nghiệm lâm sàng [2], [86]. Đặt ICD dự phòng nguyên phát đột tử do tim gần đây được khuyến cáo ở những bệnh nhân BCTDN với suy tim (NYHA II – III) và LVEF ≤ 35% dù điều trị nội khoa theo hướng dẫn [71]. Khuyến cáo này dựa trên các thử nghiệm lâm sàng trước đó cho thấy giảm cả rối loạn nhịp và tử vong do mọi nguyên nhân ở suy tim cả do nguyên nhân thiếu máu cục bộ và không do thiếu máu cục bộ [7], [48]. Những kết quả của thử nghiệm DANISH, với > 50% bệnh nhân được đặt CRT và điều trị nội khoa theo hướng dẫn cho thấy đặt ICD làm giảm nguy cơ đột tử do tim 50% mà không ảnh hưởng có ý nghĩa đến tử vong do mọi nguyên nhân [50]. Tuy nhiên, một phân tích dưới nhóm gần đây của thử nghiệm DANISH cho thấy ở những bệnh nhân ≤ 70 tuổi, đặt ICD làm giảm tử vong do mọi nguyên nhân [22]. Tương tự, trong thử nghiệm COMPANION, việc thêm chức năng phá rung vào CRT (CRT-D) làm giảm nhiều hơn tử vong do mọi nguyên nhân ở những bệnh nhân BCTDN đang điều trị nội khoa theo hướng dẫn khi so sánh với những bệnh nhân suy tim do nguyên nhân thiếu máu cục bộ [11]. Điều này nhấn mạnh nhu cầu cải thiện phân tầng nguy cơ cho những bệnh nhân BCTDN có đủ tiêu chuẩn đặt CRT, là những người có lợi ích tốt nhất từ CRT-D trong phòng ngừa nguyên phát. Ngoài ra, khoảng 1/3 bệnh nhân BCTDN có thể đảo ngược quá trình tái cấu trúc thất trái và phục hồi được suy tim với điều trị nội khoa theo hướng dẫn có nguy cơ của đột tử do tim thấp hơn đáng kể [58]. Đảo ngược quá trình tái cấu trúc đáng kể nhất được quan sát ở những nguyên nhân của BCTDN có thể điều trị được, bao gồm có liên quan đến rượu, bệnh cơ tim chu sinh hoặc bệnh cơ tim do nhịp nhanh, cho thấy tầm quan trọng của việc đánh giá nguyên nhân suy tim trong BCTDN. Những bệnh nhân này có thể được phòng ngừa đột tử do tim trong giai đoạn hồi phục với máy khử rung có thể mặc được, do đó tránh được việc phải đặt ICD vĩnh viễn.
Điều chỉnh việc mất đồng bộ cơ học thất trái (15 – 30% bệnh nhân BCTDN có suy tim) có ảnh hưởng tích cực lên tử vong và bệnh tật [10], [16], [108]. Do đó, CRT hiện được khuyến cáo cho những bệnh nhân suy tim có triệu chứng với LVEF < 35% và QRS ≥ 130ms, đặc biệt ở dạng blốc nhánh trái (chỉ điểm cho mất đồng vận thất trái), đã điều trị ≥ 3 tháng với điều trị nội khoa theo hướng dẫn bất kể nguyên nhân suy tim [71].
Dựa trên kinh nghiệm từ phẫu thuật sửa van hai lá của hở van hai lá cơ năng trung bình đến nặng, cho thấy đảo ngược tái cấu trúc thất trái và cải thiện chức năng [20], một kĩ thuật can thiệp qua da đã được phát triển để điều chỉnh hở van hai lá cơ năng. Sửa van hai lá qua da với thiết bị MitraClip cho thấy hiệu quả tương tự nhưng cải thiện được tính an toàn khi so với phẫu thuật [30]. Gần đây, hai thử nghiệm lâm sàng ngẫu nhiên so sánh về hiệu quả của sửa van hai lá qua da với điều trị nội khoa theo hướng dẫn đã cho thấy những kết quả trái ngược nhau. Trong thử nghiệm MITRA-FR nguy cơ tử vong 1 năm hoặc nhập viện do suy tim không khác biệt có ý nghĩa giữa những bệnh nhân sửa van hai lá qua da hoặc những bệnh nhân điều trị nội khoa theo hướng dẫn đơn thuần [64]. Trái lại, trong thử nghiệm COAPT, những bệnh nhân điều trị với sửa van kiểu mép – mép qua da cho thấy giảm đáng kể tử vong do mọi nguyên nhân và nhập viện do suy tim trong vòng 2 năm so với điều trị nội khoa theo hướng dẫn [89].
- Điều trị nguyên nhân
Điều trị nguyên nhân suy tim trong BCTDN là một lĩnh vực đang được phát triển, cần nhiều chứng cứ hơn nữa từ các thử nghiệm lâm sàng. Trong trường hợp BCTDN có yếu tố viêm do nguyên nhân tự miễn không có nhiễm virus, điều trị bao gồm có ức chế miễn dịch và hấp phụ miễn dịch, trong khi điều trị kháng virus có thể được cân nhắc trong trường hợp sinh thiết xác định có viêm cơ tim cấp do virus hoặc sự hiện diện của virus. Một số thử nghiệm quan sát và ngẫu nhiên cho thấy BCTDN sau viêm cơ tim virus âm tính với suy tim tiến triển, ức chế miễn dịch có thể hiệu quả trong đảo ngược tái cấu trúc thất trái và cải thiện triệu chứng suy tim [23], [34], [35]. Theo đó, những tài liệu đồng thuận của các chuyên gia đã khuyến cáo điều trị ức chế miễn dịch với azathioprine và prednisone trong 6 – 12 tháng ở những bệnh nhân có sinh thiết, BCTDN virus âm tính [15], nhưng vai trò chính xác của ức chế miễn dịch vẫn chưa được xác định. Ức chế miễn dịch cũng được khuyến cáo trong viêm cơ tim cấp do bạch cầu ái toan và đại bào và sarcoidosis tim [9], [15], [19].
Trong BCTDN sinh thiết có enterovirus mạn hoặc adenovirus và/hoặc Parvovirus B19 dương tính, điều trị điều hoà miễn dịch với interferon beta được chứng minh làm giảm tải lượng virus và cải thiện chức năng [82]. Các nghiên cứu nhãn mở có kiểm soát hoặc nghiên cứu quan sát nhỏ cho thấy việc loại bỏ kháng thể trong tuần hoàn ở BCTDN bằng hấp phụ miễn dịch, sau đó thay thế bằng IgG, cho kết quả cải thiện chức năng tim, cải thiện triệu chứng và tăng khả năng gắng sức [31], [65], [98]. Hiện tại, hấp phụ miễn dịch được xem là một chọn lựa điều trị thử nghiệm cần có thêm các đánh giá trong các thử nghiệm kết cục. Trong bệnh cơ tim do anthracycline, điều trị kịp thời với ức chế men chuyển và chẹn beta cải thiện đáng kể LVEF [27].
Điều trị với ức chế prolactin bromocriptin (dùng kèm với kháng đông dự phòng) có thể là điều trị chuyên biệt ở những bệnh nhân có suy tim cấp do bệnh cơ tim chu sinh [8], [42], [74]. Các điều trị nguyên nhân khác gồm có ngưng tác nhân có hại (như alcohol) và điều trị các rối loạn nội tiết hoặc chuyển hoá [59].
Trong các nguyên nhân đơn gen khác nhau gây BCTDN, sửa chữa gen có thể là một mục tiêu đầy hứa hẹn trong điều trị nguyên nhân của suy tim. Sau cải thiện chức năng cơ xương với kỹ thuật CRISPR/Cas9 để sửa gen trong bệnh loạn dưỡng cơ Duchenne [6], kỹ thuật này hiện đang được đánh giá để điều chỉnh gen trong các bệnh cơ tim [47]. Do đó, việc hiểu biết về kỹ thuật CRISPR/Cas9 có thể trở thành một cách tiếp cận bao quát trong điều trị nguyên nhân nguyên phát của một số bệnh cơ tim.
Bảng 1. Kết cục trong các thử nghiệm lâm sàng trên bệnh nhân suy tim phân suất tống máu giảm do BCTDN hoặc suy tim không do thiếu máu cục bộ cơ tim
| Thử nghiệm lâm sàng, năm công bố | Can thiệp | Số lượng bệnh nhân và đặc điểm | BCTDN hoặc suy tim không do thiếu máu cục bộ | Kết cục (điều trị với nhóm so sánh) |
| Điều trị nội khoa | ||||
| SOLVD [105], 1991 | Enalapril so với giả dược | 2569; NYHA I-IV; LVEF ≤ 35% | 17,9%-18,6% | Tử vong do mọi nguyên nhân: RR ↓27%
Tử vong hoặc nhập viện: RR ↓29%; P tương tác không có ý nghĩa theo nguyên nhân suy tim (thiếu máu cục bộ so với không thiếu máu cục bộ) |
| DIG [2], 1997 | Digoxin so với giả dược | 6800; NYHA I-IV; LVEF ≤ 45% | 14,1%-15,5% | Tử vong hoặc nhập viện do suy tim: RR 0.67 (KTC 95% 0,58-0,77); P tương tác = 0,06 theo nguyên nhân suy tim (thiếu máu cục bộ so với không thiếu máu cục bộ) |
| MDC [95], 1993 | Metoprolol so với giả dược | 383; 94% NYHA II-III, LVEF < 40% | 100% | Tử vong do mọi nguyên nhân: RR ↓34% (KTC 95% 6% đến 62%, p = 0,058).
Cải thiện triệu chứng có ý nghĩa, ít suy sụp về lâm sàng với metoprolol |
| CIBIS [3], 1994 | Bisoprolol so với giả dược | 641; NYHA III (95%) hoặc IV (5%); LVEF < 40% | 36% | Tử vong do mọi nguyên nhân: Giả dược so với bisoprolol: 23/115 với 11/117; p = 0,01 |
| RALES [70], 1999 | Spironolactone so với giả dược | 1663; NYHA III-IV (NYHA IV trong vòng 6 tháng trước khi tham gia); LVEF ≤ 35% | 45-46% | Tử vong do mọi nguyên nhân (dân số nghiên cứu chung): HR 0,70 (KTC 95% 0,60-0,82); P tương tác không có ý nghĩa theo nguyên nhân suy tim (thiếu máu cục bộ so với không thiếu máu cục bộ) |
| CHARM-Alternative [37], 2003 | Candesartan so với giả dược ở những bệnh nhân không dung nạp UCMC | 2028; NYHA II-IV; LVEF ≤ 40% | 18,8-20,3% | Tử vong tim mạch hoặc nhập viện do suy tim (chung cho dân số nghiên cứu): HR 0.70 (KTC 95% 0.60-0.81)
Không ghi nhận tương tác theo nguyên nhân suy tim |
| SHIFT [90], 2010 | Ivabradine so với giả dược | 6558; LVEF ≤ 35%; nhịp xoang > 70 lần/phút; NYHA II-IV; nhập viện do suy tim trong vòng 12 tháng trước | 32-33% | Tử vong do tim mạch hoặc nhập viện do suy tim: HR 0,72 (KTC 95% 0,60-0,85); P tương tác = 0,059 theo nguyên nhân suy tim (thiếu máu cục bộ so với không thiếu máu cục bộ) |
| EMPHASIS-HF [107], 2011 | Eplerenone so với giả dược | 2737; NYHA II; LVEF < 30% (hoặc LVEF 30-35% và QRS > 130ms) | 30,1-31,8% | Tử vong do tim mạch và nhập viện do suy tim (dân số nghiên cứu chung): HR 0,63 (KTC 95% 0,54-0,74); P tương tác = 0,73 theo nguyên nhân suy tim (thiếu máu cục bộ so với không thiếu máu cục bộ) |
| PARADIGM-HF [55], 2014 | Sacubitril/valsartan so với giả dược | 10.521; NYHA II-IV; LVEF ≤ 35-40%, BNP ≥ 150 pg/ml hoặc NT-proBNP ≥ 600 pg/ml, hoặc nhập viện do suy tim trong 12 tháng trước + BNP ≥ 100 pg/ml hoặc NT-proBNP ≥ 400 pg/ml | 39,9-40,1% | Tử vong do tim mạch và nhập viện do suy tim (dân số nghiên cứu chung): HR 0,80 (KTC 95% 0,73-0,87); không ghi nhận tương tác theo nguyên nhân suy tim |
|
Thiết bị |
||||
| DEFINITE [48], 2004 | ICD so với điều trị nội khoa | 458; LVEF ≤ 35%; Ngoại tâm thu thất và/hoặc nhịp nhanh thất không dai dẳng dù điều trị nội khoa theo hướng dẫn | 100% | Tử vong do mọi nguyên nhân: HR 0,65 (KTC 95% 0,40-1,06)
Đột tử do tim: HR 0,20 (KTC 95% 0,06-0,71) |
| SCD-HeFT [7], 2005 | ICD so với giả dược
Amiodarone so với giả dược |
2521; NYHA II-III; LVEF ≤ 35% dù điều trị nội khoa theo hướng dẫn | 48% | Tử vong do mọi nguyên nhân: ICD so với giả dược, HR 0,73 (KTC 95% 0,50-1,07)
Amiodarone so với giả dược, HR 1,07 (KTC 95% 0,76-1,51) P tương tác không có ý nghĩa theo nguyên nhân suy tim (thiếu máu cục bộ so với không thiếu máu cục bộ) |
| COMPANION [10], 2004 | CRT-P/CRT-D so với điều trị nội khoa | 1520; NYHA III-IV; LVEF ≤ 35% dù điều trị nội khoa theo hướng dẫn; QRS ≥ 120ms | 44,9% | Tử vong do mọi nguyên nhân: CRT-P so với giả dược, HR 0,91 (KTC 95% 0,55-1,49)
CRT-D so với giả dược, HR 0,50 (KTC 95% 0,29-0,88) P tương tác không có ý nghĩa theo nguyên nhân suy tim (thiếu máu cục bộ so với không thiếu máu cục bộ) |
| DANISH [50], 2016 | ICD so với điều trị nội khoa | 1116; NYHA II-IV với suy tim không do thiếu máu cục bộ; LVEF ≤ 35%; NT-proBNP > 200 pg/ml | 76% | Tử vong do mọi nguyên nhân: HR 0,87 (KTC 95% 0,68-1,12)
Đột tử do tim: HR 0,50 (KTC 95% 0,31-0,82) P tương tác = 0,80 theo nguyên nhân suy tim (vô căn so với van tim so với tăng huyết áp so với nguyên nhân khác) |

Hình 1. Tiếp cận lâm sàng đánh giá nguyên nhân suy tim do bệnh cơ tim.
ACE, angiotensin-converting enzyme; BCTDN, bệnh cơ tim dãn nở; BCTHC, bệnh cơ tim hạn chế; BCTPĐ, bệnh cơ tim phì đại; BNP, B-type natriuretic peptide; CK, creatine kinase; CRP, C-reative protein; CTM, công thức máu; CLVTMV, cắt lớp vi tính mạch vành; CMVXL, chụp mạch vành xâm lấn; ECG, điện tâm đồ; ECV, extracellular volumne, dịch ngoại bào; FDG, flourodeoxyglucose; HA, huyết áp; HCTBCAT, hội chứng tăng bạch cầu ái toan; HMDP, hydroxymethylene diphosphonate; hsTnT, high sensitive troponin T, troponin T siêu nhạy; IGF-1, insulin growth factor-1; 99mTc-DPD, technetium-99m 3,3- diphosphono-1,2 propanodicarboxylic acid; NT-proBNP, N-terminal pro B-type natriuretic peptide; PCR, polymerase chain reaction; PET, positron emission tomography; PYP, pyrophosphate; PSTMTT, phân suất tống máu thất trái; SATQTN, siêu âm tim qua thành ngực; SATQTQ, siêu âm tim qua thực quản; SPECT, single photon emission computed tomography.
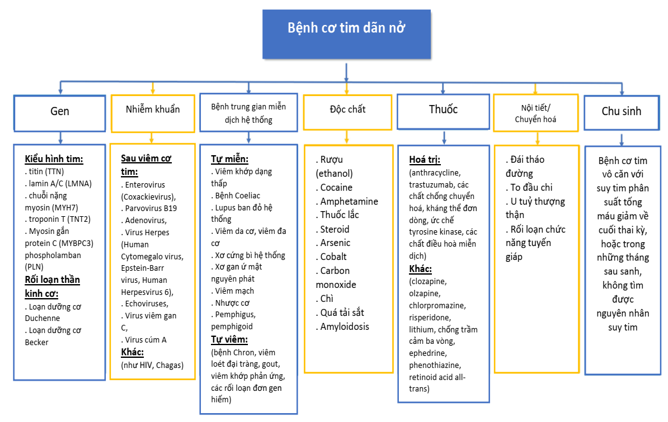
Hình 2. Các nguyên nhân của bệnh cơ tim dãn nở
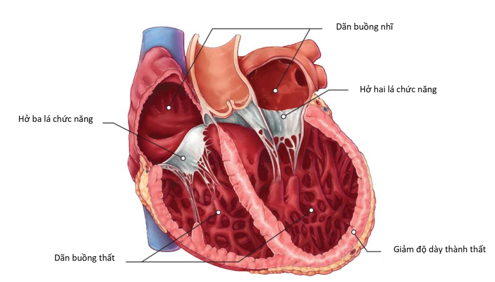
Hình 3. Những thay đổi về hình thái của tim trong suy tim do bệnh cơ tim dãn nở
TÀI LIỆU THAM KHẢO
- CIBIS-IIInvestigators and Committees (1999), “The Cardiac Insufficiency Bisoprolol Study II (CIBIS-II): a randomised trial”, Lancet, 353 (9146), pp. 9-13.
- Digitalis Investigation Group (1997), “The effect of digoxin on mortality and morbidity in patients with heart failure”, N Engl J Med, 336 (8), pp. 525-33.
- CIBIS Investigators and Committees (1994), “A randomized trial of beta-blockade in heart failure. The Cardiac Insufficiency Bisoprolol Study (CIBIS)”, Circulation, 90 (4), pp. 1765-73.
- Adams K. F., Jr., Fonarow G. C., Emerman C. L., et al. (2005), “Characteristics and outcomes of patients hospitalized for heart failure in the United States: rationale, design, and preliminary observations from the first 100,000 cases in the Acute Decompensated Heart Failure National Registry (ADHERE)”, Am Heart J, 149 (2), pp. 209-16.
- Ameri P., Canepa M., Anker M. S., et al. (2018), “Cancer diagnosis in patients with heart failure: epidemiology, clinical implications and gaps in knowledge”, Eur J Heart Fail, 20 (5), pp. 879-887.
- Amoasii L., Hildyard J. C. W., Li H., et al. (2018), “Gene editing restores dystrophin expression in a canine model of Duchenne muscular dystrophy”, Science, 362 (6410), pp. 86-91.
- Bardy G. H., Lee K. L., Mark D. B., et al. (2005), “Amiodarone or an implantable cardioverter-defibrillator for congestive heart failure”, N Engl J Med, 352 (3), pp. 225-37.
- Bauersachs J., Arrigo M., Hilfiker-Kleiner D., et al. (2016), “Current management of patients with severe acute peripartum cardiomyopathy: practical guidance from the Heart Failure Association of the European Society of Cardiology Study Group on peripartum cardiomyopathy”, Eur J Heart Fail, 18 (9), pp. 1096-105.
- Bozkurt B., Colvin M., Cook J., et al. (2016), “Current Diagnostic and Treatment Strategies for Specific Dilated Cardiomyopathies: A Scientific Statement From the American Heart Association”, Circulation, 134 (23), e579-e646.
- Bristow M. R., Saxon L. A., Boehmer J., et al. (2004), “Cardiac-resynchronization therapy with or without an implantable defibrillator in advanced chronic heart failure”, N Engl J Med, 350 (21), pp. 2140-50.
- Bristow M. R., Saxon L. A., Feldman A. M., et al. (2016), “Lessons Learned and Insights Gained in the Design, Analysis, and Outcomes of the COMPANION Trial”, JACC Heart Fail, 4(7), pp. 521-535.
- Caforio A. L., Keeling P. J., Zachara E., et al. (1994), “Evidence from family studies for autoimmunity in dilated cardiomyopathy”, Lancet, 344 (8925), pp. 773-7.
- Caforio A. L., Mahon N. G., Baig M. K., et al. (2007), “Prospective familial assessment in dilated cardiomyopathy: cardiac autoantibodies predict disease development in asymptomatic relatives”, Circulation, 115 (1), pp. 76-83.
- Caforio A. L. P., Adler Y., Agostini C., et al. (2017), “Diagnosis and management of myocardial involvement in systemic immune-mediated diseases: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Disease”, Eur Heart J, 38 (35), pp. 2649-2662.
- Caforio A. L., Pankuweit S., Arbustini E., et al. (2013), “Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases”, Eur Heart J, 34 (33), 2636-48, pp. 2648a-2648d.
- Cleland J. G., Daubert J. C., Erdmann E., et al. (2005), “The effect of cardiac resynchronization on morbidity and mortality in heart failure”, N Engl J Med, 352 (15), pp. 1539-49.
- Codd M. B., Sugrue D. D., Gersh B. J., et al. (1989), “Epidemiology of idiopathic dilated and hypertrophic cardiomyopathy. A population-based study in Olmsted County, Minnesota, 1975-1984”, Circulation, 80(3), pp. 564-72.
- Cohn J. N., Tognoni G., Glazer R., et al. (2000), “Baseline demographics of the Valsartan Heart Failure Trial. Val-HeFT Investigators”, Eur J Heart Fail, 2 (4), pp. 439-46.
- Cooper L. T., Jr., Hare J. M., Tazelaar H. D., et al. (2008), “Usefulness of immunosuppression for giant cell myocarditis”, Am J Cardiol, 102 (11), pp. 1535-9.
- De Bonis M., Taramasso M., Verzini A., et al. (2012), “Long-term results of mitral repair for functional mitral regurgitation in idiopathic dilated cardiomyopathy”, Eur J Cardiothorac Surg, 42 (4), pp. 640-6.
- Duboc D., Meune C., Lerebours G., et al. (2005), “Effect of perindopril on the onset and progression of left ventricular dysfunction in Duchenne muscular dystrophy”, J Am Coll Cardiol, 45 (6), pp. 855-7.
- Elming Marie Bayer, Nielsen Jens C., Haarbo Jens, et al. (2017), “Age and Outcomes of Primary Prevention Implantable Cardioverter-Defibrillators in Patients With Nonischemic Systolic Heart Failure”, Circulation, 136 (19), pp. 1772-1780.
- Escher F., Kuhl U., Lassner D., et al. (2016), “Long-term outcome of patients with virus-negative chronic myocarditis or inflammatory cardiomyopathy after immunosuppressive therapy”, Clin Res Cardiol, 105 (12), pp. 1011-1020.
- Escher F., Kuhl U., Lassner D., et al. (2014), “Presence of perforin in endomyocardial biopsies of patients with inflammatory cardiomyopathy predicts poor outcome”, Eur J Heart Fail, 16 (10), pp. 1066-72.
- Ewer M. S., Vooletich M. T., Durand J. B., et al. (2005), “Reversibility of trastuzumab-related cardiotoxicity: new insights based on clinical course and response to medical treatment”, J Clin Oncol, 23 (31), pp. 7820-6.
- Falase A. O., Ogah O. S. (2012), “Cardiomyopathies and myocardial disorders in Africa: present status and the way forward”, Cardiovascular journal of Africa, 23 (10), pp. 552-562.
- Farmakis D., Mantzourani M., Filippatos G. (2018), “Anthracycline-induced cardiomyopathy: secrets and lies”, Eur J Heart Fail, 20 (5), pp. 907-909.
- Fauchier L., Babuty D., Poret P., et al. (2000), “Comparison of long-term outcome of alcoholic and idiopathic dilated cardiomyopathy”, Eur Heart J, 21 (4), 306-14.
- Fayssoil A., Nardi O., Orlikowski D., et al. (2010), “Cardiomyopathy in Duchenne muscular dystrophy: pathogenesis and therapeutics”, Heart Fail Rev, 15 (1), pp. 103-7.
- Feldman T., Foster E., Glower D. D., et al. (2011), “Percutaneous repair or surgery for mitral regurgitation”, N Engl J Med, 364 (15), pp. 1395-406.
- Felix S. B., Staudt A., Dorffel W. V., et al. (2000), “Hemodynamic effects of immunoadsorption and subsequent immunoglobulin substitution in dilated cardiomyopathy: three-month results from a randomized study”, J Am Coll Cardiol, 35 (6), pp. 1590-8.
- Figueredo V. M. (2011), “Chemical cardiomyopathies: the negative effects of medications and nonprescribed drugs on the heart”, Am J Med, 124 (6), pp. 480-8.
- Forster O., Hilfiker-Kleiner D., Ansari A. A., et al. (2008), “Reversal of IFN-gamma, oxLDL and prolactin serum levels correlate with clinical improvement in patients with peripartum cardiomyopathy”, Eur J Heart Fail, 10 (9), pp. 861-8.
- Frustaci A., Chimenti C., Calabrese F., et al. (2003), “Immunosuppressive therapy for active lymphocytic myocarditis: virological and immunologic profile of responders versus nonresponders”, Circulation, 107 (6), pp. 857-63.
- Frustaci A., Russo M. A., Chimenti C. (2009), “Randomized study on the efficacy of immunosuppressive therapy in patients with virus-negative inflammatory cardiomyopathy: the TIMIC study”, Eur Heart J, 30 (16), pp. 1995-2002.
- Fuster V., Gersh B. J., Giuliani E. R., et al. (1981), “The natural history of idiopathic dilated cardiomyopathy”, Am J Cardiol, 47 (3), pp. 525-31.
- Granger C. B., McMurray J. J., Yusuf S., et al. (2003), “Effects of candesartan in patients with chronic heart failure and reduced left-ventricular systolic function intolerant to angiotensin-converting-enzyme inhibitors: the CHARM-Alternative trial”, Lancet, 362 (9386), pp. 772-6.
- Gulati A., Jabbour A., Ismail T. F., et al. (2013), “Association of fibrosis with mortality and sudden cardiac death in patients with nonischemic dilated cardiomyopathy”, Jama, 309 (9), pp. 896-908.
- Halliday B. P., Gulati A., Ali A., et al. (2018), “Sex- and age-based differences in the natural history and outcome of dilated cardiomyopathy”, Eur J Heart Fail, 20 (10), pp. 1392-1400.
- Halliday B. P., Wassall R., Lota Amrit S., et al. (2019), “Withdrawal of pharmacological treatment for heart failure in patients with recovered dilated cardiomyopathy (TRED-HF): an open-label, pilot, randomised trial”, The Lancet, 393 (10166), pp. 61-73.
- Herman D. S., Lam L., Taylor M. R., et al. (2012), “Truncations of titin causing dilated cardiomyopathy”, N Engl J Med, 366 (7), pp. 619-28.
- Hilfiker-Kleiner D., Haghikia A., Berliner D., et al. (2017), “Bromocriptine for the treatment of peripartum cardiomyopathy: a multicentre randomized study”, Eur Heart J, 38 (35), pp. 2671-2679.
- Hilfiker-Kleiner D., Kaminski K., Podewski E., et al. (2007), “A cathepsin D-cleaved 16 kDa form of prolactin mediates postpartum cardiomyopathy”, Cell, 128 (3), pp. 589-600.
- Hilfiker-Kleiner D., Sliwa K. (2014), “Pathophysiology and epidemiology of peripartum cardiomyopathy”, Nat Rev Cardiol, 11 (6), pp. 364-70.
- Japp A. G., Gulati A., Cook S. A., et al. (2016), “The Diagnosis and Evaluation of Dilated Cardiomyopathy”, J Am Coll Cardiol, 67 (25), pp. 2996-3010.
- Jefferies J. L., Towbin J. A. (2010), “Dilated cardiomyopathy”, Lancet, 375 (9716), pp. 752-62.
- Johansen A. K., Molenaar B., Versteeg D., et al. (2017), “Postnatal Cardiac Gene Editing Using CRISPR/Cas9 With AAV9-Mediated Delivery of Short Guide RNAs Results in Mosaic Gene Disruption”, Circ Res, 121 (10), pp. 1168-1181.
- Kadish A., Dyer A., Daubert J. P., et al. (2004), “Prophylactic defibrillator implantation in patients with nonischemic dilated cardiomyopathy”, N Engl J Med, 350 (21), pp. 2151-8.
- Kitaura-Inenaga K., Hara M., Higuchi K., et al. (2003), “Gene expression of cardiac mast cell chymase and tryptase in a murine model of heart failure caused by viral myocarditis”, Circ J, 67 (10), pp. 881-4.
- Kober L., Thune J. J., Nielsen J. C., et al. (2016), “Defibrillator Implantation in Patients with Nonischemic Systolic Heart Failure”, N Engl J Med, 375 (13), pp. 1221-30.
- Kubanek M., Sramko M., Maluskova J., et al. (2013), “Novel predictors of left ventricular reverse remodeling in individuals with recent-onset dilated cardiomyopathy”, J Am Coll Cardiol, 61 (1), pp. 54-63.
- Li Y., Heuser J. S., Cunningham L. C., et al. (2006), “Mimicry and antibody-mediated cell signaling in autoimmune myocarditis”, J Immunol, 177 (11), pp. 8234-40.
- Martinez-Selles M., Doughty R. N., Poppe K., et al. (2012), “Gender and survival in patients with heart failure: interactions with diabetes and aetiology. Results from the MAGGIC individual patient meta-analysis”, Eur J Heart Fail, 14 (5), pp. 473-9.
- Matsumura Y., Takata J., Kitaoka H., et al. (2006), “Long-term prognosis of dilated cardiomyopathy revisited: an improvement in survival over the past 20 years”, Circ J, 70 (4), pp. 376-83.
- McMurray J. J., Packer M., Desai A. S., et al. (2014), “Angiotensin-neprilysin inhibition versus enalapril in heart failure”, N Engl J Med, 371 (11), pp. 993-1004.
- McNamara D. M., Starling R. C., Cooper L. T., et al. (2011), “Clinical and demographic predictors of outcomes in recent onset dilated cardiomyopathy: results of the IMAC (Intervention in Myocarditis and Acute Cardiomyopathy)-2 study”, J Am Coll Cardiol, 58 (11), pp. 1112-8.
- Mendez G. F., Cowie M. R. (2001), “The epidemiological features of heart failure in developing countries: a review of the literature”, Int J Cardiol, 80 (2-3), pp. 213-9.
- Merlo M., Pyxaras S. A., Pinamonti B., et al. (2011), “Prevalence and prognostic significance of left ventricular reverse remodeling in dilated cardiomyopathy receiving tailored medical treatment”, J Am Coll Cardiol, 57 (13), pp. 1468-76.
- Mirijello A., Tarli C., Vassallo G. A., et al. (2017), “Alcoholic cardiomyopathy: What is known and what is not known”, Eur J Intern Med, 43, pp. 1-5.
- Miura K., Nakagawa H., Morikawa Y., et al. (2002), “Epidemiology of idiopathic cardiomyopathy in Japan: results from a nationwide survey”, Heart (British Cardiac Society), 87 (2), pp. 126-130.
- Mozaffarian D., Benjamin E. J., Go A. S., et al. (2016), “Executive Summary: Heart Disease and Stroke Statistics–2016 Update: A Report From the American Heart Association”, Circulation, 133 (4), pp. 447-54.
- Nasser R., Van Assche L., Vorlat A., et al. (2017), “Evolution of Functional Mitral Regurgitation and Prognosis in Medically Managed Heart Failure Patients With Reduced Ejection Fraction”, JACC Heart Fail, 5 (9), pp. 652-659.
- Nielsen T. S., Hansen J., Nielsen L. P., et al. (2014), “The presence of enterovirus, adenovirus, and parvovirus B19 in myocardial tissue samples from autopsies: an evaluation of their frequencies in deceased individuals with myocarditis and in non-inflamed control hearts”, Forensic Sci Med Pathol, 10 (3), pp. 344-50.
- Obadia J. F., Messika-Zeitoun D., Leurent G., et al. (2018), “Percutaneous Repair or Medical Treatment for Secondary Mitral Regurgitation”, N Engl J Med, 379 (24), pp. 2297-2306.
- Ohlow M. A., Brunelli M., Schreiber M., et al. (2017), “Therapeutic effect of immunoadsorption and subsequent immunoglobulin substitution in patients with dilated cardiomyopathy: Results from the observational prospective Bad Berka Registry”, J Cardiol, 69 (2), pp. 409-416.
- Pareek N., Cevallos J., Moliner P., et al. (2018), “Activity and outcomes of a cardio-oncology service in the United Kingdom-a five-year experience”, Eur J Heart Fail, 20 (12), pp. 1721-1731.
- Patten I. S., Rana S., Shahul S., et al. (2012), “Cardiac angiogenic imbalance leads to peripartum cardiomyopathy”, Nature, 485 (7398), pp. 333-8.
- Pecini R., Moller D. V., Torp-Pedersen C., et al. (2011), “Heart failure etiology impacts survival of patients with heart failure”, Int J Cardiol, 149 (2), pp. 211-215.
- Pinto Y. M., Elliott P. M., Arbustini E., et al. (2016), “Proposal for a revised definition of dilated cardiomyopathy, hypokinetic non-dilated cardiomyopathy, and its implications for clinical practice: a position statement of the ESC working group on myocardial and pericardial diseases”, Eur Heart J, 37 (23), pp. 1850-8.
- Pitt B., Zannad F., Remme W. J., et al. (1999), “The effect of spironolactone on morbidity and mortality in patients with severe heart failure. Randomized Aldactone Evaluation Study Investigators”, N Engl J Med, 341 (10), pp. 709-17.
- Ponikowski P., Voors A. A., Anker S. D., et al. (2016), “2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC)Developed with the special contribution of the Heart Failure Association (HFA) of the ESC”, Eur Heart J, 37 (27), pp. 2129-2200.
- Priori S. G., Blomstrom-Lundqvist C., Mazzanti A., et al. (2015), “2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: The Task Force for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death of the European Society of Cardiology (ESC)Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC)”, Europace, 17 (11), pp. 1601-87.
- Raman S. V., Hor K. N., Mazur W., et al. (2015), “Eplerenone for early cardiomyopathy in Duchenne muscular dystrophy: a randomised, double-blind, placebo-controlled trial”, Lancet Neurol, 14 (2), pp. 153-61.
- Regitz-Zagrosek V., Roos-Hesselink J. W., Bauersachs J., et al. (2018), “2018 ESC Guidelines for the management of cardiovascular diseases during pregnancy”, Eur Heart J, 39 (34), pp. 3165-3241.
- Richardson P., McKenna W., Bristow M., et al. (1996), “Report of the 1995 World Health Organization/International Society and Federation of Cardiology Task Force on the Definition and Classification of cardiomyopathies”, Circulation, 93 (5), pp. 841-2.
- Rizeq M. N., Rickenbacher P. R., Fowler M. B., et al. (1994), “Incidence of myocarditis in peripartum cardiomyopathy”, Am J Cardiol, 74 (5), pp. 474-7.
- Roberts A. M., Ware J. S., Herman D. S., et al. (2015), “Integrated allelic, transcriptional, and phenomic dissection of the cardiac effects of titin truncations in health and disease”, Sci Transl Med, 7 (270), pp. 270ra6.
- Rose E. A., Gelijns A. C., Moskowitz A. J., et al. (2001), “Long-term use of a left ventricular assist device for end-stage heart failure”, N Engl J Med, 345 (20), pp. 1435-43.
- Rossano J. W., Dipchand A. I., Edwards L. B., et al. (2016), “The Registry of the International Society for Heart and Lung Transplantation: Nineteenth Pediatric Heart Transplantation Report-2016; Focus Theme: Primary Diagnostic Indications for Transplant”, J Heart Lung Transplant, 35 (10), pp. 1185-1195.
- Rossi A., Dini F. L., Faggiano P., et al. (2011), “Independent prognostic value of functional mitral regurgitation in patients with heart failure. A quantitative analysis of 1256 patients with ischaemic and non-ischaemic dilated cardiomyopathy”, Heart, 97 (20), pp. 1675-80.
- Rossi M. A., Bestetti R. B. (1995), “The challenge of chagasic cardiomyopathy. The pathologic roles of autonomic abnormalities, autoimmune mechanisms and microvascular changes, and therapeutic implications”, Cardiology, 86 (1), pp. 1-7.
- Schultheiss H. P., Piper C., Sowade O., et al. (2016), “Betaferon in chronic viral cardiomyopathy (BICC) trial: Effects of interferon-beta treatment in patients with chronic viral cardiomyopathy”, Clin Res Cardiol, 105 (9), pp. 763-73.
- Schulze K, Becker B F, Schauer R, et al. (1990), “Antibodies to ADP-ATP carrier–an autoantigen in myocarditis and dilated cardiomyopathy–impair cardiac function”, Circulation, 81 (3), pp. 959-969.
- Shore S., Grau-Sepulveda M. V., Bhatt D. L., et al. (2015), “Characteristics, Treatments, and Outcomes of Hospitalized Heart Failure Patients Stratified by Etiologies of Cardiomyopathy”, JACC Heart Fail, 3 (11), pp. 906-16.
- Silva M. C., Magalhaes T. A., Meira Z. M., et al. (2017), “Myocardial Fibrosis Progression in Duchenne and Becker Muscular Dystrophy: A Randomized Clinical Trial”, JAMA Cardiol, 2 (2), pp. 190-199.
- Singh S. N., Fletcher R. D., Fisher S. G., et al. (1995), “Amiodarone in patients with congestive heart failure and asymptomatic ventricular arrhythmia. Survival Trial of Antiarrhythmic Therapy in Congestive Heart Failure”, N Engl J Med, 333 (2), pp. 77-82.
- Sliwa K., Hilfiker-Kleiner D., Petrie M. C., et al. (2010), “Current state of knowledge on aetiology, diagnosis, management, and therapy of peripartum cardiomyopathy: a position statement from the Heart Failure Association of the European Society of Cardiology Working Group on peripartum cardiomyopathy”, Eur J Heart Fail, 12 (8), pp. 767-78.
- Steinherz L. J., Steinherz P. G., Tan C. T., et al. (1991), “Cardiac toxicity 4 to 20 years after completing anthracycline therapy”, Jama, 266 (12), pp. 1672-7.
- Stone G. W., Lindenfeld J., Abraham W. T., et al. (2018), “Transcatheter Mitral-Valve Repair in Patients with Heart Failure”, N Engl J Med, 379 (24), pp. 2307-2318.
- Swedberg K., Komajda M., Bohm M., et al. (2010), “Ivabradine and outcomes in chronic heart failure (SHIFT): a randomised placebo-controlled study”, Lancet, 376 (9744), pp. 875-85.
- Thorvaldsen T., Benson L., Dahlstrom U., et al. (2016), “Use of evidence-based therapy and survival in heart failure in Sweden 2003-2012”, Eur J Heart Fail, 18 (5), pp. 503-11.
- Torp A. (1978), “Incidence of congestive cardiomyopathy”, Postgraduate Medical Journal, 54 (633), pp. 435-439.
- van der Zwaag P. A., van Rijsingen I. A., Asimaki A., et al. (2012), “Phospholamban R14del mutation in patients diagnosed with dilated cardiomyopathy or arrhythmogenic right ventricular cardiomyopathy: evidence supporting the concept of arrhythmogenic cardiomyopathy”, Eur J Heart Fail, 14 (11), pp. 1199-207.
- van Rijsingen I. A., van der Zwaag P. A., Groeneweg J. A., et al. (2014), “Outcome in phospholamban R14del carriers: results of a large multicentre cohort study”, Circ Cardiovasc Genet, 7 (4), pp. 455-65.
- Waagstein F., Bristow M. R., Swedberg K., et al. (1993), “Beneficial effects of metoprolol in idiopathic dilated cardiomyopathy. Metoprolol in Dilated Cardiomyopathy (MDC) Trial Study Group”, Lancet, 342 (8885), pp. 1441-6.
- Ware J. S., Li J., Mazaika E., et al. (2016), “Shared Genetic Predisposition in Peripartum and Dilated Cardiomyopathies”, N Engl J Med, 374 (3), pp. 233-41.
- Warraich R. S., Sliwa K., Damasceno A., et al. (2005), “Impact of pregnancy-related heart failure on humoral immunity: clinical relevance of G3-subclass immunoglobulins in peripartum cardiomyopathy”, Am Heart J, 150 (2), pp. 263-9.
- Weinmann K., Werner J., Koenig W., et al. (2018), “Add-on Immunoadsorption Shortly-after Optimal Medical Treatment Further Significantly and Persistently Improves Cardiac Function and Symptoms in Recent-Onset Heart Failure-A Single Center Experience”, Biomolecules, 8 (4), pp.133.
- Wilcox J. E., Fonarow G. C., Ardehali H., et al. (2015), “”Targeting the Heart” in Heart Failure: Myocardial Recovery in Heart Failure With Reduced Ejection Fraction”, JACC Heart Fail, 3 (9), pp. 661-9.
- Wilcox J. E., Fonarow G. C., Yancy C. W., et al. (2012), “Factors associated with improvement in ejection fraction in clinical practice among patients with heart failure: findings from IMPROVE HF”, Am Heart J, 163 (1), pp. 49-56.e2.
- Wittstein I. S., Thiemann D. R., Lima J. A., et al. (2005), “Neurohumoral features of myocardial stunning due to sudden emotional stress”, N Engl J Med, 352 (6), pp. 539-48.
- Yoshioka D., Li B., Takayama H., et al. (2017), “Outcome of heart transplantation after bridge-to-transplant strategy using various mechanical circulatory support devices”, Interact Cardiovasc Thorac Surg, 25 (6), pp. 918-924.
- Yusen R. D., Edwards L. B., Dipchand A. I., et al. (2016), “The Registry of the International Society for Heart and Lung Transplantation: Thirty-third Adult Lung and Heart-Lung Transplant Report-2016; Focus Theme: Primary Diagnostic Indications for Transplant”, J Heart Lung Transplant, 35 (10), pp. 1170-1184.
- Yusen R. D., Edwards L. B., Dipchand A. I., et al. (2016), “The Registry of the International Society for Heart and Lung Transplantation: Thirty-third Adult Lung and Heart-Lung Transplant Report-2016; Focus Theme: Primary Diagnostic Indications for Transplant”, J Heart Lung Transplant, 35 (10), pp. 1158-1169.
- Yusuf S., Pitt B., Davis C. E., et al. (1991), “Effect of enalapril on survival in patients with reduced left ventricular ejection fractions and congestive heart failure”, N Engl J Med, 325 (5), pp. 293-302.
- Zamorano J. L., Lancellotti P., Rodriguez Munoz D., et al. (2016), “2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines: The Task Force for cancer treatments and cardiovascular toxicity of the European Society of Cardiology (ESC)”, Eur Heart J, 37 (36), pp. 2768-2801.
- Zannad F., McMurray J. J., Krum H., et al. (2011), “Eplerenone in patients with systolic heart failure and mild symptoms”, N Engl J Med, 364 (1), pp. 11-21.
- Zareba W., Klein H., Cygankiewicz I., et al. (2011), “Effectiveness of Cardiac Resynchronization Therapy by QRS Morphology in the Multicenter Automatic Defibrillator Implantation Trial-Cardiac Resynchronization Therapy (MADIT-CRT)”, Circulation, 123 (10), pp. 1061-72.








