PGS.TS. NGUYỄN TUẤN VŨ1, ThS.BS. NGUYỄN MINH QUI2
BS. CK2. NGUYỄN THỊ KIM SÁNG2, BS. CK2. NGUYỂN ĐỖ ANH3
1.ĐHYK Phạm Ngọc Thạch
2.TTYK MEDIC TP.HCM
3.BV Nhân Dân Gia Định
Tóm tắt
Chụp cắt lớp quang học (OCT) là một kỹ thuật hình ảnh nội mạch động mạch vành có độ phân giải cao giúp nâng cao hiểu biết và góp phần điều trị bệnh động mạch vành nói chung và hội chứng mạch vành cấp nói riêng. Bằng cách sử dụng ánh sáng cận hồng ngoại, OCT cung cấp độ phân giải ở mức micron, cho phép hiển thị chi tiết hình thái lòng động mạch vành và đặc điểm mảng xơ vữa. Công nghệ này đã được chứng minh là đặc biệt hữu ích trong đánh giá việc đặt stent mạch vành, đánh giá hình thái mảng xơ vữa và xác định các đặc điểm nguy cơ cao có thể dẫn đến huyết khối trong stent hoặc vỡ mảng xơ vữa. Bên cạnh đó, OCT góp phần hướng dẫn và đưa ra các quyết định trước và sau can thiệp trong can thiệp mạch vành qua da, đây là một tiến bộ đáng kể trong tim mạch can thiệp hiện đại. Việc kết hợp OCT trong các can thiệp mạch vành nhấn mạnh bước tiến tới y học chính xác, đưa ra cách tiếp cận phù hợp để chăm sóc bệnh nhân.
Từ khóa: Chụp cắt lớp quang học, stent, hội chứng mạch vành cấp, mảng xơ vữa.
Abstract
Optical Coherence Tomography (OCT) is an advanced imaging technology used for intravascular coronary examination. It greatly enhances our understanding and management of coronary artery disease, particularly in cases of acute coronary syndromes. By utilizing near-infrared light, OCT provides highly detailed images at the microscopic level. This allows for a comprehensive visualization of the structure of coronary artery lumens and the characteristics of atheromatous plaques. The effectiveness of OCT has been demonstrated in various trials, such as evaluating the deployment of coronary stents, assessing plaque morphology, and identifying high-risk features that may lead to in-stent thrombosis or plaque rupture. Furthermore, OCT plays a vital role in guiding decision-making before and during percutaneous coronary procedures, making it a significant advancement in contemporary interventional cardiology. The integration of OCT into coronary treatments represents a shift towards precision medicine, offering personalized strategies for patient care.
Keywords: Optical Coherence Tomography (OCT), stent, acute coronary syndrome, atherosclerotic plaque.
1.1 Giới thiệu
Chụp cắt lớp quang học (optical coherence tomography-OCT) là một kỹ thuật hình ảnh nội mạch sử dụng ánh sáng cận hồng ngoại. OCT cung cấp hình ảnh cắt ngang động mạch vành có độ phân giải cao (∼10 μm) và các đặc điểm mô học của mảng xơ vữa.[1,2] Do đó, OCT còn có thể xác định tình trạng của mảng xơ vữa như nứt vỡ, xói mòn hay có các nốt vôi hóa. Nhờ đó mà các bác sĩ có thể đưa ra được chiến lược điều trị tối ưu và tiên lượng khác nhau giữa các kiểu mảng xơ vữa này. Hơn nữa, OCT còn cung cấp các thông tin quan trọng về những mảng xơ vữa không ổn định như vỏ sợi mỏng, lõi lipid lớn, thâm nhiễm đại thực bào, tân vi mạch trong mảng xơ vữa, tinh thể cholesterol, mảng xơ vữa đã lành, xuất huyết trong mảng xơ vữa. OCT đã được chứng minh là có lợi ích trong việc chẩn đoán nhồi máu cơ tim không có tắc nghẽn (MINOCA) và xác định các đặc điểm mảng xơ vữa nguy cơ cao.[3,4] OCT cho chúng ta một cơ hội quý giá trong việc đánh giá sinh lý bệnh và chức năng của bệnh động mạch vành và diễn tiến tự nhiên của xơ vữa mạch vành trong bối cảnh lâm sàng.
1.2 Đặc điểm hình ảnh mảng xơ vữa trên chụp cắt lớp quang học
Những nghiên cứu kiểm định bằng mô học đã cho thấy OCT là công cụ quan trọng để xác định đặc điểm mô học của mảng xơ vữa.[5] Việc mô tả chi tiết động mạch vành bình thường và bệnh lý bằng OCT là khả thi nhờ hiểu được đặc điểm suy giảm quang học của các lớp mô mạch máu. Lớp nội mạc được đặc trưng là lớp tín hiệu cao nằm bên trong cùng, lớp trung mạc là lớp tín hiệu kém nằm ở giữa, và lớp ngoại mạc là lớp tín hiệu cao ở ngoài cùng.[6]
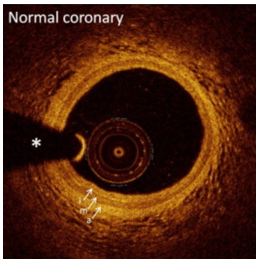
Hình 1. Động mạch vành bình thường. Hình ảnh OCT cắt ngang cho thấy cấu trúc 3 lớp của thành động mạch vành bình thường. a, Lớp áo ngoài; i, lớp nội mạc; m, lớp áo trong. Dấu hoa thị cho thấy ảnh giả của dây dẫn. (Nguồn: Ong, D. S., & Jang, I. K. (2015). Fundamentals of Optical Coherence Tomography: Image Acquisition and Interpretation. Interventional Cardiology Clinics, 4(3), 225-237.)[7]
Khi có mảng xơ vữa động mạch, cấu trúc 3 lớp của thành động mạch vành bình thường bị mất và lòng mạch có thể bị thu hẹp. Mảng xơ vữa có thể được phân loại theo thành phần mô của chúng và sự xuất hiện OCT của các mảng xơ sợi, giàu lipid và vôi hóa đã được xác nhận dựa trên các mẫu mô học tương ứng. Mô sợi xuất hiện trên hình ảnh OCT dưới dạng vùng đồng nhất có độ phản xạ cao với độ suy giảm tín hiệu thấp. Lipid xuất hiện dưới dạng một vùng đồng nhất có độ phản xạ thấp với độ suy giảm tín hiệu cao có thể hạn chế khả năng hiển thị các cấu trúc sâu hơn. Vôi hóa xuất hiện dưới dạng một vùng không đồng nhất có độ phản xạ cao hoặc thấp với độ suy giảm tín hiệu
thấp và đáng chú ý nhất là đường viền phân định rõ ràng. [7,8]
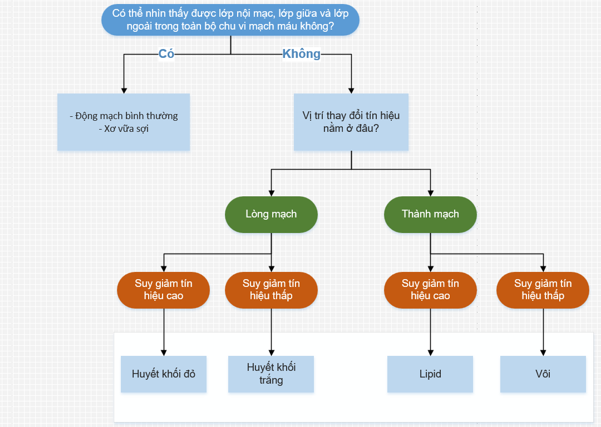
Hình 2. Sơ đồ tiếp cận đơn giản giải thích hình ảnh chụp cắt lớp kết hợp quang học ở động mạch vành chưa đặt stent. (Nguồn: Ali, Z. A., Karimi Galougahi, K., Maehara, A., Shlofmitz, R. A., Ben-Yehuda, O., Mintz, G. S., & Stone, G. W. (2017). Intracoronary optical coherence tomography 2018: current status and future directions. JACC: Cardiovascular Interventions, 10(24), 2473-2487.)[8]
Những định nghĩa trên OCT này có độ nhạy cao (từ 71 đến 96%) và độ đặc hiệu cao (từ 90 đến 98%) để đặc điểm của mảng xơ vữa và hình thành cơ sở cho việc diễn giải OCT.[9] Ngày nay, phần mềm OCT sử dụng trí tuệ nhân tạo cho phép phân tích tự động đặc điểm mảng xơ vữa và có độ chẩn đoán chính xác cao 98% (KTC 95% 93-99%) cho mảng xơ vữa sợi, 89% (KTC 95% 82-93%) cho vôi hóa, 91% (KTC 95% 85-94%) cho lipid.[10]
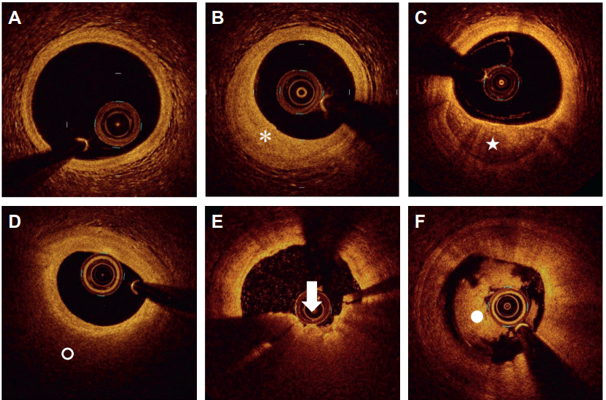
Hình 3. Hình ảnh xơ vữa động mạch vành trên chụp cắt lớp quang học. Hình A: Động mạch vành bình thường. Hình B: Mảng xơ vữa sợi (Dấu hoa thị). Hình C: Mảng xơ vữa vôi hóa. Hình D: Mảng xơ vữa giàu lipid (Hình tròn trắng). Hình E: Huyết khối đỏ (Mũi tên). Hình F: Huyết khối trắng (Chấm trắng). (Nguồn: Kubo, T. (2023). Interventional Cardiology Clinics, 12(2), 203-214.)
1.3 Đặc điểm sang thương thủ phạm trong hội chứng vành cấp
Hầu hết các biểu hiện hội chứng mạch vành cấp là do huyết khối mạch vành gây ra bởi một trong ba cơ chế bệnh lý cơ bản: vỡ mảng vữa xơ, xói mòn hoặc các nốt vôi hóa.[7] Các đặc điểm chính của định nghĩa bệnh lý về vỡ mảng vữa xơ, xói mòn và nốt vôi hóa đã được sử dụng để phát triển tiêu chí OCT cho chẩn đoán in vivo.
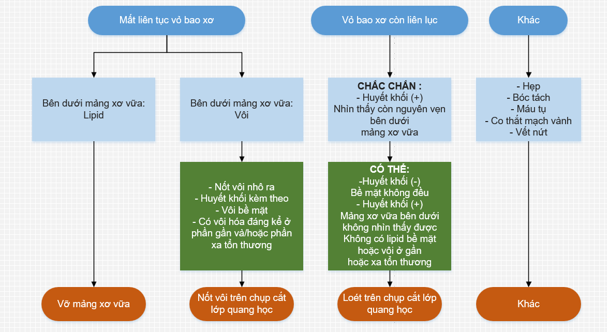
Hình 4. Lưu đồ phân loại tổn thương hội chứng mạch vành cấp trên chụp cắt lớp quang học. (Nguồn: Ong, D. S., & Jang, I. K. (2015). Fundamentals of Optical Coherence Tomography: Image Acquisition and Interpretation. Interventional Cardiology Clinics, 4(3), 225-237.)[7]
1.3.1 Vỡ mảng xơ vữa
Vỡ mảng xơ vữa (Plaque rupture) được phát hiện bằng OCT trong khoảng 40% các sang thương thủ phạm trong hội chứng mạch vành cấp (Acute coronary syndrome – ACS). Vỡ mảng xơ vữa được xác định bằng sự mất liên tục của vỏ sợi với một khoảng trống được hình thành trong lòng của mảng xơ vữa. Mảng xơ vữa bị vỡ thường có vỏ sợi mỏng, giàu lipid, thâm nhiễm đại thực bào, tinh thể cholesterol và vôi hóa điểm (cung canxi nhỏ hơn 90 độ).[11]
Vỡ mảng xơ vữa còn liên quan đến kết quả can thiệp mạch vành qua da xấu hơn (như dòng chảy chậm, không có dòng chảy, thuyên tắc xa, sự nhô ra của mô không đều sau khi đặt stent) và kết cục lâm sàng dài hạn xấu.[12] Ngoài ra, những bệnh nhân ACS do vỡ mảng xơ vữa sẽ tăng nguy cơ ACS sau đó do các mảng xơ vữa ở vị trí khác.
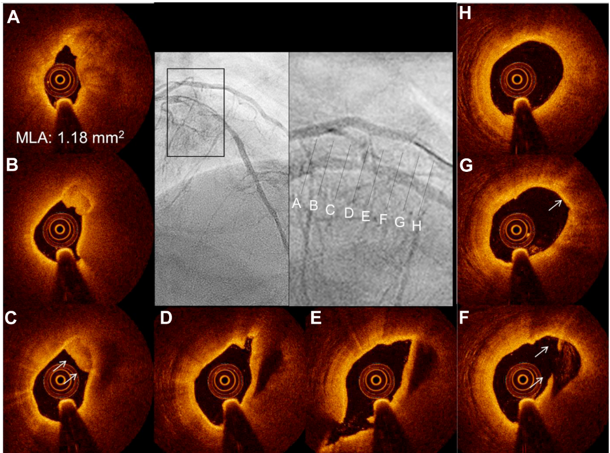
Hình 5. Nhồi máu cơ tim ST chênh lên do vỡ mảng xơ vữa cho thấy hẹp động mạch vành xuống trước trái (hình trung tâm). Hình ảnh chụp cắt lớp quang học cắt ngang động mạch vành từ đầu gần đến đầu xa của sang thương thủ phạm sau khi hút huyết khối (A) thiết diện lòng mạch nhỏ nhất (MLA), trong vùng lõi hoại tử có kèm huyết khối trắng (B, C), (D , E) miệng hố trống do vỡ mảng xơ vữa, (F) vỡ xơ vữa động mạch với vỏ bao mỏng (mũi tên), ( G ) Vỏ bao xơ mỏng còn nguyên vẹn (mũi tên), và ( H ) mảng xơ vữa lipid chưa bị vỡ . (Nguồn: Intracoronary optical coherence tomography 2018: current status and future directions. JACC: Cardiovascular Interventions, 10(24), 2473-2487.)
1.3.2 Xói mòn mảng xơ vữa
Hình ảnh xói mòn mảng xơ vữa (Plaque erosion) được xác định trên OCT trong khoảng 30% sang thương thủ phạm gây ACS. Xói mòn mảng xơ vữa biểu hiện với sự hiện diện của huyết khối bám thành trên nền mảng xơ vữa còn nguyên vẹn và có thể nhìn thấy được bề mặt của lòng mạch không đều ở tổn thương thủ phạm, hoặc bề mặt không đều và không có huyết khối hoặc sự giảm đậm độ của mảng xơ vữa do huyết khối mà không có lớp lipid hay vôi hóa ngay phía trước hoặc sau của mảng xơ vữa.[13]
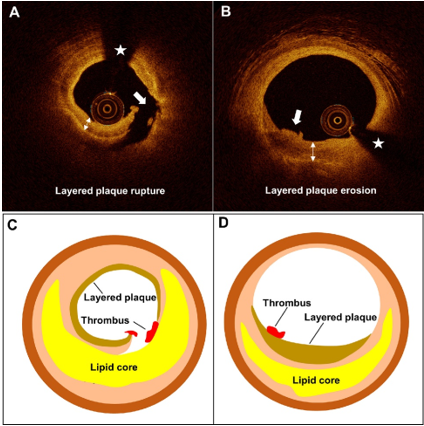
Hình 6. Mảng xơ vữa tại vị trí sang thương thủ phạm. Hình ảnh chụp cắt lớp quang học đại diện và sơ đồ tương ứng về vỡ mảng vữa xơ (A và C) và xói mòn mảng vữa xơ (B và D). Mũi tên trắng hai đầu tượng trưng cho mảng vữa xơ. Mũi tên trắng một đầu đánh dấu vị trí bị vỡ và t xói mòn. Dấu hoa thị đại diện cho ảnh giả do dây dẫn. (Nguồn: Yin, Y., Fang, C., Jiang, S., Wang, J., Wang, Y., Guo, J., … & Yu, B. (2022). Optical coherence tomographic features of pancoronary plaques in patients with acute myocardial infarction caused by layered plaque rupture versus layered plaque erosion. The American Journal of Cardiology, 167, 35-42.)[14]
Kết quả của can thiệp mạch vành qua da trong giai đoạn cấp tốt hơn đối với xói mòn mảng xơ vữa so với vỡ mảng xơ vữa.[15] Tiên lượng dài hạn sau can thiệp mạch vành qua da cũng tốt hơn ở nhóm bệnh nhân có xói mòn mảng xơ vữa so với nhóm vỡ mảng xơ vữa. Niccoli và cộng sự ghi nhận rằng tỷ lệ xuất hiện các biến cố tim mạch chính (major adverse cardiovascular event-MACE) (là kết cục gộp của tử vong do tim mạch và nhồi máu cơ tim không tử vong) trong vòng 32 tháng theo dõi sau can thiệp mạch vành qua da thấp hơn một cách có ý nghĩa ở nhóm xói mòn so với nhóm vỡ mảng xơ vữa (14% với 39%, p=0,001).[16] Yonetsu và cộng sự ghi nhận tỷ lệ MACE (kết cục gộp của tử vong, nhồi máu cơ tim, tái can thiệp, suy tim phải nhập viện) trong 21 tháng theo dõi sau CTMVQD thấp hơn một cách có ý nghĩa ở những bệnh nhân có sang thương xói mòn so với vỡ mảng xơ vữa (22% với 36%, p=0,012).[17]
1.3.3 Nốt vôi hóa
Nốt vôi hóa được xác định bằng OCT khoảng 10% trên các mảng xơ vữa thủ phạm. Nốt vôi hóa là hình ảnh gián đoạn vỏ bao sợi trên bề mặt mảng vôi hóa đặc trưng bởi sợi calci, vôi hóa bề mặt hoặc sự hiện diện của vôi hóa tại đoạn gần và/hoặc xa của mảng xơ vữa.[13] Nốt vôi hóa thường gặp trên bệnh nhân ACS lớn tuổi, nữ giới, đái tháo đường, suy thận mạn đã được lọc máu.[18] Nốt vôi hóa thường nằm gần lỗ xuất phát và ở đoạn giữa động mạch vành phải (right coronary artery-RCA) và thường liên quan đến vôi hóa nặng và chuyển động theo kiểu bản lề của mạch máu.[19] Nốt vôi hóa làm gia tăng nguy cơ stent không thể nở trọn.[20] Tiên lượng dài hạn can thiệp mạch vành qua da trên sang thương mạch vành có nốt vôi hóa vẫn chưa được làm sáng tỏ. Một số nghiên cứu gần đây đã báo cáo các nốt vôi hóa có thể nhô vào trong lòng khung stent sớm sau can thiệp mạch vành qua da và gây nên huyết khối trong stent hoặc tái hẹp.[21,22]
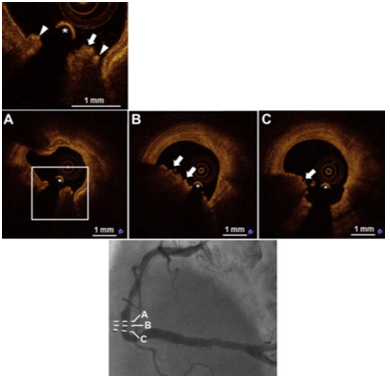
Hình 7. Nốt vôi hóa trên chụp cắt lớp quang học ở một bệnh nhân nam 75 tuổi, hút thuốc bị đau thắt ngực không ổn định. Chụp động mạch vành (hình dưới) cho thấy một tổn thương phức tạp ở phần xa của động mạch vành phải. Chụp cắt lớp quang học (OCT) cho thấy nốt vôi hóa (A) nhô vào trong lòng qua vỏ bao sợi bị vỡ (đầu mũi tên) với huyết khối đỏ (B và C, mũi tên) tại vị trí bị vỡ. Dấu hoa thị (∗): Dây dẫn. (Nguồn: Jia, H., Abtahian, F., Aguirre, A. D., Lee, S., Chia, S., Lowe, H., … & Jang, I. K. (2013). In vivo diagnosis of plaque erosion and calcified nodule in patients with acute coronary syndrome by intravascular optical coherence tomography. Journal of the American College of Cardiology, 62(19), 1748-1758.)[23]
1.3.4 Bóc tách động mạch vành tự phát
Bóc tách động mạch vành tự phát (Spontaneous Coronary Artery Dissection – SCAD) được định nghĩa là sự tách rời thành động mạch vành (không do chấn thương và không gây ra do thuốc) do xuất huyết trong thành và tạo ra lòng giả. Mặt phẳng bóc tách có thể xảy ra ở giữa lớp nội mạc-lớp giữa hoặc lớp giữa- lớp áo ngoài và không cần phải có vạt bóc tách nội mạc.[24] Tụ máu trong thành (Intraluminal hemorrhage – IMH) gây ra có thể làm tắc hoặc tổn thương lòng mạch thực sự dẫn đến thiếu máu cục bộ cơ tim và nhồi máu. SCAD là một nguyên nhân gây nên ACS không xơ vữa và phát hiện trong 4% các trường hợp ACS bằng OCT.[25] Trên hình ảnh chụp mạch vành nghi ngờ SCAD với tắc nghẽn nhưng dòng chảy bình thường, OCT được khuyến cáo sử dụng nhằm chẩn đoán và định hướng điều.[26] OCT có thể xác định lòng thật, lòng giả, mảng nội mạc, đường vào, lỗ vào và tụ máu. Tuy nhiên, kỹ thuật OCT cần phải bơm thuốc tương phản nên có thể gia tăng áp lực nội mạch một cách đáng kể (9±2 mmHg trong kỳ tâm thu).[27] và có thể làm lan rộng tổn thương của SCAD.[6]
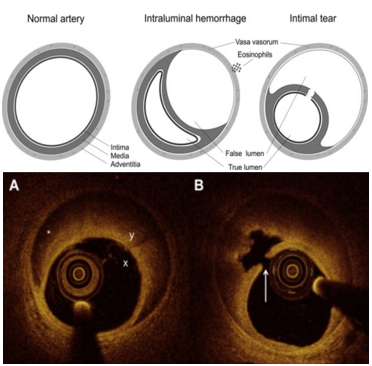
Hình 8. Sơ đồ (hình trên) và hình ảnh chụp cắt lớp quang học (bên dưới) minh họa cơ chế bóc tách động mạch vành tự phát. Hình ảnh chụp cắt lớp quang học hiển thị (A) tụ máu trong thành (dấu hoa thị) và lòng đôi (x = lòng thật và y = lòng giả) và (B) rách nội mạc (mũi tên). (Nguồn: Franco, C., Eng, L., & Saw, J. (2015). Optical Coherence Tomography in the Diagnosis and Management of Spontaneous Coronary Artery Dissection. Interventional Cardiology Clinics, 4(3), 309-320.)[28]
1.3.5 Mảng xơ vữa dễ tổn thương
OCT có thể đánh giá các đặc điểm hình thái của mảng xơ vữa không ổn định. OCT cũng có thể xác định mảng xơ vữa có vỏ xơ bao quanh mỏng (TCFA) với bề dày của mũ sợi nhỏ hơn 65 µm, là tổn thương tiềm tàng khả năng nứt vỡ. Những nghiên cứu kiểm định dựa trên giải phẫu bệnh đã cho thấy OCT có khả năng đo chính xác bề dày của mũ sợi trên lớp lõi lipid.[29] Kích thước của lõi lipid có thể đo bằng cách đo góc của lipid trên mặt phẳng cắt ngang (được gọi là cung lipid). Mảng xơ vữa giàu lipid (lipid-rich plaque-LRP) được định nghĩa là cung tối đa của lipid lớn hơn 90 độ (hoặc >180 độ). TCFA và LRP đánh giá bằng OCT có mối tương quan tốt với các mảng xơ vữa giảm đậm độ trên IVUS, mảng xơ vữa tăng sắc vàng trên nội soi nội mạch, mảng xơ vữa đậm độ thấp trên cắt lớp vi tính mạch vành, tương quan vừa với TCFA được xác định bằng mô bệnh học IVUS và chỉ số gánh nặng lõi lipid.[30]
OCT cho phép đánh giá một số cấu trúc vi thể của mảng xơ vữa không ổn định mà trước đây chỉ được đánh giá bằng mô bệnh học. Thâm nhiễm đại thực bào là hình ảnh tín hiệu cao, riêng biệt hoặc vùng hợp lưu với sự suy giảm tín hiệu nhanh chóng. Thâm nhiễm đại thực bào thường được thấy ở ranh giới giữa phần dưới của nắp sợi và phía trên lõi lipid. Bệnh nhân ACS gây ra bởi vỡ mảng xơ vữa thường có mật độ đại thực bào cao không chỉ tại sang thương thủ phạm mà còn ở những sang thương khác.[31]
Hệ tân vi mạch trong mảng xơ vữa (vasa vasorum) là những cấu trúc có lòng tín hiệu thấp nằm trong mảng xơ vữa và thường có thể quan sát trên nhiều khung hình liền kề. Sự hình thành vi mạch trong mảng xơ vữa có liên quan đến gánh nặng mảng xơ vữa.[32]
Tinh thể cholesterol là những cấu trúc mỏng, dạng đường thẳng, tín hiệu cao và không có sự giảm tín hiệu. Một nghiên cứu kiểm định dựa trên mô học cho thấy OCT có độ nhạy là 68% và độ đặc hiệu là 92% trong phát hiện tinh thể cholesterol.[33] Tinh thể cholesterol thường được phát hiện trong các sang thương thủ phạm ACS với vỡ mảng xơ vữa và thường liên quan đến mủ sợi mỏng và cung lipid lớn.[34]
Mảng xơ vữa đã lành, được hình thành do sự vỡ âm thầm của mảng xơ vữa vừa tự lành hoặc xói mòn và hình thành huyết khối một cách âm thầm không biểu hiện triệu chứng lâm sàng: là những mảng xơ vữa có nhiều lớp trên hình ảnh OCT. Mảng xơ vữa đã lành là một lớp giàu tín hiệu không đồng nhất từ các lớp có cường độ quang học khác nhau nằm gần lòng của mạch máu với giới hạn rõ. Nghiên cứu kiểm định dựa trên mô học ghi nhận OCT có độ nhạy 81% và độ đặc hiệu 98% trong phát hiện các mảng xơ vữa đã lành.[35] Mảng xơ vữa đã lành liên quan đến hẹp lòng mạch, mũ sợi mỏng, LRP, tích tụ đại thực bào, vi mạch trong mảng xơ vữa, vôi hóa điểm.[36] Những nghiên cứu gần đây cho thấy bệnh nhân ACS với mảng xơ vữa nhiều lớp ở sang thương thủ phạm sẽ có nguy cơ tim mạch, gia tăng các chỉ dấu sinh học của đáp ứng viêm hệ thống, bệnh nhiều nhánh, hình ảnh chụp mạch vành phức tạp và tỷ lệ MACE cao hơn.[37-40]
Xuất huyết trong mảng xơ vữa là những vùng tín hiệu thấp đồng nhất. Xuất huyết trong mảng xơ vữa có sự xuất hiện khác nhau phụ thuộc và thời gian xảy ra xuất huyết và có thể bị che giấu bởi lõi hoại tử tiến triển bởi sự giảm tín hiệu. Vùng xuất huyết thường tập trung các tinh thể cholesterol (82%).[41] Xuất huyết trong mảng xơ vữa có thể làm gia tăng sự tiến triển của mảng xơ vữa, hẹp lòng mạch và làm mất ổn định.
Ngoài ra, OCT có thể dự báo sự tiến triển của mảng xơ vữa[42-45], và giúp xác định những bệnh nhân dễ tổn thương bằng cách đánh giá các sang thương không phải thủ phạm.[46-49]
1.4 Các hướng dẫn hiện hành
Sự ra đời của hình ảnh nội mạch là một tiến bộ đáng kể trong việc hình dung các động mạch vành, đặc biệt là với chụp cắt lớp quang học cho phép chụp ảnh các cấu trúc mạch vành trong và xuyên thành với độ phân giải cao. OCT có nhiều vai trò trong thực hành lâm sàng như đánh giá diễn biến tự nhiên của mảng xơ vữa và điều chỉnh các biện pháp điều trị, giải thích được cơ chế của hội chứng mạch vành cấp tính, hiểu biết cơ học về tác dụng của các thiết bị can thiệp mới và tối ưu hóa can thiệp mạch vành qua da.
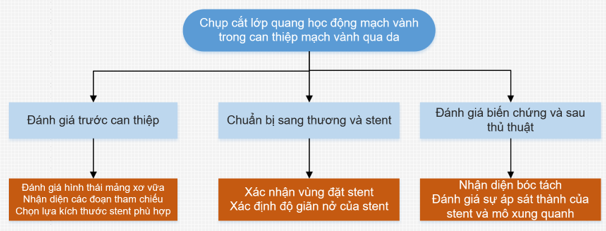
Hình 9. Chụp cắt lớp quang học giúp tối ưu hóa và hướng dẫn can thiệp mạch vành qua da. (Nguồn: Ali, Z. A., Karimi Galougahi, K., Maehara, A., Shlofmitz, R. A., Ben-Yehuda, O., Mintz, G. S., & Stone, G. W. (2017). Intracoronary optical coherence tomography 2018: current status and future directions. JACC: Cardiovascular Interventions, 10(24), 2473-2487.)
Theo hướng dẫn điều trị tái tưới máu của Trường môn Tim mạch Hoa Kỳ (American College of Cardiology-ACC)/Hội tim mạch Hoa Kỳ (American Heart Association-AHA) năm 2021 đã đưa ra khuyến cáo mức IIa cho việc sử dụng hình ảnh học nội mạch hướng dẫn CTMVQD.[50] Cụ thể, hướng dẫn khuyến cáo rằng OCT có thể là một phương tiện thay thế cho IVUS, ngoại trừ trong trường hợp bệnh lý tại lỗ xuất phát thân chung động mạch vành trái (ostial left main disease) (COR IIa, LOE B-R). Hướng dẫn này cũng khuyến cáo sử dụng IVUS hoặc OCT để xác định cơ chế thất bại của stent (COR IIa, LOE C-LD).[50] Một đồng thuận được công bố gần đây của ACC và Hội đồng Tim mạch can thiệp (2023) ủng hộ hình ảnh nội mạch nên được đưa vào tất cả các phòng thông tim trên toàn Hoa Kỳ nhằm chuẩn hóa và tăng giá trị của chụp mạch vành cổ điển.[51]
Hướng dẫn về tái tưới máu năm 2018 của Hội tim mạch châu Âu (European Society of Cardiology-ESC), IVUS hoặc OCT cũng nên được xem xét ở những bệnh nhân được chọn lọc nhằm tối ưu hóa việc đặt stent (COR IIa, LOE B) và phát hiện những vấn đề cơ học liên quan đến stent dẫn đến tái hẹp trong stent (COR IIa, LOE C).[52] Trong hướng dẫn về hội chứng vành cấp của ESC năm 2020, khuyến cáo sử dụng hình ảnh nội mạch cho chẩn đoán những trường hợp nghi ngờ bóc tách mạch vành tự phát.[51]
1.5 Kết luận
Hình ảnh chụp cắt lớp quang học là một phương tiện hỗ trợ vô cùng quang trọng trong thực hành lâm sàng như góp phần làm sáng tỏ đặc điểm cơ chế bệnh học, hỗ trợ đưa ra các chiến lược điều trị phù hợp cũng như đánh giá sau can thiệp. Bên cạnh đó phương pháp này cũng cung cấp nhiều thông tin trong tiên lượng cho người bệnh. Mặc dù còn vài hạn chế, song giá trị của chụp cắt lớp quang học rất lớn trong bệnh động mạch vành nói chung và hội chứng mạch vành cấp nói riêng.
Tài liệu tham khảo
- Tearney GJ, Regar E, Akasaka T, et al. Consensus standards for acquisition, measurement, and reporting of intravascular optical coherence tomography studies: a report from the International Working Group for Intravascular Optical Coherence Tomography Standardization and Validation. J Am Coll Cardiol. Mar 20 2012;59(12):1058-72. doi:10.1016/j.jacc.2011.09.079
- Li J, Montarello NJ, Hoogendoorn A, et al. Multimodality intravascular imaging of high-risk coronary plaque. Cardiovascular Imaging. 2022;15(1):145-159.
- Ya’Qoub L, Elgendy IY, Pepine CJ. Non-obstructive Plaque and Treatment of INOCA: More to Be Learned. Curr Atheroscler Rep. Sep 2022;24(9):681-687. doi:10.1007/s11883-022-01044-4
- Ya’qoub L, Elgendy IY, Pepine CJ. Syndrome of Nonobstructive Coronary Artery Diseases: A Comprehensive Overview of Open Artery Ischemia. Am J Med. Nov 2021;134(11):1321-1329. doi:10.1016/j.amjmed.2021.06.038
- Fujii K, Kubo T, Otake H, et al. Expert consensus statement for quantitative measurement and morphological assessment of optical coherence tomography: update 2022. Cardiovasc Interv Ther. Apr 2022;37(2):248-254. doi:10.1007/s12928-022-00845-3
- Kubo T. Optical Coherence Tomography in Vulnerable Plaque and Acute Coronary Syndrome. Interventional Cardiology Clinics. 2023;12(2):203-214.
- Ong DS, Jang I-K. Fundamentals of Optical Coherence Tomography: Image Acquisition and Interpretation. Interventional Cardiology Clinics. 2015;4(3):225-237.
- Dakroub A, Chau K, Mathew R, et al. Utility of optical coherence tomography in acute coronary syndromes. Catheterization and Cardiovascular Interventions: Official Journal of the Society for Cardiac Angiography & Interventions. 2023;
- Yabushita H, Bouma BE, Houser SL, et al. Characterization of human atherosclerosis by optical coherence tomography. Circulation. Sep 24 2002;106(13):1640-5. doi:10.1161/01.cir.0000029927.92825.f6
- Chu M, Jia H, Gutiérrez-Chico JL, et al. Artificial intelligence and optical coherence tomography for the automatic characterisation of human atherosclerotic plaques. EuroIntervention. May 17 2021;17(1):41-50. doi:10.4244/eij-d-20-01355
- Mizukoshi M, Kubo T, Takarada S, et al. Coronary superficial and spotty calcium deposits in culprit coronary lesions of acute coronary syndrome as determined by optical coherence tomography. Am J Cardiol. Jul 1 2013;112(1):34-40. doi:10.1016/j.amjcard.2013.02.048
- Soeda T, Uemura S, Park SJ, et al. Incidence and Clinical Significance of Poststent Optical Coherence Tomography Findings: One-Year Follow-Up Study From a Multicenter Registry. Circulation. Sep 15 2015;132(11):1020-9. doi:10.1161/circulationaha.114.014704
- Jia H, Abtahian F, Aguirre AD, et al. In vivo diagnosis of plaque erosion and calcified nodule in patients with acute coronary syndrome by intravascular optical coherence tomography. J Am Coll Cardiol. Nov 5 2013;62(19):1748-58. doi:10.1016/j.jacc.2013.05.071
- Yin Y, Fang C, Jiang S, et al. Optical coherence tomographic features of pancoronary plaques in patients with acute myocardial infarction caused by layered plaque rupture versus layered plaque erosion. The American Journal of Cardiology. 2022;167:35-42.
- Higuma T, Soeda T, Abe N, et al. A Combined Optical Coherence Tomography and Intravascular Ultrasound Study on Plaque Rupture, Plaque Erosion, and Calcified Nodule in Patients With ST-Segment Elevation Myocardial Infarction: Incidence, Morphologic Characteristics, and Outcomes After Percutaneous Coronary Intervention. JACC Cardiovasc Interv. Aug 17 2015;8(9):1166-1176. doi:10.1016/j.jcin.2015.02.026
- Niccoli G, Montone RA, Di Vito L, et al. Plaque rupture and intact fibrous cap assessed by optical coherence tomography portend different outcomes in patients with acute coronary syndrome. Eur Heart J. Jun 7 2015;36(22):1377-84. doi:10.1093/eurheartj/ehv029
- Yonetsu T, Lee T, Murai T, et al. Plaque morphologies and the clinical prognosis of acute coronary syndrome caused by lesions with intact fibrous cap diagnosed by optical coherence tomography. Int J Cardiol. Jan 15 2016;203:766-74. doi:10.1016/j.ijcard.2015.11.030
- Ijichi T, Nakazawa G, Torii S, et al. Evaluation of coronary arterial calcification – Ex-vivo assessment by optical frequency domain imaging. Atherosclerosis. Nov 2015;243(1):242-7. doi:10.1016/j.atherosclerosis.2015.09.002
- Lee T, Mintz GS, Matsumura M, et al. Prevalence, Predictors, and Clinical Presentation of a Calcified Nodule as Assessed by Optical Coherence Tomography. JACC Cardiovasc Imaging. Aug 2017;10(8):883-891. doi:10.1016/j.jcmg.2017.05.013
- Khalifa AKM, Kubo T, Ino Y, et al. Optical Coherence Tomography Comparison of Percutaneous Coronary Intervention Among Plaque Rupture, Erosion, and Calcified Nodule in Acute Myocardial Infarction. Circ J. May 25 2020;84(6):911-916. doi:10.1253/circj.CJ-20-0014
- Mori H, Finn AV, Atkinson JB, Lutter C, Narula J, Virmani R. Calcified Nodule: An Early and Late Cause of In-Stent Failure. JACC Cardiovasc Interv. Jul 11 2016;9(13):e125-6. doi:10.1016/j.jcin.2016.03.036
- Nakamura N, Torii S, Tsuchiya H, et al. Formation of Calcified Nodule as a Cause of Early In-Stent Restenosis in Patients Undergoing Dialysis. J Am Heart Assoc. Oct 20 2020;9(19):e016595. doi:10.1161/jaha.120.016595
- Jia H, Abtahian F, Aguirre AD, et al. In vivo diagnosis of plaque erosion and calcified nodule in patients with acute coronary syndrome by intravascular optical coherence tomography. Journal of the American College of Cardiology. 2013;62(19):1748-1758.
- Reynolds HR. Mechanisms of myocardial infarction without obstructive coronary artery disease. Trends in cardiovascular medicine. 2014;24(4):170-176.
- Nishiguchi T, Tanaka A, Ozaki Y, et al. Prevalence of spontaneous coronary artery dissection in patients with acute coronary syndrome. Eur Heart J Acute Cardiovasc Care. Jun 2016;5(3):263-70. doi:10.1177/2048872613504310
- Collet JP, Thiele H, Barbato E, et al. 2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Rev Esp Cardiol (Engl Ed). Jun 2021;74(6):544. doi:10.1016/j.rec.2021.05.002
- Shimamura K, Kubo T, Ino Y, et al. Intracoronary pressure increase due to contrast injection for optical coherence tomography imaging. J Cardiol. Mar 2020;75(3):296-301. doi:10.1016/j.jjcc.2019.08.008
- Franco C, Eng L, Saw J. Optical Coherence Tomography in the Diagnosis and Management of Spontaneous Coronary Artery Dissection. Interventional Cardiology Clinics. 2015;4(3):309-320.
- Kume T, Akasaka T, Kawamoto T, et al. Measurement of the thickness of the fibrous cap by optical coherence tomography. Am Heart J. Oct 2006;152(4):755.e1-4. doi:10.1016/j.ahj.2006.06.030
- Araki M, Soeda T, Kim HO, et al. Spatial Distribution of Vulnerable Plaques: Comprehensive In Vivo Coronary Plaque Mapping. JACC Cardiovasc Imaging. Sep 2020;13(9):1989-1999. doi:10.1016/j.jcmg.2020.01.013
- MacNeill BD, Jang IK, Bouma BE, et al. Focal and multi-focal plaque macrophage distributions in patients with acute and stable presentations of coronary artery disease. J Am Coll Cardiol. Sep 1 2004;44(5):972-9. doi:10.1016/j.jacc.2004.05.066
- Taruya A, Tanaka A, Nishiguchi T, et al. Vasa Vasorum Restructuring in Human Atherosclerotic Plaque Vulnerability: A Clinical Optical Coherence Tomography Study. J Am Coll Cardiol. Jun 16 2015;65(23):2469-77. doi:10.1016/j.jacc.2015.04.020
- Katayama Y, Tanaka A, Taruya A, et al. Feasibility and Clinical Significance of In Vivo Cholesterol Crystal Detection Using Optical Coherence Tomography. Arterioscler Thromb Vasc Biol. Jan 2020;40(1):220-229. doi:10.1161/atvbaha.119.312934
- Kataoka Y, Puri R, Hammadah M, et al. Cholesterol crystals associate with coronary plaque vulnerability in vivo. J Am Coll Cardiol. Feb 17 2015;65(6):630-2. doi:10.1016/j.jacc.2014.11.039
- Shimokado A, Matsuo Y, Kubo T, et al. In vivo optical coherence tomography imaging and histopathology of healed coronary plaques. Atherosclerosis. Aug 2018;275:35-42. doi:10.1016/j.atherosclerosis.2018.05.025
- Usui E, Mintz GS, Lee T, et al. Prognostic impact of healed coronary plaque in non-culprit lesions assessed by optical coherence tomography. Atherosclerosis. Sep 2020;309:1-7. doi:10.1016/j.atherosclerosis.2020.07.005
- Fracassi F, Crea F, Sugiyama T, et al. Healed Culprit Plaques in Patients With Acute Coronary Syndromes. J Am Coll Cardiol. May 14 2019;73(18):2253-2263. doi:10.1016/j.jacc.2018.10.093
- Russo M, Kim HO, Kurihara O, et al. Characteristics of non-culprit plaques in acute coronary syndrome patients with layered culprit plaque. Eur Heart J Cardiovasc Imaging. Dec 1 2020;21(12):1421-1430. doi:10.1093/ehjci/jez308
- Okamoto H, Kume T, Yamada R, et al. Prevalence and Clinical Significance of Layered Plaque in Patients With Stable Angina Pectoris - Evaluation With Histopathology and Optical Coherence Tomography. Circ J. Nov 25 2019;83(12):2452-2459. doi:10.1253/circj.CJ-19-0640
- Kurihara O, Russo M, Kim HO, et al. Clinical significance of healed plaque detected by optical coherence tomography: a 2-year follow-up study. J Thromb Thrombolysis. Nov 2020;50(4):895-902. doi:10.1007/s11239-020-02076-w
- Usui E, Matsumura M, Mintz GS, et al. Clinical outcomes of low-intensity area without attenuation and cholesterol crystals in non-culprit lesions assessed by optical coherence tomography. Atherosclerosis. Sep 2021;332:41-47. doi:10.1016/j.atherosclerosis.2021.08.003
- Uemura S, Ishigami K, Soeda T, et al. Thin-cap fibroatheroma and microchannel findings in optical coherence tomography correlate with subsequent progression of coronary atheromatous plaques. Eur Heart J. Jan 2012;33(1):78-85. doi:10.1093/eurheartj/ehr284
- Araki M, Yonetsu T, Kurihara O, et al. Predictors of Rapid Plaque Progression: An Optical Coherence Tomography Study. JACC Cardiovasc Imaging. Aug 2021;14(8):1628-1638. doi:10.1016/j.jcmg.2020.08.014
- Yamamoto MH, Yamashita K, Matsumura M, et al. Serial 3-Vessel Optical Coherence Tomography and Intravascular Ultrasound Analysis of Changing Morphologies Associated With Lesion Progression in Patients With Stable Angina Pectoris. Circ Cardiovasc Imaging. Sep 2017;10(9)doi:10.1161/circimaging.117.006347
- Xie Z, Hou J, Yu H, et al. Patterns of coronary plaque progression: phasic versus gradual. A combined optical coherence tomography and intravascular ultrasound study. Coron Artery Dis. Dec 2016;27(8):658-666. doi:10.1097/mca.0000000000000420
- Xing L, Higuma T, Wang Z, et al. Clinical Significance of Lipid-Rich Plaque Detected by Optical Coherence Tomography: A 4-Year Follow-Up Study. J Am Coll Cardiol. May 23 2017;69(20):2502-2513. doi:10.1016/j.jacc.2017.03.556
- Prati F, Romagnoli E, Gatto L, et al. Relationship between coronary plaque morphology of the left anterior descending artery and 12 months clinical outcome: the CLIMA study. Eur Heart J. Jan 14 2020;41(3):383-391. doi:10.1093/eurheartj/ehz520
- Prati F, Gatto L, Fabbiocchi F, et al. Clinical outcomes of calcified nodules detected by optical coherence tomography: a sub-analysis of the CLIMA study. EuroIntervention. Aug 28 2020;16(5):380-386. doi:10.4244/eij-d-19-01120
- Akasaka T, Kubo T. OCT-derived coronary calcified nodules as a predictor of high-risk patients. EuroIntervention. Aug 28 2020;16(5):361-363. doi:10.4244/eijv16i5a65
- Lawton JS, Tamis-Holland JE, Bangalore S, et al. 2021 ACC/AHA/SCAI Guideline for Coronary Artery Revascularization: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Journal of the American College of Cardiology. 2022/01/18/ 2022;79(2):e21-e129. doi:https://doi.org/10.1016/j.jacc.2021.09.006
- Truesdell AG, Alasnag MA, Kaul P, et al. Intravascular Imaging During Percutaneous Coronary Intervention: JACC State-of-the-Art Review. J Am Coll Cardiol. Feb 14 2023;81(6):590-605. doi:10.1016/j.jacc.2022.11.045
- Sousa-Uva M, Neumann FJ, Ahlsson A, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur J Cardiothorac Surg. Jan 1 2019;55(1):4-90. doi:10.1093/ejcts/ezy289







