Trưởng ban: PGS.TS. PHẠM NGUYỄN VINH
Tham gia biên soạn: PGS.TS. HỒ HUỲNH QUANG TRÍ,
TS.BS. TRẦN VŨ MINH THƯ, BS CKII. LÊ THỊ ĐẸP,
BS CKII. TRẦN THỊ TUYẾT LAN, ThS.BS. HUỲNH THANH KIỀU,
ThS.BS. PHẠM ĐỖ ANH THƯ, BS CKI. PHẠM THỤC MINH THỦY
Biên tập: LƯƠNG BÍCH NHUNG, TRẦN THỊ THANH NGA
(…)
9.2. Chẩn đoán
9.2.1. Triệu chứng lâm sàng:
Triệu chứng lâm sàng của hẹp van động mạch chủ (ĐMC) gồm cơn đau thắt ngực (60%), khó thở khi gắng sức (90%), xây xẩm hoặc ngất (35%).
Khám lâm sàng trong hẹp van ĐMC có mạch nhỏ và chậm trễ (Pulsus parvus and tardus). Nghe tim có âm thổi tâm thu dạng quả trám ở liên sườn hai bờ phải xương ức lan lên cổ. Tiếng T1 bình thường, T2 bình thường hoặc tách đôi đảo ngược.
9.2.2. Các cận lâm sàng cần làm trong chẩn đoán hẹp van ĐMC
9.2.2.1. Điện tâm đồ
Có hình ảnh dày thất trái, tăng gánh tâm thu thất trái. Một số trường hợp hẹp van ĐMC nặng nhưng ECG bình thường như ở người già, cơ tim sợi hóa. Chống chỉ định làm trắc nghiệm gắng sức ở bệnh nhân hẹp van ĐMC nặng.
9.2.2.2. X-quang tim phổi: có thể thấy hình ảnh dày thất trái.
9.2.2.3. Siêu âm tim
Giúp chẩn đoán xác định hẹp van, độ nặng, cơ chế, tình trạng lá van và ảnh hưởng huyết động lên tim như kích thước buồng tim, phân xuất tống máu thất trái, áp lực động mạch phổi và các tổn thương kết hợp khác.
Chỉ định siêu âm tim khi bệnh nhân có thay đổi triệu chứng, có mắc bệnh nội khoa cấp tính khác (ví dụ: nhiễm trùng, thiếu máu, xuất huyết tiêu hóa,..), có thai, trước phẫu thuật ngoài tim, hoặc làm định kỳ mỗi năm ở bệnh nhân hẹp van ĐMC mức độ trung bình đến nặng.
9.2.2.4. Trắc nghiệm gắng sức bằng thảm lăn hoặc xe đạp
Bệnh nhân hẹp van ĐMC nặng không triệu chứng (giai đoạn C1) có thể làm trắc nghiệm gắng sức để đánh giá những thay đổi sinh lý và xác định thật sự không có triệu chứng cơ năng (loại IIa, MCC B). Chỉ định này thường áp dụng cho bệnh nhân có triệu chứng mơ hồ, người lớn tuổi ít vận động nên khó đánh giá triệu chứng cơ năng. Khi gắng sức nếu triệu chứng đau ngực, khó thở, tụt huyết áp xảy ra, người bệnh có chỉ định điều trị can thiệp van ĐMC.
Chống chỉ định làm trắc nghiệm gắng sức ở bệnh nhân hẹp chủ nặng, có triệu chứng (giai đoạn D1) do có nguy cơ ảnh hưởng huyết động nặng (loại III, MCC B). Các biến chứng khi làm gắng sức có thể là ngất, nhịp nhanh thất và tử vong.
9.2.2.5. Siêu âm tim gắng sức Dobutamin liều thấp
Bệnh nhân hẹp van ĐMC nặng, chênh áp lực ngang van thấp, phân suất tống máu giảm (cung lượng tim thấp, phân suất tống máu thấp) cần được làm siêu âm dobutamine liều thấp (Hình 2) để xác định hẹp van ĐMC nặng thật sự hay giả hẹp van nặng; và đánh giá dự trữ co bóp thất trái.
Bệnh nhân được truyền dobutamine liều khởi đầu 2.5 – 5.0 mcg/kg/phút, tăng liều mỗi 3 – 5 phút, mỗi lần tăng 2.5 – 5.0 mcg/kg/ph, liều tối đa là 10 – 20 mcg/kg/phút. Trong mỗi mức liều mỗi 3 – 5 phút, bệnh nhân được khảo sát:
- Điện tâm đồ: đo nhịp tim
- Siêu âm tim: đo vận tốc dòng máu ngang van ĐMC, chênh áp trung bình, diện tích mở van (theo phương trình liên tục), thể tích nhát bóp
Ngưng nghiệm pháp khi:
- Đạt được liều dobutamine tối đa 20 mcg/kg/ph
- Nhịp tim tăng thêm 10 – 20 nhịp so với ban đầu hoặc nhịp tim trên 100 lần/phút
- Có triệu chứng cơ năng, tụt huyết áp hoặc rối loạn nhịp nặng.
- Kết luận được có hẹp van thật sự với vận tốc ngang van tăng ≥ 4 m/giây, chênh áp trung bình ≥ 40 mmHg và DTMV ≤ 1.0 cm2.
Chỉ số cung lượng thất (Svi) lúc ban đầu dưới 35 ml/m2 thì gọi là cung lượng tim giảm.
Ở liều dobutamine tối đa, nếu SVi tăng thêm trên 20% so với ban đầu thì kết luận còn dự trữ co bóp thất trái. Trường hợp hẹp van ĐMC nặng giai đoạn D2, nếu bệnh nhân còn dự trữ co bóp thất trái thì tiên lượng sau mổ tốt hơn bệnh nhân mất dự trữ co bóp thất trái.

Hình 2. Sơ đồ thực hiện siêu âm tim gắng sức Dobutamine liều thấp (5)
9.2.2.6. MSCT tim
Để đánh giá mức độ dãn ĐMC lên, mức độ vôi hóa lá van, mức độ hẹp van ĐMC, tìm “porcelain aorta” (ĐMC sứ hóa), khảo sát các thông số trước khi thay van ĐMC qua thông tim.
Điểm vôi hóa của van ĐMC nếu trên 1300 đơn vị Agaston ở nữ, trên 2000 đơn vị Agaston ở nam là có liên quan đến hẹp van ĐMC nặng. Ngoài ra, CT còn giúp đo đường kính vòng van ĐMC, chiều dài lá van, khoảng cách từ vòng van ĐMC đến các lỗ xuất phát mạch vành ở bệnh nhân thay van ĐMC qua da.
9.2.2.7. Chụp mạch vành và thông tim
Chỉ định chụp động mạch vành thường quy trước can thiệp van ĐMC
- Hẹp van ĐMC ở bệnh nhân có cơn đau thắt ngực hoặc có yếu tố nguy cơ bệnh mạch vành.
- Hẹp van ĐMC ở bệnh nhân nam từ 40 tuổi trở lên, nữ mãn kinh
Thông tim xác định chẩn đoán hẹp van ĐMC nặng
- Bệnh nhân có triệu chứng lâm sàng nghẽn đường ra thất trái tuy nhiên siêu âm không xác định được.
- Có sự bất tương hợp quan trọng giữa triệu chứng lâm sàng với kết quả siêu âm tim hay cận lâm sàng hình ảnh không xâm nhập khác. Thông tim đo sự chênh áp lực ngang van ĐMC xác định có hẹp van ĐMC nặng không.
Theo khuyến cáo của Hội Tim mạch Hoa Kỳ 2020, các cận lâm sàng cần thực hiện ở bệnh nhân hẹp van ĐMC được trình bày trong Bảng 7.
Bảng 7. Các cận lâm sàng ban đầu cần thực hiện ở bệnh nhân hẹp van ĐMC (1)
| Loại | MCC | Khuyến cáo các cận lâm sàng ban đầu cần thực hiện ở bệnh nhân hẹp van ĐMC |
| I | A | 1. Ở bệnh nhân có triệu chứng cơ năng và thực thể của hẹp van ĐMC hoặc van ĐMC hai mảnh, có chỉ định làm siêu âm tim qua thành ngực để chẩn đoán chính xác nguyên nhân, đánh giá độ nặng huyết động, đo kích thước và chức năng tâm thu thất trái, xác định tiên lượng và thời điểm can thiệp van. |
| I | B | 2. Bệnh nhân nghi ngờ hẹp van ĐMC nặng, cung lượng tim thấp với phân suất tống máu bình thường (giai đoạn D3), tối ưu hóa kiểm soát huyết áp trước khi đánh giá độ nặng hẹp van bằng TTE, TEE, thông tim hoặc CMR |
| IIa | B | 3. Bệnh nhân nghi ngờ hẹp van ĐMC nặng, cung lượng tim thấp với PSTM giảm (giai đoạn D2), trắc nghiệm gắng sức dobutamine liều thấp với siêu âm hoặc đánh giá huyết động xâm nhập để đánh giá độ nặng và dự trữ co thắt cơ tim. |
| IIa | B | 4. Bệnh nhân nghi ngờ hẹp van ĐMC nặng, cung lượng tim thấp với phân suất tống máu bình thường hoặc giảm (giai đoạn D2 và D3), xác định độ nặng bằng việc tính tỉ lệ tích phân dòng máu qua LVOT/van ĐMC. |
| IIa | B | 5. Bệnh nhân nghi ngờ hẹp van ĐMC nặng, cung lượng tim thấp với phân suất tống máu bình thường hoặc giảm (giai đoạn D2 và D3), xác định độ nặng bằng cách đo điểm số vôi hóa van ĐMC trên MSCT tim. |
9.3. Điều trị nội khoa
- Điều trị nội khoa hẹp van ĐMC nặng có nhiều hạn chế, tránh làm nặng thêm triệu chứng của người bệnh. Các thuốc tim mạch nên được dùng liều thấp tăng dần, tránh giảm mạnh tiền tải và theo dõi sát đáp ứng của người bệnh.
- Điều trị bệnh cơ bản đi kèm như tăng huyết áp, rối loạn lipid máu, bệnh tim thiếu máu cục bộ, suy tim,…(nếu có) theo các hướng dẫn chuẩn.
- Ức chế men chuyển hoặc chẹn thụ thể angiotensin II ở bệnh nhân sau TAVI có thể xem xét sử dụng nhằm kéo dài đời sống, giảm tử vong.
- Dùng chẹn bêta khi suy tim PSTM ≤ 40%, sau nhồi máu cơ tim cấp và/hoặc có cơn đau thắt ngực
- Dùng lợi tiểu khi có suy tim sung huyết, lưu ý nên dùng liều thấp
- Digitalis khi có rung nhĩ kèm suy tim PSTM giảm.
- Dùng statin để phòng ngừa tiên phát và thứ phát bệnh tim mạch do xơ vữa theo các khuyến cáo hiện nay.
Bảng 8. Hướng dẫn điều trị nội khoa hẹp van ĐMC (1)
| Loại | MCC | Khuyến cáo điều trị nội khoa hẹp van ĐMC |
| I | B | 1. Bệnh nhân có nguy cơ hẹp van ĐMC (giai đoạn A) và hẹp van ĐMC (giai đoạn B và C), nếu có tăng huyết áp thì điều trị theo khuyến cáo, bắt đầu liều thấp, chỉnh liều tăng dần và theo dõi sát. |
| I | A | 2. Tất cả bệnh nhân hẹp van ĐMC vôi hóa, điều trị statin phòng ngừa tiên phát và thứ phát bệnh xơ vữa động mạch dựa trên thang điểm nguy cơ. |
| IIb | B | 3. Bệnh nhân sau khi thay van ĐMC qua da, điều trị với thuốc hệ renin – angiotensin (ức chế men chuyển hoặc chẹn thụ thể angiotensin II) nên được cân nhắc để giảm nguy cơ lâu dài về tử vong do mọi nguyên nhân. |
| III | A | 4. Bệnh nhân hẹp van ĐMC vôi hóa nặng (giai đoạn B và C), chống chỉ định dung statin với mục đích ngăn ngừa tiến triển của hẹp van. |
9.3.1. Thời điểm can thiệp
Bệnh nhân hẹp van ĐMC nặng cần được theo dõi sát và điều trị can thiệp thay van ĐMC kịp thời. Chỉ định điều trị can thiệp được trình bày trong Bảng 9.
Chỉ định thay van ĐMC loại I gồm:
- Hẹp van ĐMC nặng có triệu chứng (giai đoạn D1 và D2).
- Hẹp van ĐMC nặng giai đoạn D3 với triệu chứng cơ năng được cho là do hẹp chủ nặng gây ra.
- Hẹp van ĐMC nặng không có triệu chứng, nhưng PSTMTT giảm dưới 50% (giai đoạn C2).
- Hẹp van ĐMC nặng kèm theo mổ tim do chỉ định khác.
Chỉ định thay van ĐMC loại IIa gồm:
- Hẹp van ĐMC nặng không triệu chứng, giai đoạn C1, có nguy cơ phẫu thuật thấp kèm theo 1 trong những điều sau đi kèm thì cân nhắc thay van ĐMC cho người bệnh sớm:
- Hẹp rất nặng với v trên 5.0 m/giây
- Hẹp van tiến triển nhanh với mức độ tăng vận tốc dòng máu qua van ĐMC trên 0.3 m/giây/năm khi theo dõi liên tục bằng siêu âm tim.
- Trắc nghiệm gắng sức dương tính với giảm khả năng gắng sức, xuất hiện triệu chứng hoặc huyết áp tụt ≥ 10 mmHg khi gắng sức tối đa so với ban đầu.
- Tăng peptide lợi niệu BNP trên 3 lần giới hạn bình thường.
Ngoài ra, cân nhắc thay van ĐMC (chỉ định loại IIb) trong trường hợp hẹp chủ trung bình kèm chỉ định mổ tim khác, hoặc hẹp van ĐMC nặng không triệu chứng giai đoạn C1, khi theo dõi liên tục với cận lâm sàng hình ảnh thấy phân suất tống máu thất trái giảm dần và dưới 60%. Những trường hợp này nên cân nhắc giữa lợi ích và nguy cơ trước khi quyết định.
Bảng 9. Chỉ định điều trị can thiệp hẹp van ĐMC (1)
| Loại | MCC | Khuyến cáo |
| I | A | 1. Bệnh nhân người lớn hẹp van ĐMC nặng giai đoạn D1 có triệu chứng đau thắt ngực, khó thở, suy tim, ngất hoặc gần ngất khi gắng sức trong bệnh sử hoặc khi làm trắc nghiệm gắng sức thì có chỉ định thay van ĐMC. |
| I | B | 2. Bệnh nhân hẹp van ĐMC nặng không triệu chứng, PSTM dưới 50% (giai đoạn C2) có chỉ định thay van ĐMC. |
| I | B | 3. Bệnh nhân hẹp van ĐMC nặng giai đoạn C1, cần mổ tim do một chỉ định khác thì nên được thay van ĐMC kèm theo. |
| I | B | 4. Bệnh nhân hẹp van ĐMC nặng giai đoạn D2 có chỉ định thay van ĐMC. |
| I | B | 5. Bệnh nhân hẹp van ĐMC nặng giai đoạn D3, có chỉ định thay van ĐMC nếu hẹp chủ là nguyên nhân có thể nhất gây ra các triệu chứng cơ năng. |
| IIa | B | 6. Bệnh nhân hẹp van ĐMC nặng không triệu chứng giai đoạn C1, nguy cơ phẫu thuật thấp, xem xét thay van ĐMC khi bệnh nhân giảm khả năng gắng sức (bình thường so với tuổi và giới tính) khi làm trắc nghiệm gắng sức hoặc huyết áp tâm thu giảm ≥ 10 mmHg so với ban đầu khi gắng sức tối đa. |
| IIa | B | 7. Bệnh nhân hẹp van ĐMC rất nặng không triệu chứng (vận tốc ≥ 5 m/giây), nguy cơ phẫu thuật thấp, có chỉ định thay van ĐMC. |
| IIa | B | 8. Bệnh nhân hẹp van ĐMC nặng không triệu chứng giai đoạn C1, nguy cơ phẫu thuật thấp, có chỉ định thay van ĐMC khi peptid lợi niệu BNP tăng hơn 3 lần bình thường. |
| IIa | B | 9. Bệnh nhân hẹp van ĐMC nặng không triệu chứng giai đoạn C1, nguy cơ phẫu thuật thấp, khi theo dõi siêu âm tim hàng loạt cho thấy vận tốc ngang van ĐMC tăng ≥ 0.3 m/giây mỗi năm thì nên xem xét chỉ định thay van ĐMC. |
| IIb | B | 10. Bệnh nhân hẹp van ĐMC nặng không triệu chứng giai đoạn C1, nếu PSTM giảm dần liên tục trong ít nhất 3 lần làm cận lâm sàng hình ảnh học liên tiếp đến mức dưới 60%, có thể xem xét thay van ĐMC. |
| IIb | C | 11. Bệnh nhân hẹp van ĐMC trung bình (giai đoạn B), nếu có mổ tim do chỉ định khác, có thể cân nhắc thay van ĐMC cùng lúc. |
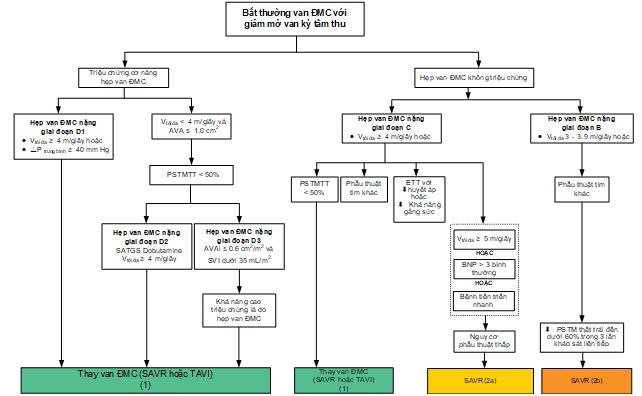
Hình 3. Chỉ định can thiệp thay van trong hẹp van ĐMC (1)
AVAi, Aortic Valve Area (index), Chỉ số diện tích mở van ĐMC; SVI, Stroke Volume Index, Chỉ số cung lượng thất; AVR, Aortic Valve Replacement; Thay van động mạch chủ; SAVR, Surgical Aortic Valve Replacement; Thay van động mạch chủ bằng phẫu thuật; ĐMC, Động Mạch Chủ; PSTMTT, Phân suất tống máu thất trái; BNP, B-type natriuretic peptide; TAVi; Transcatheter Aortic Valve Implantation, Thay van động mạch chủ qua da ; rP, độ chênh áp lực; ETT, Exercise Treadmill Test, Trắc nghệm gắng sức thảm lăn.
9.3.2. Chọn lựa phương pháp can thiệp
Chọn lựa phương pháp điều trị can thiệp thay van ĐMC bao gồm: (1) chọn loại van nhân tạo (van cơ học hay sinh học); và (2) phương pháp thay van (phẫu thuật thay van– [SAVR] hay thay van qua thông tim – [TAVI]).
Việc chọn lựa van sinh học hay van cơ học căn bản dựa vào độ tuổi của người bệnh, chống chỉ định hoặc không thể điều trị thuốc kháng đông lâu dài và đặc biệt làm mong muốn của người bệnh sau khi đã được giải thích đầy đủ về lợi ích và nguy cơ của từng loại van (Bảng 10). Bệnh nhân càng cao tuổi (trên 65 tuổi) chỉ định thay van sinh học càng được ưu tiên lựa chọn; người trẻ (dưới 50 tuổi) ưu tiên chọn van cơ học. Người trong khoảng 50 – 65 tuổi thì cân nhắc đặc điểm cụ thể từng bệnh nhân để lựa chọn. Bệnh nhân không có khả theo dõi điều trị hoặc không muốn uống thuốc kháng đông lâu dài thì nên chọn van sinh học, tuy nhiên phải chấp nhận nguy cơ thay van lần nữa do thời hạn sử dụng van sinh học ngắn hơn van cơ học.
Tất cả bệnh nhân cần thay van ĐMC cơ học sẽ được phẫu thuật thay van. Đối với van sinh học có thể thay van qua phẫu thuật hoặc qua thông tim. Chỉ định phương pháp can thiệp nào nên được ưu tiên chọn lựa được trình bày trong Bảng 11.
Thay van động mạch chủ bằng phẫu thuật được ưu tiên chọn lựa ở người trẻ tuổi (dưới 65 tuổi), thời gian sống ước đoán còn lại dài (trên 20 năm) và nguy cơ phẫu thuật thấp.
Đối với người cao tuổi (trên 80 tuổi), có nhiều bệnh nội khoa đi kèm, nguy cơ phẫu thuật cao hoặc chống chỉ định phẫu thuật, thời gian sống ước đoán còn lại thấp (dưới 10 năm) và không có chống chỉ định về mặt giải phẫu khi làm TAVI thì ưu tiên lựa chọn TAVI.
Ngoài ra, còn có một số đặc điểm khác của người bệnh cũng ảnh hưởng đến quyết định lựa chọn thay van bằng phẫu thuật hay thông tim sẽ được trình bày trong Bảng 12.
Bảng 10. Hướng dẫn chọn lựa van nhân tạo ĐMC (1)
| Loại | MCC | Khuyến cáo hướng dẫn chọn lựa van nhân tạo ĐMC |
| I | C | 1. Tất cả bệnh nhân có chỉ định thay van ĐMC, việc chọn lựa loại van nào nên dựa trên quyết định của người bệnh sau khi đã được tư vấn, cung cấp đầy đủ thông tin về nguy cơ điều trị kháng đông lâu dài khi thay van cơ học và nguy cơ tái can thiệp lại khi thay van sinh học; hoặc ý thích, mong muốn của họ. |
| I | C | 2. Bệnh nhân cần thay van ĐMC nhân tạo, ở bất kỳ độ tuổi nào, nếu có chống chỉ định với điều trị kháng đông, không thể điều trị kháng đông đúng cách, hoặc không muốn uống thuốc kháng đông thì có chỉ định thay van ĐMC sinh học. |
| IIa | B | 3. Bệnh nhân cần thay van ĐMC, dưới 50 tuổi, không có chống chỉ định với điều trị kháng đông, thay van cơ học tốt hơn van sinh học. |
| IIa | B | 4. Bệnh nhân cần thay van ĐMC, trên 65 tuổi, thay van sinh học tốt hơn van cơ học. |
| IIa | B | 5. Bệnh nhân cần thay van ĐMC, tuổi từ 50 đến 65, không có chống chỉ định với điều trị kháng đông, việc chọn van sinh học hay cơ học nên cá thể hóa dựa trên đặc điểm từng bệnh nhân và sau khi đã cung cấp đầy đủ thông tin để người bệnh quyết định. |
| IIb | B | 6. Bệnh nhân dưới 50 tuổi nếu muốn thay van sinh học, giải phẫu van thích hợp, thay van ĐMC bằng van ĐMP tự thân (phẫu thuật Ross) có thể được cân nhắc, làm ở những trung tâm có kinh nghiệm về van tim. |
Bảng 11. Hướng dẫn chọn lựa phương pháp can thiệp bằng phẫu thuật hay qua thông tim (1)
| Loại | MCC | Khuyến cáo hướng dẫn chọn lựa phương pháp can thiệp bằng phẫu thuật hay qua thông tim |
| I | A | 1. Bệnh nhân hẹp van ĐMC nặng có hoặc không có triệu chứng, có chỉ định thay van, tuổi dưới 65, đời sống còn lại ước đoán trên 20 năm, có chỉ định SAVR. |
| I | A | 2. Bệnh nhân hẹp van ĐMC nặng có triệu chứng, tuổi từ 65 đến 80, không có chống chỉ định về giải phẫu TAVI qua đường động mạch đùi, chỉ định SAVR hay TAVI dựa vào quyết định của bệnh nhân sau khi đã thảo luận cân bằng giữa đời sống còn lại của người bệnh và tuổi thọ của van. |
| I | A | 3. Bệnh nhân hẹp van ĐMC nặng có triệu chứng, trên 80 tuổi hoặc trẻ hơn nhưng có đời sống còn lại ước tính dưới 10 năm, không có chống chỉ định về giải phẫu TAVI đường động mạch đùi, TAVI là lựa chọn tốt hơn SAVR |
| I | B | 4. Bệnh nhân hẹp van ĐMC nặng không triệu chứng, PSTM dưới 50% (giai đoạn C2), tuổi ≤ 80, không có chống chỉ định về giải phẫu TAVI đường động mạch đùi, chọn lựa TAVI hay SAVR cũng giống như khuyến cáo trên hẹp van ĐMC có triệu chứng (mục 1, 2 và 3). |
| I | B | 5. Bệnh nhân hẹp van ĐMC nặng không triệu chứng có kèm bất thường về trắc nghiệm gắng sức, hẹp van ĐMC rất nặng, tiến triển nhanh, hoặc kèm tăng peptid lợi niệu BNP (chỉ định loại IIa), SAVR tốt hơn TAVI. |
| I | A | 6. Bệnh nhân có chỉ định thay van ĐMC sinh học nhưng giải phẫu van hoặc mạch máu; hay những yếu tố khác không phù hợp để TAVI đường đùi, có chỉ định SAVR. |
| I | A | 7. Bệnh nhân hẹp van ĐMC nặng có triệu chứng, bất kỳ độ tuổi nào,c có nguy cơ phẫu thuật cao hoặc chống chỉ định mổ, chỉ định làm TAVI nếu đời sống sau TAVI ước đoán trên 12 tháng với chất lượng sống chấp nhận được. |
| I | C | 8. Bệnh nhân hẹp van ĐMC nặng có triệu chứng, được tiên đoán khả năng sống còn sau TAVI hay sau SAVR dưới 12 tháng hoặc cải thiện rất ít chất lượng sống, có chỉ định điều trị chăm sóc giảm nhẹ sau khi đã cung cấp thông tin, thảo luận dựa trên nguyện vọng và quyết định của người bệnh. |
| IIb | C | 9. Bệnh nhân hẹp chủ nặng có tình trạng bệnh rất nặng, nong van ĐMC bằng bóng qua da có thể xem xét là bước bắc cầu cho TAVI hay SAVR sau đó. |
Bảng 12. Các yếu tố cân nhắc lựa chọn khi thay van ĐMC bằng phẫu thuật hay qua thông tim (18)
| Ưu tiên
TAVI |
Ưu tiên
SAVR |
|
| Đặc điểm lâm sàng | ||
| Nguy cơ phẫu thuật | Cao | Thấp |
| Tuổi | Lớn tuổi,
trên 80 tuổi |
Trẻ tuổi,
dưới 65 tuổi |
| Sức khỏe yếu, nhiều bệnh đồng mắc | + | – |
| Viêm nội tâm mạc nhiễm trùng | – | + |
| Có mổ tim trước đó | + | – |
| Yếu tố giải phẫu và thủ thuật | ||
| TAVI có thể tiếp cận qua động mạch đùi | + | – |
| Xạ trị vung ngực | + | – |
| Động mạch chủ “gốm sứ” | + | – |
| Biến dạng lồng ngực nặng hoặc vẹo cột sống | + | – |
| Huyết khối trong thất trái hay động mạch chủ | – | + |
| Giải phẫu van không phù hợp cho TAVI | – | + |
| Bệnh tim mạch khác cần can thiệp | ||
| Bệnh nhiều nhánh mạch vành cần CABG | – | + |
| Bệnh van hai lá, ba lá nặng cần can thiệp | – | + |
| Dãn/phình ĐMC lên, gốc ĐMC có chỉ định mổ | – | + |
| Phì đại vách liên thất có chỉ định cắt bớt vách | – | + |
(Còn nữa…)
TÀI LIỆU THAM KHẢO
- Otto CM, Nishimura RA, Bonow RO, et al. 2020 ACC/AHA Guideline for the Management of Patients With Valvular Heart Disease: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol. 2021;77(4):e25-e197. https://doi.org/10.1016/j.jacc.2020.11.018
- Baumgartner H, Hung J, Bermejo J, et al. Echocardiographic assessment of valve stenosis: EAE/ASE recommendations for clinical practice. J Am Soc Echocardiogr. 2009;22(1):1-23. https://doi.org/10.1016/J.ECHO.2008.11.029
- Lancellotti P, Moura L, Pierard LA, et al. European Association of Echocardiography recommendations for the assessment of valvular regurgitation. Part 2: mitral and tricuspid regurgitation (native valve disease). Eur J Echocardiogr. 2010;11(4):307-332. https://doi.org/10.1093/EJECHOCARD/JEQ031
- Zoghbi WA, Adams D, Bonow RO, et al. Recommendations for Noninvasive Evaluation of Native Valvular Regurgitation: A Report from the American Society of Echocardiography Developed in Collaboration with the Society for Cardiovascular Magnetic Resonance. J Am Soc Echocardiogr. 2017;30(4):303-371. https://doi.org/10.1016/J.ECHO.2017.01.007
- Baumgartner H, Hung J, Bermejo J, et al. Recommendations on the Echocardiographic Assessment of Aortic Valve Stenosis: A Focused Update from the European Association of Cardiovascular Imaging and the American Society of Echocardiography. J Am Soc Echocardiogr. 2017;30(4):372-392. https://doi.org/10.1016/J.ECHO.2017.02.009
- Currie PJ, Seward JB, Reeder GS, et al. Continuous-wave Doppler echocardiographic assessment of severity of calcific aortic stenosis: a simultaneous Doppler-catheter correlative study in 100 adult patients. Circulation. 1985;71(6):1162-1169. https://doi.org/10.1161/01.CIR.71.6.1162
- Medvedofsky D, Maffessanti F, Weinert L, et al. 2D and 3D Echocardiography-Derived Indices of Left Ventricular Function and Shape: Relationship With Mortality. JACC Cardiovasc Imaging. 2018;11(11):1569-1579. https://doi.org/10.1016/J.JCMG.2017.08.023
- Quiñones MA, Otto CM, Stoddard M, Waggoner A, Zoghbi WA. Recommendations for quantification of Doppler echocardiography: a report from the Doppler Quantification Task Force of the Nomenclature and Standards Committee of the American Society of Echocardiography. J Am Soc Echocardiogr. 2002;15(2):167-184. https://doi.org/10.1067/MJE.2002.120202
- Habib G, Lancellotti P. The 2015 ESC Guidelines for the management of infective endocarditis. Eur Heart J. 2015;36(44):3036-3037. https://doi.org/10.1093/EURHEARTJ/EHV488
- Pellikka PA, Sarano ME, Nishimura RA, et al. Outcome of 622 adults with asymptomatic, hemodynamically significant aortic stenosis during prolonged follow-up. Circulation. 2005;111(24):3290-3295. https://doi.org/10.1161/CIRCULATIONAHA.104.495903
- Rosenhek R, Iung B, Tornos P, et al. ESC Working Group on Valvular Heart Disease Position Paper: assessing the risk of interventions in patients with valvular heart disease. Eur Heart J. 2012;33(7). https://doi.org/10.1093/EURHEARTJ/EHR061
- Pan KL, Singer DE, Ovbiagele B, Wu YL, Ahmed MA, Lee M. Effects of Non-Vitamin K Antagonist Oral Anticoagulants Versus Warfarin in Patients With Atrial Fibrillation and Valvular Heart Disease: A Systematic Review and Meta-Analysis. J Am Heart Assoc. 2017;6(7). https://doi.org/10.1161/JAHA.117.005835
- Lip GYH, Jensen M, Melgaard L, Skjøth F, Nielsen PB, Larsen TB. Stroke and bleeding risk scores in patients with atrial fibrillation and valvular heart disease: evaluating “valvular heart disease” in a nationwide cohort study. Europace. 2019;21(1):33-40. https://doi.org/10.1093/EUROPACE/EUY151
- Vora AN, Dai D, Matsuoka R, et al. Incidence, Management, and Associated Clinical Outcomes of New-Onset Atrial Fibrillation Following Transcatheter Aortic Valve Replacement: An Analysis From the STS/ACC TVT Registry. JACC Cardiovasc Interv. 2018;11(17):1746-1756. https://doi.org/10.1016/J.JCIN.2018.05.042
- Seeger J, Gonska B, Rodewald C, Rottbauer W, Wöhrle J. Apixaban in Patients With Atrial Fibrillation After Transfemoral Aortic Valve Replacement. JACC Cardiovasc Interv. 2017;10(1):66-74. https://doi.org/10.1016/J.JCIN.2016.10.023
- Jochheim D, Barbanti M, Capretti G, et al. Oral Anticoagulant Type and Outcomes After Transcatheter Aortic Valve Replacement. JACC Cardiovasc Interv. 2019;12(16):1566-1576. https://doi.org/10.1016/J.JCIN.2019.03.003
- JW E, SJ C, M B, et al. Dabigatran versus warfarin in patients with mechanical heart valves. N Engl J Med. 2013;369(13). https://doi.org/10.1056/NEJMOA1300615
- Vahanian A, Beyersdorf F, Praz F, et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2022;43(7):561-632. https://doi.org/10.1093/eurheartj/ehab395
- Aicher D, Kunihara T, Abou Issa O, Brittner B, Gräber S, Schäfers HJ. Valve configuration determines long-term results after repair of the bicuspid aortic valve. Circulation. 2011;123(2):178-185. https://doi.org/10.1161/CIRCULATIONAHA.109.934679
- David TE, Armstrong S, Ivanov J, Webb GD. Aortic valve sparing operations: an update. Ann Thorac Surg. 1999;67(6):1840-1842. https://doi.org/10.1016/S0003-4975(99)00420-8
- Kallenbach K, Hagl C, Walles T, et al. Results of valve-sparing aortic root reconstruction in 158 consecutive patients. Ann Thorac Surg. 2002;74(6):2026-2033. https://doi.org/10.1016/S0003-4975(02)04090-0
- Pettersson GB, Crucean AC, Savage R, et al. Toward Predictable Repair of Regurgitant Aortic Valves: A Systematic Morphology-Directed Approach to Bicommissural Repair. J Am Coll Cardiol. 2008;52(1):40-49. https://doi.org/10.1016/J.JACC.2008.01.073
- de Kerchove L, Boodhwani M, Glineur D, et al. Valve sparing-root replacement with the reimplantation technique to increase the durability of bicuspid aortic valve repair. J Thorac Cardiovasc Surg. 2011;142(6):1430-1438. https://doi.org/10.1016/J.JTCVS.2011.08.021
- Kari FA, Liang DH, Escobar Kvitting JP, et al. Tirone David valve-sparing aortic root replacement and cusp repair for bicuspid aortic valve disease. J Thorac Cardiovasc Surg. 2013;145(3):S35-S40.e2. https://doi.org/10.1016/J.JTCVS.2012.11.043
- Ouzounian M, Rao V, Manlhiot C, et al. Valve-Sparing Root Replacement Compared With Composite Valve Graft Procedures in Patients With Aortic Root Dilation. J Am Coll Cardiol. 2016;68(17):1838-1847. https://doi.org/10.1016/J.JACC.2016.07.767
- Lang RM, Badano LP, Victor MA, et al. Recommendations for Cardiac Chamber Quantification by Echocardiography in Adults: An Update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Journal of the American Society of Echocardiography. 2015;28(1):1-39.e14. https://doi.org/10.1016/J.ECHO.2014.10.003
- Kawel-Boehm N, Maceira A, Valsangiacomo-Buechel ER, et al. Normal values for cardiovascular magnetic resonance in adults and children. Journal of Cardiovascular Magnetic Resonance. 2015;17(1):1-33. https://doi.org/10.1186/S12968-015-0111-7/COMMENTS
- Bonow RO, Borer JS, Rosing DR, et al. Preoperative exercise capacity in symptomatic patients with aortic regurgitation as a predictor of postoperative left ventricular function and long-term prognosis. Circulation. 1980;62(6):1280-1290. https://doi.org/10.1161/01.CIR.62.6.1280
- Klodas E, Enriquez-Sarano M, Tajik AJ, Mullany CJ, Bailey KR, Seward JB. Optimizing Timing of Surgical Correction in Patients With Severe Aortic Regurgitation: Role of Symptoms. J Am Coll Cardiol. 1997;30(3):746-752. https://doi.org/10.1016/S0735-1097(97)00205-2
- Chaliki HP, Mohty D, Avierinos JF, et al. Outcomes after aortic valve replacement in patients with severe aortic regurgitation and markedly reduced left ventricular function. Circulation. 2002;106(21):2687-2693. https://doi.org/10.1161/01.CIR.0000038498.59829.38
- Tornos P, Sambola A, Permanyer-Miralda G, Evangelista A, Gomez Z, Soler-Soler J. Long-Term Outcome of Surgically Treated Aortic Regurgitation: Influence of Guideline Adherence Toward Early Surgery. J Am Coll Cardiol. 2006;47(5):1012-1017. https://doi.org/10.1016/J.JACC.2005.10.049
- Bhudia SK, McCarthy PM, Kumpati GS, et al. Improved Outcomes After Aortic Valve Surgery for Chronic Aortic Regurgitation With Severe Left Ventricular Dysfunction. J Am Coll Cardiol. 2007;49(13):1465-1471. https://doi.org/10.1016/J.JACC.2007.01.026
- Fiedler AG, Bhambhani V, Laikhter E, et al. Aortic valve replacement associated with survival in severe regurgitation and low ejection fraction. Heart. 2018;104(10):835-840. https://doi.org/10.1136/HEARTJNL-2017-312024
- Kaneko T, Ejiofor JI, Neely RC, et al. Aortic Regurgitation With Markedly Reduced Left Ventricular Function Is Not a Contraindication for Aortic Valve Replacement. Ann Thorac Surg. 2016;102(1):41-47. https://doi.org/10.1016/J.ATHORACSUR.2015.12.068
- Forman R, Firth BG, Barnard MS. Prognostic significance of preoperative left ventricular ejection fraction and valve lesion in patients with aortic valve replacement. Am J Cardiol. 1980;45(6):1120-1125. https://doi.org/10.1016/0002-9149(80)90468-3
- Bonow RO, Picone AL, McIntosh CL, et al. Survival and functional results after valve replacement for aortic regurgitation from 1976 to 1983: impact of preoperative left ventricular function. Circulation. 1985;72(6):1244-1256. https://doi.org/10.1161/01.CIR.72.6.1244
- Cormier B, Vahanian A, Luxereau P, Kassab R, Acar J. Should asymptomatic or mildly symptomatic aortic regurgitation be operated on? Z Kardiol. 1986;75:141-145.
- Klodas E, Enriquez-Sarano M, Tajik AJ, Mullany CJ, Bailey KR, Seward JB. Aortic regurgitation complicated by extreme left ventricular dilation: long-term outcome after surgical correction. J Am Coll Cardiol. 1996;27(3):670-677. https://doi.org/10.1016/0735-1097(95)00525-0
- Saisho H, Arinaga K, Kikusaki S, et al. Long Term Results and Predictors of Left Ventricular Function Recovery after Aortic Valve Replacement for Chronic Aortic Regurgitation. Annals of Thoracic and Cardiovascular Surgery. 2015;21(4):388-395. https://doi.org/10.5761/ATCS.OA.14-00295
- Mentias A, Feng K, Alashi A, et al. Long-Term Outcomes in Patients With Aortic Regurgitation and Preserved Left Ventricular Ejection Fraction. J Am Coll Cardiol. 2016;68(20):2144-2153. https://doi.org/10.1016/J.JACC.2016.08.045
- Yang LT, Michelena HI, Scott CG, et al. Outcomes in Chronic Hemodynamically Significant Aortic Regurgitation and Limitations of Current Guidelines. J Am Coll Cardiol. 2019;73(14):1741-1752. https://doi.org/10.1016/J.JACC.2019.01.024
- de Meester C, Gerber BL, Vancraeynest D, et al. Do Guideline-Based Indications Result in an Outcome Penalty for Patients With Severe Aortic Regurgitation? JACC Cardiovasc Imaging. 2019;12(11):2126-2138. https://doi.org/10.1016/J.JCMG.2018.11.022
- Bonow RO, Lakatos E, Maron BJ, Epstein SE. Serial long-term assessment of the natural history of asymptomatic patients with chronic aortic regurgitation and normal left ventricular systolic function. Circulation. 1991;84(4):1625-1635. https://doi.org/10.1161/01.CIR.84.4.1625
- Pizarro R, Bazzino OO, Oberti PF, et al. Prospective Validation of the Prognostic Usefulness of B-Type Natriuretic Peptide in Asymptomatic Patients With Chronic Severe Aortic Regurgitation. J Am Coll Cardiol. 2011;58(16):1705-1714. https://doi.org/10.1016/J.JACC.2011.07.016
- Tornos MP, Olona M, Permanyer-Miralda G, et al. Clinical outcome of severe asymptomatic chronic aortic regurgitation: A long-term prospective follow-up study. Am Heart J. 1995;130(2):333-339. https://doi.org/10.1016/0002-8703(95)90450-6
- Tarasoutchi F, Grinberg M, Spina GS, et al. Ten-year clinical laboratory follow-up after application of a symptom-based therapeutic strategy to patients with severe chronic aortic regurgitation of predominant rheumatic etiology. J Am Coll Cardiol. 2003;41(8):1316-1324. https://doi.org/10.1016/S0735-1097(03)00129-3
- Kumpuris AG, Quinones MA, Waggoner AD, Kanon DJ, Nelson JG, Miller RR. Importance of preoperative hypertrophy, wall stress and end-systolic dimension as echocardiographic predictors of normalization of left ventricular dilatation after valve replacement in chronic aortic insufficiency. Am J Cardiol. 1982;49(5):1091-1100. https://doi.org/10.1016/0002-9149(82)90032-7
- Fioretti P, Roelandt J, Bos RJ, et al. Echocardiography in chronic aortic insufficiency. Is valve replacement too late when left ventricular end-systolic dimension reaches 55 mm? Circulation. 1983;67(1):216-221. https://doi.org/10.1161/01.CIR.67.1.216
- Detaint D, Messika-Zeitoun D, Maalouf J, et al. Quantitative echocardiographic determinants of clinical outcome in asymptomatic patients with aortic regurgitation: a prospective study. JACC Cardiovasc Imaging. 2008;1(1):1-11. https://doi.org/10.1016/J.JCMG.2007.10.008
- Stone PH, Clark RD, Goldschlager N, Selzer A, Cohn K. Determinants of prognosis of patients with aortic regurgitation who undergo aortic valve replacement. J Am Coll Cardiol. 1984;3(5):1118-1126. https://doi.org/10.1016/S0735-1097(84)80168-0
- Klodas E, Enriquez-Sarano M, Tajik AJ, Mullany CJ, Bailey KR, Seward JB. Aortic regurgitation complicated by extreme left ventricular dilation: Long-term outcome after surgical correction. J Am Coll Cardiol. 1996;27(3):670-677. https://doi.org/10.1016/0735-1097(95)00525-0
- Zhang Z, Yang J, Yu Y, et al. Preoperative ejection fraction determines early recovery of left ventricular end-diastolic dimension after aortic valve replacement for chronic severe aortic regurgitation. Journal of Surgical Research. 2015;196(1):49-55. https://doi.org/10.1016/J.JSS.2015.02.069
- Murashita T, Schaff H v., Suri RM, et al. Impact of Left Ventricular Systolic Function on Outcome of Correction of Chronic Severe Aortic Valve Regurgitation: Implications for Timing of Surgical Intervention. Ann Thorac Surg. 2017;103(4):1222-1228. https://doi.org/10.1016/J.ATHORACSUR.2016.09.004
- Wang Y, Jiang W, Liu J, et al. Early surgery versus conventional treatment for asymptomatic severe aortic regurgitation with normal ejection fraction and left ventricular dilatation. Eur J Cardiothorac Surg. 2017;52(1):118-124. https://doi.org/10.1093/EJCTS/EZX018
- Scognamiglio R, Rahimtoola SH, Fasoli G, Nistri S, Volta SD. Nifedipine in asymptomatic patients with severe aortic regurgitation and normal left ventricular function. N Engl J Med. 1994;331(11):689-694. https://doi.org/10.1056/NEJM199409153311101
- Masri A, Svensson LG, Griffin BP, Desai MY. Contemporary natural history of bicuspid aortic valve disease: a systematic review. Heart. 2017;103(17):1323-1330. https://doi.org/10.1136/HEARTJNL-2016-309916
- Cripe L, Andelfinger G, Martin LJ, Shooner K, Benson DW. Bicuspid aortic valve is heritable. J Am Coll Cardiol. 2004;44(1):138-143. https://doi.org/10.1016/J.JACC.2004.03.050
- Huntington K, Hunter AGW, Chan KL. A prospective study to assess the frequency of familial clustering of congenital bicuspid aortic valve. J Am Coll Cardiol. 1997;30(7):1809-1812. https://doi.org/10.1016/S0735-1097(97)00372-0
- Glick BN, Roberts WC. Congenitally bicuspid aortic valve in multiple family members. Am J Cardiol. 1994;73(5):400-404. https://doi.org/10.1016/0002-9149(94)90018-3
- Clementi M, Notari L, Borghi A, Tenconi R. Familial congenital bicuspid aortic valve: A disorder of uncertain inheritance. Am J Med Genet. 1996;62(4):336-338. https://doi.org/10.1002/(SICI)1096-8628(19960424)62:4<336::AID-AJMG2>3.0.CO;2-P
- Kong WKF, Delgado V, Bax JJ. Bicuspid Aortic Valve: What to Image in Patients Considered for Transcatheter Aortic Valve Replacement? Circ Cardiovasc Imaging. 2017;10(9). https://doi.org/10.1161/CIRCIMAGING.117.005987
- Michelena HI, Prakash SK, Corte A della, et al. Bicuspid aortic valve: identifying knowledge gaps and rising to the challenge from the International Bicuspid Aortic Valve Consortium (BAVCon). Circulation. 2014;129(25):2691-2704. https://doi.org/10.1161/CIRCULATIONAHA.113.007851
- Elefteriades JA, Sang A, Kuzmik G, Hornick M. Guilt by association: paradigm for detecting a silent killer (thoracic aortic aneurysm). Open Heart. 2015;2(1). https://doi.org/10.1136/OPENHRT-2014-000169
- Burstow DJ, Nishimura RA, Bailey KR, et al. Continuous wave Doppler echocardiographic measurement of prosthetic valve gradients. A simultaneous Doppler-catheter correlative study. Circulation. 1989;80(3):504-514. https://doi.org/10.1161/01.CIR.80.3.504
- Dumesnil JG, Honos GN, Lemieux M, Beauchemin J. Validation and applications of indexed aortic prosthetic valve areas calculated by Doppler echocardiography. J Am Coll Cardiol. 1990;16(3):637-643. https://doi.org/10.1016/0735-1097(90)90355-S
- Baumgartner H, Khan S, DeRobertis M, Czer L, Maurer G. Effect of prosthetic aortic valve design on the Doppler-catheter gradient correlation: an in vitro study of normal St. Jude, Medtronic-Hall, Starr-Edwards and Hancock valves. J Am Coll Cardiol. 1992;19(2):324-332. https://doi.org/10.1016/0735-1097(92)90486-7
- Vandervoort PM, Greenberg NL, Pu M, Powell KA, Cosgrove DM, Thomas JD. Pressure recovery in bileaflet heart valve prostheses. Localized high velocities and gradients in central and side orifices with implications for Doppler-catheter gradient relation in aortic and mitral position. Circulation. 1995;92(12):3464-3472. https://doi.org/10.1161/01.CIR.92.12.3464
- Salaun E, Mahjoub H, Girerd N, et al. Rate, Timing, Correlates, and Outcomes of Hemodynamic Valve Deterioration After Bioprosthetic Surgical Aortic Valve Replacement. Circulation. 2018;138(10):971-985. https://doi.org/10.1161/CIRCULATIONAHA.118.035150
- Rahimtoola SH. Choice of prosthetic heart valve in adults an update. J Am Coll Cardiol. 2010;55(22):2413-2426. https://doi.org/10.1016/J.JACC.2009.10.085
- van Geldorp MWA, Eric Jamieson WR, Kappetein AP, et al. Patient outcome after aortic valve replacement with a mechanical or biological prosthesis: weighing lifetime anticoagulant-related event risk against reoperation risk. J Thorac Cardiovasc Surg. 2009;137(4). https://doi.org/10.1016/J.JTCVS.2008.09.028
- Salaun E, Mahjoub H, Dahou A, et al. Hemodynamic Deterioration of Surgically Implanted Bioprosthetic Aortic Valves. J Am Coll Cardiol. 2018;72(3):241-251. https://doi.org/10.1016/J.JACC.2018.04.064
- Douglas PS, Leon MB, Mack MJ, et al. Longitudinal Hemodynamics of Transcatheter and Surgical Aortic Valves in the PARTNER Trial. JAMA Cardiol. 2017;2(11):1197-1206. https://doi.org/10.1001/JAMACARDIO.2017.3306
- Mack MJ, Leon MB, Smith CR, et al. 5-year outcomes of transcatheter aortic valve replacement or surgical aortic valve replacement for high surgical risk patients with aortic stenosis (PARTNER 1): a randomised controlled trial. Lancet. 2015;385(9986):2477-2484. https://doi.org/10.1016/S0140-6736(15)60308-7
- Kapadia SR, Leon MB, Makkar RR, et al. 5-year outcomes of transcatheter aortic valve replacement compared with standard treatment for patients with inoperable aortic stenosis (PARTNER 1): a randomised controlled trial. Lancet. 2015;385(9986):2485-2491. https://doi.org/10.1016/S0140-6736(15)60290-2
- Fernández-Santos S, Théron A, Pibarot P, et al. Valve hemodynamic performance and myocardial strain after implantation of a third-generation, balloon-expandable, transcatheter aortic valve. Cardiol J. 2020;27(6):789-796. https://doi.org/10.5603/CJ.A2019.0049
- Manoharan G, van Mieghem NM, Windecker S, et al. 1-Year Outcomes With the Evolut R Self-Expanding Transcatheter Aortic Valve: From the International FORWARD Study. JACC Cardiovasc Interv. 2018;11(22):2326-2334. https://doi.org/10.1016/J.JCIN.2018.07.032
- Gleason TG, Reardon MJ, Popma JJ, et al. 5-Year Outcomes of Self-Expanding Transcatheter Versus Surgical Aortic Valve Replacement in High-Risk Patients. J Am Coll Cardiol. 2018;72(22):2687-2696. https://doi.org/10.1016/J.JACC.2018.08.2146
- Blackman DJ, Saraf S, MacCarthy PA, et al. Long-Term Durability of Transcatheter Aortic Valve Prostheses. J Am Coll Cardiol. 2019;73(5):537-545. https://doi.org/10.1016/J.JACC.2018.10.078
- Søndergaard L, Ihlemann N, Capodanno D, et al. Durability of Transcatheter and Surgical Bioprosthetic Aortic Valves in Patients at Lower Surgical Risk. J Am Coll Cardiol. 2019;73(5):546-553. https://doi.org/10.1016/J.JACC.2018.10.083
- Kaneko T, Aranki S, Javed Q, et al. Mechanical versus bioprosthetic mitral valve replacement in patients. J Thorac Cardiovasc Surg. 2014;147(1):117-126. https://doi.org/10.1016/J.JTCVS.2013.08.028
- Bourguignon T, Bouquiaux-Stablo AL, Loardi C, et al. Very late outcomes for mitral valve replacement with the Carpentier-Edwards pericardial bioprosthesis: 25-year follow-up of 450 implantations. J Thorac Cardiovasc Surg. 2014;148(5):2004-2011.e1. https://doi.org/10.1016/J.JTCVS.2014.02.050
- Weber A, Noureddine H, Englberger L, et al. Ten-year comparison of pericardial tissue valves versus mechanical prostheses for aortic valve replacement in patients younger than 60 years of age. J Thorac Cardiovasc Surg. 2012;144(5):1075-1083. https://doi.org/10.1016/J.JTCVS.2012.01.024
- Hammermeister K, Sethi GK, Henderson WG, Grover FL, Oprian C, Rahimtoola SH. Outcomes 15 years after valve replacement with a mechanical versus a bioprosthetic valve: final report of the Veterans Affairs randomized trial. J Am Coll Cardiol. 2000;36(4):1152-1158. https://doi.org/10.1016/S0735-1097(00)00834-2
- Chan V, Jamieson WRE, Germann E, et al. Performance of bioprostheses and mechanical prostheses assessed by composites of valve-related complications to 15 years after aortic valve replacement. J Thorac Cardiovasc Surg. 2006;131(6):1267-1273. https://doi.org/10.1016/J.JTCVS.2005.11.052
- Banbury MK, Cosgrove DM, Thomas JD, et al. Hemodynamic stability during 17 years of the Carpentier-Edwards aortic pericardial bioprosthesis. Ann Thorac Surg. 2002;73(5):1460-1465. https://doi.org/10.1016/S0003-4975(02)03445-8
- Dellgren G, David TE, Raanani E, Armstrong S, Ivanov J, Rakowski H. Late hemodynamic and clinical outcomes of aortic valve replacement with the Carpentier-Edwards Perimount pericardial bioprosthesis. J Thorac Cardiovasc Surg. 2002;124(1):146-154. https://doi.org/10.1067/MTC.2002.121672
- Borger MA, Ivanov J. Twenty-Year Results of the Hancock II Bioprosthesis.; 2006. https://www.researchgate.net/publication/7297016
- Mykén PSU, Bech-Hansen O. A 20-year experience of 1712 patients with the Biocor porcine bioprosthesis. J Thorac Cardiovasc Surg. 2009;137(1):76-81. https://doi.org/10.1016/J.JTCVS.2008.05.068
- Goldstone AB, Chiu P, Baiocchi M, et al. Mechanical or Biologic Prostheses for Aortic-Valve and Mitral-Valve Replacement. N Engl J Med. 2017;377(19):1847-1857. https://doi.org/10.1056/NEJMOA1613792
- Badhwar V, Ofenloch JC, Rovin JD, van Gelder HM, Jacobs JP. Noninferiority of closely monitored mechanical valves to bioprostheses overshadowed by early mortality benefit in younger patients. Ann Thorac Surg. 2012;93(3):748-753. https://doi.org/10.1016/J.ATHORACSUR.2011.12.032
- Brown ML, Schaff H v., Lahr BD, et al. Aortic valve replacement in patients aged 50 to 70 years: improved outcome with mechanical versus biologic prostheses. J Thorac Cardiovasc Surg. 2008;135(4):878-884. https://doi.org/10.1016/J.JTCVS.2007.10.065
- Kulik A, Bédard P, Lam BK, et al. Mechanical versus bioprosthetic valve replacement in middle-aged patients. Eur J Cardiothorac Surg. 2006;30(3):485-491. https://doi.org/10.1016/J.EJCTS.2006.06.013
- Glaser N, Jackson V, Holzmann MJ, Franco-Cereceda A, Sartipy U. Aortic valve replacement with mechanical vs. biological prostheses in patients aged 50-69 years. Eur Heart J. 2016;37(34):2658-2667. https://doi.org/10.1093/EURHEARTJ/EHV580
- Chikwe J, Chiang YP, Egorova NN, Itagaki S, Adams DH. Survival and outcomes following bioprosthetic vs mechanical mitral valve replacement in patients aged 50 to 69 years. JAMA. 2015;313(14):1435-1442. https://doi.org/10.1001/JAMA.2015.3164
- McClure RS, McGurk S, Cevasco M, et al. Late outcomes comparison of nonelderly patients with stented bioprosthetic and mechanical valves in the aortic position: a propensity-matched analysis. J Thorac Cardiovasc Surg. 2014;148(5):1931-1939. https://doi.org/10.1016/J.JTCVS.2013.12.042
- Chiang YP, Chikwe J, Moskowitz AJ, Itagaki S, Adams DH, Egorova NN. Survival and long-term outcomes following bioprosthetic vs mechanical aortic valve replacement in patients aged 50 to 69 years. JAMA. 2014;312(13):1323-1329. https://doi.org/10.1001/JAMA.2014.12679
- Buratto E, Shi WY, Wynne R, et al. Improved Survival After the Ross Procedure Compared With Mechanical Aortic Valve Replacement. J Am Coll Cardiol. 2018;71(12):1337-1344. https://doi.org/10.1016/J.JACC.2018.01.048
- El-Hamamsy I, Eryigit Z, Stevens LM, et al. Long-term outcomes after autograft versus homograft aortic root replacement in adults with aortic valve disease: a randomised controlled trial. Lancet. 2010;376(9740):524-531. https://doi.org/10.1016/S0140-6736(10)60828-8
- Martin E, Mohammadi S, Jacques F, et al. Clinical Outcomes Following the Ross Procedure in Adults: A 25-Year Longitudinal Study. J Am Coll Cardiol. 2017;70(15):1890-1899. https://doi.org/10.1016/J.JACC.2017.08.030
- Cannegieter SC, Rosendaal FR, Wintzen AR, van der Meer FJM, Vandenbroucke JP, Briet E. Optimal oral anticoagulant therapy in patients with mechanical heart valves. N Engl J Med. 1995;333(1):11-17. https://doi.org/10.1056/NEJM199507063330103
- Sun JC, Davidson MJ, Lamy A, Eikelboom JW. Antithrombotic management of patients with prosthetic heart valves: current evidence and future trends. Lancet. 2009;374(9689):565-576. https://doi.org/10.1016/S0140-6736(09)60780-7
- van de Werf F, Brueckmann M, Connolly SJ, et al. A comparison of dabigatran etexilate with warfarin in patients with mechanical heart valves: THE Randomized, phase II study to evaluate the safety and pharmacokinetics of oral dabigatran etexilate in patients after heart valve replacement (RE-ALIGN). Am Heart J. 2012;163(6). https://doi.org/10.1016/J.AHJ.2012.03.011
- Cannegieter SC, Rosendaal FR, Briët E. Thromboembolic and bleeding complications in patients with mechanical heart valve prostheses. Circulation. 1994;89(2):635-641. https://doi.org/10.1161/01.CIR.89.2.635
- Torella M, Torella D, Chiodini P, et al. LOWERing the INtensity of oral anticoaGulant Therapy in patients with bileaflet mechanical aortic valve replacement: results from the “LOWERING-IT” Trial. Am Heart J. 2010;160(1):171-178. https://doi.org/10.1016/J.AHJ.2010.05.005
- Hering D, Piper C, Bergemann R, et al. Thromboembolic and bleeding complications following St. Jude Medical valve replacement: results of the German Experience With Low-Intensity Anticoagulation Study. Chest. 2005;127(1):53-59. https://doi.org/10.1378/CHEST.127.1.53
- Acar J, Iung B, Boissel JP, et al. AREVA: multicenter randomized comparison of low-dose versus standard-dose anticoagulation in patients with mechanical prosthetic heart valves. Circulation. 1996;94(9):2107-2112. https://doi.org/10.1161/01.CIR.94.9.2107
- Whitlock RP, Sun JC, Fremes SE, Rubens FD, Teoh KH. Antithrombotic and thrombolytic therapy for valvular disease: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012;141(2 Suppl):e576S-e600S. https://doi.org/10.1378/CHEST.11-2305
- Horstkotte D, Scharf RE, Schultheiss HP. Intracardiac thrombosis: patient-related and device-related factors. J Heart Valve Dis. 1995;4(2):114-120. Accessed May 30, 2022. https://europepmc.org/article/med/8556170
- Pruefer D, Dahm M, Dohmen G, Horstkotte D, Bergemann R, Oelert H. Intensity of oral anticoagulation after implantation of St. Jude Medical mitral or multiple valve replacement: lessons learned from GELIA (GELIA 5). European Heart Journal Supplements. 2001;3(suppl_Q):Q39-Q43. https://doi.org/10.1016/S1520-765X(01)90041-0
- Rodés-Cabau J, Masson JB, Welsh RC, et al. Aspirin Versus Aspirin Plus Clopidogrel as Antithrombotic Treatment Following Transcatheter Aortic Valve Replacement With a Balloon-Expandable Valve: The ARTE (Aspirin Versus Aspirin + Clopidogrel Following Transcatheter Aortic Valve Implantation) Randomized Clinical Trial. JACC Cardiovasc Interv. 2017;10(13):1357-1365. https://doi.org/10.1016/J.JCIN.2017.04.014
- Zuo W, Yang M, He Y, Hao C, Chen L, Ma G. Single or dual antiplatelet therapy after transcatheter aortic valve replacement: an updated systemic review and meta-analysis. J Thorac Dis. 2019;11(3):959-968. https://doi.org/10.21037/JTD.2019.01.87
- Maes F, Stabile E, Ussia GP, et al. Meta-Analysis Comparing Single Versus Dual Antiplatelet Therapy Following Transcatheter Aortic Valve Implantation. Am J Cardiol. 2018;122(2):310-315. https://doi.org/10.1016/J.AMJCARD.2018.04.006
- Heras M, Chesebro JH, Fuster V, et al. High risk of thromboemboli early after bioprosthetic cardiac valve replacement. J Am Coll Cardiol. 1995;25(5):1111-1119. https://doi.org/10.1016/0735-1097(94)00563-6
- Colli A, Castella M. Comparing Warfarin to Aspirin (WoA) after Aortic Valve Replacement with the St. Jude Medical EpicTM Heart Valve Bioprosthesis: Results of the WoA Epic Pilot Trial. Published online 2007. Accessed May 31, 2022. https://www.researchgate.net/publication/5752586
- Aramendi JI, Mestres CA, Martinez-León J, Campos V, Muñoz G, Navas C. Triflusal versus oral anticoagulation for primary prevention of thromboembolism after bioprosthetic valve replacement (trac): prospective, randomized, co-operative trial. Eur J Cardiothorac Surg. 2005;27(5):854-860. https://doi.org/10.1016/J.EJCTS.2004.12.064
- Nuñez L, Aguado MG, Larrea JL, Celemín D, Oliver J. Prevention of thromboembolism using aspirin after mitral valve replacement with porcine bioprosthesis. Ann Thorac Surg. 1984;37(1):84-87. https://doi.org/10.1016/S0003-4975(10)60717-5
- Tiede DJ, Nishimura RA, Gastineau DA, Mullany CJ, Orszulak TA, Schaff H v. Modern management of prosthetic valve anticoagulation. Mayo Clin Proc. 1998;73(7):665-680. https://doi.org/10.1016/S0025-6196(11)64893-3
- Mérie C, Køber L, Skov Olsen P, et al. Association of warfarin therapy duration after bioprosthetic aortic valve replacement with risk of mortality, thromboembolic complications, and bleeding. JAMA. 2012;308(20):2118-2125. https://doi.org/10.1001/JAMA.2012.54506
- Russo A, Grigioni F, Avierinos JF, et al. Thromboembolic complications after surgical correction of mitral regurgitation incidence, predictors, and clinical implications. J Am Coll Cardiol. 2008;51(12):1203-1211. https://doi.org/10.1016/J.JACC.2007.10.058
- Egbe AC, Pislaru S v., Pellikka PA, et al. Bioprosthetic Valve Thrombosis Versus Structural Failure: Clinical and Echocardiographic Predictors. J Am Coll Cardiol. 2015;66(21):2285-2294. https://doi.org/10.1016/J.JACC.2015.09.022
- Sundt TM, Zehr KJ, Dearani JA, et al. Is early anticoagulation with warfarin necessary after bioprosthetic aortic valve replacement? J Thorac Cardiovasc Surg. 2005;129(5):1024-1031. https://doi.org/10.1016/J.JTCVS.2004.11.028
- ElBardissi AW, DiBardino DJ, Chen FY, Yamashita MH, Cohn LH. Is early antithrombotic therapy necessary in patients with bioprosthetic aortic valves in normal sinus rhythm? J Thorac Cardiovasc Surg. 2010;139(5):1137-1145. https://doi.org/10.1016/J.JTCVS.2009.10.064
- Massel DR, Little SH. Antiplatelet and anticoagulation for patients with prosthetic heart valves. Cochrane Database Syst Rev. 2013;2013(7). https://doi.org/10.1002/14651858.CD003464.PUB2
- Puskas J, Gerdisch M, Nichols D, et al. Reduced anticoagulation after mechanical aortic valve replacement: interim results from the prospective randomized on-X valve anticoagulation clinical trial randomized Food and Drug Administration investigational device exemption trial. J Thorac Cardiovasc Surg. 2014;147(4). https://doi.org/10.1016/J.JTCVS.2014.01.004
- Puskas JD, Gerdisch M, Nichols D, et al. Anticoagulation and Antiplatelet Strategies After On-X Mechanical Aortic Valve Replacement. J Am Coll Cardiol. 2018;71(24):2717-2726. https://doi.org/10.1016/J.JACC.2018.03.535
- Ussia GP, Scarabelli M, Mul M, et al. Dual antiplatelet therapy versus aspirin alone in patients undergoing transcatheter aortic valve implantation. Am J Cardiol. 2011;108(12):1772-1776. https://doi.org/10.1016/J.AMJCARD.2011.07.049
- Chakravarty T, Patel A, Kapadia S, et al. Anticoagulation After Surgical or Transcatheter Bioprosthetic Aortic Valve Replacement. J Am Coll Cardiol. 2019;74(9):1190-1200. https://doi.org/10.1016/J.JACC.2019.06.058
- Makkar RR, Fontana G, Jilaihawi H, et al. Possible Subclinical Leaflet Thrombosis in Bioprosthetic Aortic Valves. N Engl J Med. 2015;373(21):2015-2024. https://doi.org/10.1056/NEJMOA1509233
- Jose J, Sulimov DS, El-Mawardy M, et al. Clinical Bioprosthetic Heart Valve Thrombosis After Transcatheter Aortic Valve Replacement: Incidence, Characteristics, and Treatment Outcomes. JACC Cardiovasc Interv. 2017;10(7):686-697. https://doi.org/10.1016/J.JCIN.2017.01.045
- Dangas GD, Tijssen JGP, Wöhrle J, et al. A Controlled Trial of Rivaroxaban after Transcatheter Aortic-Valve Replacement. N Engl J Med. 2020;382(2):120-129. https://doi.org/10.1056/NEJMOA1911425
- Connolly SJ, Ezekowitz MD, Yusuf S, et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med. 2009;361(12):1139-1151. https://doi.org/10.1056/NEJMOA0905561
- Giugliano RP, Ruff CT, Braunwald E, et al. Edoxaban versus warfarin in patients with atrial fibrillation. N Engl J Med. 2013;369(22):2093-2104. https://doi.org/10.1056/NEJMOA1310907
- Summary of the article: Patel MR, Mahaffey KW, Garg J et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med, 2011; 365: 1557–1559 | Szczerba | Kardiologia Polska (Polish Heart Journal). Accessed June 1, 2022. https://journals.viamedica.pl/kardiologia_polska/article/view/79117
- Granger CB, Alexander JH, McMurray JJV, et al. Apixaban versus Warfarin in Patients with Atrial Fibrillation. New England Journal of Medicine. 2011;365(11):981-992. https://doi.org/10.1056/NEJMOA1107039/SUPPL_FILE/NEJMOA1107039_DISCLOSURES.PDF
- Edmunds LH. Thrombotic and bleeding complications of prosthetic heart valves. Ann Thorac Surg. 1987;44(4):430-445. https://doi.org/10.1016/S0003-4975(10)63816-7
- Regitz-Zagrosek V, Roos-Hesselink JW, Bauersachs J, et al. 2018 ESC Guidelines for the management of cardiovascular diseases during pregnancy. Eur Heart J. 2018;39(34):3165-3241. https://doi.org/10.1093/EURHEARTJ/EHY340
- Douketis JD, Spyropoulos AC, Spencer FA, et al. Perioperative management of antithrombotic therapy: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012;141(2 Suppl):e326S-e350S. https://doi.org/10.1378/CHEST.11-2298
- Kearon C, Hirsh J. Management of anticoagulation before and after elective surgery. N Engl J Med. 1997;336(21):1506-1511. https://doi.org/10.1056/NEJM199705223362107
- Tinker JH, Tarhan S. Discontinuing Anticoagulant Therapy in Surgical Patients With Cardiac Valve Prostheses: Observations in 180 Operations. JAMA. 1978;239(8):738-739. https://doi.org/10.1001/JAMA.1978.03280350062016
- Lankiewicz MW, Hays J, Friedman KD, Tinkoff G, Blatt PM. Urgent reversal of warfarin with prothrombin complex concentrate. J Thromb Haemost. 2006;4(5):967-970. https://doi.org/10.1111/J.1538-7836.2006.01815.X
- Renda G, Ricci F, Giugliano RP, de Caterina R. Non-Vitamin K Antagonist Oral Anticoagulants in Patients With Atrial Fibrillation and Valvular Heart Disease. J Am Coll Cardiol. 2017;69(11):1363-1371. https://doi.org/10.1016/J.JACC.2016.12.038
- Hammerstingl C, Tripp C, Schmidt H, von der Recke G, Omran H. Periprocedural Bridging Therapy with Low-Molecular-Weight Heparin in Chronically Anticoagulated Patients with Prosthetic Mechanical Heart Valves: Experience in 116 Patients from the Prospective BRAVE Registry. Published online 2007.
- Hjellström L, Labaf A. Prophylactic doses of low-molecular weight heparin as periprocedural bridging therapy in mechanical heart valve patients. Thromb Res. 2018;163:180-184. https://doi.org/10.1016/J.THROMRES.2017.09.023
- Tomaselli GF, Mahaffey KW, Cuker A, et al. 2017 ACC Expert Consensus Decision Pathway on Management of Bleeding in Patients on Oral Anticoagulants: A Report of the American College of Cardiology Task Force on Expert Consensus Decision Pathways. J Am Coll Cardiol. 2017;70(24):3042-3067. https://doi.org/10.1016/J.JACC.2017.09.1085
- Tsu L v., Dienes JE, Dager WE. Vitamin K dosing to reverse warfarin based on INR, route of administration, and home warfarin dose in the acute/critical care setting. Ann Pharmacother. 2012;46(12):1617-1626. https://doi.org/10.1345/APH.1R497
- Pernod G, Godiér A, Gozalo C, Tremey B, Sié P. French clinical practice guidelines on the management of patients on vitamin K antagonists in at-risk situations (overdose, risk of bleeding, and active bleeding). Thromb Res. 2010;126(3). https://doi.org/10.1016/J.THROMRES.2010.06.017
- Weibert RT, Le DT, Kayser SR, Rapaport SI. Correction of excessive anticoagulation with low-dose oral vitamin K1. Ann Intern Med. 1997;126(12):959-962. https://doi.org/10.7326/0003-4819-126-12-199706150-00005
- CV P, PA R, J E, et al. Idarucizumab for Dabigatran Reversal. N Engl J Med. 2015;373(6). https://doi.org/10.1056/NEJMOA1502000
- Siegal DM, Curnutte JT, Connolly SJ, et al. Andexanet Alfa for the Reversal of Factor Xa Inhibitor Activity. N Engl J Med. 2015;373(25):2413-2424. https://doi.org/10.1056/NEJMOA1510991
- Connolly SJ, Milling TJ, Eikelboom JW, et al. Andexanet Alfa for Acute Major Bleeding Associated with Factor Xa Inhibitors. N Engl J Med. 2016;375(12):1131-1141. https://doi.org/10.1056/NEJMOA1607887
- Connolly SJ, Crowther M, Eikelboom JW, et al. Full Study Report of Andexanet Alfa for Bleeding Associated with Factor Xa Inhibitors. N Engl J Med. 2019;380(14):1326-1335. https://doi.org/10.1056/NEJMOA1814051
- Dangas GD, Weitz JI, Giustino G, Makkar R, Mehran R. Prosthetic Heart Valve Thrombosis. J Am Coll Cardiol. 2016;68(24):2670-2689. https://doi.org/10.1016/J.JACC.2016.09.958
- Chakravarty T, Søndergaard L, Friedman J, et al. Subclinical leaflet thrombosis in surgical and transcatheter bioprosthetic aortic valves: an observational study. Lancet. 2017;389(10087):2383-2392. https://doi.org/10.1016/S0140-6736(17)30757-2
- Sondergaard L, de Backer O, Kofoed KF, et al. Natural history of subclinical leaflet thrombosis affecting motion in bioprosthetic aortic valves. Eur Heart J. 2017;38(28):2201-2207. https://doi.org/10.1093/EURHEARTJ/EHX369
- Montorsi P, de Bernardi F, Muratori M, Cavoretto D, Pepi M. Role of cine-fluoroscopy, transthoracic, and transesophageal echocardiography in patients with suspected prosthetic heart valve thrombosis. Am J Cardiol. 2000;85(1):58-64. https://doi.org/10.1016/S0002-9149(99)00607-4
- Muratori M, Montorsi P, Teruzzi G, et al. Feasibility and diagnostic accuracy of quantitative assessment of mechanical prostheses leaflet motion by transthoracic and transesophageal echocardiography in suspected prosthetic valve dysfunction. Am J Cardiol. 2006;97(1):94-100. https://doi.org/10.1016/J.AMJCARD.2005.07.112
- Cianciulli TF, Lax JA, Beck MA, et al. Cinefluoroscopic assessment of mechanical disc prostheses: its value as a complementary method to echocardiography. J Heart Valve Dis. 2005;14(5):664-673. Accessed June 1, 2022. https://europepmc.org/article/med/16245506
- Symersky P, Budde RPJ, de Mol BAJM, Prokop M. Comparison of multidetector-row computed tomography to echocardiography and fluoroscopy for evaluation of patients with mechanical prosthetic valve obstruction. Am J Cardiol. 2009;104(8):1128-1134. https://doi.org/10.1016/J.AMJCARD.2009.05.061
- Bapat V, Attia R, Redwood S, et al. Use of transcatheter heart valves for a valve-in-valve implantation in patients with degenerated aortic bioprosthesis: technical considerations and results. J Thorac Cardiovasc Surg. 2012;144(6):1372-1380. https://doi.org/10.1016/J.JTCVS.2012.07.104
- Gündüz S, Özkan M, Kalçik M, et al. Sixty-Four-Section Cardiac Computed Tomography in Mechanical Prosthetic Heart Valve Dysfunction: Thrombus or Pannus. Circ Cardiovasc Imaging. 2015;8(12). https://doi.org/10.1161/CIRCIMAGING.115.003246
- Suh YJ, Lee S, Im DJ, et al. Added value of cardiac computed tomography for evaluation of mechanical aortic valve: Emphasis on evaluation of pannus with surgical findings as standard reference. Int J Cardiol. 2016;214:454-460. https://doi.org/10.1016/J.IJCARD.2016.04.011
- Barbetseas J, Nagueh SF, Pitsavos C, Toutouzas PK, Quiñones MA, Zoghbi WA. Differentiating thrombus from pannus formation in obstructed mechanical prosthetic valves: an evaluation of clinical, transthoracic and transesophageal echocardiographic parameters. J Am Coll Cardiol. 1998;32(5):1410-1417. https://doi.org/10.1016/S0735-1097(98)00385-4
- Zoghbi WA, Chambers JB, Dumesnil JG, et al. Recommendations for evaluation of prosthetic valves with echocardiography and doppler ultrasound: a report From the American Society of Echocardiography’s Guidelines and Standards Committee and the Task Force on Prosthetic Valves, developed in conjunction with the American College of Cardiology Cardiovascular Imaging Committee, Cardiac Imaging Committee of the American Heart Association, the European Association of Echocardiography, a registered branch of the European Society of Cardiology, the. J Am Soc Echocardiogr. 2009;22(9):975-1014. https://doi.org/10.1016/J.ECHO.2009.07.013
- Özkan M, Gündüz S, Biteker M, et al. Comparison of different TEE-guided thrombolytic regimens for prosthetic valve thrombosis: the TROIA trial. JACC Cardiovasc Imaging. 2013;6(2):206-216. https://doi.org/10.1016/J.JCMG.2012.10.016
- Suchá D, Symersky P, Tanis W, et al. Multimodality Imaging Assessment of Prosthetic Heart Valves. Circ Cardiovasc Imaging. 2015;8(9). https://doi.org/10.1161/CIRCIMAGING.115.003703
- Cáceres-Lóriga FM, Pérez-López H, Morlans-Hernández K, et al. Thrombolysis as first choice therapy in prosthetic heart valve thrombosis. A study of 68 patients. J Thromb Thrombolysis. 2006;21(2):185-190. https://doi.org/10.1007/S11239-006-4969-Y
- Özkan M, Çakal B, Karakoyun S, et al. Thrombolytic therapy for the treatment of prosthetic heart valve thrombosis in pregnancy with low-dose, slow infusion of tissue-type plasminogen activator. Circulation. 2013;128(5):532-540. https://doi.org/10.1161/CIRCULATIONAHA.113.001145
- Karthikeyan G, Senguttuvan NB, Joseph J, Devasenapathy N, Bahl VK, Airan B. Urgent surgery compared with fibrinolytic therapy for the treatment of left-sided prosthetic heart valve thrombosis: a systematic review and meta-analysis of observational studies. Eur Heart J. 2013;34(21):1557-1566. https://doi.org/10.1093/EURHEARTJ/EHS486
- Keuleers S, Herijgers P, Herregods MC, et al. Comparison of thrombolysis versus surgery as a first line therapy for prosthetic heart valve thrombosis. Am J Cardiol. 2011;107(2):275-279. https://doi.org/10.1016/J.AMJCARD.2010.09.013
- Nagy A, Nagy A, Dénes M, Lengyel M. Predictors of the Outcome of Thrombolytic Therapy in Prosthetic Mitral Valve Thrombosis: A Study of 62 Events Emiratis vs South Asian Young Patients With Acute Coronary Syndromes: Risk Factor Profiles, Presentations and In-Hospital Outcomes View project Predictors of the Outcome of Thrombolytic Therapy in Prosthetic Mitral Valve Thrombosis: A Study of 62 Events. Published online 2014. Accessed June 1, 2022. https://www.researchgate.net/publication/26322239
- Roudaut R, Lafitte S, Roudaut MF, et al. Management of prosthetic heart valve obstruction: fibrinolysis versus surgery. Early results and long-term follow-up in a single-centre study of 263 cases. Arch Cardiovasc Dis. 2009;102(4):269-277. https://doi.org/10.1016/J.ACVD.2009.01.007
- Tong AT, Roudaut R, Ozkan M, et al. Transesophageal echocardiography improves risk assessment of thrombolysis of prosthetic valve thrombosis: results of the international PRO-TEE registry. J Am Coll Cardiol. 2004;43(1):77-84. https://doi.org/10.1016/J.JACC.2003.08.028
- Bade AS, Shaikh SSA, Khemani H, Singh G, Bansal NO. Thrombolysis Is an Effective and Safe Therapy in Stuck Mitral Valves With Delayed Presentation as Well as Hemodynamically Unstable Patients: A Single Centre Study. Cardiol Res. 2018;9(3):161-164. https://doi.org/10.14740/CR708W
- Pragt H, van Melle JP, Javadikasgari H, et al. Mechanical valves in the pulmonary position: An international retrospective analysis. J Thorac Cardiovasc Surg. 2017;154(4):1371-1378.e1. https://doi.org/10.1016/J.JTCVS.2017.04.072
- Taherkhani M, Hashemi SR, Hekmat M, Safi M, Taherkhani A, Movahed MR. Thrombolytic Therapy for Right-Sided Mechanical Pulmonic and Tricuspid Valves: The Largest Survival Analysis to Date. Tex Heart Inst J. 2015;42(6):543-547. https://doi.org/10.14503/THIJ-14-4659
- Özkan M, Gündüz S, Gürsoy OM, et al. Ultraslow thrombolytic therapy: A novel strategy in the management of PROsthetic MEchanical valve Thrombosis and the prEdictors of outcomE: The Ultra-slow PROMETEE trial. Am Heart J. 2015;170(2):409-418.e1. https://doi.org/10.1016/J.AHJ.2015.04.025
- Puri R, Auffret V, Rodés-Cabau J. Bioprosthetic Valve Thrombosis. J Am Coll Cardiol. 2017;69(17):2193-2211. https://doi.org/10.1016/J.JACC.2017.02.051
- Puvimanasinghe JPA, Steyerberg EW, Takkenberg JJM, et al. Prognosis after aortic valve replacement with a bioprosthesis: predictions based on meta-analysis and microsimulation. Circulation. 2001;103(11):1535-1541. https://doi.org/10.1161/01.CIR.103.11.1535
- Jander N, Kienzle RP, Kayser G, Neumann FJ, Gohlke-Baerwolf C, Minners J. Usefulness of phenprocoumon for the treatment of obstructing thrombus in bioprostheses in the aortic valve position. Am J Cardiol. 2012;109(2):257-262. https://doi.org/10.1016/J.AMJCARD.2011.08.038
- Butnaru A, Shaheen J, Tzivoni D, Tauber R, Bitran D, Silberman S. Diagnosis and treatment of early bioprosthetic malfunction in the mitral valve position due to thrombus formation. Am J Cardiol. 2013;112(9):1439-1444. https://doi.org/10.1016/J.AMJCARD.2013.06.014
- Pislaru S v., Hussain I, Pellikka PA, et al. Misconceptions, diagnostic challenges and treatment opportunities in bioprosthetic valve thrombosis: lessons from a case series. Eur J Cardiothorac Surg. 2015;47(4):725-732. https://doi.org/10.1093/EJCTS/EZU201
- de Marchena E, Mesa J, Pomenti S, et al. Thrombus formation following transcatheter aortic valve replacement. JACC Cardiovasc Interv. 2015;8(5):728-739. https://doi.org/10.1016/J.JCIN.2015.03.005
- Petrescu I, Egbe AC, Ionescu F, et al. Long-Term Outcomes of Anticoagulation for Bioprosthetic Valve Thrombosis. J Am Coll Cardiol. 2020;75(8):857-866. https://doi.org/10.1016/J.JACC.2019.12.037
- Sellers SL, Turner CT, Sathananthan J, et al. Transcatheter Aortic Heart Valves: Histological Analysis Providing Insight to Leaflet Thickening and Structural Valve Degeneration. JACC Cardiovasc Imaging. 2019;12(1):135-145. https://doi.org/10.1016/J.JCMG.2018.06.028
- Latib A, Naganuma T, Abdel-Wahab M, et al. Treatment and clinical outcomes of transcatheter heart valve thrombosis. Circ Cardiovasc Interv. 2015;8(4). https://doi.org/10.1161/CIRCINTERVENTIONS.114.001779
- Lancellotti P, Pibarot P, Chambers J, et al. Recommendations for the imaging assessment of prosthetic heart valves: a report from the European Association of Cardiovascular Imaging endorsed by the Chinese Society of Echocardiography, the Inter-American Society of Echocardiography, and the Brazilian Department of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging. 2016;17(6):589-590. https://doi.org/10.1093/EHJCI/JEW025
- Leontyev S, Borger MA, Davierwala P, et al. Redo aortic valve surgery: early and late outcomes. Ann Thorac Surg. 2011;91(4):1120-1126. https://doi.org/10.1016/J.ATHORACSUR.2010.12.053
- Kaneko T, Vassileva CM, Englum B, et al. Contemporary Outcomes of Repeat Aortic Valve Replacement: A Benchmark for Transcatheter Valve-in-Valve Procedures. Ann Thorac Surg. 2015;100(4):1298-1304. https://doi.org/10.1016/J.ATHORACSUR.2015.04.062
- Jaussaud N, Gariboldi V, Grisoli D, et al. Risk of reoperation for mitral bioprosthesis dysfunction. J Heart Valve Dis. 2012;21(1):56-60. Accessed June 4, 2022. https://europepmc.org/article/med/22474743
- Dvir D, Webb JG, Bleiziffer S, et al. Transcatheter aortic valve implantation in failed bioprosthetic surgical valves. JAMA. 2014;312(2):162-170. https://doi.org/10.1001/JAMA.2014.7246
- Ye J, Cheung A, Yamashita M, et al. Transcatheter Aortic and Mitral Valve-in-Valve Implantation for Failed Surgical Bioprosthetic Valves: An 8-Year Single-Center Experience. JACC Cardiovasc Interv. 2015;8(13):1735-1744. https://doi.org/10.1016/J.JCIN.2015.08.012
- Zoghbi WA, Asch FM, Bruce C, et al. Guidelines for the Evaluation of Valvular Regurgitation After Percutaneous Valve Repair or Replacement: A Report from the American Society of Echocardiography Developed in Collaboration with the Society for Cardiovascular Angiography and Interventions, Japanese Society of Echocardiography, and Society for Cardiovascular Magnetic Resonance. Journal of the American Society of Echocardiography. 2019;32(4):431-475. https://doi.org/10.1016/J.ECHO.2019.01.003
- Hascoet S, Smolka G, Bagate F, et al. Multimodality imaging guidance for percutaneous paravalvular leak closure: Insights from the multi-centre FFPP register. Arch Cardiovasc Dis. 2018;111(6-7):421-431. https://doi.org/10.1016/J.ACVD.2018.05.001
- García-Fernández MA, Cortés M, García-Robles JA, Gomez de Diego JJ, Perez-David E, García E. Utility of real-time three-dimensional transesophageal echocardiography in evaluating the success of percutaneous transcatheter closure of mitral paravalvular leaks. J Am Soc Echocardiogr. 2010;23(1):26-32. https://doi.org/10.1016/J.ECHO.2009.09.028
- Nombela-Franco L, Ribeiro HB, Urena M, et al. Significant mitral regurgitation left untreated at the time of aortic valve replacement: a comprehensive review of a frequent entity in the transcatheter aortic valve replacement era. J Am Coll Cardiol. 2014;63(24):2643-2658. https://doi.org/10.1016/J.JACC.2014.02.573
- Ruiz CE, Hahn RT, Berrebi A, et al. Clinical Trial Principles and Endpoint Definitions for Paravalvular Leaks in Surgical Prosthesis: An Expert Statement. J Am Coll Cardiol. 2017;69(16):2067-2087. https://doi.org/10.1016/J.JACC.2017.02.038
- Akins CW, Bitondo JM, Hilgenberg AD, Vlahakes GJ, Madsen JC, MacGillivray TE. Early and late results of the surgical correction of cardiac prosthetic paravalvular leaks. J Heart Valve Dis. 2005;14(6):792-799; discussion 799. Accessed June 4, 2022. https://europepmc.org/article/med/16359061
- Sorajja P, Cabalka AK, Hagler DJ, Rihal CS. Percutaneous repair of paravalvular prosthetic regurgitation: acute and 30-day outcomes in 115 patients. Circ Cardiovasc Interv. 2011;4(4):314-321. https://doi.org/10.1161/CIRCINTERVENTIONS.110.960955
- Sorajja P, Cabalka AK, Hagler DJ, Rihal CS. Long-term follow-up of percutaneous repair of paravalvular prosthetic regurgitation. J Am Coll Cardiol. 2011;58(21):2218-2224. https://doi.org/10.1016/J.JACC.2011.07.041
- Alkhouli M, Rihal CS, Zack CJ, et al. Transcatheter and Surgical Management of Mitral Paravalvular Leak: Long-Term Outcomes. JACC Cardiovasc Interv. 2017;10(19):1946-1956. https://doi.org/10.1016/J.JCIN.2017.07.046
- Alkhouli M, Zack CJ, Sarraf M, et al. Successful Percutaneous Mitral Paravalvular Leak Closure Is Associated With Improved Midterm Survival. Circ Cardiovasc Interv. 2017;10(12). https://doi.org/10.1161/CIRCINTERVENTIONS.117.005730
- Ruiz CE, Jelnin V, Kronzon I, et al. Clinical outcomes in patients undergoing percutaneous closure of periprosthetic paravalvular leaks. J Am Coll Cardiol. 2011;58(21):2210-2217. https://doi.org/10.1016/J.JACC.2011.03.074
- Phan K, Zhao DF, Wang N, Huo YR, Eusanio M di, Yan TD. Transcatheter valve-in-valve implantation versus reoperative conventional aortic valve replacement: a systematic review. J Thorac Dis. 2016;8(1):E83-E93. https://doi.org/10.3978/J.ISSN.2072-1439.2016.01.44
- Webb JG, Wood DA, Ye J, et al. Transcatheter valve-in-valve implantation for failed bioprosthetic heart valves. Circulation. 2010;121(16):1848-1857. https://doi.org/10.1161/CIRCULATIONAHA.109.924613
- Shah S, Alashi A, Pettersson GB, et al. Characteristics and longer-term outcomes of paravalvular leak after aortic and mitral valve surgery. J Thorac Cardiovasc Surg. 2019;157(5):1785-1792.e1. https://doi.org/10.1016/J.JTCVS.2018.08.096
- Bouhout I, Mazine A, Ghoneim A, et al. Long-term results after surgical treatment of paravalvular leak in the aortic and mitral position. J Thorac Cardiovasc Surg. 2016;151(5):1260-1266.e1. https://doi.org/10.1016/J.JTCVS.2015.11.046
- Karchmer AW, Chu VH, Otto CM. Prosthetic valve endocarditis: Epidemiology, clinical manifestations, and diagnosis.
- Li JS, Sexton DJ, Mick N, et al. Proposed modifications to the Duke criteria for the diagnosis of infective endocarditis. Clin Infect Dis. 2000;30(4):633-638. https://doi.org/10.1086/313753
- Cahill TJ, Baddour LM, Habib G, et al. Challenges in Infective Endocarditis. J Am Coll Cardiol. 2017;69(3):325-344. https://doi.org/10.1016/J.JACC.2016.10.066
- Mgbojikwe N, Jones SR, Leucker TM, Brotman DJ. Infective endocarditis: Beyond the usual tests. Cleve Clin J Med. 2019;86(8):559-567. https://doi.org/10.3949/CCJM.86A.18120
- Mahmood M, Kendi AT, Ajmal S, et al. Meta-analysis of 18F-FDG PET/CT in the diagnosis of infective endocarditis. J Nucl Cardiol. 2019;26(3):922-935. https://doi.org/10.1007/S12350-017-1092-8
- Liebschutz JM, Crooks D, Herman D, et al. Buprenorphine treatment for hospitalized, opioid-dependent patients: a randomized clinical trial. JAMA Intern Med. 2014;174(8):1369-1376. https://doi.org/10.1001/JAMAINTERNMED.2014.2556
- Iversen K, Ihlemann N, Gill SU, et al. Partial oral versus intravenous antibiotic treatment of endocarditis. New England Journal of Medicine. 2019;380(5):415-424.
- Prendergast BD, Tornos P. Surgery for infective endocarditis: Who and when? Circulation. 2010;121(9):1141-1152. https://doi.org/10.1161/CIRCULATIONAHA.108.773598
- Lalani T, Chu VH, Park LP, et al. In-hospital and 1-year mortality in patients undergoing early surgery for prosthetic valve endocarditis. JAMA Intern Med. 2013;173(16):1495-1504.
- Fowler VG, Miro JM, Hoen B, et al. Staphylococcus aureus endocarditis: a consequence of medical progress. JAMA. 2005;293(24):3012-3021.
- Hill EE, Herijgers P, Claus P, Vanderschueren S, Herregods MC, Peetermans WE. Infective endocarditis: changing epidemiology and predictors of 6-month mortality: a prospective cohort study. Eur Heart J. 2007;28(2):196-203.
- Murdoch DR, Corey GR, Hoen B, et al. Clinical presentation, etiology, and outcome of infective endocarditis in the 21st century: the International Collaboration on Endocarditis–Prospective Cohort Study. Arch Intern Med. 2009;169(5):463-473.
- Spiliopoulos K, Haschemi A, Fink G, Kemkes BM. Infective endocarditis complicated by paravalvular abscess: A surgical challenge. An 11-year single center experience. Heart Surgery Forum. 2010;13(2). https://doi.org/10.1532/HSF98.20081141
- Head SJ, Mokhles MM, Osnabrugge RLJ, Bogers AJJC, Kappetein AP. Surgery in current therapy for infective endocarditis. Vasc Health Risk Manag. 2011;7:255.
- Baddour LM, Epstein AE, Erickson CC, et al. Update on cardiovascular implantable electronic device infections and their management: a scientific statement from the American Heart Association. Circulation. 2010;121(3):458-477. https://doi.org/10.1161/CIRCULATIONAHA.109.192665
- Lin AY, Saul T, Aldaas OM, et al. Early versus delayed lead extraction in patients with infected cardiovascular implantable electronic devices. JACC Clin Electrophysiol. 2021;7(6):755-763.
- Ghoreishi M, Foster N, Pasrija C, et al. Early operation in patients with mitral valve infective endocarditis and acute stroke is safe. Ann Thorac Surg. 2018;105(1):69-75.
- Orwat S, Diller GP, van Hagen IM, et al. Risk of Pregnancy in Moderate and Severe Aortic Stenosis: From the Multinational ROPAC Registry. J Am Coll Cardiol. 2016;68(16):1727-1737. https://doi.org/10.1016/J.JACC.2016.07.750
- Tzemos N, Silversides CK, Colman JM, et al. Late cardiac outcomes after pregnancy in women with congenital aortic stenosis. Am Heart J. 2009;157(3):474-480. https://doi.org/10.1016/J.AHJ.2008.10.020
- Arias F, J. Pineda. Aortic stenosis and pregnancy.
- Silversides CK, Colman JM, Sermer M, Farine D, Siu SC. Early and intermediate-term outcomes of pregnancy with congenital aortic stenosis. Am J Cardiol. 2003;91(11):1386-1389. https://doi.org/10.1016/S0002-9149(03)00340-0
- Yap SC, Drenthen W, Pieper PG, et al. Risk of complications during pregnancy in women with congenital aortic stenosis. Int J Cardiol. 2008;126(2):240-246. https://doi.org/10.1016/J.IJCARD.2007.03.134
- Sugishita Y, Ito I, Kubo T. Pregnancy in Cardiac Patients: Possible Influence of Volume Overload by Pregnancy on Pulmonary Circulation : PANEL DISCUSSION ON PUMP FAILURE OF THE HEART WITH COMPLICATIONS : 49th Annual Scientific Session of the Japanese Circulation Society. Jpn Circ J. 1986;50(4):376-383. https://doi.org/10.1253/JCJ.50.376
- de Santo LS, Romano G, della Corte A, et al. Mechanical Aortic Valve Replacement in Young Women Planning on Pregnancy: Maternal and Fetal Outcomes Under Low Oral Anticoagulation, a Pilot Observational Study on a Comprehensive Pre-Operative Counseling Protocol. J Am Coll Cardiol. 2012;59(12):1110-1115. https://doi.org/10.1016/J.JACC.2011.10.899
- Leśniak-Sobelga A, Tracz W, Kostkiewicz M, Podolec P, Pasowicz M. Clinical and echocardiographic assessment of pregnant women with valvular heart diseases—maternal and fetal outcome. Int J Cardiol. 2004;94(1):15-23. https://doi.org/10.1016/J.IJCARD.2003.03.017
- Hameed A, Karaalp IS, Tummala PP, et al. The effect of valvular heart disease on maternal and fetal outcome of pregnancy. J Am Coll Cardiol. 2001;37(3):893-899. https://doi.org/10.1016/S0735-1097(00)01198-0
- Orwat S, Diller GP, van Hagen IM, et al. Risk of Pregnancy in Moderate and Severe Aortic Stenosis: From the Multinational ROPAC Registry. J Am Coll Cardiol. 2016;68(16):1727-1737. https://doi.org/10.1016/J.JACC.2016.07.750
- Vinayakumar D, Vinod G v., Madhavan S, Krishnan MN. Maternal and fetal outcomes in pregnant women undergoing balloon mitral valvotomy for rheumatic mitral stenosis. Indian Heart J. 2016;68(6):780-782. https://doi.org/10.1016/J.IHJ.2016.04.017
- Gulraze A, Kurdi W, Niaz FA, Fawzy ME. Mitral balloon valvuloplasty during pregnancy:The long term up to 17 years obstetric outcome and childhood development. Pak J Med Sci. 2014;30(1):86. https://doi.org/10.12669/PJMS.301.4305
- Salomé N, Dias CC, Ribeiro J, Gonçalves M, Fonseca C, Ribeiro VG. Balloon mitral valvuloplasty during pregnancy–our experience. Rev Port Cardiol. 2002;21(12):1437-1444. Accessed August 29, 2022. https://europepmc.org/article/med/12621917
- Weiss BM, von Segesser LK, Alon E, Seifert B, Turina MI. Outcome of cardiovascular surgery and pregnancy: A systematic review of the period 1984-1996. Am J Obstet Gynecol. 1998;179(6):1643-1653. https://doi.org/10.1016/S0002-9378(98)70039-0
- Becker RM. Intracardiac Surgery in Pregnant Women. Ann Thorac Surg. 1983;36(4):453-458. https://doi.org/10.1016/S0003-4975(10)60486-9
- Parry AJ, Westaby S. Cardiopulmonary bypass during pregnancy. Ann Thorac Surg. 1996;61(6):1865-1869. https://doi.org/10.1016/0003-4975(96)00150-6
- Samiei N, Amirsardari M, Rezaei Y, et al. Echocardiographic Evaluation of Hemodynamic Changes in Left-Sided Heart Valves in Pregnant Women With Valvular Heart Disease. Am J Cardiol. 2016;118(7):1046-1052. https://doi.org/10.1016/J.AMJCARD.2016.07.005
- D’Souza R, Ostro J, Shah PS, et al. Anticoagulation for pregnant women with mechanical heart valves: a systematic review and meta-analysis. Eur Heart J. 2017;38(19):1509-1516. https://doi.org/10.1093/EURHEARTJ/EHX032
- Özkan M, Çakal B, Karakoyun S, et al. Thrombolytic therapy for the treatment of prosthetic heart valve thrombosis in pregnancy with low-dose, slow infusion of tissue-type plasminogen activator. Circulation. 2013;128(5):532-540. https://doi.org/10.1161/CIRCULATIONAHA.113.001145
- Tong AT, Roudaut R, Ozkan M, et al. Transesophageal echocardiography improves risk assessment of thrombolysis of prosthetic valve thrombosis: results of the international PRO-TEE registry. J Am Coll Cardiol. 2004;43(1):77-84. https://doi.org/10.1016/J.JACC.2003.08.028
- Lancellotti P, Pibarot P, Chambers J, et al. Recommendations for the imaging assessment of prosthetic heart valves: a report from the European Association of Cardiovascular Imaging endorsed by the Chinese Society of Echocardiography, the Inter-American Society of Echocardiography, and the Brazilian Department of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging. 2016;17(6):589-590. https://doi.org/10.1093/EHJCI/JEW025
- Massel DR, Little SH. Antiplatelet and anticoagulation for patients with prosthetic heart valves. Cochrane Database Syst Rev. 2013;2013(7). https://doi.org/10.1002/14651858.CD003464.PUB2
- Garrett AD. Dabigatran vs. Warfarin in patients with mechanical heart valves. Drug Topics. 2013;369(DEC):1206-1220. https://doi.org/10.1056/NEJMOA1300615/SUPPL_FILE/NEJMOA1300615_DISCLOSURES.PDF
- Bajaj A, Pancholy S, Sethi A, Rathor P. Safety and feasibility of PCI in patients undergoing TAVR: A systematic review and meta-analysis. Heart Lung. 2017;46(2):92-99. https://doi.org/10.1016/J.HRTLNG.2016.12.003
- Chakravarty T, Sharma R, Abramowitz Y, et al. Outcomes in Patients With Transcatheter Aortic Valve Replacement and Left Main Stenting: The TAVR-LM Registry. J Am Coll Cardiol. 2016;67(8):951-960. https://doi.org/10.1016/J.JACC.2015.10.103
- Mohr FW, Morice MC, Kappetein AP, et al. Coronary artery bypass graft surgery versus percutaneous coronary intervention in patients with three-vessel disease and left main coronary disease: 5-year follow-up of the randomised, clinical SYNTAX trial. Lancet. 2013;381(9867):629-638. https://doi.org/10.1016/S0140-6736(13)60141-5
- Thalji NM, Suri RM, Daly RC, et al. The prognostic impact of concomitant coronary artery bypass grafting during aortic valve surgery: implications for revascularization in the transcatheter era. J Thorac Cardiovasc Surg. 2015;149(2):451-460.e2. https://doi.org/10.1016/J.JTCVS.2014.08.073
- Faroux L, Guimaraes L, Wintzer-Wehekind J, et al. Coronary Artery Disease and Transcatheter Aortic Valve Replacement: JACC State-of-the-Art Review. J Am Coll Cardiol. 2019;74(3):362-372. https://doi.org/10.1016/J.JACC.2019.06.012
- Goel SS, Ige M, Tuzcu EM, et al. Severe aortic stenosis and coronary artery disease–implications for management in the transcatheter aortic valve replacement era: a comprehensive review. J Am Coll Cardiol. 2013;62(1):1-10. https://doi.org/10.1016/J.JACC.2013.01.096
- Sankaramangalam K, Banerjee K, Kandregula K, et al. Impact of Coronary Artery Disease on 30-Day and 1-Year Mortality in Patients Undergoing Transcatheter Aortic Valve Replacement: A Meta-Analysis. J Am Heart Assoc. 2017;6(10). https://doi.org/10.1161/JAHA.117.006092
- Millan-Iturbe O, Sawaya FJ, Lønborg J, et al. Coronary artery disease, revascularization, and clinical outcomes in transcatheter aortic valve replacement: Real-world results from the East Denmark Heart Registry. Catheter Cardiovasc Interv. 2018;92(4):818-826. https://doi.org/10.1002/CCD.27440
- Witberg G, Regev E, Chen S, et al. The Prognostic Effects of Coronary Disease Severity and Completeness of Revascularization on Mortality in Patients Undergoing Transcatheter Aortic Valve Replacement. JACC Cardiovasc Interv. 2017;10(14):1428-1435. https://doi.org/10.1016/J.JCIN.2017.04.035
- Chieffo A, Giustino G, Spagnolo P, et al. Routine Screening of Coronary Artery Disease With Computed Tomographic Coronary Angiography in Place of Invasive Coronary Angiography in Patients Undergoing Transcatheter Aortic Valve Replacement. Circ Cardiovasc Interv. 2015;8(7). https://doi.org/10.1161/CIRCINTERVENTIONS.114.002025
- Rossi A, de Cecco CN, Kennon SRO, et al. CT angiography to evaluate coronary artery disease and revascularization requirement before trans-catheter aortic valve replacement. J Cardiovasc Comput Tomogr. 2017;11(5):338-346. https://doi.org/10.1016/J.JCCT.2017.06.001
- van den Boogert TPW, Vendrik J, Claessen BEPM, et al. CTCA for detection of significant coronary artery disease in routine TAVI work-up : A systematic review and meta-analysis. Neth Heart J. 2018;26(12):591-599. https://doi.org/10.1007/S12471-018-1149-6
- Pesarini G, Scarsini R, Zivelonghi C, et al. Functional Assessment of Coronary Artery Disease in Patients Undergoing Transcatheter Aortic Valve Implantation: Influence of Pressure Overload on the Evaluation of Lesions Severity. Circ Cardiovasc Interv. 2016;9(11). https://doi.org/10.1161/CIRCINTERVENTIONS.116.004088
- Ahmad Y, Götberg M, Cook C, et al. Coronary Hemodynamics in Patients With Severe Aortic Stenosis and Coronary Artery Disease Undergoing Transcatheter Aortic Valve Replacement: Implications for Clinical Indices of Coronary Stenosis Severity. JACC Cardiovasc Interv. 2018;11(20):2019-2031. https://doi.org/10.1016/J.JCIN.2018.07.019
- Yamanaka F, Shishido K, Ochiai T, et al. Instantaneous Wave-Free Ratio for the Assessment of Intermediate Coronary Artery Stenosis in Patients With Severe Aortic Valve Stenosis: Comparison With Myocardial Perfusion Scintigraphy. JACC Cardiovasc Interv. 2018;11(20):2032-2040. https://doi.org/10.1016/J.JCIN.2018.07.027
- Graboys TB, Cohn PF. The prevalence of angina pectoris and abnormal coronary arteriograms in severe aortic valvular disease. Am Heart J. 1977;93(6):683-686. https://doi.org/10.1016/S0002-8703(77)80062-8
- Ramsdale DR, Bennett DH, Bray CL, Ward C, Beton DC, Faragher EB. Angina, coronary risk factors and coronary artery disease in patients with valvular disease. A prospective study. Eur Heart J. 1984;5(9):716-726. https://doi.org/10.1093/OXFORDJOURNALS.EURHEARTJ.A061732
- Dangas G, Khan S, Curry BH, Kini AS, Sharma SK. Angina pectoris in severe aortic stenosis. Cardiology. 1999;92(1):1-3. https://doi.org/10.1159/000006938
- Basta LL, Raines D, Najjar S, Kioschos JM. Clinical, haemodynamic, and coronary angiographic correlates of angina pectoris in patients with severe aortic valve disease. Br Heart J. 1975;37(2):150-157. https://doi.org/10.1136/HRT.37.2.150
- Thalji NM, Suri RM, Daly RC, et al. Assessment of coronary artery disease risk in 5463 patients undergoing cardiac surgery: when is preoperative coronary angiography necessary? J Thorac Cardiovasc Surg. 2013;146(5). https://doi.org/10.1016/J.JTCVS.2013.06.046
- Kannel WB, McGee D, Gordon T. A general cardiovascular risk profile: the Framingham Study. Am J Cardiol. 1976;38(1):46-51. https://doi.org/10.1016/0002-9149(76)90061-8
- Diamond GA, Forrester JS. Analysis of probability as an aid in the clinical diagnosis of coronary-artery disease. N Engl J Med. 1979;300(24):1350-1358. https://doi.org/10.1056/NEJM197906143002402
- Heidenreich PA, Kapoor JR. Radiation induced heart disease: systemic disorders in heart disease. Heart. 2009;95(3):252-258. https://doi.org/10.1136/HRT.2008.149088
- Gahl K, Sutton R, Pearson M, Caspari P, Lairet A, McDonald L. Mitral regurgitation in coronary heart disease. Br Heart J. 1977;39(1):13-18. https://doi.org/10.1136/HRT.39.1.13
- Enriquez-Sarano M, Klodas E, Garratt KN, Bailey KR, Tajik AJ, Holmes DR. Secular trends in coronary atherosclerosis–analysis in patients with valvular regurgitation. N Engl J Med. 1996;335(5):316-322. https://doi.org/10.1056/NEJM199608013350504
- Breisblatt WM, Cerqueira M, Francis CK, Plankey M, Zaret BL, Berger HJ. Left ventricular function in ischemic mitral regurgitation–a precatheterization assessment. Am Heart J. 1988;115(1 Pt 1):77-82. https://doi.org/10.1016/0002-8703(88)90520-0
- Mark DB, Berman DS, Budoff MJ, et al. ACCF/ACR/AHA/NASCI/SAIP/SCAI/SCCT 2010 expert consensus document on coronary computed tomographic angiography: a report of the American College of Cardiology Foundation Task Force on Expert Consensus Documents. J Am Coll Cardiol. 2010;55(23):2663-2699. https://doi.org/10.1016/J.JACC.2009.11.013
- Opolski MP, Kim WK, Liebetrau C, et al. Diagnostic accuracy of computed tomography angiography for the detection of coronary artery disease in patients referred for transcatheter aortic valve implantation. Clin Res Cardiol. 2015;104(6):471-480. https://doi.org/10.1007/S00392-014-0806-Z
- Andreini D, Pontone G, Mushtaq S, et al. Diagnostic accuracy of multidetector computed tomography coronary angiography in 325 consecutive patients referred for transcatheter aortic valve replacement. Am Heart J. 2014;168(3):332-339. https://doi.org/10.1016/J.AHJ.2014.04.022
- Chieffo A, Giustino G, Spagnolo P, et al. Routine Screening of Coronary Artery Disease With Computed Tomographic Coronary Angiography in Place of Invasive Coronary Angiography in Patients Undergoing Transcatheter Aortic Valve Replacement. Circ Cardiovasc Interv. 2015;8(7). https://doi.org/10.1161/CIRCINTERVENTIONS.114.002025
- Matsumoto S, Yamada Y, Hashimoto M, et al. CT imaging before transcatheter aortic valve implantation (TAVI) using variable helical pitch scanning and its diagnostic performance for coronary artery disease. Eur Radiol. 2017;27(5):1963-1970. https://doi.org/10.1007/S00330-016-4547-4
- Rossi A, de Cecco CN, Kennon SRO, et al. CT angiography to evaluate coronary artery disease and revascularization requirement before trans-catheter aortic valve replacement. J Cardiovasc Comput Tomogr. 2017;11(5):338-346. https://doi.org/10.1016/J.JCCT.2017.06.001
- Byrne JG, Leacche M, Vaughan DE, Zhao DX. Hybrid cardiovascular procedures. JACC Cardiovasc Interv. 2008;1(5):459-468. https://doi.org/10.1016/J.JCIN.2008.07.002
- Hamdan A, Wellnhofer E, Konen E, et al. Coronary CT angiography for the detection of coronary artery stenosis in patients referred for transcatheter aortic valve replacement. J Cardiovasc Comput Tomogr. 2015;9(1):31-41. https://doi.org/10.1016/J.JCCT.2014.11.008
- Pontone G, Andreini D, Bartorelli AL, et al. Feasibility and accuracy of a comprehensive multidetector computed tomography acquisition for patients referred for balloon-expandable transcatheter aortic valve implantation. Am Heart J. 2011;161(6):1106-1113. https://doi.org/10.1016/J.AHJ.2011.03.003
- Lund O, Nielsen TT, Pilegaard HK, Magnussen K, Knudsen MA. The influence of coronary artery disease and bypass grafting on early and late survival after valve replacement for aortic stenosis. J Thorac Cardiovasc Surg. 1990;100(3):327-337. https://doi.org/10.1016/S0022-5223(19)35524-2
- Beach JM, Mihaljevic T, Svensson LG, et al. Coronary artery disease and outcomes of aortic valve replacement for severe aortic stenosis. J Am Coll Cardiol. 2013;61(8):837-848. https://doi.org/10.1016/J.JACC.2012.10.049
- Ad N, Henry L, Hunt S, Holmes SD. Do we increase the operative risk by adding the Cox Maze III procedure to aortic valve replacement and coronary artery bypass surgery? J Thorac Cardiovasc Surg. 2012;143(4):936-944. https://doi.org/10.1016/J.JTCVS.2011.12.018
- Badhwar V, Rankin JS, Damiano RJ, et al. The Society of Thoracic Surgeons 2017 Clinical Practice Guidelines for the Surgical Treatment of Atrial Fibrillation. Ann Thorac Surg. 2017;103(1):329-341. https://doi.org/10.1016/J.ATHORACSUR.2016.10.076
- Ad N, Holmes SD, Pritchard G, Shuman DJ. Association of operative risk with the outcome of concomitant Cox Maze procedure: a comparison of results across risk groups. J Thorac Cardiovasc Surg. 2014;148(6):3027-3033. https://doi.org/10.1016/J.JTCVS.2014.05.039
- Ad N, Holmes SD, Rongione AJ, et al. The long-term safety and efficacy of concomitant Cox maze procedures for atrial fibrillation in patients without mitral valve disease. J Thorac Cardiovasc Surg. 2019;157(4):1505-1514. https://doi.org/10.1016/J.JTCVS.2018.09.131
- Gillinov AM, Bakaeen F, McCarthy PM, et al. Surgery for paroxysmal atrial fibrillation in the setting of mitral valve disease: a role for pulmonary vein isolation? Ann Thorac Surg. 2006;81(1):19-28. https://doi.org/10.1016/J.ATHORACSUR.2005.04.060
- Gillinov AM, Gelijns AC, Parides MK, et al. Surgical ablation of atrial fibrillation during mitral-valve surgery. N Engl J Med. 2015;372(15):1399-1409. https://doi.org/10.1056/NEJMOA1500528
- Abreu Filho CAC, Lisboa LAF, Dallan LAO, et al. Effectiveness of the maze procedure using cooled-tip radiofrequency ablation in patients with permanent atrial fibrillation and rheumatic mitral valve disease. Circulation. 2005;112(9 Suppl). https://doi.org/10.1161/CIRCULATIONAHA.104.526301
- Akpinar B, Guden M, Sagbas E, et al. Combined radiofrequency modified maze and mitral valve procedure through a port access approach: early and mid-term results. Eur J Cardiothorac Surg. 2003;24(2):223-230. https://doi.org/10.1016/S1010-7940(03)00258-6
- Chua YL, Schaff H v., Orszulak TA, Morris JJ. Outcome of mitral valve repair in patients with preoperative atrial fibrillation: Should the maze procedure be combined with mitral valvuloplasty? J Thorac Cardiovasc Surg. 1994;107(2):408-415. https://doi.org/10.1016/S0022-5223(12)70085-5
- Deneke T, Khargi K, Grewe PH, et al. Efficacy of an additional MAZE procedure using cooled-tip radiofrequency ablation in patients with chronic atrial fibrillation and mitral valve disease. A randomized, prospective trial. Eur Heart J. 2002;23(7):558-566. https://doi.org/10.1053/EUHJ.2001.2841
- Jessurun ER, van Hemel NM, Defauw JJ, de La Rivière AB. A randomized study of combining maze surgery for atrial fibrillation with mitral valve surgery. Journal of Cardiovascular Surgery. 2003;44(1):9.
- Ad N, Holmes SD, Lamont D, Shuman DJ. Left-Sided Surgical Ablation for Patients With Atrial Fibrillation Who Are Undergoing Concomitant Cardiac Surgical Procedures. Ann Thorac Surg. 2017;103(1):58-65. https://doi.org/10.1016/J.ATHORACSUR.2016.05.093
- Huffman MD, Karmali KN, Berendsen MA, et al. Concomitant atrial fibrillation surgery for people undergoing cardiac surgery. Cochrane Database Syst Rev. 2016;2016(8). https://doi.org/10.1002/14651858.CD011814.PUB2
- Huffman MD, Malaisrie SC, Karmali KN. Concomitant Atrial Fibrillation Surgery for People Undergoing Cardiac Surgery. JAMA Cardiol. 2017;2(3):334-335. https://doi.org/10.1001/JAMACARDIO.2016.5404
- Friedman DJ, Piccini JP, Wang T, et al. Association Between Left Atrial Appendage Occlusion and Readmission for Thromboembolism Among Patients With Atrial Fibrillation Undergoing Concomitant Cardiac Surgery. JAMA. 2018;319(4):365-374. https://doi.org/10.1001/JAMA.2017.20125
- Yao X, Gersh BJ, Holmes DR, et al. Association of Surgical Left Atrial Appendage Occlusion With Subsequent Stroke and Mortality Among Patients Undergoing Cardiac Surgery. JAMA. 2018;319(20):2116-2126. https://doi.org/10.1001/JAMA.2018.6024
- Johnsrud DO, Melduni RM, Lahr B, Yao X, Greason KL, Noseworthy PA. Evaluation of anticoagulation use and subsequent stroke in patients with atrial fibrillation after empiric surgical left atrial appendage closure: A retrospective case-control study. Clin Cardiol. 2018;41(12):1578-1582. https://doi.org/10.1002/CLC.23066
- Abrich VA, Narichania AD, Love WT, Lanza LA, Shen WK, Sorajja D. Left atrial appendage exclusion during mitral valve surgery and stroke in atrial fibrillation. J Interv Card Electrophysiol. 2018;53(3):285-292. https://doi.org/10.1007/S10840-018-0458-4
- García-Fernández MÁ, Pérez-David E, Quiles J, et al. Role of left atrial appendage obliteration in stroke reduction in patients with mitral valve prosthesis: a transesophageal echocardiographic study. J Am Coll Cardiol. 2003;42(7):1253-1258. https://doi.org/10.1016/S0735-1097(03)00954-9
- Noseworthy PA, Yao X, Deshmukh AJ, et al. Patterns of Anticoagulation Use and Cardioembolic Risk After Catheter Ablation for Atrial Fibrillation. J Am Heart Assoc. 2015;4(11). https://doi.org/10.1161/JAHA.115.002597
- Eitel C, Koch J, Sommer P, et al. Novel oral anticoagulants in a real-world cohort of patients undergoing catheter ablation of atrial fibrillation. Europace. 2013;15(11):1587-1593. https://doi.org/10.1093/EUROPACE/EUT128
- Melduni RM, Schaff H v., Lee HC, et al. Impact of Left Atrial Appendage Closure During Cardiac Surgery on the Occurrence of Early Postoperative Atrial Fibrillation, Stroke, and Mortality: A Propensity Score-Matched Analysis of 10 633 Patients. Circulation. 2017;135(4):366-378. https://doi.org/10.1161/CIRCULATIONAHA.116.021952
- Rankin JS, Grau-Sepulveda M v., Ad N, et al. Associations Between Surgical Ablation and Operative Mortality After Mitral Valve Procedures. Ann Thorac Surg. 2018;105(6):1790-1796. https://doi.org/10.1016/J.ATHORACSUR.2017.12.035







