8. Nhịp nhanh bộ nối (Junctional Tachycardia)
Xem hình 12 thuật toán điều chỉnh tiếp tục nhịp nhanh bộ nối và Tư liệu Hỗ trợ online 18 và 19 cho tư liệu bỏ xung phần 8.
TS Phạm Hữu Văn
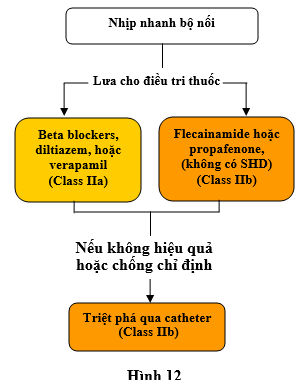
Hình 12 điều chỉnh liên tục nhịp nhanh bộ nối. Các màu tương xứng với Class các Khuyến cáo ở bẳng 1; các thuốc được liệt kê theo alphabe. SHD chỉ bệnh tim cấu trúc (gồm bệnh tim thiếu máu cục bộ)
Nhịp nhanh bộ nối (được định nghĩa ở bảng 2) là nhịp nhanh phức bộ hẹp, đôi khi không đều (với tần số thường 120 bpm đến 220 bpm) phát sinh từ bộ nối AV (gồm cả bó His). Phân ly AV (thường đồng nhịp) có thể được nhìn thấy, khi biểu hiện, loại trừ chẩn đoán sai của AVRT và làm khó chẩn đoán AVNRT. Nếu không đều, nhịp nhanh bộ nối có thể chẩn đoán nhầm với AF hoặc MAT. Cơ chế nhịp nhanh bộ nối do tính tự động gia tăng (bất thường) từ ổ ngoại vị trong bộ nối AV (gồm cả bó His) [275]
Nhịp nhanh bộ nối ít gặp ở người lớn [275]; loạn nhịp này thường được thấy ở trẻ sau phẫu thuật, sau khi phẫu thuật tim cho bệnh tim bẩm sinh; điều này còn được biết như nhịp nhanh ngoại vị bộ nối. Như vậy, có bằng chứng hạn chế liên quan đến chẩn đoán và điều chỉnh nhịp nhanh bộ nối ở các bệnh nhân người lớn.
Nhịp nhanh bộ nối nhịp có liên quan, không thành cơn (thường được biết nhiều hơn như nhịp bộ nối AV gia tăng), nhịp nhanh kịch phát bộ nối phổ biến ở người lớn hơn. Cơ chế của nhịp nhanh bộ nối không thành cơn được kết hợp với tính tự động gia tăng hoặc hoạt động khởi kích (triggered). Nó xảy ra ở tốc độ chậm hơn (70 bpm đến 130 bpm) và thường do nhiễm độc digoxin [276] hoặc nhồi máu cơ tim.[277,278]. Điều trị nhịp này tập trung chú ý vào trạng thái nền.
8.1. Điều trị cấp thời: Các khuyến cáo
Các khuyến cáo cho điều trị cấp thời nhịp nhanh bộ nối (KC 1)
|
COR |
LOE |
Các khuyến cáo |
|---|---|---|
|
IIa |
C-LD |
1. Beta blockers tĩnh mạch là phù hợp cho điều trị cấp thời các bệnh nhân nhịp nhanh bộ nối có triệu chứng.275 |
|
IIa |
C-LD |
2. Diltiazem, procainamide, hoặc verapamil tĩnh mạch là phù hợp để điều trị cấp thời các bệnh nhaanh nhịp nhanh bộ nối.279 |
8.2. Điều chỉnh tiếp tục: Các khuyến cáo
Khuyến cáo điều chỉnh tiếp tục nhịp nhanh bộ nối (KC 2)
|
COR |
LOE |
Các khuyến cáo |
|---|---|---|
|
IIa |
C-LD |
1. Uống beta blockers là phù hợp để điều trị tiếp tục các bệnh nhân có nhịp nhanh bộ nối.275 |
|
IIa |
C-LD |
2. Uống diltiazem hoặc verapamil là phù hợp để điều chỉnh tiếp tục các bệnh nhân có nhịp nhanh bộ nối.279 |
|
IIb |
C-LD |
1. Flecainide hoặc propafenone có thể là phù hợp cho điều chỉnh tiếp tục các bệnh nhân không có bệnh tim cấu trúc hoặc bệnh tim thiếu máu cục bộ có nhịp nhanh bộ nối.280,281 |
|
IIb |
C-LD |
2. Triệt phá qua catheter có thể phù hợp ở các bệnh nhân nhịp nhanh bộ nối khi điều trị thuốc không hiệu quả hoặc có chống chỉ định.282– |
9. Các quần thể đặc biệt
9.1. Nhi khoa
Như đã thảo luận trong mục 1.4, các tài liệu này nhằm vào dân số trưởng thành (≥18 tuổi) và không cung cấp các khuyến cáo cụ thể cho bệnh nhân nhi. Tuy nhiên, một cuộc thảo luận ngắn gọn về SVT ở bệnh nhi được bao gồm bên dưới, làm nổi bật những cân nhắc chính đối với SVT ở bệnh nhân trẻ hơn, trong đó có bệnh nhân vị thành niên.
SVT ở những bệnh nhân trẻ tuổi khác với SVT ở người lớn một cách đáng kể về giới hạn cơ chế, nguy cơ phát triển suy tim hoặc ngừng tim, nguy cơ liên quan với liệu pháp can thiệp, bệnh sử tự nhiên và tác động tâm lý xã hội. Khoảng một nửa số SVT nhi biểu hiện trong 4 tháng đầu tiên của đời sống, với đỉnh liên quan đến tuổi trong lần xuất hiện sau đó ở 5 đến 8 tuổi và sau 13 tuổi. Nhịp nhanh qua trung gian đường phụ chiếm khoảng > 70% các SVT ở trẻ sơ sinh, giảm xấp xỉ 55% ở thanh thiếu niên. [21,289-291] AVNRT tăng theo độ tuổi, từ 9% đến 13% các SVT ở trẻ sơ sinh, 30% đến 50% của SVT ở thanh thiếu niên. Cuồng nhĩ được gặp trong một số trẻ sơ sinh và trẻ em lớn tuổi chủ yếu được quan sát thấy sau các bệnh tim bẩm sinh. AF không phổ biến ở trẻ em, chiếm < 3% các loạn nhịp trên thất và có thể là hậu quả của AVRT hoặc AVNRT ở thanh thiếu niên hoặc có thể liên quan với bệnh tim bẩm sinh được sửa chữa. Suy tim sung huyết biểu hiện đến 20% trẻ sơ sinh và trẻ em lớn tuổi với nhịp nhanh liên hồi và trong những trường hợp hiếm hoi có thể cần hỗ trợ tim cơ học trong quá trình điều trị khởi đầu. [292]
Nguy cơ rung thất hoặc SCD liên quan đến WPW ở trẻ em là 1,3% đến 1,6% và là mức cao nhất trong 2 thập kỷ đầu tiên của đời sống.[23,165-168] Nguy cơ ngừng tim là cao hơn ở những bệnh nhân với AVRT thúc đẩy AF, giai đoạn trơ đường nối phụ ngắn và các đường phụ sau vách.[23,165-168] Điều trị thuốc SVT ở trẻ em được dựa trên các mẫu thực hành rộng lớn điều trị các thuốc chống loạn nhịp trong các RTC còn đang thiếu. Các thuốc block nút AV đã được sử dụng rộng rãi cho đại đa số loạn nhịp, AVRT và AVNRT. Các liều khởi đầu adenosine cao hơn được cần thiết ở trẻ em hơn ở người lớn, trẻ em nhận được từ 150 mcg / kg đến 250 mcg / kg.[293-295] Digoxin tránh sử dụng khi có kích thích sớm do việc sử dụng trong giai đoạn trẻ nhỏ được kết hợp với SCD hoặc VF. [296,297] Amiodarone, sotalol, Propafenone, hoặc flecainide có thể được sử dụng cho SVT trơ ở trẻ sơ sinh. Ở trẻ lớn hơn có biểu hiện SVT, điều trị beta-blocker được sử dụng thông thường nhất cho điều trị khởi đầu. Do sự xuất hiện hiếm hoi các biến cố bất lợi của flecainide, kể cả ở những bệnh nhân không có bệnh tim cấu trúc, flecainide không được sử dụng như một thuốc hàng đầu ở trẻ em.[298]
Triệt phá qua catheter có thể được thực hiện thành công ở trẻ em ở mọi lứa tuổi, với tỷ lệ thành công cấp thời so sánh với những báo cáo ở người lớn. [192.193.299.300] Các biến chứng đã được báo cáo ở 4% đến 8% của loạt lớn khởi đầu, với các biến chứng lớn ở 0,9% đến 3,2% và tỷ lệ biến chứng cao hơn ở bệnh nhân cân nặng <15 kg.[192,299-301] Các tác động của biến chứng, gồm cả block AV đòi hỏi tạo nhịp, thủng tim và động mạch vành hoặc tổn thương van hai lá nặng ở những bệnh nhân trẻ. [302-304] Ở loạt đầu, tử vong đã được báo cáo ở 0,12% trẻ em tim bình thường và kết hợp với trọng lượng thấp hơn và tăng số lượng các tổn thương triệt phá. [305] Mặc dù hầu hết các trung tâm thực hiện triệt phá chọn lọc cho các trẻ em cân nặng > 12 kg đến 15 kg, triệt phá ở người trẻ hơn hoặc trẻ nhỏ hơn thường được dành cho những bệnh nhân có SVT trơ với thuốc hoặc bệnh cơ tim do nhịp nhanh gây ra hoặc trước khi phẫu thuật có thể hạn chế tác động cho các thủ thuật trên cơ sở catheter tiếp theo.
Nhịp nhanh ngoại vị bộ nối (Junctional ectopic tachycardia) xảy ra chủ yếu ở những bệnh nhân rất trẻ, hoặc như là một hình thức bẩm sinh, hoặc thường hơn, sau khi sửa chữa bệnh tim bẩm sinh. Nhịp tim nhanh bộ nối không phải sau phẫu thuật (Nonpostoperative junctional tachycardia) đã được báo cáo đáp ứng với amiodarone hoặc trị liệu hỗn hợp gồm các thuốc beta blockers, flecainide, procainamide, hay propafenone. [306] Triệt phá cho những bệnh nhân có nhịp tim nhanh trơ hoặc rối loạn chức năng thất đã cho thấy hiệu quả 82% đến 85%, nhưng block AV ngẫu nhiên xảy ra ở 18% và tái phát đã được thấy ở 14% số bệnh nhân.[306] Nhịp nhanh bộ nối sau phẫu thuật xảy ra ở 2% đến 10% số bệnh nhân trẻ tuổi được phẫu thuật bên trong tim.[307.308] Điều trị gồm thuốc giảm đau với giãn cơ, hạn chế các loại thuốc inotrop, giảm nhiệt độ cơ thể để 34 đến 35°C, tạo nhịp nhĩ vượt tần số, procainamide hoặc truyền amiodarone. [309-313] Nói chung, giải quyết nhịp nhanh bộ nối sau phẫu thuật và không cần điều trị tiếp tục.
Mặc dù hướng dẫn này tập trung ở người lớn, cần lưu ý SVT có thể xảy ra cho thai nhi, nếu dai dẳng, có thể đưa thai nhi đến nguy cơ trụy tim mạch biểu hiện bằng ứ dịch toàn thân (hydrops). Các bà mẹ cần phải do các chuyên gia tim mạch người lớn theo dõi sự an toàn trong khi điều trị. Các cơ chế phổ biến nhất cho SVT thai nhi là AVRT và cuồng nhĩ. [314] SVT dai dẳng với ứ dịch toàn thân có tỷ lệ tử vong cao, do đó, đảm bảo điều trị kịp thời và tích cực. Sử dụng các thuốc chống loạn nhịp cho mẹ đã nhận thấy có ảnh hưởng qua nhau thai.
9.2. Các bệnh nhân có bệnh tim bẩm sinh người lớn
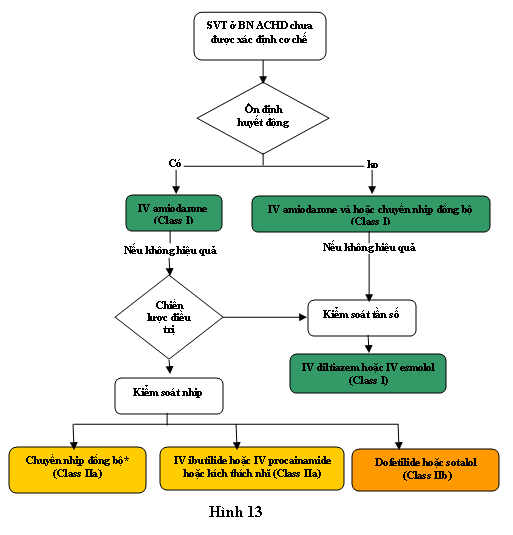
Xem Hình 13 cho các thuật toán để điều trị cấp thời SVT không có kích thích sớm ở các bệnh nhân tim bẩm sinh người lớn (adult congenital heart disease: ACHD); Hình 14 cho các thuật toán điều chỉnh tiếp tục SVT không có kích thích sớm các bệnh nhân ACHD; tư liệu trực tuyến bổ sung 20 và 21 cho tư liệu hỗ trợ Phần 9.
Hình 13. Điều trị SVT cấp thời ở bệnh nhân nhi. Các màu sắc tương ứng với các khuyến cáo ở bảng 1; các thuốc được liệt kê theo alphabe. BN: chỉ bệnh nhân. * Đối với những nhịp tự cắt hoặc tái lại tự phát, chuyển nhịp đồng bộ không thích hợp. ACHD: bệnh tim bẩm sinh người lớn; IV: tiêm tĩnh mạch; SVT: nhịp nhanh trên thất.
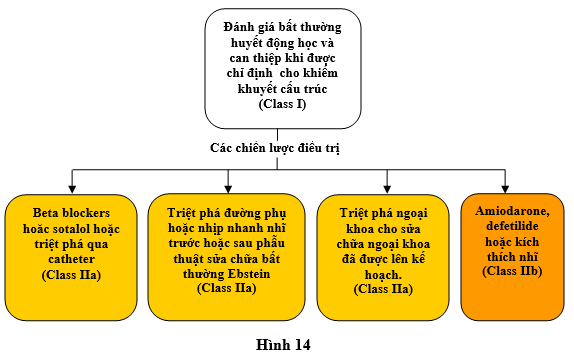
Hình 14 điều chỉnh tiếp tục SVT ở các bệnh nhân nhi. Các màu tương ứng mức độ các khuyến cáo ở bảng 1; các thuốc được liệt kê theo alphabe. ACHD chỉ bệnh tim bẩm sinh ở người lớn; SVT chỉ nhịp nhanh trên thất.
9.2.1. Các đặc tính lâm sàng
SVT thấy ở 10% đến 20% bệnh nhân ACHD và được liên kết với một nguy cơ gia tăng đáng kể suy tim, đột quỵ, và SCD. [315-319] Cơ chế phổ biến nhất của SVT ở bệnh nhân ACHD là nhịp nhanh nhĩ vào lại vòng lớn (macroreentrant AT) (còn gọi là cuồng (flutter)), chiếm ít nhất 75% SVT và thường xuyên liên quan đến việc CTI (cavotricuspid isthmus). AT ổ, AVNRT và nhịp nhanh qua trung gian đường phụ mỗi loại chiếm dưới 8% SVT, trong khi tỷ lệ AF khoảng 10% và tăng theo tuổi. [320-325]
Việc điều chỉnh SVT ở bệnh nhân ACHD chịu ảnh hưởng của giải phẫu cơ tim và phẫu thuật sửa chữa, di chứng huyết động hiện tại của sửa chữa giải phẫu và cơ chế của SVT. Điều chỉnh bệnh nhân ACHD cần được thực hiện chỉ trong sự hợp tác với một bác sĩ tim mạch có đào tạo chuyên sâu hoặc kinh nghiệm trong việc điều chỉnh các bệnh nhân này.
Tỷ lệ thành công cấp thời toàn bộ của thủ thuật triệt phá SVT ở bệnh nhân ACHD dao động từ 70% đến 85%, với tái phát ở 20% đến 60% bệnh nhân trong vòng 2 năm. [326-331] Triệt phá qua catheter được thách thức do những hạn chế tiếp cận tĩnh mạch vào tim, tổ chức nhĩ đã phì đại, vòng vào lại ở nhĩ phức tạp và các vách ngăn tâm nhĩ phân vùng xoang vành và CTI đến nhĩ tĩnh mạch phổi. Sự phát triển rối loạn nhịp nhĩ ở bệnh nhân ACHD thường là dấu hiệu của sự thay đổi huyết động tiến triển, đòi hỏi đánh giá chức năng và huyết động chuyên sâu. Can thiệp vào các khiếm khuyết huyết động / chức năng tồn dư có thể cần được lên kế hoạch như là một phần của điều chỉnh loạn nhịp lâu dài.
9.2.2. Điều trị cấp thời: Các khuyến cáo
Các khuyến cáo điều trị cấp thời SVT ở bệnh nhân ACHD (KC 3)
|
COR |
LOE |
Các khuyến cáo |
|---|---|---|
|
I |
C-LD |
1. Điều trị chống huyết khối cấp thời được khuyến cáo ở các bệnh nhân ACHD có AT hoặc cuồng nhĩ để phù hợp với điều trị kháng đông được khuyến cáo cho bệnh nhân AF.254 |
|
I |
B-NR |
2. Chuyển nhịp đồng bộ được khuyến cáo cho điều trị cấp thời ở các bệnh nhân ACHD và SVT có huyết động không ổn định.170,332 |
|
I |
C-LD |
3. Diltiazem hoặc esmolol tĩnh mạch (với sử dụng thận trọng thêm đối với một trong hai thuốc, theo dõi phát triển hạ huyết áp) được khuyến cáo cho điều trị cấp thời ở bệnh nhân ACHD và SVT có huyết động ổn định.333,334 |
|
I |
B-NR |
4. Adenosine tĩnh mạch được khuyến khích cho điều trị cấp thời ở bệnh nhân ADHD và SVT.121,335–337 |
|
IIa |
B-NR |
1. Ibutilide hoặc procainamide tĩnh mạch có thể có hiệu quả để điều trị cấp thời ở bệnh nhân ACHD và AF có huyết động ổn định.338–340 |
|
IIa |
B-NR |
2. Tạo nhịp nhĩ có thể có hiệu quả để điều trị cấp thời ở bệnh nhân ACHD và SVT có huyết động ổn định và được chống đông theo hướng dẫn hiện nay để điều trị chống huyết khối ở bệnh nhân AF .338,341–344 |
|
IIa |
B-NR |
3. Chuyển nhịp đồng bộ có chọn lọc có thể hữu ích cho việc cắt cấp thời AT hoặc cuồng nhĩ ở bệnh nhân ACHD với điều trị bằng thuốc cấp thời không hiệu quả hoặc chống chỉ định.332 |
|
IIb |
B-NR |
1. Uống dofetilide hoặc sotalol có thể là hợp lý để điều trị cấp thời các bệnh nhân ACHD và AT và / hoặc cuồng nhĩ có huyết động ổn định.345,346 |
9.2.3. Điều chỉnh tiếp tục: Các khuyến cáo
Các khuyến cáo điều chỉnh tiếp tục SVT ở các bệnh nhân ACHD (KC 4)
|
COR |
LOE |
Các khuyến cáo |
|---|---|---|
|
I |
C-LD |
1. Điều chỉnh tiếp tục với trị liệu chống huyết khối được khuyến cáo ở các bệnh nhân ACHD và AT hoặc cuồng nhĩ để phù hợp với điều trị chống huyết khối được đề nghị cho bệnh nhân AF.254 |
|
I |
C-LD |
2. Đánh giá các bất thường về huyết động liên quan cho khả năng sửa chữa các khiếm khuyết cấu trúc được khuyến cáo ở những bệnh nhân ACHD như một phần của điều trị SVT.347,348 |
|
IIa |
B-NR |
1. Triệt phá qua catheter trước phẫu thuật hoặc triệt phá phẫu thuật đường phụ hoặc AT là hợp lý ở những bệnh nhân SVT đang trải qua phẫu thuật sửa chữa bất thường.349–355 |
|
IIa |
B-NR |
2. Điều trị beta blockers hoặc sotalol uống có thể hữu ích để phòng ngừa AT hoặc cuồng nhĩ tái phát có thể hữu ích ở bệnh nhân ACHD.135,323,356 |
|
IIa |
B-NR |
3. Triệt phá qua catheter là hợp lý để điều trị SVT tái phát có triệu chứng ở bệnh nhân ACHD.222,325,326,328,331,357–361 |
|
IIa |
B-NR |
4. Triệt phá bằng phẫu thuật AT hoặc cuồng nhĩ có thể hiệu quả ở những bệnh nhân ADHD đang lên kế hoạc sửa chữa..362–373 |
|
IIb |
B-NR |
1. Tạo nhịp nhĩ có thể là hợp lý để giảm tái phát của AT hoặc cuồng nhĩ ở bệnh nhân ACHD và rối loạn chức năng nút xoang.344,374,375 |
|
IIb |
B-NR |
2. Dofetilide uống có thể hợp lý để phòng ngừa AT hoặc cuồng nhĩ tái phát ở bệnh nhân ACHD.323,346,376,377 |
|
IIb |
B-NR |
3. Amiodaron có thể là hợp lý để phòng ngừa AT hoặc cuồng nhĩ tái phát AT ở bệnh nhân ACHD đối với các bệnh nhân các thuốc khác và triệt phá qua catheter không hiệu quả hoặc chống chỉ định.323 |
|
III: Harm |
B-NR |
1. Flecainide không nên dùng để điều trị các SVT ở bệnh nhân ACHD và rối loạn chức năng tâm thất đáng kể.298 |
9.3. Thai nghén
Mang thai có thể có nhạy cảm tăng lên đối với một loạt các rối loạn nhịp, ngay cả trong trường hợp không có bệnh tim. [378] Mang thai cũng có liên quan với tăng nguy cơ loạn nhịp tim trầm trọng, chẳng hạn các cơn nhịp tim nhanh thường xuyên hơn và trơ hơn, ở những bệnh nhân có nền kích thích sớm loạn nhịp. [379] Mặc dù có độc tính tiềm tàng cho thai nhi với một số liệu pháp dùng thuốc và không dùng thuốc, lựa chọn an toàn tồn tại để cho phép điều trị đại đa số các trường hợp hiệu quả SVT của mẹ.
Các tài liệu về các lựa chọn điều trị cho việc điều chỉnh rối loạn nhịp trong thai kỳ thường được giới hạn trong các báo cáo trường hợp đơn lẻ hoặc loạt nhỏ và ủng hộ sử dụng thuốc chống loạn nhịp cũ hơn do các báo cáo phong phú hơn về việc sử dụng an toàn của các loại thuốc này. Mặc dù tất cả các loại thuốc có tác dụng phụ tiềm tàng cho cả hai mẹ và thai nhi ở bất kỳ giai đoạn nào của thai kỳ, nếu có thể, các loại thuốc nên tránh dùng trong ba tháng đầu tiên, khi nguy cơ dị tật bẩm sinh lớn nhất. Liều thấp nhất được khuyến cáo nên được sử dụng khởi đầu, kèm theo theo dõi thường xuyên đáp ứng lâm sàng.
9.3.1. Điều trị cấp thời: Các khuyến cáo
Các khuyến cáo điều trị cấp thời SVT ở các bệnh nhân mang thai (KC 5)
|
COR |
LOE |
Các khuyến cáo |
|---|---|---|
|
I |
C-LD |
1. Thủ pháp phế vị được khuyến cáo cho điều trị cấp thời ở bệnh nhân có thai với SVT.147,380 |
|
I |
C-LD |
2. Adenosine được khuyến cáo cho điều trị cấp thời ở bệnh nhân có thai với SVT.380 |
|
I |
C-LD |
3. Chuyển nhịp đồng bộ được khuyến cáo cho điều trị cấp thời ở bệnh nhân có thai với SVT huyết động không ổn định khi điều trị bằng thuốc không có hiệu quả hoặc chống chỉ định.380 |
|
IIa |
C-LD |
1. Metoprolol hoặc propranolol tĩnh mạch hợp lý để điều trị cấp thời bệnh nhân có thai với SVT khi adenosine không hiệu quả hoặc chống chỉ định.380 |
|
IIb |
C-LD |
1. Verapamil tiêm tĩnh mạch có thể thích hợp để điều trị cấp thời bệnh nhân có thai với SVT khi adenosine và beta blockers không hiệu quả hoặc chống chỉ định.380 |
|
IIb |
C-LD |
2. Procainamide tĩnh mạch có thể thích hợp để điều trị cấp thời ở bệnh nhân có thai với SVT.381 |
|
IIb |
C-LD |
3. Amiodarone tĩnh mạch có thể được xem xét điều trị cấp thời ở bệnh nhân có thai với SVT có khả năng đe dọa tính mạng khi phương pháp điều trị khác không hiệu quả hoặc chống chỉ định.382,383 |
9.3.2. Điều chỉnh tiếp tục: Các khuyến cáo
Khuyến cáo điều chỉnh tiếp tục SVT các bệnh nhân mang thai (KC 6)
|
COR |
LOE |
Các khuyến cáo |
|---|---|---|
|
IIa |
C-LD |
|
|
IIb |
C-LD |
1. Triệt phá qua catheter có thể là hợp lý ở bệnh nhân mang thai với SVT triệu chứng tăng lên, tái phát, trơ thuốc với nỗ lực hướng giảm thiểu phơi nhiễm phóng xạ.386,387 |
|
IIb |
C-LD |
2. Amiodarone uống có thể được xem xét để điều chỉnh tiếp tục ở những bệnh nhân có thai khi điều trị SVT có triệu chứng tăng lên, tái phát được đòi hỏi và các trị liệu khác không hiệu quả hoặc chống chỉ định.382,383 |
9.4. SVT ở người lớn tuổi
9.4.1. Điều trị cấp thời và điều chỉnh tiếp tục: Các khuyến cáo
Bệnh sử tự nhiên của SVT được thay đổi đều đặn vì hầu hết các bệnh nhân SVT đã trải qua triệt phá ở độ tuổi trẻ hơn, nhưng nhìn chung, tỷ lệ tương đối của AT cao hơn trong các quần thể lớn tuổi và AVNRT phổ biến hơn AVRT trong số bệnh nhân trải qua triệt phá. [16] Cuồng nhĩ không điển hình và AT vào lại vòng lớn đang gia tăng như hậu quả của việc tăng triệt phá AF trong số bệnh nhân này, tuy nhiên có số liệu kết quả hạn chế từ RCT cho phân khúc này của quần thể. Các quyết định điều trị cần được cân bằng giữa nguy cơ và lợi ích toàn bộ các đặc tính xâm lấn của triệt phá đối lại với sự nhậy cảm của khả năng đáp ứng và hiệu quả lâu dài đối với trị liệu thuốc.
Các khuyến cáo điều trị cấp thời và điều chỉnh liên tục SVT ở quần thể lớn tuổi. (KC 7)
|
COR |
LOE |
Các khuyến cáo |
|---|---|---|
|
I |
B-NR |
1. Các phương pháp chẩn đoán và điều trị SVT nên được cá thể hóa ở những bệnh nhân trên 75 tuổi để hợp thành tuổi, bệnh kèm theo, chức năng thể chất và nhận thức, sở thích bệnh nhân và mức độ nghiêm trọng của các triệu chứng.27,28,388–396 |
10. Các xem xét chất lượng sống
Bệnh nhân SVT có thể gặp các triệu chứng tái phát ảnh hưởng xấu đến chất lượng sống của họ. Các cơn nhịp tim nhanh có thể gây choáng váng và ngất, có thể trở thành một trở ngại cho việc thực hiện các hoạt động thông thường của cuộc sống hàng ngày (ví dụ, lái xe) .[29] Tuy nhiên, có những dữ liệu tối thiểu về ảnh hưởng của điều trị đến chất lượng sống đối với bệnh nhân SVT .
Xem dữ liệu trực tuyến bổ sung 22 cho dữ liệu hỗ trợ Phần 10.
11. Hiệu quả – Chi phí
Phần nhỏ y văn đánh giá các chiến lược hiệu quả – chí phí trong PSVT đã được tập trung cơ bản vào đánh giá trị liệu thuốc đối lại với triệt phá qua catheter. Mô hình Markov hiệu quả – chi phí chính xác được thực hiện vào năm 2000 để so sánh triệt phá bằng tần số radio và điều chỉnh thuốc với chủng loại metoprolol từ quan điểm xã hội. [57] Quần thể được ước tính gồm bệnh nhân AVNRT (khoảng 65%) và AVRT. Trên cơ sở mô phỏng này, các tác giả kết luận, đối với các bệnh nhân có triệu chứng với cơn PSVT hàng tháng, triệt phá tần số radio là chiến lược hiệu quả hơn và ít tốn kém hơn khi so sánh với điều trị nội khoa. Một nghiên cứu thuần tập quan sát bệnh nhân cuồng nhĩ được hỗ trợ triệt phá sớm để làm giảm đáng kể việc sử dụng thuốc trong bệnh viện và các nguy cơ của AF. [397]
Những nghiên cứu này, cùng với các y văn trước đây khác, ưu tiên triệt phá qua catheter hiệu quả hơn trị liệu thuốc để điều trị PSVT và cuồng nhĩ. Tuy nhiên, kết quả của những nghiên cứu này dựa trên số liệu chi phí và mô hình thực hành mà không áp dụng cho môi trường hiện tại và thực hành. Do đó, không có khuyến cáo được cung cấp.
Xem dữ liệu trực tuyến bổ sung 23 cho dữ liệu hỗ trợ Mục 11.
12. Chia sẻ Quyết Định
Điều quan trọng bệnh nhân được đưa vào quá trình ra quyết định lâm sàng, với việc xem xét / sở thích và mục tiêu điều trị, cũng như / tình trạng thể chất, tâm lý và tình huống xã hội của bệnh nhân. Trong các trường hợp lựa chọn, được cá thể hóa, các can thiệp tự định hướng có thể được phát triển trong quan hệ đối với bệnh nhân, chẳng hạn như thủ pháp phế vị và thuốc điều trị “thuốc trong túi” (pill – in – the – pocket).
Quá trình ra quyết định đặc biệt quan trọng đối với bệnh nhân SVT. Như đã thấy trong hướng dẫn này, điều trị SVT có thể có khác biệt tinh tế và đòi hỏi phải có kiến thức chuyên môn về quá trình EP và lựa chọn điều trị. Lựa chon điều trị rất cụ thể cho loại rối loạn nhịp chính xác và có thể phụ thuộc vào đặc tính chắc chắn của rối loạn nhịp cụ thể. Các lựa chọn khác nhau để điều trị, bao gồm cả các loại thuốc, sốc, điều trị xâm lấn, hoặc kết hợp chúng, có thể gây nhầm lẫn cho người bệnh, do đó, một lời giải thích chi tiết về những lợi ích và rủi ro phải được bao gồm trong cuộc tư vấn.
Bệnh nhân được khuyến khích đặt câu hỏi với thời gian quy định cho những người chăm sóc để đáp ứng. Cung cấp bầu không khí thoải mái, dự đoán mối quan tâm bệnh nhân và khuyến khích bệnh nhân để giữ một quyển ghi chép với những câu hỏi có thể tạo điều kiện cho các cuộc trò chuyện dễ dàng.
Điều quan trong cho các bác sỹ lâm sàng sử dụng thuật ngữ đơn giản để giải thích các lựa chọn điều trị cho bệnh nhân. Đây là trách nhiệm của đội ngũ bác sĩ và y tế để cung cấp cho bệnh nhân với sự hiểu biết tốt nhất tất cả các lựa chọn điều trị với rủi ro, lợi ích và tác động tiềm tàng về chất lượng sống.
TÀI LIỆU THAM KHẢO
1. Committee on Standards for Developing Trustworthy Clinical Practice Guidelines, Institute of Medicine (US). Clinical Practice Guidelines We Can Trust. Washington, DC: National Academies Press, 2011.
2. Committee on Standards for Systematic Reviews of Comparative Effectiveness Research, Institute of Medicine (US). Finding What Works in Health Care: Standards for Systematic Reviews. Washington, DC: National Academies Press, 2011.
3. ACCF/AHA Task Force on Practice Guidelines. Methodology Manual and Policies From the ACCF/AHA Task Force on Practice Guidelines. American College of Cardiology and American Heart Association. 2010. Available at: http://assets.cardiosource.com/Methodology_Manual_for_ACC_AHA_Writing_Committees.pdf and http://my.americanheart.org/idc/groups/ahamah-public/@wcm/@sop/documents/downloadable/ucm_319826.pdf. Accessed January 23, 2015.
4. Jacobs AK, Kushner FG, Ettinger SM, et al. ACCF/AHA clinical practice guideline methodology summit report: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation. 2013;127:268–310. FREE Full Text
5. Jacobs AK, Anderson JL, Halperin JL. The evolution and future of ACC/AHA clinical practice guidelines: a 30-year journey: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation. 2014;130:1208–17. FREE Full Text
6. Anderson JL, Heidenreich PA, Barnett PG, et al. ACC/AHA statement on cost/value methodology in clinical practice guidelines and performance measures: a report of the American College of Cardiology/American Heart Association Task Force on Performance Measures and Task Force on Practice Guidelines. Circulation. 2014;129:2329–45. FREE Full Text
7. Halperin JL, Levine GN, Al-Khatib SM. Further evolution of the ACC/AHA clinical practice guideline recommendation classification system: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Clinical Practice Guidelines. Circulation. 2016;133:1426–28. FREE Full Text
8. Arnett DK, Goodman RA, Halperin JL, et al. AHA/ACC/HHS strategies to enhance application of clinical practice guidelines in patients with cardiovascular disease and comorbid conditions: from the American Heart Association, American College of Cardiology, and US Department of Health and Human Services. Circulation. 2014;130:1662–7. FREE Full Text
9. Page RL, Joglar JA, Al-Khatib SM, et al. 2015 ACC/AHA/HRS guideline for the management of adult patients with supraventricular tachycardia: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society. Circulation. 2016;133:e506–74. FREE Full Text
10. Al-Khatib SM, Arshad A, Balk EM, et al. Risk stratification for arrhythmic events in patients with asymptomatic pre-excitation: a systematic review for the 2015 ACC/AHA/HRS guideline for the management of adult patients with supraventricular tachycardia: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society [published ahead of print September 23, 2015]. Circulation. 2015; IN PRESS. doi: 10.1161/CIR.0000000000000309. Google Scholar
11. January CT, Wann LS, Alpert JS, et al. 2014 AHA/ACC/HRS Guideline for the Management of Patients With Atrial Fibrillation: A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the Heart Rhythm Society. Circulation. 2014;130:e199–267. FREE Full Text
12. Blomström-Lundqvist C, Scheinman MM, Aliot EM, et al. ACC/AHA/ESC guidelines for the management of patients with supraventricular arrhythmias—executive summary: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Develop Guidelines for the Management of Patients With Supraventricular Arrhythmias). Developed in collaboration with NASPE-Heart Rhythm Society. Circulation. 2003;108:1871–909. FREE Full Text
13. Orejarena LA, Vidaillet H, DeStefano F, et al. Paroxysmal supraventricular tachycardia in the general population. J Am Coll Cardiol. 1998;31:150–7. CrossRefMedlineGoogle Scholar
14. Lu C-W, Wu M-H, Chen H-C, et al. Epidemiological profile of Wolff-Parkinson-White syndrome in a general population younger than 50 years of age in an era of radiofrequency catheter ablation. Int J Cardiol. 2014;174:530–4. CrossRefMedlineGoogle Scholar
15. Whinnett ZI, Sohaib SMA, Davies DW. Diagnosis and management of supraventricular tachycardia. BMJ. 2012;345:e7769. FREE Full Text
16. Porter MJ, Morton JB, Denman R, et al. Influence of age and gender on the mechanism of supraventricular tachycardia. Heart Rhythm. 2004;1:393–6. CrossRefMedlineGoogle Scholar
17. Goyal R, Zivin A, Souza J, et al. Comparison of the ages of tachycardia onset in patients with atrioventricular nodal reentrant tachycardia and accessory pathway-mediated tachycardia. Am Heart J. 1996;132:765–7. CrossRefMedlineGoogle Scholar
18. Maryniak A, Bielawska A, Bieganowska K, et al. Does atrioventricular reentry tachycardia (AVRT) or atrioventricular nodal reentry tachycardia (AVNRT) in children affect their cognitive and emotional development? Pediatr Cardiol. 2013;34:893–7. CrossRefMedlineGoogle Scholar
19. González-Torrecilla E, Almendral J, Arenal A, et al. Combined evaluation of bedside clinical variables and the electrocardiogram for the differential diagnosis of paroxysmal atrioventricular reciprocating tachycardias in patients without pre-excitation. J Am Coll Cardiol. 2009;53:2353–8. CrossRefMedlineGoogle Scholar
20. Liu S, Yuan S, Hertervig E, et al. Gender and atrioventricular conduction properties of patients with symptomatic atrioventricular nodal reentrant tachycardia and Wolff-Parkinson-White syndrome. J Electrocardiol. 2001;34:295–301. CrossRefMedlineGoogle Scholar
21. Anand RG, Rosenthal GL, Van Hare GF, et al. Is the mechanism of supraventricular tachycardia in pediatrics influenced by age, gender or ethnicity? Congenit Heart Dis. 2009;4:464–8. CrossRefMedlineGoogle Scholar
22. Walfridsson U, Strömberg A, Janzon M, et al. Wolff-Parkinson-White syndrome and atrioventricular nodal re-entry tachycardia in a Swedish population: consequences on health-related quality of life. Pacing Clin Electrophysiol. 2009;32:1299–306. CrossRefMedlineGoogle Scholar
23. Cain N, Irving C, Webber S, et al. Natural history of Wolff-Parkinson-White syndrome diagnosed in childhood. Am J Cardiol. 2013;112:961–5. CrossRefMedlineGoogle Scholar
24. Laurent G, Leong-Poi H, Mangat I, et al. Influence of ventriculoatrial timing on hemodynamics and symptoms during supraventricular tachycardia. J Cardiovasc Electrophysiol. 2009;20:176–81. CrossRefMedlineGoogle Scholar
25.↵ Auricchio A, Klein H, Trappe HJ, et al. Lack of prognostic value of syncope in patients with Wolff-Parkinson-White syndrome. J Am Coll Cardiol. 1991;17:152–8. CrossRefMedlineGoogle Scholar
26. Drago F, Turchetta A, Calzolari A, et al. Reciprocating supraventricular tachycardia in children: low rate at rest as a major factor related to propensity to syncope during exercise. Am Heart J. 1996;132:280–5. CrossRefMedlineGoogle Scholar
27. Kalusche D, Ott P, Arentz T, et al. AV nodal re-entry tachycardia in elderly patients: clinical presentation and results of radiofrequency catheter ablation therapy. Coron Artery Dis. 1998;9:359–63. CrossRefMedlineGoogle Scholar
28. Haghjoo M, Arya A, Heidari A, et al. Electrophysiologic characteristics and results of radiofrequency catheter ablation in elderly patients with atrioventricular nodal reentrant tachycardia. J Electrocardiol. 2007;40:208–13. CrossRefMedlineGoogle Scholar
29. Walfridsson U, Walfridsson H. The impact of supraventricular tachycardias on driving ability in patients referred for radiofrequency catheter ablation. Pacing Clin Electrophysiol. 2005;28:191–5. CrossRefMedlineGoogle Scholar
30. Letsas KP, Weber R, Siklody CH, et al. Electrocardiographic differentiation of common type atrioventricular nodal reentrant tachycardia from atrioventricular reciprocating tachycardia via a concealed accessory pathway. Acta Cardiol. 2010;65:171–6. CrossRefMedlineGoogle Scholar
31. Knight BP, Ebinger M, Oral H, et al. Diagnostic value of tachycardia features and pacing maneuvers during paroxysmal supraventricular tachycardia. J Am Coll Cardiol. 2000;36:574–82. CrossRefMedlineGoogle Scholar
32. Murman DH, McDonald AJ, Pelletier AJ, et al. US emergency department visits for supraventricular tachycardia, 1993–2003. Acad Emerg Med. 2007;14:578–81. CrossRefMedlineGoogle Scholar
33. Lim SH, Anantharaman V, Teo WS, et al. Comparison of treatment of supraventricular tachycardia by Valsalva maneuver and carotid sinus massage. Ann Emerg Med. 1998;31:30–5. CrossRefMedlineGoogle Scholar
34. Luber S, Brady WJ, Joyce T, et al. Paroxysmal supraventricular tachycardia: outcome after ED care. Am J Emerg Med. 2001;19:40–2. CrossRefMedlineGoogle Scholar
35. Waxman MB, Wald RW, Sharma AD, et al. Vagal techniques for termination of paroxysmal supraventricular tachycardia. Am J Cardiol. 1980;46:655–64. CrossRefMedlineGoogle Scholar
36. Brady WJ, DeBehnke DJ, Wickman LL, et al. Treatment of out-of-hospital supraventricular tachycardia: adenosine vs verapamil. Acad Emerg Med. 1996;3:574–85. CrossRefMedlineGoogle Scholar
37. Cairns CB, Niemann JT. Intravenous adenosine in the emergency department management of paroxysmal supraventricular tachycardia. Ann Emerg Med. 1991;20:717–21. CrossRefMedlineGoogle Scholar
38. Gausche M, Persse DE, Sugarman T, et al. Adenosine for the prehospital treatment of paroxysmal supraventricular tachycardia. Ann Emerg Med. 1994;24:183–9. CrossRefMedlineGoogle Scholar
39. Madsen CD, Pointer JE, Lynch TG. A comparison of adenosine and verapamil for the treatment of supraventricular tachycardia in the prehospital setting. Ann Emerg Med. 1995;25:649–55. CrossRefMedlineGoogle Scholar
40. McCabe JL, Adhar GC, Menegazzi JJ, et al. Intravenous adenosine in the prehospital treatment of paroxysmal supraventricular tachycardia. Ann Emerg Med. 1992;21:358–61. CrossRefMedlineGoogle Scholar
41. Rankin AC, Oldroyd KG, Chong E, et al. Value and limitations of adenosine in the diagnosis and treatment of narrow and broad complex tachycardias. Br Heart J. 1989;62:195–203. Abstract/FREE Full Text
42. Lim SH, Anantharaman V, Teo WS, et al. Slow infusion of calcium channel blockers compared with intravenous adenosine in the emergency treatment of supraventricular tachycardia. Resuscitation. 2009;80:523–8. CrossRefMedlineGoogle Scholar
43. DiMarco JP, Miles W, Akhtar M, et al. Adenosine for paroxysmal supraventricular tachycardia: dose ranging and comparison with verapamil. Assessment in placebo-controlled, multicenter trials. The Adenosine for PSVT Study Group. Ann Intern Med. 1990;113:104–10. CrossRefMedlineGoogle Scholar
44. Roth A, Elkayam I, Shapira I, et al. Effectiveness of prehospital synchronous direct-current cardioversion for supraventricular tachyarrhythmias causing unstable hemodynamic states. Am J Cardiol. 2003;91:489–91. CrossRefMedlineGoogle Scholar
45. Stec S, Kryñski T, Kułakowski P,. Efficacy of low energy rectilinear biphasic cardioversion for regular atrial tachyarrhythmias. Cardiol J. 2011;18:33–8. MedlineGoogle Scholar
46. Lim SH, Anantharaman V, Teo WS. Slow-infusion of calcium channel blockers in the emergency management of supraventricular tachycardia. Resuscitation. 2002;52:167–74. CrossRefMedlineGoogle Scholar
47. Gupta A, Naik A, Vora A, et al. Comparison of efficacy of intravenous diltiazem and esmolol in terminating supraventricular tachycardia. J Assoc Physicians India. 1999;47:969–72. MedlineGoogle Scholar
48. Dorian P, Naccarelli GV, Coumel P, et al. A randomized comparison of flecainide versus verapamil in paroxysmal supraventricular tachycardia. The Flecainide Multicenter Investigators Group. Am J Cardiol. 1996;77:89A–95A. CrossRefMedlineGoogle Scholar
49. Mauritson DR, Winniford MD, Walker WS, et al. Oral verapamil for paroxysmal supraventricular tachycardia: a long-term, double-blind randomized trial. Ann Intern Med. 1982;96:409–12. CrossRefMedlineGoogle Scholar
50. Winniford MD, Fulton KL, Hillis LD. Long-term therapy of paroxysmal supraventricular tachycardia: a randomized, double-blind comparison of digoxin, propranolol and verapamil. Am J Cardiol. 1984;54:1138–9. CrossRefMedlineGoogle Scholar
51. Jackman WM, Beckman KJ, McClelland JH, et al. Treatment of supraventricular tachycardia due to atrioventricular nodal reentry, by radiofrequency catheter ablation of slow-pathway conduction. N Engl J Med. 1992;327:313–8. CrossRefMedlineGoogle Scholar
52. Hindricks G. The Multicentre European Radiofrequency Survey (MERFS): complications of radiofrequency catheter ablation of arrhythmias. The Multicentre European Radiofrequency Survey (MERFS) investigators of the Working Group on Arrhythmias of the European Society of Cardiology. Eur Heart J. 1993;14:1644–53. Abstract/FREE Full Text
53. Hindricks G. Incidence of complete atrioventricular blốc following attempted radiofrequency catheter modification of the atrioventricular node in 880 patients. Results of the Multicenter European Radiofrequency Survey (MERFS) The Working Group on Arrhythmias of the European Society of Cardiology. Eur Heart J. 1996;17:82–8. Abstract/FREE Full Text
54. Spector P, Reynolds MR, Calkins H, et al. Meta-analysis of ablation of atrial flutter and supraventricular tachycardia. Am J Cardiol. 2009;104:671–7. CrossRefMedlineGoogle Scholar
55. Calkins H, Yong P, Miller JM, et al. Catheter ablation of accessory pathways, atrioventricular nodal reentrant tachycardia, and the atrioventricular junction: final results of a prospective, multicenter clinical trial. The Atakr Multicenter Investigators Group. Circulation. 1999;99:262–70. Abstract/FREE Full Text
56. Scheinman MM, Huang S. The 1998 NASPE prospective catheter ablation registry. Pacing Clin Electrophysiol. 2000;23:1020–8. CrossRefMedlineGoogle Scholar
57. Cheng CH, Sanders GD, Hlatky MA, et al. Cost-effectiveness of radiofrequency ablation for supraventricular tachycardia. Ann Intern Med. 2000;133:864–76. CrossRefMedlineGoogle Scholar
58. Bohnen M, Stevenson WG, Tedrow UB, et al. Incidence and predictors of major complications from contemporary catheter ablation to treat cardiac arrhythmias. Heart Rhythm. 2011;8:1661–6. CrossRefMedlineGoogle Scholar
59. Tendera M, Wnuk-Wojnar AM, Kulakowski P, et al. Efficacy and safety of dofetilide in the prevention of symptomatic episodes of paroxysmal supraventricular tachycardia: a 6-month double-blind comparison with propafenone and placebo. Am Heart J. 2001;142:93–8. CrossRefMedlineGoogle Scholar
60. A randomized, placebo-controlled trial of propafenone in the prophylaxis of paroxysmal supraventricular tachycardia and paroxysmal atrial fibrillation. UK Propafenone PSVT Study Group. Circulation. 1995;92:2550–7. Medline
61. Chimienti M, Cullen MT, Casadei G. Safety of flecainide versus propafenone for the long-term management of symptomatic paroxysmal supraventricular tachyarrhythmias. Report from the Flecainide and Propafenone Italian Study (FAPIS) Group. Eur Heart J. 1995;16:1943–51. Abstract/FREE Full Text
62. Anderson JL, Platt ML, Guarnieri T, et al. Flecainide acetate for paroxysmal supraventricular tachyarrhythmias. The Flecainide Supraventricular Tachycardia Study Group. Am J Cardiol. 1994;74:578–84. CrossRefMedlineGoogle Scholar
63. Pritchett EL, DaTorre SD, Platt ML, et al. Flecainide acetate treatment of paroxysmal supraventricular tachycardia and paroxysmal atrial fibrillation: dose-response studies. The Flecainide Supraventricular Tachycardia Study Group. J Am Coll Cardiol. 1991;17:297–303. CrossRefMedlineGoogle Scholar
64. Pritchett EL, McCarthy EA, Wilkinson WE. Propafenone treatment of symptomatic paroxysmal supraventricular arrhythmias. A randomized, placebo-controlled, crossover trial in patients tolerating oral therapy. Ann Intern Med. 1991;114:539–44. CrossRefMedlineGoogle Scholar
65. Henthorn RW, Waldo AL, Anderson JL, et al. Flecainide acetate prevents recurrence of symptomatic paroxysmal supraventricular tachycardia. The Flecainide Supraventricular Tachycardia Study Group. Circulation. 1991;83:119–25. Abstract/FREE Full Text
66. Wanless RS, Anderson K, Joy M, et al. Multicenter comparative study of the efficacy and safety of sotalol in the prophylactic treatment of patients with paroxysmal supraventricular tachyarrhythmias. Am Heart J. 1997;133:441–6. CrossRefMedlineGoogle Scholar
67. Gambhir DS, Bhargava M, Nair M, et al. Comparison of electrophysiologic effects and efficacy of single-dose intravenous and long-term oral amiodarone therapy in patients with AV nodal reentrant tachycardia. Indian Heart J. 1996;48:133–7. MedlineGoogle Scholar
68. Haines DE, Beheiry S, Akar JG, et al. Heart Rythm Society expert consensus statement on electrophysiology laboratory standards: process, protocols, equipment, personnel, and safety. Heart Rhythm. 2014;11:e9–51. CrossRefMedlineGoogle Scholar
69. Knight BP, Zivin A, Souza J, et al. A technique for the rapid diagnosis of atrial tachycardia in the electrophysiology laboratory. J Am Coll Cardiol. 1999;33:775–81. CrossRefMedlineGoogle Scholar
70. Horowitz LN, Kay HR, Kutalek SP, et al. Risks and complications of clinical cardiac electrophysiologic studies: a prospective analysis of 1,000 consecutive patients. J Am Coll Cardiol. 1987;9:1261–8. CrossRefMedlineGoogle Scholar
71. Asirvatham S, Narayan O. Advanced catheter mapping and navigation system. In: Huang SW, Wood M, editors. Catheter Ablation of Cardiac Arrhythmias. Philadelphia, PA: Saunders/Elsevier, 2006:135–61. Google Scholar
72. Sporton SC, Earley MJ, Nathan AW, et al. Electroanatomic versus fluoroscopic mapping for catheter ablation procedures: a prospective randomized study. J Cardiovasc Electrophysiol. 2004;15:310–5. CrossRefMedlineGoogle Scholar
73. Alvarez M, Tercedor L, Almansa I, et al. Safety and feasibility of catheter ablation for atrioventricular nodal re-entrant tachycardia without fluoroscopic guidance. Heart Rhythm. 2009;6:1714–20. CrossRefMedlineGoogle Scholar
74. Casella M, Pelargonio G, Dello RA, et al. “Near-zero” fluoroscopic exposure in supraventricular arrhythmia ablation using the EnSite NavX mapping system: personal experience and review of the literature. J Interv Card Electrophysiol. 2011;31:109–18. CrossRefMedlineGoogle Scholar
75. Razminia M, Manankil MF, Eryazici PLS, et al. Nonfluoroscopic catheter ablation of cardiac arrhythmias in adults: feasibility, safety, and efficacy. J Cardiovasc Electrophysiol. 2012;23:1078–86. CrossRefMedlineGoogle Scholar
76. Earley MJ, Showkathali R, Alzetani M, et al. Radiofrequency ablation of arrhythmias guided by non-fluoroscopic catheter location: a prospective randomized trial. Eur Heart J. 2006;27:1223–9. Abstract/FREE Full Text
77. Hindricks G, Willems S, Kautzner J, et al. Effect of electroanatomically guided versus conventional catheter ablation of typical atrial flutter on the fluoroscopy time and resource use: a prospective randomized multicenter study. J Cardiovasc Electrophysiol. 2009;20:734–40. CrossRefMedlineGoogle Scholar
78. Xu D, Yang B, Shan Q, et al. Initial clinical experience of remote magnetic navigation system for catheter mapping and ablation of supraventricular tachycardias. J Interv Card Electrophysiol. 2009;25:171–4. CrossRefMedlineGoogle Scholar
79. Sommer P, Wojdyla-Hordynska A, Rolf S, et al. Initial experience in ablation of typical atrial flutter using a novel three-dimensional catheter tracking system. Europace. 2013;15:578–81. Abstract/FREE Full Text
80. Cummings JE, Pacifico A, Drago JL, et al. Alternative energy sources for the ablation of arrhythmias. Pacing Clin Electrophysiol. 2005;28:434–43. CrossRefMedlineGoogle Scholar
81. Olshansky B, Sullivan RM. Inappropriate sinus tachycardia. J Am Coll Cardiol. 2013;61:793–801. CrossRefMedlineGoogle Scholar
82. Marcus B, Gillette PC, Garson A. Intrinsic heart rate in children and young adults: an index of sinus node function isolated from autonomic control. Am Heart J. 1990;119:911–6. CrossRefMedlineGoogle Scholar
83. Jose AD, Collison D. The normal range and determinants of the intrinsic heart rate in man. Cardiovasc Res. 1970;4:160–7. Abstract/FREE Full Text
84. Alboni P, Malcarne C, Pedroni P, et al. Electrophysiology of normal sinus node with and without autonomic blốcade. Circulation. 1982;65:1236–42. FREE Full Text
85. Cappato R, Castelvecchio S, Ricci C, et al. Clinical efficacy of ivabradine in patients with inappropriate sinus tachycardia: a prospective, randomized, placebo-controlled, double-blind, crossover evaluation. J Am Coll Cardiol. 2012;60:1323–9. CrossRefMedlineGoogle Scholar
86. Benezet-Mazuecos J, Rubio JM, Farré J, et al. Long-term outcomes of ivabradine in inappropriate sinus tachycardia patients: appropriate efficacy or inappropriate patients. Pacing Clin Electrophysiol. 2013;36:830–6. CrossRefMedlineGoogle Scholar
87. Ptaszynski P, Kaczmarek K, Ruta J, et al. Metoprolol succinate vs. ivabradine in the treatment of inappropriate sinus tachycardia in patients unresponsive to previous pharmacological therapy. Europace. 2013;15:116–21. Abstract/FREE Full Text
88. Ptaszynski P, Kaczmarek K, Ruta J, et al. Ivabradine in the treatment of inappropriate sinus tachycardia in patients after successful radiofrequency catheter ablation of atrioventricular node slow pathway. Pacing Clin Electrophysiol. 2013;36:42–9. CrossRefMedlineGoogle Scholar
89. Ptaszynski P, Kaczmarek K, Ruta J, et al. Ivabradine in combination with metoprolol succinate in the treatment of inappropriate sinus tachycardia. J Cardiovasc Pharmacol Ther. 2013;18:338–44. Abstract/FREE Full Text
90. Calò L, Rebecchi M, Sette A, et al. Efficacy of ivabradine administration in patients affected by inappropriate sinus tachycardia. Heart Rhythm. 2010;7:1318–23. CrossRefMedlineGoogle Scholar
91. Kaplinsky E, Comes FP, Urondo LSV, et al. Efficacy of ivabradine in four patients with inappropriate sinus tachycardia: a three month-long experience based on electrocardiographic, Holter monitoring, exercise tolerance and quality of life assessments. Cardiol J. 2010;17:166–71. MedlineGoogle Scholar
92. Rakovec P. Treatment of inappropriate sinus tachycardia with ivabradine. Wien Klin Wochenschr. 2009;121:715–8. CrossRefMedlineGoogle Scholar
93. Zellerhoff S, Hinterseer M, Felix Krull B, et al. Ivabradine in patients with inappropriate sinus tachycardia. Naunyn Schmiedebergs Arch Pharmacol. 2010;382:483–6. CrossRefMedlineGoogle Scholar
94. Man KC, Knight B, Tse HF, et al. Radiofrequency catheter ablation of inappropriate sinus tachycardia guided by activation mapping. J Am Coll Cardiol. 2000;35:451–7. CrossRefMedlineGoogle Scholar
95. Lin D, Garcia F, Jacobson J, et al. Use of noncontact mapping and saline-cooled ablation catheter for sinus node modification in medically refractory inappropriate sinus tachycardia. Pacing Clin Electrophysiol. 2007;30:236–42. CrossRefMedlineGoogle Scholar
96. Lee RJ, Kalman JM, Fitzpatrick AP, et al. Radiofrequency catheter modification of the sinus node for “inappropriate” sinus tachycardia. Circulation. 1995;92:2919–28. Abstract/FREE Full Text
97. Marrouche NF, Beheiry S, Tomassoni G, et al. Three-dimensional nonfluoroscopic mapping and ablation of inappropriate sinus tachycardia. Procedural strategies and long-term outcome. J Am Coll Cardiol. 2002;39:1046–54. CrossRefMedlineGoogle Scholar
98. Callans DJ, Ren JF, Schwartzman D, et al. Narrowing of the superior vena cava-right atrium junction during radiofrequency catheter ablation for inappropriate sinus tachycardia: analysis with intracardiac echocardiography. J Am Coll Cardiol. 1999;33:1667–70. CrossRefMedlineGoogle Scholar
99. Frankel DS, Lin D, Anastasio N, et al. Frequent additional tachyarrhythmias in patients with inappropriate sinus tachycardia undergoing sinus node modification: an important cause of symptom recurrence. J Cardiovasc Electrophysiol. 2012;23:835–9. CrossRefMedlineGoogle Scholar
100. Takemoto M, Mukai Y, Inoue S, et al. Usefulness of non-contact mapping for radiofrequency catheter ablation of inappropriate sinus tachycardia: new procedural strategy and long-term clinical outcome. Intern Med. 2012;51:357–62. CrossRefMedlineGoogle Scholar
101. Klein I, Ojamaa K. Thyroid hormone and the cardiovascular system. N Engl J Med. 2001;344:501–9. CrossRefMedlineGoogle Scholar
102. Steinbeck G, Hoffmann E. True atrial tachycardia. Eur Heart J. 1998; 19 Suppl E:E48–9. Google Scholar
103. Wren C. Incessant tachycardias. Eur Heart J. 1998;19 Suppl E:E54–9. Google Scholar
104. Medi C, Kalman JM, Haqqani H, et al. Tachycardia-mediated cardiomyopathy secondary to focal atrial tachycardia: long-term outcome after catheter ablation. J Am Coll Cardiol. 2009;53:1791–7. CrossRefMedlineGoogle Scholar
105. Tang CW, Scheinman MM, Van Hare GF, et al. Use of P wave configuration during atrial tachycardia to predict site of origin. J Am Coll Cardiol. 1995;26:1315–24. CrossRefMedlineGoogle Scholar
106. Kistler PM, Roberts-Thomson KC, Haqqani HM, et al. P-wave morphology in focal atrial tachycardia: development of an algorithm to predict the anatomic site of origin. J Am Coll Cardiol. 2006;48:1010–7. CrossRefMedlineGoogle Scholar
107. Chen SA, Chiang CE, Yang CJ, et al. Sustained atrial tachycardia in adult patients. Electrophysiological characteristics, pharmacological response, possible mechanisms, and effects of radiofrequency ablation. Circulation. 1994;90:1262–78. Abstract/FREE Full Text
108. Kalman JM, Olgin JE, Karch MR, et al. “Cristal tachycardias”: origin of right atrial tachycardias from the crista terminalis identified by intracardiac echocardiography. J Am Coll Cardiol. 1998;31:451–9. CrossRefMedlineGoogle Scholar
109. Morton JB, Sanders P, Das A, et al. Focal atrial tachycardia arising from the tricuspid annulus: electrophysiologic and electrocardiographic characteristics. J Cardiovasc Electrophysiol. 2001;12:653–9. CrossRefMedlineGoogle Scholar
110. Kistler PM, Sanders P, Fynn SP, et al. Electrophysiological and electrocardiographic characteristics of focal atrial tachycardia originating from the pulmonary veins: acute and long-term outcomes of radiofrequency ablation. Circulation. 2003;108:1968–75. Abstract/FREE Full Text
111. Kistler PM, Sanders P, Hussin A, et al. Focal atrial tachycardia arising from the mitral annulus: electrocardiographic and electrophysiologic characterization. J Am Coll Cardiol. 2003;41:2212–9. CrossRefMedlineGoogle Scholar
112. Gonzalez MD, Contreras LJ, Jongbloed MRM, et al. Left atrial tachycardia originating from the mitral annulus-aorta junction. Circulation. 2004;110:3187–92. Abstract/FREE Full Text
113. Kistler PM, Fynn SP, Haqqani H, et al. Focal atrial tachycardia from the ostium of the coronary sinus: electrocardiographic and electrophysiological characterization and radiofrequency ablation. J Am Coll Cardiol. 2005;45:1488–93. CrossRefMedlineGoogle Scholar
114. Ouyang F, Ma J, Ho SY, et al. Focal atrial tachycardia originating from the non-coronary aortic sinus: electrophysiological characteristics and catheter ablation. J Am Coll Cardiol. 2006;48:122–31. CrossRefMedlineGoogle Scholar
115. Roberts-Thomson KC, Kistler PM, Haqqani HM, et al. Focal atrial tachycardias arising from the right atrial appendage: electrocardiographic and electrophysiologic characteristics and radiofrequency ablation. J Cardiovasc Electrophysiol. 2007;18:367–72. CrossRefMedlineGoogle Scholar
116. Biviano AB, Bain W, Whang W, et al. Focal left atrial tachycardias not associated with prior catheter ablation for atrial fibrillation: clinical and electrophysiological characteristics. Pacing Clin Electrophysiol. 2012;35:17–27. CrossRefMedlineGoogle Scholar
117. Walters TE, Kistler PM, Kalman JM. Radiofrequency ablation for atrial tachycardia and atrial flutter. Heart Lung Circ. 2012;21:386–94. CrossRefMedlineGoogle Scholar
118. Lee G, Sanders P, Kalman JM. Catheter ablation of atrial arrhythmias: state of the art. Lancet. 2012;380:1509–19. CrossRefMedlineGoogle Scholar
119. Gillette PC, Garson A Jr.. Electrophysiologic and pharmacologic characteristics of automatic ectopic atrial tachycardia. Circulation. 1977;56:571–5. FREE Full Text
120. Mehta AV, Sanchez GR, Sacks EJ, et al. Ectopic automatic atrial tachycardia in children: clinical characteristics, management and follow-up. J Am Coll Cardiol. 1988;11:379–85. CrossRefMedlineGoogle Scholar
121. Markowitz SM, Stein KM, Mittal S, et al. Differential effects of adenosine on focal and macroreentrant atrial tachycardia. J Cardiovasc Electrophysiol. 1999;10:489–502. CrossRefMedlineGoogle Scholar
122. Reisinger J, Gstrein C, Winter T, et al. Optimization of initial energy for cardioversion of atrial tachyarrhythmias with biphasic shocks. Am J Emerg Med. 2010;28:159–65. CrossRefMedlineGoogle Scholar
123. Engelstein ED, Lippman N, Stein KM, et al. Mechanism-specific effects of adenosine on atrial tachycardia. Circulation. 1994;89:2645–54. Abstract/FREE Full Text
124. Eidher U, Freihoff F, Kaltenbrunner W, et al. Efficacy and safety of ibutilide for the conversion of monomorphic atrial tachycardia. Pacing Clin Electrophysiol. 2006;29:358–62. CrossRefMedlineGoogle Scholar
125. de Loma-Osorio F, Diaz-Infante E, et al. Spanish Catheter Ablation Registry. 12th Official Report of the Spanish Society of Cardiology Working Group on Electrophysiology and Arrhythmias (2012). Rev Esp Cardiol (Engl Ed). 2013;66:983–92. CrossRefMedlineGoogle Scholar
126. Liu X, Dong J, Ho SY, et al. Atrial tachycardia arising adjacent to noncoronary aortic sinus: distinctive atrial activation patterns and anatomic insights. J Am Coll Cardiol. 2010;56:796–804. CrossRefMedlineGoogle Scholar
127. Creamer JE, Nathan AW, Camm AJ. Successful treatment of atrial tachycardias with flecainide acetate. Br Heart J. 1985;53:164–6. Abstract/FREE Full Text
128. Kunze KP, Kuck KH, Schlüter M, et al. Effect of encainide and flecainide on chronic ectopic atrial tachycardia. J Am Coll Cardiol. 1986;7:1121–6. CrossRefMedlineGoogle Scholar
129. von Bernuth G, Engelhardt W, Kramer HH, et al. Atrial automatic tachycardia in infancy and childhood. Eur Heart J. 1992;13:1410–5. Abstract/FREE Full Text
130. Lucet V, Do Ngoc D, Fidelle J, et al. [Anti-arrhythmia efficacy of propafenone in children. Apropos of 30 cases]. Arch Mal Coeur Vaiss. 1987;80:1385–93. MedlineGoogle Scholar
131. Heusch A, Kramer HH, Krogmann ON, et al. Clinical experience with propafenone for cardiac arrhythmias in the young. Eur Heart J. 1994;15:1050–6. Abstract/FREE Full Text
132. Colloridi V, Perri C, Ventriglia F, et al. Oral sotalol in pediatric atrial ectopic tachycardia. Am Heart J. 1992;123:254–6. CrossRefMedlineGoogle Scholar
133. Guccione P, Paul T, Garson A Jr.. Long-term follow-up of amiodarone therapy in the young: continued efficacy, unimpaired growth, moderate side effects. J Am Coll Cardiol. 1990;15:1118–24. CrossRefMedlineGoogle Scholar
134. Coumel P, Fidelle J. Amiodarone in the treatment of cardiac arrhythmias in children: one hundred thirty-five cases. Am Heart J. 1980;100:1063–9. CrossRefMedlineGoogle Scholar
135. Miyazaki A, Ohuchi H, Kurosaki K, et al. Efficacy and safety of sotalol for refractory tachyarrhythmias in congenital heart disease. Circ J. 2008;72:1998–2003. CrossRefMedlineGoogle Scholar
136. Kang KT, Etheridge SP, Kantoch MJ, et al. Current management of focal atrial tachycardia in children: a multicenter experience. Circ Arrhythm Electrophysiol. 2014;7:664–70. Abstract/FREE Full Text
137. Wang K, Goldfarb BL, Gobel FL, et al. Multifocal atrial tachycardia. Arch Intern Med. 1977;137:161–4. CrossRefMedlineGoogle Scholar
138. Bittar G, Friedman HS. The arrhythmogenicity of theophylline. A multivariate analysis of clinical determinants. Chest. 1991;99:1415–20. CrossRefMedlineGoogle Scholar
139. Iseri LT, Fairshter RD, Hardemann JL, et al. Magnesium and potassium therapy in multifocal atrial tachycardia. Am Heart J. 1985;110:789–94. CrossRefMedlineGoogle Scholar
140. Kastor JA. Multifocal atrial tachycardia. N Engl J Med. 1990;322:1713–7. CrossRefMedlineGoogle Scholar
141. Arsura EL, Solar M, Lefkin AS, et al. Metoprolol in the treatment of multifocal atrial tachycardia. Crit Care Med. 1987;15:591–4. CrossRefMedlineGoogle Scholar
142. Levine JH, Michael JR, Guarnieri T. Treatment of multifocal atrial tachycardia with verapamil. N Engl J Med. 1985;312:21–5. CrossRefMedlineGoogle Scholar
143. Salerno DM, Anderson B, Sharkey PJ, et al. Intravenous verapamil for treatment of multifocal atrial tachycardia with and without calcium pretreatment. Ann Intern Med. 1987;107:623–8. CrossRefMedlineGoogle Scholar
144. Hazard PB, Burnett CR. Verapamil in multifocal atrial tachycardia. Hemodynamic and respiratory changes. Chest. 1987;91:68–70. CrossRefMedlineGoogle Scholar
145. Hazard PB, Burnett CR. Treatment of multifocal atrial tachycardia with metoprolol. Crit Care Med. 1987;15:20–5. CrossRefMedlineGoogle Scholar
146. Mehta D, Wafa S, Ward DE, et al. Relative efficacy of various physical manoeuvres in the termination of junctional tachycardia. Lancet. 1988;1:1181–5. CrossRefMedlineGoogle Scholar
147. Wen ZC, Chen SA, Tai CT, et al. Electrophysiological mechanisms and determinants of vagal maneuvers for termination of paroxysmal supraventricular tachycardia. Circulation. 1998;98:2716–23. Abstract/FREE Full Text
148. Glatter KA, Cheng J, Dorostkar P, et al. Electrophysiologic effects of adenosine in patients with supraventricular tachycardia. Circulation. 1999;99:1034–40. Abstract/FREE Full Text
149. Dougherty AH, Jackman WM, Naccarelli GV, et al. Acute conversion of paroxysmal supraventricular tachycardia with intravenous diltiazem. IV Diltiazem Study Group. Am J Cardiol. 1992;70:587–92. CrossRefMedlineGoogle Scholar
150. Waxman HL, Myerburg RJ, Appel R, et al. Verapamil for control of ventricular rate in paroxysmal supraventricular tachycardia and atrial fibrillation or flutter: a double-blind randomized cross-over study. Ann Intern Med. 1981;94:1–6. CrossRefMedlineGoogle Scholar
151. Amsterdam EA, Kulcyski J, Ridgeway MG,. Efficacy of cardioselective beta-adrenergic blốcade with intravenously administered metoprolol in the treatment of supraventricular tachyarrhythmias. J Clin Pharmacol. 1991;31:714–8. CrossRefMedlineGoogle Scholar
152. Das G, Tschida V, Gray R, et al. Efficacy of esmolol in the treatment and transfer of patients with supraventricular tachyarrhythmias to alternate oral antiarrhythmic agents. J Clin Pharmacol. 1988;28:746–50. CrossRefMedlineGoogle Scholar
153. Alboni P, Tomasi C, Menozzi C, et al. Efficacy and safety of out-of-hospital self-administered single-dose oral drug treatment in the management of infrequent, well-tolerated paroxysmal supraventricular tachycardia. J Am Coll Cardiol. 2001;37:548–53. CrossRefMedlineGoogle Scholar
154. Yeh SJ, Lin FC, Chou YY, et al. Termination of paroxysmal supraventricular tachycardia with a single oral dose of diltiazem and propranolol. Circulation. 1985;71:104–9. Abstract/FREE Full Text
155. Rinkenberger RL, Prystowsky EN, Heger JJ, et al. Effects of intravenous and chronic oral verapamil administration in patients with supraventricular tachyarrhythmias. Circulation. 1980;62:996–1010. FREE Full Text
156. DEste D, Zoppo F, Bertaglia E, et al. Long-term outcome of patients with atrioventricular node reentrant tachycardia. Int J Cardiol. 2007;115:350–3. CrossRefMedlineGoogle Scholar
157. Langberg JJ, Leon A, Borganelli M, et al. A randomized, prospective comparison of anterior and posterior approaches to radiofrequency catheter ablation of atrioventricular nodal reentry tachycardia. Circulation. 1993;87:1551–6. Abstract/FREE Full Text
158. Kalbfleisch SJ, Strickberger SA, Williamson B, et al. Randomized comparison of anatomic and electrogram mapping approaches to ablation of the slow pathway of atrioventricular node reentrant tachycardia. J Am Coll Cardiol. 1994;23:716–23. CrossRefMedlineGoogle Scholar
159. Kay GN, Epstein AE, Dailey SM, et al. Selective radiofrequency ablation of the slow pathway for the treatment of atrioventricular nodal reentrant tachycardia. Evidence for involvement of perinodal myocardium within the reentrant circuit. Circulation. 1992;85:1675–88. Abstract/FREE Full Text
160. Bogun F, Knight B, Weiss R, et al. Slow pathway ablation in patients with documented but noninducible paroxysmal supraventricular tachycardia. J Am Coll Cardiol. 1996;28:1000–4. CrossRefMedlineGoogle Scholar
161. OHara GE, Philippon F, Champagne J, et al. Catheter ablation for cardiac arrhythmias: a 14-year experience with 5330 consecutive patients at the Quebec Heart Institute, Laval Hospital. Can J Cardiol. 2007; 23 Suppl B:67B–70B. CrossRefMedlineGoogle Scholar
162. Gambhir DS, Bhargava M, Arora R, et al. Electrophysiologic effects and therapeutic efficacy of intravenous flecainide for termination of paroxysmal supraventricular tachycardia. Indian Heart J. 1995;47:237–43. MedlineGoogle Scholar
163. Musto B, Cavallaro C, Musto A, et al. Flecainide single oral dose for management of paroxysmal supraventricular tachycardia in children and young adults. Am Heart J. 1992;124:110–5. CrossRefMedlineGoogle Scholar
164. Munger TM, Packer DL, Hammill SC, et al. A population study of the natural history of Wolff-Parkinson-White syndrome in Olmsted County, Minnesota, 1953–1989. Circulation. 1993;87:866–73. Abstract/FREE Full Text
165. Pappone C, Vicedomini G, Manguso F, et al. Wolff-Parkinson-white syndrome in the era of catheter ablation: insights from a registry study of 2169 patients. Circulation. 2014;130:811–9. Abstract/FREE Full Text
166. Timmermans C, Smeets JL, Rodriguez LM, et al. Aborted sudden death in the Wolff-Parkinson-White syndrome. Am J Cardiol. 1995;76:492–4. CrossRefMedlineGoogle Scholar
167. Klein GJ, Bashore TM, Sellers TD, et al. Ventricular fibrillation in the Wolff-Parkinson-White syndrome. N Engl J Med. 1979;301:1080–5. CrossRefMedlineGoogle Scholar
168. Bromberg BI, Lindsay BD, Cain ME, et al. Impact of clinical history and electrophysiologic characterization of accessory pathways on management strategies to reduce sudden death among children with Wolff-Parkinson-White syndrome. J Am Coll Cardiol. 1996;27:690–5. CrossRefMedlineGoogle Scholar
169. Santinelli V, Radinovic A, Manguso F, et al. The natural history of asymptomatic ventricular pre-excitation a long-term prospective follow-up study of 184 asymptomatic children. J Am Coll Cardiol. 2009;53:275–80. CrossRefMedlineGoogle Scholar
170. Neumar RW, Otto CW, Link MS, et al. Part 8: adult advanced cardiovascular life support: 2010 American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation. 2010;122:S729–67. FREE Full Text
171. Smith GD, Dyson K, Taylor D, et al. Effectiveness of the Valsalva Manoeuvre for reversion of supraventricular tachycardia. Cochrane Database Syst Rev. 2013;3:CD009502. MedlineGoogle Scholar
172. Delaney B, Loy J, Kelly A-M. The relative efficacy of adenosine versus verapamil for the treatment of stable paroxysmal supraventricular tachycardia in adults: a meta-analysis. Eur J Emerg Med. 2011;18:148–52. CrossRefMedlineGoogle Scholar
173. Furlong R, Gerhardt RT, Farber P, et al. Intravenous adenosine as first-line prehospital management of narrow-complex tachycardias by EMS personnel without direct physician control. Am J Emerg Med. 1995;13:383–8. CrossRefMedlineGoogle Scholar
174. Schatz I, Ordog GJ, Karody R, et al. Wolff-Parkinson-White syndrome presenting in atrial fibrillation. Ann Emerg Med. 1987;16:574–8. CrossRefMedlineGoogle Scholar
175. Mittal S, Ayati S, Stein KM, et al. Transthoracic cardioversion of atrial fibrillation: comparison of rectilinear biphasic versus damped sine wave monophasic shocks. Circulation. 2000;101:1282–7. Abstract/FREE Full Text
176. Glatter KA, Dorostkar PC, Yang Y, et al. Electrophysiological effects of ibutilide in patients with accessory pathways. Circulation. 2001;104:1933–9. Abstract/FREE Full Text
177. Sellers TD Jr.., Campbell RW, Bashore TM, et al. Effects of procainamide and quinidine sulfate in the Wolff-Parkinson-White syndrome. Circulation. 1977;55:15–22. Abstract/FREE Full Text
178. Huycke EC, Sung RJ, Dias VC, et al. Intravenous diltiazem for termination of reentrant supraventricular tachycardia: a placebo-controlled, randomized, double-blind, multicenter study. J Am Coll Cardiol. 1989;13:538–44. CrossRefMedlineGoogle Scholar
179. Hamer A, Peter T, Platt M, et al. Effects of verapamil on supraventricular tachycardia in patients with overt and concealed Wolff-Parkinson-White syndrome. Am Heart J. 1981;101:600–12. CrossRefMedlineGoogle Scholar
180. Hombach V, Braun V, Hopp HW, et al. Antiarrhythmic effects of acute betablốcade with atenolol on supraventricular tachycardias at rest and during exercise. Klin Wochenschr. 1981;59:123–33. CrossRefMedlineGoogle Scholar
181. Morady F, DiCarlo LA Jr.., Baerman JM, et al. Effect of propranolol on ventricular rate during atrial fibrillation in the Wolff-Parkinson-White syndrome. Pacing Clin Electrophysiol. 1987;10:492–6. CrossRefMedlineGoogle Scholar
182. Sellers TD Jr.., Bashore TM, Gallagher JJ. Digitalis in the pre-excitation syndrome. Analysis during atrial fibrillation. Circulation. 1977;56:260–7. Abstract/FREE Full Text
183. Sheinman BD, Evans T. Acceleration of ventricular rate by fibrillation associated with the Wolff-Parkinson-White syndrome. Br Med J (Clin Res Ed). 1982;285:999–1000. Abstract/FREE Full Text
184. Boriani G, Biffi M, Frabetti L, et al. Ventricular fibrillation after intravenous amiodarone in Wolff-Parkinson-White syndrome with atrial fibrillation. Am Heart J. 1996;131:1214–6. CrossRefMedlineGoogle Scholar
185. Shiraishi H, Ishibashi K, Urao N, et al. Two cases of polymorphic ventricular tachycardia induced by the administration of verapamil against paroxysmal supraventricular tachycardia. Intern Med. 2002;41:445–8. CrossRefMedlineGoogle Scholar
186. Schützenberger W, Leisch F, Gmeiner R. Enhanced accessory pathway conduction following intravenous amiodarone in atrial fibrillation. A case report. Int J Cardiol. 1987;16:93–5. CrossRefMedlineGoogle Scholar
187. Jackman WM, Wang XZ, Friday KJ, et al. Catheter ablation of accessory atrioventricular pathways (Wolff-Parkinson-White syndrome) by radiofrequency current. N Engl J Med. 1991;324:1605–11. CrossRefMedlineGoogle Scholar
188. Calkins H, Langberg J, Sousa J, et al. Radiofrequency catheter ablation of accessory atrioventricular connections in 250 patients. Abbreviated therapeutic approach to Wolff-Parkinson-White syndrome. Circulation. 1992;85:1337–46. Abstract/FREE Full Text
189. Dagres N, Clague JR, Kottkamp H, et al. Radiofrequency catheter ablation of accessory pathways. Outcome and use of antiarrhythmic drugs during follow-up. Eur Heart J. 1999;20:1826–32. Abstract/FREE Full Text
190. Schläpfer J, Fromer M. Late clinical outcome after successful radiofrequency catheter ablation of accessory pathways. Eur Heart J. 2001;22:605–9. Abstract/FREE Full Text
191. Belhassen B, Rogowski O, Glick A, et al. Radiofrequency ablation of accessory pathways: a 14 year experience at the Tel Aviv Medical Center in 508 patients. Isr Med Assoc J. 2007;9:265–70. MedlineGoogle Scholar
192. Kugler JD, Danford DA, Deal BJ, et al. Radiofrequency catheter ablation for tachyarrhythmias in children and adolescents. The Pediatric Electrophysiology Society. N Engl J Med. 1994;330:1481–7. CrossRefMedlineGoogle Scholar
193. Kugler JD, Danford DA, Houston K, et al. Radiofrequency catheter ablation for paroxysmal supraventricular tachycardia in children and adolescents without structural heart disease. Pediatric EP Society, Radiofrequency Catheter Ablation Registry. Am J Cardiol. 1997;80:1438–43. CrossRefMedlineGoogle Scholar
194. Sakurai M, Yasuda H, Kato N, et al. Acute and chronic effects of verapamil in patients with paroxysmal supraventricular tachycardia. Am Heart J. 1983;105:619–28. CrossRefMedlineGoogle Scholar
195. Hopson JR, Buxton AE, Rinkenberger RL, et al. Safety and utility of flecainide acetate in the routine care of patients with supraventricular tachyarrhythmias: results of a multicenter trial. The Flecainide Supraventricular Tachycardia Study Group. Am J Cardiol. 1996;77:72A–82A. CrossRefMedlineGoogle Scholar
196. Feld GK, Nademanee K, Weiss J, et al. Electrophysiologic basis for the suppression by amiodarone of orthodromic supraventricular tachycardias complicating pre-excitation syndromes. J Am Coll Cardiol. 1984;3:1298–307. CrossRefMedlineGoogle Scholar
197. Feld GK, Nademanee K, Stevenson W, et al. Clinical and electrophysiologic effects of amiodarone in patients with atrial fibrillation complicating the Wolff-Parkinson-White syndrome. Am Heart J. 1988;115:102–7. CrossRefMedlineGoogle Scholar
198. Bauernfeind RA, Wyndham CR, Dhingra RC, et al. Serial electrophysiologic testing of multiple drugs in patients with atrioventricular nodal reentrant paroxysmal tachycardia. Circulation. 1980;62:1341–9. Abstract/FREE Full Text
199. Sharma AD, Yee R, Guiraudon G, et al. Sensitivity and specificity of invasive and noninvasive testing for risk of sudden death in Wolff-Parkinson-White syndrome. J Am Coll Cardiol. 1987;10:373–81. CrossRefMedlineGoogle Scholar
200. Gaita F, Giustetto C, Riccardi R, et al. Stress and pharmacologic tests as methods to identify patients with Wolff-Parkinson-White syndrome at risk of sudden death. Am J Cardiol. 1989;64:487–90. CrossRefMedlineGoogle Scholar
201. Spar DS, Silver ES, Hordof AJ, et al. Relation of the utility of exercise testing for risk assessment in pediatric patients with ventricular preexcitation to pathway location. Am J Cardiol. 2012;109:1011–4. CrossRefMedlineGoogle Scholar
202. Wackel P, Irving C, Webber S, et al. Risk stratification in Wolff-Parkinson-White syndrome: the correlation between noninvasive and invasive testing in pediatric patients. Pacing Clin Electrophysiol. 2012;35:1451–7. CrossRefMedlineGoogle Scholar
203. Beckman KJ, Gallastegui JL, Bauman JL, et al. The predictive value of electrophysiologic studies in untreated patients with Wolff-Parkinson-White syndrome. J Am Coll Cardiol. 1990;15:640–7. CrossRefMedlineGoogle Scholar
204. Pappone C, Vicedomini G, Manguso F, et al. Risk of malignant arrhythmias in initially symptomatic patients with Wolff-Parkinson-White syndrome: results of a prospective long-term electrophysiological follow-up study. Circulation. 2012;125:661–8. Abstract/FREE Full Text
205. Rinne C, Klein GJ, Sharma AD, et al. Relation between clinical presentation and induced arrhythmias in the Wolff-Parkinson-White syndrome. Am J Cardiol. 1987;60:576–9. CrossRefMedlineGoogle Scholar
206. Brembilla-Perrot B, Holban I, Houriez P, et al. Influence of age on the potential risk of sudden death in asymptomatic Wolff-Parkinson-White syndrome. Pacing Clin Electrophysiol. 2001;24:1514–8. CrossRefMedlineGoogle Scholar
207. Pappone C, Santinelli V, Manguso F, et al. A randomized study of prophylactic catheter ablation in asymptomatic patients with the Wolff-Parkinson-White syndrome. N Engl J Med. 2003;349:1803–11. CrossRefMedlineGoogle Scholar
208. Pappone C, Santinelli V, Rosanio S, et al. Usefulness of invasive electrophysiologic testing to stratify the risk of arrhythmic events in asymptomatic patients with Wolff-Parkinson-White pattern: results from a large prospective long-term follow-up study. J Am Coll Cardiol. 2003;41:239–44. CrossRefMedlineGoogle Scholar
209. Epstein AE, Miles WM, Benditt DG, et al. Personal and public safety issues related to arrhythmias that may affect consciousness: implications for regulation and physician recommendations. A medical/scientific statement from the American Heart Association and the North American Society of Pacing and Electrophysiology. Circulation. 1996;94:1147–66. FREE Full Text
210. Klein GJ, Yee R, Sharma AD. Longitudinal electrophysiologic assessment of asymptomatic patients with the Wolff-Parkinson-White electrocardiographic pattern. N Engl J Med. 1989;320:1229–33. CrossRefMedlineGoogle Scholar
211. Leitch JW, Klein GJ, Yee R, et al. Prognostic value of electrophysiology testing in asymptomatic patients with Wolff-Parkinson-White pattern. Circulation. 1990;82:1718–23. Abstract/FREE Full Text
212. Milstein S, Sharma AD, Klein GJ. Electrophysiologic profile of asymptomatic Wolff-Parkinson-White pattern. Am J Cardiol. 1986;57:1097–100. CrossRefMedlineGoogle Scholar
213. Satoh M, Aizawa Y, Funazaki T, et al. Electrophysiologic evaluation of asymptomatic patients with the Wolff-Parkinson-White pattern. Pacing Clin Electrophysiol. 1989;12:413–20. CrossRefMedlineGoogle Scholar
214. Havránek S, Simek J, Stovícek P, et al. Distribution of mean cycle length in cavo-tricuspid isthmus dependent atrial flutter. Physiol Res. 2012;61:43–51. MedlineGoogle Scholar
215. Waldo AL, Feld GK. Inter-relationships of atrial fibrillation and atrial flutter mechanisms and clinical implications. J Am Coll Cardiol. 2008;51:779–86. CrossRefMedlineGoogle Scholar
216. Pérez FJ, Schubert CM, Parvez B, et al. Long-term outcomes after catheter ablation of cavo-tricuspid isthmus dependent atrial flutter: a meta-analysis. Circ Arrhythm Electrophysiol. 2009;2:393–401. Abstract/FREE Full Text
217. Ellis K, Wazni O, Marrouche N, et al. Incidence of atrial fibrillation post-cavotricuspid isthmus ablation in patients with typical atrial flutter: left-atrial size as an independent predictor of atrial fibrillation recurrence. J Cardiovasc Electrophysiol. 2007;18:799–802. CrossRefMedlineGoogle Scholar
218. Hsieh M-H, Tai C-T, Chiang C-E, et al. Recurrent atrial flutter and atrial fibrillation after catheter ablation of the cavotricuspid isthmus: a very long-term follow-up of 333 patients. J Interv Card Electrophysiol. 2002;7:225–31. CrossRefMedlineGoogle Scholar
219. Tai CT, Chen SA, Chiang CE, et al. Long-term outcome of radiofrequency catheter ablation for typical atrial flutter: risk prediction of recurrent arrhythmias. J Cardiovasc Electrophysiol. 1998;9:115–21. CrossRefMedlineGoogle Scholar
220. Paydak H, Kall JG, Burke MC, et al. Atrial fibrillation after radiofrequency ablation of type I atrial flutter: time to onset, determinants, and clinical course. Circulation. 1998;98:315–22. Abstract/FREE Full Text
221. Chinitz JS, Gerstenfeld EP, Marchlinski FE, et al. Atrial fibrillation is common after ablation of isolated atrial flutter during long-term follow-up. Heart Rhythm. 2007;4:1029–33. CrossRefMedlineGoogle Scholar
222. Teh AW, Medi C, Lee G, et al. Long-term outcome following ablation of atrial flutter occurring late after atrial septal defect repair. Pacing Clin Electrophysiol. 2011;34:431–5. CrossRefMedlineGoogle Scholar
223. Gerstenfeld EP, Callans DJ, Dixit S, et al. Mechanisms of organized left atrial tachycardias occurring after pulmonary vein isolation. Circulation. 2004;110:1351–7. Abstract/FREE Full Text
224. Chugh A, Oral H, Lemola K, et al. Prevalence, mechanisms, and clinical significance of macroreentrant atrial tachycardia during and following left atrial ablation for atrial fibrillation. Heart Rhythm. 2005;2:464–71. CrossRefMedlineGoogle Scholar
225. Veenhuyzen GD, Knecht S, ONeill MD, et al. Atrial tachycardias encountered during and after catheter ablation for atrial fibrillation: part I: classification, incidence, management. Pacing Clin Electrophysiol. 2009;32:393–8. CrossRefMedlineGoogle Scholar
226. Karch MR, Zrenner B, Deisenhofer I, et al. Freedom from atrial tachyarrhythmias after catheter ablation of atrial fibrillation: a randomized comparison between 2 current ablation strategies. Circulation. 2005;111:2875–80. Abstract/FREE Full Text
227. Sawhney N, Anousheh R, Chen W, et al. Circumferential pulmonary vein ablation with additional linear ablation results in an increased incidence of left atrial flutter compared with segmental pulmonary vein isolation as an initial approach to ablation of paroxysmal atrial fibrillation. Circ Arrhythm Electrophysiol. 2010;3:243–8. Abstract/FREE Full Text
228. Neumann T, Vogt J, Schumacher B, et al. Circumferential pulmonary vein isolation with the cryoballoon technique results from a prospective 3-center study. J Am Coll Cardiol. 2008;52:273–8. CrossRefMedlineGoogle Scholar
229. Ellenbogen KA, Stambler BS, Wood MA, et al. Efficacy of intravenous ibutilide for rapid termination of atrial fibrillation and atrial flutter: a dose-response study. J Am Coll Cardiol. 1996;28:130–6. CrossRefMedlineGoogle Scholar
230. Suttorp MJ, Kingma JH, Jessurun ER, et al. The value of class IC antiarrhythmic drugs for acute conversion of paroxysmal atrial fibrillation or flutter to sinus rhythm. J Am Coll Cardiol. 1990;16:1722–7. CrossRefMedlineGoogle Scholar
231. Stambler BS, Wood MA, Ellenbogen KA, et al. Efficacy and safety of repeated intravenous doses of ibutilide for rapid conversion of atrial flutter or fibrillation. Ibutilide Repeat Dose Study Investigators. Circulation. 1996;94:1613–21. Abstract/FREE Full Text
232. Kingma JH, Suttorp MJ. Acute pharmacologic conversion of atrial fibrillation and flutter: the role of flecainide, propafenone, and verapamil. Am J Cardiol. 1992;70:56A–60A. CrossRefMedlineGoogle Scholar
233. Vos MA, Golitsyn SR, Stangl K, et al. Superiority of ibutilide (a new class III agent) over DL-sotalol in converting atrial flutter and atrial fibrillation. The Ibutilide/Sotalol Comparator Study Group. Heart. 1998;79:568–75. Abstract/FREE Full Text
234. Volgman AS, Carberry PA, Stambler B, et al. Conversion efficacy and safety of intravenous ibutilide compared with intravenous procainamide in patients with atrial flutter or fibrillation. J Am Coll Cardiol. 1998;31:1414–9. CrossRefMedlineGoogle Scholar
235. Steinwender C, Hönig S, Kypta A, et al. Pre-injection of magnesium sulfate enhances the efficacy of ibutilide for the conversion of typical but not of atypical persistent atrial flutter. Int J Cardiol. 2010;141:260–5. CrossRefMedlineGoogle Scholar
236. Singh S, Zoble RG, Yellen L, et al. Efficacy and safety of oral dofetilide in converting to and maintaining sinus rhythm in patients with chronic atrial fibrillation or atrial flutter: the symptomatic atrial fibrillation investigative research on dofetilide (SAFIRE-D) study. Circulation. 2000;102:2385–90. Abstract/FREE Full Text
237. Blackshear JL, Stambler BS, Strauss WE, et al. Control of heart rate during transition from intravenous to oral diltiazem in atrial fibrillation or flutter. Am J Cardiol. 1996;78:1246–50. CrossRefMedlineGoogle Scholar
238. Singh BN, Hecht HS, Nademanee K, et al. Electrophysiologic and hemodynamic effects of slow-channel blốcing drugs. Prog Cardiovasc Dis. 1982;25:103–32. CrossRefMedlineGoogle Scholar
239. Akhtar M, Tchou P, Jazayeri M. Use of calcium channel entry blockers in the treatment of cardiac arrhythmias. Circulation. 1989;80:IV31–9. MedlineGoogle Scholar
240. Delle Karth G, Geppert A, Neunteufl T, et al. Amiodarone versus diltiazem for rate control in critically ill patients with atrial tachyarrhythmias. Crit Care Med. 2001;29:1149–53. CrossRefMedlineGoogle Scholar
241. Ellenbogen KA, Dias VC, Plumb VJ, et al. A placebo-controlled trial of continuous intravenous diltiazem infusion for 24-hour heart rate control during atrial fibrillation and atrial flutter: a multicenter study. J Am Coll Cardiol. 1991;18:891–7. CrossRefMedlineGoogle Scholar
242. Ellenbogen KA, Dias VC, Cardello FP, et al. Safety and efficacy of intravenous diltiazem in atrial fibrillation or atrial flutter. Am J Cardiol. 1995;75:45–9. CrossRefMedlineGoogle Scholar
243. Platia EV, Michelson EL, Porterfield JK, et al. Esmolol versus verapamil in the acute treatment of atrial fibrillation or atrial flutter. Am J Cardiol. 1989;63:925–9. CrossRefMedlineGoogle Scholar
244. Salerno DM, Dias VC, Kleiger RE, et al. Efficacy and safety of intravenous diltiazem for treatment of atrial fibrillation and atrial flutter. The Diltiazem-Atrial Fibrillation/Flutter Study Group. Am J Cardiol. 1989;63:1046–51. CrossRefMedlineGoogle Scholar
245. Gallagher MM, Guo XH, Poloniecki JD, et al. Initial energy setting, outcome and efficiency in direct current cardioversion of atrial fibrillation and flutter. J Am Coll Cardiol. 2001;38:1498–504. CrossRefMedlineGoogle Scholar
246. Botkin SB, Dhanekula LS, Olshansky B. Outpatient cardioversion of atrial arrhythmias: efficacy, safety, and costs. Am Heart J. 2003;145:233–8. CrossRefMedlineGoogle Scholar
247. Pizzale S, Lemery R, Green MS, et al. Frequency and predictors of tachycardia-induced cardiomyopathy in patients with persistent atrial flutter. Can J Cardiol. 2009;25:469–72. CrossRefMedlineGoogle Scholar
248. Van Gelder IC, Crijns HJ, Van Gilst WH, et al. Prediction of uneventful cardioversion and maintenance of sinus rhythm from direct-current electrical cardioversion of chronic atrial fibrillation and flutter. Am J Cardiol. 1991;68:41–6. MedlineGoogle Scholar
249. Boriani G, Tukkie R, Manolis AS, et al. Atrial antitachycardia pacing and managed ventricular pacing in bradycardia patients with paroxysmal or persistent atrial tachyarrhythmias: the MINERVA randomized multicentre international trial. Eur Heart J. 2014;35:2352–62. Abstract/FREE Full Text
250. Mitchell ARJ, Spurrell PAR, Cheatle L, et al. Effect of atrial antitachycardia pacing treatments in patients with an atrial defibrillator: randomised study comparing subthreshold and nominal pacing outputs. Heart. 2002;87:433–7. Abstract/FREE Full Text
251. Gillis AM, Unterberg-Buchwald C, Schmidinger H, et al. Safety and efficacy of advanced atrial pacing therapies for atrial tachyarrhythmias in patients with a new implantable dual chamber cardioverter-defibrillator. J Am Coll Cardiol. 2002;40:1653–9. CrossRefMedlineGoogle Scholar
252. Waldo AL, MacLean WA, Cooper TB, et al. Use of temporarily placed epicardial atrial wire electrodes for the diagnosis and treatment of cardiac arrhythmias following open-heart surgery. J Thorac Cardiovasc Surg. 1978;76:500–5. MedlineGoogle Scholar
253. Peters RW, Shorofsky SR, Pelini M, et al. Overdrive atrial pacing for conversion of atrial flutter: comparison of postoperative with nonpostoperative patients. Am Heart J. 1999;137:100–3. CrossRefMedlineGoogle Scholar
254. Ghali WA, Wasil BI, Brant R, et al. Atrial flutter and the risk of thromboembolism: a systematic review and meta-analysis. Am J Med. 2005;118:101–7. CrossRefMedlineGoogle Scholar
255. Clemo HF, Wood MA, Gilligan DM, et al. Intravenous amiodarone for acute heart rate control in the critically ill patient with atrial tachyarrhythmias. Am J Cardiol. 1998;81:594–8. CrossRefMedlineGoogle Scholar
256. Roberts SA, Diaz C, Nolan PE, et al. Effectiveness and costs of digoxin treatment for atrial fibrillation and flutter. Am J Cardiol. 1993;72:567–73. CrossRefMedlineGoogle Scholar
257. Natale A, Newby KH, Pisanó E, et al. Prospective randomized comparison of antiarrhythmic therapy versus first-line radiofrequency ablation in patients with atrial flutter. J Am Coll Cardiol. 2000;35:1898–904. CrossRefMedlineGoogle Scholar
258. Bastani H, Drca N, Insulander P, et al. Cryothermal vs. radiofrequency ablation as atrial flutter therapy: a randomized comparison. Europace. 2013;15:420–8. Abstract/FREE Full Text
259. Poty H, Saoudi N, Nair M, et al. Radiofrequency catheter ablation of atrial flutter. Further insights into the various types of isthmus blốc: application to ablation during sinus rhythm. Circulation. 1996;94:3204–13. Abstract/FREE Full Text
260. Schwartzman D, Callans DJ, Gottlieb CD, et al. Conduction blốc in the inferior vena caval-tricuspid valve isthmus: association with outcome of radiofrequency ablation of type I atrial flutter. J Am Coll Cardiol. 1996;28:1519–31. CrossRefMedlineGoogle Scholar
261. Delacretaz E, Ganz LI, Soejima K, et al. Multi atrial maco-re-entry circuits in adults with repaired congenital heart disease: entrainment mapping combined with three-dimensional electroanatomic mapping. J Am Coll Cardiol. 2001;37:1665–76. CrossRefMedlineGoogle Scholar
262. Jaïs P, Shah DC, Haïssaguerre M, et al. Mapping and ablation of left atrial flutters. Circulation. 2000;101:2928–34. Abstract/FREE Full Text
263. Da Costa A, Thevenin J, Roche F, et al. Results from the Loire-Ardeche-Drome-Isere-Puy-de-Dome (LADIP) trial on atrial flutter, a multicentric prospective randomized study comparing amiodarone and radiofrequency ablation after the first episode of symptomatic atrial flutter. Circulation. 2006;114:1676–81. Abstract/FREE Full Text
264. Pedersen OD, Bagger H, Keller N, et al. Efficacy of dofetilide in the treatment of atrial fibrillation-flutter in patients with reduced left ventricular function: a Danish investigations of arrhythmia and mortality on dofetilide (diamond) substudy. Circulation. 2001;104:292–6. Abstract/FREE Full Text
265. Benditt DG, Williams JH, Jin J, et al. Maintenance of sinus rhythm with oral d,l-sotalol therapy in patients with symptomatic atrial fibrillation and/or atrial flutter. d,l-Sotalol Atrial Fibrillation/Flutter Study Group. Am J Cardiol. 1999;84:270–7. CrossRefMedlineGoogle Scholar
266. Reithmann C, Hoffmann E, Spitzlberger G, et al. Catheter ablation of atrial flutter due to amiodarone therapy for paroxysmal atrial fibrillation. Eur Heart J. 2000;21:565–72. Abstract/FREE Full Text
267. Huang DT, Monahan KM, Zimetbaum P, et al. Hybrid pharmacologic and ablative therapy: a novel and effective approach for the management of atrial fibrillation. J Cardiovasc Electrophysiol. 1998;9:462–9. CrossRefMedlineGoogle Scholar
268. Schumacher B, Jung W, Lewalter T, et al. Radiofrequency ablation of atrial flutter due to administration of class IC antiarrhythmic drugs for atrial fibrillation. Am J Cardiol. 1999;83:710–3. CrossRefMedlineGoogle Scholar
269. Mohanty S, Mohanty P, Di Biase L, et al. Results from a single-blind, randomized study comparing the impact of different ablation approaches on long-term procedure outcome in coexistent atrial fibrillation and flutter (APPROVAL). Circulation. 2013;127:1853–60. Abstract/FREE Full Text
270. Wazni O, Marrouche NF, Martin DO, et al. Randomized study comparing combined pulmonary vein-left atrial junction disconnection and cavotricuspid isthmus ablation versus pulmonary vein-left atrial junction disconnection alone in patients presenting with typical atrial flutter and atrial fibrillation. Circulation. 2003;108:2479–83. Abstract/FREE Full Text
271. Coffey JO, dAvila A, Dukkipati S, et al. Catheter ablation of scar-related atypical atrial flutter. Europace. 2013;15:414–9. Abstract/FREE Full Text
272. Aliot E, Denjoy I. Comparison of the safety and efficacy of flecainide versus propafenone in hospital out-patients with symptomatic paroxysmal atrial fibrillation/flutter. The Flecainide AF French Study Group. Am J Cardiol. 1996;77:66A–71A. CrossRefMedlineGoogle Scholar
273. Van Gelder IC, Crijns HJ, Van Gilst WH, et al. Efficacy and safety of flecainide acetate in the maintenance of sinus rhythm after electrical cardioversion of chronic atrial fibrillation or atrial flutter. Am J Cardiol. 1989;64:1317–21. CrossRefMedlineGoogle Scholar
274. Pietersen AH, Hellemann H. Usefulness of flecainide for prevention of paroxysmal atrial fibrillation and flutter. Danish-Norwegian Flecainide Multicenter Study Group. Am J Cardiol. 1991;67:713–7. CrossRefMedlineGoogle Scholar
275. Ruder MA, Davis JC, Eldar M, et al. Clinical and electrophysiologic characterization of automatic junctional tachycardia in adults. Circulation. 1986;73:930–937. Abstract/FREE Full Text
276. Wyndham CR, Dhingra RC, Smith T, et al. Concealed nonparoxysmal junctional tachycardia. Circulation. 1979;60:707–710. Abstract/FREE Full Text
277. Konecke LL, Knoebel SB. Nonparoxysmal junctional tachycardia complicating acute myocardial infarction. Circulation. 1972;45:367–74. Abstract/FREE Full Text
278. Fishenfeld J, Desser KB, Benchimol A. Non-paroxysmal A-V junctional tachycardia associated with acute myocardial infarction. Am Heart J. 1973;86:754–8. CrossRefMedlineGoogle Scholar
279. Kumagai K, Yamato H, Yamanouchi Y, et al. Automatic junctional tachycardia in an adult. Clin Cardiol. 1990;13:813–6. CrossRefMedlineGoogle Scholar
280. Cook JR, Steinberg JS. An incessant form of junctional ectopic tachycardia in an adult responsive to a class 1C agent. Am Heart J. 1991;122:1487–9. CrossRefMedlineGoogle Scholar
281. Kuck KH, Kunze KP, Schlüter M, et al. Encainide versus flecainide for chronic atrial and junctional ectopic tachycardia. Am J Cardiol. 1988;62: 37L–44L. CrossRefMedlineGoogle Scholar
282. Mamchur SE, Kurilin MY. High-amplitude pace mapping increases safety of radiofrequency catheter ablation of parahisian ectopic foci. Pacing Clin Electrophysiol. 2012;35:1458–63. CrossRefMedlineGoogle Scholar
283. Padanilam BJ, Manfredi JA, Steinberg LA, et al. Differentiating junctional tachycardia and atrioventricular node re-entry tachycardia based on response to atrial extrastimulus pacing. J Am Coll Cardiol. 2008;52:1711–7. CrossRefMedlineGoogle Scholar
284. Scheinman MM, Gonzalez RP, Cooper MW, et al. Clinical and electrophysiologic features and role of catheter ablation techniques in adult patients with automatic atrioventricular junctional tachycardia. Am J Cardiol. 1994;74:565–72. CrossRefMedlineGoogle Scholar
285. Fan R, Tardos JG, Almasry I, et al. Novel use of atrial overdrive pacing to rapidly differentiate junctional tachycardia from atrioventricular nodal reentrant tachycardia. Heart Rhythm. 2011;8:840–4. CrossRefMedlineGoogle Scholar
286. Srivathsan K, Gami AS, Barrett R, et al. Differentiating atrioventricular nodal reentrant tachycardia from junctional tachycardia: novel application of the delta H-A interval. J Cardiovasc Electrophysiol. 2008;19:1–6. CrossRefMedlineGoogle Scholar
287. Hamdan M, Van Hare GF, Fisher W, et al. Selective catheter ablation of the tachycardia focus in patients with nonreentrant junctional tachycardia. Am J Cardiol. 1996;78:1292–7. CrossRefMedlineGoogle Scholar
288. Law IH, Von Bergen NH, Gingerich JC, et al. Transcatheter cryothermal ablation of junctional ectopic tachycardia in the normal heart. Heart Rhythm. 2006;3:903–7. CrossRefMedlineGoogle Scholar
289. Garson A Jr.., Gillette PC. Electrophysiologic studies of supraventricular tachycardia in children. I. Clinical-electrophysiologic correlations. Am Heart J. 1981;102:233–50. CrossRefMedlineGoogle Scholar
290. Ko JK, Deal BJ, Strasburger JF, et al. Supraventricular tachycardia mechanisms and their age distribution in pediatric patients. Am J Cardiol. 1992;69:1028–32. CrossRefMedlineGoogle Scholar
291. Weindling SN, Saul JP, Walsh EP. Efficacy and risks of medical therapy for supraventricular tachycardia in neonates and infants. Am Heart J. 1996;131:66–72. CrossRefMedlineGoogle Scholar
292. Garson A Jr.., Gillette PC, McNamara DG. Supraventricular tachycardia in children: clinical features, response to treatment, and long-term follow-up in 217 patients. J Pediatr. 1981;98:875–82. CrossRefMedlineGoogle Scholar
293. Dixon J, Foster K, Wyllie J, et al. Guidelines and adenosine dosing in supraventricular tachycardia. Arch Dis Child. 2005;90:1190–1. Abstract/FREE Full Text
294. Díaz-Parra S, Sánchez-Yañez P, Zabala-Argüelles I, et al. Use of adenosine in the treatment of supraventricular tachycardia in a pediatric emergency department. Pediatr Emerg Care. 2014;30:388–93. CrossRefMedlineGoogle Scholar
295. Losek JD, Endom E, Dietrich A, et al. Adenosine and pediatric supraventricular tachycardia in the emergency department: multicenter study and review. Ann Emerg Med. 1999;33:185–91. CrossRefMedlineGoogle Scholar
296. Deal BJ, Keane JF, Gillette PC, et al. Wolff-Parkinson-White syndrome and supraventricular tachycardia during infancy: management and follow-up. J Am Coll Cardiol. 1985;5:130–5. CrossRefMedlineGoogle Scholar
297. Villain E, Bonnet D, Acar P, et al. [Recommendations for the treatment of recurrent supraventricular tachycardia in infants]. Arch Pediatr. 1998;5:133–8. CrossRefMedlineGoogle Scholar
298. Fish FA, Gillette PC, Benson DW Jr.. Proarrhythmia, cardiac arrest and death in young patients receiving encainide and flecainide. The Pediatric Electrophysiology Group. J Am Coll Cardiol. 1991;18:356–65. CrossRefMedlineGoogle Scholar
299. Lee P-C, Hwang B, Chen S-A, et al. The results of radiofrequency catheter ablation of supraventricular tachycardia in children. Pacing Clin Electrophysiol. 2007;30:655–61. CrossRefMedlineGoogle Scholar
300. Van Hare GF, Javitz H, Carmelli D, et al. Prospective assessment after pediatric cardiac ablation: demographics, medical profiles, and initial outcomes. J Cardiovasc Electrophysiol. 2004;15:759–70. CrossRefMedlineGoogle Scholar
301. Aiyagari R, Saarel EV, Etheridge SP, et al. Radiofrequency ablation for supraventricular tachycardia in children < or =15 kg is safe and effective. Pediatr Cardiol. 2005;26:622–6. CrossRefMedlineGoogle Scholar
302. Blaufox AD, Felix GL, Saul JP. Radiofrequency catheter ablation in infants </=18 months old: when is it done and how do they fare?: short-term data from the pediatric ablation registry. Circulation. 2001;104:2803–8. Abstract/FREE Full Text
303. Blaufox AD, Paul T, Saul JP. Radiofrequency catheter ablation in small children: relationship of complications to application dose. Pacing Clin Electrophysiol. 2004;27:224–9. CrossRefMedlineGoogle Scholar
304. Kantoch MJ, Gulamhusein SS, Sanatani S. Short- and long-term outcomes in children undergoing radiofrequency catheter ablation before their second birthday. Can J Cardiol. 2011;27:523.e3–9. MedlineGoogle Scholar
305. Schaffer MS, Gow RM, Moak JP, et al. Mortality following radiofrequency catheter ablation (from the Pediatric Radiofrequency Ablation Registry). Participating members of the Pediatric Electrophysiology Society. Am J Cardiol. 2000;86:639–43. CrossRefMedlineGoogle Scholar
306. Collins KK, Van Hare GF, Kertesz NJ, et al. Pediatric nonpost-operative junctional ectopic tachycardia medical management and interventional therapies. J Am Coll Cardiol. 2009;53:690–7. CrossRefMedlineGoogle Scholar
307. Batra AS, Chun DS, Johnson TR, et al. A prospective analysis of the incidence and risk factors associated with junctional ectopic tachycardia following surgery for congenital heart disease. Pediatr Cardiol. 2006;27:51–5. CrossRefMedlineGoogle Scholar
308. Andreasen JB, Johnsen SP, Ravn HB. Junctional ectopic tachycardia after surgery for congenital heart disease in children. Intensive Care Med. 2008;34:895–902. CrossRefMedlineGoogle Scholar
309. Haas NA, Camphausen CK. Impact of early and standardized treatment with amiodarone on therapeutic success and outcome in pediatric patients with postoperative tachyarrhythmia. J Thorac Cardiovasc Surg. 2008;136:1215–22. CrossRefMedlineGoogle Scholar310. Laird WP, Snyder CS, Kertesz NJ, et al. Use of intravenous amiodarone for postoperative junctional ectopic tachycardia in children. Pediatr Cardiol. 2003;24:133–7. CrossRefMedlineGoogle Scholar
311. Kovacikova L, Hakacova N, Dobos D, et al. Amiodarone as a first-line therapy for postoperative junctional ectopic tachycardia. Ann Thorac Surg. 2009;88:616–22. CrossRefMedlineGoogle Scholar
312. Walsh EP, Saul JP, Sholler GF, et al. Evaluation of a staged treatment protocol for rapid automatic junctional tachycardia after operation for congenital heart disease. J Am Coll Cardiol. 1997;29:1046–53. CrossRefMedlineGoogle Scholar
313. Sanatani S, Potts JE, Reed JH, et al. The study of antiarrhythmic medications in infancy (SAMIS): a multicenter, randomized controlled trial comparing the efficacy and safety of digoxin versus propranolol for prophylaxis of supraventricular tachycardia in infants. Circ Arrhythm Electrophysiol. 2012;5:984–91. Abstract/FREE Full Text
314. van Engelen AD, Weijtens O, Brenner JI, et al. Management outcome and follow-up of fetal tachycardia. J Am Coll Cardiol. 1994;24:1371–5. CrossRefMedlineGoogle Scholar
315. Bouchardy J, Therrien J, Pilote L, et al. Atrial arrhythmias in adults with congenital heart disease. Circulation. 2009;120:1679–86. Abstract/FREE Full Text
316. Bernier M, Marelli AJ, Pilote L, et al. Atrial arrhythmias in adult patients with right- versus left-sided congenital heart disease anomalies. Am J Cardiol. 2010;106:547–51. CrossRefMedlineGoogle Scholar
317. Engelfriet P, Boersma E, Oechslin E, et al. The spectrum of adult congenital heart disease in Europe: morbidity and mortality in a 5 year follow-up period. The Euro Heart Survey on adult congenital heart disease. Eur Heart J. 2005;26:2325–33. Abstract/FREE Full Text
318. Trojnarska O, Grajek S, Kramer L, et al. Risk factors of supraventricular arrhythmia in adults with congenital heart disease. Cardiol J. 2009;16:218–26. MedlineGoogle Scholar
319. Verheugt CL, Uiterwaal CSPM, van der Velde ET, et al. Gender and outcome in adult congenital heart disease. Circulation. 2008;118:26–32. Abstract/FREE Full Text
320. Akar JG, Kok LC, Haines DE, et al. Coexistence of type I atrial flutter and intra-atrial re-entrant tachycardia in patients with surgically corrected congenital heart disease. J Am Coll Cardiol. 2001;38:377–84. CrossRefMedlineGoogle Scholar
321. Collins KK, Love BA, Walsh EP, et al. Location of acutely successful radiofrequency catheter ablation of intraatrial reentrant tachycardia in patients with congenital heart disease. Am J Cardiol. 2000;86:969–74. CrossRefMedlineGoogle Scholar
322. De Groot NMS, Zeppenfeld K, Wijffels MC, et al. Ablation of focal atrial arrhythmia in patients with congenital heart defects after surgery: role of circumscribed areas with heterogeneous conduction. Heart Rhythm. 2006;3:526–35. CrossRefMedlineGoogle Scholar
323. Koyak Z, Kroon B, de Groot JR, et al. Efficacy of antiarrhythmic drugs in adults with congenital heart disease and supraventricular tachycardias. Am J Cardiol. 2013;112:1461–7. CrossRefMedlineGoogle Scholar
324. Mah DY, Alexander ME, Cecchin F, et al. The electroanatomic mechanisms of atrial tachycardia in patients with tetralogy of Fallot and double outlet right ventricle. J Cardiovasc Electrophysiol. 2011;22:1013–7. CrossRefMedlineGoogle Scholar
325. Wasmer K, Köbe J, Dechering DG, et al. Isthmus-dependent right atrial flutter as the leading cause of atrial tachycardias after surgical atrial septal defect repair. Int J Cardiol. 2013;168:2447–52. CrossRefMedlineGoogle Scholar
326. De Groot NMS, Atary JZ, Blom NA, et al. Long-term outcome after ablative therapy of postoperative atrial tachyarrhythmia in patients with congenital heart disease and characteristics of atrial tachyarrhythmia recurrences. Circ Arrhythm Electrophysiol. 2010;3:148–54. Abstract/FREE Full Text
327. Hårdhammar PA, van Beusekom HM, Emanuelsson HU, et al. Reduction in thrombotic events with heparin-coated Palmaz-Schatz stents in normal porcine coronary arteries. Circulation. 1996;93:423–30. Abstract/FREE Full Text
328. Tanner H, Lukac P, Schwick N, et al. Irrigated-tip catheter ablation of intraatrial reentrant tachycardia in patients late after surgery of congenital heart disease. Heart Rhythm. 2004;1:268–75. CrossRefMedlineGoogle Scholar
329. Triedman JK, Saul JP, Weindling SN, et al. Radiofrequency ablation of intra-atrial reentrant tachycardia after surgical palliation of congenital heart disease. Circulation. 1995;91:707–14. Abstract/FREE Full Text
330. DeMazumder D, Lake DE, Cheng A, et al. Dynamic analysis of cardiac rhythms for discriminating atrial fibrillation from lethal ventricular arrhythmias. Circ Arrhythm Electrophysiol. 2013;6:555–61. Abstract/FREE Full Text
331. Yap S-C, Harris L, Silversides CK, et al. Outcome of intra-atrial re-entrant tachycardia catheter ablation in adults with congenital heart disease: negative impact of age and complex atrial surgery. J Am Coll Cardiol. 2010;56:1589–96. CrossRefMedlineGoogle Scholar
332. Ammash NM, Phillips SD, Hodge DO, et al. Outcome of direct current cardioversion for atrial arrhythmias in adults with congenital heart disease. Int J Cardiol. 2012;154:270–4. CrossRefMedlineGoogle Scholar
333. Pass RH, Liberman L, Al-Fayaddh M, et al. Continuous intravenous diltiazem infusion for short-term ventricular rate control in children. Am J Cardiol. 2000;86:559–62, A9. CrossRefMedlineGoogle Scholar
334. Garnock-Jones KP. Esmolol: a review of its use in the short-term treatment of tachyarrhythmias and the short-term control of tachycardia and hypertension. Drugs. 2012;72:109–32. CrossRefMedlineGoogle Scholar
335. DiMarco JP, Sellers TD, Lerman BB, et al. Diagnostic and therapeutic use of adenosine in patients with supraventricular tachyarrhythmias. J Am Coll Cardiol. 1985;6:417–25. CrossRefMedlineGoogle Scholar
336. Haines DE, DiMarco JP. Sustained intraatrial reentrant tachycardia: clinical, electrocardiographic and electrophysiologic characteristics and long-term follow-up. J Am Coll Cardiol. 1990;15:1345–54. CrossRefMedlineGoogle Scholar
337. Kall JG, Kopp D, Olshansky B, et al. Adenosine-sensitive atrial tachycardia. Pacing Clin Electrophysiol. 1995;18:300–6. CrossRefMedlineGoogle Scholar
338. Olshansky B, Okumura K, Hess PG, et al. Use of procainamide with rapid atrial pacing for successful conversion of atrial flutter to sinus rhythm. J Am Coll Cardiol. 1988;11:359–64. CrossRefMedlineGoogle Scholar
339. Heisel A, Jung J, Stopp M, et al. Facilitating influence of procainamide on conversion of atrial flutter by rapid atrial pacing. Eur Heart J. 1997;18:866–9. Abstract/FREE Full Text
340. Hoyer AW, Balaji S. The safety and efficacy of ibutilide in children and in patients with congenital heart disease. Pacing Clin Electrophysiol. 2007;30:1003–8. CrossRefMedlineGoogle Scholar
341. Crawford W, Plumb VJ, Epstein AE, et al. Prospective evaluation of transesophageal pacing for the interruption of atrial flutter. Am J Med. 1989;86:663–7. CrossRefMedlineGoogle Scholar
342. Rhodes LA, Walsh EP, Saul JP. Conversion of atrial flutter in pediatric patients by transesophageal atrial pacing: a safe, effective, minimally invasive procedure. Am Heart J. 1995;130:323–7. CrossRefMedlineGoogle Scholar
343. Brockmeier K, Ulmer HE, Hessling G. Termination of atrial reentrant tachycardias by using transesophageal atrial pacing. J Electrocardiol. 2002;35 Suppl:159–63. Google Scholar
344. Stephenson EA, Casavant D, Tuzi J, et al. Efficacy of atrial antitachycardia pacing using the Medtronic AT500 pacemaker in patients with congenital heart disease. Am J Cardiol. 2003;92:871–6. CrossRefMedlineGoogle Scholar
345. Rao SO, Boramanand NK, Burton DA, et al. Atrial tachycardias in young adults and adolescents with congenital heart disease: conversion using single dose oral sotalol. Int J Cardiol. 2009;136:253–7. CrossRefMedlineGoogle Scholar
346. Wells R, Khairy P, Harris L, et al. Dofetilide for atrial arrhythmias in congenital heart disease: a multicenter study. Pacing Clin Electrophysiol. 2009;32:1313–8. CrossRefMedlineGoogle Scholar
347. Warnes CA, Williams RG, Bashore TM, et al. ACC/AHA 2008 guidelines for the management of adults with congenital heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Develop Guidelines on the Management of Adults With Congenital Heart Disease). Developed in Collaboration With the American Society of Echocardiography, Heart Rhythm Society, International Society for Adult Congenital Heart Disease, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons. Circulation. 2008;118:e714–833. FREE Full Text
348. Khairy P, Van Hare GF, Balaji S, et al. PACES/HRS Expert Consensus Statement on the Recognition and Management of Arrhythmias in Adult Congenital Heart Disease: developed in partnership between the Pediatric and Congenital Electrophysiology Society (PACES) and the Heart Rhythm Society (HRS). Endorsed by the governing bodies of PACES, HRS, the American College of Cardiology (ACC), the American Heart Association (AHA), the European Heart Rhythm Association (EHRA), the Canadian Heart Rhythm Society (CHRS), and the International Society for Adult Congenital Heart Disease (ISACHD). Heart Rhythm. 2014;11:e102–65. CrossRefMedlineGoogle Scholar
349. Huang CJ, Chiu IS, Lin FY, et al. Role of electrophysiological studies and arrhythmia intervention in repairing Ebsteins anomaly. Thorac Cardiovasc Surg. 2000;48:347–50. CrossRefMedlineGoogle Scholar
350. Reich JD, Auld D, Hulse E, et al. The Pediatric Radiofrequency Ablation Registrys experience with Ebsteins anomaly. Pediatric Electrophysiology Society. J Cardiovasc Electrophysiol. 1998;9:1370–7. CrossRefMedlineGoogle Scholar
351. Cappato R, Schlüter M, Weiss C, et al. Radiofrequency current catheter ablation of accessory atrioventricular pathways in Ebsteins anomaly. Circulation. 1996;94:376–83. Abstract/FREE Full Text
352. Misaki T, Watanabe G, Iwa T, et al. Surgical treatment of patients with Wolff-Parkinson-White syndrome and associated Ebsteins anomaly. J Thorac Cardiovasc Surg. 1995;110:1702–7. CrossRefMedlineGoogle Scholar
353. Khositseth A, Danielson GK, Dearani JA, et al. Supraventricular tachyarrhythmias in Ebstein anomaly: management and outcome. J Thorac Cardiovasc Surg. 2004;128:826–33. CrossRefMedlineGoogle Scholar
354. Bockeria L, Golukhova E, Dadasheva M, et al. Advantages and disadvantages of one-stage and two-stage surgery for arrhythmias and Ebsteins anomaly. Eur J Cardiothorac Surg. 2005;28:536–40. Abstract/FREE Full Text
355. Pressley JC, Wharton JM, Tang AS, et al. Effect of Ebsteins anomaly on short- and long-term outcome of surgically treated patients with Wolff-Parkinson-White syndrome. Circulation. 1992;86:1147–55. Abstract/FREE Full Text
356. Khairy P, Harris L, Landzberg MJ, et al. Sudden death and defibrillators in transposition of the great arteries with intra-atrial baffles: a multicenter study. Circ Arrhythm Electrophysiol. 2008;1:250–7. Abstract/FREE Full Text
357. Lukac P, Pedersen AK, Mortensen PT, et al. Ablation of atrial tachycardia after surgery for congenital and acquired heart disease using an electroanatomic mapping system: which circuits to expect in which substrate? Heart Rhythm. 2005;2:64–72. CrossRefMedlineGoogle Scholar
358. Yap S-C, Harris L, Downar E, et al. Evolving electroanatomic substrate and intra-atrial reentrant tachycardia late after Fontan surgery. J Cardiovasc Electrophysiol. 2012;23:339–45. CrossRefMedlineGoogle Scholar
359. Wu J, Deisenhofer I, Ammar S, et al. Acute and long-term outcome after catheter ablation of supraventricular tachycardia in patients after the Mustard or Senning operation for D-transposition of the great arteries. Europace. 2013;15:886–91. Abstract/FREE Full Text
360. Jones DG, Jarman JWE, Lyne JC, et al. The safety and efficacy of trans-baffle puncture to enable catheter ablation of atrial tachycardias following the Mustard procedure: a single centre experience and literature review. Int J Cardiol. 2013;168:1115–20. CrossRefMedlineGoogle Scholar
361. Scaglione M, Caponi D, Ebrille E, et al. Very long-term results of electroanatomic-guided radiofrequency ablation of atrial arrhythmias in patients with surgically corrected atrial septal defect. Europace 2014 1800–7. Google Scholar
362. Giamberti A, Chessa M, Abella R, et al. Surgical treatment of arrhythmias in adults with congenital heart defects. Int J Cardiol. 2008;129:37–41. CrossRefMedlineGoogle Scholar
363. Stulak JM, Dearani JA, Puga FJ, et al. Right-sided Maze procedure for atrial tachyarrhythmias in congenital heart disease. Ann Thorac Surg. 2006;81:1780–4. CrossRefMedlineGoogle Scholar
364. Mavroudis C, Deal BJ, Backer CL, et al. Arrhythmia surgery in patients with and without congenital heart disease. Ann Thorac Surg. 2008;86:857–68. CrossRefMedlineGoogle Scholar
365. Karamlou T, Silber I, Lao R, et al. Outcomes after late reoperation in patients with repaired tetralogy of Fallot: the impact of arrhythmia and arrhythmia surgery. Ann Thorac Surg. 2006;81:1786–93. CrossRefMedlineGoogle Scholar
366. Deal BJ, Mavroudis C, Backer CL, et al. Comparison of anatomic isthmus blốc with the modified right atrial maze procedure for late atrial tachycardia in Fontan patients. Circulation. 2002;106:575–9. Abstract/FREE Full Text
367. Mavroudis C, Backer CL, Deal BJ, et al. Total cavopulmonary conversion and maze procedure for patients with failure of the Fontan operation. J Thorac Cardiovasc Surg. 2001;122:863–71. CrossRefMedlineGoogle Scholar
368. Mavroudis C, Deal BJ, Backer CL, et al. J. Maxwell Chamberlain Memorial Paper for congenital heart surgery. 111 Fontan conversions with arrhythmia surgery: surgical lessons and outcomes. Ann Thorac Surg. 2007;84:1457–65. CrossRefMedlineGoogle Scholar
369. Aboulhosn J, Williams R, Shivkumar K, et al. Arrhythmia recurrence in adult patients with single ventricle physiology following surgical Fontan conversion. Congenit Heart Dis. 2010;5:430–4. CrossRefMedlineGoogle Scholar
370. Said SM, Burkhart HM, Schaff HV, et al. Fontan conversion: identifying the high-risk patient. Ann Thorac Surg. 2014;97:2115–21. CrossRefMedlineGoogle Scholar
371. Gutierrez SD, Earing MG, Singh AK, et al. Atrial tachyarrhythmias and the Cox-maze procedure in congenital heart disease. Congenit Heart Dis. 2013;8:434–9. MedlineGoogle Scholar
372. Terada T, Sakurai H, Nonaka T, et al. Surgical outcome of Fontan conversion and arrhythmia surgery: Need a pacemaker? Asian Cardiovasc Thorac Ann. 2013;22:682–6. MedlineGoogle Scholar
373. Theodoro DA, Danielson GK, Porter CJ, et al. Right-sided maze procedure for right atrial arrhythmias in congenital heart disease. Ann Thorac Surg. 1998;65:149–53. CrossRefMedlineGoogle Scholar
374. Silka MJ, Manwill JR, Kron J, et al. Bradycardia-mediated tachyarrhythmias in congenital heart disease and responses to chronic pacing at physiologic rates. Am J Cardiol. 1990;65:488–93. CrossRefMedlineGoogle Scholar
375. Ragonese P, Drago F, Guccione P, et al. Permanent overdrive atrial pacing in the chronic management of recurrent postoperative atrial reentrant tachycardia in patients with complex congenital heart disease. Pacing Clin Electrophysiol. 1997;20:2917–23. CrossRefMedlineGoogle Scholar
376. Banchs JE, Baquero GA, Nickolaus MJ, et al. Clinical efficacy of dofetilide for the treatment of atrial tachyarrhythmias in adults with congenital heart disease. Congenit Heart Dis. 2014;9:221–7. CrossRefMedlineGoogle Scholar
377. Tanel RE, Walsh EP, Lulu JA, et al. Sotalol for refractory arrhythmias in pediatric and young adult patients: initial efficacy and long-term outcome. Am Heart J. 1995;130:791–7. CrossRefMedlineGoogle Scholar
378.Shotan A, Ostrzega E, Mehra A, et al. Incidence of arrhythmias in normal pregnancy and relation to palpitations, dizziness, and syncope. Am J Cardiol. 1997;79:1061–4. CrossRefMedlineGoogle Scholar
379.Tawam M, Levine J, Mendelson M, et al. Effect of pregnancy on paroxysmal supraventricular tachycardia. Am J Cardiol. 1993;72:838–40. CrossRefMedlineGoogle Scholar
380. Ghosh N, Luk A, Derzko C, et al. The acute treatment of maternal supraventricular tachycardias during pregnancy: a review of the literature. J Obstet Gynaecol Can. 2011;33:17–23. CrossRefMedlineGoogle Scholar
381. Allen NM, Page RL. Procainamide administration during pregnancy. Clin Pharm. 1993;12:58–60. MedlineGoogle Scholar
382. Qasqas SA, McPherson C, Frishman WH, et al. Cardiovascular pharmacotherapeutic considerations during pregnancy and lactation. Cardiol Rev. 2004;12:201–21. CrossRefMedlineGoogle Scholar
383. Bartalena L, Bogazzi F, Braverman LE, et al. Effects of amiodarone administration during pregnancy on neonatal thyroid function and subsequent neurodevelopment. J Endocrinol Invest. 2001;24:116–30. CrossRefMedlineGoogle Scholar
384. Jaeggi ET, Carvalho JS, De Groot E, et al. Comparison of transplacental treatment of fetal supraventricular tachyarrhythmias with digoxin, flecainide, and sotalol: results of a nonrandomized multicenter study. Circulation. 2011;124:1747–54. Abstract/FREE Full Text
385. Ersbøll AS, Hedegaard M, Søndergaard L, et al. Treatment with oral beta-blockers during pregnancy complicated by maternal heart disease increases the risk of fetal growth restriction. BJOG. 2014;121:618–26. CrossRefMedlineGoogle Scholar
386. Szumowski L, Szufladowicz E, Orczykowski M, et al. Ablation of severe drug-resistant tachyarrhythmia during pregnancy. J Cardiovasc Electrophysiol. 2010;21:877–82. MedlineGoogle Scholar
387. Damilakis J, Theocharopoulos N, Perisinakis K, et al. Conceptus radiation dose and risk from cardiac catheter ablation procedures. Circulation. 2001;104:893–7. Abstract/FREE Full Text
388. Chen SA, Lee SH, Wu TJ, et al. Initial onset of accessory pathway-mediated and atrioventricular node reentrant tachycardia after age 65: clinical features, electrophysiologic characteristics, and possible facilitating factors. J Am Geriatr Soc. 1995;43:1370–7. CrossRefMedlineGoogle Scholar
389. Chen SA, Chiang CE, Tai CT, et al. Complications of diagnostic electrophysiologic studies and radiofrequency catheter ablation in patients with tachyarrhythmias: an eight-year survey of 3,966 consecutive procedures in a tertiary referral center. Am J Cardiol. 1996;77:41–6. CrossRefMedlineGoogle Scholar
390. Zado ES, Callans DJ, Gottlieb CD, et al. Efficacy and safety of catheter ablation in octogenarians. J Am Coll Cardiol. 2000;35:458–62. CrossRefMedlineGoogle Scholar
391. Rostock T, Risius T, Ventura R, et al. Efficacy and safety of radiofrequency catheter ablation of atrioventricular nodal reentrant tachycardia in the elderly. J Cardiovasc Electrophysiol. 2005;16:608–10. CrossRefMedlineGoogle Scholar
392. Kihel J, Da Costa A, Kihel A, et al. Long-term efficacy and safety of radiofrequency ablation in elderly patients with atrioventricular nodal re-entrant tachycardia. Europace. 2006;8:416–20. Abstract/FREE Full Text
393. Dagres N, Piorkowski C, Kottkamp H, et al. Contemporary catheter ablation of arrhythmias in geriatric patients: patient characteristics, distribution of arrhythmias, and outcome. Europace. 2007;9:477–80. Abstract/FREE Full Text
394. Pedrinazzi C, Durin O, Agricola P, et al. Efficacy and safety of radiofrequency catheter ablation in the elderly. J Interv Card Electrophysiol. 2007;19:179–85. CrossRefMedlineGoogle Scholar
395. Hoffmann BA, Brachmann J, Andresen D, et al. Ablation of atrioventricular nodal reentrant tachycardia in the elderly: results from the German Ablation Registry. Heart Rhythm. 2011;8:981–7. CrossRefMedlineGoogle Scholar
396. Yangni NO, Brembilla-Perrot B. Clinical characteristics and management of paroxysmal junctional tachycardia in the elderly. Arch Cardiovasc Dis. 2008;101:143–8. CrossRefMedlineGoogle Scholar
397. Dewland TA, Glidden DV, Marcus GM. Healthcare utilization and clinical outcomes after catheter ablation of atrial flutter. PLoS One. 2014;9:e100509. CrossRefMedlineGoogle Scholar