ĐẠI CƯƠNG
Suy tim là một hội chứng lâm sàng với tỉ lệ hiện mắc ngày càng gia tăng và có bệnh suất và tử suất cao [1], [2]. Khoảng một nửa bệnh nhân suy tim có phân suất tống máu thất trái (PSTMTT) giảm [1].
ThS. BS TRẦN CÔNG DUY
Bộ môn Nội, Đại học Y Dược TP. Hồ Chí Minh
Tần số tim là một thông số có giá trị tiên lượng ở các bệnh nhân suy tim PSTMTT giảm với nhịp xoang. Tần số tim nền và việc giảm trị số này có khả năngtiên lượng ở bệnh nhân suy tim, và mối liên quan trực tiếp giữa giảm tần số tim và cải thiện bệnh suất và tử suất đã được ghi nhận [3], [4]. Vì lý do đó, các hướng dẫn thực hành lâm sàng của Hội Tim Châu Âu khuyến cáo mục tiêu tần số tim < 70 lần/phút và các thuốc giảm tần số tim trong lưu đồ điều trị. Ivabradine là một thuốc ức chế đặc hiệu kênh If ở nút xoang nhĩ [5] và được sử dụng để điều trị bệnh nhân suy tim có nhịp xoang và tần số tim trên giá trị mục tiêu đã nhận liều tối ưu hoặc liều tối đa dung nạp được của ức chế beta [6]. Ivabradine có lợi ích tiên lượng và cải thiện các thông số chức năng và an toàn thậm chí ở bệnh nhân suy tim tâm thu mạn nặng [7],[8]. Một số nghiên cứu đã báo cáo mối liên quan giữa giảm tần số tim và sử dụng ức chế beta nhưng không phát hiện mối liên quan với liều của thuốc này [9],[11]. Tỉ lệ bệnh nhân đạt tần số tim mục tiêu với điều trị ức chế beta còn thấp [12]. Ivabradine gần đây được xem không chỉ có lợi ích tiên lượng đối với kiểm soát tần số tim mà còn có ý nghĩa tiên lượng đối với thời gian cần để đạt kiểm soát này [4]. Do đó, việc sử dụng và tăng liều thuốc sớm trong giai đoạn dễ tổn thương sau nhập viện quan trọng đối với giảm tử vong và tái nhập viện sớm. Chỉ định hiện tại của Ivabradine dựa vào thiết kế nghiên cứu SHIFT như ≥4 tuần sau nhập viện. Nghiên cứu ETHIC-AHF phân tích tác dụng của phối hợp sớm Ivabradine và ức chế beta so với đơn trị ức chế beta ở những bệnh nhân suy tim cấp có rối loạn chức năng tâm thu và nhịp xoang tại thời điểm nhập viện.Bài báo này sẽ trình bày tóm tắt nghiên cứu này để xem xét một chiến lược điều trị mới ở bệnh nhân suy tim nhập viện có phân suất tống máu giảm.
PHƯƠNG PHÁP NGHIÊN CỨU
ETHIC-AHF là một nghiên cứu tiến cứu, so sánh, ngẫu nhiên, không làm mù được thiết kế với chiến lược phân nhóm ngẫu nhiên đơn giản. Thử nghiệm so sánh chiến lược điều trị hiện hành được khuyến cáo bởi hướng dẫn thực hành lâm sàng của Hội Tim Châu Âu [6] bao gồm tăng liều ức chế beta và điều trị Ivabradine ở bệnh nhân nhịp xoang, tần số tim trên 70 lần/phút sau khi đạt liều tối ưu hoặc liều tối đa dung nạp được của ức chế beta (nhóm chứng) và chiến lược khởi đầu điều trị kép (ivabradine và ức chế beta) với tăng liều đồng thời cả hai nhóm (nhóm can thiệp).
Bệnh nhân biểu hiện suy tim cấp lúc nhập viện, thỏa tiêu chuẩn nhận vào và đồng ý tham gia nghiên cứu được phân nhóm ngẫu nhiên vào24-48 giờ sau nhập viện khi ổn định lâm sàng. Chẩn đoán suy tim cấp được thực hiện theo tiêu chuẩn của ESC (triệu chứng và/hoặc dấu hiệu của suy tim và phân suất tống máu thất trái giảm) [6].
►Tiêu chuẩn nhận vào:
♦ Nhập viện vì suy tim cấp lần đầu hoặc suy tim mạn mất bù.
♦ Phân suất tống máu thất trái dưới 40% (định lượng bằng kỹ thuật Simpson) do nguyên nhân không hồi phục.
♦ Tuổi trên 18
♦ Ổn định lâm sàng vào 24-48 giờ sau nhập viện
♦ Nhịp xoang, tần số tim lúc nhập viện trên 70 lần/phút
♦ Không tiền sử điều trị với ivabradine
♦ Không có bệnh đồng mắc nặng gây ra giảm tuổi thọ (thời gian sống dưới 6 tháng)
♦ Không phải là người mang hoặc ứng cử viên cho đặt máy tạo nhịp/tái đồng bộ lúc nhập viện
♦ Không phải là ứng cử viên cho ghép tim, phẫu thuật tim hoặc các thủ thuật tim mạch xâm lấn khác
♦ Có thể theo dõi ít nhất 1 năm
♦ Kí bản đồng thuận tham gia nghiên cứu
►Tiêu chuẩn loại trừ:
♦ Tiền sử cá nhân rung nhĩ (vĩnh viễn, dai dẳng hoặc kịch phát) vào năm trước khi nhận vào,bao gồm các bệnh nhân rung nhĩ trong năm nay.
♦ Rối loạn chức năng thất trái do biến cố cấp (nhồi máu cơ tim cấp, viêm cơ tim, …)
Khi bệnh nhân được phân nhóm ngẫu nhiên, cả hai nhóm bắt đầu điều trị với ức chế beta liều thấp và thêm Ivabradine 5 mg/12 giờ ở nhóm can thiệp. Cả hai thuốc được tăng liều trong lúc nhập viện. Các thuốc ức chế beta có thể sử dụng là carvedilol, bisoprolol hoặc nebivolol mặc dù không có bệnh nhân dùng nebivolol. Quyết định sử dụng thuốc được thực hiện bởi bác sĩ lâm sàng. Bệnh nhân với tiền sử dùngức chế beta không ngưng thuốc đó sau nhập viện, giảm liều nếu cần thiết dựa vàotình trạng lâm sàng và huyết động của bệnh nhân. Ở bệnh nhân không sử dụng ức chế beta trước nhập viện, có thể bắt đầu liều thấp (carvedilol: 3,125 mg/12 giờ hoặc 6,25 mg/12 giờ, bisoprolol: 1,25 đến 2,5 mg/ngày) khi bệnh nhân ổn định, thường 24-48 giờ sau nhập viện ở cả hai nhóm. Trong thời gian nhập viện, ức chế beta tăng liều mỗi 48 giờ ở cả hai nhóm nếu dung nạp được với liều tăng 3,125 mg/ngày carvedilol và 1,25 mg/ngày bisoprolol. Ở nhóm can thiệp, ivabradine được thêm vào ức chế beta với liều khởi đầu 5 mg/12 giờ vào 24-48 giờ sau nhập viện, và tăng 2,5 mg/ngày mỗi 48 giờ đến khi đạt liều 7,5 mg/12 giờ. Tần số tim mục tiêu ít nhất < 70 lần/phút và không thấp hơn 60 lần/phút. Nếu tần số tim dưới 60 lần/phút, ivabradine và/hoặc ức chế beta có thể giảm xuống liều trước đó. Sau xuất viện, ức chế beta có thể được tăng liều tiếp tục vào lần khám 14 và 28 ngày ở cả hai nhóm với cùng tần số tim mục tiêu. Ivabradine có thể được tăng đến liều tối đa 7,5 mg/12 giờ vào 14 ngày ở nhóm can thiệp. Ở nhóm chứng, ivabradine có thể được thêm vào ức chế beta vào 28 ngày nếu tần số tim > 60 lần/phút và bệnh nhân đã uống liếu tối đa (10 mg/ngày bisoprolol và 25 mg/12 giờ carvedilol) hoặc liều tối đa dung nạp được của ức chế beta. Nếu tần số tim < 60 lần/phút hoặc triệu chứng do nhịp chậm, ivabradine được giảm liều.
Tần số tim vào 28 ngày sau nhập viện là kết cục chính. Kết cục phụ bao gồm sự tiến triển của tần số tim vào 4 tháng, tính an toàn của thuốc (tác dụng phụ và ngưng thuốc do tác dụng phụ) , và tổ hợp kết cục các biến cố lâm sàng (tử vong do mọi nguyên nhân + nhập viện do suy tim hoặc nguyên nhân tim mạch trong quá trình theo dõi). Ngoài ra, một số kết cục đại diện bao gồm thay đổi phân suất tống máu thất trái, peptide bài natri niệu (BNP) và phân độ chức năng NYHA trong quá trình theo dõi.
Bệnh nhân được đánh giá theo dõi vào 15 ngày, 28 ngày và 4 tháng sau xuất viện để tiếp tục tăng liều ivabradine và ức chế beta như đã mô tả và thu thập các biến cố an toàn và lâm sàng. Bệnh nhân được siêu âm tim bởi hai người siêu âm tim có kinh nghiệm không biết nhóm ngẫu nhiên của bệnh nhân. Phương pháp Simpson được dử dụng để phân tích chức năng tâm thu.
Carvedilol, bisoprolol và nebivolol là các thuốc ức chế beta có thể được sử dụng trong nghiên cứu này mặc dù chỉ carvedilol và bisoprolol được kê đơn (chủ yếu là bisoprolol chiếm 69%, không khác biệt ở hai nhóm). Bisoprolol được thực hiện ở 49 bệnh nhân (23 ở nhóm can thiệp và 26 ở nhóm chứng), và carvedilol ở 22 bệnh nhân (10 ở nhóm can thiệp và 12 ở nhóm chứng). Thuốc ức chế men chuyển được sử dụng trong nghiên cứu bao gồm ramipril và enalapril. Thuốc ức chế thụ thể angiotensin II được sử dụng bao gồm candesartan, losartan và valsartan. Spironolactone và eplerenone có thể được sử dụng như kháng thụ thể mineralocorticoid. Các liều thấp, trung bình và cao của mỗi thuốc được liệt kê ở Bảng 1.
Để tính cở mẫu, nhóm nghiên cứu sử dụng chương trình Epidat 3.1 với mức độ tin cậy 80%, sai số 5% và mục tiêu giảm tần số tim của nhóm chứng 15%. Cở mẫu được tính là 72 bệnh nhân. Nhóm nghiên cứu phân tích thống kê bằng phần mềm SPSS phiên bản 21.0 và sự khác biệt có ý nghĩa thống kê nếu p < 0,05.
Bảng 1. Liều thấp, trung bình và cao của các thuốc
|
|
Thấp |
Trung bình |
Cao |
|
Ramipril (mg) |
1,25-2,5 |
5 |
7,5-10 |
|
Enalapril (mg) |
2,5-7,5 |
10-15 |
20-40 |
|
Candesartan (mg) |
4-8 |
16 |
32 |
|
Losartan (mg) |
12,5-25 |
50-75 |
100-150 |
|
Carvedilol (mg) |
3,125-6,25 |
12,5 |
25-50 |
|
Bisoprolol (mg) |
1,25-2,5 |
3,75-5 |
7,5-10 |
KẾT QUẢ
Từ 156 bệnh nhân nhập viện trong khoảng thời gian nghiên cứu 18 tháng (từ tháng 11/2013 đến tháng 4/2015) có suy tim cấp và phân suất tống máu thất trái < 40%, không có chống chỉ định ức chế beta và không phải là ứng cử viên của bất kỳ biện pháp điều trị không dùng thuốc, tổng số 72 bệnh nhân được đánh giá. Một bệnh nhân rút lại bản đồng thuận trong thời gian nằm viện và bị loại ra khỏi nghiên cứu. Do đó, nghiên cứu có 71 bệnh nhân, 38 ở nhóm chứng và 33 ở nhóm can thiệp, và hoàn thành theo dõi ở tất cả 71 bệnh nhân này. Cả hai nhóm đồng nhất về đặc điểm ban đầu ngoại trừ trị số creatinine hơi cao hơn ở nhóm can thiệp. Đặc điểm ban đầu của các bệnh nhân được trình bày ở Bảng 2. Nguyên nhân thường gặp nhất của suy tim ở hai nhóm là bệnh tim thiếu máu cục bộ (37,5% so với 45,7%), tiếp theolàbệnh cơ tim dãn nở vô căn và các nguyên nhân khác. Ở nhóm chứng, 8 bệnh nhân (21%) có các nguyên nhân khác, tất cả do độc tính trên tim (3 do hóa trị và 5 do rượu). Ở nhóm can thiệp, 8 bệnh nhân có nguyên nhân khác cũng do độc tính trên tim ( 2 do hóa trị và 6 do rượu). Tỉ lệ hiện mắc đái tháo đường là 56,3% và 62,1% ở nhóm can thiệp và nhóm chứng. Tỉ lệ tương đối thấp của bệnh tim thiếu máu cục bộ có thể do tiêu chuẩn nhận vào và loại trừ, vì các bệnh nhân suy tim mất bù do hội chứng mạch vành cấp bị lọai ra. Về điều trị thuốc của hai nhóm lúc xuất viện (Bảng 3), không có sự khác biệt giữa hai nhóm về sử dụng lợi tiểu, ức chế men chuyển/ức chế thụ thể angiotensinII, kháng thụ thể mineralocorticoid. Ngoài ra, nghiên cứu cho thấy không có sự khác biệt giữa hai nhóm về sử dụng ức chế beta hoặc liều của ức chế beta lúc xuất viện. Phân suất tống máu và BNP lúc nhập viện và xuất viện không có sự khác biệt giữa hai nhóm. Tần số tim lúc nhập viện là 87,3 ± 10,6 lần/phút ở nhóm can thiệp và 88,4 ± 11,2 lần/phút ở nhóm chứng. Tần số tim lúc xuất viện hơi thấp hơn ở nhóm can thiệp mà không có ý nghĩa thống kê (70,1 ± 10,6 so với 73,9 ± 9,3 lần/phút). Thời gian nằm viện của hai nhóm không khác nhau có ý nghĩa thống kê.
Khi phân tích kết cục chính, tần số tim vào 28 ngày sau xuất viện hơi thấp hơn ở nhóm can thiệp (64,3 ± 7,5 so với 70,3 ± 9,3 lần/phút, p = 0,01). Vào 4 tháng, tần số tim trung bình khác nhau có ý nghĩa giữa hai nhóm (60,6 ± 7,5 so với 67,8 ± 8 lần/phút, p = 0,004). Ở nhóm can thiệp, liều ivabradine lúc xuất viện là 5 mg/12 giờ ở 20 bệnh nhân (61%) và 7,5 mg/12 giờ ở 13 bệnh nhân (39%) và liều trung bình là 11,9 ± 1,6 mg/ngày. Tỉ lệ bệnh nhân đạt tần số tim mục tiêu (< 70 lần/phút) cao hơn có ý nghĩa ở nhóm can thiệp lúc xuất viện và 28 ngày sau xuất viện (Hình 1). Vào 4 tháng, sự khác nhau không có ý nghĩa thống kê chủ yếu do thêm ivabradine vào chế độ điều trị của 8 bệnh nhân ở nhóm chứng vào lần khám 28 ngày (Bảng 5) vì không khác biệt có ý nghĩa giữa hai nhóm về tỉ lệ bệnh nhân có liều trung bình/liều cao ức chế beta vào 4 tháng.
Phân suất tống máu vào 4 tháng khác nhau có ý nghĩa giữa hai nhóm (44,8 ± 14,4% ở nhóm can thiệp so với 38,1 ± 6,1% ở nhóm chứng, p = 0,039) cũng như trị số BNP vào 4 tháng (259 ± 78 so với 554 ± 192 pg/mL, p = 0,02). Phân độ chức năngNYHAcó xu hướng tốt hơn ở các bệnh nhân của nhóm can thiệp vì chỉ 13% so với 27% ở nhóm can thiệp có NYHA III hoặc IV vào 4 tháng (p = 0,08). 4 trường hợp tử vong được ghi nhận trong 4 tháng theo dõi bao gồm 2 ở nhóm chứng (1 do biến chứng sau phẫu thuật phình động mạch chủ bụng và 1 do sốc nhiễm trùng từ đường niệu), và 2 ở nhóm can thiệp (1 do u đường tiêu hóa di căn chưa được phát hiện trước lúc nhận vào nghiên cứu và 1 do đột tử tại nhà). Hai nhóm không khác biệt về tử vong do mọi nguyên nhân (7,6% ở nhóm can thiệp so với 6,7% ở nhóm chứng), tái nhập viện do suy tim (9,1 so với 7,9%), tổ hợp kết cục của tử vong hoặc tái nhập viện do suy tim. Ngoài ra, không có bất kỳ tác dụng phụ nặng liên quan với thuốc sử dụng. Liều ivabradine giảm từ 7,5 mg/12 giờ xuống 5 mg/12 giờ ở 2 bệnh nhân vào 14 ngày và 5 bệnh nhân khác vào 4 tháng ở nhóm can thiệp do tần số tim dưới 60 lần/phút. Không có bệnh nhân nào cần ngưng ivabradine. 7 bệnh nhân ở nhóm can thiệp (22,5%) và 6 ở nhóm chứng (15,8%) có nhịp chậm với tần số tim < 60 lần/phút trong khoảng thời gian 4 tháng nhưng không triệu chứng ở tất cả trường hợp.
Trong thời gian theo dõi, 3 bệnh nhân được đặt máy khử rung chuyển nhịp cấy được (ICD) – tái đồng bộ thất (CRT) bao gồm 1 bệnh nhân ở nhóm chứng do phòng ngừa thứ phát và 2 ở nhóm can thiệp (1 bệnh nhân phòng ngừa nguyên phát) và 1 bệnh nhân ở nhóm chứng được đặt máy tạo nhịp – CRT.
Bảng 2. Đặc điểm ban đầu của bệnh nhân
|
|
Nhóm can thiệp |
Nhóm chứng |
Trị số p |
|
Tuổi (năm) |
66,2 ± 15,4 |
67,7 ± 12,3 |
NS |
|
Nữ (%) |
28,1 |
31,4 |
NS |
|
Tăng huyết áp (%) |
75 |
71,4 |
NS |
|
Đái tháo đường (%) |
56,3 |
62,1 |
NS |
|
Rối loạn lipid máu (%) |
43,8 |
40 |
NS |
|
Hút thuốc lá (%) |
43,3 |
54,2 |
NS |
|
Tiền sử nhồi máu cơ tim (%) |
34,4 |
37,1 |
NS |
|
Bệnh phổi tắc nghẽn mạn tính (%) |
12,5 |
25,7 |
NS |
|
Thiếu máu (%) |
43,8 |
45,2 |
NS |
|
Tiền sử đột quỵ (%) |
16,1 |
5,7 |
NS |
|
Độ lọc cầu thận (ml/ph) (%) |
67,9 ± 26,8 |
61,3± 26,6 |
NS |
|
Huyết áp tâm thu (mmHg) (%) |
135,5 ± 31,9 |
137,3 ± 22 |
NS |
|
Creatinine (mg/dL) (%) |
1,17 ± 0,41 |
1,36 ± 0,72 |
0,04 |
|
Loại suy tim (%) |
Lần đầu: 56,3 Đợt mất bù: 43,7 |
Lần đầu: 68,6 Đợt mất bù: 31,4 |
NS |
|
Nguyên nhân (%) |
Thiếu máu cơ tim: 37,5 Tăng huyết áp: 9,4 Vô căn: 28,1 Khác: 25 |
Thiếu máu cơ tim: 45,7 Tăng huyết áp: 5,7 Vô căn: 25,7 Khác: 22,9 |
NS |
|
Phân độ chức năng III/IV lúc nhập viện (%) |
92,7 |
97,1 |
NS |
|
Tiền sử nhập viện vì suy tim (%) |
35,5 |
25 |
NS |
|
Tiền sử tái thông mạch vành (%) |
25 |
28,6 |
NS |
|
Tiền sử CRT/ICD (%) |
0 |
0 |
NS |
|
Thời gian QRS trong block nhánh trái (ms) |
138 ± 27 |
135 ± 18
|
NS |
NS: khác biệt không có ý nghĩa
Bảng 3. Điều trị ở hai nhóm lúc xuất viện
|
|
Nhóm can thiệp |
Nhóm chứng |
Trị số p |
|
Lợi tiểu (%) |
97 |
100 |
NS |
|
Ức chế men chuyển/ức chế thụ thể angiotensin II(%) |
94 |
97 |
NS |
|
Liều cao Liều trung bình Liều thấp |
13,3 40 46,7 |
20,6 26,4 53 |
NS |
|
Kháng thụ thể mineralocorticoid(%) |
81,3 |
68,6 |
NS |
|
Digoxin(%) |
3 |
5,7 |
NS |
|
Kháng đông(%) |
6,3 |
11,4 |
NS |
|
Kháng tiểu cầu(%) |
62,5 |
57,1 |
NS |
|
Ức chế beta(%) |
87,5 |
97 |
NS |
|
Liều cao Liều trung bình Liều thấp |
7,1 28,6 64,3 |
5,9 38,2 55,9 |
NS |
Bảng 4. Phân suất tống máu, nồng độ BNP, tần số tim và số ngày nằm viện
|
|
Nhóm can thiệp |
Nhóm chứng |
Trị số p |
|
Phân suất tống máu thất trái (%) |
|||
|
Lúc nhập viện |
29,8 ± 7,5 |
29,9 ± 6,1 |
NS |
|
Lúc xuất viện |
32,9 ± 8,7 |
31,9 ± 6,1 |
NS |
|
Nồng độ BNP (pg/mL) |
|||
|
Lúc nhập viện |
1469 ± 1074 |
1061 ± 890 |
NS |
|
Lúc xuất viện |
463 ± 495 |
671 ± 399 |
NS |
|
Tần số tim |
|||
|
Lúc nhập viện |
87,3 ± 10,6 |
88,4 ± 11,2 |
NS |
|
Lúc xuất viện |
70,1 ± 3,6 |
73,9 ± 9,3 |
NS |
|
Số ngày nằm viện |
5,3 ± 3,6 |
6,3 ± 3,1 |
NS |
Bảng 5. Liều của ivabradine vào 28 ngày và 4 tháng sau xuất viện
|
|
28 ngày |
4 tháng |
|
Nhóm can thiệp (33 bệnh nhân) |
N = 33 |
N = 31 |
|
5 mg/12 giờ |
7 (21%) |
8 (26%) |
|
7,5 mg/12 giờ |
26 (79%) |
23 (74%) |
|
Nhón chứng (38 bệnh nhân) |
N = 8 |
N = 11 |
|
5 mg/12 giờ |
7 (87%) |
9 (82%) |
|
7,5 mg/12 giờ |
1 (13%) |
2 (18%) |
Bảng 6. Loại và liều của ức chế beta ở hai nhóm
|
|
Nhóm can thiệp |
Nhóm chứng |
Trị số p |
|
Bisoprolol |
|
|
|
|
Lúc nhập viện |
3,8 ± 0,3 |
3,9 ± 0,3 |
NS |
|
14 ngày |
5,2 ± 0,4 |
5,5 ± 0,6 |
NS |
|
28 ngày |
6,1 ± 0,9 |
7,2 ± 0,6 |
< 0,05 |
|
4 tháng |
6,7 ± 0,9 |
7,6 ± 0,7 |
< 0,05 |
|
Carvedilol (mg/ngày) |
|
|
|
|
Lúc xuất viện |
8,4 ± 1,2 |
9,1 ± 1,3 |
NS |
|
14 ngày |
12,1 ± 1,9 |
13,6 ± 2,1 |
NS |
|
28 ngày |
16,1 ± 3,3 |
22,3 ± 3,9 |
< 0,05 |
|
4 tháng |
20,3 ± 4,6 |
27,8 ± 4,8 |
< 0,05 |
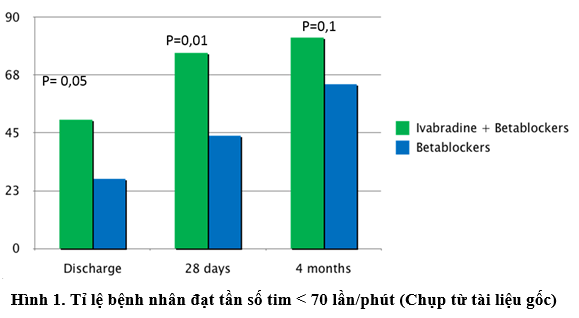
BÀN LUẬN
Sử dụng và tăng liều thuốc sớm trong giai đoạn tổn thương sau nhập viện có thể quan trọng để giảm tử vong và tái nhập viện sớm. Nghiên cứu ETHIC-AHFchứng minh tính an toàn của phối hợp sớm ivabradine và ức chế beta ở những bệnh nhân nhập viện với suy tim cấp (lần đầu hoặc suy tim mạn mất bù), và tỉ lệ bệnh nhân đạt tần số tim mục tiêu cao hơn điều trị chuẩn đơn trị ức chế beta trong thời gian nằm viện.
Lợi ích của ức chế thần kinh thể dịch để cải thiện tiên lượng của các bệnh nhân suy tim phân suất tống máu giảm đã được biết từ lâu. Tuy nhiên, tần số tim thấp hơn đang trở thành một mục tiêu quan trọng cải thiện tiên lượng bệnh nhân về tử vong và bệnh tật [3-4],[9-11], [13-14]. Hơn nữa, mặc dù hướng dẫn thực hành lâm sàng châu Âu đã đề cập thuốc giảm tần số tim như ivabradine nhưng với mức khuyến cáo thấp (IIa), cho thấy chỉ sử dụng dành cho bệnh nhân đã đạt liều tối đa dung nạpđượccủa ức chế beta hoặcliều tối ưu của thuốc nàymàkhông đạt tần số tim dưới 70 lần/phút hoặc đối với bệnh nhân không dung nạp ức chế beta [5]. Một số nghiên cứu đã chứng minh tình trạng cải thiện tiên lượng với sử dụng ức chế beta có liên quan trực tiếp với giảm tần số tim [9-11]; tuy nhiên, tỉ lệ bệnh nhân đạt liều tối ưu dung nạp được của ức chế beta thì thấp [12], do đó, tỉ lệ bệnh nhân đạt tần số tim mục tiêu cũng thấp.
Trong nghiên cứu này, hai nhóm không khác biệt ý nghĩa về liều trung bình/cao của ức chế beta, nhưng liều trung bình của các thuốc này vào 28 ngày và 4 tháng sau xuất viện cao hơn ở nhóm chứng (Bảng 6). Mặc dù vậy, tần số tim vào 28 ngày và 4 tháng thấp hơn ở nhóm can thiệp và tỉ lệ bệnh nhân đạt tần số tim dưới 70 lần/phút cũng thấp hơn có thể liên quan với tác dụng của ivabradine (Hình 1).
Ngoài ra, một số nghiên cứu cho thấy lợi ích tiên lượng của đạt tần số tim mục tiêu [4]. Vì thế, bệnh nhân có thể chưa được điều trị đúng mức khi bác sĩ làm chậm đạt tần số tim mục tiêu dokhông sử dụng liều ức chế beta cao hơn. Phân suất tống máu thất trái cải thiện so với ban đầu ở cả hai nhóm, điều này phù hợp với dữ liệu của nghiên cứu SHIFT cũng như giảm có ý nghĩa trị số BNP và xu hướng phân độ chức năngNYHA thấp hơn.
Về tính an toàn của chiến lược điều trị, tỉ lệ biến cố lâm sàng nặng (tử vong do mọi nguyên nhân và nhập viện do nguyên nhân suy tim) không khác nhau giữa hai nhóm mặc dù dữ liệu này có thể bị ảnh hưởng của cở mẫu nhỏ. Mặc dù không khác biệt về bệnh tật và tử vong nhưng có cải thiện các dấu ấn đại diện như phân suất tống máu thất trái và nồng độ BNP ở nhánh can thiệp. Tác dụng phụ nặng do thuốc không hiện diện ở bất kỳ thuốc nào. Chỉ 7 bệnh nhân ở nhóm can thiệp (22,5%) và 6 ở nhóm chứng (15,8%) có nhịp chậm < 60 lần/phút trong khoảng thời gian 4 tháng nhưng không có triệu chứng.
Hiện tại, chưa có báo cáo nào xuất bản chứng minh tính an toàn và lợi ích của sử dụng ivabradine ở loại tình huống lâm sàng này. Do đó, nghiên cứu này đã góp phần ủng hộ tính an toàn của ivabradine trong giai đoạn sớm hoặc cấp tính của suy tim mất bù. Đây là nghiên cứu đơn trung tâm với số lượng bệnh nhân hạn chế; tuy nhiên cở mẫu đủ để nghiên cứu kết cục chính (giảm tần số tim vào 28 ngày sau khởi trị). Mặc dù, không khác biệt về bệnh tật và tử vong giữa hai nhóm nhưng cải thiện các dấu ấn đại diện như phân suất tống máu thất trái và nồng độ BNP ở nhánh can thiệp.
KẾT LUẬN
Tóm lại, qua nghiên cứu ETHIC-AHF, chiến lược phối hợp sớm ivabradine và ức chế beta khả thi và an toàn trong đợt mất bù của suy tim phân suất tống máu giảm. Phối hợp này làm giảm đáng kể tần số tim vào ngày thứ 28 và tháng thứ 4 sau xuất viện. Hơn nữa, vào tháng thứ 4, chiến lược này cải thiện các thông số chức năng và sinh hóa liên quan với tiên lượng như phân suất tống máu thất trái, nồng độ BNP và mức độ nặng của triệu chứng. Trong tương lai, nghiên cứu với quy mô lớn hơn bao gồm số lượng bệnh nhân nhiều hơn và thời gian theo dõi dài hơn cần được tiến hành để khẳng định chiến lược điều trị này có cải thiện tiên lượng về các biến cố dài hạn.
TÀI LIỆU THAM KHẢO
1. Anguita M, Crespo MG, De Teresa E, Jiménez M, Alonso-Pulpón L, Muñiz J. Prevalence of Heart Failure in the Spanish General Population Aged Over 45 Years. The PRICE Study. Rev Esp Cardiol. 2008;61:1041- 9.
2. Macintyre K, Capewell S, Stewart S, et al. Evidence of improving prognosis in heart failure. Trends in case fatality in 66547 patients hospitalised between 1986 and 1995. Circulation;102:1126-31.
3. Bohm M, Swedberg K, Komajda M, et al. Heart rate as a risk factor in chronic heart failure (SHIFT): the association between heart rate and outcomes in a randomised placebo-controlled trial. Lancet. 2010;376:886-94.
4. Bohm M, Borer J, Ford I, et al. Heart rate at baseline influences the effect of ivabradine on cardiovascular outcomes in chronic heart failure: analysis from the SHIFT study. Clin Res Cardiol. 2013;102:11-22.
5. Savelieva I, Camm AJ. If inhibition with ivabradine: electrophysiological effects and safety. Drug Saf. 2008;31:95-107.
6. McMurray J, Adamopoulos S, Anker SD, et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012. Eur Heart J. 2012;33:1787-1847.
7. Tardif JC, OMeara E, Komajda M, et al. Effects of selective heart rate reduction with ivabradine on left ventricular remodelling and function: results from the SHIFT echocardiography substudy. Eur Heart J. 2011;32:2507-15.
8. Borer JS, Bohm M, Ford I, et al. Efficacy and safety of ivabradine in patients with severe chronic systolic heart failure (from the SHIFT study). AM J Cardiol. 2014;113:497-503.
9. McAlister FA, Wiebe N, Ezekowitz JA, Leung AA and Armstrong PW. Meta-analysis: B-Blocker dose, heart rate reduction, and death in patients with heart failure. Ann Intern Med. 2009;150:784-94.
10. Swedberg K, Komajda M, Bohm M, et al. Effects on outcomes of heart rate reduction by ivabradine in patients with congestive heart failure: is there an influence of beta-blocker dose?. J Am Coll Cardiol. 2012;59:1938-45.
11. Cullington D, Goode KM, Clark AL and Cleland JG. Heart rate achieved or beta-blocker dose in patients with chronic heart failure: which is the better target?. Eur J Heart Fail. 2012;14:737-47.
12. Maggioni AP, Dahlstrom U, Filippatos G, et al. EURObservational Research Programme: The heart failure pilot survey (ESC-HF Pilot). Eur J Heart Fail. 2010; 12:1076-84.
13. Swedberg K, Komajda M, Bohm M, et al. Ivabradine and outcomes in chronic heart failure (SHIFT): a randomised placebo-controlled study. Lancet. 2010;376:875-85.
14. González JR, Anguita M, Raposeiras S, Castillo JC. Estudio SHIFT: papel de la Ivabradina en la insuficiencia cardiaca y su importancia en la práctica clínica. Rev Esp Cardiol Supl. 2012;12:8-13.







