BS. NGUYỄN THANH HIỀN
BS. TRẦN NGUYỄN THU THỦY*
BS. NGUYỄN XUÂN VINH**
*Khoa TMCT Bv Nhân dân 115
**Khoa TMCT Bv ĐHYD Tp Hồ chí Minh
- MỞ ĐẦU
Hiện tại, tái thông mạch vành (TTMV) đại diện cho điều trị can thiệp được thực hiện thường xuyên nhất trên thế giới. Các kỹ thuật TTMV mang lại kết quả lâm sàng tuyệt vời trong quá trình theo dõi lâu dài. Mặc dù vậy, khoảng 20% bệnh nhân (BN) TTMV cần được thực hiện lại thủ thuật tái thông mạch vành trong 5 năm đầu theo dõi, với nguy cơ cao hơn đối với nhóm can thiệp mạch vành qua da (PCI) so với phẫu thuật bắc cầu động mạch vành (CABG) [1,2].
Việc TTMV nhiều lần có tác động đáng kể đến chất lượng cuộc sống và các nguồn lực chăm sóc sức khỏe, đồng thời khiến BN gặp các rủi ro có liên quan đến tái nhập viện và các tai biến có thể có của thủ thuật xâm lấn. Hơn nữa, đặc điểm của những BN cần tái thông mạch máu là có nguy cơ tim mạch cao, do các bệnh đồng mắc và các đặc điểm về giải phẫu học khiến việc điều trị lâm sàng của họ là một thách thức đối với chúng ta [3,4].
Chính vì vậy, chúng tôi viết bài này nhằm tiếp cận việc điều trị sau TTMV thất bại từ quan điểm định hướng cho BN, dựa trên các cơ chế cơ bản dẫn đến nhu cầu tái thông lại mạch máu trên lâm sàng gồm 3 loại chính: thất bại PCI, thất bại CABG và tiến triển của bệnh động mạch vành (CAD) ở các phân đoạn động mạch vành chưa được tái tưới máu trước đó.
- CAN THIỆP MẠCH VÀNH THẤT BẠI
Chiếm phần lớn trong thủ thuật can thiệp mạch vành là đặt stent mạch vành. Huyết khối (HK) trong stent và tái hẹp trong stent là nguyên nhân chính làm can thiệp mạch vành thất bại và cần thiết phải lặp lại TTMV.
2.1. Huyết khối trong stent
- HK trong stent sớm
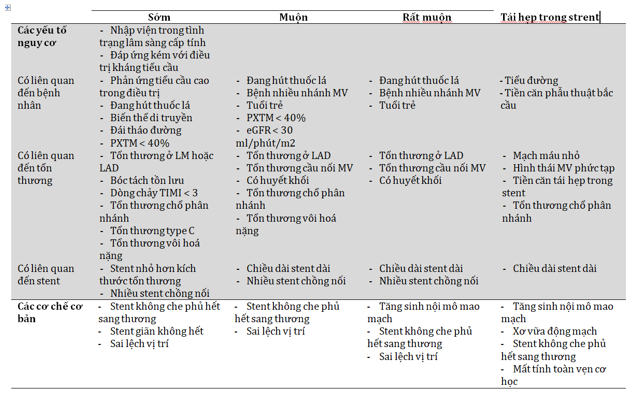
Là tình trạng HK trong stent xảy ra trong vòng 30 ngày đầu tiên sau khi đặt stent và được phân loại thành HK trong stent cấp tính (0 – 24 giờ) và bán cấp (> 24 giờ – 30 ngày). HK trong stent sớm hiện nay hiếm gặp, hầu hết có liên quan đến các yếu tố cơ học hoặc các yếu tố về mặt giải phẫu, trong bối cảnh thành lập HK hoặc được kích hoạt bởi một biến cố cấp tính (bảng 1-2) [5-7].
- HK trong stent muộn và rất muộn
HK muộn là tình trạng HK trong stent xảy ra từ 30 ngày đến một năm, còn HK rất muộn trong stent là khi HK trong stent xảy ra muộn hơn một năm sau đặt stent. Trong các nghiên cứu lớn trên BN đặt stent phủ thuốc (DES), với các tiêu chí thu nhận rộng rãi, HK trong stent sau 30 ngày đặt stent có tỷ lệ thấp. Các yếu tố nguy cơ và cơ chế của HK trong stent muộn và rất muộn được tóm tắt trong bảng 2 [5-7].
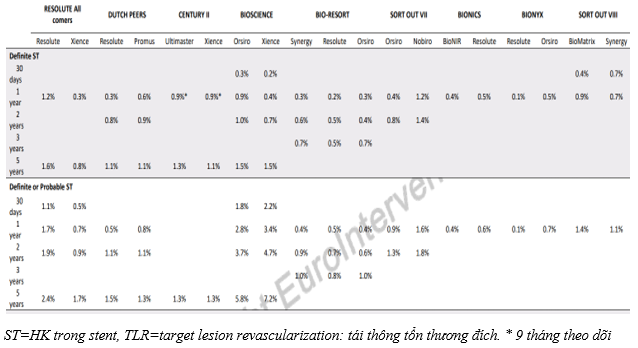
Bảng 1: Tỉ lệ HK trong stent và tái thông tổn thương đích trong các thử nghiệm lâm sàng lớn [7]
Bảng 2: Các yếu tố nguy cơ và cơ chế huyết khối trong stent [7]
2.1.3. Điều trị HK trong stent
Hầu hết BN HK trong stent nhập viện trong bệnh cảnh nhồi máu cơ tim (NMCT) cấp, có hoặc không có ST chênh lên [8]. Tuỳ theo bệnh cảnh lâm sàng cụ thể, nguyên tắc xử trí đã được khuyến cáo trong các hướng dẫn thực hành lâm sàng liên quan (Khuyến cáo điều trị NMCT với đoạn ST chênh lên hoặc không chênh lên, khuyến cáo chiến lược tái tưới máu). Thông thường những BN nghi ngờ có NMCT ST chênh lên nên được chụp CAD khẩn để xác định chẩn đoán và điều trị nguyên nhân.
Sử dụng hình ảnh trong lòng mạch vành (siêu âm trong lòng mạch-IVUS, và chụp cắt lớp quang học nội mạch vành-OCT) là các biện pháp chẩn đoán hiện nay để xác định và đánh giá cơ chế huyết khối cũng như tái hẹp trong stent [9].
Trong trường hợp tắc hoàn toàn mạch vành, trước hết nên khôi phuc dòng chảy, sau đó tiến hành chụp hình ảnh nội mạch. Ngoài hình ảnh nội mạch, kỹ thuật khuếch đại stent trên chụp mạch vành là một phương pháp hữu ích để chẩn đoán mất tính toàn vẹn của stent hoặc stent giãn không đủ. Hút HK thường quy không được khuyến các trong các hướng dẫn hiện nay, nhưng phương pháp này có thể được xem xét trong một số trường hợp HK trong stent lớn. Tương tự, việc điều trị thuốc đối kháng thụ thể glycoprotein IIb/IIIa nên được cân nhắc ở những BN có biểu hiện tăng thành lập HK. Cân nhắc sử dụng Cangrelor ở những BN không được điều trị thuốc ức chế P2Y12 tại thời điểm HK trong stent [7,10].
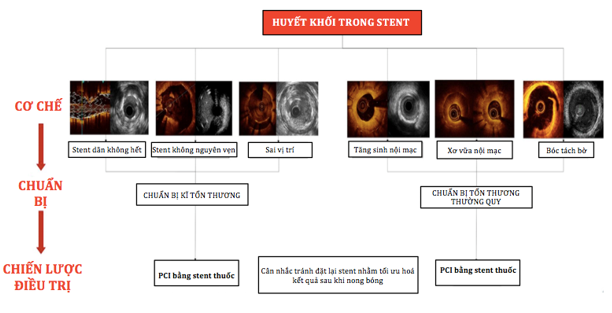
Hình 1: Chiến lược điều trị huyết khối trong stent [7]
Đa số trường hợp HK trong stent đều do các cơ chế không liên quan đến yếu tố cơ học. Các cơ chế này bao gồm ức chế tiểu cầu không đủ do đáp ứng kém, không tuân thủ liệu pháp kháng tiểu cầu, hoặc gián đoạn điều trị do phẫu thuật không được lên kế hoạch trước hoặc không thể trì hoãn.
Trong trường hợp không xác định được rõ ràng nguyên nhân cơ học của HK trong stent, chúng ta nên nong bằng bóng stent bị HK để khôi phục dòng chảy và dùng các thuốc chống HK (ví dụ: thuốc ức chế thụ thể glycoprotein, thuốc ức chế P2Y12 đường tĩnh mạch). Tiếp theo cần đánh giá tình trạng đáp ứng kém với các chất ức chế tiểu cầu. Sử dụng các xét nghiệm kiểu hình gen và di truyền tại nơi tiếp cận BN ban đầu được khuyến cáo đối với những BN bị huyết khối stent có kèm hoặc không kèm nguyên nhân cơ học rõ ràng. Việc đánh giá tuân thủ điều trị kháng kết tập tiểu cầu kép (DAPT) là cực kỳ quan trọng, đặc biệt là trong vòng 30 ngày đầu sau can thiệp mạch vành. Presugrel và Ticagrelor được ưu tiên hơn clopidogrel trong điều trị BN có HK cấp tính sau đặt stent. Liệu trình điều trị DAPT kéo dài hơn 12 tháng nên được xem xét ở những BN có HK trong stent, cần cân nhắc giữa nguy cơ gia tăng huyết khối so với nguy cơ xuất huyết trên những BN này [7,11]. Tóm tắt điều trị HK trong stent nêu ở hình 1 và bảng 3.
Bảng 3: HK trong stent: nên và không nên [7]

Lặp lại can thiệp bằng stent trong những trường hợp stent giãn không hết, đặc biệt là những tổn thương có nhiều lớp stent đè lên nhau.
2.2. Tái hẹp trong stent (In-stent restenosis-ISR)
ISR là một đáp ứng với tổn thương thành mạch dẫn đến tăng sinh mô quá mức (ví dụ: tăng sản cơ trơn mạch máu, hoặc tân tạo mảng xơ vữa) trong các đoạn mạch đã được đặt stent. ISR là một chẩn đoán dựa trên hình ảnh chụp động mạch vành, xác định bởi hẹp đường kính lòng động mạch > 50% đoạn mạch được đặt stent (bao gồm đoạn stent và giới hạn đầu gần hoặc đầu xa 5mm đoạn stent). Mặc dù DES có hiệu quả cao trong việc làm giảm nguy cơ ISR so với stent không phủ thuốc (BMS), ISR vẫn là nguyên nhân hàng đầu của PCI thất bại và là chỉ định thường gặp nhất trong TTMV đích. Các thử nghiệm lâm sàng quy mô lớn trên BN được điều trị bằng DES thế hệ mới với các tiêu chuẩn nhận bệnh rộng rãi thu thập tỷ lệ ISR trên lâm sàng (tức là TTMV đích được chỉ định lâm sàng) là <3% sau 1 năm và 10% sau 5 năm (Bảng 1). Đáng chú ý, ISR biểu hiện như một hội chứng mạch vành cấp tính ở 20% trường hợp [12].
2.2.1. Phân loại
Mặc dù ISR có thể quan sát được bằng chụp mạch vành đơn thuần, hình ảnh học trong lòng mạch (IVUS hoặc OCT) có độ nhạy cao hơn để phát hiện và mô tả ISR, đồng thời cung cấp cái nhìn sâu sắc về cơ chế IRS. Phân loại ISR qua chụp mạch vành được mô tả bởi Mehran và cộng sự là đại diện cho ISR kim loại trần (BMS-ISR) và chia làm bốn kiểu tái hẹp. Trong lược đồ phân loại này, dựa trên các yếu tố tiên lượng về TTMV cho BMS, ít liên quan đến DES. Các tiêu chí mang tính lịch sử này không cung cấp cái nhìn sâu sắc về cơ chế thất bại của việc đặt stent và không đưa ra ứng dụng điều trị. Do đó, các tác giả đề xuất một hệ thống phân loại hiện đại hóa cụ thể cho tái hẹp trong stent phủ thuốc (DES-ISR) (Bảng 4), dựa trên cơ chế hoạt động cụ thể của ISR, từ đó đưa ra phương pháp điều trị cho phù hợp. Phân loại Waksman ISR phân biệt giữa các nguyên nhân cơ học (Loại I), sinh học (Loại II) hoặc hỗn hợp (Loại III), bao gồm tổn thương tắc hoàn toàn mạn tính (Loại IV) và các tổn thương của DES-ISR đã được điều trị trước đó với hơn 2 stent (Loại V). Chúng tôi cho rằng điều quan trọng là phải phân loại chính xác và cá nhân hóa điều trị DES-ISR trên cơ sở phân loại này để cải thiện kết quả lâm sàng [13].
Bảng 4: Phân độ tái hẹp trong stent Waksman [13]
| Típ | Định nghĩa | Lựa chọn điều trị | |
| I | Cơ học | Stent nở không tốt (Típ I A) | Bóng áp lực cao |
| Gãy stent (Típ I B) | DES | ||
| II | Sinh học | Tăng sinh nội mạc (Típ II A) | Bóng, DCB, DES, VBT |
| Mảng xơ vữa mới, không vôi hóa (Típ II B) | DCB và DES | ||
| Mảng xơ vữa mới, vôi hóa
(Típ II C) |
Bóng tạo hình (scoring balloon),
ELCA và RA |
||
| III | Kiểu hỗn hợp: nguyên nhân cơ học và sinh học phối hợp | Bóng áp lực cao kèm DCB,
DES hoặc VBT |
|
| IV | Tắc nghẽn mạn tính | DCB hoặc DES, VBT nhiều lớp,
CABG nếu cần |
|
| V | >2 lớp stent | Bóng, DCB, VBT và CABG | |
Chú thích: CABG: phẫu thuật bắc cầu mạch vành, DCB: drug-coated balloon, bóng phủ thuốc, DES: drug-eluting stent, stent phủ thuốc, ELCA: excimer laser coronary atherectomy, khoan cắt mảng xơ vữa bằng laser, RA: rotational atherectomy, khoan cắt mảng xơ vữa bằng Rotablator, VBT: vascular brachytherapy, xạ trị trong lòng mạch
2.2.2. Vai trò của hình ảnh học trong lòng mạch:
Việc xác định nguyên nhân gây ra ISR bằng IVUS hoặc OCT là rất quan trọng, từ đó đưa ra chiến lược điều trị (Hình 2). Hình ảnh học nội mạch có thể phân biệt giữa nguyên nhân cơ học và sinh học. Nguyên nhân cơ học của ISR có thể liên quan đến việc stent nở không tốt, kích thước nhỏ hoặc gãy stent. Sự giãn nở của stent là một trong những yếu tố dự báo mạnh nhất về ISR có ý nghĩa về mặt chức năng. Các nghiên cứu tử thiết đã chứng minh sự không phù hợp sâu sắc giữa BN và stent về kích thước DES và mạch máu, với tỷ lệ diện tích giữa stent và mạch 0,5:1 ở những người có tái hẹp. Việc chuẩn bị sang thương không đầy đủ trong vôi hóa CAD ban đầu có thể dẫn đến tình trạng stent nở không tốt và có thể gây khó khăn cho việc điều trị về sau. Vì lý do này, việc xác định đặc điểm của vôi hóa CAD nặng là cần thiết trước khi đặt stent.
Trong trường hợp stent không nở tốt hoặc kích thước nhỏ, việc xác định thành phần mô học mảng xơ vữa có thể hướng dẫn lựa chọn thiết bị điều trị tối ưu. Mô mềm nhiều khả năng đáp ứng với điều trị bằng bơm bóng áp lực cao, trong khi các tổn thương vôi hóa có thể cần điều trị hỗ trợ, bao gồm khoan cắt mảng xơ vữa bằng laser, thiết bị Rotablator hoặc tán vôi hoá nội mạch Trong trường hợp stent đã nở tốt nhưng cơ chế tái hẹp là tăng sinh lớp nội mạch có thể điều trị tốt với bong bóng cắt, sau đó là bong bóng phủ thuốc (DCB) nếu có sẵn, hoặc dùng DES với loại thuốc khác hoặc liệu pháp xạ trị trong lòng mạch (VBT). Hình ảnh học nội mạch có thể xác định số lượng lớp stent tại vị trí tổn thương, cũng như đánh giá sự giãn nở của mỗi lớp stent (Hình 2). Việc xác định rõ ràng số lượng lớp stent bằng hình ảnh nội mạch cho phép lựa chọn phương pháp điều trị tối ưu. Trong trường hợp có nhiều lớp ISR, nên lựa chọn VBT vì ít ảnh hưởng lên các lớp stent khác.
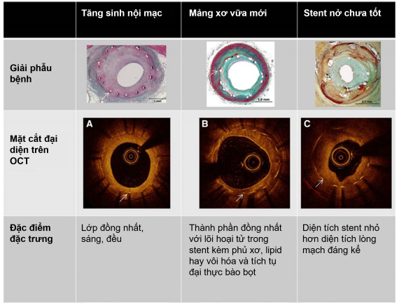
Hình 2: Thân stent (mũi tên trắng) được đánh dấu trong mỗi mặt cắt. A, mặt cắt OCT cho thấy stent với lớp tăng sinh nội mạc đặc trưng sáng, đồng nhất. B, Mảng xơ vữa mới bao gồm mảng vôi hóa bao thân stent. C, Stent nở chưa tốt với thân stent xa đáng kể lớp đàn hồi bên ngoài (đường gạch đỏ) kèm mô cạnh lòng mạch [13]
Gãy stent là một nguyên nhân của ISR được đánh giá tốt nhất bằng hình ảnh nội mạch và được xác định khi không có thanh chống của stent tại vị trí gãy (Hình 3). Tỷ lệ thực sự của gãy stent thường không được đánh giá cao nhưng đã được báo cáo nằm trong khoảng từ 1% đến 8%, với tỷ lệ tái hẹp cao kèm theo. Kích thước của mạch máu tại vị trí thanh chống stent bị gãy sẽ bị ảnh hưởng cùng với giảm tác dụng tại chỗ của thuốc do biến dạngstent và lớp phủ polyme. Từ đó làm tăng nguy cơ tái hẹp, dẫn đến viêm tại chỗ và tăng sinh lớp nội mạch.Cơ chế của biến dạng stent theo chiều dọc được xem như là một trong những nguyên nhân gây ISR, tuy nhiên việc phủ thuốc không đồng đều trên stent có liên quan hay không vẫn chưa rõ ràng.
Trong khi hình ảnh nội mạch đóng một vai trò thiết yếu trong việc đánh giá nguyên nhân thất bại của việc đặt stent, khảo sát sinh lý học mạch vành giúp đưa ra quyết định xem có chỉ định tái thông mạch hay không. Phân suất dự trữ vành (FFR) đã được xác nhận để đánh giá ISR, khi chỉ số FFR ³0,80; không nên thực hiện TTMV [13].
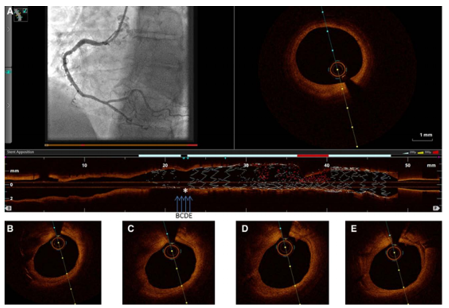
Hình 3: Gãy stent. OCT kèm ghi nhận mạch vành của động mạch vành phải (A), với diễn tả stent bề ngang cho thấy gãy stent được đánh dấu hoa thị (*). Loạt mặt cắt OCTliên tiếp từ đoạn xa đến đoạn gần vùng stent gãy cho thấy thân stent (C) [13]
2.2.3. Điều trị ISR
Điều trị ISR là một thách thức so với điều trị tổn thương mới, do tỷ lệ tái phát tương đối cao. BN ISR có thể không có triệu chứng và chỉ nên điều trị khi có triệu chứng hoặc có bằng chứng khách quan của thiếu máu cục bộ cơ tim.Trong bệnh cảnh ổn định, nếu thấy nhu cầu tái tưới máu là cần thiết, chiến lược điều trị phải được lên kế hoạch cẩn thận. Cũng như các trường hợp hẹp CAD tự nhiên, khi độ nặng của ISR trên hình ảnh chụp CAD không rõ ràng, nên sử dụng các biện pháp thăm dò sinh lý chức năng và hình ảnh nâng cao (đo lưu lượng dự trữ vành-FFR, IVUS…). Nếu có thể, nên xem xét lại tổn thương ban đầu và quá trình thủ thuật đã được thực hiện (ví dụ, chất liệu stent, bóng được sử dụng, áp suất bóng tối đa, những khó khăn gặp phải trong khi thực hiện thủ thuật, v.v.) để xác định các vấn đề tiềm ẩn về kỹ thuật có thể cần được giải quyết trong quá trình can thiệp lại.
Điều trị thường tập trung vào đoạn mạch vành đã được đặt stent hơn là toàn bộ chiều dài của nhánh mạch vành. Để ngăn chặn tái hẹp trong stent lặp lại, điều quan trọng là phải tối ưu hóa kết quả của các thủ thuật lặp lại [7,12].
Chúng ta cần giãn nở tích cực stent bên dưới, đặc biệt là những stent không nở tốt hoặc bị biến dạng, lý tưởng là sử dụng bóng cứng nong với áp lực cao (thường là> 18 bar). Cẩn thận tránh sai lệch vị trí vì điều này có thể dẫn đến tái hẹp liên quan đến đường rìa. Sử dụng bóng cắt hoặc bong có khía để nong trước,làm bóng giảm trượt ra khỏi stent (còn gọi là “hạtdưahấu”-“watermelon seeding”), có thể dẫn đến bóc tách rìa, nguy cơ bị tái hẹp cạnh stent. Các loại bóng cắt này tiếp xúc lên bề mặt của mô tân sinh, về mặt lý thuyết có thể tạo điều kiện thuận lợi cho việc phân phối thuốc bằng nong mạch với bóng phủ thuốc (DCB) hoặc đặt lại DES. Thử nghiệm ISAR-DESIRE-4 cho thấy kết quả chụp mạch vành được cải thiện sau nong trước bằng bóng cắt so với nong bằng bóng đơn thuần trước khi nong mạch bằng DCB.
Trong trường hợp stent giãn nở không tốt, bóng áp lực rất cao (25 đến 35 bar) có thể được sử dụng. Các mảng vôi hóa làm stent không giãn nở tốt có thể được thực hiện bằng khoan cắt động mạch bằng laser cực tím hoặc tán vôi hoá nội mạch, các phương pháp này cũng hữu ích trong ISR với cơ chế bệnh sinh là mảng xơ vữa mới có vôi hoá. Khoan cắt mảng vôi bằng dụng cụ Rotablator nên được thực hiện thận trọng do nguy cơ biến chứng nghiêm trọng. Nghiên cứu thêm về các liệu pháp này là cần thiết để xác nhận lợi ích của biện pháp này.
Sau khi chuẩn bị sang thương, một số BN sẽ được đặt stent lại để khắc phục tình trạng stent không phủ hết sang thương (ví dụ: do gãy, do khoảng trống hoặc trong một số trường hợp hiếm gặp, với stent bị biến dạng). Những BN còn lại sau khi nong stent và điều chỉnh bất kỳ stent giãn dưới mức nào, đều có sự đồng thuận chung rằng cần bổ sung điều trị ngoài phương pháp nong cơ học bởi vì kết quả sau khi nong mạch bằng bóng đơn thuần là kém, đó là sử dụng nong mạch DCB hoặc đặt DES lại. Các hướng dẫn thực hành lâm sàng của Châu Âu khuyến nghị sử dụng DES hoặc DCB như liệu pháp đầu tay ở BN ISR (khuyến cáo I vàmức độ bằng chứng A cho cả hai). Đặt DES lại so với DCB dường như có hiệu quả một chút nhưng không đáng kể trong trường hợp ISR và có nhu cầu tái can thiệp sang thương đích, đặc biệt ở những BN có ISR là DES. Tuy nhiên, DCB tránh được nhiều lớp kim loại trên thành mạch, có thể được quan tâm đặc biệt ở những BN bị tái phát ISR. Do đó, lựa chọn giữa hai chiến lược này có thể được xem xét dựa trên đặc điểm từng BN và tổn thương cần điều trị. Ví dụ, DCB có thể được ưu tiên hơn DES trong ISR của BMS, nhiều lớp kim loại hoặc các nhánh bên lớn. Ngược lại, DES có thể được ưu tiên hơn DCB trong các tổn thương có gãy stent, ISR lan tỏa mở rộng ra ngoài rìa của stent, hoặc trong trường hợp có bóc tách mạch vành có ý nghĩa hoặc giảm dòng chảy sau khi nong bóng. Một số thủ thuật viên thích đặt stent lại trong trường hợp ISR ở rìa stent, mặc dù các nghiên cứu cho thấy DCB có hiệu quả như nhau khi so ISR giới hạn trong thân stent với những ISR liên quan đến các rìa [7,12].
Xạ trị trong lòng mạch (Vascular Brachytherapy-VBT) ức chế sự hình thành tăng sinh lớp nội mạc trong stent bằng cách cung cấp bức xạ β-Strontium-90 phóng xạ cục bộ thông qua cơ chế thủy lực với thiết bị Beta-Cath (Novoste, Norcross, GA), làm giảm phản ứng của mô tăng sinh.Việc sử dụng VBT đã từng là một biện pháp điều trị hứa hẹn để làm giảm tỷ lệ tái hẹp nhưng hiện chỉ có ở một số trung tâm và việc sử dụng rất hạn chế. Negi và cộng sự đã đưa ra báo cáo đầu tiên gồm 186 BN sử dụng VBT có DES, với tỷ lệ tái can thiệp tổn thương đích là 3,3% sau 6 tháng, 12,1% sau 1 năm và 19,4% sau 3 năm. Trong một nghiên cứu quan sát gần đây, Varghese và cộng sự đã so sánh kết quả ở 197 BN trải qua VBT và 131 BN được can thiệp mạch vành qua da không có VBT và báo cáo giảm các biến cố tim mạch chính khi sử dụng liệu pháp điều trị này.
Khoan cắt mảng xơ vữa bằng Laser trước khi VBT có thể cải thiện kết quả lâm sàng; Tuy nhiên, các dữ liệu còn hạn chế với kỹ thuật này. VBT chủ yếu được sử dụng cho ISR kháng trị và việc sử dụng nó nên được xem xét khi có nhiều lớp stent. Điều trị bằng VBT có thể được lặp lại khi cần thiết, với khoảng cách 12 tháng giữa các lần sử dụng. Sau khi điều trị bằng VBT, vì quá trình tăng sinh nội mạc diễn ra chậm nên BN cần được duy trì điều trị kháng tiểu cầu suốt đời. Những BN tái phát sau khi được điều trị bằng VBT cộng với đặt DES cho ISR kháng trị có nguy cơ cao bị huyết khối trong stent. Do đó, đối với những BN bị tái phát sau VBT, chúng tôi đề xuất điều trị lặp lại với VBT, nong động mạch bằng bóng đơn thuần hoặc DCBs [12-15].
Điều trị chống kết tập tiểu cầu tương như bị tổn thương lần đầu. Khi ISR biểu hiện lâm sàng là hội chứng mạch vành mạn, việc chuyển đổi liệu pháp kháng tiểu cầu không được khuyến cáo trừ khi cơ chế tái hẹp là mảng xơ vữa mới có vỡ hoặc xói mòn mảng xơ vữa được xác định bằng hình ảnh nội mạch (IVUS hoặc OCT) [16, 17].
Tóm tắt chiến lược xử trí theo cơ chế ISR nêu ở hình 4 và bảng 5.
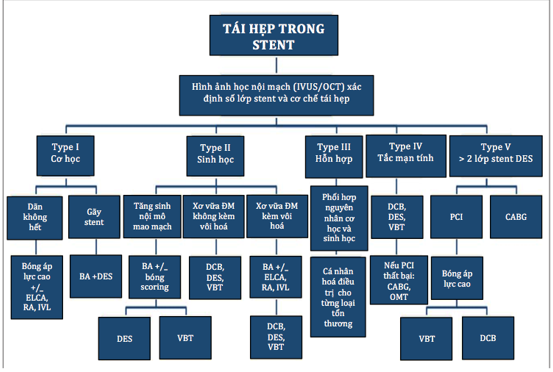
Hình 4: Sơ đồ hướng dẫn điều trị tái hẹp trong stent [13].
Chú thích: BA: nong mạch vành bằng bóng, CABG: phẫu thuật bắc cầu mạch vành, CTO: tắc mạch vành mạn tính, DCB: bóng có phủ thuốc, DES: stent phủ thuốc, ELCA: khoan cắt động mạch bằng laser cực tím, ISR: tái hẹp trong stent, IVL tán vôi hoá nội mạch, IVUS: siêu âm trong lòng mạch, OCT: chụp cắt lớp quang học nội mạch, OMT: tối ưu hoá điều trị nội khoa, PCI: can thiệp mạch vành qua da, RA: khoan cắt mảng xơ vữa bằng Rotablator, VBT: xạ trị trong lòng mạch vành [13].
Bảng 5: Tái hẹp trong stent: nên và không nên [7]

2.3. Suy chức năng MV cấp sau PCI
Không xác định được tình trạng hẹp CAD có ý nghĩa huyết động là một trong những lý do phổ biến nhất cảnh báo thất bại TTMV. Chụp mạch vành bổ sung với đánh giá chức năng xâm lấn đã được khuyến cáo ở mức cao nhất theo các hướng dẫn hiện hành để đánh giá sự liên quan về huyết động của hẹp mạch vành mức độ trung bình, khi không có bằng chứng thiếu máu cục bộ trên các xét nghiệm không xâm lấn.
FFR sau khi đặt stent dưới mức tối ưu là một yếu tố dự báo độc lập về kết quả lâm sàng bất lợi sau 6 tháng. Một nghiên cứu quan sát hồi cứu gần đây, bao gồm 574 BN (664 tổn thương mạch vành) với FFR trước và sau PCI đã đánh giá kết quả lâm sàng trong thời gian theo dõi trung bình 31 ± 16 tháng. Mặc dù có kết quả chụp mạch tối ưu, 143 tổn thương (21%) có giá trị FFR sau PCI trong khoảng thiếu máu cục bộ (FFR ≤ 0,80). Một số NC quan sát cho thấy rằng các can thiệp bổ sung có thể tối ưu hóa kết quả cấp tính ở những BN có FFR sau PCI dưới mức tối ưu. Một nghiên cứu hồi cứu quy mô nhỏ gần đây cho thấy hình ảnh nội mạch với chụp cắt lớp quang học có thể cho thấy các nguyên nhân có thể điều trị được (ví dụ: giãn stent dưới mức, stent bao phủ không hoàn toàn tổn thương, stent sai vị trí, bóc tách bờ hoặc lồi mô), cho phép tối ưu hóa kết quả chức năng mạch vành sau PCI . Tuy nhiên, liệu các can thiệp bổ sung dựa trên đánh giá chức năng sau PCI có tác động đáng kể đến kết quả lâm sàng hay không vẫn chưa được xác định rõ ràng [7,18,19] (bảng 6).
Bảng 6: Suy chức năng mạch vành cấp: cần làm gì [7]

- CABG thất bại
Thất bại trong CABG hiện được ghi nhận ngày càng tăng với sử dụng mảnh ghép tĩnh mạch hiển cao tới 50% sau 10 năm và 27% trong năm đầu tiên. Trong tháng đầu tiên sau phẫu thuật, nguyên nhân của CABG thất bại chủ yếu liên quan đến kỹ thuật phẫu thuật và các biến chứng huyết khối của cầu nối, trong khi CABG thất bại sau thời gian đó được đặc trưng bởi sự tăng sản cơ trơn mạch máu và BMV tiến triển nhanh.
3.1. CABG thất bại cấp (< 1 tháng)
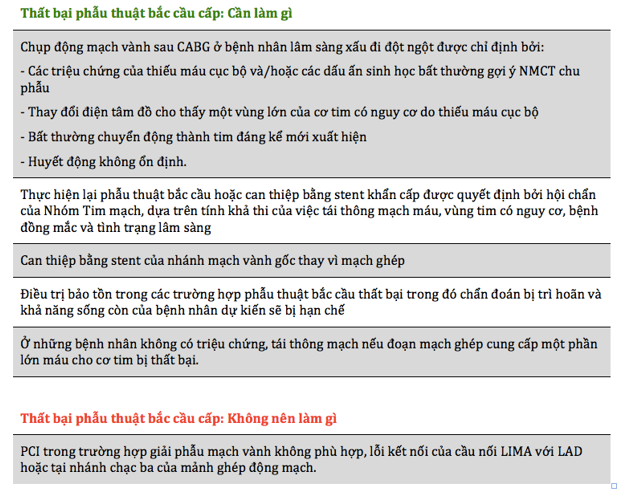
Tắc cầu nối cấp tính có thể do bóc tách cầu nối, cầu nối bị gấp khúc hoặc xoắn vặn, lỗi kỹ thuật nối mạch, suy giảm dòng chảy của cầu nối vào động mạch vành gốc, dòng chảy cạnh tranh từ động mạch vành gốc, hoặc huyết khối cầu nối. Trong một nghiên cứu thực hiện trên 366 BN được chụp mạch thường quy sau CABG, 12,2% miệng nối vành hẹp có ý nghĩa trên hình ảnh học. Trong đó, 2,8% trường hợp cần điều chỉnh nhỏ miệng nối, 3,4% cần kiểm tra lại miệng nối, 6% cần làm can thiệp mạch vành qua da [21]. Vì các vấn đề vận chuyển khó khăn khi chụp mạch thường quy sau phẫu thuật, kiểm tra lưu lượng trong mổ và siêu âm thượng tâm mạc tần số cao được dùng trong lúc phẫu thuật để tìm nguyên nhân tắc cầu nối trước khi đóng ngực và cho phép kiểm tra lại miệng nối trước khi thiếu máu cơ tim xảy ra hay diễn tiến.
Về mặt lâm sàng, thất bại CABG cấp tính có thể dẫn đến NMCT với nguy cơ tử vong sau đó. Nghi ngờ thất bại CABG sớm nên được đặt ra khi tình trạng lâm sàng đột ngột xấu đi; được chỉ điểm bởi các dấu hiệu điện tâm đồ của thiếu máu cục bộ, rối loạn nhịp thất, thay đổi marker tim, bất thường vận động vùng cơ tim mới, hoặc huyết động không ổn định. Do độ đặc hiệu thấp của các thay đổi điện tâm đồ và bất thường vận động vùng cơ tim trên hình ảnh học siêu âm tim trong thời gian hậu phẫu và sự xuất hiện chậm trễ của thay đổi các marker tim; việc đánh giá cẩn thận tất cả các thông số để đưa ra quyết định chụp động mạch vành đánh giá.
CABG có xu hướng được dành cho những vùng quan trọng nhất của cơ tim (ví dụ, nối động mạch vú trong bên trái [LIMA] với động mạch liên thất trước trái [LAD]). Do đó, thất bại CABG cấp tính thường có biểu hiện lâm sàng nghiêm trọng hơn trên CABG dùng mảnh ghép động mạch, trong khi CABG dùng mảnh ghép tĩnh mạch thường xảy ra dưới lâm sàng. Một nghiên cứu quan sát cho thấy thất bại CABG cấp tính của cầu nối động mạch LIMA-LAD chắc chắn cần can thiệp lại ở 80% BN, trong khi thất bại CABG cầu nối ghép tĩnh mạch cấp tính được điều trị bảo tồn ở khoảng 50% BN [7].
Trong trường hợp thất bại CABG cấp tính, can thiệp mạch vành bằng stent cấp cứu có thể hạn chế mức độ lan rộng của NMCT. Các hướng dẫn lâm sàng hiện tại ủng hộ PCI nên là chiến lược điều trị ưu tiên trong các trường hợp thất bại CABG cấp tính, khi có giải phẫu mạch vành phù hợp. PCI sau CABG có liên quan đến gia tăng nguy cơ tử vong trong bệnh viện không hiệu chỉnh (5.1% so với 2.7%; p< 0.001), tỷ lệ đột quỵ cao hơn (2.1% so với 1.6%, p < 0.001), tỷ lệ tổn thương thận cấp cao hơn (16% so với 12.3%, p < 0.001), và gia tăng 50% chi phí điều trị [22-24].
Lặp lại phẫu thuật bắt cầu nên được ưu tiên cho những BN có giải phẫu mạch vành không phù hợp PCI (bất thường giải phẫu mạch vành, hoặc khi có nhiều đoạn ghép quan trọng bị tắc…). Điều trị nội khoa bảo tồn nên được cân nhắc trong những trường hợp chẩn đoán trễ và dự kiến khả năng sống còn thấp. Ở những BN không có triệu chứng, việc lặp lại tái thông mạch vành nên được xem xét nếu đoạn mạch ghép cung cấp máu cho một vùng lớn cơ tim (hình 5 và bảng 7).
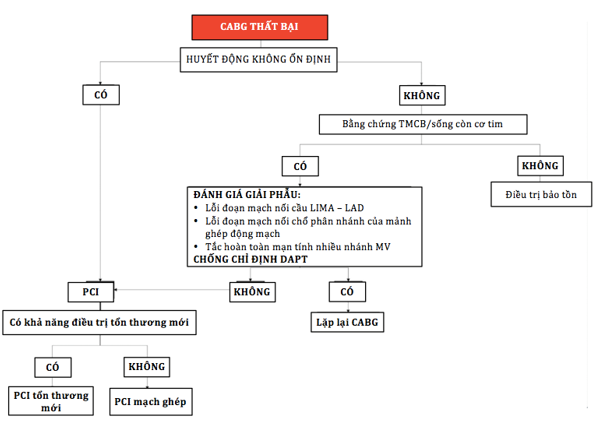
Hình 5: Chiến lược điều trị đối với CABG thất bại [7)
Bảng 7: Thất bại phẫu thuật bắc cầu: nên và không nên [7]
3.2. CABG thất bại muộn (> 1 tháng sau phẫthuật CABG)
Khi thời gian phẫu thuật kéo dài, các đoạn tĩnh mạch ghép trở nên dễ bị tác động bởi quá trình xơ vữa động mạch. Điều này dẫn đến phần lớn các mảng xơ vữa động mạch mềm, giàu lipid lan tỏa với các lõi hoại tử lan rộng có hoặc không có xuất huyết trong lòng dễ bị vỡ và gây tắc mạch xuôi dòng.
Biểu hiện lâm sàng của thất bại CABG muộn chủ yếu ở dạng cơn đau thắt ngực ổn định hoặc không ổn định [25].
PCI được coi là lựa chọn điều trị hợp lý trong trường hợp thất bại CABG muộn. Tuy nhiên nghiên cứu so sánh ngẫu nhiên giữa CABG và PCI còn thiếu, một phần nguyên nhân do BN không mong muốn được phân bố vào nhóm làm lại CABG. Trong một phân tích nhóm nhỏ trên những BN thất bại CABG muộn từ nghiên cứu sổ bộ AWESOME, lặp lại CABG có liên quan đến tỷ lệ tử vong chu phẫu cao hơn khi so sánh với nhóm PCI. Vì thế, CABG lại chỉ được khuyến cáo trong trường hợp BMV nặng với tắc nhiều nhánh động mạch ghép, đặc biệt trong trường hợp không có mảnh ghép động mạch [22].
Can thiệp PCI ở đoạn mạch ghép tĩnh mạch được xem như là thủ thuật can thiệp nguy cơ cao do làm tăng nguy cơ mất dòng chảy/ hoặc dòng chảy chậm có liên quan đến mảng xơ vữa nứt vỡ gây thuyên tắc xa, và phụ thuộc vào mức độ thoái hoá của mảnh ghép. Một số tác giả đề nghị sử dụng dụng cụ lưới lọc để ngăn ngừa thuyên tắc xa. Có rất nhiều nghiên cứu ngẫu nhiên so sánh việc sử dụng DES với BMS trong can thiệp những tổn thương của đoạn mạch ghép tĩnh mạch. Một phân tích tổng hợp từ các nghiên cứu ngẫu nhiên, cho thấy không có khác biệt giữa DES và BMS về mọi nguyên nhân tử vong (RR 1.06, 95%, KTC 0.76-1.48), NMCT (RR 0.81, 95%, KTC 0.50-1.29), tái can thiệp động mạch thủ phạm (RR 0.73, 95%, KTC 0.48-1.11) và tái can thiệp tổn thương đích (RR 1.05, 95%, KTC 0.76-1.43) trong khoảng thời gian theo dõi lâu dài nhất (bảng 8).
Bảng 8: Thất bại phẫu thuật bắc cầu muộn: nên và không nên [7]
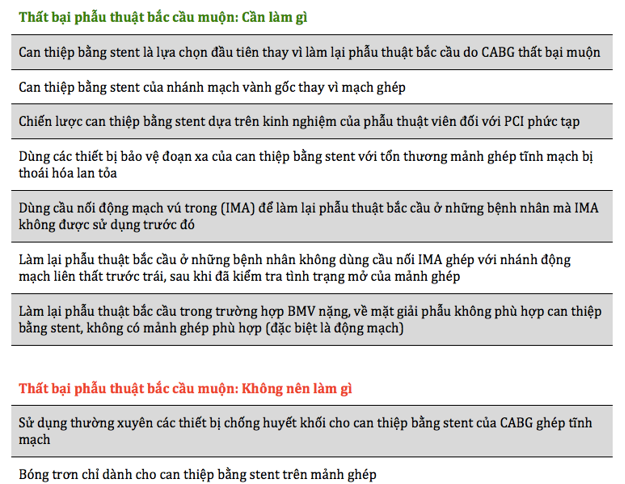
- Lặp lại tái thông mạch vành do bệnh mạch vành (BMV) tiến triển
BMV tiến triển trên những đoạn mạch vành tự nhiên chưa được can thiệp trước đó là nguyên nhân chính của việc cần lặp lại các thủ thuật sau khi tái thông mạch vành.
- Tiến triển BMV tự nhiên sau PCI
Tỷ lệ cộng dồn của các biến cố tim mạch nặng – bao gồm đột tử do tim, ngừng tim, NMCT và nhập viện vì đau thắt ngực – là 20,4% sau 3 năm, với 12,9% biến cố có liên quan đến tổn thương do động mạch thủ phạm và 11,6% biến cố do tiến triển của BMV tại các động mạch vành không phải là thủ phạm. Tổng tỷ lệ tái thông mạch vành sau 3 năm là 17,1%, với tỉ lệ tương đương của các biến cố liên quan đến tổn thương động mạch thủ phạm và sự tiến triển của BMV [7].
Các yếu tố dự báo BMV tiến triển trong các đoạn mạch vành chưa được điều trị trước đây bao gồm các yếu tố lâm sàng và giải phẫu mạch vành mà phần lớn trùng lặp với các yếu tố dự báo PCI và CABG thất bại, chẳng hạn như tuổi tác, đái tháo đường, giải phẫu mạch vành phức tạp, độ nặng BMV, mạch máu nhỏ và PCI trước CABG hoặc tổn thương lỗ (chỗ chia nhánh) [26].
- Tiến triển BMV tự nhiên sau CABG
Các khuyến cáo hiện nay đối với CABG vốn dĩ chọn lựa những BN có nguy cơ BMV tiến triển cao hơn các phương pháp điều trị khác. Những nguy cơ này bao gồm bệnh nhiều nhánh mạch vành, có giải phẫu mạch vành phức tạp và BMV nặng, có nhiều bệnh đồng mắc như đái tháo đường, giảm phân suất tống máu thất trái, và bệnh thận mạn. Ghi nhận lâm sàng trong thời gian dài cho thấy BMV tiến triển thường xảy ra cao gấp 10 lần ở những tổn thương xơ vữa động mạch không tắc nghẽn trên các nhánh động mạch vành bắc cầu so với các tổn thương tương tự ở những đoạn mạch không bắc cầu sau 3 năm. Trong một nghiên cứu khác, nguy cơ BMV tiến triển ở những đoạn mạch có mảnh ghép còn thông cao gấp 2 lần so với đoạn mạch có mạch ghép bị tắc, với phần lớn động mạch được ghép tổn thương dần đến tắc nghẽn hoàn toàn [27].
4.3. Nguyên tắc chung điều trị BMV tiến triển
Trong trường hợp BMV tiến triển ở các đoạn mạch vành chưa được điều trị trước đó sau khi TTMV, các khuyến cáo điều trị nên dựa trên các triệu chứng lâm sàng và bằng chứng của thiếu máu cục bộ cơ tim. Trong bối cảnh này, điều trị nội khoa tối ưu đóng một vai trò quan trọng không chỉ để giảm nguy cơ BMV tiến triển mà còn để điều trị ban đầu những BN có bằng chứng về sự tiến triển của BMV. Việc điều trị can thiệp đối với BMV tiến triển khác nhau tùy theo phương thức tái thông mạch ban đầu [7,22].
- Điều trị BMV tiến triển sau PCI
Trong các nghiên cứu PCI quy mô lớn hiện tại, có tới một phần ba số BN tham gia nghiên cứu đã được điều trị bằng PCI trước đó. Điều trị PCI đối với BMV tiến triển sau PCI trước đó là lựa chọn hợp lý. Một chiến lược TTMV bằng phẫu thuật có thể thích hợp trong trường hợp BMV tiến triển liên quan đến đoạn gần của các nhánh CAD chính hoặc bệnh nhiều nhánh mạch vành có kèm thân chung hoặc nhánh liên thất trước (LAD) đoạn gần. Một nghiên cứu sổ bộ lớn đánh giá kết quả của những BN được CABG có tiền căn PCI trước đó cho thấy tỷ lệ tử vong sớm và các biến cố có liên quan đến thiếu máu cục bộ cơ tim không tăng có ý nghĩa ở những BN có một hoặc nhiều lần PCI trước đó. Do đó, một chiến lược điều trị dựa trên các yếu tố lâm sàng và giải phẫu tương tự như những BN có chẩn đoán BMV đầu tiên được khuyến cáo ở những BN có BMV tiến triển sau PCI [7,22,28].
- Điều trị BMV tiến triển sau CABG
Lặp lại các thủ thuật TTMV sau CABG thường được thực hiện ở những BN lớn tuổi có nhiều bệnh đồng mắc và giải phẫu mạch vành phức tạp hơn so với những BN được chẩn đoán BMV lần đầu. Hơn nữa, ở những BN này, mạch máu dùng làm cầu nối động mạch vành thường ít có sẵn, hoặc đã được sử dụng. Do đó, thực hiện lại CABG làm tăng nguy cơ có liên quan đến phẫu thuật và kết quả lâm sàng xấu hơn so với CABG lần đầu tiên. Các bằng chứng gần đây cho thấy xu hướng giảm nguy cơ mắc các biến cố ngoại ý ở BN được điều trị bằng PCI dẫn đến việc gia tăng sử dụng điều trị bằng PCI đối với những bệnh cảnh này. Do có rất ít những nghiên cứu sẵn có so sánh hiệu quả giữa hai chiến lược điều trị, ở những BN này, việc lựa chọn chiến lược tái thông mạch máu nên dựa trên việc đánh giá các yếu tố nguy cơ lâm sàng và giải phẫu của từng BN với sự tham gia của các đội nhóm tim mạch (Heart Team) [29,30] (bảng 9)
Bảng 9: BMV tiến triển: nên và không nên [7]

Kết luận:
Các thủ thuật TTMV bằng PCI và CABG hiện nay với kĩ thuật tiên tiến đã đem lại những kết quả lâm sàng dài hạn khả quan. Tuy nhiên, vẩn còn một tỷ lệ đáng kể BN cần phải lặp lại thủ thuật tái thông trong thời gian theo dõi lâu dài do thất bại trong việc tái thông động mạch thủ phạm ban đầu – do PCI hoặc CABG – hoặc sự tiến triển của BMV ở những đoạn mạch chưa được điều trị trước đó. Chúng tôi hy vọng bài viết này cung cấp các hướng dẫn dựa trên bằng chứng để xử trí thất bại do TTMV tuỳ theo cơ chế, thời gian và các đặc điểm lâm sàng và giải phẫu học mạch vành của từng BN.
TÀI LIỆU THAM KHẢO
- Head SJ, Milojevic M, Taggart DP, Puskas JD. Current Practice of State-of-the-Art Surgical Coronary
Revascularization. Circulation. 2017;136:1331–45.
- Byrne RA et al: Report of a European Society of Cardiology-European Association of Percutaneous Cardiovascular Interventions task force on the evaluation of coronary stents in Europe: executive summary. Eur Heart J. 2015;36:2608–20.
3 Giustino G et al: Mortality After Repeat Revascularization Following PCI or Coronary Artery Bypass Grafting for Left Main Disease: The EXCEL trial. JACC CardiovascInterv. 2020;13(3):375-387.
- Palmerini T et al: Mortality Following Nonemergent, Uncomplicated Target Lesion Revascularization After Percutaneous Coronary Intervention. JACC CardiovascInterv. 2018;11(9):892.902.
- Garcia-Garcia HM et al: Academic Research Consortium. Standardized End Point Definitions for Coronary Intervention Trials. Eur Heart J. 2018;39:2192–207.
- Byrne RA, Joner M, Kastrati A. Stent thrombosis and restenosis: what have we learned and where are we going? The Andreas Grüntzig Lecture ESC 2014. Eur Heart J. 2015;36:3320–31.
- Stefanini. GG et al: Management of Myocardial Revascularization Failure: An Expert Consensus Document of the EAPCI. DOI: 10.4244/EIJ-D-20-00487. 2020
- Adriaenssens T et al: Optical Coherence Tomography Findings in Patients With Coronary Stent Thrombosis. Circulation. 2017;136:1007–21
- Souteyrand G et al: Mechanisms of stent thrombosis analysed by optical coherence tomography: insights from the national PESTO French registry. Eur Heart J. 2016;37:1208–16.
- Salazar C et al: A Complex Scenario Successfully Managed With Intravascular Lithotripsy. JACC CardiovascInterv. 2019;12:1510–2. .
- Stefanescu Schmidt AC et al: Myocardial Infarction Risk After Discontinuation of Thienopyridine Therapy in the Randomized DAPT Study (Dual Antiplatelet Therapy). Circulation. 2017;135:1720–32.
- Alfonso F, Byrne RA, Rivero F, Kastrati A. Current Treatment of In-Stent Restenosis. J Am Coll Cardiol. 2014;63:2659–73.
- Shlofmitz.E, Iantorno. M, Waksman.R: Restenosis of Drug-Eluting Stents A New Classification System Based on Disease Mechanism to Guide Treatment and State-of-the-Art Review. CircCardiovascInterv. 2019;12:e007023. DOI: 10.1161/CIRCINTERVENTIONS.118.007023
- Kufner S et al: Neointimal Modification With Scoring Balloon and Efficacy of Drug-Coated Balloon Therapy in Patients With Restenosis in Drug-Eluting Coronary Stents. JACC CardiovascInterv. 2017;10:1332–40
- Alfonso F et al: Coronary Lithoplasty for the Treatment of Undilatable Calcified De Novo and In-Stent Restenosis Lesions. JACC CardiovascInterv. 2019;12:497–9.
- Johnson TW et al: Clinical use of intracoronary imaging. Part 2: acute coronary syndromes, ambiguous coronary angiography findings, and guiding interventional decision making: an expert consensus document of the European Association of Percutaneous Cardiovascular Interventions. Eur Heart J. 2019;40:2566–84.
- Räber L et al: Clinical use of intracoronary imaging. Part 1: Guidance and optimization of coronary interventions. An expert consensus document of the European Association of Percutaneous Cardiovascular Interventions. Eur Heart J. 2018;39:3281–300.
- Rimac G et al: Clinical Value of Post-Percutaneous Coronary Intervention Fractional Flow Reserve Value: A Systematic Review and Meta-Analysis. Am Heart J. 2017;183:1-9.
- Crea F et al: Mechanisms and diagnostic evaluation of persistent or recurrent angina following
percutaneous coronary revascularization. Eur Heart J. 2019;40:2455–62.
- Lamy A et al: Rivaroxaban, Aspirin, or Both to Prevent Early Coronary Bypass Graft Occlusion: The COMPASS-CABG Study. J Am Coll Cardiol. 2019;73:121–30.
- Zhao DX et al: Routine Intraoperative Completion Angiography After Coronary Artery Bypass Grafting and 1-Stop Hybrid Revascularization. J Am Coll Cardiol. 2009;53:232–41.
- Neumann F-J et al: 2018 ESC/EACTS Guidelines on myocardial revascularization. EuroIntervention. 2019;14:1435–534.
- Head SJ, Milojevic M, Taggart DP, Puskas JD. Current Practice of State-of-the-Art Surgical Coronary
Revascularization. Circulation. 2017;136:1331–45.
- Alqahtani F et al: Incidence, Predictors, and Outcomes of In-Hospital Percutaneous Coronary Intervention Following Coronary Artery Bypass Grafting. J Am Coll Cardiol. 2019;73:415–23.
- Brilakis ES et al: Drug-eluting stents versus bare-metal stents in saphenous vein grafts: a double-blind, randomised trial. Lancet. 2018;391:1997–2007.
- Taniwaki M et al: The association between in-stent neoatherosclerosis and native coronary artery disease progression: a long-term angiographic and optical coherence tomography cohort study. Eur Heart J. 2015;36(32):2167-76.
- Pereg D et al: Native Coronary Artery Patency After Coronary Artery Bypass Surgery. JACC CardiovascInterv. 2014;7:761–7.
- Kandzari DE et al: Ultrathin, bioresorbable polymer sirolimus-eluting stents versus thin, durable polymer everolimus-eluting stents in patients undergoing coronary revascularisation (BIOFLOW V): a randomised trial. Lancet. 2017;390:1843–52.
- Escaned J. Secondary revascularization after CABG surgery. Nat Rev Cardiol. 2012;9:540–9.
- Brener SJ, Lytle BW, Casserly IP, Ellis SG, Topol EJ, Lauer MS. Predictors of revascularization method and long-term outcome of percutaneous coronary intervention or repeat coronary bypass surgery in patients with multivessel coronary disease and previous coronary bypass surgery. Eur Heart J. 2006;27:413–8.







