1. ĐẠI CƯƠNG
Bệnh tim mạch xơ vữa (atherosclerotic cardiovascular disease-BTMXV) là nguyên nhân hàng đầu gây tử vong và tàn tật trên thế giới. Trong năm 2012, BTMXV gây tử vong cho khoảng 17,3 triệu người trên toàn thế giới [1]. Nhiều nguyên nhân dẫn đến BTMXV.
ThS.BS Phạm Tú Quỳnh
BS CK II Nguyễn Thanh Hiền
Trong đó, có những yếu tố nguy cơ (YTNC) không điều chỉnh được như tuổi, giới nam nhưng cũng có nhiều yếu tố có thể điều chỉnh được liên quan đến lối sống như hút thuốc lá, ít hoạt động thể lực, thói quen ăn uống hay liên quan đến các rối loạn khác như tăng huyết áp (THA), đái tháo đường (ĐTĐ), rối loạn lipid máu (RLLM). Việc điều trị sớm và tích cực các YTNC đóng vai trò quan trọng trong hạn chế tiến triển BTMXV. Nhiều nghiên cứu và thử nghiệm cho thấy vai trò ngày càng quan trọng của statin- một loại thuốc điều trị RLLM- trong dự phòng tiên phát và thứ phát BTMXV. Gần đây đã có những thay đổi trong cách tiếp cận và điều trị RLLM. Bài viết này trình bày cách tiếp cận mới hiện nay.
1.1. Định nghĩa
RLLM có thể được định nghĩa như sự tăng bất thường cholesterol và/hoặc triglycerid trong máu, và/hoặc sự giảm HDL – cholesterol.
1.2. Nguyên nhân
RLLM có thể do di truyền (nguyên phát) hoặc do hậu quả của những bệnh khác hoặc do thuốc (thứ phát)
1.2.1. RLLM nguyên phát
Rối loạn di truyền có thể gây ra quá nhiều hay thiếu hụt lipoprotein
Lipoprotein bị rối loạn có thể là LDL, lipoprotein (a), lipoprotein tồn lưu (phần dư lại của lipoproein sau khi bị lấy đi triglyceride- lipoprotein remnants), lipoprotein giàu triglyceride (gồm chylomicron, chylomicron tồn lưu và VLDL), hay HDL.
Bảng 1. Những rối loạn lipoprotein nguyên phát[2]
|
Rối loạn |
Gen |
|
Bất thường LDL |
|
|
Tăng cholesterol máu gia đình |
LDL-R |
|
Khiếm khuyết apo B100 gia đình |
Apo B |
|
Tăng cholesterol máu gen trội nhiễm sắc thể thường |
PCSK9 |
|
Tăng cholesterol máu gen lặn nhiễm sắc thể thường |
ARH |
|
Không có betalipoprotein |
MTP |
|
Giảm betalipoprotein |
Apo B |
|
Sitosterolemia gia đình |
ABCG5/ABCG8 |
|
Tăng lipoprotein lipoprotein(a) máu gia đình |
Apo (a) |
|
Lipoprotein tồn lưu |
|
|
Rối loạn betalipoprotein type III |
Apo E |
|
Thiếu lipase gan |
HL |
|
Lipoprotein giàu triglyceride |
|
|
Thiếu lipase lipoprotein |
LPL |
|
Thiếu apo C-II |
Apo C-II |
|
Thiếu apo A-V |
Apo A-V |
|
Tăng triglycerid máu gia đình |
Đa gen |
|
Tăng lipid máu hỗn hợp gia đình |
Đa gen |
|
Bất thường HDL |
|
|
Thiếu apo A-I |
Apo A-I |
|
Bệnh Tangier, thiếu HDL gia đình |
ABCA1 |
|
Hội chứng thiếu LCAT gia đình |
LCAT |
|
Thiếu CETP |
CETP |
|
Bệnh Niemann-Pick type A và B |
SMPD1 |
|
Bệnh Niemann-Pick type C |
NPC1 |
1.2.2. RLLM thứ phát[3]
Bảng 2. Nguyên nhân thứ phát RLLM
|
Nguyên nhân thứ phát |
Tăng LDL-C |
Tăng triglyceride |
|
Chế độ ăn |
Mỡ bão hòa hay mỡ chuyển hóa, tăng cân, chán ăn |
Tăng cân, chế độ ăn rất low-fat, ăn nhiều carbohydrates tinh chế, quá nhiều rượu |
|
Thuốc |
Lợi tiểu, cyclosporine, glucocorticoids, amiodarone |
Estrogen đường uống, glucocorticoid, tách acid mật, ức chế protease, acid retioic, steroid đồng hóa, sirolimus, raloxifene, tamoxifen, ức chế beta (trừ carvedilo), thiazide |
|
Bệnh lý |
Tắc mật, hội chứng thận hư |
hội chứng thận hư, suy thận mãn, loạn dưỡng mỡ |
|
Rối loạn hay thay đổi chuyển hóa |
Nhược giáp, béo phì, thai kỳ* |
ĐTĐ (kiểm soát kém), nhược giáp, béo phì, thai kỳ* |
|
*cholesterol và triglyceride tăng dần trong suốt thai kỳ |
||
2. TRIỆU CHỨNG LÂM SÀNG
Hầu hết bệnh nhân không có triệu chứng cơ năng và triệu chứng thực thể đặc hiệu.
Hiếm hơn, bệnh nhân bị RLLM gia đình có thể có u vàng ở da và u vàng ở gân như gân bánh chè, gân gót và gân duỗi bàn tay.
RLLM thường được chẩn đoán bởi tầm soát xét nghiệm thường quy ở bệnh nhân không có triệu chứng hay bệnh nhân có các bệnh lý liên quan đến RLLM
3. CHẨN ĐOÁN
Các bước tiến hành chẩn đoán RLLM[3]
Bước 1: Xét nghiệm mỡ máu
Phân tích lipoprotein máu nên được thực hiện sau 12 giờ nhịn đói bao gồm: cholesterol toàn phần, triglycerid, HDL-cholesterol(HDL-C) và LDL-cholesterol (LDL-C).
Những chú ý trong xét nghiệm LDL-C[4]
LDL-C thường được ước lượng từ công thức Friedewald:
. LDL-C = cholesterol toàn phần – VLDL-C – HDL-C
VLDL-C được ước lượng bằng 1/5 nồng độ triglyceride nên có thể có một số sai số liên quan đến tính LDL-C:
. Công thức chỉ có giá trị khi nồng độ triglyceride dưới 400mg/dL. Nếu triglyceride trên mức này, LDL-C cần được đo trực tiếp bằng phân tích siêu ly tâm hay kỹ thuật kết tủa miễn dịch.
. Ước lượng LDL-C bị ảnh hưởng bởi các sai số trong xét nghiệm cholesterol toàn phần, triglyceride và HDL-C. Vì cholesterol toàn phần, triglyceride bị ảnh hưởng đáng kể theo chế độ ăn nên theo quy ước chung hiện nay, các xét nghiệm lipid máu nên làm lúc đói (> 12 giờ không ăn).
. Ước tính VLDL-C bằng nồng độ triglyceride đã đánh giá thấp hơn thực tế lượng cholesterol cũng có khả năng sinh xơ vữa trong VLDL tồn lưu (VLDL remnants) hay còn gọi là IDL (intermediate density lipoprotein).
. LDL-C ước tính bao gồm cả các choleserol của các lipoprotein khác như lipoprotein(a) và lipoprotein-X. Lipoprotein(a) có thể liên quan đến nguy cơ BMV độc lập với LDL. Nhưng, lipoprotein-X là phần tử chứa cholesterol được tạo ra trong bệnh gan ứ mật, lại không liên quan đến BTM.
Số lượng phần tử LDL liên quan mạnh với BTM. Tuy nhiên, bằng kỹ thuật phân tích định lượng cholesterol trong LDL thì không thể xác định chính xác số các phần tử LDL. Các LDL kích thước nhỏ mang ít cholesterol hơn các LDL kích thước lớn. Cùng một lượng LDL-C, bệnh nhân có LDL nhỏ có nhiều hơn 70% số phần tử LDL so với người có kích thước LDL lớn.
Ở người có tình trạng đề kháng insulin (hội chứng chuyển hóa, ĐTĐ type 2) có sự không đồng bộ giữa LDL-C với nồng độ các phần tử LDL và apolipoprotein B. Đó là do đề kháng insulin gây ra tái cấu trúc LDL, các phần tử LDL bị tách bớt cholesterol và kích thước trở nên nhỏ hơn, dẫn đến tăng số lượng các phần tử LDL. Vì vậy, tăng đề kháng insulin hay tăng số lượng các YTNC chuyển hóa không làm tăng mức LDL-C đáng kể, nhưng làm tăng nhiều nồng độ phần tử LDL nhỏ và tăng tổng lượng phần tử LDL.
Gần 2/3 bệnh nhân ĐTĐ type 2 dù đang điều trị statin và có LDL-C dưới 100 mg/dL, vẫn còn có quá nhiều phần tử LDL. Tương tự, 41% bệnh nhân ĐTĐ type 2 dù đang điều trị statin và có LDL-C dưới 70 mg/dL cũng còn có quá nhiều phần tử LDL. Do đó, những trường hợp đề kháng insulin mà đã đạt mức LDL-C đích nên đo lường nồng độ các phần tử LDL hay thay thế bằng xét nghiệm apo B.
non HDL-C: non HDL-C được tính bằng cholesterol toàn phần trừ HDL-C. non HDL-C được dùng để đánh giá toàn bộ các phần tử sinh xơ vữa trong máu (VLDL, IDL, LDL) và liên quan tốt với mức apoB.
HDL-C: Mặc dù tăng HDL-C tiên đoán giảm mảng xơ vữa và hạ HDL-C có liên quan đến gia tăng biến cố và tử vong ở bệnh nhân bệnh động mạch vành. Tuy nhiên, do còn thiếu các bằng chứng thuyết phục về hiệu quả can thiệp loại RLLM này trên nguy cơ BTMXV, nên hạ HDL-C chưa được xem là mục tiêu điều trị chính BTMXV
Triglyceride:Tăng triglyceride máu thường liên quan đến hạ HDL-C và tăng LDL nhỏ đậm đặc. Vì vậy, ảnh hưởng của tăng triglyceride máu trên BTMXV có thể do tình trạng hạ HDL-C và tăng LDL nhỏ đậm đặc. Do còn thiếu các bằng chứng thuyết phục nên hiện nay, triglyceride chưa được xem là YTNC BTMXV.
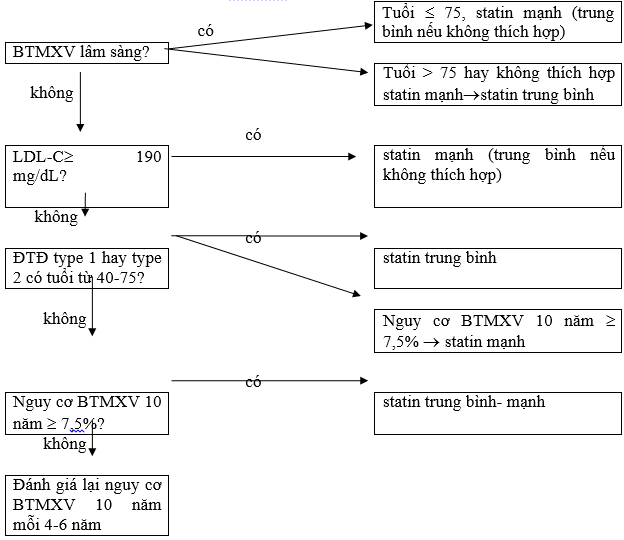
Bước 2 : Xác định bệnh nhân có BTMXV lâm sàng
Xác định bệnh nhân có các dạng lâm sàng của BTMXV
. Hội chứng vành cấp, đau thắt ngực ổn định
. Tiền căn nhồi máu cơ tim cũ, đau thắt ngực không ổn định
. Tái tưới máu mạch vành hay động mạch khác
. Đột quỵ
. Cơn thiếu máu não thoáng qua
. Bệnh động mạch ngoại biên do xơ vữa
Nếu có các dạng lâm sàng của BTMXV Äbắt đầu điều trị statin (xem 4.2.1)
Nếu không các dạng lâm sàng của BTMXV, tiếp bước 3
Bước 3 : Xác định bệnh nhân có LDL-C ³190 mg/dL?
Nếu có LDL-C ³190 mg/dL Äbắt đầu điều trị statin mạnh (xem 4.2.1)
Nếu không LDL-C ³190 mg/dL, tiếp bước 4
Bước 4: Xác định bệnh nhân có trong nhóm tuổi từ 40-75 và có ĐTĐ không?
Xác định bệnh nhân tuổi từ 40-75 và có ĐTĐ
Nếu có tuổi từ 40-75 và có ĐTĐ Äbắt đầu điều trị statin (xem 4.2.1)
Nếu không tuổi từ 40-75 và có ĐTĐ, tiếp bước 5
Bước 5:đánh giá nguy cơ BTMXV trong 10 năm
Đánh giá nguy cơ BTMXV trong 10 năm bằng Pooled Cohort Equations (http://my.americanheart.org/cvriskcalculator hay http://www.cardiosource.org/science-and-quality/practice-guidelines-and-quality-standards/2013-prevention-guideline-tools.aspx)
Nếu nguy cơ BTMXV 10 năm ³7,5%®statin trung bình-mạnh (xem 4.2.1)
Nếu nguy cơ BTMXV 10 năm < 7,5%®tiếp bước 6
Bước 6:Một số trường hợp đặc biệt
Nếu nguy cơ BTMXV 10 năm < 7,5%
. Đánh giá lại nguy cơ BTMXV 10 năm mỗi 4-6 năm
. Xem xét một số yếu tố có lợi khi dùng statin
– LDL-C ³160 mg/dL
– Tăng lipid máu di truyền
– Tiền căn gia đình có BTMXV lâm sàng sớm: nam < 55 tuổi, nữ <65 tuổi
– CRP siêu nhạy ³2 mg/L
– Điểm vôi hóa mạch vành ³300 đơn vị Agatston hay ³75% theo tuổi, giới, chủng tộc
– ABI (chỉ số huyết áp cổ chân- cánh tay) < 0,9
– Nguy cơ BTMXV lâu dài cao
Sơ đồ 1. Tiếp cận bệnh nhân RLLM[3]
Bước 7: Kiểm tra bệnh nhân có tăng triglyceride ³500 mg/dL?
. Nếu có tăng triglyceride ³500 mg/dL, điều trị fibrat để giảm nguy cơ viêm tụy cấp(xem 4.2.2)
4. ĐIỀU TRỊ
Xử trí RLLM bao gồm thay đổi lối sống và điều trị thuốc
Thay đổi lối sống là cơ bản trong điều trị RLLM
Trong số các thuốc RLLM, statin có vai trò vượt trội. Statin là thuốc có chỉ định bắt buộc trong một số trường hợp (xem các bước chẩn đoán)
. Bệnh nhân có BTMXV lâm sàng
. Bệnh nhân có LDL-C ³190 mg/dL
. Bệnh nhân có trong nhóm tuổi từ 40-75 và có ĐTĐ
. Nguy cơ BTMXV 10 năm ³7,5%
4.1. Thay đổi lối sống[3,5]
Cân nặng và hoạt động thể lực
Quá cân khi BMI ≥25 kg/m2 và <30 kg/m2; béo phì khi BMI ≥30kg/m2. Béo bụng với người châu Á khi vòng eo ở nam ≥ 90 cm, ở nữ ≥ 80 cm.
Quá cân, béo phì, béo bụng góp phần gây RLLM. Do đó, giảm cân làm cải thiện lipid máu, hơn nữa còn tác động có lợi lên các YTNC BTMXV khác thường đi kèm trên các bệnh nhân này.
Cần khuyên bệnh nhân giảm thức ăn giàu năng lượng cũng như tăng tiêu thụ năng lượng bằng tăng vận động thể lực để tổng năng lượng mỗi ngày âm 300-500 kcal.
Nên hoạt động thể lực 3-4 lần/tuần. mỗi lần trung bình 40 phút với cường độ thể lực trung bình, nặng
Rượu
Lượng rượu tối đa mỗi ngày mà không làm tăng triglyceride là 20-30g với nam, và 10-20g ở nữ. Đối với người tăng triglyceride, khuyến cáo bỏ rượu.
Thuốc lá
Ngưng hút thuốc lá có lợi rõ ràng trên nguy cơ tử vong toàn bộ BTMXV
Chế độ ăn
Lượng và loại lipid trong thức ăn
Tổng lượng lipid trong thức ăn nên khoảng 25-35% calo thu nhập. Khi lượng lipid >35% calo thu nhập thường liên quan đến tăng acid béo bão hòa và tăng calo thu nhập. Ngược lại, nếu lượng lipid quá thấp có nguy cơ làm giảm hấp thu vitamin E và các acid béo thiết yếu, góp phần làm thay đổi bất lợi trên HDL.
Loại lipid trong thức ăn
. Cơ thể người hấp thu lipid chủ yếu dưới dạng các acid béo tự do, và một phần nhỏ hơn là cholesterol
. Lượng acid béo bão hòa nên < 6 % calo thu nhập
. Lượng acid béo chuyển hóa <1% calo thu nhập
. Lượng cholesterol trong chế độ ăn lý tưởng nên < 150mg/ngày
. Nên ăn loại chứa nhiều acid béo không bão hòa đơn và acid béo không bão hòa đa n-3, n-6 (omega-3, omega-6)
. Lượng acid béo không bão hòa đa n-6 nên < 10% calo thu nhập
Bảng 3. Loại lipid và ảnh hưởng lên chuyển hóa, tim mạch[6]
|
Loại lipid |
Ảnh hưởng lên chuyển hóa |
Ảnh hưởng lên tim mạch |
|
Acid béo bão hòa (SFA: saturated fatty acids) |
-Tăng HDL-C và LDL-C -Có thể thúc đẩy tạo huyết khối |
-Tăng tỷ lệ bệnh ĐMV -Có thể tăng nguy cơ ung thư tiền liệt tuyến, đại tràng |
|
Acid béo không bão hòa đơn (MUFA: monounsaturated fatty acids) |
-Giảm LDL-C nhẹ -Tăng HDL-C -Có thể cản trở quá trình oxy hóa |
-Có thể giảm thấp bệnh ĐMV |
|
Acid béo không bão hòa đa n-3 (PUFA: polyunsaturated fatty acids) |
-Có thể giảm tạo huyết khối -Quan trọng trong phát triển võng mạc và não |
-Tăng tỷ lệ n-3/n-6 có thể giảm tỷ lệ bệnh ĐMV -n-3 có thể tăng trọng lượng sinh -Có thể ngừa đột tử tim |
|
Acid béo không bão hòa đa n-6 (PUFA: polyunsaturated fatty acids) |
-Acid arachidonic, chất quan trọng trong viêm |
-Có thể giảm bệnh ĐMV -Lượng nhiều có thể sinh ung thư |
|
Acid béo chuyển hóa (trans fatty acids) , chủ yếu từ hydrogen hóa PUFA trong công nghiệp thực phẩm |
-Tăng LDL-C -Giảm HDL-C -Tăng Lp(a) -Cản trở chuyển hóa PUFA |
-Tăng tỷ lệ bệnh ĐMV |
Carbonhydrate trong chế độ ăn
Lượng carbonhydrate nên chiếm khoảng 45-55% calo thu nhập. Khuyến khích ăn nhiều rau, trái cây, hạt, và ngũ cốc nguyên hạt.
Lượng đường cần giảm < 10%. Hạn chế các loại nước ngọt. Cần tiết chế chặt chẽ hơn với bệnh nhân có tăng cân hay tăng triglyceride máu.
Protein
Nên ăn các loại thịt trắng, thịt nạc,gia cầm, cá
Hạn chế thịt đỏ
Chất xơ
Những thực phẩm nhiều chất xơ hòa tan thường được dung nạp tốt, có hiệu quả giảm LDL-C. Liều khuyến cáo 5-15 g chất xơ hòa tan mỗi ngày.Để điều trị tốt mỡ máu, chế độ ăn cần 25-40g chất xơ, tối thiểu 7-13 g chất xơ hòa tan.
Nên ăn theo chế độ DASH (Dietary Approaches to Stop Hypertension)
|
Bảng 4. Chế độ ăn DASH cho người có nhu cầu 2100 calo/ngày |
|||
|
Tổng lượng mỡ
|
27% calo |
Natri |
2300 mg |
|
Mỡ bão hòa
|
6% calo |
Kali |
4700 mg |
|
Protein |
18% calo |
Calcium |
1250 mg |
|
Carbonhydrate |
55% calo |
Magne |
500 mg |
|
Cholesterol |
150 mg |
Chất xơ |
30 g |
4.2. Thuốc hạ lipid máu[2,3,5,7]
4.2.1. Statin
Tác dụng trên lipid máu
. Giảm LDL-C: 20-60%
. Giảm triglyceride: 10-33%
. Tăng HDL-C: 5 – 10%
Những tác động khác của statin
. Cải thiện mức độ rối loạn dãn mạch do nội mô
. Chống huyết khối
. Giảm viêm mạch máu
. Giảm tăng sinh cơ trơn mạch máu
. Làm ổn định mảng xơ vữa
Chỉ định statin
Statin có chỉ định bắt buộc trong 4 nhóm (xem các bước chẩn đoán)
. Bệnh nhân có BTMXV lâm sàng
. Bệnh nhân có LDL-C ³190 mg/dL
. Bệnh nhân có trong nhóm tuổi từ 40-75 và có ĐTĐ
. Nguy cơ BTMXV 10 năm ³7,5%
Statin có thể được sử dụng khi
. LDL-C ³160 mg/dL
. Tăng lipid máu di truyền
. Tiền căn gia đình có BTMXV lâm sàng sớm: nam < 55 tuổi, nữ <65 tuổi
. CRP siêu nhạy ³2 mg/L
. Điểm vôi hóa mạch vành ³300 đơn vị Agatston hay ³75% theo tuổi, giới, chủng tộc
. ABI (chỉ số huyết áp cổ chân- cánh tay) < 0,9
. Nguy cơ BTMXV lâu dài cao
Các thuốc statin (bảng 5)
Bảng 5. Các thuốc statin
|
Đặc điểm |
Atorvas |
Fluvas |
Lovas |
Pravas |
Rosuvas |
Simvas |
|
↓ LDL theo liều |
38 – 54 % (10 – 80) |
17 – 33 % (20 – 80) |
29 – 48 % (20 – 80) |
19 – 40 % (10 – 40) |
52 – 63 % (10 – 40) |
28 – 48 % (10 – 80) |
|
Thời gian bán hủy |
15 – 30 |
0.2 – 2.3 |
2.9 |
1.3 – 2.8 |
19 |
2 – 3 |
|
Ảnh hưởng của thức ăn |
Không |
Có |
↑ hấp thu |
↓ hấp thu |
Không |
Không |
|
Thời gian dùng thuốc |
Tối |
Đi ngủ |
Vào bữa ăn |
Ngủ |
Bất kỳ |
Tối |
Chiến lược dùng statin (bảng 6)
Chiến lược dùng statin dựa trên mức độ làm giảm LDL-C máu
. Statin mạnh: liều uống hàng ngày làm giảm trung bình LDL-C ³50%
. Statin trung bình: liều uống hàng ngày làm giảm trung bình LDL-C 30% -50%
. Statin yếu: liều uống hàng ngày làm giảm trung bình LDL-C < 30%
Bảng 6. Chiến lược dùng statin[3]
|
Statin mạnh |
Statin trung bình |
Statin yếu |
|
Atorvastatin (40)-80mg Rosuvastatin 20(40)mg |
Atorvastatin 10(20)mg Rosuvastatin(5) 10 mg Simvastatin 20-40mg Pravastatin 40 (80)mg Lovastatin 40 mg Fluvastatin XL 80mg Fluvastatin 40mg bid Pitavastatin 2-4 mg |
Simvastatin 10 mg Pravastatin 10-20mg Lovastatin 20 mg Fluvastatin 20-40mg Pitavastatin 1mg |
Thuốc, liều dùng in nghiêng là được cục quản lý thuốc và dược phẩm Hoa kỳ cho phép nhưng chưa được kiểm chứng trong các nghiên cứu thử nghiệm kiểm chứng ngẫu nhiên
Chiến lược sử dụng statin theo từng trường hợp cụ thể
. Bệnh nhân có BTMXV lâm sàng
– Trường hợp tuổi £75, statin mạnh (trung bình nếu không thích hợp)
– Trường hợp tuổi > 75 hay không thích hợp statin mạnh®statin trung bình
. Bệnh nhân có LDL-C ³190 mg/dL
– Statin mạnh (trung bình nếu không thích hợp)
. Bệnh nhân có trong nhóm tuổi từ 40-75 và có ĐTĐ
– Statin trung bình
– Nguy cơ BTMXV 10 năm ³7,5% ®statin mạnh
. Nguy cơ BTMXV 10 năm ³7,5%
– Statin trung bình- mạnh
Trường hợp bệnh nhân có chỉ định dùng statin mạnh, nhưng có một trong số các yếu tố sau cần xem xét chọn statin trung bình
. Tuổi > 75
. Tình trạng hay tương tác thuốc làm giảm độ an toàn của statin
. Tiền căn không dung nạp statin
Tác dụng phụ
. Đau cơ, có thể chuyển thành bệnh cơ (tăng creatine kinase), nếu không điều trị dẫn đến viêm cơ/ly giải cơ vân. Nguy cơ bị tác dụng phụ này tăng khi phối hợp với gemfibrozil, niacin, erythromycin, kháng nấm azoles (ức chế CYP3A4)
. Nhức đầu, chướng bụng, đau bụng, buồn nôn, táo bón/tiêu chảy, nổi mẩn đỏ (thường gặp nhất)
. Tăng các chỉ số chức năng gan (AST, ALT, CK, phosphatase kiềm, bilirubine toàn phần)
Khởi trị statin
Trước khi khởi trị statin
. Kiểm tra bilan lipid máu
. Kiểm tra các nguyên nhân thứ phát gây tăng lipid máu
. ALT. Khi ALT > 3 lần ngưỡng: không điều trị statin, kiểm tra bệnh gan mật, kiểm tra lại ALT
. CK (khi bệnh nhân có tiền căn không dung nạp statin hay có bệnh cơ). Khi CK >5 lần ngưỡng: không điều trị statin, kiểm tra bệnh cơ, kiểm tra lại CK
. Các nguy cơ tổn thương cơ
Bảng 7. Các yếu tố nguy cơ tổn thương cơ[8]
|
Yếu tố nội sinh |
Yếu tố ngoại sinh |
|
-Tuổi > 80 -Phụ nữ -Chủng tộc châu Á -BMI thấp -Tiền căn đau gân, cơ -Tiền căn tăng CK -ĐTĐ -Tiền sử gia đình đau cơ -Bệnh cơ do chuyển hóa -Bệnh thận nặng (eGFR £30ml/phút) -Bệnh gan mất bù cấp -Suy giáp -Men CYP có đa kiểu gen |
-Liều cao statin -Lạm dụng rượu -Dùng thuốc gây nghiện -Dùng thuốc hướng tâm thần -Phẫu thuật cần nhu cầu trao đổi chất lớn -Tập thể dục nặng và/hoặc không thường xuyên(thường biết yếu tố khởi kích) -Điều trị: amiodaron, thuốc kháng nấm nhóm azole, cyclosporin, fibrates, kháng sinh nhóm macrolide, nefazodone, acid nicotinic, ức chế protease, tacrolimus, verapamil, wafarin -Ăn nhiều bưởi |
Theo dõi khi điều trị statin
. 4-12 tuần sau khi khởi trị với statin hay khi điều chỉnh liều thuốc: kiểm tra bilan lipid máu
. 12 tuần sau khi khởi trị với statin hay khi tăng liều statin: kiểm tra ALT
. Hàng năm
– Kiểm tra lipid máu sau khi đã đạt mức LDL-C đích hay tối ưu
– Kiểm tra ALT, nếu ALT < 3 lần ngưỡng
. Kiểm tra CK khi đang điều trị statin mà bệnh nhân có bệnh cơ, đau cơ
. Kiểm tra bilan lipid máu bất kỳ khi bệnh nhân không dùng thuốc liên tục hay có những bệnh lý kèm theo có thể làm RLLM thứ phát
. Kiểm tra ALT bất kỳ khi bệnh nhân có các bệnh lý gan mật có thể làm tăng ALT
Theo dõi đáp ứng điều trị với statin
Đánh giá đáp ứng điều trị và tuân thủ điều trị. Đáp ứng với thuốc khi
.LDL-C giảm ³50% so với trước điều trị ở bệnh nhân đang dùng statin mạnh
. Nếu không có LDL-C trước đó, chọn mục tiêu đích là LDL-C < 100 mg/dL ở bệnh nhân đang dùng statin mạnh
. LDL-C giảm từ 30% đến < 50% so với trước điều trị ở bệnh nhân đang dùng statin trung bình
.Nồng độ LDL-C và phần trăm giảm LDL-C không phải là tiêu chuẩn điều trị, chỉ dùng để đánh giá đáp ứng và tuân thủ điều trị.
*Trường hợp bệnh nhân đáp ứng với điều trị
. Tiếp tục điều trị cùng loại và liều lượng statin đã cho trong 3-12 tháng
. Xem xét giảm liều statin khi LDL-C hai lần thử liên tiếp < 40 mg/dL
. Ngưng statin khi LDL-C < 20 mg/dL
*Trường hợp bệnh nhân không đáp ứng với điều trị
. Kiểm tra tình trạng không dung nạp với liều statin theo khuyến cáo
– Bệnh nhân có cùng lúc nhiều bệnh nặng, phối hợp
– Rối loạn chức năng gan, thận
– Bệnh sử không dung nạp với statin, hay có bệnh cơ
– ALT tăng trên 3 lần ngưỡng
– Sử dụng đồng thời thuốc gây tương tác hay ảnh hưởng đến chuyển hóa statin
– > 75 tuổi
Äcần giảm thành statin loại trung bình. Chọn liều statin tối ưu mà không gây tác dụng phụ. Nên chọn statin có tác dụng hạ LDL-D mạnh mà không cần liều điều trị cao
§Nếu không có tình trạng không dung nạp
– Kiểm tra tuân thủ điều trị: thuốc, tích cực thay đổi lối sống
– Loại trừ nguyên nhân RLLM thứ phát
– Theo dõi lipid máu sau 4-12 tuần, nếu không đạt đáp ứng điều trị
¨ Tăng liều statin
¨ Hay xem xét thêm thuốc hạ lipid nhóm khác
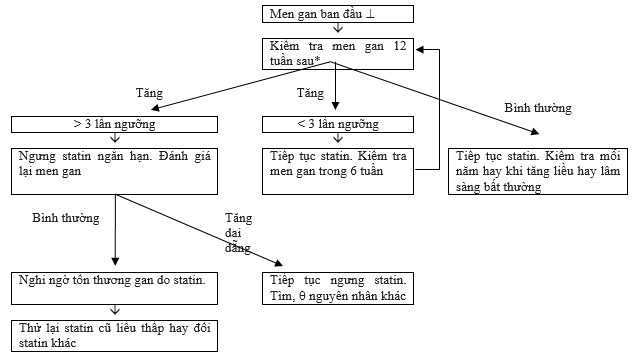
Xử trí tăng men gan ở bệnh nhân đang dùng statin
F< 3 lần ngưỡng
§Tiếp tục điều trị
§Kiểm tra lại trong 6 tuần
F≥3 lần ngưỡng
§Ngưng statin, kiểm tra lại trong 6 tuần
§Nếu ALT trở về bình thường, cho lại statin, chú ý hạn chế tác dụng phụ[7,8]
– Statin mạnh với liều thấp
– Đổi thuốc sang loại statin ít tác động lên CYP3A4 (rosuvastatin)
– Uống cách ngày (rosuvastatn) hay tuần 2 lần (atorvastatin)
Sơ đồ 2. Theo dõi men gan khi điều trị statin[7]
Xử trí tăng CK ở bệnh nhân đang dùng statin
. Trường hợp CK >5 lần ngưỡng
– Ngừng điều trị, kiểm tra chức năng thận và theo dõi CK mỗi 2 tuần
– Đánh giá CK có tăng do nguyên nhân khác như gắng sức cơ
– Xem xét bệnh cơ nếu CK vẫn còn tăng
. Trường hợp CK ≤5 lần ngưỡng
– Nếu không có triệu chứng tổn thương cơ, tiếp tục dùng statin (hướng dẫn bệnh nhân theo dõi biểu hiện bệnh cơ, kiểm tra CK sau đó)
– Nếu có triệu chứng bệnh cơ, theo dõi triệu chứng và CK đều đặn.
4.2.2. Các thuốc điều trị RLLM khác
Các thuốc điều trị RLLM khác (trừ statin) chỉ nên sử dụng trong các trường hợp sau:
. Không đạt đích điều trị hạ LDL-C khi đã dùng liều statin tối ưu dung nạp được. Sử dụng các thuốc lipid này cần phối hợp cùng với statin
. Không dung nạp với statin
. Tăng triglyceride ³500 mg/dL
Trường hợp statin liều tối ưu không đạt đích điều trị
. Kết hợp statin với thuốc ức chế hấp thu cholesterol
. Kết hợp statin với tách acid mật
. Kết hợp statin với acid nicotinic
Trường hợp không dung nạp statin
. Tách acid mật
. Acid nicotinic
. Thuốc ức chế hấp thu cholesterol, đơn độc hay phối hợp với tách acid mật.
Trường hợp tăng triglyceride ³500 mg/dL
Tăng triglyceride là nguyên nhân gây 10% viêm tụy cấp
Tiết chế calo và lượng mỡ (khuyến cáo 10%-15%), bỏ rượu và điều trị thuốc tích cực.
Hạ triglyceride bằng các thuốc
§Fibrate đơn độc khi không có chỉ định bắt buộc của statin
§Statin kèm fibrate khi có chỉ định bắt buộc của statin
4.2.2.1. Fibrate
Có 2 nhóm chính: fenofibrate và gemfibrozil
FFenofibrate
Tác dụng
. Làm giảm triglyceride: 41 – 53%.
. Làm tăng HDL: 5 – 20%
. Làm giảm LDL-C: 6 – 20%
Chỉ định
Có thể dùng đồng thời với statin loại trung bình- thấp khi không đáp ứng với statin đơn độc
. Cần thận trọng khi dùng statin và fibrate cùng lúc với các thuốc chuyển hóa qua cytochrome P450
. Nên cho fibrate buổi sáng và statin buổi tối để giảm thiểu nồng độ đỉnh
Khi triglyceride > 500 mg/dL
Liều dùng: 200mg/ ngày
Tác dụng phụ:Khó tiêu, đau bụng, mẩn đỏ, sỏi mật, tiêu chảy.
Tương tác thuốc: tăng độc tính của cyclosporine; tương tác warfarin, có thể làm tăng hoạt tính kháng đông
Khởi trị fibrate
. Theo dõi chức năng thận khi khởi trị
. Không nên cho fenofibrate nếu GFR < 30 ml/phút/1,73m2
Theo dõi khi điều trị fibate
. Theo dõi chức năng thận trong vòng 3 tháng sau khởi trị, mỗi 6 tháng sau đó
. Trường hợp 30 <GFR< 59 ml/phút/1,73m2, liều fenofibrate tối đa <54 mg/ngày
. Ngưng fenofibrate khi GFR < 30 ml/phút/1,73m2
FGemfibrozil
Tác dụng
. Làm giảm triglyceride: 35 – 50%.
. Làm giảm nhẹ LDL-C: 10-15%.
. Tăng HDL: 5 – 20%.
Liều dùng: 600 mg x 2 lần khi tăng triglycerid nặng
Tác dụng phụ:Khó tiêu, đau bụng, tiêu chảy.
Tương tác thuốc: tăng hoạt tính của warfarin
Không nên dùng đồng thời với statin do tăng nguy cơ hủy cơ vân
4.2.2.2 Tách acid mật
Tác dụng
. Làm giảm LDL-C: 15 – 30%
. Tăng triglyceride
. Không hay tăng nhẹ HDL-C
Chỉ định
. Không đạt đích điều trị hạ LDL-C khi đã dùng liều statin tối ưu dung nạp được. Sử dụng thuốc lipid này cần phối hợp cùng với statin
. Bệnh nhân có chỉ định dùng statin nhưng không dung nạp với statin
. Không cho tách acid mật khi triglyceride ³300mg/dL
Liều dùng
. Cholestyramine: 4 g x 2-6 lần/ ngày, uống khi ăn
. Colestipol: 5g x 2-6 lần/ ngày, uống khi ăn
Tác dụng phụ:táo bón, chướng bụng, đầy hơi, buồn nôn, đau thượng vị.
Tương tácquan trọng với amiodarone, digoxin, warfarin, statin, thiazides, ức chế beta, thyroxine, phenobarbital. Có thể làm kém hấp thu các vitamin tan trong dầu (A, D, E, K). Có thể tăng khuynh hướng chảy máu. Có thể làm giảm hấp thu nhiều thuốc khác, nên dùng thuốc khác 1 giờ trước hay 4 giờ sau
Theo dõi khi điều trị tách acid mật
. Theo dõi bilan lipid máu 3 tháng sau khởi trị, mỗi 6-12 tháng sau đó
. Trường hợp 250< triglyceride< 299 mg/dL
– Cẩn trọng khi cho tách acid mật
– Theo dõi sát bilan lipid máu trong 4-6 tuần sau
– Ngưng tách acid mật khi triglyceride > 400 mg/dL
4.2.2.3 Acid nicotinic
Tác dụng
. Làm tăng HDL (tác dụng rõ nhất của nhóm này): 15 – 35%
. Làm giảm LDL-C: 10 – 25%
. Giảm triglyceride: 25 – 30%.
Chỉ định
. Không đạt đích điều trị hạ LDL-C khi đã dùng liều statin tối ưu dung nạp được. Sử dụng thuốc lipid này cần phối hợp cùng với statin
. Bệnh nhân có chỉ định dùng statin nhưng không dung nạp với statin
. Acid nicotinic không nên cho khi
– ALT > 2 lần ngưỡng
– Triệu chứng da nặng, tăng đường huyết dai dẵng, gout cấp, đau bụng không giải thích được
– Rung nhĩ mới khởi phát hay sụt cân gần đây
Liều dùng
. 2000- 3000 mg/ngày chia làm 3 lần, uống trong bữa ăn
. Loại phóng thích nhanh có nhiều tác dụng phụ hơn loại phóng thích chậm, nhưng hiệu quả hạ LDL-C hơn và ít độc gan hơn
Tác dụng phụ
. Đỏ bừng da: ấm, ngứa phần trên cơ thể và nhức đầu có thể xảy ra với liều khởi đầu.
. Có thể cải thiện tác dụng đỏ bừng da bằng cách cho aspirin. Aspirin 325mg được cho nửa giờ trước khi dùng acid nicotinic, khởi đầu liều thấp và định chuẩn liều tăng lên.
. Rối loạn tiêu hóa.
. Độc gan, tăng đường huyết, tăng acid uric huyết.
Tương tácwarfarin (có thể làm tăng kháng đông).
Khởi trị acid nicotinic
. Kiểm tra AST,ALT, đường huyết đói, HbA1c, acid uric
Theo dõi khi điều trị acid nicotinic
. Kiểm tra AST,ALT, đường huyết đói, HbA1c, acid uric khi tăng liều thuốc, mỗi 6 tháng sau đó
4.2.2.4. Thuốc ức chế sự hấp thu cholesterol
Ezetimibe
Tác dụng
. Giảm LDL-C: 17%.
. Không đổi triglyceride và HDL-C.
Chỉ định
. Không đạt đích điều trị hạ LDL-C khi đã dùng liều statin tối ưu dung nạp được. Sử dụng thuốc lipid này cần phối hợp cùng với statin
. Bệnh nhân có chỉ định dùng statin nhưng không dung nạp với statin
Liều dùng: 10mg/ngày
Thử ALT trước khởi trị
Khi cùng dùng với statin, ngưng ezetimibe khi ALT > 3 lần ngưỡng
4.2.6. Acid béo không bão hòa đa n-3 (acid béo omega 3)
Những acid béo n-3 [eicosapentaenoic acid (EPA) and docosahexaenoic acid (DHA)] là thành phần chính của dầu cá
Tác dụng
. Làm tăng LDL: 4 – 49%
. Làm tăng HDL: 5 – 9%
. Giảm triglyceride: 29 – 45%.
Chỉ định: tăng triglycerid máu nên phối hợp cùng với fibrate
Liều dùng: 2-10 g/ngày, uống trong hay ngay sau ăn
Tương tácaspirin, clopidogrel
Tài liệu tham khảo
1. Peter WF Wilson,” Overview of the risk equivalents and established risk factors for cardiovascular disease”, Uptodate Nov 2013
2. JacquesGenest & PeterLibby: Lipoprotein Disorders and Cardiovascular Disease. In Braunwald’s heart disease: a textbook of cardiovascular medicine 9th W.B Saunders Company, 2012
3. ACC/AHA Guideline on the Treatment of Blood Cholesterol to Reduce Atherosclerotic Cardiovascular Risk in Adults: A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. http://circ.ahajournals.org . Circulation. 2013;00:000–000.
4. Robert S Rosenson,” Measurement of serum lipids and lipoproteins”, Uptodate Nov 2013
5. ESC/EAS Guidelines for the management of dyslipidaemias. European Heart Journal.2011; 32, pp. 1769–1818
6. Matthew W Gillman,”Dietary fat “, Uptodate Nov 2013
7. Neil J.Stone: drugs for elevated low-density lipoprotein cholesterol. In Antman. EM & Sabatine.MS: Cardiovascular Therapeutics: A Companion to Braunwald’s Heart Disease 4th. W.B Saunders Company, 2013: 975-984
8. www.RxFiles.ca. June 2013







