Như chúng ta đã biết, cơn đau thắt ngực hoặc tương đương cơn đau thắt ngực là triệu chứng mang bệnh nhân đến với bác sĩ lâm sàng.
TS BS NGÔ MINH HÙNG
Khoa Tim mạch Can thiệp – Bệnh viện Chợ Rẫy
Một số trong những bệnh nhân này sẽ được chỉ định chụp và/hoặc can thiệp mạch vành (can thiệp mạch vành qua da hoặc phẫu thuật bắc cầu nối chủ vành). Tuy nhiên, theo một công bố mới thực hiện năm 2018 trên 833.344 bệnh nhân đã được can thiệp mạch vành thì có đến 77,982 bệnh nhân nhân phải tái nhập viện trong 30 ngày đầu, trong đó có 43,9% bệnh nhân nhập viện vì lý do tim mạch. Mặc dù những tiến bộ rất lớn trong lĩnh vực chẩn đoán, điều trị nội khoa và các thủ thuật tái thông mạch, một số lượng lớn bệnh nhân và ngày càng tăng sẽ biểu hiện các triệu chứng bất lực do thiếu máu cơ tim cục bộ, trong khi đó sự kết hợp giữa thuốc chống đau thắt ngực thông thường và can thiệp mạch vành vẫn không hiệu quả nhiều trong việc giúp cải thiện triệu chứng. Những bệnh nhân này thường được gọi là đau thắt ngực tái phát hoặc đau ngực trơ với điều trị. Bởi vì sự đa dạng của các bệnh lý nền tảng cho nên việc xác định những bệnh nhân nào không thích hợp cho thủ thuật tái thông mạch và sử dụng các chiến lược y tế khác để kiểm soát triệu chứng là hết sức cần thiết. Tỷ lệ bệnh mới mắc đau thắt ngực trơ đã được ước tính khoảng 5% số bệnh nhân nói chung và 15% ở bệnh nhân đã trải qua chụp mạch vành và/hoặc can thiệp mạch vành. Bên cạnh các thuốc thông thường dùng để điều trị đau thắt ngực hay tương đương đau thắt ngực như đã biết, chúng ta còn có các thuốc như trimetazidine, ranolazine, nicorandil… Phân tử Trimetazidine (TMZ) đã ra đời hơn 40 năm qua và đã ít nhiều đóng góp vai trò không nhỏ của nó trong điều trị bệnh tim mạch. Bằng chứng gần đây còn cho thấy rằng TMZ có thể đóng một vai trò quan trọng trong bệnh tim mạch bên cạnh điều trị đau thắt ngực. TMZ có thể đảo ngược tình trạng suy tim, cải thiện triệu chứng bệnh động mạch ngoại vi, giảm tỉ lệ bệnh thận do thuốc cản quang, và ảnh hưởng tốt đến tổn thương do tái tưới máu gây ra. Mối quan ngại về Parkinson là điểm cần lưu ý khi sử dụng phân tử thuốc này.
CÁC CƠ CHẾ TÁC DỤNG KHẢ DĨ CỦA PHÂN TỬ TRIMETAZIDINE (TMZ):
Quá trình sản xuất năng lượng và sự cân bằng tại tế bào:
Quá trình oxy hóa bình thường ban đầu của các chất (ví dụ: axit béo và chất đường) tạo ra cơ chất chung cho chu trình Krebs, đó là acetyl-CoA. Sau đó quá trình oxy hóa sản xuất ra các chất thoái giáng tương đương NADH và FADH2. NADH và FADH2 vừa là chất chứa năng lượng tiềm tàng (NADH có thể cho 3 ATP và FADH2 có thể cho 2 ATP) vừa là những chuỗi vận chuyển các điện tử chính trong tế bào. Các electron được đưa vào các chuỗi vận chuyển electron, sau đó kết hợp các phản ứng oxy hóa khử để chuyển các điện tích dương vào bên trong tế bào tạo ra sự chênh lệch điện thế giữa bên trong với ngoài màng tế bào và thay đổi pH nội bào dẫn đến quá trình tổng hợp ATP từ men tổng hợp ATP (ATP synthetase) tại ti thể. Các kênh ion ở ti thể chọn lọc hay không chọn lọc với ion sử dụng năng lượng sẽ làm thay đổi cân bằng ion và thay đổi thể tích của mạng lưới ti thể. Sự thay đổi điện tích này phần nào được cân bằng bởi các kênh vận chuyển đối trọng H+ (hình 1) [15].
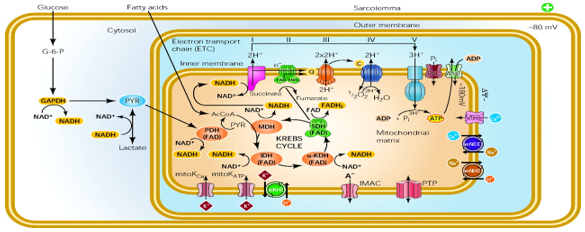
Hình 1: Tổng quan về việc phosphoryl oxy hóa trong các tế bào tim. (ANT: adenine nucleotide translocase; G-6-P, glucose-6-phốt phát; IMAC, kênh ion âm ở bên trong màng; MCU: kênh đơn vận Ca2+ của ti thể; MitoKCa: kênh K+ được kích hoạt bởi Ca2+ tại ti thể; MitoKATP: kênh K+ nhạy cảm với ATP tại ti thể; PIC: chất vận chuyển phosphate; PTP: cổng chuyển đổi tính thấm; PYR, pyruvate; KHE: Chất trao đổi K+/H+; NHE, Chất trao đổi Na+/H+; NCE, chất trao đổi Na+/Ca2+; IDH, isocitrate dehydrogenase; KDH, α-ketoglutarate dehydrogenase; MDH, malate dehydrogenase; PDH, pyruvate dehydrogenase; SDH, succinate dehydrogenase.
Một điểm quan trọng cần nhớ là các kênh ion bảo vệ và phá hủy ti thể tham gia vào các quyết định sự sống và chết của cả tế bào. Sự kích hoạt của hai kênh bảo vệ K+ (mitoKATP và mitoKCa) đã được chứng minh là có thể bảo vệ cơ tim chống lại tình trạng thiếu máu cục bộ và ảnh hưởng do tổn thương, trong khi sự mở cửa của kênh PTP hoặc IMAC có thể dẫn đến sự sụp đổ (hoặc dao động) của điện thế màng ti thể (ΔΨm). Ngoài ra các kênh bảo vệ còn có vai trò ngăn cản kênh PTP mở. Điều này có thể xảy ra hoặc là do kết quả của ức chế của các yếu tố gây ra mở PTP (ví dụ: ROS, Ca2+) hoặc do tương tác vật lý trực tiếp với phức hợp protein PTP (hình 2) [15].
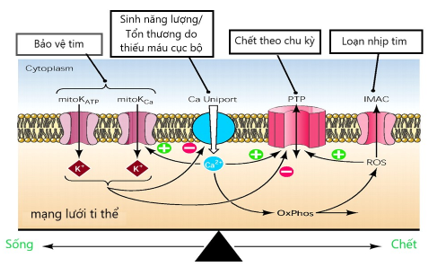
Hình 2: Các kênh ion của ti thể phá hủy hoặc bảo vệ [15]
Ức chế con đường oxy hóa beta của acid béo tự do:
Oxy hóa acid béo tự do (FFA) là nguồn năng lượng cơ bản của tế bào cơ tim, chiếm khoảng 60 – 90%, phần còn lại là do đường phân tạo ra [6]. Mặc dù cùng tạo ra số lượng adenosine triphosphate, việc oxy hóa a-xít béo tự do tiêu tốn thêm một lượng oxy từ 10% – 15%, điều mà được xem là bất lợi trong điều kiện thiếu máu cục bộ, nhất là khi thiếu máu cục bộ do giảm dòng chảy [9]. TMZ đã được công nhận rộng rãi như là thuốc bảo vệ tế bào, điều hòa chuyển hóa tế bào, kích thích việc oxy hóa đường hiệu quả hơn ở tế bào cơ tim trong trường hợp thiếu máu cục bộ do giảm lưu lượng thông qua việc ức chế bán phần oxy hóa a-xít béo. TMZ ức chế hoạt tính của men 3-ketoacyl CoA thiolase, đây là men chịu trách nhiệm cho giai đoạn cuối của quá trình beta oxy hóa acyl béo (Hình 3). Để làm được như vậy, TMZ tạo ra một sự dịch chuyển năng lượng theo phương thức hóa sinh để thực hiện quá trình đường phân qua đó duy trì việc tạo năng lượng trong khi vẫn tiết kiệm oxy [9].
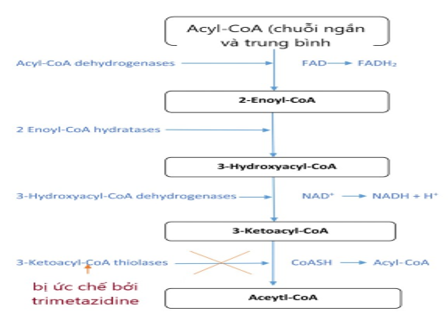
Hình 3: Tác dụng của TMZ trên con đường beta oxy hóa a-xít béo
Gia tăng hoạt động của men Pyruvate dehydrogenase:
Trimetazidine được biết như là chất làm tăng hoạt động của men pyruvat dehydrogenase, một thành phần của phức hợp pyroruvate dehydrogenase [1],[7],[9]. Thông qua cơ chế này, nó tạo điều kiện cho sự chuyển dạng của pyruvat thành acetyl Co-A, qua đó kết nối quá trình đường phân với chu trình a-xít citric qua NADH (nicotinamide adenine dinucleotide hydride). Các nhà nghiên cứu thừa nhận rằng tác dụng trên ti thể ở tế bào cơ tim giúp kích thích tổng hợp adenosine triphosphate thông qua việc vận chuyển ion can-xi ở ti thể giúp cho TMZ phát huy hiệu quả dược học của mình [8].
Ức chế tổn thương do tái tưới máu:
Nghiên cứu mới đây đã cho thấy TMZ làm tăng microRNA-21 [21]. Tăng biểu hiện microRNA-21 làm điều chỉnh tăng các hoạt động phát tín hiệu của AKT dẫn đến giảm tỷ lệ bax/bcl-2 và cũng giảm biểu hiện của caspase-3, kết quả cuối cùng là giảm chết tế bào do giảm oxy hoặc do tái tưới máu gây ra [21]. Ngoài ra, TMZ có thể bảo vệ tế bào cơ tim khỏi tổn thương sau nhồi máu cơ tim cấp tính thông qua việc tăng cường sức đề kháng của các mạng cơ tương [17],[18]. Thông thường, sau khi phục hồi lưu lượng máu trong nhồi máu cơ tim cấp, mạng cơ tương bị tiếp xúc với đáng kể với các chấn thương cơ học của dòng chảy dẫn đến phù mô mềm. Bằng cách tăng sức đề kháng mạng cơ tương, TMZ bảo vệ các tế bào khỏi chết chu kỳ tiềm ẩn và hậu quả rối loạn chức năng thất [17],[18].
Ức chế xơ hóa cơ tim:
Trimetazidine có thể trực tiếp ức chế quá trình xơ hóa cơ tim. Thuốc này giúp giảm tích tụ collagen, yếu tố phát triển mô liên kết ở nguyên bào sợi cơ tim, nồng độ men oxy hóa NADP (nicotinamide adenine dinucleotide phosphate-oxidase: NADP), và sản xuất các gốc oxy phản ứng [11]. Các cơ chế trên cũng được cho là để giải thích những tác động có lợi của thuốc này trong bệnh cảnh suy tim sung huyết.
TRIMETAZIDINE LÀ THUỐC ĐIỀU TRỊ CHỐNG ĐAU THẮT NGỰC
Vai trò của TMZ được công nhận và thiết lập nhiều nhất trong lĩnh vực nội tim mạch là điều trị đau thắt ngực. Các thuốc thông thường trong điều trị đau thắt ngực như ức chế beta, ức chế kênh can-xi, và các nitrate đóng vai trò quan trọng trong thực hành lâm sàng trong việc cải thiện triệu chứng cho bệnh nhân bệnh động mạch vành ổn định. Tuy nhiên, các thuốc vừa kể trên không thể tránh khỏi các tác dụng ngoại ý trên huyết động, điển hình là làm thay đổi huyết áp và nhịp tim. Ngược lại, sở hữu cơ chế tác dụng riêng và duy nhất, TMZ có rất ít ảnh hưởng trên huyết động [12]và vì vậy nó là thuốc thích hợp cho những bệnh nhân nhạy cảm đối với những biến đổi về mặt huyết động. Một số lượng lớn các nghiên cứu lâm sàng đã đánh giá hiệu quả điều trị đau thắt ngực của TMZ cả trên đơn trị và đa trị.
Đơn trị với Trimetazidine
Trong một nghiên cứu mù đôi, so sánh với giả dược được thực hiện bởi Passeron [16]trên109 bệnh nhân, TMZ đã làm giảm đáng kể số cơn đau thắt ngực từ 8,1 ± 0,3 xuống 2,9 ± 0,5 cơn mỗi tuần. Hơn nữa, số lượng thuốc nitroglycerin trong số những người tham gia nghiên cứu trong một tuần cũng giảm hơn 50% từ 9,1 ± 0,6 xuống 3,1 ± 0,5 viên [16]. Trong các nghiên cứu so sánh với các thuốc điều trị đau thắt ngực thông thường, TMZ cũng đã chứng minh kết quả tương đương. Trong một nghiên cứu đa trung tâm, mù đôi thực hiện bởi Koylan và cộng sự [10], tác dụng của TMZ đã được đánh giá so với diltiazem trên khả năng gắng sức ở 116 bệnh nhân có đau thắt ngực. Bệnh nhân đã được ngẫu nhiên nhận TMZ (20 mg, ba lần mỗi ngày) hoặc diltiazem (60 mg, ba lần mỗi ngày) cho một giai đoạn điều trị 4 tuần sau khi trải qua giai đoạn điều trị giả dược 2 tuần. Cả hai loại thuốc đều cho thấy có hiệu quả đáng kể trong việc giảm đáng kể số cơn đau thắt ngực và số viên nitrat dùng mỗi tuần, song song với sự cải thiện tình trạng đau thắt ngực là cải thiện tối đa giảm độ chênh xuống của đoạn ST qua gắng sức bằng thảm lăn [10]. Tuy nhiên, trong khi diltiazem gây kéo dài khoảng PR và thời gian phức bộ QRS (P= 0,039) trên ECG, tác dụng này đã không ghi nhận ở các bệnh nhân sử dụng TMZ [10]. Trong một nghiên cứu đa trung tâm (phân nhóm song song và mù đôi), trên 149 bệnh nhân có đau thắt ngực ổn định, TMZ (20 mg, ba lần mỗi ngày), so với propranolol (40 mg, ba lần mỗi ngày), đã cho thấy hiệu quả tương tự trên chống đau thắt ngực, thời gian gắng sức, và thời gian để đoạn ST chênh xuống 1 mm trên ECG [5].
Điều trị kết hợp với Trimetazidine
Việc sử dụng TMZ như một loại thuốc điều trị kết hợp đã được chứng minh rằng đây là một lựa chọn hấp dẫn cho các bệnh nhân đã sử dụng thuốc nhóm đầu tiên mà triệu chứng vẫn chưa được kiểm soát hoặc những bệnh nhân có nhạy cảm huyết động. Hiệu quả của TMZ trên nền đang điều trị bởi ức chế beta và chặn kênh can-xi đã được nghiên cứu.
Trimetazidine kết hợp với ức chế beta
Nghiên cứu TACT (TheTrimetazidineinAnginaCombinationTherapy:TACT)là một nghiên cứu ngẫu nhiên, đa trung tâm, có sử dụng đối chứng giả dược được thực hiện trên 177 bệnh nhân có đau thắt ngực ổn định để đánh giá hiệu quả và tính phù hợp của TMZ kết hợp với các thuốc có tác dụng trên huyết động (ức chế beta hoặc nitrates tác dụng dài) [2]. Bệnh nhân đã được điều trị ngẫu nhiên với TMZ (20 mg, ba lần mỗi ngày) hoặc giả dược uống trong 12 tuần. Sau 12 tuần điều trị, thời gian gắng sức tăng 89s ở nhóm TMZ vs 23,6s ở nhóm giả dược (P< 0,05). Thời gian để đoạn ST trên điện tâm đồ chênh xuống 1 mm tăng 90 s ở nhóm TMZ so với 16,7s ở nhóm giả dược (P<0,05). Thời gian để khởi phát của cơn đau tăng đến 100s ở nhóm TMZ so với 21,3s ở nhóm giả dược (P< 0,005). Số lượng trung bình các cơn đau thắt ngực hằng tuần giảm từ 5,6 ± 0,6 xuống còn 2,7 ± 0,5 ở nhóm TMZ so với 6,8 ± 0,7 xuống 5,1 ± 0,7 ở nhóm giả dược (P< 0,05), và số lượng viên nitrate tiêu thụ cũng giảm có nghĩa trong tuần từ 5,2 ± 0,9 xuống còn 2,8 ± 0,8 ở nhóm TMZ so với 5,5 ± 0,8 xuống 4,1 ± 0,9 ở nhóm giả dược [2].
Nghiên cứu TRIMPOL II (The TRIMetazidine inPOLand:TRIMPOL)là nghiên cứu giả dược, mù đôi có đối chứng, trên 426 bệnh nhân với đau thắt ngực ổn định [19]. Nghiên cứu đã cho thấy rằng việc bổ sung thêm các TMZ (60 mg/ngày) vào liệu pháp đang trị metoprolol (50 mg/ngày), trong một khoảng thời gian 12 tuần, cải thiện đáng kể tổng số thời gian gắng sức (+20,1s, P < 0,023), thời gian đến biểu hiện đoạn ST chênh xuống 1 mm trên ECG (+33,4s, p < 0,003), thời gian để phát cơn đau thắt ngực (+33,9s, p< 0,001), và giảm đáng kể số cơn đau thắt ngực và số lượng nitrate tác dụng ngắn mỗi tuần trong khi tác dụng phụ ghi nhận rất ít [19].
Các nghiên cứu lớn nhất, như nghiên cứu đau thắt ngực VASCO (VASCO-angina study), là một nghiên cứu ngẫu nhiên mù đôi có đối chứng giả dược được thực hiện trong 12 tuần nhằm đánh giá hiệu quả chống đau thắt ngực và an toàn của hai liều TMZ MR (TMZ 70mg/ngày, TMZ 140 mg/ngày) trên 645 bệnh nhân có triệu chứng với đau thắt ngực ổn định mãn tính trên nền đang điều trị atenolol [20]. So với điều trị cơ bản, trong toàn bộ đoàn hệ bệnh nhân trong nghiên cứu có đau thắt ngực ổn định mãn tính, TMZ cải thiện đáng kể tổng thời gian gắng sức (TMZ: 6 ± 23%; giả dược: 0,7 ± 5%; giá trị t: -2,689; giá trị P< 0,0074) với những cải thiện tương tự trong tổng thời gian gắng sức ở cả hai nhóm điều trị với TMZ (TMZ 70 mg/ngày: 5,3 ± 20%, P < 0,0338; TMZ 140 mg/ngày: 6,8 ± 20%, P < 0.0044) [20]. Cải thiện thời gian gắng sức ở nhóm bệnh nhân sử dụng liều TMZ 140 mg/ngày nhiều hơn nhóm bệnh nhân sử dụng liều TMZ 70 mg/ngày, tuy nhiên, sự khác biệt không đáng kể [20].
Trimetazidine kết hợp với các thuốc chặn kênh canxi
Trong một nghiên cứu mù đôi, ngẫu nhiên, có đối chứng với giả dược trong thời gian 4 tuần, được thực hiện bởi Manchanda và cộng sự [13]trên 64 bệnh nhân có đau thắt ngực ổn định không kiểm soát được với diltiazem, so sánh với giả dược, có cải thiện ròng với TMZ có nghĩa thống kê trên số cơn đau thắt ngực (4,8/tuần; P< 0,002); thời gian gắng sức đến khi có biểu hiện chênh xuống hơn 1mm của đoạn ST trên ECG là 94,2s (p< 0,05), thời gian để khởi phát của đau thắt ngực khi gắng sức là 113,1s (p< 0,02); và cải thiện điểm chuyển hóa tối đa trung bình khi thực hiện gắng sức là 1,4 METs (P< 0,05). Trong một nghiên cứu tiếp theo các nhà nghiên cứu sử dụng diltiazem liều thấp hơn (90 mg/ngày), lợi ích tương tự đã được chứng minh [14]. So với giả dược, TMZ giúp cải thiện có ý nghĩa thời gian gắng sức đến khi có biểu hiện chênh xuống hơn 1mm của đoạn ST trên ECG 128s (P< 0,01); số điểm gắng sức trên thảm lăn duke trung bình 57,4% (P< 0,02); số cơn đau thắt ngực 5,1 mỗi tuần (P< 0.01) [14].
Các phân tích gộp
Các kết quả có được từ đơn trị hay điều trị kết hợp đã được phân tích gộp. Trong một phân tích gộp 23 thử nghiệm trên 1378 bệnh nhân có đau thắt ngực ổn định được thực hiện bởi Ciapponi và cộng sự [3], TMZ giúp giảm số lượng các cơn đau thắt ngực hàng tuần (P< 0,0001) và số lượng viên nitroglycerin sử dụng hàng tuần (P< 0,0001) và cũng cải thiện thời gian gắng sức cho tới khi biến đổi chênh xuống hơn 1mm của đoạn ST trên ECG (P < 0,0002), so với giả dược. Trong phân tích gộp lớn nhất được thực hiện bởi Danchin và cộng sự [4]đã đánh giá 218 thử nghiệm với tổng số 19 028 bệnh nhân, TMZ cải thiện đáng kể khả năng dung nạp với gắng sức, số cơn đau thắt ngực hàng tuần, và số lượng nitrate tác dụng ngắn sử dụng khi so sánh với giả dược.
Kết luận:
Trimetazidine, một thuốc chống đau thắt ngực độc đáo và có giá trị, là một thuốc hấp dẫn và có tiềm năng to lớn thay thế hay bổ sung cho các thuốc quy ước, đặc biệt là trong số những bệnh nhân có nhạy cảm biến đổi huyết động. Với cơ chế như đã trình bày, thuốc này cho thấy khả năng bảo vệ tế bào cơ tim khi tái tưới máu trở lại sau tình trạng thiếu máu cục bộ lâu dài hay cấp tính. Qua các phân tích gộp từ các thử nghiệm hồi cứu cho thấy thuốc có lợi ích cải thiện tử vong tim mạch cho bệnh nhân suy tim mãn tính. Cần tiếp tục nghiên cứu trong tương lai bằng các nghiên cứu ngẫu nhiên mù đôi với cở mẫu lớn để đánh giá thêm ích lợi của trị liệu bằng thuốc này. Mặc dù hiếm, các bác sĩ cũng nên cảnh giác các nguy cơ tiềm tàng về các rối loạn vận động do thuốc này gây ra và chuyển bệnh nhân đến khám tại các bác sĩ thần kinh nếu các triệu chứng vẫn tồn tại quá 4 tháng.
TÀI LIỆU THAM KHẢO
1. Banach M (2006), “The role of trimetazidne in the treatment of heart diseases”. Poznan: Termedia Publishing House.
2. Chazov EI, LV, Zharova EA, Fitilev SB, Levin AM, Rumiantzeva EG, Fitileva TB, (2005), “Trimetazidine in Angina Combination Therapy—the TACT study: trimetazidine versus conventional treatment in patients with stable angina pectoris in a randomized, placebo-controlled, multicenter study”. Am J Ther, 12, 12:35–42.
3. Ciapponi A, PR, Harrison J, (2005), “Trimetazidine for stable angina”. Cochrane Database Syst Rev, 4, CD003614.
4. Danchin N, MM, Parkhomenko A, Ribeiro JP, (2011), “Ef?cacy comparison of trimetazidine with therapeutic alternatives in stable angina pectoris: a network meta-analysis”. Cardiology, 120, 59 –72.
5. Detry JM, SP, Pennaforte S, Cokkinos D, Dargie H, Mathes P, (1994), “Trimetazidine: a new concept in the treatment of angina. Comparison with propranolol in patients with stable angina. Trimetazidine European Multicenter Study Group. “. Br J Clin Pharmacol, 37, 279 –288.
6. Dyck JR, LG (2002), “Malonyl CoA control of fatty acid oxidation in the ischemic heart”. J Mol Cell Cardiol, 34, 1099-1109.
7. Fantini E, DL, Sentex E, Grynberg A, Athias P, “Some biochemical aspects of the protective effect of trimetazidine on rat cardiomyocytes during hypoxia and reoxygenation”. J Mol Cell Cardiol, 26, 949–958.
8. Guarnieri C, FC, Zini M, Muscari C, (1997), “Effects of trimetazidine on the calcium transport and oxidative phosphorylation of isolated rat heart mitochondria”. Basic Res Cardiol, 92, 90-95.
9. Kantor PF, LA, Kozak R, Lopaschuk GD, (2000), “The antianginal drug trimetazidine shifts cardiac energy metabolism from fatty acid oxidation to glucose oxidation by inhibiting mitochondrial long-chain 3-ketoacyl coenzyme A thiolase”. Circ Res, 86, 580-588.
10. Koylan N, BA, Adalet K, Mercanoglu F, Buyukozturk K, (2004), “Comparison of the effects of trimetazidine and diltiazem on exercise performance in patients with coronary heart disease”. Acta Cardiol 59, 644–650.
11. Liu X, GY, Liu F, Gao W, Zhang Y, Xu M, Li Z, (2010), “Trimetazidine inhibits pressure overload-induced cardiac ?brosis through NADPH oxidase–ROS–CTGF pathway”. Cardiovasc Res, 88, 150 –158.
12. Lopaschuk GD, BR, Thomas PD, Dyck JR, (2003), “Bene?cial effects of trimetazidine in ex vivo working ischemic hearts are due to a stimulation of glucose oxidation secondary to inhibition of long-chain 3-ketoacyl coenzyme a thiolase”. Circ Res, 93, e33–e37.
13. Manchanda SC, KS (1997), “Combination treatment with trimetazidine and diltiazem in stable angina pectoris”. Heat, 78, 353–357.
14. Manchanda SC, KS (1997), “Treatment of stable angina with low dose diltiazem in combination with the metabolic agent trimetazidine”. Int J Cardiol, 88, 83–89.
15. ORourke B, CS, Aon MA, (2005), “Mitochondrial Ion Channels: Gatekeepers of Life and Death”. Physiology, 20.
16. Passeron J “Effectiveness of trimetazidine in stable effort angina due to chronic coronary insuf?ciency. A double-blind versus placebo study”. Presse Med 1775–1778.
17. Ruixing Y (2007), “The role of trimetazidine in inhibiting cardiomyocyte apoptosis”. Arch Med Sci, 3(517-524).
18. Ruiz-Meana M, G-DD, Julia M, Gonzalez MA, Inserte J, Soler-Soler J, (1996), “Pre-treatment with trimetazidine increases sarcolemmal mechanical resistance in reoxygenated myocytes,”. Cardiovasc Res, 32, 587-592.
19. Szwed H, SZ, Elikowski W, Koronkiewicz A, Mamcarz A, Orszulak W, Skibin ska E, Szymczak K, Swiatek J, Winter M, (2001), “Combination treatment in stable effort angina using trimetazidine and metoprolol: results of a randomized, doubleblind, multicentre study (TRIMPOL II). TRIMetazidine in POLand”. Eur Heart J, 22, 2267–2274.
20. Vitale C, SI, Malorni W, Perrone-Filardi P, Volterrani M, Rosano GM, (2013), “Ef?cacy of trimetazidine on functional capacity in symptomatic patients with stable exertional angina—the VASCO-angina study”. Int J Cardiol, 168, 1078–1081.
21. Yang Q, YK, Li AY, (2015), “Trimetazidine protects against hypoxia-reperfusion-induced cardiomyocyte apoptosis by increasing microRNA-21 expression”. 8, 3735–3741.







