TS. Phạm Hữu Văn
9 Chẩn đoán phân biệt nhịp nhanh
9.1 Nhịp nhanh phức bộ QRS hẹp (≤120 ms)
Các phức hợp QRS hẹp là do kích hoạt nhanh các tâm thất thông qua hệ thống His – Purkinje (HPS), điều này cho thấy nguồn gốc của rối loạn nhịp tim nằm ở trên hoặc trong phạm vi bó His. Tuy nhiên, việc kích hoạt sớm bó His có thể xẩy ra trong VT vùng vách cao, do đó gây ra phức hợp QRS hẹp tương đối (110 -140 ms). [44]
9.1.1 Chẩn đoán phân biệt điện tâm đồ
Trong trường hợp không có ECG được ghi nhận trong nhịp nhanh, ECG 12 chuyển đạo ở nhịp xoang có thể cung cấp các manh mối để chẩn đoán SVT và nên được xem xét kỹ lượng cho bất kỳ sự bất thường nào. Sự hiện diện của kích thích sớm ở một bệnh nhân có tiền sử đánh trống ngực thường xuyên thường gợi ý AVRT. Sự vắng mặt của kích thích sớm rõ ràng không loại trừ chẩn đoán AVRT, vì nó có thể là do do đường phụ (AP) ẩn, dẫn truyền chỉ theo đường ngược hoặc đường không điển hình (Mahaim), tiềm ẩn ở nhịp xoang.
ECG được thực hiện trong nhịp tim nhanh rất hữu ích trong chẩn đoán hiệu quả SVT, mặc dù điều này có thể không dẫn đến chẩn đoán cụ thể. [45] Nó có thể không có khả năng ở những bệnh nhân có thời gian đánh trống ngực rất ngắn hoặc không thường xuyên.
9.1.1.1 Khởi đầu và kết thúc nhịp nhanh
Sự kéo dài đột ngột của khoảng PR xảy ra trong AVNRT điển hình sau một nhắt bóp ngoại vị nhĩ. Một AT cũng có thể được bắt đầu bằng một nhắt bóp ngoại vị nhĩ, nhưng không phụ thuộc vào sự kéo dài PR rõ rệt. AT tự động, ổ được đặc trưng bằng gia tăng từ từ (hiện tượng hâm nóng: warm up phenomenon) sau đó là giảm dần (hiện tượng lạnh xuống: cool down phenomenon), [46] và cũng có thể không liên tục với sự gián đoạn ngắn bằng nhịp xoang. Nhịp nhĩ sớm hoặc thất sớm có thể khởi kích AVRT. Các phức hợp tâm thất sớm là một tác nhân phổ biến của AVNRT không điển hình, nhưng hiếm khi gây ra AVNRT điển hình và chỉ AT đặc biệt.
9.1.1.2 Sự đều đặn của chiều dài chu kỳ nhịp nhanh
Cần đánh giá tính đều đặn của khoảng RR (Hình 1). Nhịp tim nhanh không đều có thể đại diện cho AT ổ hoặc AT đa ổ, AF ổ và cuồng nhĩ có dẫn truyền AV thay đổi. Đôi khi có thể tim thấy các mô hình bất thường đôi khi có thể được tìm thấy, chẳng hạn như trong cuồng nhĩ được dẫn truyền với chu kỳ Wenckebach. Rối loạn nhịp tim không đều, chẳng hạn như AT đa ổ, biểu hiện điển hình các hình thái sóng P thay đổi, các khoảng PP, RR và PR thay đổi. Cuồng nhĩ có thể có dẫn truyền AV cố định và biểu hiện như nhịp nhanh đều, và thậm chí AF có thể xuất hiện gần như đều khi rất nhanh. Nhịp nhanh vào lại, cho dù các vào lại lớn hoặc nhỏ, thường là đều. Nhịp tim nhanh không liên tục có thể được gọi là nhịp tim nhanh qua bộ nối vĩnh viễn (PJRT), AT ổ, hoặc, hiếm khi, AVNRT không điển hình. Chiều dài chu kỳ (CL) thay đổi luân phiên (còn gọi là RR thay đổi luân phiên) có thể được nhìn thấy trong AVNRT, nhưng những thay đổi này <15% chiều dài chu kỳ nhịp nhanh.[47] Nếu không đều vượt quá 15% của CL, nhiều khả năng rối loạn nhịp ổ.[48] Các QRS thay đổi luân phiên là hiện tượng hiếm gặp ở các SVT chậm, có thể không liên quan đến các thay đổi luân phiên của CL và đã được mô tả khởi đầu với AVRT.[49,50] Tuy nhiên, điều này có thể được nhìn thấy trong bất kỳ SVT nhanh nào. [51]
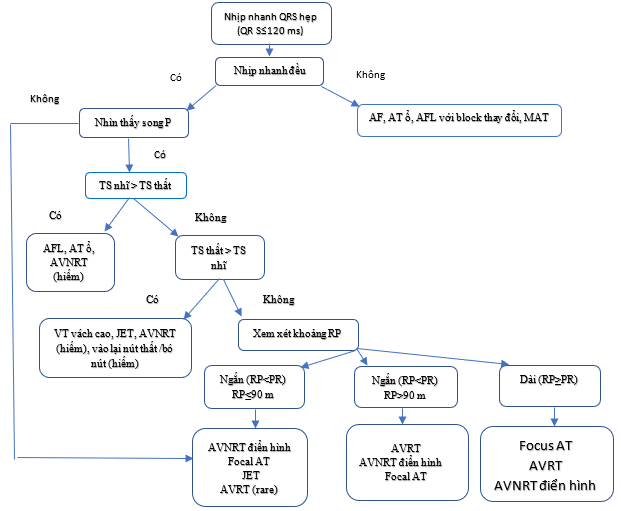
Hình 1. Chẩn đoán phân biệt của nhịp nhanh QRS hẹp. Cần ghi lại sóng P ngược bằng cách lấy Điện tâm đồ 12 chuyển đạo, nếu cần, sử dụng các chuyển đạo Lewis hoặc thậm chí là một chuyển đạo thực quản được nối với một chuyển đạo tiền thân (V1) bằng cách sử dụng kẹp cá sấu. Ngưỡng 90ms là một số khá tùy ý được sử dụng để đo điện tâm đồ bề mặt nếu có thể nhìn thấy sóng P và dựa trên dữ liệu hạn chế. Trong phòng thí nghiệm điện sinh lý, giới hạn của khoảng thất nhĩ là 70ms. Nhịp nhanh bộ nối lạc chỗ cũng có thể xuất hiện với sự phân ly nhĩ thất.
AF = rung tâm nhĩ; AT = nhịp nhanh nhõ; AV = nhĩ thất; AVNRT = nhịp nhanh vào lại nút nhĩ thất; AVRT = nhịp nhanh vào lại nhĩ thất; JET = nhịp nhanh bộ nối lạc chỗ; RP = khoảng RP; VT = nhịp nhanh thất. TS= tần số.
Thay đổi trong chiều dài chu kỳ tâm thất (CL) được đi trước bằng sự thay đổi ở chiều dài chu kỳ nhĩ được nhìn thấy trong AT hoặc AVNRT không điểu hình. Thay đổi trong CL thất đi trước thay đổi trong CL nhĩ liên tiếp ủng hộ AVNRT điển hình hoặc AVRT. [47,52] Một khoảng thất nhĩ cố định (VA) trong sự hiện diện của các khoảng RR biến đổi loại trừ AT. [45]
9.1.1.3 Liên hệ P/QRS
Theo mối quan hệ P / QRS của chúng, các SVT được phân loại là có khoảng thời gian RP ngắn hoặc dài. Các SVT RP ngắn là những SVT có khoảng thời gian RP ngắn hơn một nửa khoảng thời gian RR nhịp nhanh, trong khi các SVT RP dài hiển thị RP≥PR (Hình 1). Hiếm khi, ghi lại sóng U trong AVNRT điển hình có thể mô phỏng nhịp tim nhanh RP dài. [53]
Trên EPS, khoảng VA rất ngắn (≤70 ms) thường biểu thị AVNRT điển hình, hoặc ít gặp trong AT ổ, nhưng cũng đã được báo cáo trong AVRT. [54] Đối với các phép đo ECG bề mặt, khoảng thời gian giới hạn 90 ms đã được chứng minh là hữu ích và có thể được sử dụng nếu có thể nhìn thấy sóng P, [55] nhưng dữ liệu về các phép đo RP thực tế trong các các type SVT khác nhau là hiếm gặp.
Các sóng P tương tự như sóng xoang bình thường gợi ý nhịp xoang nhanh phù hợp hoặc không phù hợp, nhịp nhanh vào lại nút xoang, hoặc AT ổ phát sinh gần nút xoang. Các sóng P khác với sóng trong nhịp xoang và được dẫn với khoảng PR bằng hoặc dài hơn PR trong nhịp xoang, thường thấy trong AT ổ. Trong AT, dẫn truyền đến tâm thất có thể nhanh (1:1) hoặc chậm (3:1 hoặc 4:1). Khả năng cuồng nhĩ với dẫn truyền 2:1 cũng nên được xem xét nếu tốc độ tâm thất trong SVT là ∼150 b.p.m., vì hoạt động của tâm nhĩ thường là 250 – 330 b.p.m. Với sự hiện diện của thuốc chống loạn nhịp trong tình huống này, việc hạ thấp nhịp nhĩ có thể dẫn đến nhịp thất cao hơn trong trường hợp không có block nút AV.
Trong trường hợp dẫn truyền ngược tương đối chậm cho phép xác định sóng P ngược, hoạt động lệch hướng r giả ở chuyển đạo V1 và sóng S giả ở các chuyển đạo dưới thường gặp hơn trong AVNRT điển hình hơn so với AVRT hoặc AT. [56,57] Các tiêu chí này đặc hiệu (91-100%) nhưng độ nhạy cảm khiêm tốn (tương ứng 58 và 14%). [56] Sự khác biệt về khoảng RP trong chuyển đạo V1 và III > 20 ms cũng là dấu hiệu của AVNRT thay vì AVRT do đường vách sau. [57] Sự hiện diện của một QRS có chẽ (notch) ở chuyển đạo aVL cũng đã được tìm thấy là một tiêu chí đáng tin cậy cho thấy AVNRT, [58] trong khi r giả ở aVR đã được chứng minh là có độ nhạy và độ đặc hiệu cao hơn so với r giả trong V1 để chẩn đoán AVNRT điển hình. [59] Tuy nhiên, trong tất cả các nghiên cứu được tham chiếu, các trường hợp AT hoặc AVNRT không điển hình bị hạn chế hoặc hoàn toàn không có.
Block hoặc phân ly AV trong nhịp tim nhanh QRS hẹp thường không được nhìn thấy, nhưng nó loại trừ AVRT vì cả hai nhĩ và thất là một phần của vòng chu kỳ. Sự phát triển của block nhánh (BBB) trong SVT cũng có thể hữu ích trong việc chẩn đoán AVRT. BBB dọc theo đến AP có thể dẫn đến kéo dài CL do kéo dài VA, do nhánh tâm thất của mạch bị kéo dài bằng cách dẫn truyền qua vách liên thất từ dẫn truyền nhánh bó. [60] Tuy nhiên, cần lưu ý rằng việc kéo dài khoảng VA có thể không nhất thiết dẫn đến việc kéo dài CL, do sự chuyển đổi điện thế của dẫn truyền xuôi từ chậm sang đường nhanh của đường nút AV.
9.1.2 Các thủ pháp phế vị và adenosine
Thủ pháp cường phế vị (như massage xoang động mạch cảnh) và tiêm adenosine có thể giúp chẩn đoán lâm sàng, đặc biệt trong các tình huống ECG trong quá trình nhịp nhanh không rõ ràng. Các đáp ứng có thể xảy ra đối với các thủ pháp phế vị và adenosine được thể hiện trong Bảng 8 và Hình 2.
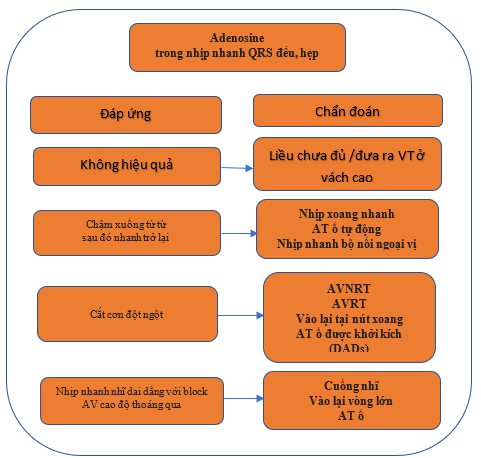
Hình 2. Đáp ứng của nhịp nhanh phức bộ hẹp với adenosine. AT = nhịp nhanh nhĩ; AV = nhĩ thất; AVNRT = nhịp nhanh vào lại nút nhĩ thất; AVRT = nhịp nhanh vào lại nhĩ thất; DADs = chậm trễ sau khử cực; VT = nhịp nhanh thất.
Bảng 8. Khả năng đáp ứng của nhịp nhanh QRS hẹp với thủ pháp phế vị và adenosine.
| (1). Làm chậm dẫn truyền AVN và gây ra block AV không liên tục. Do đó, hoạt động điện tâm nhĩ có thể được bộc lộ, cho thấy sóng P phân ly (AT ổ, cuồng nhĩ hoặc sóng AF).
(2). Giảm tạm thời tần số nhĩ của nhịp nhanh tự động (AT ổ, nhịp nhanh xoang và JET). (3). Cắt nhịp nhanh. Điều này có thể xảy ra bằng cách làm gián đoạn vòng vào lại trong AVNRT và AVRT bằng cách tác động lên AVN là một phần của mạch. Hiếm gặp hơn, nhịp nhanh vào lại tại nút xoang và AT do hoạt động khởi kích có thể làm chậm xuống và cắt cơn. (4). Không có tác dụng trong một số trường hợp. |
AF = rung nhĩ; AT = nhịp nhanh nhĩ; AV = nhĩ thất; AVN = nút nhĩ thất; AVNRT = nhịp mhanh vào lại nút nhĩ thất; AVRT = nhịp nhanh vào lại nhĩ thất; JET = nhịp nhanh bộ nối ngoại vị.
Cắt cơn rối loạn nhịp tim với sóng P sau phức hợp QRS cuối cùng rất khó xảy ra ở AT, và phổ biến nhất trong AVRT và AVNRT điển hình. Cắt cơn với phức hợp QRS thường thấy trong AT, và có thể trong AVNRT không điển hình. Adenosine không làm gián đoạn các ATs vào lại vòng lớn (MRAT).[61] VT bó nhanh, đặc biệt là verapamil- nhưng không nhạy cảm với adenosine. Hầu hết các VT, trái ngược với SVT, không đáp ứng với xoa xoang động mạch cảnh, nhưng một QRS VT hẹp bắt nguồn từ nhánh bó bên trái và cắt cơn với xoa xoang động mạch cảnh đã được báo cáo.[62]
9.1.3 Nghiên cứu điện sinh lý
Một số kỹ thuật điện sinh lý và thủ pháp có thể được sử dụng trong phòng thí nghiệm điện sinh lý để chẩn đoán phân biệt nhịp tim nhanh QRS hẹp đều. [45] Một cuộc thảo luận chi tiết nằm ngoài phạm vi của các hướng dẫn này.
9.2 Nhịp nhanh QRS rộng (>120 ms)
Nhịp nhanh QRS rộng có thể là VT, SVT dẫn truyền lệch hướng BBB, hoặc dẫn truyền xuôi qua AP, với tỷ lệ được thông báo lần lượt là 80, 15 và 5%. [63] Chẩn đoán chính xác VT rất quan trọng đối với việc điều chỉnh, vì chẩn đoán sai và sử dụng thuốc thường được sử dụng cho SVT có thể gây hại cho bệnh nhân VT. [64] Do đó, chẩn đoán mặc định nên là VT cho đến khi được chứng minh khác. Chẩn đoán phân biệt bao gồm: [65]
- SVT với BBB. Điều này có thể phát sinh do BBB tồn tại từ trước hoặc do sự phát triển của dẫn truyền lệch hướng trong quá trình nhịp nhanh (được gọi là block pha 3), thường gặp hơn, mặc dù không phải lúc nào cũng là mẫu BBB phải (RBBB) do RP dài hơn của bó nhánh phải.
- SVT với dẫn truyền xuôi qua AP, “SVT được kích thích sớm”, chúng tham gia trong vòng chu kỳ (AVRT antidromic) hoặc là bộ phận bên ngoài trong quá trình AF, AT ổ / cuồng nhĩ, hoặc AVNRT.
- SVT với QRS giãn rộng được gây ra do thuốc hoặc rối loạn điện giải. Thuốc class IA và class IC gây chậm dẫn truyền phụ thuộc vào sử dụng và thuốc nhóm III kéo dài thời kỳ trơ ở tổ chức His-Purkinje nhiều hơn ở cơ tâm thất. Cả hai đều có thể dẫn đến hình thái BBB không điển hình trong SVT bắt chước VT.
- Nhịp tim nhanh vòng lặp vô tận liên quan đến máy tạo nhịp và các biểu hiện bên ngoài (artefacts), cũng có thể bắt chước VT.
9.2.1 Chẩn đoán điện sinh lý phân biệt
Nếu ECG 12 chuyển đạo có sẵn trong nhịp xoang, điều này có thể cung cấp thông tin chẩn đoán hữu ích. Đặc biệt, nếu hình thái QRS giống hệt nhau trong nhịp xoang và nhịp tim nhanh, như vậy rối loạn nhịp tim rất có thể không phải VT. Tuy nhiên, nếu VT vào lại bó nhánh và vách cao, nhánh bó lại tái tạo VT và VT đi ra sát với hệ thống dẫn truyền có thể có hình thái tương tự như nhịp xoang. Sự hiện diện của một mẫu BBB đối lập trong nhịp xoang là biểu hiện rõ hơn của VT.
9.2.1.1 Phân ly nhĩ thất
Sự có mặt của phân ly AV hoặc nhắt bóp bắt được/nhắt bóp hỗn hợp trên ECG 12 chuyển đạo trong quá trình nhịp nhanh là đặc tính chìa khóa chẩn đoán VT. Sự phân ly AV có thể khó nhận ra vì sóng P thường bị ẩn vào phước bộ QRS rộng và sóng T trong quá trình nhanh QRS rộng. Sóng P thường nổi bật hơn ở các chuyển đạo dưới và ở vị trí chuyển đạo ngực cải biên (chuyển đạo Lewis). [63]
Mối quan hệ giữa các sự kiện tâm nhĩ và tâm thất là 1:1 hoặc lớn hơn (nhiều nhĩ hơn nhịp thất) trong hầu hết các SVT (Bảng 9). AVNRT có thể được liên kết với dẫn 2:1, [66] nhưng điều này rất hiếm. Mặc dù dẫn truyền VA có thể được nhận thấy ở ≤50% bệnh nhân bị VT và có thể có mối quan hệ 1:1, hầu hết các VT có mối quan hệ <1:1 (phức hợp QRS nhiều hơn sóng P).
Bảng 9. Tóm tắt các tiêu chí chìa khóa của điện tâm đồ gợi ý nhịp nhanh thất hơn là nhịp nhanh trên thất trong nhịp nhanh phức bộ QRS rộng.
| Phân ly AV | Tần số thất > tần số nhĩ |
| Nhát bóp hỗn hợp / nhát bóp bắt được | Hình thái QRS khác biệt với những QRS trong nhịp nhanh |
| Concordance âm ở các chuyển đạo ngực | Tất cả các chuyển đạo trước ngực âm tính |
| RS ở các chuyển đạo trước ngực | – Không có RS ở các chuyển đạo trước ngực
– RS >100 ms ở chuyển đạo bất kỳa |
| Phức bộ QRS ở chuyển đạo aVR | · Sóng R khởi đầu
· R khởi đầu hoặc song Q >40 ms · Sự có mặt của chẽ của phức bộ âm chuyến ưu thế
|
| Trục QRS −90 đến ±180° | Cả hai biểu hiện hình thái RBBB và LBBB |
| Thời gian đỉnh sóng R ở chuyển đạo II | Thời gian đỉnh sóng R ≥50 ms |
| Hình thái RBBB | Chuyển đạo V1: R một pha, Rsr’, Phức bộ qR hai pha, R rộng (>40 ms), và song R hai đỉnh với đỉnh trái cao hơn phải (còn gọi là dấu hiệu tai thỏ) Chuyển đạo V6: tỷ lệ R:S <1 (mẫu rS, QS) |
| Hình thái LBBB | Chuyển đạo V1: Sóng R rộng, líu ríu hoặc chễ nét xuống của sóng S líu ríu hoặc chễ đôi, điểm thấp nhất của sóng S bị trễ Chuyển đạo V6: sóng Q hoặc QS |
AV = nhĩ thất; LBBB = Block nhánh bó trái; RBBB = Block nhánh bó phải.
aRS: Khởi đầu của R đến phần sâu nhất của S.
Bảng 10. Các nguyên nhân nhịp xoang nhanh sinh lý
| Các nguyên nhân sinh lý | Cảm xúc, gắng sức, giao hợp, đau, mang thai |
| Các nguyên nhân bệnh lý | Lo lắng, hoảng loạn, thiếu máu, sốt, mất nước, nhiễm trùng, ác tính, cường giáp, hạ đường huyết, pheochromocytoma, bệnh Cushing, bệnh đái tháo đường với bệnh lý rối loạn chức năng tự chủ, tắc mạch phổi, nhồi máu cơ tim, viêm màng ngoài tim, bệnh van tim, suy tim ứ huyết, shock. |
| Các thuốc | Epinephrine, norepinephrine, dopamine, dobutamine, atropine, các chất kích thích thụ thể beta-2 adrenergic (salbutamol), methylxanthines, doxorubicin, daunorubicin, ngừng beta-blocker. |
| Các thuốc bất hợp pháp (Illicit) | Amphetamines, cocaine, lysergic acid diethylamide, psilocybin, ecstasy, crack, cocaine |
| Các loại khác | Caffeine, alcohol |
9.2.1.2 Khoảng thời gian QRS
Khoảng thời gian QRS >140 ms với mẫu RBBB hoặc >160 ms với mẫu LBBB gợi ý VT. Các tiêu chuẩn này không giúp để phân biệt VT với SVT trong các trạng thái đặc biệt, như SVT có kích thích sớm, hoặc khi sử dụng các thuốc chống loạn nhịp class IC hoặc class IA. [67]
9.2.1.3 Trục QRS
Khi các vòng VT (đặc biệt là sau MI hoặc trong bệnh cơ tim) thường nằm bên ngoài mạng lưới His – Purkinje bình thường, sự dịch chuyển trục đáng kể có thể xảy ra, cho phép chẩn đoán. Do đó, ở những bệnh nhân SVT và dẫn truyền lệch hướng, trục QRS được khẳng định giữa khoảng −60 đến + 120 °. Cụ thể, độ lệch trục cực lớn (trục từ −90 đến ± 180 °) là dấu hiệu mạnh mẽ của VT, cả khi có sự hiện diện của RBBB và LBBB. [65]
9.2.1.4 Concordance chuyển đạo ngực
Sự có mặt của concordance các chuyển đạo ngực âm tính (tất cả các phức hợp QRS âm từ V1 – V6) (hình 3) hầu như chẩn đoán VT, với độ đặc hiệu > 90%, nhưng chỉ gặp ở 20% VT. Concordance dương có thể chỉ ra VT hoặc nhịp nhanh antidromic sử dụng AF sau trái hoặc bên trái. [68]
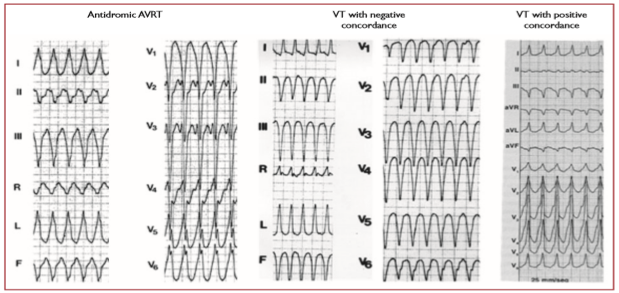
Hình 3. Các mẫu concordance chuyển đạo ngực dương và âm trong VT. AVRT = nhịp nhanh vào lại nhĩ thất; VT: nhịp nhanh thất.
9.2.1.5 Hình thái block bó nhanh phải
Chuyển đạo V1: Dẫn truyền lệch hướng RBBB điển hình có r’ khởi đầu nhỏ, do trong RBBB, vách cao được kích hoạt chủ yếu từ bó vách bên trái. Do đó, các mẫu sau đây là hiển nhiên: rSR, rSr hoặc rR ′ ở chuyển đạo V1. Tuy nhiên, ở VT, mặt sóng kích hoạt tiến triển từ tâm thất trái (LV) sang chuyển đạo trước bên phải V1, theo cách mà một sóng R chiếm ưu thế (Phức bộ R đơn pha, Rsr′, qR hai pha, hoặc R rộng > 40 ms) sẽ thường thấy hơn trong chuyển đạo V1. Ngoài ra, sóng R có đỉnh đôi (mẫu M) ở chuyển đạo V1 được quy cho VT nếu đỉnh trái cao hơn đỉnh phải (được gọi là dấu hiệu tai thỏ). Một tai thỏ phải cao hơn đặc trưng cho RBBB dẫn truyền lệch hướng, nhưng không loại trừ VT.
Chuyển đạo V6: Một lượng nhỏ điện thế thất phải bình thường được hướng ra từ chuyển đạo V6. Vì đây là một vectơ nhỏ trong RBBB dẫn truyền lệch hướng, tỷ lệ R: S là> 1. Trong VT, tất cả điện thế thất phải và một số bên trái, được hướng ra từ V6, dẫn đến tỷ lệ R: S <1 (mẫu rS và QS). Hình thái RBBB với tỷ lệ R: S trong V6 <1 hiếm khi được nhìn thấy trong SVT với dẫn truyền lệch hướng, chủ yếu là khi bệnh nhân có trục lệch trái trong quá trình nhịp xoang.
Phân biệt VT bó với SVT với block hai bó (bifascicular block) (RBBB và hemiblock trái trước) là rất khó khăn. Các đặc tính chỉ ra SVT trong bối cảnh này gồm QRS > 140 ms, r’ ở V1, tất cả QRS âm ở aVR và tỷ lệ R / S> 1 ở V6. [44]
9.2.1.6 Hình thái block nhánh bó trái
Chuyển đạo V1: Như đã nêu ở trên đối với RBBB, vì những lý do tương tự, sự hiện diện của sóng R rộng, chỗ rốc xuống của sóng S líu ríu hoặc chẽ đôi, và điểm thấp nhất (nadir) của sóng S là yếu tố dự báo mạnh mẽ cho VT.
Chuyển đạo V6: Trong LBBB thực sự, không có bất kỳ sóng Q ở các chuyển đạo trước bên. Do đó sự hiện diện của bất kỳ sóng Q hoặc QS ở V6 đều ưu tiên cho VT, chỉ ra mặt sóng kích hoạt đang di chuyển ra khỏi vị trí đỉnh LV.
Các tiêu chí hình thái này không được đáp ứng ở bất kỳ chuyển đạo nào ở 4% SVT và 6% VT, và trong một phần ba trường hợp khi một chuyển đạo (V1 hoặc V6) ủng hộ một chẩn đoán, các yếu tố khác lại ủng hộ chẩn đoán ngược lại (VT trong một chuyển đạo và SVT ở các chuyển đạo khác, và ngược lại). [69,70]
Một số thuật toán đã được phát triển để phân biệt VT với SVT [69,71,72] Trình bày và nhận xét chi tiết nằm ngoài phạm vi của các Hướng dẫn này và có thể được tìm thấy trong các hướng dẫn của EHRA/HRS/APHRS/SLECEC.[3]
Tất cả các tiêu chí này đều có những hạn chế. Các trạng thái như nhịp nhanh vào lại nhánh bó, VT bó, VT vị trí đường ra sát hệ thống His Purkinje, và nhịp nhanh QRS rộng xuất hiện trong quá trình điều trị các thuốc chống loạn nhịp là khó sử dụng các tiêu chuẩn hình thái như nói ở trên để chẩn đoán. Phân biệt VT với AVRT antidromic là cực kỳ khó khăn trong thực tế hình thái QRS trong AVRT antidromic tương tự với VT, với nguồn gốc của nó đi vào AP trong cơ thất. Thuật toán. Một thuật toán đã được biến đổi để chẩn đoán phân biệt, dựa trên phân tích của 267 nhịp tim nhanh QRS rộng, gồm VT và AVRT antidromic. Các tiêu chí dẫn xuất đã được tìm thấy để cung cấp độ nhạy 75% và độ đặc hiệu 100%, [73] và thuật toán cũng được xác nhận trong một nghiên cứu khác, [74] nhưng kinh nghiệm vẫn còn hạn chế.
Trên thực tế, một số nghiên cứu độc lập đã phát hiện ra các phương pháp dựa trên ECG khác nhau có độ đặc hiệu 40 – 80% và độ chính xác là ∼75% .[44,68,75] Thật vậy, độ chính xác chẩn đoán tương đương ∼75% sẽ dễ dàng đạt được bằng xem xét mỗi nhịp nhanh QRS rộng là VT, do chỉ có 25 – 30% là SVT. Do đó, các phương pháp tiếp cận mới nổi để tích hợp các thuật toán này và cung cấp các hệ thống tính điểm chính xác hơn đang được đánh giá. [81] Ngoài ra, các tiêu chí ECG thông thường đã làm giảm độ nhạy để phân biệt VT với SVT dẫn truyền lệch hướng ở bệnh nhân VT nguyên phát. Điều này được thấy rõ nhất ở các VT có nguồn gốc từ các vị trí vách, đặc biệt là các vị trí Purkinje và các khu vực đường ra vách. [82]
9.2.2 Nghiên cứu điện sinh lý
Trong một số trường hợp, một EPS là cần thiết để chẩn đoán.
9.3 Nhịp nhanh không đều
Nhịp thất không đều thường gặp nhất chỉ ra AF, AT đa ổ hoặc AT ổ / cuồng nhĩ với dẫn truyền AV thay đổi, và có thể xảy ra trong bối cảnh cả hai phức bộ QRS hẹp và rộng. Khi AF được kết hợp với tần số thất nhanh, sự không đều của đáp ứng thất này ít được phát hiện dễ dàng hơn và có thể bị chẩn đoán nhầm là SVT đều. [83] Nếu tần số nhĩ vượt quá tần số thất, khi đó cuồng nhĩ hoặc AT (ổ hoặc đa ổ) thường hiện diện. VT đa hình và, hiếm khi, VT đơn hình cũng có thể không đều. Đôi khi, nhịp nhanh bộ nối, nhịp nhanh không phải do vào lại có thể có tần số thay đổi.
Đặc biệt, chẩn đoán phân biệt nhịp nhanh QRS rộng không đều hoặc là AF có kích thích sớm hoặc VT đa hình, hoặc AT với block thay đổi trong tình trạng dẫn tryền lệch hướng. AF kích thích sớm tự nó biểu hiện không đều, hình dạng QRS thay đổi, và tần số thất nhanh (do RP ngắn của AP). Thay đổi hình thái QRS gây ra do thay đổi mức độ hỗn hợp do hoạt hóa cả hai AF và AVN, điều này cũng dẫn đến sự thay đổi về độ rộng của sóng delta. Một nguyên nhân nữa của hình thái QRS khác nhau trong hoàn cảnh này sẽ là nếu có nhiều hơn một dẫn truyền xuôi AP hiện diện với sự dẫn truyền không liên tục qua mỗi đường. Tần số thất có xu hướng cao hơn so với những người có AF không có kích thích sớm. [84]
10 Điều chỉnh cấp thời khi không có chẩn đoán được xác lập
10.1 Nhịp nhanh đều
10.1.1 Nhịp nhanh phức hợp QRS hẹp (≤120 ms)
| Thủ pháp cường phế vị
(IB) |
| Sốc chuyển nhịp đồng bộ
(IB) |
| Nếu không có hiệu quả |
| Adenosin IV
(IB) |
| Nếu không có hiệu quả |
| Verapamil hoặc Diltiazem IV
(IIa B) |
| Beta blocker IV
(IIa C) |
| Nếu không có hiệu quả |
Bệnh nhân mắc SVT là những người tham gia phổ biến và có khả năng tái phát tại các khoa cấp cứu, ước tính khoảng 50 000 lượt khám mỗi năm ở Hoa Kỳ. Cách tiếp cận ban đầu đối với quản lý cấp tính có xu hướng không dựa trên thuốc, với sự leo thang đến thuốc tiêm tĩnh mạch (iv) hoặc chuyển nhịp bằng điện trong trường hợp không điều chỉnh sớm (Hình 4).
Hình 4. Các khuyến cáo cho điều trị nhịp nhanh phức bộ QRS hẹp khi không có chẩn đoán được xác định
i.v. = đường tĩnh mạch
Khuyến cáo cho điều chỉnh cấp thời nhịp nhanh QRS hẹp khi không có chẩn đoán được xác định
| Khuyến cáo | Classa | Levelb |
| Bệnh nhân không ổn định huyết động | ||
| Chuyển nhịp DC đồng bộ được khuyến cáo cho các bệnh nhân không ổn định về huyết động.[86-88] | I | B |
| Các bệnh nhân huyết động ổn định | ||
| ECG 12 chuyển đạo trong quá trình nhịp nhanh được khuyến cáo. | I | C |
| Thủ pháp phế vị, tốt nhất là ở tư thế nằm ngửa với chân nâng lên cao, được khuyến cáo.[41,89-91] | I | B |
| Adenosine (6-18 mg i.v. bolus) được khuyến cáo nếu thủ pháp phế vị thất bại.[92-94] | I | B |
| Verapamil hoặc diltiazem (i.v.) nên được xem xét, nếu thủ pháp phế vị và adenosine thất bại. [92,94-98] | IIa | B |
| Beta -blockers (esmolol hoặc metoprolol IV) nên được xem xét nếu thủ pháp phế vị và adenosine thất bại. [97,99,100] | IIa | C |
| Chuyển nhịp dòng điện một chiều đồng bộ được khuyến cáo khi điều trị bằng thuốc thất bại để chuyển nhịp hoặc kiểm soát nhịp nhanh. [87,88] | I | B |
i.v. beta-blockers được chống chỉ định khi có HF mất bù.
i.v. verapamil và diltiazem bị chống chỉ định khi có hạ huyết áp hoặc HFrEF.
DC = dòng điện một chiều; ECG = điện tâm đồ; HF = suy tim; HFrEF = suy tim với phân suất tống máu giảm; i.v. = đường tĩnh mạch.
aClass của khuyến cáo.
bMức độ bằng chứng.
10.1.1.1 Các bệnh nhân huyết động không ổn định
Chuyển nhịp bằng dòng điện một chiều ngay lập tức là lựa chọn đầu tiên ở các bệnh nhân có tổn thương huyết động bị nhịp nhanh QRS hẹp. [86-88,101]
10.1.1.2 Các bệnh nhân huyết động ổn định
Thủ pháp phế vị có thể được sử dụng để cắt cơn SVT QRS hẹp. [41] Hiệu quả của các thủ pháp phế vị truyền thống trong cắt cơn SVT, khi thực hiện một cách chính xác, đã được báo cáo từ 19 đến 54%. [41,89–91,102,103] Các thủ pháp phế vị này gồm các kỹ thuật khác nhau được sử dụng để kích thích các thụ thể trong các động mạch cảnh trong. Các kích thích này gây ra kích thích phản xạ dây thần kinh phế vị, dẫn đến việc giải phóng acetylcholine, từ đó có thể làm chậm xung điện qua AVN và làm chậm nhịp tim. Nhiều thủ pháp trong số này có thể được thực hiện với nguy cơ tối thiểu ở bên giường bệnh hoặc trong môi trường văn phòng, và có thể vừa để chẩn đoán vừa để điều trị. Thủ pháp Valsalva là phương pháp điều trị khẩn cấp hàng đầu an toàn và được khuyến cáo quốc tế cho SVT, mặc dù một đánh giá gần đây của Cochrane cho thấy không đủ bằng chứng để hỗ trợ hoặc bác bỏ tiện ích của nó. [89] Thủ pháp Valsalva thường được chứng minh là hiệu quả nhất ở người lớn, trong AVRT thay vì AVNRT. Một cách tiếp cận được sửa đổi đối với thủ pháp Valsalva cung cấp gia tăng tần số chuyển nhịp thành công có thể được xem xét (tỷ lệ chuyển nhịp 43 đối lại 17%). [41] Phương pháp gia tăng này đòi hỏi thủ pháp Valsalva cần được thực hiện nửa nằm (semi-recumbent), với tư thế nằm ngửa và nâng cao chân thụ động sau căng thẳng Valsalva. Thổi vào ống tiêm 10 mL với lực đủ mạnh để di chuyển pít tông có thể chuẩn hóa phương pháp tiếp cận. [104],
Massage xoang động mạch cảnh được thực hiện với cổ bệnh nhân ở một vị trí mở rộng, với đầu quay về phía đối diện. Nó phải luôn luôn thực hiện một bên vì có nguy cơ tiềm ẩn với áp lực cả hai bên, và nó nên được giới hạn trong 5 giây. Bệnh nhân cần được theo dõi. Kỹ thuật này nên tránh ở những bệnh nhân bị cơn thiếu máu não thoáng qua hoặc đột quỵ trước đó, và ở những bệnh nhân tiếng thổi ở động mạch xoang cảnh. [3]
Các thủ pháp khác, chẳng hạn như ngâm mặt trong nước lạnh hoặc ho mạnh, hiếm khi được sử dụng
Adenosine, một nucleoside purine nội sinh (6 -18 mg iv bolus) là thuốc đầu tiên được lựa chọn. [92-94] Ảnh hưởng điện sinh lý có liên quan đến dược lý được điều hòa thông qua các thụ thể adenosine A1 của tim. [105.106] EPS lâm sàng đã chứng minh kéo dài dẫn truyền AV liên quan đến liều lượng tiến triển [do ảnh hưởng đến khoảng nhĩ His (AH) và không có trong khoảng HV], đỉnh điểm là block AV tạm thời, sau đó gây cắt cơn nhịp nhanh. [107]
Liều trung bình cần thiết để cắt cơn là ∼6 mg. Để đạt được điều chỉnh nhịp có hiệu quả, tiêm cần phải được bolus nhanh với là một liều nhanh chóng với nước muối đẩy ngay lập tức. Các tĩnh mạch lớn, nằm ở trung tâm (ví dụ: tĩnh mạch trụ) có khả năng cung cấp nồng độ thuốc hiệu quả hơn cho tim so với các tĩnh mạch nhỏ hơn. [108] Liều dùng sau đó nên tăng dần, bắt đầu từ 6 mg ở người lớn sau đó là 12 mg. Một liều 18 mg sau đó nên được xem xét, cũng có tính đến khả năng dung nạp / tác dụng phụ ở từng bệnh nhân. Adenosine có thời gian bán hủy trong huyết tương rất ngắn do sự khử amin thành inosine không hoạt động đạt được trong vài giây, với hiệu quả lâm sàng hoàn thành trong phạm vị 20-30 giây. [107] Do đó, việc lặp lại là an toàn trong vòng 1 phút của liều cuối. [2,3] Khoảng liều giữa các bệnh nhân có thể rất rộng, [107] với thành công > 90% thường được mong đợi. [94.109] Một số loại thuốc (ví dụ: dipyridamole và theophylline) đôi khi có thể ảnh hưởng đến yêu cầu liều lượng, nhưng bất kỳ ảnh hưởng nào của việc vừa uống đồ uống chứa caffein đều bị tranh chấp. [110.111]
Khó thở thoáng qua là phổ biến với tăng thông khí, và có nhiều khả năng là kết quả của sự kích thích của các sợi C phế vị phổi. [112] Đỏ bừng mặt có thể xảy ra, liên quan đến giãn mạch và tăng nhiệt độ da. [107] Đau ngực, có thể thay đổi với cái tên làn khắp ngực, có thể gợi ý nguồn gốc thiếu máu cục bộ hoặc thực quản, và có liên quan đến tăng lưu lượng máu xoang vành nên có thể có nguồn gốc từ tim. [107]
Suy giảm chức năng nút xoang nhĩ được dự kiến dựa trên dược lý đã được thiết lập, nhưng nhịp tim chậm kéo dài là không bình thường. [105,107] Tuy nhiên, nên thận trọng khi sử dụng adenosine ở những người mắc bệnh nút xoang đã biết. [113] Nguy cơ nhịp tim chậm nhận được ở các đối tượng ghép tim toàn bộ đã bị cắt thần kinh, ở họ SVT là phổ biến, đã gây ra một chống chỉ định tương đối. [114,115] Tuy nhiên, nhiều bằng chứng thực tế gần đây ủng hộ việc sử dụng adenosine trong nhóm này mà không có cảnh báo cụ thể nào. [116] AF có thể xảy ra sau khi dùng adenosine do kích hoạt tĩnh mạch phổi trực tiếp (PV) [117] hoặc tăng tính không đồng nhất của tái cực, [118] và xuất hiện phổ biến hơn với AVRT so với AVNRT. [93] Adenosine đôi khi cũng có thể gây ra hoặc gia tăng rối loạn nhịp nhĩ do kích thích sớm. [119,120]
Cơn co thắt phế quản quan trọng trên lâm sàng hiếm khi được báo cáo ở những người nhận i.v. adenosine cho SVT, [121] và quan sát này được hỗ trợ thêm do kinh nghiệm lớn có được khi truyền adenosine đã được đưa ra trong test tim gắng sức.[105.122.123] Ngoài ra, mặc dù hít phải adenosine sản xuất thuốc giãn phế quản ở người bị hen suyễn, [124] sử dụng đường tĩnh mạch không có tác động đến đường thở trong các nghiên cứu thử nghiệm lâm sàng.[125] Đã có báo cáo riêng biệt về bệnh phế quản được chứng minh bằng lâm sàng xảy ra ở bệnh nhân mắc hoặc không mắc bệnh hô hấp, do đó cho thấy cần phải chăm sóc ở bệnh nhân hen suyễn. [121.126.127]. Cần sử dụng thận trọng ở những người bị hen suyễn, mặc dù verapamil có thể là lựa chọn thích hợp hơn ở những bệnh nhân bị hen nặng
Adenosine triphosphate có thể được sử dụng nhưng kinh nghiệm lâm sàng còn hạn chế.
Các thuốc chẹn kênh canxi (verapamil / diltiazem i.v.) và các thuốc chẹn beta (như esmolol và metoprolol i.v.) có giá trị, đặc biệt ở các bệnh nhân có các nhắt bóp nhĩ hoặc thất sớm. Verapamil [0,075 – 0,15 mg / kg i.v. (trung bình 5 – 10 mg) trên 2 phút] hoặc i.v. diltiazem [0,25 mg / kg (trung bình 20 mg) trong 2 phút] đã được chứng minh cắt SVT từ 64 đến 98% bệnh nhân, nhưng có liên quan đến nguy cơ hạ huyết áp. [92,94-98,128] ở những bệnh nhân mất ổn định huyết động, HF với phân suất tống máu LV giảm (<40%), nghi ngờ VT hoặc AF có kích thích sớm. Thuốc chẹn beta (iv), chẳng hạn như esmolol tác dụng ngắn (0,5 mg / kg iv bolus hoặc 0,05 – 0,3 mg / kg / phút truyền) hoặc metoprolol (2,5-15 mg được tiêm iv trong 2,5 mg bolus), có hiệu quả hơn trong giảm tần số nhịp tim nhanh hơn so với cắt cơn. [97,99,100,128] Mặc dù bằng chứng về hiệu quả của thuốc chẹn beta trong việc cắt cơn SVT còn hạn chế, chúng có một hồ sơ an toàn tuyệt vời ở những bệnh nhân ổn định huyết động. Thuốc chẹn beta chống chỉ định ở những bệnh nhân bị HF mất bù. Cần thận trọng khi sử dụng đồng thời tĩnh mạch thuốc chẹn kênh canxi và thuốc chẹn beta, vì có thể có tác dụng hạ huyết áp và nhịp tim chậm. Trong thử nghiệm lâm sàng đầu tiên của etripamil, thuốc chẹn kênh canxi loại L tác dụng ngắn với tác dụng nhanh chóng sau khi sử dụng đường mũi (nitranasal), tỷ lệ chuyển từ SVT sang nhịp xoang dao động trong khoảng 65% 95%.
10.1.2 Nhịp nhanh QRS rộng (>120 ms)
Điều chỉnh cấp thời các bệnh nhân nhịp nhanh phức hợp QRS rộng phụ thuộc với sự ổn định huyết động của bệnh nhân (Hình 5). [106,130,131]
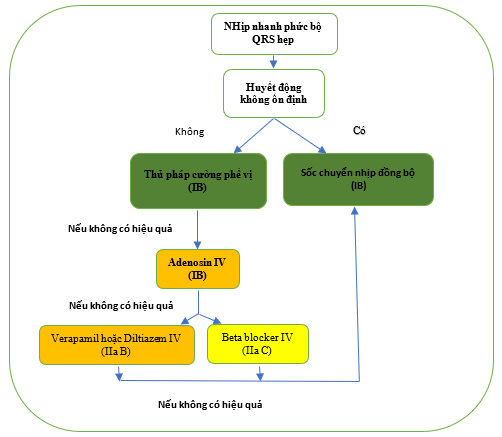
Hình 5. Điều trị nhịp nhanh phức bộ rộng khi không có chẩn đoán được xác định.
AVRT = nhịp nhanh vào lại nhĩ thất; i.v. = đường tĩnh mạch. KT = kích thích.
Khuyến cáo cho điều chỉnh cấp thời nhịp nhanh QRS rộng khi không có chẩn đoạn được xác định
| Khuyến cáo | Classa | Levelb |
| Các bệnh nhân không ổn định huyết động | ||
| Chuyển nhịp bằng dòng một chiều đồng bộ được khuyến cáo ở các bệnh nhân không ổn định huyết động. [86,130] | I | B |
| Các bệnh nhân ổn định huyết động | ||
| ECG 12 chuyển đạo trong quá trình nhịp nhanh được khuyến cáo. | I | C |
| Các thủ pháp phế vị được khuyến cáo. | I | C |
| Adenosine nên được xem xét nếu thủ pháp phế vị thất bại và không có kích thích sớm trên ECG lúc nghỉ. | IIa | C |
| Procainamide (i.v.) nên được xem xét nếu thủ pháp và adenosine thất bại.[132] | IIa | B |
| Amiodarone (i.v.) có thể được xem xét nếu thủ pháp phế vị và adenosine thất bại.[132] | IIb | C |
| Chuyển nhịp bằng dòng một chiều đồng bộ được khuyến cáo nếu điều trị bằng thuốc thất bại để chuyển nhịp và kiểm soát nhịp nhanh. [86, 130] |
I |
B |
| Verapamil không được khuyến cáo trong nhịp tim nhanh phức bộ QRS rộng không rõ căn nguyên. [64,133,134] | III | B |
DC = dòng một chiều; ECG = điện tâm đồ; i.v. = đường tĩnh mạch.
aClass khuyến cáo.
bMức độ bằng chứng.
10.1.2.1 Các bệnh nhân không ổn định huyết động
Mất ổn định huyết động có thể xảy ra với bất kỳ nhịp tim nhanh QRS rộng, bất kể nguyên nhân, nhưng có nhiều khả năng ở bệnh nhân VT. Chuyển nhịp đồng bộ được khuyến cáo cho bất kỳ nhịp tim nhanh QRS rộng dai dẳng dẫn đến tụt huyết áp, tình trạng tâm thần thay đổi cấp thời, đau ngực, triệu chứng HF cấp tính hoặc có dấu hiệu sốc. [86,87]
10.1.2.2 Các bệnh nhân ổn định huyết động
Ở bệnh nhân có nhịp tim nhanh QRS rộng, ổn định về huyết động, đáp ứng với thủ pháp phế vị có thể cung cấp nhận định về cơ chế chịu trách nhiệm về rối loạn nhịp tim. SVT với dẫn truyền lệch hướng, nếu được xác định rõ ràng, có thể được điều trị theo cách tương tự như SVT phức hợp hẹp, với các thủ thuật phế vị hoặc thuốc (adenosine và các thuốc chẹn AVN khác như thuốc chẹn beta hoặc thuốc chẹn kênh canxi). 117–119,129]
Một số loại thuốc được sử dụng để chẩn đoán hoặc điều trị SVT (ví dụ verapamil) có thể gây suy giảm huyết động nghiêm trọng ở bệnh nhân có VT ổn định trước đó. [64,133,134] Vì vậy, chúng chỉ nên được sử dụng để điều trị cho bệnh nhân chẩn đoán SVT đã được hoàn toàn xác định và an toàn. Adenosine có thể hữu ích bằng cách cho phép chẩn đoán hoặc chấm dứt VT nhạy cảm với adenosine, nhưng phải tránh nếu kích thích sớm có trên ECG lúc nghỉ gợi ý nhịp nhanh có kích thích sớm. Có một nguy cơ trong vào lại thể antidromic, adenosine có thể gây thúc đẩy ngừng tim nếu AF được tạo ra do adenosine, như đôi khi có thể xảy ra. [135]
Đối với việc cắt cơn nhịp nhanh phức bộ QRS rộng ổn định về huyết động chưa biết căn nguyền bằng dược lý, i.v. Procainamide hoặc amiodarone có thể được sử dụng trong bệnh viện. [132,136111] Trong thử nghiệm PROCAMIO132 ở những bệnh nhân có nhịp nhanh QRS rộng dung nạp tốt, có hoặc không giảm phân suất tống máu LV, procainamide được kết hợp với số ít biến cố có hại cho tim lớn và tỷ lện cao hơn cắt cơn nhịp nhanh trong phạm vị 40 phút so với amiodarone.
Trong trường hợp cơ chế rối loạn nhịp không hoàn toàn hiểu rõ, rối loạn nhịp nên được điều trị như VT.
10.2 Nhịp nhanh không đều
Nhịp nhanh QRS rộng không đều thường là biểu hiện của AF. Hiếm khi, VT đa hình và, rất hiếm khi, VT đơn hình cũng có thể xuất hiện dưới dạng nhịp tim nhanh không đều. Chuyển nhịp bằng điện là phương pháp điều trị cấp thời được lựa chọn trong nhịp tim nhanh không đều có kích thích sớm kết hợp với không ổn định về huyết động. Điều trị chuyên biệt AF có kích thích sớm được thảo luận trong phần 11.
Nếu nhịp được dung nạp tốt với nhịp tim nhanh phức hợp QRS hẹp không đều, điều này có thể được coi là có khả năng là AF, và kiểm soát tần số bằng thuốc chẹn beta hoặc thuốc chẹn kênh canxi, và điều trị chuyển nhịp bằng thuốc hoặc bằng điện có lựa chọn khi có thể điều trị dự phòng huyết khối tại chỗ có thể là thích hợp. [4]
(Còn nữa)
Tài liệu tham khảo
- Blomstro¨m-Lundqvist C, Scheinman MM, Aliot EM, Alpert JS, Calkins H, Camm AJ, Campbell WB, Haines DE, Kuck KH, Lerman BB, Miller DD, Shaeffer CW, Stevenson WG, Tomaselli GF. ACC/AHA/ESC guidelines for the management ofpatients with supraventricular arrhythmias–executive summary: a report of the American college of cardiology/American heart association task force on practice guidelines and the European society of cardiology committee for practice guidelines (writing committee to develop guidelines for the management of patients with supraventricular arrhythmias) developed in collaboration with NASPE-Heart Rhythm Society. J Am Coll Cardiol 2003;42:14931531.
- Page RL, Joglar JA, Caldwell MA, Calkins H, Conti JB, Deal BJ, Estes NAM, Field ME, Goldberger ZD, Hammill SC, Indik JH, Lindsay BD, Olshansky B, Russo AM, Shen W-K, Tracy CM, Al-Khatib SM. 2015 ACC/AHA/HRS guideline for the management of adult patients with supraventricular tachycardia: executive summary: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society. J Am Coll Cardiol 2016;67:15751623.
- Katritsis DG, Boriani G, Cosio FG, Hindricks G, Jais P, Josephson ME, Keegan R, Kim Y-H, Knight BP, Kuck K-H, Lane DA, Lip GYH, Malmborg H, Oral H, Pappone C, Themistoclakis S, Wood KA, Blomstro¨m-Lundqvist C. European Heart Rhythm Association (EHRA) consensus document on the management of supraventricular arrhythmias, endorsed by Heart Rhythm Society (HRS), AsiaPacific Heart Rhythm Society (APHRS), and Sociedad Latinoamericana de Estimulacion Cardiaca y Electrofisiologia (SOLAECE). Eur Heart J 2018;39:14421445.
- Kirchhof P, Benussi S, Kotecha D, Ahlsson A, Atar D, Casadei B, Castella M, Diener H-C, Heidbuchel H, Hendriks J, Hindricks G, Manolis AS, Oldgren J, Popescu BA, Schotten U, Van Putte B, Vardas P, Agewall S, Camm J, Baron Esquivias G, Budts W, Carerj S, Casselman F, Coca A, De Caterina R, Deftereos S, Dobrev D, Ferro JM, Filippatos G, Fitzsimons D, Gorenek B, Guenoun M, Hohnloser SH, Kolh P, Lip GYH, Manolis A, McMurray J, Ponikowski P, Rosenhek R, Ruschitzka F, Savelieva I, Sharma S, Suwalski P, Tamargo JL, Taylor CJ, Van Gelder IC, Voors AA, Windecker S, Zamorano JL, Zeppenfeld K. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J 2016;37:28932962.
- Calkins H, Hindricks G, Cappato R, Kim YH, Saad EB, Aguinaga L, Akar JG, Badhwar V, Brugada J, Camm J, Chen PS, Chen SA, Chung MK, Nielsen JC, Curtis AB, Davies DW, Day JD, d’Avila A, de Groot N, Di Biase L, Duytschaever M, Edgerton JR, Ellenbogen KA, Ellinor PT, Ernst S, Fenelon G, Gerstenfeld EP, Haines DE, Haissaguerre M, Helm RH, Hylek E, Jackman WM, Jalife J, Kalman JM, Kautzner J, Kottkamp H, Kuck KH, Kumagai K, Lee R, Lewalter T, Lindsay BD, Macle L, Mansour M, Marchlinski FE, Michaud GF, Nakagawa H, Natale A, Nattel S, Okumura K, Packer D, Pokushalov E, Reynolds MR, Sanders P, Scanavacca M, Schilling R, Tondo C, Tsao HM, Verma A, Wilber DJ, Yamane T. 2017 HRS/ EHRA/ECAS/APHRS/SOLAECE expert consensus statement on catheter and surgical ablation of atrial fibrillation: executive summary. Europace 2018;20:157208.
- Mairesse GH, Moran P, Van Gelder IC, Elsner C, Rosenqvist M, Mant J, Banerjee A, Gorenek B, Brachmann J, Varma N, Glotz de Lima G, Kalman J, Claes N, Lobban T, Lane D, Lip GYH, Boriani G; ESC Scientific Document Group. Screening for atrial fibrillation: a European Heart Rhythm Association (EHRA) consensus document endorsed by the Heart Rhythm Society (HRS), Asia Pacific Heart Rhythm Society (APHRS), and Sociedad Latinoamericana de Estimulacion Cardiaca y Electrofisiologia (SOLAECE). Europace 2017;19:15891623.
- Lip GYH, Collet JP, Haude M, Huber K. Management of antithrombotic therapy in AF patients presenting with ACS and/or undergoing PCI: a summary of the Joint Consensus Document of the European Heart Rhythm Association (EHRA), European Society of Cardiology Working Group on Thrombosis, European Association of Percutaneous Cardiovascular Interventions (EAPCI) and European Association of Acute Cardiac Care (ACCA) endorsed by the Heart Rhythm Society (HRS), Asia-Pacific Heart Rhythm Society (APHRS), Latin America Heart Rhythm Society (LAHRS), and Cardiac Arrhythmia Society of Southern Africa (CASSA). Eur Heart J 2018;39:28472850.
- Wit AL, Wellens HJ, Josephson ME. Electrophysiological foundations of cardiac arrhythmias. 1st ed. Minneapolis: Cardiotext Publishing; 2017.
- Orejarena LA, Vidaillet H, DeStefano F, Nordstrom DL, Vierkant RA, Smith PN, Hayes JJ. Paroxysmal supraventricular tachycardia in the general population. J Am Coll Cardiol 1998;31:150157.
- Wu M-H, Chen H-C, Kao F-Y, Huang S-K. Postnatal cumulative incidence of supraventricular tachycardia in a general pediatric population: a national birth cohort database study. Heart Rhythm 2016;13:20702075.
- Garcıa-Fernandez FJ, Ib a~ nez Criado JL, Quesada Dorador A; collaborators of the Spanish Catheter Ablation Registry; REGISTRY COLLABORATORS. Spanish Catheter Ablation Registry. 17th Official Report of the Spanish Society of Cardiology Working Group on Electrophysiology and Arrhythmias (2017). Rev Esp Cardiol (Engl Ed) 2018;71:941951.
- Hosseini SM, Rozen G, Saleh A, Vaid J, Biton Y, Moazzami K, Heist EK, Mansour MC, Kaadan MI, Vangel M, Ruskin JN. Catheter ablation for cardiac arrhythmias: utilization and in-hospital complications, 2000 to 2013. JACC Clin Electrophysiol 2017;3:12401248.
- Holmqvist F, Kesek M, Englund A, Blomstro ¨m-Lundqvist C, Karlsson LO, Kenneb€ack G, Poc¸i D, Samo-Ayou R, Sigurjonsdottir R, Ringborn M, Herczku C, Carlson J, Fengsrud E, Tabrizi F, Ho¨glund N, Lo¨nnerholm S, Kongstad O, Jo¨nsson A, Insulander P. A decade of catheter ablation of cardiac arrhythmias in Sweden: ablation practices and outcomes. Eur Heart J 2019;40:820830.
- Porter MJ, Morton JB, Denman R, Lin AC, Tierney S, Santucci PA, Cai JJ, Madsen N, Wilber DJ. Influence of age and gender on the mechanism of supraventricular tachycardia. Heart Rhythm 2004;1:393396.
- Gonzalez-Torrecilla E, Almendral J, Arenal A, Atienza F, Atea LF, del Castillo S, Fernandez-Aviles F. Combined evaluation of bedside clinical variables and the electrocardiogram for the differential diagnosis of paroxysmal atrioventricular reciprocating tachycardias in patients without pre-excitation. J Am Coll Cardiol 2009;53:23532358.
(Xem phần Tài liệu tham khảo được đăng đầy đủ trên www.timmachhoc.vn)
- Liuba I, Jo¨nsson A, S€afstro¨m K, Walfridsson H. Gender-related differences in patients with atrioventricular nodal reentry tachycardia. Am J Cardiol 2006;97:384388.
- Rosano GMC, Leonardo F, Rosano GMC, De Luca F, Sarrel PM, Beale CM, Collins P. Cyclical variation in paroxysmal supraventricular tachycardia in women. Lancet 1996;347:786788.
- Chang S-H, Kuo C-F, Chou I-J, See L-C, Yu K-H, Luo S-F, Chiou M-J, Zhang W, Doherty M, Wen M-S, Chen W-J, Yeh Y-H. Outcomes associated with paroxysmal supraventricular tachycardia during pregnancy. Circulation 2017;135:616618.
- Krahn AD, Manfreda J, Tate RB, Mathewson FL, Cuddy T. The natural history of electrocardiographic preexcitation in men: the Manitoba Follow-up Study. Ann Intern Med 1992;116:456460.
- Vidaillet HJJ, Pressley JC, Henke E, Harrell FEJ, German LD. Familial occurrence of accessory atrioventricular pathways (preexcitation syndrome). N Engl J Med 1987;317:6569.
- Lu C-W, Wu M-H, Chen H-C, Kao F-Y, Huang S-K. Epidemiological profile of WolffParkinsonWhite syndrome in a general population younger than 50 years of age in an era of radiofrequency catheter ablation. Int J Cardiol 2014;174:530534.
- Skov MW, Rasmussen PV, Ghouse J, Hansen SM, Graff C, Olesen MS, Pietersen A, Torp-Pedersen C, Haunsø S, Køber L, Svendsen JH, Holst AG, Nielsen JB. Electrocardiographic preexcitation and risk of cardiovascular morbidity and mortality. Results from the Copenhagen ECG Study. Circ Arrhythm Electrophysiol 2017;10:e004778.
- Granada J, Uribe W, Chyou P-H, Maassen K, Vierkant R, Smith PN, Hayes J, Eaker E, Vidaillet H. Incidence and predictors of atrial flutter in the general population. J Am Coll Cardiol 2000;36:22422246.
- Withers KL, White J, Carolan-Rees G, Patrick H, O’Callaghan P, Murray S, Cunningham D, Wood KA, Lencioni M, Griffith M. Patient reported outcome measures for cardiac ablation procedures: a multicentre pilot to develop a new questionnaire. Europace 2014;16:16261633.
- Wood KA, Stewart AL, Drew BJ, Scheinman MM, Froelicher ES. Patient perception of symptoms and quality of life following ablation in patients with supraventricular tachycardia. Heart Lung 2010;39:1220.
- White J, Withers KL, Lencioni M, Carolan-Rees G, Wilkes AR, Wood KA, Patrick H, Cunningham D, Griffith M. Cardiff cardiac ablation patient-reported outcome measure (C-CAP): validation of a new questionnaire set for patients undergoing catheter ablation for cardiac arrhythmias in the UK. Qual Life Res 2016;25:15711583.
- Brachmann J, Lewalter T, Kuck KH, Andresen D, Willems S, Spitzer SG, Straube F, Schumacher B, Eckardt L, Danilovic D, Thomas D, Hochadel M, Senges J. Long-term symptom improvement and patient satisfaction following catheter ablation of supraventricular tachycardia: insights from the German ablation registry. Eur Heart J 2017;38:13171326.
- Farkowski MM, Pytkowski M, Maciag A, Golicki D, Wood KA, Kowalik I, Kuteszko R, Szwed H. Gender-related differences in outcomes and resource utilization in patients undergoing radiofrequency ablation of supraventricular tachycardia: results from Patients’ Perspective on Radiofrequency Catheter Ablation of AVRT and AVNRT Study. Europace 2014;16:18211827.
- Feldman A, Voskoboinik A, Kumar S, Spence S, Morton JB, Kistler PM, Sparks PB, Vohra JK, Kalman JM. Predictors of acute and long-term success of slow pathway ablation for atrioventricular nodal reentrant tachycardia: a single center series of 1,419 consecutive patients. Pacing Clin Electrophysiol 2011;34:927933.
- Zimetbaum P, Josephson ME. Evaluation of patients with palpitations. N Engl J Med 1998;338:13691373.
- Page RL, Wilkinson WE, Clair WK, McCarthy EA, Pritchett EL. Asymptomatic arrhythmias in patients with symptomatic paroxysmal atrial fibrillation and paroxysmal supraventricular tachycardia. Circulation 1994;89:224227.
- Thavendiranathan P, Bagai A, Khoo C, Dorian P, Choudhry NK. Does this patient with palpitations have a cardiac arrhythmia? JAMA 2009;302:21352143.
- Leitch JW, Klein GJ, Yee R, Leather RA, Kim YH. Syncope associated with supraventricular tachycardia. An expression of tachycardia rate or vasomotor response? Circulation 1992;85:10641071.
- Thiruganasambandamoorthy V, Rowe BH, Sivilotti MLA, McRae AD, Arcot K, Nemnom MJ, Huang L, Mukarram M, Krahn AD, Wells GA, Taljaard M. Duration of electrocardiographic monitoring of emergency department patients with syncope. Circulation 2019;139:13961406.
- Razavi M, Luria DM, Jahangir A, Hodge DO, Low PA, Shen W-K. Acute blood pressure changes after the onset of atrioventricular nodal reentrant tachycardia: a time-course analysis. J Cardiovasc Electrophysiol 2005;16:10371040.
- Abe H, Nagatomo T, Kobayashi H, Miura Y, Araki M, Kuroiwa A, Nakashima Y. Neurohumoral and hemodynamic mechanisms of diuresis during atrioventricular nodal reentrant tachycardia. Pacing Clin Electrophysiol 1997;20(11):2783-2788.
- Chinen S, Miura M, Tamame T, Matsuoka M, Ohki H, Sumitomo N. Life-threatening atrial tachycardia after the Senning operation in a patient with transposition of the great arteries. Heart Vessels 2012;27:424427.
- Gu ¨rsoy S, Steurer G, Brugada J, Andries E, Brugada P. The hemodynamic mechanism of pounding in the neck in atrioventricular nodal reentrant tachycardia. N Engl J Med 1992;327:772774.
- Contreras-Valdes FM, Josephson ME. IMAGES IN CLINICAL MEDICINE. “Frog sign” in atrioventricular nodal reentrant tachycardia. N Engl J Med 2016;374:e17.
- Lessmeier TJ, Gamperling D, Johnson-Liddon V, Fromm BS, Steinman RT, Meissner MD, Lehmann MH. Unrecognized paroxysmal supraventricular tachycardia: potential for misdiagnosis as panic disorder. Arch Intern Med 1997;157:537543.
- Appelboam A, Reuben A, Mann C, Gagg J, Ewings P, Barton A, Lobban T, Dayer M, Vickery J, Benger J. Postural modification to the standard Valsalva manoeuvre for emergency treatment of supraventricular tachycardias (REVERT): a randomised controlled trial. Lancet 2015;386:17471753.
- Wang R, Blackburn G, Desai M, Phelan D, Gillinov L, Houghtaling P, Gillinov M. Accuracy of wrist-worn heart rate monitors. JAMA Cardiol 2017;2:104106.
- Katritsis DG, Mark DB, Gersh BJ. Revascularization in stable coronary disease: evidence and uncertainties. Nat Rev Cardiol 2018;15:408419.
- Michowitz Y, Tovia-Brodie O, Heusler I, Sabbag A, Rahkovich M, Shmueli H, Glick A, Belhassen B. Differentiating the QRS morphology of posterior fascicular ventricular tachycardia from right bundle branch block and left anterior hemiblock aberrancy. Circ Arrhythm Electrophysiol 2017;10:e005074.
- Katritsis DG, Josephson ME. Differential diagnosis of regular, narrow-QRS tachycardias. Heart Rhythm 2015;12:16671676.
- Roberts-Thomson KC, Kistler PM, Kalman JM. Focal atrial tachycardia I: clinical features, diagnosis, mechanisms, and anatomic location. Pacing Clin Electrophysiol 2006;29:643652.
- Katritsis DG, Becker A. The atrioventricular nodal reentrant tachycardia circuit: a proposal. Heart Rhythm 2007;4:13541360.
- Jaı ¨s P, Matsuo S, Knecht S, Weerasooriya R, Hocini M, Sacher F, Wright M, Nault I, Lellouche N, Klein G, Cle´menty J, Haı¨ssaguerre M. A deductive mapping strategy for atrial tachycardia following atrial fibrillation ablation: importance of localized reentry. J Cardiovasc Electrophysiol 2009;20:480491. 49. Green M, Heddle B, Dassen W, Wehr M, Abdollah H, Brugada P, Wellens HJ. Value of QRS alteration in determining the site of origin of narrow QRS supraventricular tachycardia. Circulation 1983;68:368373.
- Chen SA, Tai CT, Chiang CE, Chang MS. Role of the surface electrocardiogram in the diagnosis of patients with supraventricular tachycardia. Cardiol Clin 1997;15:539565.
- Morady F. Significance of QRS alternans during narrow QRS tachycardias. Pacing Clin Electrophysiol 1991;14:21932198.
- Crawford TC, Mukerji S, Good E, Chugh A, Bogun F, Pelosi F, Oral H, Morady F, Jongnarangsin K. Utility of atrial and ventricular cycle length variability in determining the mechanism of paroxysmal supraventricular tachycardia. J Cardiovasc Electrophysiol 2007;18:698703.
- Bogossian H, Ninios I, Frommeyer G, Bandorski D, Eckardt L, Lemke B, Zarse M. U wave during supraventricular tachycardia: simulation of a long RP tachycardia and hiding the common type AVNRT. Ann Noninvasive Electrocardiol 2015;20:292295.
- Nagashima K, Watanabe I, Okumura Y, Kaneko Y, Sonoda K, Kogawa R, Sasaki N, Iso K, Takahashi K, Kurokawa S, Nakai T, Ohkubo K, Hirayama A. Ventriculoatrial intervals <_70 ms in orthodromic atrioventricular reciprocating tachycardia. Pacing Clin Electrophysiol 2016;39:11081115.
- Letsas KP, Weber R, Herrera Siklody C, Mihas CC, Stockinger J, Blum T, Kalusche D, Arentz T. Electrocardiographic differentiation of common type atrioventricular nodal reentrant tachycardia from atrioventricular reciprocating tachycardia via a concealed accessory pathway. Acta Cardiologica 2010;65:171176.
- Kalbfleisch SJ, el-Atassi R, Calkins H, Langberg JJ, Morady F. Differentiation of paroxysmal narrow QRS complex tachycardias using the 12-lead electrocardiogram. J Am Coll Cardiol 1993;21:8589.
- Tai CT, Chen SA, Chiang CE, Lee SH, Wen ZC, Chiou CW, Ueng KC, Chen YJ, Yu WC, Chang MS. A new electrocardiographic algorithm using retrograde P waves for differentiating atrioventricular node reentrant tachycardia from atrioventricular reciprocating tachycardia mediated by concealed accessory pathway. J Am Coll Cardiol 1997;29:394402.
- Di Toro D, Hadid C, Lopez C, Fuselli J, Luis V, Labadet C. Utility of the aVL lead in the electrocardiographic diagnosis of atrioventricular node re-entrant tachycardia. Europace 2009;11:944948.
- Haghjoo M, Bahramali E, Sharifkazemi M, Shahrzad S, Peighambari M. Value of the aVR lead in differential diagnosis of atrioventricular nodal reentrant tachycardia. Europace 2012;14:16241628.
- Knight BP, Ebinger M, Oral H, Kim MH, Sticherling C, Pelosi F, Michaud GF, Strickberger SA, Morady F. Diagnostic value of tachycardia features and pacing maneuvers during paroxysmal supraventricular tachycardia. J Am Coll Cardiol 2000;36:574582.
- Markowitz SM, Stein KM, Mittal S, Slotwtner DJ, Lerman BB. Differential effects of adenosine on focal and macroreentrant atrial tachycardia. J Cardiovasc Electrophysiol 1999;10:489502.
- Alzand BSN, Manusama R, Gorgels APM, Wellens HJJ. An “almost wide” QRS tachycardia. Circ Arrhythm Electrophysiol 2009;2:e1e3.
- Alzand BSN, Crijns HJ. Diagnostic criteria of broad QRS complex tachycardia: decades of evolution. Europace 2011;13:465472.
- Stewart RB, Bardy GH, Greene H. Wide complex tachycardia: misdiagnosis and outcome after emergent therapy. Ann Intern Med 1986;104:766771.
- Wellens HJJ. Ventricular tachycardia: diagnosis of broad QRS complex tachycardia. Heart 2001;86:579585.
- Willems S, Shenasa M, Borggrefe M, Hindricks G, Chen X, Rotman B, Kottkamp H, Haverkamp W, Breithardt G. Atrioventricular nodal reentry tachycardia: electrophysiologic comparisons in patients with and without 2:1 infra-His block. Clin Cardiol 1993;16:883888.
- Ranger S, Talajic M, Lemery R, Roy D, Villemaire C, Nattel S. Kinetics of usedependent ventricular conduction slowing by antiarrhythmic drugs in humans. Circulation 1991;83:19871994.
- Jastrzebski M, Kukla P, Czarnecka D, Kawecka-Jaszcz K. Comparison of five electrocardiographic methods for differentiation of wide QRS-complex tachycardias. Europace 2012;14:11651171.
- Brugada P, Brugada J, Mont L, Smeets J, Andries EW. A new approach to the differential diagnosis of a regular tachycardia with a wide QRS complex. Circulation 1991;83:16491659.
- Kindwall KE, Brown J, Josephson ME. Electrocardiographic criteria for ventricular tachycardia in wide complex left bundle branch block morphology tachycardias. Am J Cardiol 1988;61:12791283.
- Vereckei A, Duray G, Sze´nasi G, Altemose GT, Miller JM. New algorithm using only lead aVR for differential diagnosis of wide QRS complex tachycardia. Heart Rhythm 2008;5:8998.
- Pava LF, Perafan P, Badiel M, Arango JJ, Mont L, Morillo CA, Brugada J. R-wave peak time at DII: a new criterion for differentiating between wide complex QRS tachycardias. Heart Rhythm 2010;7:922926.
- Steurer G, Gursoy S, Frey B, Simonis F, Andries E, Kuck K, Brugada P. The differential diagnosis on the electrocardiogram between ventricular tachycardia and preexcited tachycardia. Clin Cardiol 1994;17:306308.
- Jastrzebski M, Moskal P, Kukla P, Fijorek K, Kisiel R, Czarnecka D. Specificity of wide QRS complex tachycardia criteria and algorithms in patients with ventricular preexcitation. Ann Noninvasive Electrocardiol 2018;23:e12493.
- Alberca T, Almendral J, Sanz P, Almazan A, Cantalapiedra JL, Delcan JL. Evaluation of the specificity of morphological electrocardiographic criteria for the differential diagnosis of wide QRS complex tachycardia in patients with intraventricular conduction defects. Circulation 1997;96:35273533.
- Ceresnak SR, Liberman L, Avasarala K, Tanel R, Motonaga KS, Dubin AM. Are wide complex tachycardia algorithms applicable in children and patients with congenital heart disease? J Electrocardiol 2010;43:694700.
- Jastrzebski M, Kukla P, Czarnecka D, Kawecka-Jaszcz K. Specificity of the wide QRS complex tachycardia algorithms in recipients of cardiac resynchronization therapy. J Electrocardiol 2012;45:319326.
- Lau EW, Ng GA. Comparison of the performance of three diagnostic algorithms for regular broad complex tachycardia in practical application. Pacing Clin Electrophysiol 2002;25:822827.
- Isenhour JL, Craig S, Gibbs M, Littmann L, Rose G, Risch R. Wide-complex tachycardia: continued evaluation of diagnostic criteria. Acad Emerg Med 2000;7:769773.
- Baxi RP, Hart KW, Vereckei A, Miller J, Chung S, Chang W, Gottesman B, Hunt M, Culyer G, Trimarco T, Willoughby C, Suarez G, Lindsell CJ, Collins SP. Vereckei criteria as a diagnostic tool amongst emergency medicine residents to distinguish between ventricular tachycardia and supra-ventricular tachycardia with aberrancy. J Cardiol 2012;59:307312.
- Jastrzebski M, Sasaki K, Kukla P, Fijorek K, Stec S, Czarnecka D. The ventricular tachycardia score: a novel approach to electrocardiographic diagnosis of ventricular tachycardia. Europace 2016;18:578584.
- Yadav AV, Nazer B, Drew BJ, Miller JM, El Masry H, Groh WJ, Natale A, Marrouche N, Badhwar N, Yang Y, Scheinman MM. Utility of conventional electrocardiographic criteria in patients with idiopathic ventricular tachycardia. JACC Clin Electrophysiol 2017;3:669677.
- Knight BP, Zivin A, Souza J, Goyal R, Man KC, Strickberger A, Morady F. Use of adenosine in patients hospitalized in a university medical center. Am J Med 1998;105:275280.
- Jolobe OMP. Caveats in preexcitation-related atrial fibrillation. Am J Emerg Med 2010;28:252253.
- Murman DH, McDonald AJ, Pelletier AJ, Camargo CA. U.S. Emergency Department Visits for Supraventricular Tachycardia, 19932003. Acad Emerg Med 2007;14(6):578-581.
- Roth A, Elkayam I, Shapira I, Sander J, Malov N, Kehati M, Golovner M. Effectiveness of prehospital synchronous direct-current cardioversion for supraventricular tachyarrhythmias causing unstable hemodynamic states. Am J Cardiol 2003;91:489491.
- Wittwer MR, Rajendran S, Kealley J, Arstall MA. A South Australian registry of biphasic cardioversions of atrial arrhythmias: efficacy and predictors of success. Heart Lung Circ 2015;24:342347.
- Reisinger J, Gstrein C, Winter T, Zeindlhofer E, Ho¨llinger K, Mori M, Schiller A, Winter A, Geiger H, Siostrzonek P. Optimization of initial energy for cardioversion of atrial tachyarrhythmias with biphasic shocks. Am J Emerg Med 2010;28:159165.
- Smith GD, Fry MM, Taylor D, Morgans A, Cantwell K. Effectiveness of the Valsalva Manoeuvre for reversion of supraventricular tachycardia. Cochrane Database Syst Rev 2015;2:CD009502.
- Lim SH, Anantharaman V, Teo WS, Goh PP, Tan ATH. Comparison of treatment of supraventricular tachycardia by Valsalva maneuver and carotid sinus massage. Ann Emerg Med 1998;31:3035.
- Smith G, Morgans A, Boyle M. Use of the Valsalva manoeuvre in the prehospital setting: a review of the literature. Emerg Med J 2009;26:810.
- Brady WJJ, DeBehnke DJ, Wickman LL, Lindbeck G. Treatment of out-of-hospital supraventricular tachycardia: adenosine vs verapamil. Acad Emerg Med 1996;3(6):574-585.
- Glatter KA, Cheng J, Dorostkar P, Modin G, Talwar S, Al-Nimri M, Lee RJ, Saxon LA, Lesh MD, Scheinman MM. Electrophysiologic effects of adenosine in patients with supraventricular tachycardia. Circulation 1999;99:10341040.
- Delaney B, Loy J, Kelly A-M. The relative efficacy of adenosine versus verapamil for the treatment of stable paroxysmal supraventricular tachycardia in adults: a meta-analysis. Eur J Emerg Med 2011;18:148152.
- Dougherty AH, Jackman WM, Naccarelli GV, Friday KJ, Dias VC. Acute conversion of paroxysmal supraventricular tachycardia with intravenous diltiazem. Am J Cardiol 1992;70:587592.
- Hood MA, Smith WM. Adenosine versus verapamil in the treatment of supraventricular tachycardia: A randomized double-crossover trial. Am Heart J 1992;123:15431549.
- Gupta A, Naik A, Vora A, Lokhandwala Y. Comparison of efficacy of intravenous diltiazem and esmolol in terminating supraventricular tachycardia. J Assoc Physicians India 1999;47:969972.
- Lim SH, Anantharaman V, Teo WS, Chan YH. Slow infusion of calcium channel blockers compared with intravenous adenosine in the emergency treatment of supraventricular tachycardia. Resuscitation 2009;80:523528.
- Das G, Tschida V, Gray R, Dhurandhar R, Lester R, McGrew F, Askenazi J, Kaplan K, Emanuele M, Turlapaty P, Hua TA, Hoff J, Allin D, Laddu A. Efficacy of esmolol in the treatment and transfer of patients with supraventricular tachyarrhythmias to alternate oral antiarrhythmic agents. J Clin Pharmacol1988;28:746750.
- Amsterdam EA, Kulcyski J, Ridgeway MG. Efficacy of cardioselective beta-adrenergic blockade with intravenously administered metoprolol in the treatment of supraventricular tachyarrhythmias. J Clin Pharmacol 1991;31:714718.
- Smith G, Taylor DM, Morgans A, Cameron P. Prehospital synchronized electrical cardioversion of a poorly perfused SVT patient by paramedics. Prehosp Disaster Med 2013;28:301304. 102. Wen Z-C, Chen S-A, Tai C-T, Chiang C-E, Chiou C-W, Chang M-S. E







