4.2. Các thử nghiệm lâm sàng có liên quan:
Sử dụng DTIs trong điều trị hội chứng mạch vành cấp đã được đánh giá qua một số thử nghiệm lâm sàng. Hai thử nghiệm lâm sàng GUSTO-IIA (the Global Utilization of Strategies to Open Occluded Coronary Arteries) [57] và OASIS-2 (the Organization
4.2. Các thử nghiệm lâm sàng có liên quan:
Sử dụng DTIs trong điều trị hội chứng mạch vành cấp đã được đánh giá qua một số thử nghiệm lâm sàng. Hai thử nghiệm lâm sàng GUSTO-IIA (the Global Utilization of Strategies to Open Occluded Coronary Arteries) [57] và OASIS-2 (the Organization to Assess Strategies for Ischemic Syndromes) [23] tập trung vào sử dụng hirudin dạng kết hợp trong điều trị hội chứng mạch vành cấp. GUSTO IIB là thử nghiệm quốc tế đa trung tâm so sánh heparin với hirudin liều thấp (0,1 mg/kg bolus, sau đó 0,1 mg/kg/ giờ truyền tĩnh mạch; aPTT mục tiêu là 60-85 giây) trên 12.142 bệnh nhân đăng kí trong năm 1994 và 1995 hoặc là NMCT có đoạn ST chênh lên (4.131 bệnh nhân) hoặc không có đoạn ST chênh lên (8.011 bệnh nhân) [1]. Tại thời điểm 24 giờ, điều trị hirudin có liên quan tới giảm tỉ lệ tử vong hoặc NMCT tái phát có ý nghĩa thống kê (1,3% so với 2,1% với heparin, p=0,001). Tuy nhiên, tới ngày thứ 30, sự khác biệt này chỉ ở mức giới hạn 8,9% và 9,8% ở hai nhóm hirudin và heparin (p=0,06) trong các tiêu chí chính của nghiên cứu là tử vong hoặc NMCT không tử vong. Trong nhóm bệnh nhân không có đoạn ST chênh lên, sự khác biệt về tỉ lệ tử vong hoặc thiếu máu cục bộ tái phát ít ấn tượng và không có ý nghĩa thống kê (8,3% đối với hirudin so với 9,1% đối với heparin, p=0,22). Xu hướng giảm biến cố thiếu máu cơ tim cục bộ được bù trừ bởi sự gia tăng tỉ lệ chảy máu mức độ trung bình và nặng và tỉ lệ truyền máu là 9,7% đối với hirudin so với 8,6% của heparin (p=0,04).
Một thử nghiệm được thực hiện theo sau đó là OASIS II, đánh giá một giả thuyết tương tự là hirudin sẽ tốt hơn heparin trong điều trị bệnh nhân NSTE ACS [23]. Trong thử nghiệm này, 10.141 bệnh nhân được đưa vào nghiên cứu từ tháng 8 năm 1996 tới tháng 4 năm 1998 và được phân ngẫu nhiên điều trị với liều chuẩn của UFH so với liều cao của hirudin (0,4 mg/kg bolus, sau đó 0,15 mg/kg/giờ truyền tĩnh mạch, aPTT mục tiêu 60-100 giây). Tại thời điểm 7 ngày, nhóm bệnh nhân được điều trị với hirudin ít bị các biến cố như tử vong hoặc NMCT mới hơn (3,6% so với 4,2%, p=0,07). Mặt khác, điều trị với hirudin có liên quan tới giảm ý nghĩa thống kê tiêu chí kết hợp bao gồm tử vong, NMCT hoặc đau thắt ngực không đáp ứng với điều trị tại thời điểm 7 ngày (5,6% so với 6,7% của heparin, p=0,0125). Sự khác biệt đặc biệt rõ nhất ở nhóm bệnh nhân nguy cơ cao, những người mà cuối cùng cần phải can thiệp. Tương tự như thử nghiệm GUSTO II, nguy cơ chảy máu nặng cao hơn ở nhóm hirudin so với nhóm điều trị heparin (1,2% so với 0,7%, p=0,01).
Một phân tích gộp được thực hiện bởi sự cộng tác của các nhà nghiên cứu về các thử nghiệm DTIs để so sánh hiệu quả và sự an toàn của 4 thử nghiệm DTIs khác nhau từ 11 thử nghiệm lâm sàng ngẫu nhiên và 35.970 bệnh nhân bị NSTE ACS và NMCT cấp có đoạn ST chênh lên được đưa vào phân tích [21]. So với heparin, bệnh nhân điều trị với DTIs có giảm ý nghĩa tiêu chí chính về hiệu quả trên tỉ lệ tử vong hoặc NMCT (4,3% so với 5,1%) tại ngày thứ 30. Đặc biệt nhất là lợi ích điều trị được thấy ở nhóm DTIs hai hóa trị, hirudin và bivalirudin, còn ở nhóm DTIs đơn hóa trị, inogatran hoặc argatroban thì không thấy được điều này. Phát hiện này cũng được xác nhận trong nhóm bệnh nhân NSTE ACS với tiêu chí chính xảy ra 3,7% ở nhóm DTIs so với 4,6% ở nhóm heparin ([OR] 0,80 (0,70-0,92)). Có lẽ đáng chú ý nhất từ kết quả của các thử nghiệm OASIS II và GUSTO II là có sự gia tăng chảy máu nặng ở nhóm hirudin nhưng tỉ lệ này giảm thật sự ở nhóm bivalirudin. Sự phát hiện về hiệu quả của kháng đông mà không có liên quan tới chảy máu nặng được công bố lần đầu tiên trong thử nghiệm BAT (Bivalirudin Angioplasty Trial). Thử nghiệm này bao gồm 4.098 bệnh nhân hoặc là đau thắt ngực không ổn định hoặc là đau thắt ngực sau NMCT giữa tháng 3 năm 1993 và tháng 7 năm 1994 [10]. Bệnh nhân ngẫu nhiên được điều trị với heparin hoặc bivalirudin trước khi chụp động mạch vành. Mặc dù không có sự khác biệt ở tiêu chí chính về tử vong trong bệnh viện, NMCT, tắc mạch máu cấp tính hoặc lâm sàng trở nặng do nguyên nhân tim giữa bivalirudin và heparin (11,4% so với 12,2%, p=0,44), nhưng có một sự giảm ý nghĩa tỉ lệ chảy máu nặng được thấy trong nhóm điều trị với bivalirudin so với nhóm điều trị với heparin (3,8% so với 9,8%, p < 0.001). Dù cho cơ chế chưa được hiểu rõ, nhưng có giả thuyết rằng sự giảm chảy máu được thấy ở bivalirubin là do sự gắn kết với thrombin có thể phục hồi được và thời gian bán hủy ngắn [10]. Kết quả của thử nghiệm BAT cho thấy bivalirubin có thể ít nhất cũng tương đương trong giảm biến cố thiếu máu cơ tim cục bộ mà không gây ra gia tăng nguy cơ chảy máu. Gộp chung lại, các kết quả của các thử nghiệm riêng biệt và phân tích gộp so sánh DTIs với heparin trong điều trị hội chứng mạch vành cấp cho thấy DTIs hơn heparin trong điều trị giảm biến cố thiếu máu cơ tim cục bộ ở mức độ vừa phải, và trong một giới hạn điều trị để đạt được hiệu quả điều trị thì hirudin làm gia tăng chảy máu. Phân tích gộp cũng cho thấy sự không đồng nhất của DTIs trong cả lợi ích lâm sàng và tỉ lệ chảy máu nặng. Lợi ích lớn nhất trong phân tích gộp được thấy từ những bệnh nhân được điều trị với bivalirudin, những người mà sau đó trải qua can thiệp động mạch vành qua da [21], những người mà trong thử nghiệm BAT đã cho thấy bivalirubin thật sự giảm được tỉ lệ chảy máu.
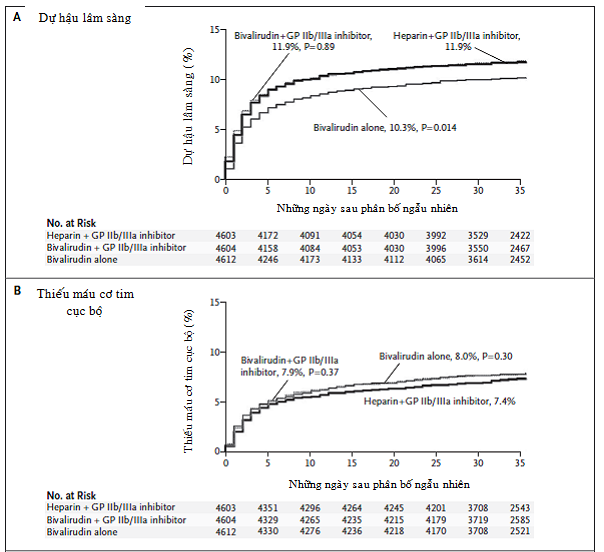
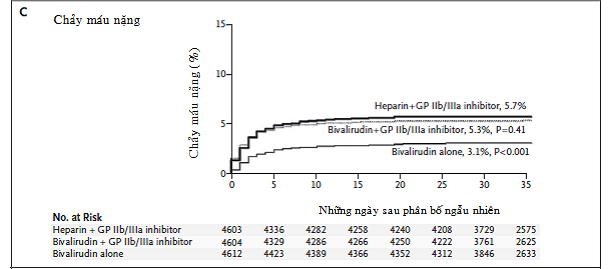
Dựa trên các thông số an toàn so với các DTIs khác và từ kết quả của thử nghiệm BAT, bivalirudin nhận được chấp nhận dùng như là thuốc điều trị kháng đông trong can thiệp động mạch vành qua da. Tuy nhiên, sử dụng rộng rãi bivalirudin trong trường hợp này không xảy ra cho tới khi thử nghiệm REPLACE-2 (The Randomized Evaluation in PCI Linking Angiomax to Reduced Clinical Events) cho thấy bivalirudin có thể được dùng như là thuốc kháng thay thế cho heparin và ức chế thụ thể GP IIb/IIIa [43]. Thử nghiệm REPLACE-2 cho thấy bivalirudin không kém heparin kết hợp với ức chế thụ thể IIb/IIIa trong giảm biến cố thiếu máu cơ tim cục bộ liên quan tới can thiệp mạch vành qua da, trong khi giảm một cách ý nghĩa tỉ lệ chảy máu trong bệnh viện (4,1% ở nhóm heparin kết hợp với ức chế thụ thể GP IIb/IIIa so với 2,4% ở nhóm bivalirubin đơn thuần, p=0,001). Dự định của thử nghiệm REPLACE-2 là để đánh giá việc dùng bivalirudin trong can thiệp chương trình hoặc khẩn cấp, và thử nghiệm không bao gồm những bệnh nhân NMCT cấp hoặc những người đã được dùng kháng đông trước khi can thiệp mạch vành do hội chứng vành cấp nguy cơ cao [43]. Vì vậy, để đánh giá vai trò của bivalirudin trong bệnh cảnh chung từ điều trị nội khoa hiện tại tới chụp mạch vành sớm và can thiệp mạch vành qua da trong trường hợp hội chứng mạch vành cấp có nguy cơ trung bình hoặc cao, thì thử nghiệm ACUITY (the Acute Catheterization and Urgent Intervention Triage Strategy) được thực hiện [62]. Thử nghiệm này bao gồm 13.819 bệnh nhân, tất cả được dùng aspirin và trải qua chụp động mạch vành trong vòng 72 giờ nhập viện, dùng clopidogrel thì tùy theo các nhà nghiên cứu địa phương. Bệnh nhân được chia thành một trong ba nhóm để điều trị kháng đông: UFH hoặc LMWH kết hợp với ức chế thụ thể GP IIb/IIIa (heparin kết hợp với ức chế thụ thể GP IIb/IIIa), bivalirudin kết hợp với ức chế thụ thể GP IIb/IIIa hoặc bivalirudin kết hợp tạm thời với ức chế thụ thể GP IIb/IIIa (tùy ý các nhà nghiên cứu, bivalirudin đơn thuần). Cả hai nhóm bivalirudin đơn thuần và kết hợp với ức chế thụ thể GP IIb/IIIa, so với heparin kết hợp với ức chế thụ thể GP IIb/IIIa, có liên quan tới tỉ lệ cao hơn của tiêu chí chính về tử vong, NMCT hoặc tái tưới máu khẩn cấp (hình 4.3). Tỉ lệ chảy máu nặng thì tương tự cho nhóm bivalirudin kết hợp với ức chế thụ thể GP IIb/IIIa và heparin kết hợp với ức chế thụ thể GP IIb/IIIa (5,3% so với 5,6%, p=0,38), trong ở nhóm khi bivalirudin đơn thuần thì ít chảy máu nặng hơn một cách có ý nghĩa thống kê (3,0%, p<0,001). Trong phân tích phân nhóm, có một điều đáng chú ý là điều trị với bivalirudin đơn thuần mà không có điều trị trước đó với clopidogrel trước khi chụp động mạch vành cho thấy gia tăng biến cố thiếu máu cơ tim cục bộ ở mức gần đạt ý nghĩa về mặt thống kê (9,1% so với 7,1% ở nhóm heparin kết hợp với ức chế thụ thể GP IIb/IIIa, p= 0,054). Trong một phân tích chi tiết sau đó cho thấy rằng dự hậu ở nhóm đơn trị liệu bivalirudin thì tương tự với nhóm heparin kết hợp với ức chế thụ thể GP IIb/IIIa miễn là clopidogrel được dùng trước hoặc trong vòng 30 phút sau khi hoàn tất can thiệp mạch vành qua da. [44]
Hình 4.3. Đường cong thời gian-biến cố Kaplan-Meier về các tiêu chí dự hậu lâm sàng (a), thiếu máu cơ tim cục bộ (b), chảy máu nặng (c). [62]
4.3. Các khuyến cáo hiện nay về sử dụng ức chế thrombin trực tiếp trong hội chứng mạch vành cấp.
Hirudin có lợi ích trong NSTE ACS (đặc biệt ở những bệnh nhân trải qua can thiệp mạch vành qua da) so với UFH. Tuy nhiên, nó có liên quan tới gia tăng nguy cơ chảy máu nặng và cần phải truyền máu. Bivalirudin đơn thuần thì hiệu quả như UFH hoặc enoxaparin kết hợp với ức chế thụ thể GP IIb/IIIa ở bệnh nhân hội chứng mạch vành cấp có nguy cơ từ trung bình tới nguy cơ cao trải qua can thiệp mạch vành qua da và có liên quan tới nguy cơ chảy máu thấp hơn.
Trong năm 2007, Hội Tim mạch và Trường Môn Tim mạch Hoa Kì (ACC/AHA) đã đưa ra khuyến cáo về vai trò của của ức chế thrombin trực tiếp cho bệnh nhân NSTE ACS như sau: [4]
– Những bệnh nhân mà chiến lược điều trị xâm lấn được chọn lựa, bivalirudin được đề nghị dùng, với enoxaparin, UFH và fondaparinux là thuốc thay thế. Khi bivalirudin được chọn dùng như là thuốc kháng đông thì có thể ngưng ức chế thụ thể GP IIb/IIIa trước chụp mạch vành chẩn đoán và can thiệp mạch vành qua da miễn là clopidogrel (ít nhất 300 mg) được cho ít nhất 6 giờ trước thủ thuật.
– Những bệnh nhân mà CABG được chọn lựa như là chiến lược điều trị sau khi có kết quả chụp động mạch vành, thì ngưng bivalirudin 3 giờ trước CABG và chuyển sang UFH với liều phù hợp.
– Những bệnh nhân mà điều trị nội khoa được chọn lựa sau khi có kết quả chụp động mạch vành và bivalirudin đã được dùng trước thủ thuật, hoặc ngưng bivalirudin hoặc tiếp tục dùng với liều 0,25 mg/kg/giờ cho tới 72 giờ tùy ý theo bác sĩ điều trị.
5. ỨC CHẾ TỔNG HỢP YẾU TỐ Xa TRONG ĐIỀU TRỊ HỘI CHỨNG MẠCH VÀNH CẤP.
5.1. Cơ chế tác dụng:
Fondaparinux sodium là một pentasaccharide tổng hợp và là thuốc tiêu biểu cho ức chế chọn lọc yếu tố Xa hiện nay [12]. Fondaparinux bao gồm ba đơn vị d-glucosamine được chia ra bởi một đơn vị acid d-glucuronic và một đơn vị acid l-iduronic, mỗi đơn vị này có một số nhóm sulfonate ở những vị trí quan trọng (hình 5.1).
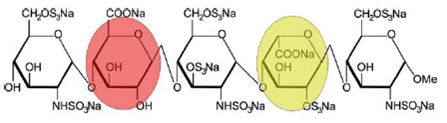
Hình 5.1. Cấu trúc phân tử của fondaparinux sodium. Ba đơn vị d-glucosamine được chia ra bởi một đơn vị acid d-glucuronic (màu đỏ) và một đơn vị acid l-iduronic (màu vàng).
Các nghiên cứu về tinh thể học cho thấy rằng nó gắn kết một cách chọn lọc tại vị trí gắn kết của heparin trên antithrombin và điều này gây ra thay đổi cấu hình vĩnh viễn của phân tử antithrombin [38]. Sự thay đổi cấu hình này làm cho antithrombin gia tăng ái tính với yếu tố Xa, gia tăng khoảng 300 lần khả năng ức chế yếu tố Xa. Một khi yếu tố Xa được gắn kết, fondaparinux được phóng thích từ antithrombin, sẽ cho phép nó gắn kết liên tục với một số phân tử antithrombin (hình 5.2).
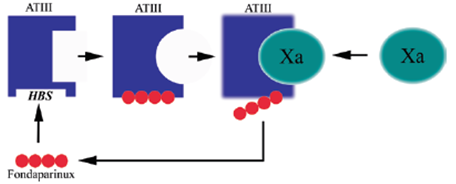
Chú thích: ATIII antithrombin III; HBS: heparin binding site (vị trí gắn kết của heparin).
Hình 5.2. Cơ chế tác dụng của fondaparinux.
Không giống như UFH và LMWH, fondaparinux không tương tác với các phân tử protein trong huyết tương khác (bao gồm yếu tố IIa). Nó chỉ tác dụng chọn lọc trên yếu tố Xa, điều này có thể giúp cho dự đoán được tác dụng dược lý của nó. Các nghiên cứu về dược động học trên người tình nguyện trẻ khỏe mạnh cho thấy rằng fondaparinux tiêm dưới da có hoạt tính sinh học 100%, biểu hiện bằng khởi phát tác dụng nhanh chóng (đạt tới nửa nồng độ tối đa trong huyết tương trong vòng 25 phút và nồng độ tối đa trong 2 giờ), thời gian bán hủy khoảng 15 giờ, thích hợp cho dùng một lần mỗi ngày [55]. Fondaparinux dùng qua đường tĩnh mạch cũng có những đặc điểm về dược động học tương tự như dùng qua đường tiêm dưới da. Fondaparinux được đào thải chủ yếu qua thận.
5.2. Các thử nghiệm lâm sàng có liên quan tới fondaparinux trong điều trị hội chứng mạch vành cấp:
ASPIRE (The Arixtra Study in Percutaneous Coronary Intervention: a Randomized Evaluation) [50] thử nghiệm ngẫu nhiên, mù đơn, phase II so sánh hai liều fondaparinux (2,5 mg và 5 mg) với UFH (100 đơn vị/kg mà không có dùng cùng lúc ức chế thự thể GP IIb/IIIa; 65 đơn vị/kg với dùng cùng lúc ức chế thụ thể GP IIb/IIIa) ở 350 bệnh nhân trải qua can thiệp động mạch vành qua da. Các chỉ định chính cho can thiệp là hội chứng mạch vành cấp (79%) hoặc đau thắt ngực ổn định (20%). Thử nghiệm này là điều kiện cần thiết để thực hiện thử nghiệm lớn OASIS-5 và OASIS-6 sau đó. Thử nghiệm ASPIRE giúp xác định liều tối ưu của fondaparinux cho những bệnh nhân trong hai thử nghiệm này, những người mà sẽ được can thiệp mạch vành qua da. Thử nghiệm ASPIRE là nghiên cứu an toàn với tiêu chí chính bao gồm biến cố chảy máu nặng và nhẹ trong vòng 48 giờ sau can thiệp mạch vành. Hiệu quả của fondaparinux cũng đã được khảo sát như là tiêu chí phụ bao gồm tử vong, NMCT, tái tưới máu khẩn cấp và sử dụng ức chế thụ thể GP IIb/IIIa hỗ trợ trong cùng khoảng thời gian trên (48 giờ). Khi so sánh với những bệnh nhân được điều trị với UFH, những bệnh nhân được điều trị với fondaparinux có xu hướng chảy máu ít hơn nhưng không có ý nghĩa thống kê (7,6% so với 6%, p=0,61) (hình 5.3). Thêm vào đó, có xu hướng tỉ lệ chảy máu thấp hơn ở nhóm fondaparinux liều thấp (2,5 mg) nhưng không có ý nghĩa thống kê (3,4% so với 9,6%, p=0,06). Kết quả này cũng tương tự ở những bệnh nhân có kế hoạch hoặc không có kế hoạch điều trị với ức chế GP IIb/IIIa đường tĩnh mạch.
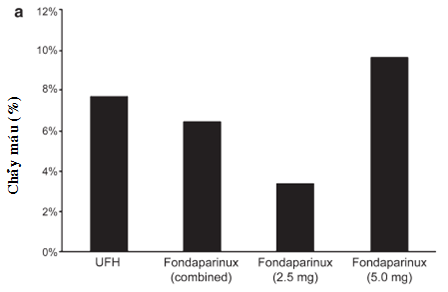
Hình 5.3a. Tỉ lệ chảy máu toàn bộ của UFH và fondaparinux với các liều lượng khác nhau trong thử nghiệm ASPIRE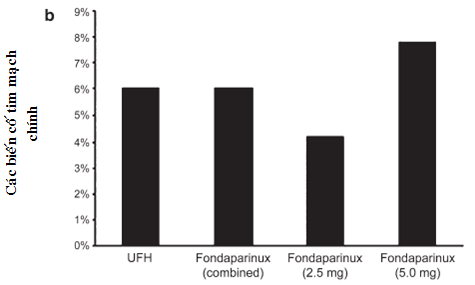
Hình 5.3b. Tỉ lệ các biến cố tim mạch chính của UFH và fondaparinux với các liều lượng khác nhau trong thử nghiệm ASPIRE. MACE được định nghĩa như là tử vong, NMCT, tái tưới máu khẩn cấp và/hoặc sử dụng ức chế thụ thể GP IIb/IIIa hỗ trợ.
Cuối cùng, chú ý tới hiệu quả điều trị, tiêu chí hiệu quả tương đương nhau giữa hai nhóm fondaparinux và heparin, với đáp ứng liều không rõ ràng được ghi nhận giữa hai nhóm 2,5 mg và 5 mg (hình 5.3b). Hiệu quả lâm sàng tương tự và xu hướng an toàn với liều fondaparinux 2,5 mg làm cơ sở cho việc đề nghị liều lượng trong can thiệp mạch vành ở hai thử nghiệm OASIS-5 và OASIS-6 sau đó. Cho tới nay, chưa có thử nghiệm lớn nào chứng minh dùng fondaparinux trong can thiệp mạch vành theo chương trình.
OASIS-5 – HỘI CHỨNG VÀNH CẤP KHÔNG CÓ ĐOẠN ST CHÊNH LÊN
Thử nghiệm OASIS-5 (The Fifth Organization to Assess Strategies for Ischemic Syndromes) là một thử nghiệm ngẫu nhiên, mù đôi so sánh fondaparinux liều thấp (2,5 mg tiêm dưới da, một lần mỗi ngày) với enoxaparin (1 mg/kg tiêm dưới da, hai lần mỗi ngày) ở 20.078 bệnh nhân bị đau thắt ngực không ổn định hoặc NMCT cấp không có đoạn ST chênh lên [67]. Mục tiêu chính của nghiên cứu là xác định có hay không điều trị với fondaparinux sẽ tốt hơn enoxaparin trong mối liên quan với tử vong, NMCT hoặc thiếu máu cơ tim cục bộ không đáp ứng với điều trị nộ khoa đơn thuần tại ngày thứ 9. Thêm vào đó, dự hậu an toàn chính của nghiên cứu là sự xuất hiện của chảy máu tại thời điểm 9 ngày. Dự hậu phụ bao gồm đánh giá các tiêu chí tương tự này để thiết lập sơ đồ theo dõi trong 30 ngày và tới khi kết thúc nghiên cứu (tối đa 180 ngày). Kết quả của nghiên cứu cho thấy không có sự khác biệt ở các tiêu chí chính bao gồm tử vong, NMCT hoặc thiếu máu cơ tim cục bộ không đáp ứng với điều trị tại ngày thứ 9 giữa hai nhóm nghiên cứu (5,8% ở nhóm fondaparinux so với 5,7% ở nhóm enoxaparin, HR 1,01; CI 95% 0,9-1,13; phép kiểm về sự không thua kém, non-inferiority, p=0,007) (hình 5.4a). Tuy nhiên, theo dõi tại thời điểm 30 ngày và 180 ngày, tỉ lệ kết hợp của tử vong, NMCT và thiếu máu cơ tim cục bộ không đáp ứng với điều trị có xu hướng thấp hơn ở nhóm điều trị với fondaparinux so với nhóm điều trị với enoxaparin. Sự khác biệt này phần lớn là do giảm được tỉ lệ tử vong ở nhóm fondaparinux, đạt tới mức ý nghĩa thống kê ở ngày 30 và ở mức giới hạn của ý nghĩa thống kê ở ngày 180.
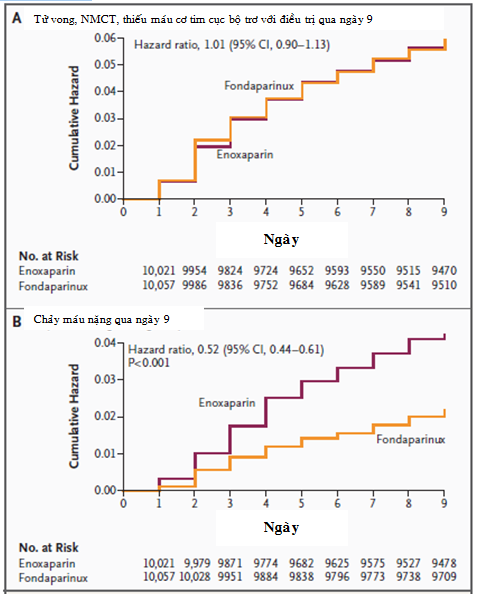
Hình 5.4 (a&b). Nguy cơ tích lũy của tử vong, NMCT và thiếu máu cơ tim cục bộ không đáp ứng với điều trị (A) và chảy máu nặng (B) tại thời điểm 9 ngày. [67]
Phân tích dự hậu an toàn chính cho thấy tỉ lệ chảy máu nặng tại thời điểm 9 ngày thấp hơn ý nghĩa ở nhóm fondaparinux so với nhóm enoxaparin (2,2% so với 4,1%, p<0,0001) (hình 5.4b). Đặc biệt, nhóm bệnh nhân điều trị với fondaparinux giảm đáng kể cả tỉ lệ tử vong và chảy máu nặng, với giảm ý nghĩa tụ máu sau phúc mạc và chảy máu nặng đòi hỏi phải can thiệp phẫu thuật hoặc truyền máu. Chảy máu nặng trong nghiên cứu này có liên quan tới tỉ lệ tử vong, NMCT tái phát và đột quỵ cao hơn một cách có ý nghĩa, mà điều này có thể được giải thích do lợi ích kéo dài trên tỉ lệ tử vong được thấy trong nhóm fondaparinux và nhấn mạnh tầm quan trọng của dự phòng chảy máu nặng trong điều trị hội chứng mạch vành cấp. Tỉ lệ chảy máu nặng thấp hơn ý nghĩa ở nhóm fondaparinux so với nhóm enoxaparin trong số những bệnh nhân có độ thanh thải creatinin <30 ml/phút (2,4% so với 9,9%, p=0,001) hoặc độ thanh thải creatinin ít nhất 30 ml/phút (2,2% so với 4,0%, p<0,001).
Trong năm 2007, Melta và cộng sự đã phân tích hiệu quả và độ an toàn của fondaparinux so với enoxaparin ở bệnh nhân trải qua can thiệp động mạch vành qua da [49]. Kết quả này có được từ thử nghiệm OASIS-5 trước đó. Trong hơn 20.000 bệnh nhân ban đầu, có 6.238 bệnh nhân trải qua can thiệp động mạch vành qua da. Tại thời điểm 9 ngày, tỉ lệ biến cố thiếu máu cục bộ thì tương tự giữa hai nhóm fondaparinux và enoxaparin (tử vong, NMCT hoặc đột quỵ) (6,3% so với 6,2%, p=0,79) và giảm ý nghĩa tỉ lệ chảy máu nặng (2,4% so với 5,1%, p<0,00001). Những đặc điểm này được duy trì tới ngày thứ 30 và 6 tháng sau. Mặc dù lợi ích lâm sàng thật sự của fondaparinux được thấy rõ trong phân tích này, nhưng một vấn đề quan tâm lớn trong phân tích này là có sự gia tăng tỉ lệ của huyết khối liên quan tới catheter trong nhóm fondaparinux (0,9% so với 0,4%). Sự hiện diện của huyết khối liên quan tới catheter có liên quan tới một tỉ lệ rất cao của NMCT và đột quỵ (27% và 5,4%, theo thứ tự). Sự bổ sung cho thiết kế nghiên cứu OASIS-5 đã được thực hiện sau khi có kết quả phân tích này, cho phép dùng UFH tùy theo nhà nghiên cứu. Trong phần còn lại của nghiên cứu, 9/10 biến cố huyết khối liên quan tới catheter ở nhóm fondaparinux xảy ra ở những người mà không được bổ sung UFH. Mặc dù dự hậu toàn bộ trong nhóm can thiệp qua da với fondaparinux được đảm bảo an toàn hơn, nhưng các bác sĩ tim mạch can thiệp dường như rất lo lắng với tác dụng tiềm ẩn, huyết khối liên quan tới catheter, tuy không thường gặp nhưng nguy hiểm này. Điều này có thể làm cản trở ứng dụng rộng rãi fondaparinux cho bệnh nhân hội chứng mạch vành cấp.
Tóm lại, OASIS-5 cho thấy rằng fondaparinux liều thấp thì tương đương với enoxaparin về hiệu quả ngắn hạn trong dự phòng biến cố thiếu máu cơ tim cục bộ ở những bệnh nhân NSTE ACS nguy cơ cao và làm giảm quan trọng tỉ lệ chảy máu nặng, mà điều này có liên quan tới giảm tử suất và bệnh suất lâu dài. Mặc dù lợi ích lâm sàng toàn bộ ở nhóm can thiệp mạch vành qua da đạt được, nhưng vấn đề huyết khối liên quan tới catheter cần phải được chú ý và chiến lược hiệu quả để dự phòng cho những bệnh nhân được điều trị với fondaparinux thì cần thiết được đặt ra.
Rất gần đây, một loại thuốc ức chế chọn lọc yếu tố Xa mới, otamixaban, đã được nghiên cứu trong thử nghiệm SEPIA-ACS1 TIMI 42 (Study Program to Evaluate
the Prevention of Ischemia with direct Anti-Xa inhibition in Acute Coronary Syndromes 1-Thrombolysis in Myocardial Infarction 42) [46]. Đây là thử nghiệm ngẫu nhiên, mù đôi, có đối chứng, đang thực hiện phase 2. Mục tiêu của thử nghiệm là nhằm đánh giá hiệu quả và độ an toàn của otamixaban trong điều trị NSTE ACS và xác định giới hạn liều tối ưu cho việc đánh giá thêm ở phase 3 của nghiên cứu. Nghiên cứu được thực hiện ở 196 nơi trên 36 quốc gia, với 3.241 bệnh nhân bị NSTE ACS, được chia thành 5 nhóm điều trị với otamixaban với các liều khác nhau (0,08 mg/kg bolus, sau đó truyền tĩnh mạch 0,035 (n=125), 0,070 (n=676), 0,105 (n=662), 0,140 (n=658), hoặc 0,175 (n=671) mg/kg/h) và nhóm đối chứng được dùng UFH (60 đơn vị/kg bolus tĩnh mạch, sau đó truyền tĩnh mạch 12 đơn vị/kg/giờ) kết hợp với eptifibatide (180 µg/kg bolus tĩnh mạch, sau đó truyền tĩnh mạch 1,0-2,0 µg/kg/phút (n=449). Cả các nhà nghiên cứu và bệnh nhân không được biết nhóm điều trị cụ thể. Những người đăng ký vào nhóm liều thấp nhất đã được ngưng sớm do đề nghị của Ủy ban theo dõi dữ liệu (bởi vì chứng cứ lâm sàng cho thấy hiệu quả kháng đông không đủ). Tiêu chí hiệu quả chính bao gồm tử vong, NMCT, tái tưới máu khẩn cấp hoặc phải bổ sung thêm ức chế GP IIb/IIIa tới ngày thứ 7. Tiêu chí an toàn chính là chảy máu nặng hoặc nhẹ theo phân độ TIMI không liên quan tới CABG. Phân tích hiệu quả được thực hiện theo ý định điều trị, phân tích độ an toàn ở nhóm bệnh nhân được điều trị. Kết quả của nghiên cứu cho thấy tỉ lệ tiêu chí hiệu quả chính ở trong 5 nhóm với liều các liều otamixaban khác nhau là 7,2% (9/125) với 0,035 mg/kg/giờ, 4,6% (31/676) với 0,070 mg/kg/giờ, 3,8% (25/662) với 0,105 mg/kg/giờ, 3,6% (24/658) với 0,140 mg/kg/giờ và 4,3% (29/671) với 0,175 mg/kg/giờ (p=0,34). Trong nhóm chứng, tỉ lệ là 6,2% (28/449), nguy cơ tương đối cho 5 liều otamixaban theo thứ tự là 1,16 (CI 95% 0,56-2,38), 0,74 (CI 95% 0,45-1,21), 0,61 (CI 95% 0,36-1,02), 0,58 (CI 95% 0,34-1,00) và 0,69 (CI 95% 0,42-1,15). Tỉ lệ tiêu chí an toàn chính trong 5 liều otamixaban theo thứ tự là 1,6% (2/122), 1,6% (11/669), 3,1% (20/651), 3,4% (22/651) và 5,4% (36/664) (p=0,0001); tỉ lệ trong nhóm chứng là 2,7% (12/448). Và các nhà nghiên cứu đã đưa ra kết luận ở bệnh nhân NSTE ACS, otamixaban truyền tĩnh mạch liều 0,100-0,140 mg/kg/giờ có thể giảm được biến cố thiếu máu cơ tim cục bộ và có độ an toàn tương tự như UFH kết hợp với eptifibatide.
5.3. Các khuyến cáo hiện nay về sử dụng fondaparinux trong điều trị hội chứng mạch vành cấp.
– Khuyến cáo của ACC/AHA năm 2007 về fondaparinux trong điều trị hội chứng mạch vành cấp như sau: [4]
* Những bệnh nhân trải qua can thiệp mạch vành sớm, fondaparinux đã được chứng minh hiệu quả tương tự enoxaparin, UFH và bivalirudin. Nếu fondaparinux được dùng, bổ sung UFH nên được thực hiện trong lúc can thiệp mạch vành.
* Tuy nhiên, các chuyên gia không khuyến cáo dùng fondaparinux ở những bệnh nhân trải qua can thiệp mạch vành sớm, khi mà thuốc kháng đông thứ hai (hoặc heparin hoặc bivalirudin) phải được cho để dự phòng huyết khối liên quan tới catheter.
* Những bệnh nhân được điều trị bảo tồn, fondaparinux và enoxaparin được xem như thích hợp hơn UFH trừ khi CABG được dự định trong vòng 24 giờ, và fondaparinux được đề nghị như là thuốc kháng đông chọn lựa cho bệnh nhân có gia tăng nguy cơ chảy máu.
* Khi CABG được dự định trong vòng 24 giờ, UFH thích hợp hơn fondaparinux hoặc enoxaparin, vì hiệu quả kháng đông của nó có thể được phục hồi nhanh hơn.
– Khuyến cáo của Hội Tim Mạch Châu Âu (ESC) năm 2007 cho chẩn đoán và điều trị hội chứng mạch vành cấp không có đoạn ST chênh lên đề nghị dùng fondaparinux hơn là LMWH trong trường hợp mà quyết định giữa can thiệp sớm hoặc điều trị bảo tồn chưa được thực hiện [8]. Đề nghị này được thực hiện dựa trên các thông số về hiệu quả/độ an toàn của fondaparinux thấy trong thử nghiệm OASIS-5. Ở những bệnh nhân không gia tăng nguy cơ chảy máu, LMWH được xem là thuốc chọn lựa thích hợp hơn. Khuyến cáo của ESC cũng đề cập đến một số điểm về sử dụng fondaparinux như sau:
* UFH với liều chuẩn (30-100 đơn vị/kg bolus) nên được bổ sung trong phòng thông tim cho bệnh nhân trải qua can thiệp mạch vành qua da do gia tăng huyết khối liên quan tới catheter được thấy trong các thử nghiệm khác.
* Fondaparinux có thể ngưng trong 24 giờ sau thủ thuật xâm lấn.
* Fondaparinux có thể được tiếp tục dùng cho tới khi xuất viện ở những bệnh nhân trải qua chiến lược điều trị bảo tồn.
* Khuyến cáo không đề nghị dùng fondaparinux ở những bệnh nhân cần thiết phải can thiệp khẩn cấp/cấp cứu, có lẽ do thiếu chứng cứ về sử dụng nó trong trường hợp này.
– Khuyến cáo của ACCP (American College of Chest Physicians) năm 2008 về điều trị kháng đông và tiêu sợi huyết đề nghị dùng fondaparinux hơn là enoxaparin cho những bệnh nhân khi mà chiến lược điều trị xâm lấn bị trì hoãn hoặc điều trị bảo tồn được chọn lựa. [35]
5.4. Ức chế yếu tố Xa đường uống:
Hiện nay, một số thuốc ức chế yếu tố Xa trực tiếp đường uống và tĩnh mạch đã được đưa vào trong điều trị lâm sàng. Trái với ức chế qua trung gian antithrombin, những hợp chất này ức chế yếu tố Xa cả khi tự do trong tuần hoàn và khi yếu tố Xa kết hợp trong phức hợp prothrombinase. Một vài thông tin của các kết quả thử nghiệm và chương trình phát triển các thuốc này đang được thực hiện như otamixaban [13], [46] và một số thuốc ức chế yếu tố Xa đường uống: edoxaban (DU-176b) [31], apixaban [3], rivaroxaban [48], waroxaban (LY 5157117) [2], và YM 150 [24]. Đa số các dữ liệu lâm sàng hiện nay liên quan tới tính hiệu quả và độ an toàn của của ức chế yếu tố Xa đường uống đều ở giai đoạn phase 2 tới phase 3 của nghiên cứu trên dự phòng thuyên tắc do huyết khối tĩnh mạch sau đại phẫu thuật chấn thương chỉnh hình. Đối với otamixaban, kết quả gần đây của phase 2 nghiên cứu trong bối cảnh can thiệp mạch vành qua [13], điều trị bệnh nhân NSTE ACS [6] đã được công bố. Rivaroxaban, apixaban và edoxaban hiện nay đang được đánh giá ở phase 3 trong dự phòng đột quỵ ở bệnh nhân rung nhĩ và/hoặc dự phòng thứ phát sau hội chứng mạch vành cấp.
6. CÁC THUỐC KHÁNG ĐÔNG MỚI.
Cả hai thuốc kháng đông đường uống và đường tĩnh mạch hiện nay đang được thử nghiệm nhằm mang lại hiệu quả cao trong điều điều trị. Các thuốc kháng đông mới có thể được chia thành 3 nhóm dựa trên điểm tác dụng chính của chúng trên dòng thác đông máu: 1) ức chế trong giai đoạn cầm máu ban đầu; 2) ức chế trong giai đoạn cầm máu tăng cường; và 3) ức chế thrombin [65]. Ức chế giai đoạn cầm máu ban đầu bao gồm những thuốc tập trung trên yếu tố mô, phức hợp yếu tố mô-VIIa và ức chế vị trí hoạt động của yếu tố VIIa. Một protein kết hợp dùng đường tĩnh mạch (rNAPc2) có nguồn gốc từ giun móc đang được thử nghiệm ở giai đoạn phase 2 trong điều trị NSTE ACS và can thiệp mạch vành sớm [30]. Mặc dù rNAPc2 nhìn chung được dung nạp tốt khi thêm UFH hoặc enoxaparin, heparin thì cần thiết để tránh huyết khối liên quan tới thủ thuật (như được thấy với fondaparinux trong thử nghiện OASIS-5 và 6- OASIS- 6 bàn về điều trị fodaparinux ở bệnh nhân NMCT cấp có đoạn ST chênh lên, mà không được nói đến trong chuyên đề này). Thuốc kháng đông mới ức chế giai đoạn cầm máu tăng cường bằng cách tập trung trên các yếu tố IXa, Xa hoặc các đồng yếu tố tương ứng (VIIIa, Va) đang được nghiên cứu.
7. KẾT LUẬN.
Điều trị kháng đông là để dự phòng các biến cố liên quan tới huyết khối ở bệnh nhân bị hội chứng mạch vành cấp không có đoạn ST chênh lên. Khi kết hợp điều trị kháng đông với kháng kết tập tiểu cầu đã cho thấy giảm được tỉ lệ tử vong, NMCT và nhu cầu cần phải tái tưới máu (ở những bệnh nhân được điều trị bảo tồn). Ở những bệnh nhân có gia tăng nguy cơ chảy máu với những thuốc này, thì quyết định điều trị phải được dựa trên những lợi ích và nguy cơ. Dựa trên những chứng cứ và các khuyến cáo hiện nay, fondaparinux có xu hướng được dùng như là thuốc kháng đông cho bệnh nhân bị hội chứng mạch vành cấp không có đoạn ST chênh lên được điều trị nội khoa bảo tồn mà có gia tăng nguy cơ chảy máu. Những người mà có gia tăng nguy cơ chảy máu khi trải qua can thiệp mạch vành qua da thì bivalirudin thích hợp hơn enoxaparin và heparin không phân đoạn.
DANH MỤC CÁC CHỮ VIẾT TẮT
|
|
Tiếng Anh |
Tiếng Việt |
|
NMCT |
|
Nhồi máu cơ tim |
|
ACC/AHA |
American College of Cardiology /American Heart Association |
Trường Môn Tim mạch/ Hội Tim mạch Hoa Kì |
|
ACUITY |
The Acute Catheterization and Urgent Intervention Triage Strategy |
Chiến lược can thiệp khẩn cấp và thông tim cấp cứu. |
|
ACUTE |
The Antithrombotic Combination Using Tirofiban and Enoxaparin study |
Nghiên cứu kết hợp dùng kháng đông tirofiban và enoxaparin |
|
aPTT |
Activated Partial Thromboplastin Time |
Thời gian hoạt hóa thromboplastin từng phần |
|
ASPIRE |
The Arixtra Study in Percutaneous Coronary Intervention: a Randomized Evaluation |
Nghiên cứu dùng Arixtra trong can thiệp động mạch vành qua da: một đánh giá ngẫu nhiên |
|
BAT |
Bivalirudin Angioplasty Trial |
Thử nghiệm dùng bivalirudin trong can thiệp động mạch vành |
|
CABG |
Coronary Artery Bypass Graft |
Phẫu thuật bắc cầu nối động mạch vành |
|
CURRENT-OASIS |
Clopidogrel Optimal Loading Dose Usage to Reduce Recurrent Events/Optimal Antiplatelet Strategy for Interventions |
Liều tải tối ưu của clopidogrel để giảm biến cố tái phát/chiến lược kháng kết tập tiểu cầu tối ưu cho can thiệp |
|
DTI |
Direct thrombin inhibitors |
Ức chế thrombin trực tiếp |
|
ESC |
European Society of Cardiology |
Hội Tim Mạch Châu Âu |
|
ESSENCE |
The Efficacy and Safety of Subcutaneous Enoxaparin in Non-Q-Wave Coronary Events |
Hiệu quả và độ an toàn của enoxaparin tiêm dưới da trong biến cố mạch vành không có sóng Q |
|
FRAXIS |
FRAxiparine in Ischaemic Syndrome |
Franxiparin trong hội chứng thiếu máu cơ tim cục bộ |
|
FRIC |
Fragmin In unstable Coronary artery disease study |
Nghiên cứu Fragmin trong điều trị bệnh mạch vành không ổn định |
|
GUSTO |
Global Utilization of Streptokinase and t-PA for Occluded Coronary Arteries |
Sử dụng chung streptokinase và t-PA cho động mạch vành bị tắc nghẽn |
|
INTERACT |
The INTegrelin and Enoxaparin Randomized assessment of Acute Coronary syndrome Treatment Trial |
Đánh giá ngẫu nhiên integrilin và enoxaparin trong điều trị hội chứng mạch vành cấp |
|
LDL |
Low-Density Lipoprotein |
Lipoprotein có tỉ trọng thấp |
|
LMWH |
Low Molecular Weight Heparin |
Heparin trọng lượng phân tử thấp |
|
MACE |
Major Adverse Cardiac Events |
Các biến cố tim mạch chính |
|
NSTE ACS |
Non -ST-elevation acute coronary syndrome |
Hội chứng mạch vành cấp không có đoạn ST chênh lên |
|
OASIS |
Organization to Assess Strategies for Ischemic Syndromes |
Cơ quan đánh giá chiến lược cho điều trị hội chứng thiếu máu cơ tim cục bộ |
|
PDGF |
Platelet-derived growth factor |
Yếu tố tăng trưởng có nguồn gốc từ tiểu cầu |
|
PLATO |
A Study of Platelet Inhibition and Patient Outcomes |
Nghiên cứu về sử dụng ức chế tiểu cầu và dự hậu |
|
REPLACE |
The Randomized Evaluation in PCI Linking Angiomax to Reduced Clinical Events |
Đánh giá ngẫu nhiên mối liên hệ angiomax trong giảm biến cố lâm sàng ở bệnh nhân can thiệp mạch vành qua da |
|
SEPIA-ACS1 TIMI 42 |
Study to Evaluate the Pharmacodynamics, the Safety and Tolerability, and the Pharmacokinetics of Several Intravenous Regimens of the Factor Xa Inhibitor Otamixaban (XRP0673), in Comparison to Intravenous Unfractionated Heparin-Acute Coronary Syndromes-Thrombolysis In Myocardial Infarction |
Nghiên cứu đánh giá dược động học, độ an toàn và tính dung nạp, và dược lực học của một vài chế độ điều trị ức chế yếu tố Xa Otamixaban qua đường tĩnh mạch, so với heparin không phân đoạn đường tĩnh mạch- Hội chứng mạch vành cấp- Tiêu huyết khối trong nhồi máu cơ tim cấp |
|
SYNERGY |
Superior Yield of the New Strategy of Enoxaparin, Revascularization & GlYcoprotein IIb/IIIa Inhibitors |
Sự vượt trội của chiến lược điều trị mới bao gồm enoxaparin, tái tưới máu và ức chế thụ thể GP IIb/IIIa |
|
TIMI |
Thrombolysis in Myocardial Infarction |
Tiêu huyết khối trong nhồi máu cơ tim cấp |
|
UFH |
Unfractionated heparin |
Heparin không phân đoạn |
TÀI LIỆU THAM KHẢO
1. A comparison of recombinant hirudin with heparin for the treatment of acute coronary syndromes. The Global Use of Strategies to Open Occluded Coronary Arteries (GUSTO) IIb investigators (1996). N Engl J Med (335), pp. 775-782.
2. Agnelli G, Haas S, Ginsberg JS, Krueger KA, Dmitrienko A, Brandt JT (2007). A phase II study of the oral factor Xa inhibitor LY517717 for the prevention of venous thromboembolism after hip or knee replacement. J Thromb Haemost (5), pp. 746 -53.
3. Alexander JH, Becker RC, Bhatt DL, et al (2009). Apixaban, an oral, direct, selective factor Xa inhibitor, in combination with antiplatelet therapy after acute coronary syndrome: results of the Apixaban for Prevention of Acute Ischemic and Safety Events (APPRAISE) trial. Circulation (119), pp. 2877- 85.
4. Anderson J, Adams C, Antman E, et al (2007). ACC/AHA 2007 guidelines for the management of patients with unstable angina/non-ST-elevation myocardial infarction: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to revise the 2002 Guidelines for the Management of Patients with Unstable Angina/Non-ST-Elevation Myocardial Infarction): developed in collaboration with the American College of Emergency Physicians, American College or Physicians, Society for Academic Emergency Medicine, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons. J Am Coll Cardiol 50:e1. Available at: www.acc.org/qualityandscience/clinical/statements.htm (accessed September 18, 2007).
5. Anil J. Mani, Martin E. Edep, David L. Brown (2010). Pathophysiology of Acute Coronary Syndromes: Plaque Rupture and Atherothrombosis. In Cardiac Intensive Care, second edition, pp.73-86.
6. Antman EM, Cohen M, Radley D, et al (1999). Assessment of the treatment effect of enoxaparin for unstable angina/non-Q-wave myocardial infarction TIMI 11B-ESSENCE meta-analysis. Circulation 100(15), pp. 1602-1608.
7. Antman EM, McCabe CH, Gurfinkel EP, et al (1999). Enoxaparin prevents death and cardiac ischemic events in unstable angina/non-Q-wave myocardial infarction: results of the Thrombolysis In Myocardial Infarction (TIMI) 11B trial. Circulation 100(15), pp. 1593-1601.
8. Bassand JP, Hamm CW, Ardissino D, et al (2007). Guidelines for the diagnosis and treatment of non-ST-segment elevation acute coronary syndromes. The Task Force for the Diagnosis and Treatment of Non-ST-Segment Elevation Acute Coronary Syndromes of the European Society of Cardiology. Eur Heart J (28), pp. 1598.
9. Bates SM, Weitz JI (1998). Direct thrombin inhibitors for treatment of arterial thrombosis: potential differences between bivalirudin and hirudin. Am J Cardiol (82), pp. 12P- 8P.
10. Bittl JA, Strony J, Brinker JA, et al (1995). Treatment with bivalirudin (Hirulog) as compared with heparin during coronary angioplasty for unstable or postinfarction angina. Hirulog Angioplasty Study Investigators. N Engl J Med (333), pp. 764-769.
11. Blazing MA, de Lemos JA, White HD, et al (2004). Safety and efficacy of enoxaparin vs unfractionated heparin in patients with non-ST-segment elevation acute coronary syndromes who receive tirofiban and aspirin: a randomized controlled trial. JAMA 292 (1), pp. 55-64.
12. Choay J, Petitou M, Lormeau JC, Sinay P, Casu B, Gatti G (1983). Structure-activity relationship in heparin: a synthetic pentasaccharide with high affinity for antithrombin III and eliciting high anti-factor Xa activity. Biochem Biophys Res Commun 116 (2), pp. 492-499.
13. Cohen M, Bhatt DL, Alexander JH, et al (2007). Randomized, double-blind, dose-ranging study of otamixaban, a novel, parenteral, short-acting direct factor Xa inhibitor, in percutaneous coronary intervention: the SEPIA-PCI trial. Circulation (115), pp. 2642-51.
14. Cohen M, Demers C, Gurfinkel EP, et al (1997). A comparison of low-molecular-weight heparin with unfractionated heparin for unstable coronary artery disease. Efficacy and Safety of Subcutaneous Enoxaparin in Non-Q-Wave Coronary Events Study Group. N Engl J Med 337(7), pp. 447-452.
15.Cohen M, Theroux P, Borzak S, et al (2002). Randomized double-blind safety study of enoxaparin versus unfractionated heparin in patients with non-ST-segment elevation acute coronary syndromes treated with tirofiban and aspirin: the ACUTE II study. The Antithrombotic Combination Using Tirofiban and Enoxaparin study. Am Heart J 144 (3), pp. 470-477.
16. Cohen M, Theroux P, Weber S, et al (1999). Combination therapy with tirofiban and enoxaparin in acute coronary syndromes. Int J Cardiol 71(3), pp. 273-281.
17. Comparison of two treatment durations (6 days and 14 days) of a low-molecular-weight heparin with a 6-day treatment of unfractionated heparin in the initial management of unstable angina or non-Q-wave myocardial infarction: FRAX.I.S. (FRAxiparine in Ischaemic Syndrome) (1999). Eur Heart J 20(21), pp. 1553-1562.
18. Davies MJ (1990). A macro and micro view of coronary vascular insult in ischaemic heart disease. Circulation 82(Suppl II):II-38-II-46.
19. Davies MJ, Thomas AC (1984). Thrombosis and acute coronary artery lesions in sudden cardiac ischemic death. N Engl J Med (310), pp. 1137-1140.
20. Dewood MA, Spores J, Notske R, et al (1980). Prevalence of total coronary occlusion during early hours of transmural myocardial infarction. N Engl J Med (303), pp. 897-902.
21. Direct Thrombin Inhibitor Trialists’ Collaborative Group (2002). Direct thrombin inhibitors in acute coronary syndromes: principal results of a meta-analysis based on individual patients’ data. Lancet (359), pp. 294-302.
22. Direct thrombin inhibitors in acute coronary syndromes: principal results of a metaanalysis based on individual patients’ data (2002). Lancet (359), pp. 294-302.
23. Effects of recombinant hirudin (lepirudin) compared with heparin on death, myocardial infarction, refractory angina, and revascularisation procedures in patients with acute myocardial ischaemia without ST elevation: a randomized trial. Organisation to Assess Strategies for Ischemic Syndromes (OASIS-2) Investigators (1999). Lancet (353), pp. 429-438.
24. Eriksson BI, Turpie AG, Lassen MR, et al (2005). YM150, an oral direct Factor Xa inhibitor, as prophylaxis for venous thromboembolism in patients with elective primary hip replacement surgery: a dose escalation study (abstr). Blood (Suppl 104), pp. 813.
25. Falk E, Shah PK, Fuster V (1995). Coronary plaque disruption. Circulation (92), pp. 657-671.
26. Fareed J, Hoppensteadt D, Walenga J, et al (2003). Pharmacodynamic and pharmacokinetic properties of enoxaparin: implications for clinical practice. Clin Pharmacokinet 42(12), pp. 1043-1057.
27. Ferguson JJ; Califf RM; Antman EM; et al (2004). Enoxaparin vs unfractionated heparin in high-risk patients with non-ST-segment elevation acute coronary syndromes managed with an intended early invasive strategy: primary results of the SYNERGY randomized trial. JAMA 292(1), pp. 45-54.
28. Fuster V, Badimon L, Cohen M, et al (1988). Insights into the pathogenesis of acute ischemic syndromes. Circulation (77), pp. 1213-1220.
29. Fuster V, Stein B, Ambrose JA, et al (1990). Atherosclerotic plaque rupture and thrombosis: evolving concepts. Circulation 82 [Suppl II]:II-47-II-59.
30. Giugliano RP, Rohatagi S, Kastrissios H, et al (2009). The relationship between the oral factor Xa inhibitor edoxaban (DU-176b) pharmacokinetics and the probability of bleeding events in patients with non-valvular atrial fibrillation. Presented at: ISTH Scientific Sessions; Boston, MA; July 15.
31. Giugliano RP, Wiviott SD, Stone PH, et al (2007). Recombinant nematode anticoagulant protein c2 in patients with non-ST-segment elevation acute coronary syndrome: the ANTHEM-TIMI-32 trial. J Am Coll Cardiol (49), pp. 2398-407.
32. Goodman SG, Cohen M, Bigonzi F, et al (2000). Randomized trial of low-molecular-weight heparin (enoxaparin) versus unfractionated heparin for unstable coronary artery disease: one-year results of the ESSENCE study Efficacy and Safety of Subcutaneous Enoxaparin in Non-Q-Wave Coronary Events. J Am Coll Cardiol 36(3), pp. 693-698.
33. Goodman SG, Fitchett D, Armstrong PW, et al (2003). Randomized evaluation of the safety and efficacy of enoxaparin versus unfractionated heparin in high-risk patients with non-ST-segment elevation acute coronary syndromes receiving the glycoprotein IIb/IIIa inhibitor eptifibatide. Circulation 107(2), pp. 238-244.
34. Gưran K. Hansson (2005). Inflammation, Atherosclerosis, and Coronary Artery Disease. N Engl J Med (352), pp. 1685-95.
35. Harrington, RA, Becker, RC, Cannon, CP, et al (2008). Antithrombotic therapy for non-ST-segment elevation acute coronary syndromes: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest (133), pp. 670S.
36. Hawiger J (1987). Formation and regulation of platelet and fibrin hemostatic plug. Hum Pathol (18), pp. 111.
37. Hirsh J, Raschke R (2004). Heparin and low-molecular-weight heparin: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest 126 (suppl 3):188S-203S.
38. Jin L, Abrahams JP, Skinner R, Petitou M, Pike RN, Carrell RW (1997). The anticoagulant activation of antithrombin by heparin. Proc Natl Acad Sci U S A 94(26), pp. 14683-14688.
39. Jolicoeur EM, Wang T, Lopes RD, et al (2007). Percutaneous coronary interventions in patients with heparin-induced thrombocytopenia. Curr Cardiol Rep (9), pp. 396-405.
40. Jonasson L, Holm J, Skalli O, Bondjers G, Hansson GK (1986). Regional accumulations of T cells, macrophages, and smooth muscle cells in the human atherosclerotic plaque. Arteriosclerosis (6), pp. 131-8.
41. Klein W, Buchwald A, Hillis SE, et al (1997). Comparison of low-molecular-weight heparin with unfractionated heparin acutely and with placebo for 6 weeks in the management of unstable coronary artery disease Fragmin in unstable coronary artery disease study (FRIC). Circulation 96(1), pp. 61-68.
42. Kovanen PT, Kaartinen M, Paavonen T (1995). Infiltrates of activated mast cells at the site of coronary atheromatous erosion or rupture in myocardial infarction. Circulation (92), pp. 1084-8.
43. Lincoff AM, Bittl JA, Harrington RA, et al (2003). Bivalirudin and provisional glycoprotein IIb/IIIa blockade compared with heparin and planned glycoprotein IIb/IIIa blockade during percutaneous coronary intervention: REPLACE-2 randomized trial. JAMA (289), pp. 853-863.
44. Lincoff AM, Steinhubl SR, Manoukian SV, et al (2008). Influence oftiming of clopidogrel treatment on theefficacy and safety of bivalirudin in patients with non-st-segment elevation acute coronary syndromes undergoing percutaneous coronary intervention: an analysis of the ACUITY (Acute Catheterization and Urgent Intervention Triage strategY) trial. J Am Coll Intv (1), pp. 639-648.
45. MacIsaac A, Thomas JD, Topol EJ (1993). Toward the quiescent coronary plaque. J Am Coll Cardiol (22), pp. 1228-1241.
46. Marc S Sabatine, Elliott M Antman, Petr Widimsky, Iftikhar O Ebrahim, et al (2009) Otamixaban for the treatment of patients with non-ST-elevation acute coronary syndromes (SEPIA-ACS1 TIMI 42): a randomised, double-blind, active-controlled, phase 2 trial. Lancet (374), pp. 787-95.
47. Marcello D, Saskia M, Harry R (2005). Direct Thrombin Inhibitors. N Engl J Med (353), pp. 1028-40.
48. Mega JL, Braunwald E, Mohanavelu S, et al (2009). Rivaroxaban versus placebo in patients with acute coronary syndromes (ATLAS ACSTIMI 46): a randomised, double-blind, phase II trial. Lancet (374), pp. 29 -38.
49. Mehta SR, Granger CB, Eikelboom JW, et al (2007). Efficacy and safety of fondaparinux versus enoxaparin in patients with acute coronary syndromes undergoing percutaneous coronary intervention: results from the OASIS-5 trial. J Am Coll Cardiol 50 (18), pp. 1742-1751.
50. Mehta SR, Steg PG, Granger CB, et al (2005). Randomized, blinded trial comparing fondaparinux with unfractionated heparin in patients undergoing contemporary percutaneous coronary intervention: Arixtra Study in Percutaneous Coronary Intervention: a Randomized Evaluation (ASPIRE) Pilot. Circulation 111(11), pp. 1390-1397.
51. Morais J (2010). Recent research on antithrombotics: News on the treatment of patients with acute coronary syndromes. Rev Port Cardiol, May, 29(5), pp. 783-98.
52. Murphy SA; Gibson CM; Morrow DA; Van de Werf F, et al (2007). Efficacy and safety of the low-molecular weight heparin enoxaparin compared with unfractionated heparin across the acute coronary syndrome spectrum: a meta-analysis. Eur Heart J 28(17), pp. 2077-86.
53. Myler RK, Frink RJ, Shaw RE, et al (1990). The unstable plaque: pathophysiology and therapeutic implications. J Invasive Cardiol (2), pp. 117-128.
54. Petersen JL; Mahaffey KW; Hasselblad V; Antman EM; Cohen M; Goodman SG, et al (2004). Efficacy and bleeding complications among patients randomized to enoxaparin or unfractionated heparin for antithrombin therapy in non-ST-segment elevation acute coronary syndromes: a systematic overview. JAMA 292(1), pp. 89-96.
55. Petitou M, Duchaussoy P, Herbert JM, et al (2002). The synthetic pentasaccharide fondaparinux: first in the class of antithrombotic agents that selectively inhibit coagulation factor Xa. Semin Thromb Hemost 28(4), pp. 393-402.
56. Pierluigi Tricoci and Kenneth W. Mahaffey (2010). Unfractionated Heparin and Enoxaparin for the Management of Non-ST-Segment Elevation Acute Coronary Syndromes. In Antithrombotic Drug Therapy in Cardiovascular Disease, pp. 165-182.
57. Randomized trial of intravenous heparin versus recombinant hirudin for acute coronary syndromes. The Global Use of Strategies to Open Occluded Coronary Arteries (GUSTO) IIa Investigators (1994). Circulation (90), pp. 1631-1637.
58. Ross R (1993). The pathogenesis of atherosclerosis: a perspective for the 1990s. Nature (362), pp. 801-809.
59. Sameer Amin and Prediman K. Shah (2008). Pathophysiology of Myocardial Infarction. In Reperfusion Therapy for Acute Myocardial Infarction, Edition by Informa Healthcare USA, pp. 15-28.
60. Stary HC, Chandler AB, Dinsmore RE, et al (1995). A definition of advanced types of atherosclerotic lesions and a histological classification of atherosclerosis: a report from the Committee on Vascular Lesions of the Council on Arteriosclerosis, American Heart Association. Circulation (92), pp. 1355-74.
61. Steinberg D, Parthasarathy S, Carew TE, et al (1989). Beyond cholesterol: modification of low-density lipoprotein that increases its atherogenicity. N Engl J Med (320), pp. 915-924.
62. Stone GW, McLaurin BT, Cox DA, et al (2006). Bivalirudin for patients with acute coronary syndromes. N Engl J Med (355), pp. 2203-2216.
63. The CURRENT-OASIS 7 Investigators (2010). Dose Comparisons of Clopidogrel and Aspirin in Acute Coronary Syndromes. N Engl J Med (363), pp. 930-42.
64. The PLATO Investigators (2009). Ticagrelor versus Clopidogrel in Patients with Acute Coronary Syndromes. N Engl J Med (361), pp. 1045-57.
65. Weitz JI, Linkins LA (2007). Beyond heparin and warfarin: the new generation of anticoagulants. Expert Opin Invest Drugs (16), pp. 271- 82.
66. Xiao Z, Theroux P (1998). Platelet activation with unfractionated heparin at therapeutic concentrations and comparisons with a low-molecular weight heparin and with a direct thrombin inhibitor. Circulation (97), pp. 251- 6.
67. Yusuf S, Mehta SR, Chrolavicius S, et al (2006). Comparison of fondaparinux and enoxaparin in acute coronary syndromes. N Engl J Med 354(14), pp. 1464-1476.
Yusuf S, Mehta SR, Chrolavicius S, et al (2006). Effects of fondaparinux on mortality and reinfarction in patients with acute ST-segment elevation myocardial infarction: the OASIS-6 randomized trial. JAMA 295(13), pp. 1519-1530.