Tóm tắt
Viêm cơ tim là một bệnh lý viêm trầm trọng có thể gây tử vong. Hiện vẫn chưa tìm ra điều trị đặc hiệu hoặc có hiệu quả. Thuốc ức chế DPP-4 có hiệu quả tốt không chỉ trong đái tháo đường típ 2 mà còn trong một số bệnh tim mạch nhất định.
Hiroyuki Hirakawa1, Hirofumi Zempo1, Masahito Ogawa1, Ryo Watanabe1,
Jun-ichi Suzuki2*, Hiroshi Akazawa2, Issei Komuro3, Mitsuaki Isobe1
1 Department of Cardiovascular Medicine, Tokyo Medical and Dental University, Tokyo, Japan,
2 Department of Advanced Clinical Science and Therapeutics, The University of Tokyo, Tokyo, Japan,
3 Department of Cardiovascular Medicine, The University of Tokyo, Tokyo, Japan
Người dịch: BS CKI Lê Hoàng Bảo
Khoa Nội Tiết, BV Đại Học Y Dược TP.HCM
Tuy nhiên, vai trò của thuốc ức chế DPP-4 đối với viêm cơ tim vẫn chưa được nghiên cứu. Để làm rõ hiệu quả của thuốc ức chế DPP-4 trên viêm cơ tim, chúng tôi dùng một mô hình viêm cơ tim tự miễn thực nghiệm (EAM) ở chuột Balb/c. Chuột EAM được chỉ định vào các nhóm sau: Nhóm chuột EAM điều trị với một thuốc ức chế DPP-4 (linagliptin) (n = 19) và nhóm không điều trị (n = 22). Phân tích giải phẫu bệnh cho thấy tỷ lệ diện tích xơ hóa cơ tim trong nhóm điều trị thấp hơn rõ rệt so với nhóm không điều trị. Phân tích RT-PCR đã chứng minh rằng mức độ biểu lộ mRNA của IL-2, TNF-α, IL-1β và IL-6 trong nhóm điều trị thấp hơn rõ rệt so với nhóm không điều trị. Xét nghiệm tăng sinh lympho bào cho thấy điều trị với thuốc ức chế DPP-4 không ảnh hưởng đến sự tăng sinh tế bào lách do kháng nguyên. Sử dụng thuốc ức chế DPP-4 ngăn chặn mạnh mẽ xơ hóa cơ tim và giảm biểu lộ gen cytokine gây viêm ở chuột EAM. Do đó, thuốc ức chế DPP-4 có thể có lợi trong điều trị và/hoặc phòng ngừa viêm cơ tim trên lâm sàng.
Giới thiệu
Viêm cơ tim là một bệnh lý viêm trầm trọng gây rối loạn chức năng thất trái (LV) nặng nề, rối loạn nhịp nguy hiểm đến tính mạng và đột tử do tim trong giai đoạn cấp[1].Phản ứng viêm nghiêm trọng ở cơ tim cũng kích hoạt tái cấu trúc cơ tim. Điều này liên quan đến tăng nguy cơ xuất hiện bệnh cơ tim dãn nở (DCM) do xơ hóa tim, tích tụ chất nền ngoại bào, chết cơ tim theo chương trình, và giảm co bóp [2–4].Những nghiên cứu trước đây cho thấy có vài mục tiêu tiềm năng trong viêm cơ tim [4], tuy nhiên, không tìm thấy điều trị nào đặc hiệu và có hiệu quả. Do vậy, cần thiết phải phát triển những chiến lược điều trị mới nhằm giảm nhẹ tình trạng viêm cơ tim.
Dipeptidyl peptidase-4 (DPP-4), một protein gồm 766 acid amin, là một amino peptidase cắt hai acid amin khỏi đầu tận N của protein hoặc peptides mục tiêu, nhờ đó làm giảm hoạt tính của cơ chất[5,6].Chức năng chủ yếu của DPP-4 là làm giảm hoạt tính của peptides incretin, bao gồm glucagon-like peptide-1 (GLP-1) và glucose-dependent insulinotropic polypeptide (GIP), góp phần làm giảm chế tiết insulin[6,7]. Thuốc ức chế DPP-4 đã được sử dụng rộng rãi để điều trị đái tháo đường típ 2.
Ngày càng có nhiều bằng chứng cho thấy ích lợi của thuốc ức chế DPP-4 không chỉ có trong đái tháo đường típ 2 mà còn ở nhiều bệnh lý tim mạch. Sử dụng alogliptin, một thuốc ức chế DPP-4, làm giảm các loại oxygen phản ứng (ROS) và giảm có hiệu quả sự hình thành phình động mạch chủ[8].Sử dụng linagliptin, một thuốc ức chế DPP-4 khác, làm giảm đáng kể diện tích nhồi máu sau nhồi máu não[9].Tác động của thuốc ức chế DPP-4 trên bệnh lý tim mạch đưa đến giả thuyết là nó cũng có lợi đối với viêm cơ tim. Do đó, mục tiêu của nghiên cứu này là làm sáng tỏ vai trò của thuốc ức chế DPP-4 trong viêm cơ tim tự miễn thực nghiệm (EAM) ở chuột.
Phương pháp
Động vật vàTiêm chủng
Chuột đực Balb/c (6 tuần tuổi; cân nặng 20 đến 25g) được mua từ CLEA JAPAN. Chúng được nuôi bằng một chế độ ăn chuẩn. Mọi quy trình liên quan đến động vật đều được tiến hành phù hợp với khuyến cáo của Hướng dẫn Chăm sóc và Sử dụng Động vật Thí nghiệm của Viện Sức khỏe Quốc gia. Quy trình này nhận được sự chấp thuận từ Ủy ban Đạo đức Động vật Thực nghiệm của Đại học Y khoa và Nha khoa Tokyo (Giấy phép số: 0140140A). MyHC-α614–629 (Japan Bio Service Co., Saitama, Japan), một peptide tổng hợp tinh khiết, được nhũ tương hóa chất hỗ trợ hoàn toàn Freund với một lượng bằng nhau Mycobacterium tuberculosis H37RA (Difco, sparks, MD, US)[10,11].Chúng tôi tiêm 0.2mL nhũ dịch (150 μg myosin tim cho mỗi con chuột) bằng kim 27-gauge dưới da lưng mỗi con chuột vào ngày 0 và 7 để gây EAM[10].Chuột được gây mê với 2, 2, 2- trichloro-1, 1-ethanediol và nỗ lực hết mức để giảm thiểu sự đau đớn.
Sử dụng một thuốc ức chế DPP-4
Linagliptin, một thuốc ức chế DPP-4, của công ty Boehringer Ingelheim (Ingelheim, Đức), với một thỏa thuận chuyển giao vật liệu. Chuột đã qua tiêm chủng được chỉ định ngẫu nhiên vào hai nhóm. Dựa vào báo cáo trước đó[12],nhóm điều trị (n = 19) được uống linagliptin (1.0 mg/kg) từ ngày 0 đến ngày 21 và nhóm không điều trị (n = 22) được uống tá dược từ ngày 0 đến ngày 21. Chuột không tiêm chủng không uống linagliptin được dùng làm nhóm chứng.
Siêu âm tim
Tiến hành siêu âm tim qua thành ngực ở chuột gây mê bằng cách tiêm vào màng bụng 3.6% chloral hydrate (2,2,2-trichloro-1,1,ethanediol: Wako Pure Chemical Industries, Osaka, Japan) trong nước muối sinh lý vào ngày 21. Máy siêu âm tim với đầu dò 14MHz (Toshiba, Tokyo, Japan) được dùng để ghi siêu âm thất trái M-mode. Siêu âm tim M-mode hai chiều được thực hiện dọc theo mặt phẳng trục ngắn của thất trái ở cơ nhú. Phân suất thu ngắn LV được tính toán từ siêu âm tim M-mode qua ba chu kỳ tim liên tiếp theo Hiệp hội Siêu âm tim Mỹ[2,13].Siêu âm tim B-mode được dùng để quan sát chức năng thất trái. Để phân tích chức năng tim, hai bác sĩ đánh giá độ co bóp độc lập, và tính giá trị trung bình
Mô bệnh học
Tim được lấy ngay lập tức sau khi chuột bị giết bằng cách cắt động mạch chủ bụng, dưới gây mê sâu vào ngày 21. Sau khi đo cân nặng (mg), thực hiện vài lát cắt ở mỗi tim để đánh giá mô bệnh học. Lát cắt mỏm tim, giữa tâm thất, và đáy tim được nhuộm với hematoxylin và eosin (HE) và nhuộm Mallory. Diện tích cơ tim có thâm nhiễm tế bào được gọi là diện tích thâm nhiễm; thay đổi xơ hóa và hoại tử được tính là diện tích xơ hóa. Chúng tôi tính toán tỷ lệ diện tích (diện tích thâm nhiễm tế bào hoặc xơ hóa/diện tích toàn bộ)[14].Để tránh sai lệch, hai nghiên cứu viên độc lập, bị làm mù đối với nhận diện lát cắt, sử dụng Image-J (Viện Sức khỏe Quốc gia, Hoa Kỳ), một hệ thống phân tích vi tính, để đo diện tích thâm nhiễm tế bào và xơ hóa. Giá trị được tính trung bình.
Hóa mô miễn dịch
Hóa mô miễn dịch được thực hiện để đánh giá biểu thị CD4 (#1540–10, SouthernBiotech), F4/80 (#123102, BioLegend) ở tim vào ngày 21. Phần đông lạnh được cố định trong acetone ở 4°C. Những phần này được ủ với kháng thể chính không gắn nhãn qua đêm ở 4°C và rửa trong PBS. Sau đó chúng tôi dùng kháng thể thứ cấp (Histofine; Nichirei Co., Tokyo, Japan) 5μg/mL trong 60 phút ở nhiệt độ phòng. Những phần này được rửa trong PBS và ủ với một phức hợp aminoethylcarbazole (AEC) (Nichirei). Tiếp theo chúng sẽ được làm phản màu với dung dịch hematoxylin (Sigma-Aldrich Japan, Tokyo, Japan). Tế bào dương tính CD4 và F4/80 được đếm và số lượng được chia cho toàn bộ diện tích.
Real-timeRT-PCR
Toàn bộ RNA được phân lập từ tim và cDNA được chuẩn bị với bộ Kit RT-PCR (Life- technologies Japan, Tokyo, Japan). Sử dụng Real-time PCR trong hệ thống StepOne real-time PCR (Lifetechnologies Japan, Tokyo, Japan), xác định biểu lộ mRNA của interleukin (IL)-2 (Mm00434256_m1), yếu tố hoại tử khối u (TNF)-α (Mm00443258_m1), IL-1β (Mm00434228_m1), IL-6 (Mm00446190_m1), collagen (Col)-1a1 (Mm00801666_g1), và fi- bronectin (Fn)-1 (Mm01256744_m1). Một quy trình real-time PCR được thực hiện sử dụng các thông số chu kỳ sau: 95°C trong 20 giây tiếp theo là 50 chu kỳ: 95°C trong 1 giây, ủ ở 60°C trong 20 giây. cDNA được chạy trong các bản sao và tính toán dữ liệu định lượng bằng phương pháp so sánh Ct (ΔΔCt). Nồng độ mRNA được định lượng và bình thường hóa đối với mức 18s (4319413E).
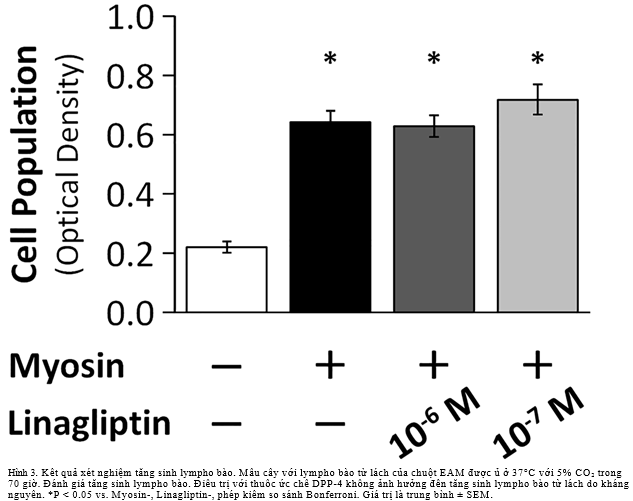
Xét nghiệm tăng sinh lympho bào
Tế bào lách được phân lập vô khuẩn từ chuột EAM vào ngày 21. Sau khi loại bỏ hồng cầu, lympho bào lách (2.5×105/giếng) được ủ trong môi trường RPMI 1640 được bổ sung huyết thanh bào thai bò 10% (FBS) và 10–4% 2-mercaptoethanol (Katayama Chemical Japan, Osaka, Japan) ở 37°C với 5% CO2 trong 1 giờ. Sau đó, thêm 100μl MyHC-α614–629 (50μg/ml) vào dung dịch cấy. Chúng tôi cho linagliptin vào từng giếng ở những nồng độ khác nhau. Dung dịch cấy được ủ ở 37°C với 5% CO2 trong 70 giờ. Ước tính sự tăng sinh lympho bào bằng một bộ đếm tế bào-8 (Dojindo, Kumamoto, Japan) [15].Sự tăng sinh tế bào được thể hiện bằng mật độ quang học 45 phút sau khi thêm bộ đếm tế bào-8.
Phân tích thống kê
Giá trị được thể hiện bằng trung bình ± sai số chuẩn của trung bình. So sánh các nhóm bằng phép kiểm T (đối với siêu âm tim và hóa mô miễn dịch), và ANOVA một chiều, tiếp theo là phép kiểm so sánh Fisher’s PLSD (đối với giải phẫu bệnh và PCR) hoặc Bonferroni (đối với xét nghiệm tăng sinh lympho bào). Sự khác biệt được xem là có ý nghĩa thống kê khi giá trị P<0.05.
Kết quả
Khối lượng tim và phổi
Khối lượng tim so với khối lượng cơ thể (mg/g) không khác biệt có ý nghĩa thống kê giữa nhóm điều trị (4.73 ± 0.12) và nhóm không điều trị (4.95 ± 0.13). Khối lượng phổi so với khối lượng cơ thể (mg/g), một chỉ số của sung huyết phổi, không khác biệt có ý nghĩa thống kê giữa nhóm điều trị (4.85 ± 0.20) và nhóm không điều trị (5.09 ± 0.23).
Chức năng tim
Phép đo qua siêu âm tim cho thấy phân suất thu ngắn (FS), phân suất tống máu (EF), bề dày vách liên thất cuối tâm trương (IVSTd), đường kính thất trái thì tâm trương (LVIDd), thành sau thất trái thì tâm trương (LVPWd), và đường kính thất trái thì tâm thu (LVIDs) giữa nhóm điều trị và không điều trị không khác biệt có ý nghĩa thống kê.(Bảng 1)
Mô bệnh học
Tỷ lệ diện tích xơ hóa cơ tim trong nhóm điều trị (2.0 ± 0.1%) thấp hơn nhóm không điều trị (4.6 ± 1.0%, P<0.05). Về diện tích cơ tim thâm nhiễm tế bào, không khác biệt có ý nghĩa thống kê giữa nhóm điều trị (1.75 ± 0.57) và nhóm không điều trị (3.04 ± 0.58) (p = 0.27).(Hình 1)
Hóa mô miễn dịch
Phân tích hóa mô miễn dịch cho thấy không có sự khác biệt có ý nghĩa thống kê về số lượng tế bào CD4 dương tính trong toàn bộ diện tích (mm2)giữa nhóm điều trị (9.86 ± 5.26) và nhóm không điều trị (7.93 ± 2.31). Tương tự, không có sự khác biệt có ý nghĩa thống kê về số lượng tế bào F4/80 dương tính trong toàn bộ diện tích (mm2) giữa nhóm điều trị (21.8 ± 8.8) và nhóm không điều trị (20.9 ± 6.7).
RT-PCR
Phân tích PCR định lượng cho thấy mức độ biểu lộ mRNA của IL-2, TNF-α, IL-1β
và IL-6 trong nhóm điều trị linagliptin thấp hơn rõ rệt nhóm EAM không điều trị
vào ngày 21. Hơn nữa, linagliptin có xu hướng giảm nồng độ mRNA của Col-1a1 và
Fn-1 so với nhóm EAM không điều trị.(Hình2)
Xét nghiệm tăng sinh lympho bào
Chúng tôi thực hiện xét nghiệm tăng sinh lympho bào để đánh giá hiệu quả của thuốc ức chế DPP-4 trên tăng sinh tế bào lách do kháng nguyên (n = 12 mỗi nhóm). Thuốc ức chế DPP-4 không ảnh hưởng đến sự tăng sinh lympho bào do kháng nguyên.(Hình3)
Bàn luận
Dù thuốc ức chế DPP-4 đã được biết là có hiệu quả tốt đối với bệnh tim mạch, như phình động mạch chủ và đột quỵ [8,9], tác dụng của ức chế DPP-4 đối với viêm cơ tim vẫn chưa được tìm hiểu. Nghiên cứu của chúng tôi là nghiên cứu đầu tiên cho thấy tác dụng chống xơ hóa của một thuốc ức chế DPP-4 (linagliptin) trên chuột EAM.
Nhiều bằng chứng gợi ý rằng T helper 1 (Th1) cytokines (ví dụ, IL-2 và TNF-α) có liên quan đến tiến trình EAM[16,17].Đặc biệt, TNF-αcó vai trò quan trọng trong sinh bệnh học của EAM [4,18,19].Chẹn TNF-αlàm giảm quá trình viêm ở chuột EAM[4]. Liu và cộng sự chứng minh rằng TNF-αđóng một vai trò then chốt trong sự thoái giáng các thành phần chất nền ngoại bào cơ tim thông qua điều hòa tăng lên metalloproteinases chất nền, đến lượt nó sẽ làm giảm sức co bóp cơ tim[18].Xơ hóa cơ tim tăng lên rõ rệt ở chuột bị biến đổi gen biểu hiện quá mức TNF-αđặc hiệu cho tim [20].Chúng tôi cũng chứng minh rằng sử dụng linagliptin ức chế có hiệu quả tình trạng xơ hóa và giảm IL-1βvà IL-6 ở chuột EAM. Vì các cytokines này là những yếu tố quan trọng trong việc đẩy nhanh EAM [11,21],linagliptin có khả năng ức chế sự tiến triển của EAM. Hơn nữa, Col-1a1 và Fn-1, được biết đến như là những yếu tố tiền xơ hóa ở các mô bị tổn thương, bị linagliptin ức chế. Những dữ liệu này gợi ý rằng linagliptin có thể có tác dụng đa hiệu kháng viêm và chống xơ hóa. Dữ liệu gần đây phát hiện ức chế DPP-4 có hiệu quả làm giảm hoạt tính của nguyên bào sợi. Kanasaki và cộng sự cho thấy linagliptin làm giảm xơ hóa thận ở chuột đái tháo đường mà không thay đổi đường huyết. Hiệu quả điều trị của linagliptin trên bệnh thận đái tháo đường có liên quan đến ức chế chương trình tiền xơ hóa[22].Vào thời điểm này chúng tôi không thể tìm ra cơ chế chi tiết, tuy nhiên, linagliptin có thể có tác động đa hiệu mới mẻ ức chế quá trình viêm và xơ hóa mô.
Dạng hòa tan của DPP-4, không có chức năng xuyên màng của một aminopeptidase, được mô tả ở trên. Mặt khác, DPP-4, cũng được biết đến như CD26, được biểu lộ trên bề mặt tế bào miễn dịch, bao gồm tế bào T cells, tế bào cells, tế bào NK, tế bào đuôi gai và đại thực bào [6,23,24].DPP-4 tương tác với một loạt phối tử, như adenosine deaminase và bơm trao đổi ion Na+/H+ ở thận[6],do đó đóng vai trò quan trọng trong di chuyển tế bào và bám dính tế bào với collagen típ I và với fibronectin. Shin và cộng sự chứng minh rằng sự di chuyển và bám dính tế bào thông qua DPP-4 độc lập với hoạt tính men của DPP-4 [25].Hơn nữa, CD26 cũng tham gia vào sự tương tác xuyên màng trong đáp ứng của tế bào T đối với kháng nguyên [26–28]. Tuy nhiên, kết quả hiện tại cho thấy sự tăng sinh lympho bào do kháng nguyên không bị ngăn chặn bởi một ức chế DPP-4. Điều đó gợi ý rằng DPP-4 qua trung gian tín hiệu có thể không liên quan đến sự tăng sinh lympho bào trong đáp ứng viêm.
Để hiểu cơ chế phân tử của DPP-4 trong tiến trình bệnh lý tim mạch do viêm, phải tính đến cơ chất của DPP-4. DPP-4 được biết là có nhiều cơ chất khác nhau bị bất hoạt bởi hoạt tính của aminopeptidase, bao gồm GLP-1, GIP và SDF-1α[6,29].Bose và cộng sự chứng minh rằng GLP-1 có chức năng bảo vệ tim ở mô hình chuột thiếu máu cơ tim và tổn thương tái tưới máu[30].Exenatide, một GLP-1 analogue, làm giảm kích thước cơ tim nhồi máu ở mô hình lợn thiếu máu cơ tim [7]. Shigeta và cộng sự phát hiện thấy ức chế DPP-4 làm thoái lui rối loạn chức năng tâm trương thất trái đáp ứng với quá tải áp lực, thông qua hoạt động hình thành mạch tại chỗ, qua trung gian DPP-4/SDF-1α[29]. Do vậy, ức chế DPP-4 có thể có hiệu quả điều trị nào đó đối với EAM thông qua điều hòa chức năng của cơ chất DPP-4.
Giới hạn
Nghiên cứu của chúng tôi phát hiện ra rằng ức chế DPP-4 làm giảm có ý nghĩa sự biểu lộ mRNA IL-2, TNF-α, IL-1βvà IL-6 và xơ hóa tim EAM. Tuy nhiên, nghiên cứu của chúng tôi không làm rõ thuốc ức chế DPP-4 có ngăn chặn chức năng lympho bào trực tiếp hay không và cơ chất của DPP-4 có liên quan đến hiệu quả kháng viêm trong EAM hay không. Vì nhiều yếu tố, như nhiễm virus và tự miễn, có liên quan đến viêm cơ tim [4,31], hiệu quả của thuốc ức chế DPP-4 cũng nên làm sáng tỏ thông qua việc sử dụng mô hình viêm cơ tim do virus. Do đó, cần thêm nghiên cứu để làm rõ tác dụng của thuốc ức chế DPP-4 trên chuột bị EAM.
Kết luận
Linagliptin, một thuốc ức chế DPP-4, phòng ngừa xơ hóa cơ tim và giảm biểu lộ Th1 cytokine ở EAM. Kết quả này gợi ý khả năng sử dụng thuốc ức chế DPP-4 để làm giảm xơ hóa ở bệnh nhân viêm cơ tim.
References
1. Sagar S, Liu PP, Cooper LT Jr. (2012) Myocarditis. Lancet 379: 738–747. doi: 10.1016/S0140-6736 (11)60648-X PMID: 22185868
2. Suzuki J, Ogawa M, Maejima Y, Isobe K, Tanaka H, Sagesaka YM, et al. (2007) Tea catechins attenu- ate chronic ventricular remodeling after myocardial ischemia in rats. J Mol Cell Cardiol 42: 432–440. PMID: 17174976
3. Kishimoto C, Nimata M, Okabe TA, Shioji K (2013) Immunoglobulin treatment ameliorates myocardial injury in experimental autoimmune myocarditis associated with suppression of reactive oxygen spe- cies. Int J Cardiol 167: 140–145. doi: 10.1016/j.ijcard.2011.12.058 PMID: 22244481
4. Leuschner F, Katus HA, Kaya Z (2009) Autoimmune myocarditis: past, present and future. J Autoim- mun 33: 282–289. doi: 10.1016/j.jaut.2009.07.009 PMID: 19679447
5. Matteucci E, Giampietro O (2009) Dipeptidyl peptidase-4 (CD26): knowing the function before inhibiting the enzyme. Curr Med Chem 16: 2943–2951. PMID: 19689275
6. Zhong J, Rao X, Rajagopalan S (2013) An emerging role of dipeptidyl peptidase 4 (DPP4) beyond glu- cose control: potential implications in cardiovascular disease. Atherosclerosis 226: 305–314. doi: 10.
1016/j.atherosclerosis.2012.09.012 PMID: 23083681
7. Timmers L, Henriques JP, de Kleijn DP, Devries JH, Kemperman H, Steendijk P, et al. (2009) Exena- tide reduces infarct size and improves cardiac function in a porcine model of ischemia and reperfusion injury. J Am Coll Cardiol 53: 501–510. doi: 10.1016/j.jacc.2008.10.033 PMID: 19195607
8. Bao W, Morimoto K, Hasegawa T, Sasaki N, Yamashita T, Hirata K, et al. (2013) Orally administered dipeptidyl peptidase-4 inhibitor (alogliptin) prevents abdominal aortic aneurysm formation through an antioxidant effect in rats. J Vasc Surg.
9. Darsalia V, Ortsater H, Olverling A, Darlof E, Wolbert P, Nystrom T, et al. (2013) The DPP-4 inhibitor linagliptin counteracts stroke in the normal and diabetic mouse brain: a comparison with glimepiride. Di- abetes 62: 1289–1296. doi: 10.2337/db12-0988 PMID: 23209191
10. Pummerer CL, Luze K, Grassl G, Bachmaier K, Offner F, Burrell SK, et al. (1996) Identification of cardi- ac myosin peptides capable of inducing autoimmune myocarditis in BALB/c mice. J Clin Invest 97:
2057–2062. PMID: 8621795
11. Eriksson U, Kurrer MO, Schmitz N, Marsch SC, Fontana A, Eugster HP, et al. (2003) Interleukin-6-defi- cient mice resist development of autoimmune myocarditis associated with impaired upregulation of complement C3. Circulation 107: 320–325. PMID: 12538435
12. Thomas L, Eckhardt M, Langkopf E, Tadayyon M, Himmelsbach F, Mark M (2008) (R)-8-(3-amino- piperidin-1-yl)-7-but-2-ynyl-3-methyl-1-(4-methyl-quinazolin-2-ylm ethyl)-3,7-dihydro-purine-2,6-dione (BI 1356), a novel xanthine-based dipeptidyl peptidase 4 inhibitor, has a superior potency and longer duration of action compared with other dipeptidyl peptidase-4 inhibitors. J Pharmacol Exp Ther 325:
175–182. doi: 10.1124/jpet.107.135723 PMID: 18223196
13. Futamatsu H, Suzuki J, Kosuge H, Yokoseki O, Kamada M, Ito H, et al. (2003) Attenuation of experi- mental autoimmune myocarditis by blocking activated T cells through inducible costimulatory molecule pathway. Cardiovasc Res 59: 95–104. PMID: 12829180
14. Suzuki J, Ogawa M, Futamatsu H, Kosuge H, Tanaka H, Isobe M (2006) A cyclooxygenase-2 inhibitor alters Th1/Th2 cytokine balance and suppresses autoimmune myocarditis in rats. J Mol Cell Cardiol
40: 688–695. PMID: 16499924
15. Futamatsu H, Suzuki J, Mizuno S, Koga N, Adachi S, Kosuge H, et al. (2005) Hepatocyte growth factor ameliorates the progression of experimental autoimmune myocarditis: a potential role for induction of T helper 2 cytokines. Circ Res 96: 823–830. PMID: 15774858
16. Daniels MD, Hyland KV, Wang K, Engman DM (2008) Recombinant cardiac myosin fragment induces experimental autoimmune myocarditis via activation of Th1 and Th17 immunity. Autoimmunity 41:
490–499. doi: 10.1080/08916930802167902 PMID: 18781477
17. Watanabe R, Azuma RW, Suzuki JI, Ogawa M, Itai A, Hirata Y, et al. (2013) Inhibition of NF-kappaB ac- tivation by a novel IKK inhibitor reduces the severity of experimental autoimmune myocarditis via sup- pression of T-cell activation. Am J Physiol Heart Circ Physiol.
18. Liu X, Li B, Wang W, Zhang C, Zhang M, Zhang Y, et al. (2012) Effects of HMG-CoA reductase inhibitor on experimental autoimmune myocarditis. Cardiovasc Drugs Ther 26: 121–130. doi: 10.1007/s10557-
012-6372-6 PMID: 22382902
19. Tang Z, McGowan BS, Huber SA, McTiernan CF, Addya S, Surrey S, et al. (2004) Gene expression profiling during the transition to failure in TNF-alpha over-expressing mice demonstrates the develop- ment of autoimmune myocarditis. J Mol Cell Cardiol 36: 515–530. PMID: 15081311
20. Sivasubramanian N, Coker ML, Kurrelmeyer KM, MacLellan WR, DeMayo FJ, Spinale FG, et al. (2001) Left ventricular remodeling in transgenic mice with cardiac restricted overexpression of tumor necrosis factor. Circulation 104: 826–831. PMID: 11502710
21. Zempo H, Sugita Y, Ogawa M, Watanabe R, Suzuki JI, Isobe M (2014) A P2X7 receptor antagonist at- tenuates experimental autoimmune myocarditis via suppressed myocardial CD4 T and macrophage in- filtration and NADPH oxidase 2/4 expression in mice. Heart Vessels.
22. Kanasaki K, Shi S, Kanasaki M, He J, Nagai T, Nakamura Y, et al. (2014) Linagliptin-mediated DPP-4 inhibition ameliorates kidney fibrosis in streptozotocin-induced diabetic mice by inhibiting endothelial-
to-mesenchymal transition in a therapeutic regimen. Diabetes 63: 2120–2131. doi: 10.2337/db13-1029
PMID: 24574044
23. Reinhold D, Bank U, Buhling F, Kahne T, Kunt D, Faust J, et al. (1994) Inhibitors of dipeptidyl peptidase IV (DP IV, CD26) specifically suppress proliferation and modulate cytokine production of strongly CD26 expressing U937 cells. Immunobiology 192: 121–136. PMID: 7750986
24. Zhong J, Rao X, Deiuliis J, Braunstein Z, Narula V, Hazey J, et al. (2013) A potential role for dendritic cell/macrophage-expressing DPP4 in obesity-induced visceral inflammation. Diabetes 62: 149–157. doi: 10.2337/db12-0230 PMID: 22936179
25. Shin JW, Jurisic G and Detmar M (2008) Lymphatic-specific expression of dipeptidyl peptidase IV and its dual role in lymphatic endothelial function. Exp Cell Res 314: 3048–3056. doi: 10.1016/j.yexcr.
2008.07.024 PMID: 18708048
26. Ohnuma K, Uchiyama M, Hatano R, Takasawa W, Endo Y, Dang NH, et al. (2009) Blockade of CD26- mediated T cell costimulation with soluble caveolin-1-Ig fusion protein induces anergy in CD4+T cells. Biochem Biophys Res Commun 386: 327–332. doi: 10.1016/j.bbrc.2009.06.027 PMID: 19523449
27. Martin M, Huguet J, Centelles JJ, Franco R (1995) Expression of ecto-adenosine deaminase and CD26 in human T cells triggered by the TCR-CD3 complex. Possible role of adenosine deaminase as costimulatory molecule. J Immunol 155: 4630–4643. PMID: 7594462
28. Pacheco R, Martinez-Navio JM, Lejeune M, Climent N, Oliva H, Gatell JM, et al. (2005) CD26, adeno- sine deaminase, and adenosine receptors mediate costimulatory signals in the immunological syn- apse. Proc Natl Acad Sci U S A 102: 9583–9588. PMID: 15983379
29. Shigeta T, Aoyama M, Bando YK, Monji A, Mitsui T, Takatsu M, et al. (2012) Dipeptidyl peptidase-4 modulates left ventricular dysfunction in chronic heart failure via angiogenesis-dependent and- independent actions. Circulation 126: 1838–1851. doi: 10.1161/CIRCULATIONAHA.112.096479
PMID: 23035207
30. Bose AK, Mocanu MM, Carr RD, Brand CL, Yellon DM (2005) Glucagon-like peptide 1 can directly pro- tect the heart against ischemia/reperfusion injury. Diabetes 54: 146–151. PMID: 15616022
31. Shauer A, Gotsman I, Keren A, Zwas DR, Hellman Y, Durst R, et al. (2013) Acute viral myocarditis: cur- rent concepts in diagnosis and treatment. Isr Med Assoc J 15: 180–185. PMID: 23662385







