THS. BS. NGUYỄN DƯƠNG KHANG*
BSCKII. NGUYỄN THANH HIỀN
* Khoa Tim mạch can thiệp, BV Đại học Y Dược TP.HCM
- TỔNG QUAN
Thuyên tắc phổi (PE) là tình trạng thuyên tắc tại động mạch phổi với nguyên nhân có thể từ huyết khối, khối u, mỡ hoặc khí. Trong phạm vi bài này, thuyên tắc phổi tập trung vào thuyên tắc do huyết khối. PE xảy ra khi một phần của huyết khối vỡ ra và trôi trong dòng máu cho đến khi bị nghẽn lại tại động mạch phổi [1]. Đa số các thuyên tắc tĩnh mạch sâu tiến triển ở chi dưới, nhưng có đến một nửa số trường hợp có thể đưa đến PE [2]. PE là một vấn đề về sức khỏe quan trọng trên toàn thế giới vì tần suất tình trạng này ở người lớn tuổi ngày càng gia tăng. Các yếu tố nguy cơ khác của PE bao gồm béo phì, bất động, chấn thương và ung thư [3].
Các Hướng dẫn điều trị bằng kháng đông hiện nay đều ưu tiên sử dụng thuốc kháng đông đường uống thế hệ mới (NOACs) trong khởi trị cũng như điều trị lâu dài PE [4]. Dabigatran, rivaroxaban, apixaban, và edoxaban được ưu tiên lựa chọn so với thuốc kháng vitamin K (VKA). Khuyến cáo này được đưa ra dựa trên bằng chứng về giảm nguy cơ thuyên tắc huyết khối tĩnh mạch (VTE) là tương đương nhưng giảm nguy cơ chảy máu và cũng như tiện lơn cho cả bệnh nhân và nhân viên y tế trong việc theo dõi điều trị [4]. Mỗi loại thuốc NOAC đều mang lại hiệu quả điều trị là tương đương VKA với nguy cơ chảy máu là thấp hơn; trừ tình huống dùng dabigatran, rivaroxaban và edoxaban có thể có khả năng chảy máu tiêu hóa cao hơn khi so với warfarin trong điều trị những bệnh nhân rung nhĩ [4]. Những khuyến cáo điều trị này có khác biệt nhỏ so với điều trị thuyên tắc liên quan đến ung thư. Ở những bệnh nhân này, heparin trọng lượng phân tử thấp (LMWH) vẫn được khuyến cáo mạnh hơn VKA khi những bằng chứng cho thấy LMWH có hiệu quả hơn trong việc giảm tái phát biến cố huyết khối ở nhóm dân số khó dung nạp đường uống cũng như không thể theo dõi chỉ số INR thường xuyên được [4].
Thời gian sử dụng kháng đông trong PE ít nhất là 3 tháng, sau đó có thể kéo dài hoặc sử dụng vô thời hạn trong một số tình huống nhất định. Ở những bệnh nhân có PE khởi phát sau phẫu thuật hoặc một yếu tố nguy cơ không liên quan phẫu thuật thoáng qua khác, thời gian dùng kháng đông khuyến cáo là 3 tháng [4]. Ở những bệnh nhân có PE không yếu tố kích gợi, thời gian dùng kháng đông sẽ được quyết định dựa trên nguy cơ chảy máu; nhưng ở những bệnh nhân có nguy cơ chảy máu cao, thời gian dùng thuốc sẽ vẫn giữ vững ở mức 3 tháng. Ở nhóm bệnh nhân nguy cơ chảy máu thấp – trung bình, thời gian điều trị sẽ là vô thời hạn [4].
Dự phòng PE ở những bệnh nhân nội viện có vai trò của cả LMWH, UFH hoặc fondaparinux [5]. Chảy máu vẫn là quan ngại chính trong điều trị kháng đông. Các thuốc đảo ngược tác dụng kháng đông như protamine sulfate và vitamin K lần lượt được sử dụng trong trường hợp chảy máu liên quan đến heparin và warfarin. Phức hợp prothrombin yếu tố 4 (4F-PCC) được ưa chuộng hơn huyết tương tươi đông lạnh (FFP) trong trường hợp chảy máu liên quan warfarin. Andexanet alfa là một chất hóa giải mới, được sử dụng khi chảy máu liên quan apixaban hoặc rivaroxaban; còn idarucizumab là kháng thể đơn dòng được dùng làm chất hóa giải cho dabigatran. Sự có mặt của các thuốc này đã giúp cho các bác sĩ lâm sàng thêm phần tự tin trong việc quản lý bệnh nhân PE nội trú và ngoại trú bằng kháng đông.
- ĐIỀU TRỊ
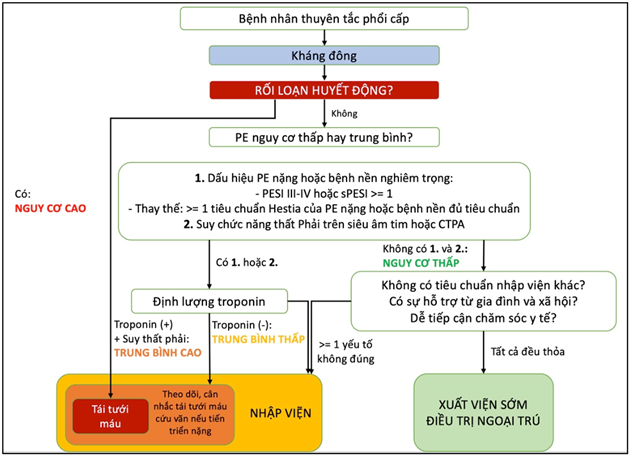
Hình 1. Lưu đồ tiếp cận quản lý bệnh nhân thuyên tắc phổi [6]
2.1 Tiêu sợi huyết trong PE
Liệu pháp tiêu sợi huyết trong PE có thể được sử dụng qua đường toàn thân hoặc tại chỗ qua catheter trực tiếp vào động mạch phổi. Tiêu sợi huyết có thể làm giảm áp lực động mạch phổi và làm tăng nồng độ oxy máu động mạch [7]. Những nghiên cứu về tiêu sợi huyết trong PE cấp tính cho kết cục khả quan khi giới hạn việc sử dụng chỉ ở những bệnh nhân có PE lớn (massive) tức nguy cơ cao [7], [8]. Những bệnh nhân có rối loạn huyết động, suy chức năng thất Phải và không có nguy cơ chảy máu nặng sẽ là những ứng cử viên hàng đầu cho việc sử dụng tiêu sợi huyết cấp cứu [4], [6]. Hiệu quả của việc dùng tiêu sợi huyết đúng lúc sẽ được quan sát thấy trong 36 giờ đầu tiên [9]. Tử suất sẽ lên đến 30% ở những bệnh nhân nguy cơ cao, và do vậy thời điểm dùng thuốc là tối quan trọng [10], [11]. Các tác dụng không mong muốn, đặc biệt là chảy máu nội sọ và nơi khác, đòi hỏi nhà lâm sàng phải đánh giá kỹ lưỡng bệnh nhân trước khi khởi động liệu pháp tiêu sợi huyết [12], [13]. Alteplase đường toàn thân là thuốc tiêu sợi huyết duy nhất được FDA thông qua để điều trị PE rối loạn huyết động, thuyên tắc lớn (nguy cơ cao) [14]. Tất cả các thuốc kháng đông phải được ngừng sử dụng trước khi khởi đầu alteplase với liều thường dùng nhất là 100mg IV trong vòng 2 giờ. Phác đồ thay thế có thể được dùng ở những bệnh nhân có cân nặng < 65 kg [15]. Phác đồ này khởi đầu bằng 15mg bolus, sau đó là 0,75 mg/kg trong vòng 30 phút (tối đa 50mg) và sau đó là 0,5 mg/kg trong 30 phút tiếp theo (tối đa 35mg). Alteplase dùng qua catheter trực tiếp với liều 0,5 – 2 mg/giờ trong 2 – 15 giờ với tổng liều 4 – 24mg đã được dùng thành công trong những cơ sở có bác sĩ có kinh nghiệm và hướng dẫn tiến hành cụ thể; nhưng đường dùng này hiện chưa được FDA thông qua [16]. Tenecteplase và reteplase đã được dùng trong PE lớn, nguy cơ cao nhưng cũng không được FDA thông qua sử dụng ở bệnh nhân PE [17], [18].
Chỉ định dùng tiêu sợi huyết còn nhiều tranh cãi, nhất là trong nhóm nguy cơ trung bình [19]. Nhiều nghiên cứu đã chứng minh thuốc tiêu sợi huyết cải thiện suy chức năng thất Phải, và một phân tích gộp đã cho thấy lợi ích về sống còn [20], [12], [21]. Nghiên cứu lớn nhất trong số này là nghiên cứu Pulmonary Embolism Thrombolysis Study, là nghiên cứu đa trung tâm, mù đôi có nhóm chứng, so sánh Tenecteplase + heparin với placebo + heparin. Kết quả cho thấy tiêu sợi huyết không làm giảm tử vong có ý nghĩa trong vòng 7 ngày hoặc 30 ngày đầu, nhưng giúp ngăn ngừa rối loạn huyết động. Tuy nhiên, chảy máu nặng thường gặp hơn đáng kể khi dùng Tenecteplase [12]. Một nghiên cứu ngẫu nhiên khác so sánh LMWH và LMWH + Tenecteplase. Sau theo dõi 3 tháng, nhóm Tenecteplase có tiên lượng, chất lượng sống và khả năng gắng sức tốt hơn [22]. Trong bài phỏng vấn gần đây [23], GS. Stavros Konstantinides đã đưa ra nhận định rằng: với nhóm bệnh nhân thuyên tắc phổi nguy cơ trung bình cao, phân tích dưới nhóm của nghiên cứu PEITHO cho chúng ta thấy ta cần xác định chính xác hơn những bệnh nhân nào có nguy cơ ở giới hạn trên của trung bình cao, mà có thể có lợi được từ việc dùng tiêu sợi huyết (các chỉ số như nhịp tim nhanh, thay đổi huyết áp, nồng độ oxy máu, và tần số thở có thể có ích trong việc đưa ra quyết định).
Gánh nặng huyết khối lan rộng có thể làm tăng áp lực động mạch phổi mà không gây rối loạn huyết động hoặc suy chức năng thất phải. Một nghiên cứu hồi cứu lớn đã cho thấy trong PE cấp tính, chỉ số tắc nghẽn trên CTA > 40% có liên quan với tăng tử suất 11 lần. Tuy vậy, một bài tổng quan gần đây đã cho thấy rằng vẫn còn thiếu dữ kiện để kết luận rằng việc dùng tiêu sợi huyết toàn thân sẽ làm giảm tử vong với tần suất chảy máu chấp nhận được.
Dữ liệu từ việc dùng tiêu sợi huyết ở những bệnh nhân có giảm oxy máu nặng, ngưng hô hấp tuần hoàn do PE, và huyết khối tự do trong lòng thất Phải hoặc nhĩ Phải là còn giới hạn; do đó khuyến cáo nên tiếp cận theo từng trường hợp.
Bảng 1. Chỉ định tiêu sợi huyết trong điều trị thuyên tắc phổi
| Chỉ định tuyệt đối | Chỉ định tương đối |
| PE nguy cơ cao (massive)
|
PE nguy cơ trung bình (submassive) có kèm:
Tụt oxy máu nặng Suy chức năng thất Phải nặng/nặng hơn Những bệnh nhân PE có tình trạng diễn tiến xấu hơn (như tăng dấu ấn sinh học tại tim, tần số tim tăng dần…) Huyết khối tự do trong lòng nhĩ Phải hoặc thất Phải Gánh nặng huyết khối lan rộng |
Bảng 2. Chống chỉ định tiêu sợi huyết trong điều trị thuyên tắc phổi [6]
| Chống chỉ định tuyệt đối | Chống chỉ định tương đối |
| Tiền sử đột quỵ xuất huyết hoặc đột quỵ không rõ vị trí
Đột quỵ thiếu máu não trong 6 tháng qua U thần kinh trung ương Chấn thương nặng, phẫu thuật hoặc chấn thương đầu trong 3 tuần qua Bệnh lý dễ chảy máu Chảy máu tiến triển |
Thoáng thiếu máu não trong 6 tháng qua
Đang dùng kháng đông đường uống Mang thai hoặc tuần đầu tiên hậu sản Vị trí thủ thuật không đè ép được Hồi sức sau chấn thương Tăng huyết áp kháng trị (huyết áp tâm thu > 180 mmHg) Bệnh gan tiến triển Viêm nội tâm mạc nhiễm trùng Loét dạ dày tiến triển |
Alteplase (rt-PA) vẫn là thuốc tiêu sợi huyết được dùng phổ biến nhất trong PE. Liều được chấp thuận trong PE là 100mg truyền trong 2 giờ. Ở mức liều này, y văn đã ghi nhận những trường hợp có biến chứng chảy máu lớn (đa phần là chảy máu não), đặc biệt ở bệnh nhân lớn tuổi. Do vậy, các nghiên cứu gần đây đã ghi nhận rt-PA liều thấp (0,6 mg/kg, tối đa 50mg/2 giờ) cũng có hiệu quả như liều chuẩn và an toàn hơn nhiều trên phương diện chảy máu [24], [25], [26]. Một phân tích gộp gần đây bao gồm 4 nghiên cứu so sánh alteplase liều chuẩn và liều thấp cho thấy không có sự khác biệt về tử vong giữa 2 nhóm điều trị và tỉ lệ chảy máu lớn thấp hơn trong nhóm rt-PA liều thấp, nhưng sự khác biệt này là không có ý nghĩa thống kê [27]. Hơn nữa, một nghiên cứu hồi cứu đánh giá kết cục dài hạn của việc dùng rt-PA liều thấp cho thấy kết cục tương tự với nhóm dùng liều chuẩn [28]. Những kết quả này cho thấy việc dùng liều thấp có thể được cân nhắc là lựa chọn thay thế hàng đầu ở những bệnh nhân PE nguy cơ trung bình. Tuy vậy, cần thiết có những nghiên cứu tiến cứu lớn hơn. Đồng thời, các kết quả cho thấy rt-PA liều thấp có hiệu quả tương tự liều chuẩn cũng dấy lên nhiều câu hỏi: liệu liều tiêu sợi huyết toàn thân có thể giảm thêm nữa không? Liều có thể được hiệu chỉnh dựa trên sự cải thiện các chỉ số lâm sàng hay không? Bằng cách này, liệu nguy cơ chảy máu có thể giảm thiểu được hơn nữa?
Một khía cạnh khác trong việc sử dụng tiêu sợi huyết ở bệnh nhân PE là vai trò của tiêu sợi huyết tại chỗ trong PE nặng có nguy cơ chảy máu cao hoặc những bệnh nhân PE nguy cơ trung bình thấp và nguy cơ chảy máu không cao. Có 2 loại thiết bị có thể được dùng và đang được đánh giá trên lâm sàng: (1) tiêu sợi huyết liều thấp tại chỗ qua catheter (liều khoảng 1/5 liều thông thường), có hoặc không có hướng dẫn của siêu âm (dành cho những bệnh nhân không có chống chỉ định tuyệt đối với tiêu sợi huyết); và (2) các thiết bị hút/ly giải huyết khối thuần về mặt cơ học (dành cho những bệnh nhân có chống chỉ định tuyệt đối của tiêu sợi huyết). Tuy vậy, những cách tiếp cận này vẫn chưa được khuyến cáo rõ ràng trong các Hướng dân. Chúng ta vẫn cần các nghiên cứu lâm sàng ngẫu nhiên có nhms chứng với kết cục đo lường có ý nghĩa về mặt lâm sàng để đánh giá các thiết bị này. Từ đó, chúng ta mới có được kết luận vững chắc về việc áp dụng các phương thức điều trị can thiệp này trong PE cấp.
2.2 Kháng đông trong PE
Bảng 3. Tổng quan các loại thuốc kháng đông trong điều trị thuyên tắc phổi
| Thuốc | Liều | Lưu ý |
| UFH | 80 UI/kg IV bolus, sau đó truyền 18 UI/kg/giờ | |
| Enoxaparin | 1 mg/kg TDD x 2 lần/ngày | |
| Dalteparin | 200 UI/kg/ngày TDD trong 1 tháng sau đó 150 UI/kg/ngày TDD từ tháng 2 – tháng 6 | Tối đa 18000 UI/ngày |
| Fondaparinux | <50kg: 5mg TDD mỗi ngày
50 – 100kg: 7,5mg TDD mỗi ngày >100kg: 10mg TDD mỗi ngày |
Khởi động warfarin trong 72 giờ và dùng đồng thời trong ít nhất 5 ngày |
| Edoxaban | 60mg 1 lần/ngày; 30mg 1 lần/ngày nếu =< 60kg | Không dùng ở bệnh nhân có CrCl > 95 mL/phút. Khởi động sau 5 – 10 ngày dùng kháng đông tĩnh mạch |
| Apixaban | 10mg x 2 lần/ngày trong 7 ngày, sau đó 5mg x 2 lần/ngày | |
| Rivaroxaban | 15mg x 2 lần/ngày x 3 tuần, sau đó 20mg 1 lần/ngày trong ít nhất 6 tháng | Dùng khi ăn để cải thiện hấp thu |
| Dabigatran | 150mg x 2 lần/ngày; 110mg x 2 lần/ngày với BN >= 80 tuổi | Khởi động sau 5 – 10 ngày dùng kháng đông tĩnh mạch
Giảm liều còn 110mg x 2 lần/ngày ở BN >= 80 tuổi hoặc >= 75 tuổi với ít nhất 1 yếu tố nguy cơ chảy máu |
2.2.1 Heparin không phân đoạn
UFH là một dạng kháng đông đường tĩnh mạch, được phân lập từ mô bò hoặc mô lợn, hoạt động bằng cách bất hoạt thrombin (IIa) và yếu tố Xa thông qua anti-thrombin. Với thời gian bán hủy từ 0,5 – 1,5 giờ, UFH là kháng đông được ưa chuộng ở bệnh nhân PE, đặc biệt là những trường hợp có nguy cơ chảy máu cao, bệnh nguy kịch, hoặc người cần được tiến hành thủ thuật/phẫu thuật. Hoạt tính kháng đông xảy ra nhánh chóng và biến mất trong vòng vài giờ sau khi ngưng truyền. Một ưu điểm khác của UFH là sự chuyển hóa và thải trừ chuyên biệt qua hệ lưới nội bào, từ đó khiến nó trở nên một lựa chọn tốt cho những bệnh nhân có chức năng thận xấu hoặc không ổn định (độ thanh thải creatinine (CrCl) < 30 mL/phút) [1]. Vì UFH không có hoạt tính enzyme cytochrome P450 tại gan, tương tác thuốc chỉ giưới hạn ở mức tăng nguy cơ chảy máu khi dùng các thuốc kháng đông và kháng kết tập tiểu cầu đồng thời. Đường truyền tĩnh mạch là lựa chọn được ưa chuộng trong tình huống shock và/hoặc tụt huyết áp. Nếu chọn khởi động IV UFH, liều khởi đầu sẽ là bolus 80 U/kg hoặc 5000 U, sau đó truyền liên tục 18 U/kg/giờ hoặc 1300 U/giờ; với mục tiêu là đạt được nhanh chóng và duy trì aPTT ở trong ngưỡng điều trị. Chúng ta sẽ theo dõi aPTT mỗi 4 – 6 giờ để chỉnh liều UFH thích hợp (Bảng 1).
Giảm tiểu cầu liên quan với heparin có thể hiện diện ở 2 dạng. Một dạng giảm tiểu cầu không do miễn dịch, xảy ra sớm, lành tính, có thể phục hồi được; và một dạng giảm tiểu cầu qua trung gian miễn dịch IgG xảy ra muộn, nguy hiểm hơn, gọi là giảm tiểu cầu do heparin (heparin-induced thrombocytopenia – HIT). HIT là một điều đáng quan ngại khi dùng UFH trong điều trị PE, với tần suất toàn thể được báo cáo lên đến 7% với tử suất từ 20 – 30% và thay đổi dựa trên nhiều yếu tố như tùy dân số bệnh nhân (phẫu thuật so với dùng thuốc), thời gian dùng heparin, loại heparin được sử dụng [29], [30]. UFH có nguy cơ gây HIT cao hơn LMWH 3 lần và có các biến chứng đe dọa chi và đe dọa tính mạng nghiêm trọng [31]. Cơ chế của HIT đến từ việc hình thành igG chống lại phức hợp heparin/PF4 trên tiểu cầu. Một khi IgG gắn vào phức hợp heparin/PF4 trên tiểu cầu, tiểu cầu sẽ trở nên hoạt hóa, từ đó hình thành huyết khối động mạch và tĩnh mạch [31], [32]. Khuyến cáo theo dõi số lượng tiểu cầu mỗi 2 – 4 ngày hoặc sát hơn ở những bệnh nhân nguy cơ cao hơn ở những bệnh nhân được dùng heparin [32].
Một số tác dụng phụ đáng quan tâm là giảm tiểu cầu và chảy máu nặng, như chảy máu não và chảy máu tiêu hóa. Một tác dụng phụ khác là giảm mật độ xương đáng kể với tần suất được báo cáo lên tới 30% số bệnh nhân người lớn và gãy xương có triệu chứng xảy ra ở 2 – 3% số bệnh nhân được dùng heparin ít nhất 1 tháng [33].
Bảng 4. Điều chỉnh liều heparin không phân đoạn
| aPTT | Thay đổi liều |
| < 35s (< 1,2 x chứng) | 80 U/kg bolus, sau đó tăng tốc độ truyền 4 U/kg/giờ |
| 35 – 45s (1,2 – 1,5 x chứng) | 40 U/kg bolus, sau đó tăng tốc độ truyền 2 U/kg/giờ |
| 46 – 70s (1,5 – 2,3 x chứng) | Không thay đổi |
| 71 – 90s (2,3 – 3,0 x chứng) | Giảm tốc độ truyền 2 U/kg/giờ |
| > 90s (> 3,0 x chứng) | Ngưng truyền trong 1 giờ, sau đó giảm tốc độ 3 U/kg/giờ |
2.2.2 Heparin trọng lượng phân tử thấp
LMWH, bao gồm enoxaparin và dalteparin, có trọng lượng phân tử trung bình dưới 50% UFH. Các thuốc này có ưu điểm là hoạt tính kháng đông bên vững khi dùng qua đường tiêm dưới da và chỉnh liều theo trọng lượng cơ thể. LMWHs hiện nay được khuyến cáo là kháng đông ưa chuộng trong trường hợp bệnh lý ác tính đang hoạt động và thai kỳ. Tuy vậy các bằng chứng mới hơn có sự cởi mở hơn trong việc chỉ định DOACs, khi các bằng chứng chỉ ra lợi ích của các thuốc này trong điều trị VTE ở bệnh nhân ung thư. Theo dõi nồng độ anti-Xa thường quy không được khuyến cáo khi dùng enoxaparin nhưng có thể được cân nhắc ở những bệnh nhân có chức năng thận suy giảm nặng hoặc không ổn định và những bệnh nhân béo phì với BMI >= 40 kg/m2 (hoặc > 190 kg) và sẽ dùng enoxaparin kéo dài hơn 1 – 2 tuần. Nồng độ anti-Xa đạt đỉnh sẽ được ghi nhận tại thời điểm nồng độ thuốc đã đạt được trạng thái bình nguyên và được lấy máu 4 giờ sau khi tiêm enoxaparin, với mục tiêu điều trị là 0,6 – 1,9 IU/mL [34]. Theo dõi hoạt tính anti-Xa ở những bệnh nhân béo phì > 120 – 140 kg và những bệnh nhân suy thận nặng/không ổn định có thể được cân nhắc trong trường hợp dalteparin với ngưỡng anti-Xa mục tiêu 0,5 – 1,5 IU/mL. Tương tự như enoxaparin, nồng độ anti-Xa khi dùng dalteparin cũng được ghi nhận khi đã đạt được trạng thái bình nguyên (tức dùng ít nhất 3 – 4 liều thuốc) và sau 4 – 6 giờ tiêm dalteparin.
Dù nguy cơ HIT khi dùng LMWH là thấp hơn UFH, nên ghi nhận số lượng tiểu cầu nền tảng để theo dõi tiến triển của HIT. Những bệnh nhân đã có tiền căn HIT nên tránh dùng LMWH. Mặc dù LMWH ít kích hoạt sự hình thành kháng thể HIT hơn UFH, thì một khi đã hình thành kháng thể HIT rồi thì LMWH cũng tác dụng tương đương UFH trong kích hoạt hoạt tính tiểu cầu bởi kháng thể HIT [33].
Bảng 5. Kháng đông tĩnh mạch ngắt quãng trong điều trị thuyên tắc phổi
| Liều | Khoảng liều | |
| Enoxaparin | 1,0 mg/kg | Mỗi 12 giờ |
| Hoặc | ||
| 1,5 mg/kg | Mỗi ngày | |
| Tinzaparin | 175 U/kg | Mỗi ngày |
| Dalteparin | 100 IU/kg | Mỗi 12 giờ |
| Hoặc | ||
| 200 IU/kg | Mỗi ngày | |
| Nadroparin | 86 IU/kg | Mỗi 12 giờ |
| Hoặc | ||
| 171 IU/kg | Mỗi ngày | |
| Fondaparinux | 5 mg (cân nặng < 50 kg) | Mỗi ngày |
| 7,5 mg (cân nặng 50 – 100 kg) | ||
| 10 mg (cân nặng > 100 kg) |
2.2.3 Kháng vitamin K đường uống
Thuốc kháng vitamin K đường uống (Vitamin K antagonist – VKA) như warfarin vẫn có vai trò trong điều trị PE, đặc biệt ở những bệnh nhân có suy chức năng thận nặng, hội chứng kháng phospholipid, và eo hẹp về kinh tế để có thể dùng DOACs [7]. Khuyến cáo theo dõi điều trị với VKA bằng chỉ số INR. Mặc dù khi bắt đầu sử dụng, chỉ số INR có thể tăng, những bệnh nhân có thể sẽ có tình trạng tăng đông trong những ngày đầu tiên dùng warfarin do các đặc tính của thuốc: thời gian bán hủy dài, chậm thải trừ yếu tố II và thải trừ nhanh yếu tố kháng đông protein C [35]. Do tình trạng tăng đông ban đầu này, bắc cầu với UFH, LMWH, hoặc fondparinux trong ít nhất 5 ngày cho đến khi INR đạt được ngưỡng điều trị là 2 – 3 [36]. Các thuốc giàu vitamin K như dầu, mỡ, gan, các loại hạt và rau xanh có thể tương tác và làm giảm tác dụng của warfarin. Các bệnh nhân dùng warfarin sẽ được tư vấn về việc ổn định trong chế độ ăn và cần thảo luận với bác sĩ trước khi có bất kỳ thay đổi trong chế độ ăn nào. Bên cạnh đó, warfarin còn tương tác đáng kể với các thuốc có chuyển hóa qua CYP2C9, 2C19, 1A2 và 3A4. Không chỉ bất lợi về việc theo dõi INR, mà sự tương tác thuốc và thức ăn rộng rãi cũng là nhược điểm làm hạn chế sử dụng warfarin trong điều trị lâu dài.
2.2.4 Kháng đông đường uống thể hệ mới
Apixaban là thuốc ức chế trực tiếp yếu tố Xa đường uống được chỉ định trong giảm nguy cơ đột quỵ và phòng ngừa huyết khối tĩnh mạch sâu (DVT) Và điều trị DVT và PE. Các chỉ định mới gần đây của apixaban bao gồm nằm trong liệu pháp kháng huyết khối sau hội chứng vành cấp (ACS) hoặc can thiệp mạch vành qua da (PCI) ở bệnh nhân có rung nhĩ và HIT [7], [36]. Hoạt tính sinh học qua đường uống vào khoảng 50%, với phần lớn sự hấp thu diễn ra tại ruột non [37]. Thải trừ thuốc thông qua chuyển hóa bởi hệ CYP3A4 trong ruột và gan. Một khi đã được hấp thu, thời gian bán hủy sẽ từ 8 – 12 giờ, với trạng thái ổn định đạt được sau 3 ngày [7], [38].
Rivaroxaban là thuốc ức chế yếu tố Xa trực tiếp với hoạt tính sinh học đường uống vào khoảng 80% – 100% cho liều 10mg và 66% cho liều 20mg [39], [40]. Liều >= 15mg cải thiện khả dụng sinh học khi dùng chung bữa ăn [39], [40]. Thời gian bán hủy trong huyết tương của rivaroxaban từ 5 – 9 giờ, với thời gian bán hủy kéo dài đến 11 – 13 giờ ở những bệnh nhân lớn tuổi. Nồng độ đạt trạng thái ổn định thường diễn ra sau 3 ngày. Rivaraxoban thải trừ qua thận khoảng 36% lượng thuốc không chuyển hóa; hiện chưa khuyến cáo dùng thuốc khi CrCl < 30 mL/phút, và CrCl < 15 mL/phút là chống chỉ định. Rivaroxaban không lọc qua màng lọc thận [41]. Rivaroxaban cũng thải trừ theo con đường tương tự apixaban, với chuyển hóa qua hệ CYP3A4 chiếm khoảng 57%.
Dabigatran là thuốc ức chế trực tiếp thrombin (IIa). Liều dùng trong điều trị PE là 150mg đường uống 2 lần mỗi ngày sau khi đã dùng 5 – 10 ngày thuốc kháng đông đường tĩnh mạch ở những bệnh nhân có chức năng thận tương đối tốt (CrCl > 30 mL/phút). Khác với rivaroxaban và apixaban, dabixaban cần bắc cầu với UFH hoặc LMWH trong 5 – 10 ngày [1]. Dabigatran nên được dùng trước liều dự kiến của kháng đông tĩnh mạch từ 0 – 2 giờ, hoặc là tại thời điểm ngưng truyền UFH. Tương tự với các loại kháng đông khác, bất kỳ loại thuốc nào có khả năng làm tăng nguy cơ chảy máu, như kháng kết tập tiểu cầu, kháng đông và tiêu sợi huyết cũng cần nên được cân nhắc là tương tác thuốc quan trọng khi dùng cùng với dabigatran. Các thuốc cảm ứng P-glycoprotein như phenobarbital, rifampin, fosphenytoin làm giảm tác dụng của dabigatran và do đó nên tránh dùng. Ngược lại, các thuốc ức chế P-glycoprotein làm tăng tác dụng của dabigatran; khuyến cáo hiện nay khác nhau tùy theo loại thuốc ức chế P-glycoprotein và chỉ định của dabigatran.
Suy giảm chức năng thận và các thuốc ức chế P-gp là những yếu tố nguy cơ độc lập quan trọng dẫn đến tăng nồng độ dabigatran và từ đó tăng nguy cơ chảy máu. Đánh giá chức năng thận được khuyến cáo trước khi khởi động dùng dabigatran và trước các tình huống có thể làm suy giảm chức năng thận. Cẩn trọng trong sử dụng ở những bệnh nhân lớn tuổi, vì nguy cơ đột quỵ và nguy cơ chảy máu đều tăng theo tuổi, như đã được phân tích trong nghiên cứu RE-LY (Randomized Evaluation of Long Term Anticoagulation Therapy) [42]. Dabigatran có chống chỉ định ở những bệnh nhân có van tim cơ học. Nghiên cứu RE-ALIGN (Randomized, Phase II Study to Evaluate the sAfety and Pharmacokinetics of oral dabigatran Etexilate in Patients after Heart Valve replacement) bị ngừng sớm do các biến cố thuyên tắc huyết khối (huyết khối tại van, đột quỵ, và nhồi máu cơ tim), cũng như biến cố chảy máu nặng được ghi nhận trong nhóm dabigatran so với nhóm warfarin trên dân số bệnh nhân van tim [43].
Bên cạnh các biến cố chảy máu nặng và nhẹ, các tác dụng phụ trên đường tiêu hóa cũng đã được báo cáo trong các nghiên cứu với tần suất từ 24,7% đến 35%. Tác dụng phụ trên đường tiêu hóa có thể bao gồm khó tiêu, viêm dạ dày, đau thượng vị. Do tần suất hay gặp của các tác dụng phụ này, cần thiết tư vấn cho bệnh nhân về chúng và khuyên họ không nên ngưng thuốc đột ngột mà chưa thảo luận với bác sĩ.
Một đặc tính riêng biệt của dabigatran là tăng độ khả dụng sinh học 75% nếu viên thuốc bị bể, nhai, hoặc bị tách vỏ bọc. Việc này đương nhiên dẫn đến các nguy cơ đi kèm, đặc biệt là nguy cơ chảy máu. Cũng vì nguyên nhân này, dabigatran không nên dùng qua bất kỳ loại ống nuôi ăn nào. Thuốc cũng không nên dùng sau 4 tháng kể từ ngày mở hộp vì kém bền với ánh sáng và độ ẩm có thể làm thuốc bị phân hủy và giảm hoạt tính.
Edoxaban, một loại thuốc ức chế yếu tố X trực tiếp đường uống, được chấp thuận sử dụng ở Hoa Kỳ và châu Âu vào năm 2015 cho chỉ định điều trị PE. Chấp thuận này chủ yếu được dựa trên nghiên cứu Hokusai VTE, trong đó thu thập 3319 bệnh nhân PE. Nghiên cứu này cho thấy edoxaban không tốt hơn warfarin nhưng có nguy cơ chảy máu thấp hơn [44]. Edoxaban hiện chỉ được chấp thuận trong phòng ngừa để làm giảm nguy cơ đột quỵ và thuyên tắc hệ thống ở những bệnh nhân rung nhĩ không do van tim và trong điều trị VTE. Khác với apixaban và rivaroxaban, edoxaban không có chỉ định trong phòng ngừa tái phát VTE hoặc trong phòng ngừa của phẫu thuật thay khớp gối và háng [45].
2.3 Thuốc hóa giải tác dụng kháng đông
Biến chứng đang quan ngại nhất của các thuốc kháng đông nói chung là biến chứng chảy máu, đặc biệt là các chảy máu đe dọa tính mạng như chảy máu nội sọ và chảy máu tiêu hóa. Cũng chính vì nguy cơ chảy máu sẽ tăng lên khi dùng thuốc kháng đông dẫn đến thôi thúc phát triển những tác nhân hóa giải tác dụng kháng đông nhanh chóng khi cần thiết. Protamine sulfate là chất hóa giải dùng trong trường hợp chảy máu liên quan với UFH và LMWH. Protamine sulfate được dùng qua đường truyền tĩnh mạch chậm ở liều < 5 mg/phút do lo ngại phản vệ, tụt huyết áp, nhịp chậm và độc tính trên hô hấp khi truyền nhanh. Do thời gian bán hủy của UFH ngắn nên thường đa số trường hợp không cần thiết dùng thuốc hóa giải vì tác dụng của UFH sẽ biến mất do thải trừ nhanh chóng. LMWHs chỉ được hóa giải một phần bởi protamine (60 – 80%), do việc gắn kết chỉ xảy ra ở những phân tử protein heparin trọng lượng phân tử lớn, dài. Do kích thước nhỏ, fondaparinux không bị hóa giải bởi protamine [46].Protamine sẽ tác dụng với tiểu cầu, fibrinogen và các protein huyết thanh khác. Điều này sẽ dẫn đến tác dụng kháng đông của chính bản thân nó, do đó, cần dùng đủ lượng protamine cần thiết để trung hòa sự hiện diện của heparin trong máu.
Bảng 6. Thuốc hóa giải tác dụng kháng đông được khuyến cáo
| Thuốc hóa giải đầu tay | Thuốc hóa giải thay thế | |
| UFH | Protamine sulfate | |
| LMWH | Protamine sulfate | |
| VKA | 4F-PCC | FFP |
| Dabigatran | Idarucizumab | PCC
aPCC |
| Thuốc ức chế yếu tố Xa trực tiếp đường uống | Andexanet alfa | PCC
aPCC |
| Fondaparinux | Yếu tố VIIa | aPCC
Andexanet alfa |
Vitamin K là thuốc hóa giải được khuyến cáo trong trường hợp dùng warfarin mà INR > 10 nhưng không có chảy máu nặng, và lặp lại liều vitamin K mỗi 6 – 24 giờ khi cần [47]. Vitamin K có thể dùng qua đường tĩnh mạch hoặc đường uống, ưu tiên đường uống hơn vì có nguy cơ phản ứng phản vệ trong 3/10000 trường hợp dùng đường tiêm [48]. Không khuyến cáo tiêm dưới da vì hiệu quả chậm và không đoán trước được. Sự ra đời của 4F-PCC (phức hợp prothrombin yếu tố 4) trong thập kỷ qua đã đưa ứng dụng của chế phẩm này phổ biến hơn FFP trong chỉ định hóa giải biến chứng chảy máu liên quan warfarin. Loại chế phẩm này được đặc biệt sử dụng trong trường hợp chảy máu đe dọa tính mạng, vì 4F-PCC có hoạt tính gấp 25 lần FFP trong thay thế các yếu tố đông máu phụ thuộc vitamin K. Hạn chế của FFP khi so sánh với 4F-PCC gồm thời gian khởi phát tác dụng chậm hơn, nguy cơ phản ứng dị ứng và lây nhiễm chéo, phù hợp nhóm máu, thời gian chuẩn bị lâu hơn và thể tích truyền lớn hơn. Một ưu điểm lớn của 4F-PCC là có thể trữ ở nhiệt độ phòng và có thể dùng ngay khi cần [49]. Trong trường hợp chảy máu đe dọa tính mạng, khuyến cáo dùng vitamin K 5 – 10 mg truyền tĩnh mạch chậm.
Dabigatran có một loại thuốc hóa giải chuyên biệt, là idarucizumab (Praxbind). Đây là một loại kháng thể đơn dòng có hoạt tính gắn dabigatran gấp 350 lần so với thrombin [50]. Thuốc lợi tiểu cũng có thể giúp thải trừ dabigatran.
Aldexanet alfa có thể dùng để đảo ngược tác dụng của apixaban, rivaroxaban, và edoxaban (off-label) trong trường hợp chảy máu đe dọa tính mạng hoặc không kiểm soát được. Liều aldexanet alfa được dựa trên lượng ức chế yếu tố Xa cần được đảo ngược, liều và thời điểm của liều dùng kháng đông cuối cùng. Aldexanet alfa 400mg bolus đường TM được sử dụng với tốc độ 30mg/phút, sau đó là truyền liên tục 4 mg/ơhút cho đến 120 phút, để đảo ngược tác dụng của apixaban (=< 5 mg) hoặc rivaroxaban (=< 10 mg), dùng trong vòng 8 giờ hoặc khi thời điểm liều kháng đông cuối là không biết rõ. Với liều rivaroxaban > 10mg hoặc khi không rõ liều cuối dùng trong vòng 8 giờ, hoặc không rõ thời điểm dùng cuối cùng; khuyến cáo dùng liều cao aldexanet alfa. Liều này cũng được chỉ định khi liều apixaban > 5mg, hoặc không rõ liều dùng trong vòng 8 giờ, hoặc không rõ thời điểm cuối cùng. Liều cao là 800mg bolus tĩnh mạch với tốc độ 30 mg/phút, sau đó là truyền liên tục 8 mg/phút cho đến 120 phút.
Khi không có cả idarucizumab hoặc aldexanet alfa, việc dùng phức hợp prothrombin (PCC) hoặc phức hợp prothrombin hoạt hóa (aPCC) được cân nhắc dùng thay thế. Bằng chứng của liệu pháp này còn hạn chế, chủ yếu trên người và động vật trong phòng thí nghiệm. Than hoạt tính có thể có hiệu quả khi DOAC được uống trong vòng 2 – 4 giờ vừa rồi.
- NHỮNG ĐIỂM CẦN LƯU Ý TRONG ĐIỀU TRỊ
3.1 Chọn lựa kháng đông trong điều trị PE cấp
Kháng đông là điều trị nền tảng trong thuyên tắc phổi cấp, và thường được chia làm 3 giai đoạn: khởi đầu từ thời điểm ban đầu đến 7 ngày, giai đoạn dài hạn từ 1 tuần đến 3 tháng, và giai đoạn kéo dài từ 3 tháng đến vô thời hạn [4]. Kháng đông dùng đường tĩnh mạch như heparin trọng lượng phân tử thấp (LMWH), fondaparinux, hoặc heparin không phân đoạn thường được dùng ở những bệnh nhân nội viện khi khởi đầu điều trị. Các bệnh nhân ổn định khi được xuất viện hoặc những bệnh nhân phù hợp để quản lý nội trú ngay từ thời điểm chẩn đoán thuyên tắc phổi đều có thể được điều trị với DOACs. Mỗi loại DOAC đều được chứng minh không thua kém bộ đôi VKA/LMWH trong các nghiên cứu ngẫu nhiên có đối chứng pha III trong phòng ngừa thuyên tắc huyết khối tĩnh mạch tái phát có triệu chứng ở bệnh nhân có thuyên tắc huyết khối tĩnh mạch cấp tính. DOACs cũng được ghi nhận có ít biến cố chảy máu nặng hơn VKA [51]. Hạn chế của các nghiên cứu này là dân số nghiên cứu không đồng nhất và thiếu so sánh trực tiếp giữa các DOAC. Một RCT (randomized controlled trial) so sánh rivaroxaban và apixaban ở những bệnh nhân thuyên tắc huyết khối tĩnh mạch cấp tính đang được tiến hành (NCT03266783), giúp đánh giá sự khác biệt về chảy máu có ý nghĩa lâm sàng ở những loại kháng đông này.
Bảng 7. So sánh các nghiên cứu ngẫu nhiên có nhóm chứng của DOACs
| Đặc điểm nghiên cứu | Dabigatran | Rivaroxaban | Apixaban | Edoxaban |
| Cỡ mẫu | 5132 | 8281 | 5395 | 8292 |
| Kháng đông đơn | Không | Có | Có | Không |
| Thời gian điều trị (tháng) | 6 | 3, 6 hoặc 12 | 6 | 3 – 12 |
| Tiêu chí chính: không thua kém về hiệu quả so VKA | HR 1,09 (0,76 – 1,57) | HR 0,89 (0,66 – 1,19) | RR 0,84 (0,60 – 1,18) | HR 0,89 (0,70 – 1,13) |
| Chảy máu nặng so VKA | HR 0,73 (0,48 – 1,11) | HR 0,54 (0,37 – 0,79) | RR 0,31 (0,17 – 0,55) | HR 0,84 (0,59 – 1,21) |
| Chảy máu nặng hoặc không nặng nhưng ý nghĩa lâm sàng so VKA | HR 0,56 (0,45 – 0,71) | HR 0,93 (0,81 – 1,06) | RR 0,44 (0,36- 0,55) | HR 0,81 (0,71 – 0,94) |
| Khoảng cách liều | 2 lần/ngày | 2 lần/ngày, sau đó 1 lần/ngày | 2 lần/ngày | 1 lần/ngày |
Cho đến thập kỷ trước, VKA là thuốc kháng đông đường uống duy nhất sẵn có để điều trị thuyên tắc huyết khối tĩnh mạch, và được sử dụng cùng lúc với kháng đông đường tĩnh mạch trong ít nhất 5 ngày và đến khi INR 2 lần liên tiếp nằm trong khoảng 2 – 3. Mặc dù tính ứng dụng của VKA đã giảm hẳn với sự xuất hiện của DOACs, thì hiện nay VKA vẫn có vai trò quan trọng trong trường hợp bệnh nhân suy thận nặng, có hội chứng kháng phospholipid hoặc không đủ khả năng kinh tế để dùng DOACs.
3.2 Thrombophilia testing
Tiền sử gia đình có thuyên tắc huyết khối tĩnh mạch là một yếu tố dự báo nguy cơ cao [52], đặc biệt khi thuyên tắc huyết khối tĩnh mạch không có yếu tố kích gợi hoặc bệnh nhân < 50 tuổi [53]. Dù vậy, việc xét nghiệm về tăng đông di truyền (đột biến yếu tố V Leiden, đột biến gen prothrombin, thiếu hụt protein C, thiếu hụt protein S hoặc thiếu antithrombin) qua các nghiên cứu đã cho thấy dù có bệnh lý thì cũng không ảnh hưởng đến điều trị [53]. Hơn nữa, các xét nghiệm về bệnh lý tăng đông cũng không xác định được tất cả các nguyên nhân thuyên tắc huyết khối tĩnh mạch di truyền [54], [55], vì nghiên cứu quan sát cho thấy chỉ có 30% số người có tiền sử gia đình thế hệ thứ 1 bị thuyên tắc có kết quả dương tính [56].
Những bệnh nhân thuyên tắc huyết khối tĩnh mạch trong bối cảnh có yếu tố kích gợi mạnh, như phẫu thuật lớn, thì có nguy cơ tái phát thấp, và nguy cơ này không bị ảnh hưởng đáng kể bởi việc có bệnh lý về tăng máu di truyền hay không [53]. Những bệnh nhân thuyên tắc huyết khối tĩnh mạch mà không có yếu tố kích gợi thì có nguy cơ tái phát cao, nhưng xét nghiệm về bệnh lý tăng máu không được chứng minh là làm thay đổi nguy cơ này để ảnh hưởng đến điều trị về thời gian sử dụng kháng đông [57], [58]. Người thân trong gia đình là người mang đột biến nhưng không triệu chứng sẽ có nguy cơ thuyên tắc huyết khối tĩnh mạch trọn đời tăng lên (đột biến yếu tố V Leiden: 0,58 – 0,67% mỗi năm; thiếu protein C: 1,0 – 2,5% mỗi năm; thiếu protein S: 0,7 – 2,2% mỗi năm; thiếu antithrombin: 4% mỗi năm), nhưng phân nửa số biến cố xảy ra có kèm thêm yếu tố kích gợi [59]. Tiền sử gia đình có bệnh lý thuyên tắc huyết khối là một yếu tố quan trọng, vì những bệnh nhân này dễ khởi phát biến cố thuyên tắc huyết khối tĩnh mạch hơn khi so với những người có bệnh lý tăng đông di truyền nhưng không có tiền sử gia đình có biến cố thuyên tắc huyết khối [56].
Nếu quyết định xét nghiệm tầm soát bệnh lý tăng đông máu, thì xét nghiệm này nên được thực hiện sau khi hoàn thành điều trị đợt VTE cấp tính và tốt nhất là khi đã ngưng dùng kháng đông, vì các kết quả dương tính giả có thể gặp liên quan với warfarin (thiếu protein C, thiếu protein S), heparin (kháng đông lupus), và DOACs (kháng đông lupus) [53]. Chúng tôi đề nghị các xét nghiệm về bệnh lý tăng đông máu không nên được tiến hành khi VTE có liên quan với một yếu tố kích gợi mạnh, vì những bệnh nhân này có nguy cơ VTE tái phát thấp, ngay cả khi trong gia đình có bệnh lý đông máu di truyền [57]. Chúng tôi cũng đề nghị các xét nghiệm bệnh lý đông máu nên được thực hiện trên những bệnh nhân thuyên tắc huyết khối tĩnh mạch có chỉ định dùng kháng đông dài hạn (dựa trên giới hoặc các thang điểm nguy cơ). Ở những bệnh nhân còn lại, tức những người bị VTE không có yếu tố kích gợi và không có chỉ định dùng kháng đông vô thời hạn, chúng tôi đề nghị thảo luận về việc xét nghiệm bệnh lý đông máu di truyền với bệnh nhân. Trong đa số trường hợp, các xét nghiệm sẽ không làm thay đổi quyết định về thời gian sử dụng kháng đông, nhưng có ngoại lệ hiếm gặp bao gồm bệnh lý đông máu di truyền nguy cơ cao như thiếu hụt antithrombin, hoặc bệnh lý tăng đông kết hợp. Vì không có bằng chứng có chất lượng cao, chọn lựa của bệnh nhân nên là quyết định cuối cùng. Tư vấn di truyền nên được khuyến khích ở những bệnh nhân làm xét nghiệm tăng đông di truyền, vì tác động có thể có về mặt tâm lý các kết quả này mang lại cho họ [60].
3.3 PE liên quan với thai kỳ
DOACs và fondaparinux qua được nhau thai và do đó tránh dùng trong thai kỳ. Heparin không phân đoạn và LMWH là các kháng đông an toàn nhất trong thai kỳ vì không qua được nhau thai; trong đó LMWH là trị liệu chính vì chỉ cần dùng 1 lần 1 ngày và có thể tự tim dưới da được. Kháng đông quanh chuyển dạ cần được phối hợp sát sao với một đội đa chuyên khoa gồm sản khoa, gây mê, thuyên tắc và sơ sinh. Một nghiên cứu RCT gần đây gồm 3062 thai kỳ nguy cơ thấp ghi nhận thúc sanh có kế hoạch sẽ an toàn, không làm tăng nguy cơ phải sanh mổ, và có lợi ích nhỏ trên kết cục chính gồm tử vong sơ sinh hoặc biến chứng nhũ nhi nặng (nguy cơ tương đối 0,80, 0,64 – 1,00) [61]. Ở những bệnh nhân có biến cố thuyên tắc huyết khối tĩnh mạch cấp tính khi đang mang thai và trước ngày dự sinh hơn 1 tháng, chúng tôi đề nghị nên thúc sanh chương trình với liều cuối của LMWH tiêm trước đó 24 giờ. Ngừng LMWH 24 giờ trước khi sanh cho phép dùng thuốc gây tê qua tủy sống an toàn (nếu cần) [62]. Khi không có bất kỳ chảy máu sau sanh nào, LMWH sẽ được khởi động lại 6 giờ sau khi sanh và được tiếp tục trong ít nhất 6 tuần sau sanh. Ở những bệnh nhân có thuyên tắc phổi cấp tính trong vòng 1 tháng trước dự sinh, chúng tôi đề nghị thúc sanh chương trình nhưng dùng UFH liều điều trị cho đến khi chuyển dạ để tránh khoảng ngưng điều trị quá lâu. Nếu thuyên tắc phổi xảy ra dưới 2 tuần trước ngày dự sanh, có thể cân nhắc đặt lưới lọc tĩnh mạch chủ dưới [63]. Sau sanh, các lựa chọn kháng đông cho phụ nữ cho con bú bao gồm UFH, LMWH, VKA, fondaparinux, hoặc danaparoid. DOACs hiện diện trong sữa mẹ và do vậy có chống chỉ định nhưng có thể cân nhắc ở phụ nữ không cho con bú hoặc sau khi đã kết thúc cho con bú và có chỉ định điều trị lâu dài. Phòng ngừa thuyên tắc huyết khối tĩnh mạch trước và sau sanh với LMWH được khuyến cáo cho các thai kỳ tiếp theo [30].
Khuyến cáo hiện nay ghi nhận LMWH là thuốc được ưu tiên sử dụng để điều trị VTE trong thai kỳ và thời gian hậu sản. Khi nghi ngờ DVT hoặc PE, LMWH nên được dùng liều điều trị cho đến khi loại trừ chẩn đoán, trừ khi điều trị có chống chỉ định mạnh. Liều điều trị LMWH được tính toán dựa trên trọng lượng cơ thể sản phụ khi đi khám hoặc lần khám gần nhất. Hiện còn thiếu dữ kiện để khuyến cáo liệu nên dùng liều LMWH 1 lần hay 2 lần 1 ngày. Định lượng hoạt tính anti-Xa đỉnh thường quy ở những sản phụ được dùng LMWH để điều trị VTE cấp là không được khuyến cáo, trừ trường hợp trọng lượng cơ thể quá cao hoặc quá thấp (< 50 kg hoặc >= 90 kg) hoặc khi có những yếu tố phức tạp khác (như suy thận hoặc VTE tái phát). Liều khởi đầu của enoxaparin và dalteparin được trình bày như trong Bảng 8 và Bảng 9 [6]. UFH sẽ được dùng trong giai đoạn cấp của PE lớn (massive). Tiêu sợi huyết nên được dùng ở những bệnh nhân tụt huyết áp nặng hoặc sốc. Khi dùng tiêu sợi huyết, nên bỏ qua liều khởi đầu của UFH và bắt đầu bằng truyền liên tục với tốc độ 18 U/kg/giờ. Sau khi bệnh nhân ổn định, UFH có thể được chuyển sang LMWH. Fondaparinux 7,5mg 1 lần/ngày ở phụ nữ có thai cân nặng bình thường có thể được cân nhắc nếu bệnh nhân có dị ứng hoặc tác dụng phụ khi dùng LMWH. Chỉ định của đặt lưới lọc tĩnh mạch chủ dưới là tương tự những bệnh nhân không mang thai; tuy vậy, còn ít kinh nghiệm trong thực hành và do đó, nguy cơ của thủ thuật cũng có thể tăng lên. Hậu sản: heparin nên được khởi động lại từ 6 giờ sau khi sanh ngả âm đạo và 12 giờ sau khi sanh mổ nếu không có chảy máu đáng kể, và dùng đồng thời với VKA trong ít nhất 5 ngày. VKA có thể được khởi động từ ngày thứ 2 sau sanh và tiếp tục ít nhất 3 tháng, hoặc 6 tháng nếu PE xảy ra trễ trong thai kỳ. INR nên được giữ giữa 2 – 3 và cần theo dõi thường xuyên, tối ưu là mỗi 1 – 2 tuần. VKA không vào sữa mẹ ở các dạng hoạt động và do đó an toàn với người cho con bú.
Bảng 8. Liều khởi đầu của enoxaparin
| Trọng lượng cơ thể lúc khám | Liều enoxaparin khởi đầu |
| < 50kg | 40mg/lần x 2 lần/ngày; hoặc 60mg 1 lần/ngày |
| 50 – 69kg | 60mg/lần x 2 lần/ngày; hoặc 90mg 1 lần/ngày |
| 70 – 89kg | 80mg/lần x 2 lần/ngày; hoặc 120mg 1 lần/ngày |
| 90 – 109kg | 100mg/lần x 2 lần/ngày; hoặc 150mg 1 lần/ngày |
| 110 – 125kg | 120mg/lần x 2 lần/ngày; hoặc 180mg 1 lần/ngày |
| > 125kg | Thảo luận với bác sĩ huyết học |
Bảng 9. Liều khởi đầu của dalteparin
| Trọng lượng cơ thế lúc khám | Liều dalteparin khởi đầu |
| < 50kg | 5000 IU/lần x 2 lần/ngày; hoặc 10000 IU 1 lần/ngày |
| 50 – 69kg | 6000 IU/lần x 2 lần/ngày; hoặc 12000 IU 1 lần/ngày |
| 70 – 89kg | 8000 IU/lần x 2 lần/ngày; hoặc 16000 IU 1 lần/ngày |
| 90 – 109kg | 10000 IU/lần x 2 lần/ngày; hoặc 20000 IU 1 lần/ngày |
| 110 – 125kg | 12000 IU/lần x 2 lần/ngày; hoặc 24000 IU 1 lần/ngày |
| > 125kg | Thảo luận với bác sĩ huyết học |
3.4 PE liên quan với ung thư
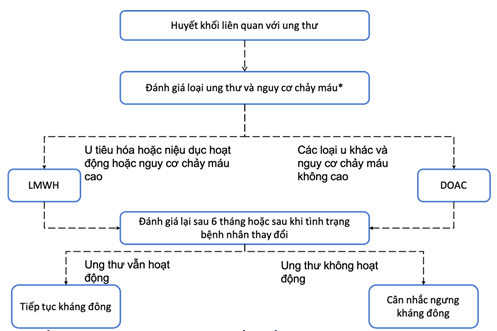
Hình 2. Hướng tiếp cận gợi ý trong quản lý huyết khối liên quan ung thư [112 – 2]. *Cân nhắc các yếu tố nguy cơ chảy máu bao gồm tiền sử chảy máu tiêu hóa trước đây, dùng thuốc độc cho đường tiêu hóa, giảm tiểu cầu (< 50000 tiểu cầu/mL), suy thận, chảy máu gần đây hoặc chảy máu đe dọa tính mạng, sang thương nội sọ, dùng kháng kết tập tiểu càu kèm theo [7]
Những bệnh nhân ung thư sẽ có nguy cơ thuyên tắc huyết khối tĩnh mạch tăng gấp 7 lần, với nguy cơ tuyệt đối là 7% trong năm đầu sau chẩn đoán ung thư và lên đến 20% dựa trên loại ung thư và phương thức điều trị [64]. Thuyên tắc phổi có thể có triệu chứng hoặc phát hiện tình cờ trên hình ảnh học khi đánh giá đáp ứng với điều trị ung thư. Thuyên tắc phổi có triệu chứng hay tình cờ có nguuy cơ tái phát cao tương tự nhau [65]. Các biến chứng chảy máu nặng cũng thường gặp như VTE ở bệnh nhân ung thư [66], [67]. Điều trị bệnh nhân thuyên tắc phổi ở bệnh nhân ung thư được cá thể hóa dựa trên nguy cơ thuyên tắc phổi tái phát và nguy cơ chảy máu. LMWH là trị liệu chính trong VTE liên quan ung thư trong một thời gian dài, dựa trên các kết quả nghiên cứu nền tảng so sánh LMWH và VKA [68]. Gần đây, 4 nghiên cứu RCTs đã so sánh DOACs và LMWH ở những bệnh nhân VTE liên quan ung thư. Nghiên cứu HOKUSAI VTE Cancer thu nhận 1050 bệnh nhân ung thư và VTE, kết quả ghi nhận edoxaban (sau 5 ngày LMWH) không thua kém LMWH trong kết cục chính về thuyên tắc huyết khối tái phát hoặc chảy máu chính trong 12 tháng theo dõi (HR 0,97; 95% CI 0,70 – 1,36; P=0,006 về không thua kém) [44]. Tỉ lệ VTE thấp hơn không đáng kể (khác biệt trong nguy cơ – 3,4 (-7,0 – 0,2) điểm), nhưng tỉ lệ chảy máu nặng cao hơn đáng kể (khác biệt trong nguy cơ 2,0 (0,1 – 5,6) điểm) ở những bệnh nhân được dùng edoxaban. Các biến cố chảy máu chính được quan sát chủ yếu ở phân nhóm bệnh nhân có ung thư đường tiêu hóa trên.
Nghiên cứu RCT thứ hai, SELECT-D, so sánh rivaroxaban và LMWH trong điều trị VTE liên quan ung thư ở 406 bệnh nhân. Tần suất thuyên tắc huyết khối tĩnh mạch tái phát vào thời điểm 6 tháng là 11% (7% – 16%) trong nhánh dalteparin và 4% (2% – 9%) cho rivaroxaban, với ít biến cố VTE tái phát ở những bệnh nhân nhánh rivaroxaban (HR 0,43, 0,19 – 0,99). Kết quả ghi nhận khác biệt về chảy máu nặng không có ý nghĩa thống kê ở nhóm rivaroxaban (HR 1,83, 0,68 – 4,96) và biến cố chảy máu không nặng, có ý nghĩa lâm sàng tăng đáng kể với rivaroxaban (3,76, 1,63 – 8,69) [69]. Thuật toán xác định tính an toàn ghi nhận không có khác biệt có ý nghĩa về chảy máu nặng giữa các nhánh ở những bệnh nhân ung thư thực quản, và loại ung thư này sau này đã được loại ra khỏi nghiên cứu. Không may là do thu nhận bệnh nhân chậm, dẫn đến không thể so sánh chắc chắn tính an toàn và độ hiệu quả giữa rivaroxaban và LMWH.
Hai nghiên cứu RCT so sánh apixaban và LMWH trong điều trị VTE ở bệnh nhân ung thư. Nghiên cứu ADAM VTE thu nhận 300 bệnh nhân ngẫu nhiên vào nhóm apixaban hoặc LMWH để điều trị trong 6 tháng [70]. Thuyên tắc tái phát được ghi nhận trong nhóm LMWH nhiều hơn đáng kể (HR 0,099, 0,013 – 0,780). Không có khác biệt có ý nghĩa thống kê về kết cục an toàn về chảy máu nặng hoặc chảy máu không nặng, có ý nghĩa lâm sàng ở mức 6% trong mỗi nhóm. Nghiên cứu CARAVAGGIO thu nhận 1170 bệnh nhân vào nhóm apixaban hoặc LMWH trong 6 tháng điều trị [51]. Apixaban không thua kém LMWH về kết cục chính gồm thuyên tắc huyết khối tĩnh mạch tái phát trong thời gian nghiên cứu (HR 0,63, 0,37 – 1,07; P<0,001 về không thua kém). Không có khác biệt về chảy máu nặng (HR 0,82, 0,40 – 1,69).
Bảng 10. Các giai đoạn điều trị thuyên tắc phổi liên quan ung thư
| Khởi đầu (0 – 7 ngày)
* LMWH/fondaparinux * Apixaban 10mg x 2 lần/ngày trong 7 ngày * Rivaroxaban 15mg x 2 lần/ngày trong 21 ngày |
| Dài hạn (1 tuần – 6 tháng)
* LMWH * Apixaban 5mg x 2 lần/ngày * Edoxaban 60mg mỗi ngày# * Rivaroxaban 20mg mỗi ngày * VKA mục tiêu INR 2 – 3 |
| Kéo dài (6 tháng – vô hạn)
* LMWH * Apixaban 5mg x 2 lần/ngày * Edoxaban 60mg mỗi ngày# * Rivaroxaban 20mg mỗi ngày * VKA mục tiêu INR 2 – 3 #: 30mg mỗi ngày nếu CrCl 30 – 50 mL/phút hoặc cân nặng < 60 kg |
Tựu trung, những bệnh nhân có thuyên tắc phổi liên quan ung thư mà không có chống chỉ định dùng kháng đông sẽ được đánh giá nguy cơ chảy máu dựa trên tiền sử chảy máu, bệnh đi kèm, và loại ung thư. Tương tác giữa các loại thuốc cũng là một điều cần cân nhắc, đặc biệt trong trường hợp DOACs. Tất cả các DOACs đều là cơ chất của P-glycoprotein; apixaban và rivaroxaban còn là cơ chất của cytochrome P450 (CYP3A4). Xác định tương tác thuốc có ý nghĩa về mặt lâm sàng là một vấn đề phức tạp ở những bệnh nhân ung thư vì các bệnh nhân này thường được dùng nhiều loại thuốc điều trị ung thư khác nhau mà có thể đối đầu nhau trong cùng một con đường chuyển hóa chung. Việc lựa chọn loại kháng đông nên được cân nhắc trong từng tình huống cụ thể và có hội chẩn với dược sĩ để đánh giá tương tác thuốc [66]. VKAs có thể được chọn nếu LMWH hoặc DOACs không có sẵn hoặc có chống chỉ định, như suy thận nặng hoặc có tương tác thuốc. Thời gian điều trị trong VTE cấp tính ở bệnh nhân ung thư thường là 6 tháng, và cân nhắc kéo dài hơn dựa trên tình trạng bệnh và điều trị ung thư của bệnh nhân. Một RCT đang được tiến hành để so sánh apixaban liều thấp và apixaban liều tiêu chuẩn ở bệnh nhân ung thư được điều trị hơn 6 tháng (NCT03692065).
3.5. PE tái phát
Những bệnh nhân có tiền sử DVT hoặc PE sẽ có nguy cơ tái phát biến cố cao hơn [71]. Thuốc kháng đông giúp làm giảm tần suất tái phát VTE khoảng 80 – 85% [72]. Tuy vậy, những bệnh nhân nhập viện vì triệu chứng của VTE tái phát sẽ là một thách thức cho các bác sĩ lâm sàng khi phân biệt với các triệu chứng liên quan biến chứng mạn tính của VTE, như hội chứng sau thuyên tắc và hội chứng sau PE. Vì tiền sử VTE là một biến số trong một số thang điểm khả dĩ lâm sàng nên những bệnh nhân này thường được phân loại là nguy cơ cao, cần được thực hiện các cận lâm sàng về hình ảnh tiếp theo. Hơn nữa, nồng độ D-dimer thường vẫn tăng ở nhiều bệnh nhân sau jkhi hàon thiện liệu trình điều trị VTE chuẩn, từ đó gây giới hạn tính hữu dụng của nó trong loại trừ các biến cố tái phát [73].
Vì các hình ảnh khuyết thuốc thường tồn tại trên CTPA và phin xạ hình-tưới máu phổi từ 6 đến 12 tháng sau khi được chẩn đoán nên phân tích hình ảnh học chẩn đoán trong nghi ngờ biến cố tái phát cần thiết phải được so sánh với các hình ảnh đã có trước đó để tránh chẩn đoán quá mức. Tần suất hồi phục hoàn toàn so với hình ban đầu thay đổi từ 50 – 84% [74]. Phân biệt thuyên tắc phổi cấp với các huyết khối tồn lưu là một thách thức, và đồng thuận giữa các nhà hình ảnh học cũng chưa có được tiếng nói chung. Các đặc điểm của huyết khối như mật độ, calci hóa, hoặc khuyết thuốc đồng tâm cũng là một số gợi ý, nhưng đều chưa được xác thực qua các nghiên cứu [73]. Do đó, việc áp dụng nhiều công cụ giúp hỗ trợ chẩn đoán, đồng thời hội chẩn với các bác sĩ chẩn đoán hình ảnh có kinh nghiệm, xem xét các hình ảnh ghi nhận trước đó và tối ưu là chụp lại sau 6 – 12 tháng chẩn đoán PE sẽ giúp đánh giá bệnh nhân chính xác hơn khi nghi ngờ biến cố tái phát, và cũng là cách tiếp cận an toàn và hợp lý [75].
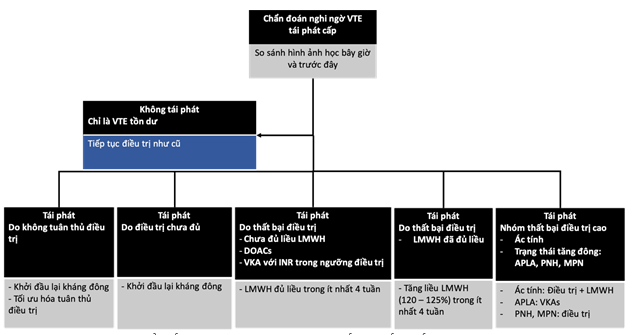
Hình 3. Lưu đồ tiếp cận trường hợp thuyên tắc huyết khối tĩnh mạch tái phát [76]
- KẾT LUẬN
Thuyên tắc phổi là một bệnh lý ngày càng phổ biến, đặc biệt là ở người lớn tuổi, với những yếu tố nguy cơ đã được xác định, trong đó có béo phì, bất động, ung thư. Việc xác định chẩn đoán sớm và lên kế hoạch điều trị ngắn hạn và dài hạn mang đến lợi ích tức thời và phòng ngừa được những biến cố nghiêm trọng cho người bệnh. Tuy vậy, thời gian dùng kháng đông và loại kháng đông được sử dụng sẽ có tác động đến nguy cơ chảy máu của người bệnh. Cân nhắc nguy cơ thuyên tắc huyết khối và nguy cơ chảy máu trên từng trường hợp để có quyết định chính xác, mang lại lợi ích cân bằng hợp lý cho người bệnh là điều mỗi bác sĩ cần ghi nhớ.
TÀI LIỆU THAM KHẢO
- Essien EO, Rali P, Mathai SC. Pulmonary Embolism. Med Clin North Am. 2019;103(3):549-64. Epub 2019/04/09. doi: 10.1016/j.mcna.2018.12.013. PubMed PMID: 30955521.
- Girard P, Decousus M, Laporte S, Buchmuller A, Hervé P, Lamer C, et al. Diagnosis of pulmonary embolism in patients with proximal deep vein thrombosis: specificity of symptoms and perfusion defects at baseline and during anticoagulant therapy. Am J Respir Crit Care Med. 2001;164(6):1033-7. Epub 2001/10/06. doi: 10.1164/ajrccm.164.6.2101045. PubMed PMID: 11587992.
- Di Nisio M, van Es N, Büller HR. Deep vein thrombosis and pulmonary embolism. Lancet. 2016;388(10063):3060-73. Epub 2016/07/05. doi: 10.1016/s0140-6736(16)30514-1. PubMed PMID: 27375038.
- Kearon C, Akl EA, Ornelas J, Blaivas A, Jimenez D, Bounameaux H, et al. Antithrombotic Therapy for VTE Disease: CHEST Guideline and Expert Panel Report. Chest. 2016;149(2):315-52. Epub 2016/02/13. doi: 10.1016/j.chest.2015.11.026. PubMed PMID: 26867832.
- Kahn SR, Lim W, Dunn AS, Cushman M, Dentali F, Akl EA, et al. Prevention of VTE in nonsurgical patients: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012;141(2 Suppl):e195S-e226S. Epub 2012/02/15. doi: 10.1378/chest.11-2296. PubMed PMID: 22315261; PubMed Central PMCID: PMCPMC3278052.
- Konstantinides SV, Meyer G, Becattini C, Bueno H, Geersing GJ, Harjola VP, et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020;41(4):543-603. Epub 2019/09/11. doi: 10.1093/eurheartj/ehz405. PubMed PMID: 31504429.
- Duffett L, Castellucci LA, Forgie MA. Pulmonary embolism: update on management and controversies. BMJ. 2020;370:m2177. doi: 10.1136/bmj.m2177.
- Hao Q, Dong BR, Yue J, Wu T, Liu GJ. Thrombolytic therapy for pulmonary embolism. Cochrane Database Syst Rev. 2015(9):Cd004437. Epub 2015/10/01. doi: 10.1002/14651858.CD004437.pub4. PubMed PMID: 26419832.
- Meneveau N, Séronde MF, Blonde MC, Legalery P, Didier-Petit K, Briand F, et al. Management of unsuccessful thrombolysis in acute massive pulmonary embolism. Chest. 2006;129(4):1043-50. Epub 2006/04/13. doi: 10.1378/chest.129.4.1043. PubMed PMID: 16608956.
- Konstantinides S, Tiede N, Geibel A, Olschewski M, Just H, Kasper W. Comparison of alteplase versus heparin for resolution of major pulmonary embolism. Am J Cardiol. 1998;82(8):966-70. Epub 1998/10/30. doi: 10.1016/s0002-9149(98)00513-x. PubMed PMID: 9794353.
- White RH. The epidemiology of venous thromboembolism. Circulation. 2003;107(23 Suppl 1):I4-8. Epub 2003/06/20. doi: 10.1161/01.Cir.0000078468.11849.66. PubMed PMID: 12814979.
- Meyer G, Vicaut E, Danays T, Agnelli G, Becattini C, Beyer-Westendorf J, et al. Fibrinolysis for patients with intermediate-risk pulmonary embolism. N Engl J Med. 2014;370(15):1402-11. Epub 2014/04/11. doi: 10.1056/NEJMoa1302097. PubMed PMID: 24716681.
- Martin Saborido C, Jimenez D, Muriel A, Zamora J, Morillo R, Barrios DD, et al. Efficacy And Safety Outcomes of Recanalization Procedures In Patients with Acute Symptomatic Pulmonary Embolism: Systematic Review And Network Meta-Analysis. Value in Health. 2017;20(9):A604-A5. doi: 10.1016/j.jval.2017.08.1169.
- Ortel TL, Neumann I, Ageno W, Beyth R, Clark NP, Cuker A, et al. American Society of Hematology 2020 guidelines for management of venous thromboembolism: treatment of deep vein thrombosis and pulmonary embolism. Blood Adv. 2020;4(19):4693-738. Epub 2020/10/03. doi: 10.1182/bloodadvances.2020001830. PubMed PMID: 33007077; PubMed Central PMCID: PMCPMC7556153 the systematic review team, or both. They completed disclosure-of interest-forms, which were reviewed by ASH and are available as Supplements 2 and 3. The following disclosure was added after the finalization of the guideline panel’s disclosure of interest forms: In January 2020, M.R.J. became part-time chief medical officer for Boston Scientific, for which he receives salary and equity. Embolitech was sold to Surmodics, for which M.R.J. received equity.
- Brandt K, McGinn K, Quedado J. Low-Dose Systemic Alteplase (tPA) for the Treatment of Pulmonary Embolism. Ann Pharmacother. 2015;49(7):818-24. Epub 2015/04/11. doi: 10.1177/1060028015579988. PubMed PMID: 25857308.
- St Pierre BP, Edwin SB. Assessment of Anticoagulation in Patients Receiving Ultrasound-Assisted Catheter-Directed Thrombolysis for Treatment of Pulmonary Embolism. Ann Pharmacother. 2019;53(5):453-7. Epub 2018/11/01. doi: 10.1177/1060028018811155. PubMed PMID: 30378437.
- Kearon C, Akl EA, Comerota AJ, Prandoni P, Bounameaux H, Goldhaber SZ, et al. Antithrombotic therapy for VTE disease: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012;141(2 Suppl):e419S-e96S. Epub 2012/02/15. doi: 10.1378/chest.11-2301. PubMed PMID: 22315268; PubMed Central PMCID: PMCPMC3278049.
- Kline JA, Hernandez-Nino J, Jones AE. Tenecteplase to treat pulmonary embolism in the emergency department. J Thromb Thrombolysis. 2007;23(2):101-5. Epub 2007/01/16. doi: 10.1007/s11239-006-9018-3. PubMed PMID: 17221330.
- Rali PM, Criner GJ. Submassive Pulmonary Embolism. Am J Respir Crit Care Med. 2018;198(5):588-98. Epub 2018/04/20. doi: 10.1164/rccm.201711-2302CI. PubMed PMID: 29672125.
- Chatterjee S, Chakraborty A, Weinberg I, Kadakia M, Wilensky RL, Sardar P, et al. Thrombolysis for pulmonary embolism and risk of all-cause mortality, major bleeding, and intracranial hemorrhage: a meta-analysis. Jama. 2014;311(23):2414-21. Epub 2014/06/19. doi: 10.1001/jama.2014.5990. PubMed PMID: 24938564.
- Kuo WT, Banerjee A, Kim PS, DeMarco FJ, Jr., Levy JR, Facchini FR, et al. Pulmonary Embolism Response to Fragmentation, Embolectomy, and Catheter Thrombolysis (PERFECT): Initial Results From a Prospective Multicenter Registry. Chest. 2015;148(3):667-73. Epub 2015/04/10. doi: 10.1378/chest.15-0119. PubMed PMID: 25856269.
- Kline JA, Nordenholz KE, Courtney DM, Kabrhel C, Jones AE, Rondina MT, et al. Treatment of submassive pulmonary embolism with tenecteplase or placebo: cardiopulmonary outcomes at 3 months: multicenter double-blind, placebo-controlled randomized trial. J Thromb Haemost. 2014;12(4):459-68. Epub 2014/02/04. doi: 10.1111/jth.12521. PubMed PMID: 24484241.
- Ahrens I. Pulmonary embolism: future perspectives and ongoing trials. European Heart Journal Acute Cardiovascular Care. 2021;10(3):241-2. doi: 10.1093/ehjacc/zuab019.
- Wang C, Zhai Z, Yang Y, Wu Q, Cheng Z, Liang L, et al. Efficacy and safety of low dose recombinant tissue-type plasminogen activator for the treatment of acute pulmonary thromboembolism: a randomized, multicenter, controlled trial. Chest. 2010;137(2):254-62. Epub 2009/09/11. doi: 10.1378/chest.09-0765. PubMed PMID: 19741062; PubMed Central PMCID: PMCPMC7126994.
- Zhang Z, Zhai ZG, Liang LR, Liu FF, Yang YH, Wang C. Lower dosage of recombinant tissue-type plasminogen activator (rt-PA) in the treatment of acute pulmonary embolism: a systematic review and meta-analysis. Thromb Res. 2014;133(3):357-63. Epub 2014/01/15. doi: 10.1016/j.thromres.2013.12.026. PubMed PMID: 24412030.
- Sharifi M, Bay C, Skrocki L, Rahimi F, Mehdipour M. Moderate pulmonary embolism treated with thrombolysis (from the “MOPETT” Trial). Am J Cardiol. 2013;111(2):273-7. Epub 2012/10/30. doi: 10.1016/j.amjcard.2012.09.027. PubMed PMID: 23102885.
- Jimenez D, Martin-Saborido C, Muriel A, Zamora J, Morillo R, Barrios D, et al. Efficacy and safety outcomes of recanalisation procedures in patients with acute symptomatic pulmonary embolism: systematic review and network meta-analysis. Thorax. 2018;73(5):464-71. Epub 2017/11/15. doi: 10.1136/thoraxjnl-2017-210040. PubMed PMID: 29133351.
- Yilmazel Ucar E, Araz O, Kerget B, Yilmaz N, Akgun M, Saglam L. Comparison of long-term outcomes of 50 and 100 mg rt-PA in the management of acute pulmonary thromboembolism. The Clinical Respiratory Journal. 2018;12(4):1628-34. doi: https://doi.org/10.1111/crj.12721.
- Salter BS, Weiner MM, Trinh MA, Heller J, Evans AS, Adams DH, et al. Heparin-Induced Thrombocytopenia: A Comprehensive Clinical Review. J Am Coll Cardiol. 2016;67(21):2519-32. Epub 2016/05/28. doi: 10.1016/j.jacc.2016.02.073. PubMed PMID: 27230048.
- Cuker A, Arepally GM, Chong BH, Cines DB, Greinacher A, Gruel Y, et al. American Society of Hematology 2018 guidelines for management of venous thromboembolism: heparin-induced thrombocytopenia. Blood Adv. 2018;2(22):3360-92. Epub 2018/11/30. doi: 10.1182/bloodadvances.2018024489. PubMed PMID: 30482768; PubMed Central PMCID: PMCPMC6258919 members of the systematic review team or both. They completed disclosure-of-interest forms, which were reviewed by ASH and are available as supplements 2 and 3.
- Mahan CE, Spyropoulos AC. ASHP therapeutic position statement on the role of pharmacotherapy in preventing venous thromboembolism in hospitalized patients. Am J Health Syst Pharm. 2012;69(24):2174-90. Epub 2013/01/08. doi: 10.2146/ajhp120236. PubMed PMID: 23289165.
- Linkins LA, Dans AL, Moores LK, Bona R, Davidson BL, Schulman S, et al. Treatment and prevention of heparin-induced thrombocytopenia: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012;141(2 Suppl):e495S-e530S. Epub 2012/02/15. doi: 10.1378/chest.11-2303. PubMed PMID: 22315270; PubMed Central PMCID: PMCPMC3278058.
- Hirsh J, Warkentin TE, Shaughnessy SG, Anand SS, Halperin JL, Raschke R, et al. Heparin and low-molecular-weight heparin: mechanisms of action, pharmacokinetics, dosing, monitoring, efficacy, and safety. Chest. 2001;119(1 Suppl):64s-94s. Epub 2001/02/07. doi: 10.1378/chest.119.1_suppl.64s. PubMed PMID: 11157643.
- Hirsh J, Lee AY. How we diagnose and treat deep vein thrombosis. Blood. 2002;99(9):3102-10. Epub 2002/04/20. doi: 10.1182/blood.v99.9.3102. PubMed PMID: 11964271.
- Sallah S, Thomas DP, Roberts HR. Warfarin and heparin-induced skin necrosis and the purple toe syndrome: infrequent complications of anticoagulant treatment. Thromb Haemost. 1997;78(2):785-90. Epub 1997/08/01. PubMed PMID: 9268171.
- Guyatt GH, Akl EA, Crowther M, Gutterman DD, Schuünemann HJ. Executive summary: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012;141(2 Suppl):7s-47s. Epub 2012/03/15. doi: 10.1378/chest.1412S3. PubMed PMID: 22315257; PubMed Central PMCID: PMCPMC3278060.
- Wang L, Zhang D, Raghavan N, Yao M, Ma L, Frost CE, et al. In vitro assessment of metabolic drug-drug interaction potential of apixaban through cytochrome P450 phenotyping, inhibition, and induction studies. Drug Metab Dispos. 2010;38(3):448-58. Epub 2009/11/27. doi: 10.1124/dmd.109.029694. PubMed PMID: 19940026.
- Barlow A, Barlow B, Reinaker T, Harris J. Potential Role of Direct Oral Anticoagulants in the Management of Heparin-induced Thrombocytopenia. Pharmacotherapy. 2019;39(8):837-53. Epub 2019/06/25. doi: 10.1002/phar.2298. PubMed PMID: 31233222.
- Liu Y, Xu S. Post-conditioning the human heart: technical concerns beyond the protocol algorithm. J Am Coll Cardiol. 2013;62(13):1216-7. Epub 2013/07/31. doi: 10.1016/j.jacc.2013.05.083. PubMed PMID: 23892255.
- Vazquez SR. Drug-drug interactions in an era of multiple anticoagulants: a focus on clinically relevant drug interactions. Hematology Am Soc Hematol Educ Program. 2018;2018(1):339-47. Epub 2018/12/07. doi: 10.1182/asheducation-2018.1.339. PubMed PMID: 30504330; PubMed Central PMCID: PMCPMC6246002 Anticoagulation Forum.
- Kim IS, Kim HJ, Yu HT, Kim TH, Uhm JS, Kim JY, et al. Non-vitamin K antagonist oral anticoagulants with amiodarone, P-glycoprotein inhibitors, or polypharmacy in patients with atrial fibrillation: Systematic review and meta-analysis. J Cardiol. 2019;73(6):515-21. Epub 2019/02/17. doi: 10.1016/j.jjcc.2018.12.018. PubMed PMID: 30770140.
- American Geriatrics Society 2019 Updated AGS Beers Criteria® for Potentially Inappropriate Medication Use in Older Adults. J Am Geriatr Soc. 2019;67(4):674-94. Epub 2019/01/30. doi: 10.1111/jgs.15767. PubMed PMID: 30693946.
- Eikelboom JW, Connolly SJ, Brueckmann M, Granger CB, Kappetein AP, Mack MJ, et al. Dabigatran versus warfarin in patients with mechanical heart valves. N Engl J Med. 2013;369(13):1206-14. Epub 2013/09/03. doi: 10.1056/NEJMoa1300615. PubMed PMID: 23991661.
- Raskob GE, van Es N, Verhamme P, Carrier M, Di Nisio M, Garcia D, et al. Edoxaban for the Treatment of Cancer-Associated Venous Thromboembolism. N Engl J Med. 2018;378(7):615-24. Epub 2017/12/13. doi: 10.1056/NEJMoa1711948. PubMed PMID: 29231094.
- Stacy ZA, Call WB, Hartmann AP, Peters GL, Richter SK. Edoxaban: A Comprehensive Review of the Pharmacology and Clinical Data for the Management of Atrial Fibrillation and Venous Thromboembolism. Cardiol Ther. 2016;5(1):1-18. Epub 2016/03/05. doi: 10.1007/s40119-016-0058-2. PubMed PMID: 26935434; PubMed Central PMCID: PMCPMC4906085.
- Smythe MA, Priziola J, Dobesh PP, Wirth D, Cuker A, Wittkowsky AK. Guidance for the practical management of the heparin anticoagulants in the treatment of venous thromboembolism. Journal of Thrombosis and Thrombolysis. 2016;41(1):165-86. doi: 10.1007/s11239-015-1315-2.
- Ansell J, Hirsh J, Hylek E, Jacobson A, Crowther M, Palareti G. Pharmacology and management of the vitamin K antagonists: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest. 2008;133(6 Suppl):160s-98s. Epub 2008/07/24. doi: 10.1378/chest.08-0670. PubMed PMID: 18574265.
- Ageno W, Gallus AS, Wittkowsky A, Crowther M, Hylek EM, Palareti G. Oral anticoagulant therapy: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012;141(2 Suppl):e44S-e88S. Epub 2012/02/15. doi: 10.1378/chest.11-2292. PubMed PMID: 22315269; PubMed Central PMCID: PMCPMC3278051.
- Tomaselli GF, Mahaffey KW, Cuker A, Dobesh PP, Doherty JU, Eikelboom JW, et al. 2020 ACC Expert Consensus Decision Pathway on Management of Bleeding in Patients on Oral Anticoagulants: A Report of the American College of Cardiology Solution Set Oversight Committee. J Am Coll Cardiol. 2020;76(5):594-622. Epub 2020/07/19. doi: 10.1016/j.jacc.2020.04.053. PubMed PMID: 32680646.
- Kim JS, Lee HJ, Sung JD, Kim H-J, Lee S-Y, Kim JS. Monitoring of Unfractionated Heparin Using Activated Partial Thromboplastin Time: An Assessment of the Current Nomogram and Analysis According to Age. Clinical and Applied Thrombosis/Hemostasis. 2013;20(7):723-8. doi: 10.1177/1076029613485153.
- Agnelli G, Becattini C, Meyer G, Muñoz A, Huisman MV, Connors JM, et al. Apixaban for the Treatment of Venous Thromboembolism Associated with Cancer. N Engl J Med. 2020;382(17):1599-607. Epub 2020/03/31. doi: 10.1056/NEJMoa1915103. PubMed PMID: 32223112.
- Sørensen HT, Riis AH, Diaz LJ, Andersen EW, Baron JA, Andersen PK. Familial risk of venous thromboembolism: a nationwide cohort study. J Thromb Haemost. 2011;9(2):320-4. Epub 2010/11/03. doi: 10.1111/j.1538-7836.2010.04129.x. PubMed PMID: 21040446.
- Connors JM. Thrombophilia Testing and Venous Thrombosis. N Engl J Med. 2017;377(12):1177-87. Epub 2017/09/21. doi: 10.1056/NEJMra1700365. PubMed PMID: 28930509.
- Couturaud F, Leroyer C, Julian JA, Kahn SR, Ginsberg JS, Wells PS, et al. Factors that predict risk of thrombosis in relatives of patients with unprovoked venous thromboembolism. Chest. 2009;136(6):1537-45. Epub 2009/07/14. doi: 10.1378/chest.09-0757. PubMed PMID: 19592474.
- Couturaud F, Leroyer C, Tromeur C, Julian JA, Kahn SR, Ginsberg JS, et al. Factors that predict thrombosis in relatives of patients with venous thromboembolism. Blood. 2014;124(13):2124-30. Epub 2014/07/23. doi: 10.1182/blood-2014-03-559757. PubMed PMID: 25049279; PubMed Central PMCID: PMCPMC4186541.
- Bezemer ID, van der Meer FJ, Eikenboom JC, Rosendaal FR, Doggen CJ. The value of family history as a risk indicator for venous thrombosis. Arch Intern Med. 2009;169(6):610-5. Epub 2009/03/25. doi: 10.1001/archinternmed.2008.589. PubMed PMID: 19307525.
- Coppens M, Reijnders JH, Middeldorp S, Doggen CJ, Rosendaal FR. Testing for inherited thrombophilia does not reduce the recurrence of venous thrombosis. J Thromb Haemost. 2008;6(9):1474-7. Epub 2008/06/11. doi: 10.1111/j.1538-7836.2008.03055.x. PubMed PMID: 18540999.
- Baglin T, Gray E, Greaves M, Hunt BJ, Keeling D, Machin S, et al. Clinical guidelines for testing for heritable thrombophilia. Br J Haematol. 2010;149(2):209-20. Epub 2010/02/05. doi: 10.1111/j.1365-2141.2009.08022.x. PubMed PMID: 20128794.
- Langlois NJ, Wells PS. Risk of venous thromboembolism in relatives of symptomatic probands with thrombophilia: a systematic review. Thromb Haemost. 2003;90(1):17-26. Epub 2003/07/24. PubMed PMID: 12876621.
- Etchegary H, Wilson B, Brehaut J, Lott A, Langlois N, Wells PS. Psychosocial aspects of venous thromboembolic disease: an exploratory study. Thromb Res. 2008;122(4):491-500. Epub 2008/02/01. doi: 10.1016/j.thromres.2007.12.001. PubMed PMID: 18234291.
- Grobman WA, Rice MM, Reddy UM, Tita ATN, Silver RM, Mallett G, et al. Labor Induction versus Expectant Management in Low-Risk Nulliparous Women. N Engl J Med. 2018;379(6):513-23. Epub 2018/08/09. doi: 10.1056/NEJMoa1800566. PubMed PMID: 30089070; PubMed Central PMCID: PMCPMC6186292.
- Gogarten W, Vandermeulen E, Van Aken H, Kozek S, Llau JV, Samama CM. Regional anaesthesia and antithrombotic agents: recommendations of the European Society of Anaesthesiology. Eur J Anaesthesiol. 2010;27(12):999-1015. Epub 2010/10/05. doi: 10.1097/EJA.0b013e32833f6f6f. PubMed PMID: 20890208.
- Duffett L, Carrier M. Inferior vena cava filters. J Thromb Haemost. 2017;15(1):3-12. Epub 2016/12/27. doi: 10.1111/jth.13564. PubMed PMID: 28019712.
- Timp JF, Braekkan SK, Versteeg HH, Cannegieter SC. Epidemiology of cancer-associated venous thrombosis. Blood. 2013;122(10):1712-23. Epub 2013/08/03. doi: 10.1182/blood-2013-04-460121. PubMed PMID: 23908465.
- Kraaijpoel N, Bleker SM, Meyer G, Mahé I, Muñoz A, Bertoletti L, et al. Treatment and Long-Term Clinical Outcomes of Incidental Pulmonary Embolism in Patients With Cancer: An International Prospective Cohort Study. J Clin Oncol. 2019;37(20):1713-20. Epub 2019/05/23. doi: 10.1200/jco.18.01977. PubMed PMID: 31116676.
- Carrier M, Blais N, Crowther M, Kavan P, Le Gal G, Moodley O, et al. Treatment algorithm in cancer-associated thrombosis: Canadian expert consensus. Curr Oncol. 2018;25(5):329-37. Epub 2018/11/23. doi: 10.3747/co.25.4266. PubMed PMID: 30464682; PubMed Central PMCID: PMCPMC6209545.
- Sørensen HT, Mellemkjaer L, Olsen JH, Baron JA. Prognosis of cancers associated with venous thromboembolism. N Engl J Med. 2000;343(25):1846-50. Epub 2000/12/16. doi: 10.1056/nejm200012213432504. PubMed PMID: 11117976.
- Lyman GH, Bohlke K, Khorana AA, Kuderer NM, Lee AY, Arcelus JI, et al. Venous thromboembolism prophylaxis and treatment in patients with cancer: american society of clinical oncology clinical practice guideline update 2014. J Clin Oncol. 2015;33(6):654-6. Epub 2015/01/22. doi: 10.1200/jco.2014.59.7351. PubMed PMID: 25605844; PubMed Central PMCID: PMCPMC4881372 online at www.jco.org. Author contributions are found at the end of this article.
- Young AM, Marshall A, Thirlwall J, Chapman O, Lokare A, Hill C, et al. Comparison of an Oral Factor Xa Inhibitor With Low Molecular Weight Heparin in Patients With Cancer With Venous Thromboembolism: Results of a Randomized Trial (SELECT-D). J Clin Oncol. 2018;36(20):2017-23. Epub 2018/05/11. doi: 10.1200/jco.2018.78.8034. PubMed PMID: 29746227.
- McBane RD, 2nd, Wysokinski WE, Le-Rademacher JG, Zemla T, Ashrani A, Tafur A, et al. Apixaban and dalteparin in active malignancy-associated venous thromboembolism: The ADAM VTE trial. J Thromb Haemost. 2020;18(2):411-21. Epub 2019/10/21. doi: 10.1111/jth.14662. PubMed PMID: 31630479.
- Kearon C. Natural history of venous thromboembolism. Circulation. 2003;107(23 Suppl 1):I22-30. Epub 2003/06/20. doi: 10.1161/01.Cir.0000078464.82671.78. PubMed PMID: 12814982.
- Rodger MA, Le Gal G, Anderson DR, Schmidt J, Pernod G, Kahn SR, et al. Validating the HERDOO2 rule to guide treatment duration for women with unprovoked venous thrombosis: multinational prospective cohort management study. Bmj. 2017;356:j1065. Epub 2017/03/21. doi: 10.1136/bmj.j1065. PubMed PMID: 28314711; PubMed Central PMCID: PMCPMC6287588 www.icmje.org/coi_disclosure.pdf and declare: the study was partially funded by bioMérieux the manufacturer of the Vidas D-Dimer (used in the current study); no financial relationships with any organisations that might have an interest in the submitted work in the previous three years; no other relationships or activities that could appear to have influenced the submitted work. All authors fulfilled the conditions required for authorship and the final manuscript has been seen and approved by all authors (see authorship appendix for detailed contributions).
- Ageno W, Squizzato A, Wells PS, Büller HR, Johnson G. The diagnosis of symptomatic recurrent pulmonary embolism and deep vein thrombosis: guidance from the SSC of the ISTH. J Thromb Haemost. 2013;11(8):1597-602. Epub 2013/05/21. doi: 10.1111/jth.12301. PubMed PMID: 23682905.
- Nijkeuter M, Hovens MM, Davidson BL, Huisman MV. Resolution of thromboemboli in patients with acute pulmonary embolism: a systematic review. Chest. 2006;129(1):192-7. Epub 2006/01/21. doi: 10.1378/chest.129.1.192. PubMed PMID: 16424432.
- Le Gal G, Kovacs MJ, Carrier M, Do K, Kahn SR, Wells PS, et al. Validation of a diagnostic approach to exclude recurrent venous thromboembolism. J Thromb Haemost. 2009;7(5):752-9. Epub 2009/02/21. doi: 10.1111/j.1538-7836.2009.03324.x. PubMed PMID: 19228281.
- Rodger MA, Miranda S, Delluc A, Carrier M. Management of suspected and confirmed recurrent venous thrombosis while on anticoagulant therapy. What next? Thromb Res. 2019;180:105-9. Epub 2019/07/07. doi: 10.1016/j.thromres.2019.06.017. PubMed PMID: 31279158.







