Bệnh động mạch ngoại biên (BĐMNB) là một biểu hiện của xơ vữa động mạch hệ thống và cũng là một phần trong chuỗi tiến trình liên tục bệnh lý tim mạch.
Berger JS, Katona BG, Jones WS, Patel MR, Norgren L, Baumgartner I, Blomster J, Mahaffey KW, Held P, illegård M,
Heizer G, Reist C, Fowkes FG, Hiatt WR.
Design and rationale for the Effects of Ticagrelor and Clopidogrel in Patients
with Peripheral Artery Disease (EUCLID) trial. Am Heart J. 2016 May; 175:86-93.
Lược dịch: ThS. BS. Nguyễn Hoàng Hải
Tần suất lưu hành BĐMNB tăng gần 25% từ năm 2000 cho đến năm 2010 và được ước đoán ảnh hưởng > 200 triệu người trên toàn thế giới [1]. Bệnh nhân BĐMNB có tăng mức độ hoạt động tiểu cầu và tăng đáng kể nguy cơ biến cố tim mạch qua trung gian tiểu cầu, như nhồi máu cơ tim (NMCT), đột quị thiếu máu não, và tử vong do tim mạch [2]. Các biểu hiện lâm sàng liên quan đến BĐMNB chi dưới bao gồm suy giảm chức năng và chất lượng cuộc sống, kể cả mất chi ở những bệnh nhân BĐMNB nặng.
Các khuyến cáo điều trị hiện nay khuyên dùng kháng kết tập tiểu cầu để làm giảm nguy cơ NMCT, đột quị, và tử vong do mạch máu trên bệnh nhân BĐMNB [3-5]; cụ thể, đơn trị liệu với aspirin 75-325mg hay clopidogrel 75mg mỗi ngày là trị liệu kháng kết tập tiểu cầu an toàn và hiệu quả. Tuy nhiên, một nghiên cứu gộp bao gồm 18 thử nghiệm ngẫu nhiên, tiến cứu so sánh aspirin với giả dược hay nhóm chứng trên 5,269 bệnh nhân BĐMNB đã chứng minh rằng điều trị bằng aspirin không làm giảm có ý nghĩa thống kê các biến cố tim mạch [6]. Những nghiên cứu gần đây về aspirin trên bệnh nhân BĐMNB không triệu chứng hay BĐMNB có đái tháo đường cũng không chứng minh được lợi ích của aspirin [5,7-9].
Clopidogrel trong BĐMNB
Clopidogrel, một thuốc đối kháng thụ thể P2Y12 không hồi phục, với liều 75mg mỗi ngày được khuyến cáo là trị liệu kháng kết tập tiểu cầu thay thế cho aspirin trên bệnh nhân có BĐMNB. Nghiên cứu so sánh Clopidogrel với Aspirin trên bệnh nhân có nguy cơ các biến cố thiếu máu cục bộ (Clopidogrel versus Aspirin in Patients at Risk of Ischemic Events), đã chứng minh lợi ích có ý nghĩa nhưng ở mức độ vừa phải của clopidogrel so với aspirin trên những bệnh nhân mới bị NMCT, đột quị, hay BĐMNB có triệu chứng trong suốt thời gian nghiên cứu 36 tháng [10]. Lợi ích được thể hiện là giảm 24% nguy cơ tương đối về biến cố kết hợp trong phân nhóm BĐMNB (P tương tác < 0,05). Điều trị kháng kết tập tiểu cầu kép chưa được chứng minh làm giảm đáng kể các biến cố tim mạch trong bệnh cảnh BĐMNB ổn định [11]. Bên cạnh đó, các khuyến cáo của Hội tim Châu Âu (European Society of Cardiology), đồng thuận liên hội về điều trị BĐMNB (Inter-Society Consensus for the Management of Peripheral Arterial Disease), Hội trường môn Tim mạch Hoa Kỳ / Hội Tim Hoa Kỳ (American College of Cardiology Foundation/American Heart Association), và Hội trường môn bác sĩ Lồng ngực Hoa Kỳ (American College of Chest Physicians) đều không khuyến cáo việc dùng thường qui kháng kết tập tiểu cầu kép trong BĐMNB, trên cơ sở là không có lợi ích tăng thêm cho sự phối hợp này và làm tăng nguy cơ chảy máu [3-5,12].
Ticagrelor
Ticagrelor là một thuốc ức chế thụ thể adenosine diphosphate P2Y12 mạnh, có khả năng hồi phục, đường uống. Thử nghiệm PLATO (Platelet Inhibition and Patient Outcomes) [13] đã chứng minh tính vượt trội của ticagrelor so với clopidogrel trong phòng ngừa biến cố tim mạch tử vong và không tử vong trên bệnh nhân hội chứng vành cấp, với điều trị nền tảng là aspirin. Không có sự khác biệt đáng kể về kết cục an toàn tiên phát, được định nghĩa là “chảy máu nặng” theo nghiên cứu PLATO, của ticagrelor so với clopidogrel. Trong phân nhóm bệnh nhân BĐMNB trong thử nghiệm PLATO, việc làm giảm các biến cố thiếu máu cục bộ của ticagrelor so với clopidogrel vẫn được duy trì đối với kết quả chung cuộc của nghiên cứu [14].
Nghiên cứu PEGASUS-TIMI 54 (Prevention of Cardiovascular Events in Patients with Prior Heart Attack Using Ticagrelor Compared to Placebo on a Background of Aspirin-Thrombolysis in Myocardial Infarction 54) phân nhóm ngẫu nhiên 21,162 bệnh nhân có tiền căn NMCT trong vòng 1 đến 3 năm trước đó để dùng ticagrelor 90 mg, 60 mg, hay giả dược 2 lần mỗi ngày phối hợp với điều trị nền tảng aspirin liều thấp trong thời gian theo dõi trung vị 33 tháng. Cả hai liều ticagrelor đều làm giảm kết cục kết hợp chính bao gồm tử vong do tim mạch, NMCT, hay đột quị khi so sánh với giả dược. Chảy máu nặng theo TIMI xảy ra với tần suất cao hơn ở cả hai liều ticagrelor, tuy nhiên, không có sự khác biệt về tần suất chảy máu nội sọ hay chảy máu gây tử vong giữa 3 nhóm [15].
Nghiên cứu về những ảnh hưởng của Ticagrelor và Clopidogrel trên bệnh nhân BĐMNB (EUCLID – Effects of Ticagrelor and Clopidogrel in Patients with Peripheral Artery Disease) đang được tiến hành nhằm xác định trong đơn trị liệu kháng kết tập tiểu cầu, ticargrelor so với clopidogrel, thuốc nào sẽ làm giảm tỉ suất các biến cố thiếu máu cục bộ do thuyên tắc xơ vữa, thông qua kết cục kết hợp tử vong do tim mạch, NMCT, đột quị thiếu máu trên dân số được chẩn đoán BĐMNB.
Thiết kế nghiên cứu và dân số nghiên cứu
EUCLID là một nghiên cứu quốc tế, đa trung tâm, ngẫu nhiên, mù đôi, nhóm song song, theo hướng kết cục ở pha IIIb, nhằm đánh giá việc ngăn ngừa các biến cố thuyên tắc xơ vữa với ticagrelor 90mg hai lần mỗi ngày so với clopidogrel 75mg mỗi ngày trên bệnh nhân có BĐMNB. Thiết kế nghiên cứu được thể hiện trong Hình (ClinicalTrials.gov no., NCT01732822) [16].
Tiêu chuẩn đưa vào của nghiên cứu EUCLID được thiết kế để thu nhận mẫu đại diện cho những bệnh nhân BĐMNB. Bệnh nhân tham gia nghiên cứu phải >=50 tuổi và có BĐMNB có triệu chứng, được định nghĩa bởi 1 trong các tiêu chí sau: (1) chỉ số cổ chân-cánh tay (ABI) <=0.80 và có các triệu chứng ở chi dưới, hay (2) có tái thông mạch máu chi dưới trước đó (Bảng I).
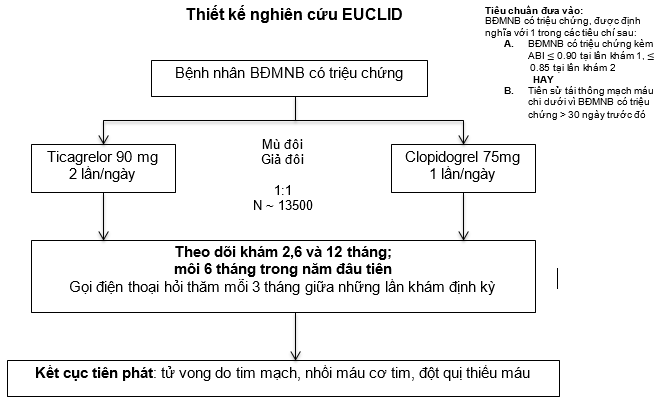
Hình1. Thiết kế nghiên cứu EUCLID
Đối với những bệnh nhân được đánh giá qua tiêu chí ABI, phải có 2 lần đo riêng biệt – lần đầu tiên, chỉ số ABI phải 0,80; và ở lần thăm khám ngẫu nhiên kế tiếp, ABI phải
≤0,85. Điều này nhằm làm cải thiện tính đặc hiệu của chỉ số ABI, qua đó bảo đảm những bệnh nhân tham gia nghiên cứu có bằng chứng huyết động thật sự của BĐMNB (biết rằng sai số giữa các lần đo là 0,10, và chỉ số ABI bằng 0,8 nghĩa là giới hạn trên sai số sẽ ≤ 0,90) [17,18]. Nếu ABI ≥1,40, chỉ số ngón chân-cánh tay (TBI) ≤0,60 ở lần khám 1 và ≤0,65 ở lần khám 2 là tiêu chí thay thế. Những bệnh nhân được tái thông mạch máu chi dưới trước đó vì BĐMNB có triệu chứng được xem đủ tiêu chuẩn nhận vào nếu được tái thông > 30 ngày trước khi được phân nhóm ngẫu nhiên, bất kể các triệu chứng và huyết động của chân hiện có tại thời điểm tầm soát của nghiên cứu.
Tiêu chuẩn loại ra chính bao gồm những bệnh nhân được dự định dùng kháng kết tập tiểu cầu kép, phải dùng aspirin, tiền căn bệnh lý chảy máu, điều trị kháng đông, hay trạng thái chuyển hoá kém của CYP2C19 – được định nghĩa là kiểu gen bao gồm 2 allen mất chức năng. Tất cả bệnh nhân phải được cung cấp bản đồng ý viết tay để tham gia nghiên cứu. Danh sách tiêu chuẩn chọn vào/loại ra đầy đủ được trình bày trong Bảng 1.
Bảng I. Tiêu chuẩn nhận vào và tiêu chuẩn loại ra
|
Tiêu chuẩn nhận vào |
|---|
|
Ít nhất 50 tuổi |
|
BĐMNB có triệu chứng, được định nghĩa bởi: |
|
A. Các triệu chứng BĐMNB kèm với tiêu chuẩn ABI |
|
-Các triệu chứng BĐMNB bao gồm đau cách hồi điển hình, cảm giác khó chịu ở chân khi gắng sức liên quan đến giới hạn hoạt động thể lực do BĐMNB, đau khi nghỉ do thiếu máu cục bộ chi, loét do thiếu máu, hay hoại thư |
|
-ABI ≤ 0.80 ở lần khám 1 và ≤0.85 ở lần khám 2 |
|
-Nếu ABI ≥1.40, chỉ số TBI phải ≤0.60 ở lần khám 1 và ≤0.65 ở lần khám 2 |
|
HAY |
|
B. Tái thông mạch máu chi dưới trước đó > 30 ngày vì BĐMNB có triệu chứng |
|
Bản đồng ý tham gia nghiên cứu viết tay trước bất cứ tiến trình nghiên cứu đặc hiệu nào |
|
Tiêu chuẩn loại ra |
|
Tình trạng chuyển hoá kém của CYP2C19, được định nghĩa khi kiểu gene có 2 allen mất chức năng |
|
Dị ứng với clopidogrel hay ticagrelor |
|
Bệnh nhân cần dùng kháng kết tập tiểu cầu kép tại đầu vào của nghiên cứu |
|
Cần dùng kháng đông đường uống lâu dài hay heparin trọng lượng phân tử thấp lâu dài hay fondaparinux lâu dài |
|
Dự định (và đánh giá cần thiết) dùng ticlodipine, prasugrel, aspirin, hay dipyridamole |
|
Dự định (và đánh giá cần thiết) dùng omeprazole hay esomeprazole. Những thuốc ức chế bơm proton khác được cho phép sử dụng. |
|
Bất cứ tình trạng nào mà theo ý kiến của nghiên cứu viên là bệnh nhân không an toàn và không thích hợp để tham gia nghiên cứu (bao gồm ung thư hoạt động ngoài ung thư da tế bào vảy hay ung thư tế bào đáy, dùng thuốc ức chế CYP2C19 mạnh hay vừa, điều trị lâu dài các thuốc kháng viêm không steroids kèm theo) |
|
Dự đoán sống còn < 6 tháng dựa trên phán xét của nghiên cứu viên |
|
Dự định tái thông mạch máu (nội mạch hay phẫu thuật) tại bất cứ trung tâm mạch máu nào trong 3 tháng tới |
|
Dự định cắt cụt chi lớn do BĐMNB trong vòng 3 tháng tới hay cắt cụt chi lớn trong vòng 30 ngày cuối cùng |
|
Bệnh nhân bị đột quị trong vòng 3 tháng trước đó |
|
Lú lẫn có thể gây hiểu sai nguy hiểm những thông tin cần thiết cho tiến hành nghiên cứu hay tuân thủ tiến trình nghiên cứu |
|
Tăng huyết áp nặng mà có thể làm tăng nguy cơ cho bệnh nhân |
|
Những bệnh nhân được xem có nguy cơ xuất hiện các biến cố rối loạn nhịp chậm (bao gồm những bệnh nhân đã biết hội chứng suy nút xoang hay có blốc nhĩ thất độ 2 hay độ 3) trừ khi bệnh nhân đã được đặt máy tạo nhịp vĩnh viễn |
|
Bệnh gan nặng đã biết (báng bụng và/hoặc các dấu hiệu lâm sàng rối loạn đông máu) |
|
Suy thận cần lọc máu |
|
Một bệnh lý lâm sàng dễ chảy máu nguy hiểm, rối loạn đông cầm máu, hay chảy máu hệ thống |
|
Tiền sử xuất huyết nội sọ bất cứ thời điểm nào, xuất huyết tiêu hoá trong vòng 6 tháng trước đó, hay phẫu thuật lớn trong vòng 30 ngày (nếu vết thương phẫu thuật được đánh giá có liên quan đến tăng nguy cơ chảy máu) |
|
Giảm bạch cầu hay giảm tiểu cầu quan trọng trên lâm sàng |
|
Phụ nữ có khả năng mang thai (bao gồm những phụ nữ không triệt sản bằng thuốc hay phẫu thuật hay không ở giai đoạn mãn kinh) mà không muốn dùng biện pháp ngừa thai được chấp nhận về mặt y khoa, được xem xét chắc chắn trong suy xét của nghiên cứu viên HAY phụ nữ có xét nghiệm thử thai dương tính ở lần khám thứ 1 |
|
Lo ngại bệnh nhân không có khả năng tuân theo tiến trình nghiên cứu và/hoặc theo dõi (những bệnh nhân lạm dụng rượu hay thuốc) |
|
Đã được phân nhóm ngẫu nhiên trong nghiên cứu hiện tại |
|
Liên quan đến kế hoạch và/hoặc tiến hành nghiên cứu (ứng cử vào nhân viên AstraZeneca và nhân viên tại trung tâm nghiên cứu) |
Bệnh nhân trong nghiên cứu EUCLID được phân nhóm ngẫu nhiên theo tỉ lệ 1:1 để được đơn trị ticagrelor hay clopidogrel. Quá trình tuyển chọn bắt đầu từ tháng 12 năm 2012 và đã hoàn thành vào tháng 3 năm 2014; tổng cộng 13.887 bệnh nhân được phân nhóm ngẫu nhiên. Có 2 bệnh nhân được xác định được tuyển chọn và phân nhóm ngẫu nhiên 2 lần ( có nghĩa là cùng một bệnh nhân được đưa vào và phân nhóm ngẫu nhiên ở 2 địa điểm khác nhau); vì thế, tổng số bệnh nhân được phân nhóm ngẫu nhiên là 13.885. Những đặc điểm nền tảng của bệnh nhân tham gia nghiên cứu EULCID được ghi nhận trong Bảng II. Những bệnh nhân phân nhóm ngẫu nhiên đang được theo dõi bằng tất cả các kết cục lâm sàng và biến cố ngoại ý trầm trọng (AEs-serious adverse events) cho đến thời điểm kết thúc nghiên cứu, trong đó, kết cục tiên phát và một vài kết cục thứ phát được khẳng định bởi trung tâm thẩm định (central adjudication). Thử nghiệm sẽ được tiếp tục cho đến khi cộng dồn đủ ít nhất 1.364 các kết cục tiên phát được phân tích (tử vong do tim mạch, NMCT, hay đột quị thiếu máu).
Bảng II. Đặc điểm nền tảng của những bệnh nhân được đưa vào nghiên cứu EUCLID tại thời điểm đầu vào (không phải dữ liệu cuối cùng [dữ liệu ngày 30–11–2015]*)
|
Tất cả bệnh nhân (N = 13885)† |
|
|---|---|
|
Tuổi, trung vị (bách phân vị 25, 75), năm |
66,0 (60,0, 73,0) |
|
Giới nam |
9997 (72,0) |
|
Tiêu chuẩn nhận vào để phân nhóm ngẫu nhiên |
|
|
Tái thông mạch máu trước đó |
7878 (56,7) |
|
Tiêu chuẩn ABI/TBI |
6007 (43,3) |
|
ABI lúc phân nhóm ngẫu nhiên, trung vị (bách phân vị 25, 75)‡ |
0,70 (0,58, 0,82) |
|
Tiền căn y khoa |
|
|
Tiền căn đột quị |
1134 (8,2) |
|
Tiền căn TIA |
506 (3,6) |
|
NMCT |
2518 (18,1) |
|
PCI hay CABG trước đó |
3218 (23,2) |
|
Đái tháo đường |
5342 (38,5) |
|
Tăng huyết áp cần điều trị thuốc |
10839 (78,1) |
|
Tăng lipid máu cần điều trị thuốc |
10462 (75,4) |
|
Hút thuốc lá |
|
|
Chưa bao giờ hút |
2990 (21,7) |
|
Đang hút thuốc lá |
4285 (31,0) |
|
Từng hút thuốc lá |
6527 (47,3) |
Dữ liệu được trình bày dưới dạng số (phần trăm), trừ khi được ghi chú dưới hình thức khác. TIA, cơn thoáng thiếu máu não ; PCI, can thiệp động mạch vành qua da; CABG, phẫu thuật bắc cầu động mạch vành
* Một bệnh nhân có thể có nhiều hơn 1 tiêu chuẩn loại ra.
† N thể hiện tổng số bệnh nhân, không phân ngẫu nhiên. Hai bệnh nhân được xác định được tuyển kép (nghĩa là cùng một bệnh nhân được đưa vào tại 2 địa điểm nghiên cứu khác nhau); vì thế, tổng số bệnh nhân phân nhóm ngẫu nhiên là 13,885.
‡ ABI (hay TBI) thông qua đo đạc được báo cáo tại các địa điểm nghiên cứu trong CRF và được tính là số đo trung bình của ABI (hay TBI) khi tuyển vào và phân nhóm ngẫu nhiên, trong đó, tại mỗi lần khám, trị số ABI (hay TBI) được lấy dựa vào giá trị cao nhất của bên phải hay bên trái
Nghiên cứu này được tiến hành theo các nguyên lý y đức của Tuyên ngôn Helsinki, các khuyến cáo của ICH-GCP (International Conference on Harmonisation Good Clinical Practice), và các yêu cầu chế định thích hợp. Đề cương nghiên cứu cuối cùng và bản đồng ý tham gia nghiên cứu đã được xem xét và chấp thuận bởi các cơ quan y tế có thẩm quyền và các hội đồng y đức tại tất cả các địa điểm tham gia nghiên cứu. Những bệnh nhân được tuyển chọn đưa bản đồng ý tham gia nghiên cứu viết tay để tham gia nghiên cứu.
Phương thức điều trị và quá trình theo dõi bệnh nhân
Chọn lựa điều trị và tuân thủ
Thuốc nghiên cứu được cung cấp dưới dạng mù đôi cho cả ticagrelor 90mg 2 lần/ngày hay clopidogrel 75mg 1 lần/ngày (ticagrelor hay giả dược tương xứng so với clopidogrel hay giả dược tương xứng vào buổi sáng, và ticagrelor hay giả dược tương xứng vào buổi tối). Ticagrelor liều 90mg dung nạp tốt và cho thấy có mức độ ức chế tiểu cầu cao và hằng định trong các nghiên cứu pha II, với dữ liệu về tính an toàn chấp nhận được [19,20]. Ngoài ra, nghiên cứu PLATO đã cho thấy hướng cân bằng nguy cơ – lợi ích lâm sàng tích cực với liều này [13]. Clopidogrel liều 75mg mỗi ngày được lựa chọn vì nó đã được chấp nhận là liều điều trị duy trì trong thực hành lâm sàng. Liều tải không được sử dụng vì thuốc không cần thiết phải khởi phát tác dụng nhanh trong bệnh cảnh ổn định. Trong suốt nghiên cứu, một số bệnh nhân được lường trước có thể xuất hiện một chỉ định dùng liều tải thuốc đối kháng thụ thể P2Y12. Một lựa chọn điều trị bổ sung trong nghiên cứu được đưa ra cho nghiên cứu viên để cho phép dùng thêm 90mg ticagrelor hay giả dược và đến 600mg clopidogrel hay giả dược như một liều tải bổ sung.
Các điều trị kèm theo
Tất cả bệnh nhân trong nghiên cứu EUCLID được khuyến cáo điều trị phòng ngừa bệnh lý tim mạch chuẩn, bao gồm statins; điều này phù hợp với các khuyến cáo cho bệnh nhân có BĐMNB. Điều trị thêm thuốc kháng đông không được cho phép, chẳng hạn như các thuốc ức chế P2Y12 khác, kháng đông dùng dài hạn ở liều điều trị, và các thuốc ức chế tiểu cầu khác. Kháng kết tập tiểu cầu kép tại thời điểm bắt đầu nghiên cứu không được chấp nhận, nhưng được cho phép sau đó nếu có một chỉ định lâm sàng (như NMCT) xuất hiện trong suốt quá trình theo dõi, và aspirin nhãn mở được cho phép dùng thêm vào. Những điều trị dự định kèm theo như bất kỳ các thuốc ức chế phosphodiesterase D3 đã được chấp thuận trong đau cách hồi (cilostazol, pentoxifyline, hay naftidrofuryl) được cho phép sử dụng. Chi tiết nhiều hơn được mô tả trong phụ lục A trực tuyến.
Các khuyến cáo cho bệnh nhân thực hiện thủ thuật
Theo ý kiến nghiên cứu viên, trong các phẫu thuật chương trình tim và phẫu thuật lớn không tim có nguy cơ chảy máu nặng về lâm sàng, bệnh nhân được khuyên ngưng điều trị nghiên cứu 5 ngày trước thủ thuật và thời điểm thích hợp điều trị lại được xác định bởi bác sĩ điều trị. Đối với những phẫu thuật và thủ thuật xâm lấn khác, điều trị nghiên cứu có thể được duy trì hoặc ngưng tạm thời tuỳ theo suy xét của nghiên cứu viên. Điều trị nghiên cứu được khuyên không nên dừng kéo dài nhiều hơn 5 ngày để tránh nguy cơ các biến chứng thuyên tắc xuất hiện khi ngưng điều trị.
Lịch khám và theo dõi bệnh nhân
Những bệnh nhân được phân nhóm ngẫu nhiên trở lại khám trong nghiên cứu tại thời điểm tháng thứ 2, thứ 6 và 12 trong suốt năm đầu tiên và sau đó mỗi 6 tháng cho đến khi kết thúc nghiên cứu, điều này giúp xác định thời điểm nghiên cứu đạt được ít nhất 1,364 kết cục tiên phát theo dự tính. Khám qua điện thoại được thực hiện mỗi 6 tháng bắt đầu từ tháng thứ 9 cho đến khi kết thúc nghiên cứu. Trong suốt những lần theo dõi tái khám, bệnh nhân được đánh giá về các biến cố ngoại ý và các biến cố kết cục có thể xảy ra. Tất cả bệnh nhân được trải qua một thăm khám Kết thúc điều trị khi ngưng điều trị vĩnh viễn và được một lần liên lạc theo dõi khoảng 2 tuần sau liều thuốc nghiên cứu cuối cùng. Tất cả bệnh nhân phân nhóm ngẫu nhiên được khuyên đích thân đến thăm khám lần cuối trong nghiên cứu bất kể họ có hay không có uống thuốc nghiên cứu ngẫu nhiên. Tình trạng sống còn sẽ được đánh giá ở tất cả bệnh nhân tại thời điểm kết thúc nghiên cứu.
Đo ABI và TBI
Chỉ số ABI/TBI được đo tại lần khám thứ 1 trên tất cả bệnh nhân và ở cả lần khám thứ 1 và thứ 2 trên những bệnh nhân được tuyển chọn qua tiêu chí ABI/TBI; những lần đo ABI/TBI kế tiếp được thực hiện ở các lần khám mỗi 6 tháng và tại lần khám kết thúc nghiên cứu. Động mạch cổ chân và động mạch chi được chọn đo trong 2 lần khám đầu tiên được ghi nhận và sẽ được dùng trong tất cả các lần khám kế tiếp. 2 lần đo ABI đầu tiên cho 3 bệnh nhân đầu tiên ở mỗi địa điểm nghiên cứu được đánh giá chất lượng bởi xét nghiệm trung tâm ABI (ABI core laboratory) (xem phần sau).
Chỉ số ABI/TBI được dùng để xác định tính phù hợp của bệnh nhân tham gia nghiên cứu theo tiêu chí ABI. Chỉ số ABI/TBI sẽ cũng được xem là một kết cục thăm dò trong nghiên cứu nhằm đánh giá tiến triển của bệnh theo thời gian và kiểm chứng giả thuyết rằng ticagrelor làm giảm tỉ suất sự suy giảm tương đối ABI/TBI so với clopidogrel.
Xét nghiệm trung tâm ABI được hình thành nhằm đưa ra một sự kiểm soát chất lượng đo đạt để đảm bảo bệnh nhân thoả tiêu chuẩn đưa vào ABI và tránh phân nhóm nhầm, điều này có thể ảnh hưởng tiêu cực đến tỉ suất biến cố dự định. Xét nghiệm trung tâm ABI tiến hành theo dõi dữ liệu thường xuyên về khả năng lặp lại của ABI/TBI tại đầu vào và tại bất cứ địa điểm, quốc gia và vùng tham gia nghiên cứu nào. Dựa trên dữ liệu tích luỹ từ các địa điểm và quốc gia, can thiệp vào sự sai biệt quá mức sẽ được thúc đẩy, bắt đầu từ phản hồi của địa điểm nghiên cứu bằng thư điện tử và thư bưu điện, cho đến kiểm tra tại các địa điểm nghiên cứu để quan sát cách đo ABI/TBI với từng cá nhân trong địa điểm và huấn luyện lại nếu cần thiết.
Các kết cục nghiên cứu
Kết cục tiên phát của thử nghiệm là sự kết hợp tử vong do tim mạch, NMCT, hay đột quị thiếu máu. Các biến cố kết cục thứ phát chính bao gồm tử vong do tim mạch, NMCT, đột quị thiếu máu, và thiếu máu cục bộ chi cấp tính (ALI-acute limb ischemia) cần nhập viện. Thiếu máu cục bộ chi cấp tính được chọn là một kết cục vì trên bệnh nhân BĐMNB có bệnh tật chi đáng kể. Bên cạnh đó, thuốc kháng kết tập tiểu cầu với hoạt tính đối kháng thụ thể protease-activated receptor -1 đã được chứng minh làm giảm các biến cố chính bất lợi trên chi [21]. Các định nghĩa của kết cục chính được trình bày chi tiết trong phụ lục A trực tuyến.
Mục tiêu an toàn tiên phát của nghiên cứu này là chảy máu nặng theo định nghĩa TIMI. Các biến cố chảy máu cũng sẽ được suy xét theo các định nghĩa trong nghiên cứu PLATO, Bleeding Academic Research Consortium, và Hội Huyết khối và Đông máu quốc tế (International Society on Thrombosis and Heamostasis). Tính an toàn sẽ được đánh giá thông qua tiêu chuẩn xác định của các tác dụng bất lợi không mong muốn do các địa điểm báo cáo. Những tác dụng ngoại ý không trầm trọng được quan tâm ( bao gồm các biến cố chảy máu, khó thở, suy giảm chức năng thận/tăng creatinine, loạn nhịp tim chậm, bất thường xét nghiệm chức năng gan, gout/tăng acid uric, viêm phổi, nữ hoá tuyến vú, chảy máu tử cung bất thường, tất cả các ung thư ngoại trừ ung thư da không-melanoma), các biến cố tác dụng ngoại ý đang xảy ra trong lúc ngưng vĩnh viễn thuốc nghiên cứu do tác dụng ngoại ý, và tất cả các tác dụng ngoại ý trầm trọng sẽ được xem xét lại trong bối cảnh tính an toàn đã được đánh giá trước đó của thuốc.
Tất cả các kết cục về hiệu quả và tính an toàn về chảy máu được báo cáo bởi các địa điểm thông qua hệ thống điện tử Web-based capture với nguồn tài liệu được hỗ trợ có thể áp dụng được. Phán xét mỗi biến cố được tiến hành căn cứ theo các định nghĩa trong bản tuyên bố của Uỷ ban các kết cục lâm sàng EUCLID (EUCLID Clinical End Points Committee Charter) (phụ lục B trực tuyến) bởi hội đồng các kết cục lâm sàng độc lập, mù, được huấn luyện, với giấy chứng nhận trong lĩnh vực tim mạch hay thần kinh, tuỳ theo loại biến cố.
Các xem xét thống kê
Biến số hiệu quả tiên phát là thời gian từ lúc phân nhóm ngẫu nhiên cho đến lúc xảy ra lần đầu bất kỳ biến cố nào trong kết cục tiên phát kết hợp gồm tử vong do tim mạch, NMCT, hay đột quị thiếu máu. Biến số tiên phát sẽ được kiểm tại mức ý nghĩa 4.94% (2 đuôi) cho 1 phân tích tạm thời được dự tính với sai số loại I chung duy trì ở mức 5%. Phân tích tất cả các biến số hiệu quả được dựa trên nguyên lý xử lý theo chủ định (intention-to-treat) bằng mô hình hồi qui Cox (Cox proportional hazards model) với một hệ số cho nhóm điều trị. Tỉ số nguy cơ của ticagrelor so với clopidogrel, khoảng tin cậy 95% sẽ được trình bày. Đối với vấn đề đa kiểm, phân tích khẳng định sẽ bao gồm chuỗi phép kiểm thứ bậc với biến số hiệu quả tiên phát, sau đó là các biến số hiệu quả thứ phát với thứ tự được liệt kê trong Bảng III. Phép kiểm khẳng định sẽ tiếp tục ở mức ý nghĩa 4.94% cho đến khi sự khác biệt về hiệu quả điều trị không có ý nghĩa thống kê đầu tiên trong chuỗi được quan sát. Phân tích hiệu quả được tiến hành trên cơ sở xử lý theo chủ định (intention-to-treat) trong tất cả đối tượng được phân nhóm ngẫu nhiên. Đánh giá tính an toàn sẽ bao gồm tất cả những bệnh nhân được nhận ít nhất 1 liều thuốc nghiên cứu và trong vòng 7 ngày sau liều thuốc nghiên cứu cuối cùng. Phân tích dưới nhóm sẽ được tiến hành để đánh giá khác biệt về hiệu quả điều trị, cũng như kiểm tra tương tác điều trị cho mỗi biến số dưới nhóm. Giá trị P của các phân tích dưới nhóm và kiểm định tương tác sẽ không được điều chỉnh để so sánh đa biến bởi vì các kiểm định nhằm tìm yếu tố khám phá và sẽ được biểu diễn bằng phương thức mô tả. Các phân tích dưới nhóm sẽ được thực hiện với các biến số hiệu quả tiên phát và tính an toàn. Các phân tích dưới nhóm sẽ tiến hành dựa trên một bộ các biến số nền tảng (Phụ lục bổ sung Bảng I trực tuyến).
Bảng III. Các kết cục thứ phát
|
1. Kết hợp tử vong do tim mạch, NMCT, đột quị thiếu máu, hay nhập viên vì thiếu máu chi cấp tính |
|
2. Tử vong do tim mạch |
|
3. NMCT |
|
4. Tử vong do mọi nguyên nhân |
|
5. Kết hợp tử vong do tim mạch, NMCT, hay đột quị do mọi nguyên nhân (thiếu máu hay xuất huyết) |
|
6. Nhập viên vì thiếu máu chi cấp tính |
|
7. Tái thông mạch máu chi dưới |
|
8. Kết hợp tất cả tái thông mạch máu (mạch vành và động mạch ngoại biên [chi, mạc treo, thận, cảnh hay động mạch khác]) |
Muốn ước lượng cỡ mẫu cần phải ước lượng tỉ suất biến cố trên bệnh nhân BĐMNB có triệu chứng. Ước lượng mẫu được thực hiện bằng dữ liệu tốt nhất sẵn có. Phân nhóm BĐMNB được phân tích từ các thử nghiệm [10,22,23] và nghiên cứu sổ bộ trước đó [24-28]. Các biến số chính được dùng cho ước lượng biến cố bao gồm tỉ lệ đối tượng ước tính được tuyển vào với các giá trị cắt ngang (cutoff) ABI khác nhau, tỉ lệ lưu hành của bệnh đa mạch máu, và thiếu máu cục bộ chi trầm trọng. Dữ liệu từ phân nhóm BĐMNB trong nghiên cứu PLATO đã chứng minh giảm nguy cơ tương đối 15% tương tự như các kết quả tổng quát của nghiên cứu, trong đó nguy cơ tuyệt đối được giảm mạnh hơn [14].
Để xác định tỉ số nguy cơ thật sự là 0,85, phân nhóm ngẫu nhiên khoảng 11.500 bệnh nhân được kỳ vọng để có 1.596 biến cố kết cục tiên phát, với xác suất tình huống là 90% ở mức ý nghĩa 4,94%. Cỡ mẫu ban đầu đã được tính toán dựa trên giả định rằng có 6% – 6,5% mỗi năm tỉ suất gộp các biến cố tử vong do tim mạch, NMCT, hay đột quị thiếu máu. Bởi vì tỉ suất biến cố thấp hơn kỳ vọng, Uỷ ban điều hành EUCLID đã điều chỉnh thử nghiệm nhằm giữ xác suất tình huống đủ để kiểm định giả thuyết nghiên cứu tiên phát. Đề cương nghiên cứu được sửa đổi trong tháng 12 năm 2013 để tăng cỡ mẫu từ 11.500 lên ít nhất 13.500 bệnh nhân được phân nhóm ngẫu nhiên. Trong tháng 3 năm 2015, mục tiêu về số lượng của các biến cố tiên phát đã được giảm từ 1.596 xuống còn tối thiểu 1.364; điều này dẫn đến việc xác suất tình huống giảm từ 90% xuống còn 85% ở mức ý nghĩa 4,94%.
Một uỷ ban theo dõi dữ liệu độc lập (DMC-data monitoring committee) chịu trách nhiệm theo dõi tính an toàn trong suốt thử nghiệm và sẽ tiến hành ít nhất 1 phân tích tạm thời về tính hiệu quả khi đủ xấp xỉ phân nửa các kết cục tiên phát dự đoán đã được cộng dồn và thẩm định. Trong quá trình xem xét, uỷ ban theo dõi dữ liệu độc lập có thể đưa ra những tác động hiệu quả khác để bổ sung thêm vào. Một hàm alpha (alpha spending function) sẽ được dùng tạm thời và trong kiểm định thống kê cuối cùng để kiểm soát sai lầm loại I ở mức chung là 5%.
Nghiên cứu dưới nhóm về tiểu cầu
Một nghiên cứu dưới nhóm về tiểu cầu được thực hiện ở Hoa Kỳ sẽ đánh giá dược động học của thuốc bằng xét nghiệm chức năng tiểu cầu. Nghiên cứu dưới nhóm về tiểu cầu đang được tiến hành ở 10 trung tâm nhằm so sánh ảnh hưởng của các thuốc nghiên cứu lên xét nghiệm đánh giá kết tập tiểu cầu bởi adenosine diphosphate (adenosine diphosphate-induced platelet light transmission aggregation), xét nghiệm ELISA phosphoprotein gây dãn mạch (vasodilator-stimulated phosphoprotein enzyme-linked immunosprbent assay – based assay) (BioCytex, Marseille, France), và xét nghiệm P2Y12 VerifyNow (Accumetrics, San Diego, CA).
Tổ chức nghiên cứu
Thử nghiệm EUCLID đang được tiến hành trên 28 quốc gia và 821 địa diểm nghiên cứu. Nhóm tổ chức nghiên cứu là sự cộng tác các thành viên của Viện Nghiên cứu lâm sàng Duke (Duke Clinical Research Institute (DRCI; Durham, NC), Trung tâm phòng ngừa Colorado (Colorado Prevention Center (Denver, CO), và nhà tài trợ nghiên cứu AstraZeneca (London, UK) (Phụ lục C trực tuyến). Uỷ ban điều hành nghiên cứu theo dõi tiến trình thực hiện nghiên cứu. Một uỷ ban chỉ đạo nghiên cứu quốc tế bao gồm các chuyên gia và nghiên cứu viên đứng đầu mỗi quốc gia chịu trách nhiệm về đề cương nghiên cứu và quá trình thực thi nghiên cứu. Một uỷ ban theo dõi dữ liệu độc lập chịu trách nhiệm xem xét định kì về sự an toàn của bệnh nhân trong suốt nghiên cứu.
Nghiên cứu EUCLID được thiết kế bởi uỷ ban điều hành nghiên cứu với sự cộng tác của DCRI và nhà tài trợ nghiên cứu. Những phân tích dữ liệu độc lập sẽ được thực hiện bởi DCRI cùng với sự kiểm chứng của nhà tài trợ nghiên cứu. Uỷ ban điều hành nghiên cứu hoàn toàn tự do tiếp cận tất cả dữ liệu nghiên cứu và sẽ nộp kết quả nghiên cứu cho một tạp chí y khoa để được thẩm định trước khi xuất bản.
Nghiên cứu EUCLID được tài trợ nghiên cứu từ AstraZeneca. Các tác giả chỉ chịu trách nhiệm thiết kế và tiến hành nghiên cứu, tất cả các phân tích của nghiên cứu, phác thảo và chỉnh sửa bản thảo, cũng như những nội dung nghiên cứu chính thức cuối cùng.
Bàn luận
Mặc dù số lượng bệnh nhân BĐMNB chi dưới ngày càng gia tăng [1], những chứng cứ cho việc điều trị nhằm cải thiện tiên lượng bệnh tim mạch và tử vong còn giới hạn [29]. Những khuyến cáo về BĐMNB hiện nay của Trường môn Tim mạch Hoa Kỳ/Hội Tim Hoa Kỳ/Hội Tim Châu Âu khuyên dùng aspirin hay clopidogrel để làm giảm các biến cố tim mạch [4,5]. Tuy nhiên, những khuyến cáo này dựa trên việc đánh giá tác động của thuốc trên phân nhóm bệnh nhân BĐMNB vốn là những nhóm nhỏ của các nghiên cứu lớn. Nghiên cứu EUCLID sẽ xác định vai trò của điều trị kháng kết tập tiểu cầu trên bệnh nhân BĐMNB có triệu chứng.
Chính vì chúng tôi muốn tiến hành một nghiên cứu lớn hướng tới bệnh nhân BĐMNB, nghiên cứu sẽ có một số suy xét quan trọng về thiết kế nghiên cứu, bao gồm dân số tuyển chọn, các điều trị so sánh, quản lý bệnh nhân trong suốt thời gian nghiên cứu, và tiên lượng cần quan tâm.
Dân số nghiên cứu
Những bệnh nhân BĐMNB có triệu chứng có nguy cơ các biến cố tim mạch cao, cần thay đổi lối sống tích cực và điều trị thuốc để làm giảm nguy cơ. Để khắc phục nguồn dữ liệu hạn chế trong BĐMNB, nghiên cứu EUCLID bao gồm toàn bộ các kiểu bệnh nhân BĐMNB có triệu chứng, đó là những bệnh nhân có ABI bất thường ( ABI < 0.80) hay TBI bất thường (< 0.60 với ABI > 1.4), có triệu chứng chi dưới điển hình và không điển hình, thiếu máu cục bộ chi nặng gây đau lúc nghỉ. Ngoài ra, nghiên cứu EUCLID còn bao gồm cả những bệnh nhân có hay không có tái thông mạch máu (can thiệp nội mạch hay phẫu thuật) hay cắt cụt chi.
Điều trị kháng kết tập tiểu cầu so sánh
Khi thiết kế nghiên cứu, các nhóm so sánh kháng kết tập tiểu cầu khác nhau đã được xem xét, bao gồm đơn trị liệu aspirin, đơn trị liệu clopidogrel, hay kháng kết tập tiểu cầu kép. Lợi ích của aspirin trong bệnh cảnh BĐMNB vẫn còn chưa chắc chắn. Một phân tích gộp từ 9 thử nghiệm trên bệnh nhân BĐMNB đã không cho thấy sự khác biệt có ý nghĩa về các biến cố tim mạch của aspirin so với giả dược hay nhóm chứng [6]. Đơn trị liệu clopidogrel tốt hơn aspirin đơn trị liệu trên bệnh nhân có tiền sử NMCT, đột quị hay BĐMNB. Thực tế cho thấy clopidogrel làm giảm các biến cố tim mạch nhiều nhất trong đoàn hệ bệnh nhân BĐMNB, hay clopidogrel có hiệu quả tốt hơn trong bệnh cảnh BĐMNB [10]. Nghiên cứu CHARISMA không chứng minh được lợi ích đáng kể từ việc điều trị kháng kết tập tiểu cầu kép trong đoàn hệ nghiên cứu chung [22] và trong đoàn hệ BĐMNB [11]. Một cách tổng thể, điều này cho thấy đơn trị liệu clopidogrel là chiến lược điều trị kháng kết tập tiểu cầu được chứng minh nhiều nhất trên bệnh nhân có BĐMNB. Để có được sự so sánh chính xác nhất giữa clopidogrel và ticagrelor, những bệnh nhân có 2 allen CYP2C19 mất chức năng được loại khỏi nghiên cứu EUCLID.
Quản lý trong suốt nghiên cứu
EUCLID được thiết kế như là một nghiên cứu lâm sàng hữu dụng. Vì thế, điều trị nền tảng và thông thường vẫn được phép, bao gồm cả can thiệp nội mạch hay phẫu thuật để điều trị BĐMNB có triệu chứng. Mặc dù việc dùng aspirin được xem là tiêu chuẩn loại trừ tại thời điểm bắt đầu nghiên cứu, việc dùng thêm aspirin được cho phép trên một số đối tượng đặc biệt (biến cố tim mạch xuất hiện tình cờ hay tái thông mạch máu) mà kháng kết tập tiểu cầu được khuyến cáo. Đối với những bệnh nhân được thực hiện thủ thuật, việc điều trị tiếp tục được khuyến cáo, và đường dây hỗ trợ bởi các bác sĩ sẵn có 24 giờ trong ngày,7 ngày trong tuần để trả lời các câu hỏi lâm sàng.
Các kết cục về chi
Các biến cố lâm sàng chi quan trọng đang được khảo sát và thẩm định như những kết cục thứ phát của nghiên cứu này. Bởi vì nghiên cứu trên mẫu những bệnh nhân BĐMNB có triệu chứng, các kết cục đặc hiệu cho chi là quan trọng để hiểu rõ dân số nguy cơ cao này. Vì thế, nghiên cứu này khảo sát thiếu máu cục bộ chi cấp tính cần phải nhập viện kèm với kết cục kết hợp tiên phát như là kết cục thứ phát chính đầu tiên. Những biến cố chi khác đang được khảo sát bao gồm tái thông mạch máu chi dưới, tình trạng lâm sàng chi dưới (theo giai đoạn Rutherford và Fontaine), sự thay đổi ABI (hay TBI) , cắt cụt chi, và bảng câu hỏi động mạch ngoại biên. Ngoài ra, nghiên cứu TRA20P-TIMI 50 gần đây đã tiến hành so sánh vorapaxar, một thuốc kháng tiểu cầu đường uống nhắm đến thụ thể hoạt hoá protease bởi thrombin (protease-activated receptor-1 by thrombin), với giả dược trên bệnh nhân tiền sử NMCT, đột quị hay BĐMNB. Mặc dù vorapaxar không làm giảm kết cục kết hợp tiên phát trên bệnh nhân BĐMNB, thuốc này làm giảm có ý nghĩa thiếu máu cục bộ chi cấp tính và tái thông động mạch ngoại biên [21]. Những dữ liệu trên chứng minh giả thuyết rằng điều trị kháng tiểu cầu hiệu quả sẽ làm giảm các biến cố đặc hiệu cho chi.
Tóm tắt
Nghiên cứu EUCLID đang đánh giá liệu rằng đơn trị liệu ticagrelor hay clopidogrel sẽ làm giảm các biến cố tim mạch chính và các biến cố đặc hiệu cho chi trên một dân số đại diện rộng lớn bệnh nhân có BĐMNB
Dữ liệu bổ sung
Dữ liệu bổ sung có thể tìm thấy trực tuyến tại http://dx.doi.org/10.1016/j.ahj.2016.01.018.
Tài liệu tham khảo
1. Fowkes FG, Rudan D, Rudan I, et al. Comparison of global estimates of prevalence and risk factors for peripheral artery disease in 2000 and 2010: a systematic review and analysis. Lancet 2013;382: 1329-40.
2. Pande R, Perlstein T, Backman J, et al. Secondary prevention and mortality in peripheral arterial disease: National Health and Nutrition Examination Study, 1994 to 2004. Circulation 2011;124:17-23.
3. Norgren L, Hiatt WR, Dormandy JA, et al. Inter-society consensus for the management of peripheral arterial disease (TASC II). Vasc Surg 2007;45(Suppl S):S5-S67.
4. Rooke TW, Hirsch AT, Misra S, et al. Focused update of the guideline for the management of patients with peripheral artery disease (updating the 2005 guideline): a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 2011;58:2020-45.
5. Tendera M, Aboyans V, Bartelink ML, et al. ESC guidelines on the diagnosis and treatment of peripheral artery diseases: document covering atherosclerotic disease of extracranial carotid and vertebral, mesenteric, renal, upper and lower extremity arteries: the Task Force on the Diagnosis and Treatment of Peripheral Artery Diseases of the European Society of Cardiology (ESC). Eur Heart J 2011;32:2851-906.
6. Berger JS, Krantz MJ, Kittelson JM, et al. Aspirin for the prevention of cardiovascular events in patients with peripheral artery disease: a meta-analysis of randomized trials. JAMA 2009;301:1909-19.
7. Belch J, MacCuish A, Campbell I, et al. The prevention of progression of arterial disease and diabetes (POPADAD) trial: factorial rando- mised placebo controlled trial of aspirin and antioxidants in patients with diabetes and asymptomatic peripheral arterial disease. BMJ 2008;337:a1840.
8. Fowkes FG, Price JF, Stewart MC, et al. Aspirin for prevention of cardiovascular events in a general population screened for a low ankle brachial index: a randomized controlled trial. JAMA 2010;303:841-8.
9. Hiatt WR, Goldstone J, Smith Jr SC, et al. Atherosclerotic Peripheral Vascular Disease Symposium II: nomenclature for vascular diseases. Circulation 2008;118:2826-9.
10. CAPRIE Steering Committee. A randomized, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). Lancet 1996;348:1329-39.
11. Cacoub PP, Bhatt DL, Steg PG, et al. Patients with peripheral arterial disease in the CHARISMA trial. Eur Heart J 2009;30:192-201.
12. Alonso-Coello P, Bellmunt S, McGorrian C, et al. Antithrombotic therapy in peripheral artery disease: antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest 2012;141(2 Suppl):e669S-90S.
13. Wallentin L, Becker RC, Budaj A, et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2009;361: 1045-57.
14. Patel MR, Becker RC, Wojdyla DM, et al. Cardiovascular events in acute coronary syndrome patients with peripheral arterial disease treated with ticagrelor compared with clopidogrel: data from the PLATO Trial. Eur J Prev Cardiol 2015;22:734-42.
15. Bonaca MP, Bhatt DL, Cohen M, et al. Long-term use of ticagrelor in patients with prior myocardial infarction. N Engl J Med 2015;372: 1791-800.
16. A study comparing cardiovascular effects of ticagrelor and clopido- grel in patients with peripheral artery disease (EUCLID). Clinical- Trials.gov identifier: NCT01732822. Available at, https:// clinicaltrials.gov/ct2/show/NCT01732822. Accessed June 8, 2015.
17. Espeland MA, Regensteiner JG, Jaramillo SA, et al. Measurement characteristics of the ankle-brachial index: results from the Action for Health in Diabetes study. Vasc Med 2008;13:225-33.
18. Aboyans V, Criqui MH, Abraham P, et al. Measurement and interpretation of the ankle-brachial index. Circulation 2012;126:2890-909.
19. Husted S, Emanuelsson H, Heptinstall S, et al. Pharmacodynamics, pharmacokinetics, and safety of the oral reversible P2Y12 antagonist AZD6140 with aspirin in patients with atherosclerosis: a double-blind comparison to clopidogrel with aspirin. Eur Heart J 2006;27:1038-47.
20. Cannon CP, Husted S, Harrington RA, et al. Safety, tolerability, and initial efficacy of AZD6140, the first reversible oral adenosine diphosphate receptor antagonist, compared with clopidogrel, in patients with non-ST-segment elevation acute coronary syndrome: primary results of the DISPERSE-2 trial. J Am Coll Cardiol 2007;50:1844-51.
21. Bonaca MP, Scirica BM, Creager MA, et al. Vorapaxar in patients with peripheral artery disease: results from TRA2°P-TIMI 50. Circulation 2013;127:1522-9.
22. Bhatt DL, Fox KA, Hacke W, et al. Clopidogrel and aspirin versus aspirin alone for the prevention of atherothrombotic events. N Engl J Med 2006;354:1706-17.
23. Ostergren J, Sleight P, Dagenais G, et al. Impact of ramipril in patients with evidence of clinical or subclinical peripheral arterial disease. Eur Heart J 2004;25:17-24.
24. Bhatt DL, Steg PG, Ohman EM, et al. International prevalence, recognition, and treatment of cardiovascular risk factors in outpatients with atherothrombosis. JAMA 2006;295:180-9.
25. Cacoub PP, Abola MT, Baumgartner I, et al. Cardiovascular risk factor control and outcomes in peripheral artery disease patients in the Reduction of Atherothrombosis for Continued Health (REACH) Registry. Atherosclerosis 2009;204:e86-92.
26. Monreal M, Alvarez L, Vilaseca B, et al. Clinical outcome in patients with peripheral artery disease. Results from a prospective registry (FRENA). Eur J Intern Med 2008;19:192-7.
27. Cambou JP, Aboyans V, Constans J, et al. Characteristics and outcome of patients hospitalized for lower extremity peripheral artery disease in France: the COPART Registry. Eur J Vasc Endovasc Surg 2010;39:577-85.
28. Bhatt DL, Peterson ED, Harrington RA, et al. Prior polyvascular disease: risk factor for adverse ischaemic outcomes in acute coronary syndromes. Eur Heart J 2009;30:1195-202.
29. Berger JS, Hiatt WR. Medical therapy in peripheral artery disease. Circulation 2012;126:491-500.







