Viện Tim TP.HCM
Nhồi máu cơ tim (NMCT) là một trong các biến chứng nghiêm trọng nhất trong giai đoạn chu phẫu. Các thủ thuật can thiệp mạch vành như nong mạch vành (MV) qua da, phẫu thuật bắc cầu mạch vành (PTBCMV) hoặc làm tan cục máu đông trong lòng MV góp phần tạo nên tình trạng thiếu máu – tái tưới máu cơ tim và những hậu quả hư hại của nó. Trong quá trình gây mê (GM) và phẫu thuật (PT), cũng như giai đoạn sau mổ, nhiều bệnh nhân cũng phải trải qua các giai đoạn thiếu máu cơ tim (TMCT) im lặng kéo dài hoặc ngắn hơn, có thể hồi phục được và cũng dẫn đến tình trạng cơ tim choáng váng (stunning) tương tự.
Sự gia tăng các men tim do hoại tử cơ tim trong giai đoạn chu phẫu là một trong các yếu tố nguy cơ có ý nghĩa đối với tiên lượng lâu dài sau mổ (1) . Do vậy, việc làm giảm nguy cơ NMCT chu phẫu là một trong những ưu tiên hàng đầu trong quá trình xử trí gây mê.
Việc khám phá ra tác dụng bảo vệ cơ tim của thuốc mê hô hấp có ảnh hưởng mạnh đến thực hành gây mê hằng ngày, đặc biệt trong PT tim mạch. Thuốc mê hô hấp có tác dụng ức chế cơ tim dẫn đến giảm nhu cầu tiêu thụ 02 cơ tim,vì vậy có ảnh hưởng thuận lợi trên sự cân bằng cung cầu 02 trong lúc TMCT. Nhiều nghiên cứu thực nghiệm cho thấy thuốc mê hô hấp và khí xenon có tác dụng bảo vệ cơ tim chống lại với các hậu quả do thiếu máu và tái tưới máu qua cơ chế tiền thích nghi với TMCT cục bộ (2).
“Tiền thích nghi với TMCT cục bộ” (preconditioning) là tập cho cơ tim thích nghi với stress gây thiếu máu bằng cách tạo ra nhiều giai đoạn ngắn thiếu máu và tái tưới máu trước khi xảy ra tình trạng thiếu máu cơ tim kéo dài theo sau là giai đoạn tái tưới máu. Là một cơ chế bảo vệ nội sinh mạnh chống lại các hậu quả hư hại do hiện tượng thiếu máu – tái tưới máu, giúp cho cơ tim chịu đựng được tình trạng TMCT kéo dài hơn và giảm kích thước vùng NMCT.
Thuốc mê hô hấp cũng có cơ chế bảo vệ cơ tim tương tự như các stress gây thiếu máu nên được gọi là “tiền thích nghi với TMCT cục bộ bằng dược chất (pharmacological preconditioning).Tình trạng thích nghi với TMCT cục bộ này có thể mang lại nhiều lợi ích khi ứng dụng lâm sàng trong gây mê-phẫu thuật. Đặc biệt trong các tình huống có nguy cơ xảy ra các giai đoạn thiếu máu – tái tưới máu như phẫu thuật tim mạch , mổ mạch máu trên bệnh nhân có nguy cơ tim mạch, lấy cơ quan để ghép tạng… Hơn nữa, tác dụng bảo vệ cơ tim của thuốc mê hô hấp còn mang lại nhiều thuận lợi cho cả các bệnh nhân không có bệnh lý mạch vành trong phẫu thuật ngoài tim phải chịu đựng các giai đoạn thay đổi huyết động bất thường nghiêm trọng trong lúc mổ. Những người này có nguy cơ NMCT chu phẫu loại 2 theo phân loại của Hiệp hội tim mạch Hoa Kỳ/Hiệp hội tim mạch Châu Âu năm 2007.
Cơ chế cơ tim choáng váng sau TMCT
Tất cả những trường hợp giảm có ý nghĩa lưu lượng mạch vành có thể dẫn đến xuất hiện rối loạn chức năng thất. Việc tái thiết lập tưới máu đến vùng cơ tim thiếu máu cũng như điều chỉnh cân bằng cung – cầu 02 cơ tim sẽ dẫn đến phát triển các tổn thương mô có thể hoặc không thể hồi phục được, tuỳ theo mức độ nặng của giai đoạn thiếu máu.
Vì vậy, hội chứng thiếu máu – tái tưới máu được định nghĩa là một tình trạng tổn thương tế bào có liên quan trực tiếp với sự tái tưới máu cũng như thiếu máu đã có trước, dẫn đến tình trạng cơ tim choáng váng, với các biểu hiện như rối loạn nhịp tim, giảm chức năng co bóp cơ tim và tổn thương hệ thống mạch máu vi tuần hoàn của mạch vành (hình 1). Tình trạng ức chế chức năng thất có thể kéo dài cho dù việc tưới máu MV đã được hồi phục hoàn toàn (3,4).
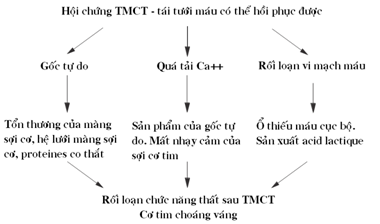
Hình 1: Cơ chế phát triển tình trạng cơ tim choáng váng sau một giai đoạn TMCT- tái tưới máu có thể hồi phục được (5)
TMCT kéo dài dẫn đến kích hoạt tình trạng chết theo chương trình hoặc hoại tử tế bào cơ tim. Khi tế bào thiếu 02 dẫn đến tăng cao nồng độ Ca2+ trong tế bào chất hậu quả là làm mở các lỗ bán thấm của màng trong ty lạp thể (mPTPs: mitochondrial permeability transition-pore). Điều này lần lượt dẫn đến hiện tượng không bắt cặp của chuỗi hô hấp, phóng thích cytochrome C vào tế bào chất, làm giảm nồng độ ATP, gây phù tế bào, sản xuất các gốc tự do, chết tế bào theo chương trình và kết quả là là chết tế bào (6).
Cơ sở của tiền thích nghi với TMCT cục bộ
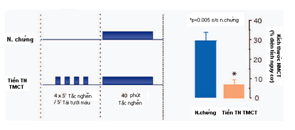
Hình 2: Murry và cs năm 1986. Mô tả hiện tượng tiền thích nghi với TMCT cục bộ trên chó trong nghiên cứu thực nghiệm: tạo ra 4 chu kỳ ngắn gây tắc nghẽn ĐMV trong 5 phút và tái tưới máu 5 phút trước khi gây ra một giai đoạn tắc nghẽn kéo dài hơn (40 phút) đã làm giảm kích thước vùng NMCT một cách có ý nghĩa so với nhóm chứng (7)
Tiền thích nghi với TMCT được mô tả lần đầu tiên bởi Murry và cs năm 1986(7). Trong nghiên cứu này tác giả đã cho thấy một hiện tượng nghịch đảo khi quan sát trên 2 nhóm chó mổ lồng ngực: một nhóm được thực hiện 4 giai đoạn thiếu máu ngắn (gây tắc nghẽn MV 5 phút xen kẽ với giai đoạn tái tưới máu 5 phút) trước một giai đoạn gây tổn thương thiếu máu nghiêm trọng và kéo dài hơn (gây tắc nghẽn MV kéo dài 40 phút và theo sau là 4 ngày tái tưới máu) với nhóm chứng chỉ gây tắc nghẽn MV kéo dài 40 phút. Theo lý thuyết người ta cho rằng nhóm chó nhận 4 giai đoạn TMCT ngắn sẽ có vùng nhồi máu rộng hơn vì nó phải chịu đựng thêm 20 phút thiếu máu nữa. Nhưng điều ngạc nhiên ghi nhận được là vùng nhồi máu ở nhóm chó có các giai đoạn thiếu máu ngắn lại nhỏ hơn nhiều so với nhóm chứng và tác dụng này độc lập với lưu lượng máu của tuần hoàn bàng hệ (hình 2)
Qua nghiên cứu này cho thấy tiền thích nghi với TMCT không ngăn cản được tình trạng chết tế bào, nhưng nó làm chậm xảy ra NMCT. Điều này này có nghĩa là khi quả tim chịu đựng một hoặc nhiều giai đoạn ngắn TMCT sẽ giữ lại trong trí nhớ nó sự tấn công này và đóng vai trò bảo vệ nội sinh, cho phép quả tim dung nạp được tình trạng TMCT kéo dài hơn sau đó. Hiệu quả của tiền thích nghi với TMCT cục bộ là giảm kích thước vùng NMCT, giảm rối loạn chức năng co bóp và rối loạn nhịp do hậu quả của các giai đoạn TMCT – tái tưới máu.
Sau khi báo cáo của Murry được công bố, số lượng các nghiên cứu về tiền thích nghi với TMCT cục bộ đã gia tăng nhanh chóng. Trong 10 năm qua, hơn 5000 bài báo đã được đăng tải (hình 3). Ban đầu hầu hết là các nghiên cứu trên thực nghiệm và sau đó các nghiên cứu trên lâm sàng đã sớm xuất hiện và tiếp tục gia tăng. Điều này minh chứng cho mức độ phát triển và tính hấp dẫn của hiện tượng này đối với các nhà lâm sàng.
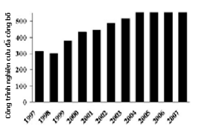
Hình 3: Biểu đồ biểu diễn số lượng bài báo cáo được đăng tải hằng năm trong các y văn tiếng Anh về đề tài bảo vệ cơ tim của tiền thích nghi với TMCT cục bộ từ năm 1997 – 2007(8).
Sau đó, một khám phá lớn vào năm 1993 phát hiện được tiền thích nghi với TMCT cục bộ có 2 giai đoạn, giai đoạn muộn được sinh ra từ giai đoạn sớm: giai đoạn sớm khởi phát gần như ngay tức khắc (chỉ vài phút) sau kích thích tiền thích nghi, kéo dài từ 2 – 4 giờ và giai đoạn muộn xảy ra chậm hơn tái xuất hiện khoảng giờ thứ 24 và tồn tại trong 72 giờ (9) (hình 4).
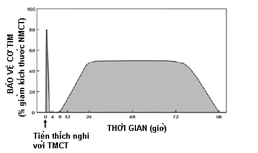
Hình 4: Sơ đồ diễn tả hai giai đoạn bảo vệ. Giai đoạn sớm xảy ra ngay tức khắc nhưng ngắn hơn , kéo dài 2 – 4 giờ. Giai đoạn trễ xảy ra chậm hơn (trong khoảng 12 – 24 giờ) nhưng kéo dài hơn (3 đến 4 ngày). Hình của Marber et al (9)
Cơ chế của 2 giai đoạn này hoàn toàn khác nhau. Giai đoạn sớm xảy ra do sự biến đổi sau sao chép nhanh các proteins đã có trước, trong khi giai đoạn muộn xảy ra bởi sự tổng hợp các proteins bảo vệ cơ tim mới (giải thích cho thời điểm xảy ra muộn của hiện tượng này). Mức độ bảo vệ cũng khác nhau, giai đoạn sớm rất hiệu quả để hạn chế tổn thương thiếu máu – tái tưới máu gây chết người (như NMCT) nhưng không bảo vệ đối với rối loạn chức năng co bóp sau thiếu máu có thể hồi phục được (cơ tim choáng váng). Giai đoạn trể bảo vệ cả NMCT và cơ tim choáng váng, mặc dù kém mạnh hơn giai đoạn sớm để hạn chế kích thước vùng NMCT.
Tiền thích nghi với TMCT là một hiện tượng dẫn truyền từ cơ quan này đến cơ quan khác. Nó cũng được chứng minh TMCT dẫn đến tác dụng bảo vệ cho vùng lân cận của cơ tim và lan truyền đến các nơi khác (tim, gan, thận, hệ tiêu hoá, hệ thần kinh…) bởi hệ tuần hoàn chéo, có thể do cơ chế thể dịch. Tương tự, thiếu máu trong giai đoạn ngắn một cơ quan ở xa như thận, hoặc ống tiêu hoá có thể dẫn đến bảo vệ cơ tim và ngược lại.
Cơ chế bảo vệ cơ tim bởi tiền thích nghi với TMCT cục bộ
Trong giai đoạn sớm, các giai đoạn thiếu máu ngắn dẫn đến trigger tiền thích nghi, gây phóng thích các chất như NO dẫn xuất từ sự tổng hợp NO của nội mạc, adenosine, bradykinin, endothelin và endorphins. Các chất này gắn kết với các thụ thể bắt cặp của protein G (GPCRs) trên bề mặt tế bào cơ tim và kích hoạt nhiều dòng thác dẫn truyền tín hiệu, bao gồm phosphatidylinositol – 3 kinase (PI3K)-Akt (10), các kinase điều hoà tín hiệu ở ngoại bào (Erk1/2), và các yếu tố sao chép như HIF-1 (hypoxia inducible factor) (11) và nuclear factor-kB (12,13).
Hình 5: Các tín hiệu của tiền thích nghi với TMCT cục bộ (14).DAG: diacylglycerol; COX-2: cyclooxygenase type 2; Ca: kênh Ca 2+lệ thuộc điện thế màng sợi cơ vân; PLC/PLD: phospholipaseC/D; AIRed: aldose reductase; Bcl-2= anti-apoptotic protein; eNOS: endothelial NO synthase; G protein: heterotrimeric G proteins; HSP27và HSP70: heat shock proteins; iNOS: inducible NO synthase; IP3: inositol triphosphate; IP3R: inositol triphosphat receptor;K: kênh KATP ty lạp thể và màng sợi cơ vân; MnSOD: managanese superoxide dismutase;NK-kB: nuclear factor –kB; NO: nitric oxide; PIP2: phosphatidylinositol biphosphate; PKC: protein kinase C; ROS: reactive oxygen species; RYR: ryanodine Ca 2+release channels; SERCA 2 = Ca 2+ pump of the SR
Khi gắn kết với các thụ thể bắt cặp của protein G (GPCRs) trên bề mặt tế bào cơ tim, ức chế dòng Ca2+ đi vào tế bào TMCT, tác động trực tiếp lên kênh KATP và bắt đầu hiện tượng phosphoryl hoá, kích hoạt các phospholipase C (PLC) và D (PLD) dẫn đến sản xuất ra DAG (diacyl glycerol) hoặc chuyển đổi vị trí của các protein kinase C (PKC), tyrosine kinase và MAPK (mitogen -activated protein kinase) làm kích hoạt mở kênh KATP của màng tế bào và ty lạp thể phóng thích ra những gốc oxy có hoạt tính (ROS :reactive oxygen species)(15,16).
Các kinase tín hiệu bị kích hoạt như protein kinase C , chịu trách nhiệm cho việc truyền đạt thông tin “tác dụng ghi nhớ” của tiền thích nghi (17).
Việc mở các kênh KATP ty lạp thể gây khử cực màng trong của ty lạp thể dẫn đến giảm ứ đọng Ca2+, duy trì sản xuất ra ATP, tránh mở các lổ bán thấm màng ty lạp thể. Sự kích hoạt các kinase này gây ra hiện tượng điều chỉnh lên các hoạt động của các yếu tố sao chép như NF-kB (nuclear factor -kB), HIF-1 (hypoxie inducible factor). Kích hoạt sự sao chép gene có liên quan đến giai đoạn muộn của hiện tượng tiền thích nghi bởi trung gian NF-kB. Sự điều chỉnh lên của các yếu tố sao chép dẫn đến gia tăng sao chép gene của nhiều chất trung gian khác như tổng hợp nitric oxide là inducible nitrous oxide synthase (iNOs), cyclooxygenase 2 (COX-2), manganese super oxide dismustase (MnSOD), heat shock proteins (HSPs)…
Giai đoạn bảo vệ cơ tim muộn xuất hiện trễ và tương đối kéo dài (24 – 72 giờ sau TMCT) vì có liên quan đến việc tổng hợp các protein mới, chống chết tế bào theo chương trình (apotosis)(17). Các con đường tín hiệu này qua trung gian bảo vệ thế nào và cuối cùng dẫn đến giảm kích thước vùng NMCT hiện nay chưa rõ. Cơ chế có thể là duy trì sản xuất ATP của ty lạp thể, giảm ứ đọng Ca 2+ trong ty thể, giảm sinh ra oxidative stress , ức chế chết tế bào theo chương trình và ngăn ngừa việc mở các lỗ bán thấm của màng trong ty lạp thể ( 17, 18).
Tác dụng bảo vệ cơ tim bởi dược lý
Tiền thích nghi với TMCT cục bộ là một cơ chế bảo vệ sinh lý hấp dẫn, các nhà nghiên cứu thực nghiệm nhanh chóng hướng đến việc tìm kiếm các dược chất có thể gây khởi phát tác dụng này.
Nhiều nghiên cứu đã chứng minh có thể gây tiền thích nghi với TMCT cục bộ bởi một số các dược chất như adenosine ( liên quan với thụ thể A1 và A3), Acetylcholine (M2), Bradykinin (B2), endotheline (ET1), kháng vận của thụ thể adrenergic (a1) và làm mở các kênh KATP như nicorandil.
Trong các thuốc mê, nhóm thuốc á phiện (thụ thể d1) và các thuốc mê hô hấp nhóm halogénés có thể dẫn đến tác dụng tiền thích nghi với TMCT cục bộ. Các chất này thiết kế con đường dẫn truyền tín hiệu kích hoạt tác dụng bảo vệ cơ tim tương tự như tiền thích nghi với TMCT cục bộ, có thể tránh được các tổn thương mạch máu và cơ tim do hậu quả của tắc nghẽn động mạch vành và do đó ít gây tổn thương cơ tim hơn.
Tác dụng bảo vệ cơ tim của nhóm thuốc phiện và thuốc mê tĩnh mạch
Nhiều nghiên cứu đã chứng minh thuốc phiện làm giảm kích thước vùng NMCT. Ngược lại chỉ có ít nghiên cứu về tác dụng của nó trên tình trạng cơ tim choáng váng (19, 20). Kato và cs đã chứng minh fentanyl làm dễ dàng lấy lại chức năng tim sau khi bị TMCT thoáng qua (21). Fentanyl làm giảm kích thước vùng NMCT trên thực nghiệm, nó cho phép cải thiện chức năng tim một phần do giảm bớt số lượng và sự lan rộng của vùng hoại tử trên vi thể (22).
Thụ thể d của thuốc phiện có vai trò bảo vệ cơ tim (23,24,25). Các thụ thể này có nhiều trong hệ thần kinh trung ương và cả trong tim. Trong mô của tâm nhĩ người, có nhiều thụ thể d và m hơn k.
Vai trò các thụ thể của thuốc phiện đã được xác định khi sử dụng naloxone để hoá giải tác dụng của thuốc phiện dẫn đến làm mất tác dụng tiền thích nghi với TMCT cục bộ của nó (26). Trong khi việc tẩy rửa thuốc phiện không huỷ bỏ tác dụng bảo vệ cơ tim của nó. Điều này xác định thuốc phiện có tác dụng tiền thích nghi với TMCT cục bộ (27,28). Liang chứng minh 1 mM morphine có tác dụng bảo vệ tương tự như tác dụng tiền thích nghi do thiếu máu kéo dài trong 5 phút.
Tác dụng tiền thích nghi với TMCT cục bộ của thuốc phiện tương tự như tiền thích nghi với TMCT do stress thiếu máu, xảy ra cả ở giai đoạn sớm và muộn. Thuốc phiện (Morphine, Fentanyl) có tác dụng bảo vệ cơ tim thông qua thụ thể d, đặc biệt là thụ thể d1 (25,29) vì vậy các thuốc có tác dụng ức chế thụ thể d sẽ huỷ bỏ tác dụng bảo vệ cơ tim của morphine và fentanyl(30,24). Tác dụng bảo vệ cơ tim của thuốc phiện bị huỷ bỏ bởi ức chế protein Gi, protein kinase C và kênh KATP. Wang cho rằng thuốc phiện có tác dụng bảo vệ cơ tim qua trung gian sự giảm kết dính và di chuyển của các bạch cầu trung tính (neutrophils) tuy nhiên điều này còn bàn cải (31,32).
Khác với thuốc mê hô hấp, dường như một số thuốc mê tĩnh mạch không có tác dụng bảo vệ chống lại với tình trạng rối loạn chức năng tim kéo dài sau giai đoạn TMCT thoáng qua. Zaugg và cs (33) tìm thấy các thuốc mê tĩnh mạch như R-ketamine, thiopental, pentobarbital có thể huỷ bỏ tác dụng tiền thích nghi thông qua việc ức chế mở kênh KATP của ty lạp thể. Một số nghiên cứu chứng minh propofol có tác dụng bảo vệ cơ tim bởi đặc tính kháng oxýt hoá của nó (anti-oxydante)(24,25,26). Các nghiên cứu thực nghiệm trên trái tim tách rời của động vật cho thấy propofol làm giảm tác dụng của TMCT thoáng qua, giảm kích thước vùng NMCT cũng như các dấu hiệu thoái dưỡng mô học(33,34,35). Tác dụng này không bị huỷ bỏ bởi việc gây ức chế kênh KATP, điều này cho thấy propofol không có tác dụng bảo vệ cơ tim thông qua cơ chế mở kênh KATP.
Ko và cs(36) báo cáo việc sử dụng propofol ở nồng độ cao (100mm) làm giảm tác dụng hư hại cơ học, sinh hoá và mô học dẫn đến bởi các giai đoạn thiếu máu – tái tưới máu trên tim chuột . Các kết quả này không tìm thấy bởi Ebel và cs (37) khi sử dụng propofol ở liều lâm sàng trên tim chuột thực nghiệm. Một báo cáo mới đây của Ansley và cs (38) trên người cho thấy sự cải thiện khả năng kháng oxýt hoá của các hồng cầu trong quá trình chạy THNCT với propofol liều cao (liều bolus 2 – 2,5 mg/kg tiếp theo truyền liên tục 200mg/kg/phút). Nhóm bệnh nhân này có cung lượng tim sau mổ cao hơn nhóm sử dụng propofol ở liều thấp hoặc gây mê với isoflurane. Điều này cho thấy rằng propofol có tác dụng bảo vệ cơ tim khi nồng độ thuốc trong máu rất cao (39).
Tác dụng bảo vệ cơ tim của thuốc mê hô hấp nhóm halogénés
Rất nhiều nghiên cứu thực nghiệm và lâm sàng hướng đến tác dụng bảo vệ cơ tim của thuốc mê hô hấp, chống lại tổn thương thiếu máu và tái tưới máu (39). Isoflurane làm giảm kích thước vùng NMCT ở chó và tác dụng có lợi này vẫn còn tồn tại mặc dù đã ngưng thuốc mê hô hấp trước khi gây tắc nghẽn động mạch vành (40). Hiện tượng này được gọi là tác dụng tiền thích nghi với TMCT cục bộ bởi thuốc mê (anesthetic -induced preconditioning: APC) và đặc trưng bởi một giai đoạn ghi nhớ ngắn tương tự như những gì quan sát được trong quá trình tiền thích nghi với TMCT cục bộ. Tác dụng bảo vệ cơ tim của thuốc mê hô hấp xảy ra độc lập với tác dụng trên cân bằng cung – cầu 02 cơ tim(41).
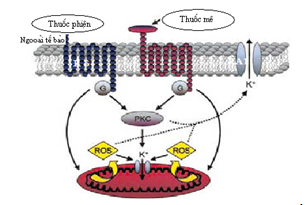
Hình 6: Thuốc mê có tác dụng bảo vệ cơ tim qua trung gian nhiều con đường tín hiệu nội sinh. Sự khởi phát (trigger) bắt đầu một dòng thác các tín hiệu dẫn truyền, dẫn đến là kích hoạt các tác nhân ảnh hưởng cuối làm tăng thêm tình trạng trơ đối với tổn thương thiếu máu. Kênh (KATP) của ty lạp thể có liên quan như là tác nhân ảnh hưởng cuối (end effector) trong sơ đồ bảo vệ này. Nhưng kênh KATP của màng sợi cơ vân có thể cũng có vai trò. Tín hiệu của thuốc mê hô hấp xuyên qua các thụ thể adenosine và thuốc phiện, điều hoà protein G, kích thích protein kinase C (PKC) và các kinase khác trong tế bào , hoặc có tác dụng trực tiếp trên ty lạp thể để sinh ra reactive oxygen species (ROS) mà cuối cùng là làm mạnh thêm hoạt động của kênh KATP. Thuốc mê hô hấp cũng có thể có tác dụng trực tiếp làm dễ dàng mở kênh KATP. Mũi tên chấm chấm mô tả các cơ quan đích trong nội bào có thể được điều hoà bởi thuốc mê hô hấp; mũi tên đậm biểu diễn sức mạnh của các dòng thác tín hiệu. Theo Tanaka K, Ludwig LM, et al, Mechanisms of cardioprotection by volatile anesthetics. Anesthesiology 2004; 100: 707 – 21
Tác dụng tiền thích nghi với TMCT cục bộ của thuốc mê đã được mô tả trên các động vật nghiên cứu như chuột (42), thỏ (43). Hiệu quả của isoflurane là làm giảm kích thước vùng NMCT tuỳ thuộc liều trên chuột (42) và trên các động vật thực nghiệm có lưu lượng tuần hoàn tối thiểu (44). Tương tự, sevoflurane bảo tồn khả năng sống của tế bào cơ tim trong khi bị thiếu máu (45).
Thuốc mê bay hơi có tác dụng dãn động mạch vành do kích hoạt kênh KATP (46) hoặc bởi tác động thuận lợi của Ca2+ thể dịch nội nào trong cơ trơn mạch máu. Sevoflurane làm tăng lưu lượng máu của tuần hoàn bàng hệ đến vùng thiếu máu cơ tim khi áp lực tưới máu được duy trì (47). Sevoflurane cũng cải thiện sự hồi phục chức năng của các phản ứng mạch vành và phóng thích NO trên trái tim tách rời khi bị thiếu máu toàn bộ (48).
Thuốc mê hô hấp làm giảm sự kết dính của các bạch cầu đa nhân trung tính với tiểu cầu (49) và cũng ức chế sản xuất ra cytokine từ các tế bào chết sau tổn thương thiếu máu – tái tưới máu in vitro (50). Thuốc mê hô hấp làm giảm hiện tượng chết tế bào theo chương trình (apoptotic) và chuyển cơ tim vào tình trạng “chống chết tế bào theo chương trình” bởi sự điều hoà của các protein BCL-2 family(51,52).
Thuốc mê có tác dụng bảo vệ cơ tim qua trung gian nhiều con đường tín hiệu nội sinh. Tín hiệu của thuốc mê hô hấp xuyên qua các thụ thể adenosine và thuốc phiện, điều hoà protein G, kích thích protein kinase C và các kinase khác trong tế bào, hoặc có tác dụng trực tiếp trên ty lạp thể để sinh ra những gốc oxy có hoạt tính (ROS) và cuối cùng làm tăng hoạt động của kênh KATP . Thuốc mê hô hấp cũng có tác dụng trực tiếp làm dễ dàng mở kênh KATP dẫn đến tình trạng trơ đối với tổn thương thiếu máu. (hình 6).
Tanaka nhận thấy isoflurane làm giảm tổn thương tế bào cơ tim khi được cho vào 24 giờ trước khi gây tắc nghẽn và tái tưới máu động mạch vành trên tim thỏ thực nghiệm(53). Điều trị trước với isoflurane cũng có tác dụng bảo vệ khả năng sống của nội mạc và tế bào cơ trơn mạch máu 12 – 48 giờ sau tổn thương gây ra bởi cytokine(54). Vì vậy, thuốc mê hô hấp cũng có tác dụng bảo vệ cơ tim ở giai đoạn muộn (cửa sổ thứ hai) tương tự như tiền thích nghi với TMCT cục bộ. Hơn nữa, sevoflurane rút ngắn thời gian của các giai đoạn thiếu máu cần thiết để bảo vệ chống lại NMCT trong quá trình tiền thích nghi với TMCT cục bộ (55). Sevoflurane cũng tăng tác dụng bảo vệ cơ tim vào thời điểm 24 giờ sau kích thích tiền thích nghi với thiếu máu cục bộ lúc ban đầu(43). Các nghiên cứu trên cho thấy rằng việc dùng thuốc mê hô hấp kết hợp với các giai đoạn thiếu máu ngắn có hiệu quả đồng vận bảo vệ cơ tim rất tốt chống lại các hậu quả của tổn thương do thiếu máu – tái tưới máu.
Các thử nghiệm lâm sàng của tiền thích nghi với TMCT cục bộ trên người.
Trong lúc nong MV qua da, nhiều tác giả đã chứng minh được hậu quả của tình trạng bơm phồng và làm xẹp nhanh bóng nong MV trước khi thực hiện nong MV tương tự như tạo ra tình trạng tiền thích nghi với TMCT cục bộ. Kết quả là tổn thương cơ tim ít hơn, biểu hiện bởi giảm ST chêch lên và men tim (56,57,58,59) .
Tiền thích nghi với TMCT cục bộ được chứng minh lần đầu tiên trên người năm 1993(17) thực hiện trên bệnh nhân PTBCMV dưới tuần hoàn ngoài cơ thể (THNCT), gây 2 lần thiếu máu, mỗi lần 3 phút, cách nhau bởi 2 phút tái tưới máu được thực hiện trước khi chạy THNCT trong 10 phút, nhận thấy bảo tồn được ATP trong tế bào cơ tim hơn đối với nhóm chứng không thực hiện tiền thích nghi với TMCT.
Một số nghiên cứu khác trong quá trình mổ tim với THNCT, thực hiện 2 lần kẹp động mạch chủ (ĐMC), mỗi lần 2 phút và tiếp theo sau tái tưới máu 3 phút, rồi mới kẹp ĐMC và truyền dung dịch làm liệt tim máu lạnh. Qua đó các tác giả đã chứng minh được tác dụng bảo vệ cơ tim của tiền thích nghi với TMCT cục bộ trong phẫu thuật tim mạch bởi các thông số sinh hoá(60,61,62) như các gốc tự do, proteins chết theo chương trình hoặc các thông số lâm sàng như loạn nhịp, thay đổi huyết động , men tim…
Ích lợi của tiền thích nghi với TMCT cục bộ của thuốc mê hố hấp trong gây mê tim mạch:
Bellhomme(63) thực hiện tiền thích nghi với TMCT bằng gây mê với isoflurane (2,5 MAC) kéo dài 5 phút trước khi kẹp ĐMC trên các bệnh nhân PTBCMV dưới THNCT. Kết quả là nồng độ troponine I của nhóm isoflurane thấp hơn so với nhóm chứng.
Tương tự, một nghiên cứu khác thực hiện tiền thích nghi với TMCT bởi isoflurane trên bệnh nhân có chức năng thất trái kém (EF <50%) nhận thấy men tim sau mổ (CM-MB, TnI) thấp hơn so với nhóm chứng (64). Haroun đã chứng minh việc cho isoflurane trước khi chạy THNCT dẫn đến cải thiện cung lượng tim và giảm ST chêch lên sau khi ngưng THNCT(65).
Một nghiên cứu đa trung tâm, tiền cứu, kiểm chứng, mù đôi trên 72 bệnh nhân PTBCMV cho thấy hiệu quả bảo vệ cơ tim khi cho sevoflurane (2 MAC) trong 10 phút trong lúc chạy THNCT trước khi kẹp động mạch chủ (66). Tác giả nhận thấy pro-BNP tăng ít hơn sau mổ, chức năng thất sau THNCT ít bị rối loạn hơn, định lượng cystatine C cho thấy duy trì chức năng thận tốt hơn ở nhóm sevoflurane. Không có sự khác biệt có ý nghĩa về pic của troponin T, nhưng tỷ lệ bệnh nhân có troponin T >0,65 mg/L thì ít hơn ở nhóm sevoflurane. Hơn nữa, kết quả sinh thiết tế bào cơ tim trong lúc mổ là một bằng chứng cụ thể nhất. Đó là sự gia tăng của chuyển vị trí của proteine kinase C epsilon tại tế bào cơ tim. Kết quả theo dõi 1 năm sau mổ các bệnh nhân này cho thấy giảm tỷ lệ biến chứng tim mạch ở nhóm bệnh nhân có thực hiện tiền thích nghi với TMCT bởi sevoflurane.
Nghiên cứu của Van der Linder (67), so sánh 2 giai đoạn (mỗi giai đoạn 6 tháng) trước và sau khi đặt bình bốc hơi thuốc mê hô hấp nhóm halogénés trong PT tim mạch. Giai đoạn trước khi đặt bình bốc hơi, bệnh nhân được gây mê tĩnh mạch với midazolam và sufentanil. Giai đoạn sau khi đặt bình bốc hơi, gây mê bằng sevoflurane kết hợp với sufentanil. Tác giả nhận thấy nồng độ troponine T giảm vào ngày thứ hai và ba sau mổ, nhu cầu sử dụng inotrope thấp hơn và tỷ lệ cung lượng tim thấp sau mổ ít hơn ở nhóm được gây mê sevoflurane.
Kết quả nghiên cứu trên các bệnh nhân có nguy cơ cao (> 70 tuổi, hẹp 3 nhánh MV, FE<50%) cho thấy cung lượng tim tốt hơn sau mổ, giảm nhu cầu sử dụng inotrope, cải thiện chức năng thất trái, nồng độ troponine I thấp hơn ở nhóm bệnh nhân được gây mê bằng sevoflurane(68).
Một nghiên cứu ngẫu nhiên của Hertz và cs so sánh giữa gây mê hô hấp (sevoflurane và desflurane) với gây mê tĩnh mạch propofol cho bệnh nhân PTBCMV dưới THNCT nhận thấy cải thiện sự hồi phục chức năng cơ tim sau THNCT, nồng độ cTnI/huyết tương thấp hơn, nhu cầu sử dụng inotrope thấp hơn, thời gian nằm hồi sức và nằm viện ngắn hơn (69) ở nhóm gây mê hô hấp.
Garcia và cs(70) theo dõi các biến chứng tim mạch 1 năm sau mổ trên 72 bệnh nhân mổ tim dưới THNCT cho thấy tỷ lệ biến chứng và tử vong sau mổ trên nhóm bệnh nhân được gây mê bằng sevoflurane thấp hơn so với nhóm chứng.
Tác dụng bảo vệ cơ tim của sevoflurane diễn tả bởi sự giảm nồng độ troponin I và hồi phục nhanh chóng chức năng tâm thu và tâm trương của tim sau THNCT cũng được quan sát thấy ở bệnh nhân thay van ĐMC. Điều này đặc biệt quan trọng ở BN có bệnh lý cơ tim phì đại nặng, việc bảo vệ tối ưu cơ tim có thể khó đạt được(71).
Các nghiên cứu phân tích gộp trên việc sử dụng thuốc mê bay hơi trong quá trình PTBCMV với THNCT cho thấy rằng các bệnh nhân được gây mê với thuốc mê hô hấp có nồng độ cTnT thấp hơn, cung lượng tim sau mổ cao hơn, nhu cầu cần hỗ trợ inotrope thấp hơn, thời gian thở máy và nằm viện ngắn hơn. Tuy nhiên, không có sự khác biệt có ý nghĩa về tần suất NMCT chu phẫu và tỷ lệ tử vong(72,73).
Các nghiên cứu phân tích gộp so sánh gây mê hô hấp với gây mê tĩnh mạch trong quá trình PTBCMV trên toàn bộ 34.000 bệnh nhân, cho thấy tỷ lệ trong vòng 30 ngày thì thấp hơn ở nhóm bệnh nhân gây mê hô hấp (74).
Một nghiên cứu phân tích gộp bởi Landoni và cs (75) kết hợp ngẫu nhiên 22 nghiên cứu trên 1922 bệnh nhân được chọn ngẫu nhiên gây mê với sevoflurane và desflurane hoặc propofol (TIVA) nhận thấy giảm tỷ lệ tử vong và biến chứng sau mổ tim trên nhóm bệnh nhân được gây mê với thuốc mê hô hấp. Biến chứng NMCT của nhóm thuốc mê hô hấp thấp hơn có ý nghĩa (2,4%) so với nhóm propofol (5,1%). Hơn nữa những nguyên nhân tử vong tại bệnh viện cũng thấp hơn có ý nghĩa ở nhóm thuốc mê hô hấp (0,4%) so với TIVA (1,6%). Nồng độ cTnI của nhóm thuốc mê hô hấp thấp hơn, giảm nhu cầu inotrope và rút ngắn thời gian thở máy và thời gian nằm viện.
Meco và cs(76) quan sát thấy nồng độ cTnT và pro-BNP thấp hơn ở nhóm sử dụng desflurane trước khi kẹp ĐMC trong PTBCMV với THNCT cũng như cải thiện chức năng tâm trương của thất trái, được diễn tả bởi tăng vận động của vòng van 2 lá vào giai đoạn đầu của thì tâm trương.
Phân tích hồi cứu trên 10.000 bệnh nhân sau mổ tim, không thấy có sự khác biệt về tỷ lệ tử vong sau mổ và NMCT chu phẫu giữa 2 nhóm gây mê với propofol và sevoflurane(77). Tỷ lệ tử vong thấp hơn chỉ quan sát được ở nhóm bệnh nhân gây mê với sevoflurane mà không có bệnh lý mạch vành không ổn định sớm hơn, điều này hỗ trợ cho giả thiết là tiền thích nghi với TMCT của thuốc mê chỉ có tác dụng bảo vệ nhẹ trên quả tim đã bị ảnh hưởng bởi tiền thích nghi.
Nghiên cứu tiền cứu mù đôi trên 414 bệnh nhân PTBCMV dưới THNCT được chia làm 3 nhóm: Desflurane, Sevoflurane, và gây mê tĩnh mạch (TIVA). Theo dõi 1 năm sau mổ cho thấy tỷ lệ tử vong sau mổ ở nhóm TIVA là 12,3%, nhóm sevoflurane là 3,3% và Desflurane là 6,7%. Không có sự khác biệt có ý nghĩa về cTnI(78).
Thời gian và phương pháp ứng dụng thuốc mê bay hơi trong quá trình mổ tim để đạt được hiệu quả bảo vệ cơ tim tối đa.
Để đạt được hiệu quả bảo vệ cơ tim, thuốc mê hô hấp phải được dùng đúng thời điểm và đủ nồng độ. Tuy nhiên, phương pháp hiệu quả nhất về việc sử dụng nó trong mổ tim thì chưa biết. Trong phần lớn các nghiên cứu thực nghiệm, tác dụng bảo vệ của nó quan sát được ở nồng độ > 1MAC và thời gian sử dụng thuốc mê từ 10 – 30 phút (79).
Dưới điều kiện thực nghiệm, sevoflurane dẫn đến giảm kích thước vùng NMCT và nồng độ men tim thấp hơn, tăng ATP trong cơ tim và cải thiện chức năng thất trái (80). Nồng độ CK-MB và troponin thì thấp hơn ở nhóm sử dụng sevoflurane ngắt quãng trước THNCT so với nhóm sử dụng liên tục sevoflurane hoặc gây mê với propofol (81). Tuy nhiên, việc tiếp xúc ngắt quãng 3 lần, mỗi lần 10 phút với desflurane ở nồng độ ½ MAC dẫn đến tác dụng tiền thích nghi tương đương với tiếp xúc liên tục với desflurane ở nồng độ 1 – 1,5 MAC(82). Việc sử dụng sevoflurane ở nồng độ cao hơn, hoặc kéo dài hơn không làm tăng thêm tác dụng bảo vệ cơ tim. Các tác giả đã hướng đến các giả thuyết hấp dẫn là việc tiếp xúc ngắt quãng sevoflurane có thể dẫn đến việc thúc đẩy gia tăng nồng độ ROS, điều này thì quan trọng để kích hoạt cơ chế bảo vệ cơ tim.
Gần đây, có nhiều bài báo đăng tải về việc phân tích tác dụng thiếu máu và tiền thích nghi của thuốc mê trong lúc tái tưới máu. Các tác dụng hậu thích nghi với TMCT của thuốc mê cũng đã được chứng minh với isoflurane, sevoflurane, desflurane. Kết hợp cả tiền thích nghi và hậu thích nghi với TMCT bởi sevoflurane có hiệu quả bảo vệ cơ tim tốt hơn so với chỉ đơn thuần tiền thích nghi trước khi thiếu máu (83).
Hơn nữa, tác dụng bảo vệ cơ tim của desflurane quan sát được khi thuốc này được dùng cả trước và sau khi thiếu máu (79). Trong trường hợp tác dụng hậu thích của thuốc mê bảo vệ tim chống lại với tình trạng tổn thương tái tưới máu, khi đó nên cho thuốc mê vào giai đoạn sớm của tái tưới máu. Người ta nhận thấy cho sevoflurane trong vòng 2 phút đầu của tái tưới máu sẽ dẫn đến giảm kích thước vùng NMCT mà điều này sẽ không cải thiện nếu cho sau 5 – 10 phút (84).
Bảo vệ cơ tim trong phẫu thuật ngoài tim
Từ nhiều năm qua, tác dụng bảo vệ cơ tim của thuốc mê hô hấp trong phẫu thuật tim mạch cũng như các PT ngoài tim trên các bệnh nhân có bệnh lý mạch vành với nguy cơ biến chứng tim mạch cao đã được chứng minh. Một số thử nghiệm lâm sàng cho thấy nồng độ troponin thấp ở nhóm bệnh nhân được gây mê với thuốc mê hô hấp trong các PT ngoài tim.
Một phân tích gộp của 79 thử nghiệm lâm sàng trên 6129 bệnh nhân, không cho thấy khác biệt có ý nghĩa giữa gây mê với sevoflurane, desflurane so với propofol (85). Cho đến hiện nay các thử nghiệm không xác định rõ ràng về việc sử dụng thuốc mê hô hấp cho những bệnh nhân có nguy cơ cao NMCT và TMCT chu phẫu trong các PT ngoài tim(86).
Tuy vậy, dựa vào nhiều kết quả nghiên cứu đã chứng minh tác dụng vượt trội của thuốc mê hô hấp trên tim. Năm 2007 Hiệp hội tim mạch Hoa Kỳ/ Trường môn tim mạch Hoa Kỳ đã đưa ra khuyến cáo về việc sử dụng thuốc mê hô hấp trong các PT ngoài tim cho các bệnh nhân có nguy cơ cao NMCT chu phẫu (87).
Tác dụng của thuốc mê hô hấp trên phản ứng viêm
Việc kích hoạt phản ứng viêm do tác dụng inotrope âm tính của một số chất trung gian có thể dẫn đến suy tuần hoàn sau PT tim mạch. Nhiều thông số nghiên cứu cho thấy thuốc mê hô hấp có khả năng hạn chế các phản ứng viêm, cho dù là điều này không phải luôn luôn có tác dụng bảo vệ nội mạc mạch máu dưới điều kiện thiếu máu – tái tưới máu. Một nghiên cứu tiến hành trên chuột cho thấy dưới nồng độ 1 MAC của isoflurane và sevoflurane, kích thích bạch cầu đa nhân trung tính do yếu tố kích hoạt tiểu cầu dẫn đến việc sản xuất những gốc oxy có hoạt tính thấp hơn và không có khả năng gây rối loạn chức năng tim (88). Hơn nữa, isoflurane dẫn đến làm hạn chế tác dụng của cytokines trên sự nuôi cấy của tế bào cơ trơn của chuột và tế bào nội mạc người đã được mô tả (50).
Ở bệnh nhân gây mê với sevoflurane, làm giảm sự tiết ra TNT-a trong quá trình PTBCMV với THNCT (89) . Hơn nữa, gây mê với sevoflurane kết hợp với giảm sự kích hoạt các phản ứng viêm được xác định dựa trên tỷ lệ CD-11b/CD18 và IL-6 cũng như nồng độ TNF-a (90). Trong quá trình PTBCMV dưới THNCT, sevoflurane dẫn đến giảm có ý nghĩa IL-6 và IL-8 (91). Cũng quan sát được rằng sevoflurane làm giảm sự kích hoạt của mRNA gây kết dính các phân tử, TNF-a và IL-8 trong khi desflurane thì ngược lại (92).
Tuy nhiên, những hiểu biết hiện nay về tác dụng trên phản ứng viêm của thuốc mê bay hơi thì còn chưa hoàn chỉnh và không cho phép kết luận lâm sàng quan trọng. Cần phải thêm nhiều nghiên cứu khác để giải thích cơ chế và đánh giá lâm sàng của thuốc mê hô hấp trên phản ứng viêm dẫn đến bởi chấn thương ngoại khoa và thiếu máu.
Một số yếu tố làm hạn chế tác dụng bảo vệ cơ tim của thuốc mê hô hấp
Có nhiều yếu tố làm hạn chế tác dụng có lợi của thuốc mê hô hấp trên tim. Người ta tìm thấy tác dụng bảo vệ của hậu thích nghi của desflurane không quan sát được khi đã dùng thuốc chẹn bêta (93) vào giai đoạn tiền mê. Hơn nữa, nhiều nghiên cứu thực nghiệm cho thấy hiệu quả bảo vệ cơ tim của thuốc mê hô hấp có thể thấp hơn ở người già (94). Đường huyết chu phẫu cao cũng hạn chế tác dụng tiền thích nghi của thuốc mê. Tăng đường huyết (cả cấp và mạn) đều làm tăng nguy cơ tổn thương cơ tim do thiếu máu. Các con đường tín hiệu bảo vệ nội sinh thì bị hư hại, và lưu lượng mạch vành đến vùng cơ tim thiếu máu bị giảm trong lúc đường huyết cao. Nhiều nghiên cứu đã chứng minh có mối liên quan chặt chẽ giữa tăng đường huyết chu phẫu với tăng nguy cơ tử vong và biến chứng sau mổ tim (95,96,97).
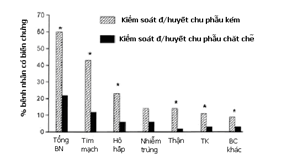
Hình 5: Tần suất tử vong tại bệnh viện ở bệnh nhân được kiểm soát tốt đường huyết trong lúc mổ so với bệnh nhân kiểm soát đường huyết không tốt. CV: biến chứng tim mạch, Inf: biến chứng nhiễm trùng, Neuro: thần kinh, resp: biến chứng HH; * p< 0,5 so với kiểm soát tốt . Từ nghiên cứu của Outtare và cs( 98)
Nghiên cứu tiền cứu của Ouattara và cs(98) trên 200 bệnh nhân dưới PTBCMV cho thấy sự kết hợp có ý nghĩa giữa tăng đường huyết chu phẫu (đường máu > 200 mg/dL) và kết quả sau mổ xấu so với nhóm bệnh nhân được kiểm soát tốt đường huyết trong lúc mổ (hình 5). Việc kiểm soát đường huyết không đủ cũng sẽ ảnh hưởng đến tác dụng tiền thích nghi của thuốc mê. Đường huyết cao làm mất tác dụng của bảo vệ cơ tim của thuốc mê hô hấp trên các loài động vật thực nghiệm có bị hoặc không bị tiểu đường(99,100,101,102).
Bệnh nhân tiểu đường điều trị với thuốc giảm đường huyết dạng uống sulfonylurea như glibenclamide hầu như không thuận lợi cho bất kỳ dạng tiền thích nghi với TMCT nào. Đích của sulfonylurea là kênh ATP trong tế bào b của tuyến tuỵ cũng có trong ty lạp thể và màng tế bào cơ tim (103) .Sự kích hoạt chúng cũng liên quan đến cả sự khởi phát (trigger) và hiệu quả tiền thích nghi của cơ tim. Tác dụng tiền thích nghi do cơ chế thiếu máu hay bởi thuốc mê hô hấp đều bị phá huỷ bởi thuốc sulfonylurea. Vì vậy thuốc điều trị tiểu đường dạng uống nên ngưng 24 – 48 giờ trước mổ chương trình. Thay bằng insulin truyền tĩnh mạch để duy trì đường huyết ở mức bình thường. Insulin làm tăng thêm tác dụng có lợi kích hoạt các con đường sống của tế bào gồm con đường lệ thuộc phosphatidylinositol 3′-kinase/Akt để làm giảm kích thước vùng nhồi máu và chết tế bào cơ tim theo chương trình (104).
Hậu thích nghi với TMCT cục bộ (myocardial postconditionning)
“Hậu thích nghi với TMCT cục bộ” (postconditioning) dẫn đến bởi việc thực hiện xen kẽ các giai đoạn TMCT và tái tưới máu hoặc bảo vệ cơ tim bằng dược chất (thuốc mê bay hơi) vào giai đoạn cuối của quá trình thiếu máu dẫn đến giảm kích thước vùng NMCT. Ý niệm này được đưa ra lần đầu bởi Zhao và cs năm 2003 (105). Thực hiện 3 giai đoạn gây tắc nghẽn động mạch vành trái trước xuống (left anterior descending artery) mỗi lần kéo dài 30 giây xen kẽ với tái tưới máu, ngay tức khắc theo sau là giai đoạn gây tắc nghẽn 1 giờ, dẫn đến giảm có ý nghĩa kích thước vùng nhồi máu cơ tim. Từ đó , hậu thích nghi với TMCT cục bộ đã được chứng minh trên thực nghiệm (in vivo) ở nhiều loài động vật khác nhau, cũng như ex vivo trên tế bào cơ tim chuột và trên tim chuột. Tương tự với tiền thích nghi với TMCT trên thỏ, thuốc mê bay hơi cũng đã được tìm thấy có tác dụng bảo vệ cơ tim khi cho vào lúc cuối của chỉ số thiếu máu và tái tưới máu sớm (đó là tác dụng hậu thích nghi với TMCT của thuốc mê hô hấp) (106) .
Cơ chế bảo vệ cơ tim của hậu thích nghi với TMCT
Cơ chế chính xác của hậu thích nghi với TMCT để làm giảm kích thước vùng NMCT thì chưa rõ. Điều tìm thấy của các nghiên cứu gợi ý rằng tác dụng bảo vệ tuỳ thuộc vào sự kích thích thụ thể adenosine, kích hoạt các kinase sống còn (PI3K – Akt) (107), Erk1/2 và ức chế sự mở các lỗ bán thấm màng trong ty lạp thể ( mPTP)(108) (hình 7). Hậu thích nghi với TMCT cũng kèm theo bởi giảm các yếu tố trung gian gây tổn thương tái tưới máu của tế bào cơ tim như oxidative stress, các yếu tố chết tế bào theo chương trình, và ứ đọng bạch cầu đa nhân trung tính (105). Hậu thích nghi với TMCT cục bộ có cùng cơ chế bảo vệ cơ tim như tiền thích nghi. Gần đây, Lucchinetti và cs (109) đã chứng minh rõ ràng các đáp ứng chống lại TMCT của hệ gen trong quá trình tiền và hậu thích nghi với TMCT cục bộ.
Như tiền thích nghi, thuốc mê hô hấp được tìm thấy có tác dụng bảo vệ cơ tim đối với TMCT và tái tưới máu cũng như khi cho thuốc trong giai đoạn tái tưới máu. Nhiều nghiên cứu trên các động vật thực nghiệm đã chứng minh tác dụng bảo vệ cơ tim bởi hậu thích nghi với TMCT (106,110,111,112) .
Các thuốc mê hô hấp có tác dụng bảo vệ cơ tim khi cho trong lúc tái tưới máu. Trên thú vật thực nghiệm ở thỏ, cho desflurane và sevoflurane trong 15 phút đầu của tái tưới máu làm giảm kích thước vùng hoại tử cơ tim và cải thiện chức năng co bóp khi tái tưới máu (112,113,114) .
Một nghiên cứu gần đây, cho sevoflurane nồng độ 1MAC trong 2 phút vào giai đoạn đầu của tái tưới máu cơ tim làm giảm thể tích vùng nhồi máu (115) .
De Hertz và cs(69) đã báo cáo tác dụng tiền thích nghi và hậu thích nghi với TMCT trên 2 nhóm bệnh nhân PTBCMV với THNCT với cho ngủ bằng sevoflurane trong toàn bộ cuộc mổ so với gây mê tĩnh mạch bằng propofol . Kết quả sau mổ cho thấy nhóm sevoflurane có chức năng thất trái tốt hơn, ít tổn thương cơ tim hơn (nồng độ troponine I thấp hơn). Điều này xác định tác dụng cộng của tiền và hậu thich nghi với TMCT cục bộ của sevoflurane. Tác dụng bảo vệ cơ tim rõ ràng nhất khi cho sevoflurane trong toàn bộ quá trình thiếu máu, kết quả là giảm tổn thương cơ tim và rút ngắn thời gian nằm viện.
Kết luận:
Sự hiểu biết về cơ chế tiền thích nghi với TMCT cục bộ của thuốc mê hô hấp ngày càng được phát triễn rộng rãi. Từ kết quả cuả các nghiên cứu gốc và phân tích gộp đã xác định tác dụng vượt trội của thuốc mê hô hấp trên tim, trên kết quả lâm sàng và tiên lượng lâu dài của các bệnh nhân dưới PT tim mạch cũng như trên những bệnh nhân có nguy cơ cao tim mạch trong các PT ngoài tim. Chính điều này đã thu hút được sự quan tâm và lựa chọn của các nhà lâm sàng trong thực hành gây mê hằng ngày, khi phải đối diện với những bệnh nhân chức năng tim mạch hạn chế, nguy cơ cao TMCT, NMCT chu phẫu, cần phải thực hiện các phẫu thuật tim mạch hoặc các phẫu thuật ngoài tim. Nhằm mục đích phòng ngừa và giảm thiểu các biến chứng tim mạch, rút ngắn thời gian nằm hồi sức, thời gian nằm viện và giảm bớt chi phí điều trị.
TÀI LIỆU THAM KHẢO
1.Oscarsson A, Eintrei C, Anskar S, Engdahl O, Fagerstrom L, Blomqvist P, Fredriksson M Swahn E: Troponin T-values provide long-term prognosis in elderly patients undergoing non-cardiac surgery. Acta Anaesthesiol Scand 2004; 48: 1071-1079.
2. Mio Y, Hee shim Y, Richards E, Bosnjak ZJ, Pagel PS, Bienengraeber M: Xenon preconditioning: the role of prosurvival ignaling, mitochondrial permeability transition and bioenergetics in rats. Anesth Analg 2009; 108: 858-866.
3. Bolli R., Triana J.F., Jeroudi M.O. Prolonged impairment of coronary vasodilation after reversible ischemia. Evidence for microvascular “stunning” , Circ. Res., 1990; 67 (2): 332 – 343.
4. Bolli R. Mechanism of myocardial “stunning”. Circulation 1990; 82 (3): 723 – 738.
5. Van Der Linden, S. De Hert. Effect bénéfique potentiels des agents anesthésique volatils. Le risque cardiaque de l’anesthésie – La mémorisation périopératoire. Journées d’Enseignement Post -Universitaire d’Anesthésie et de Réanimation 2003, p.75.
6. Zhi-Qing Z, Vinten-Johansen J: Postconditioning: reduction of reperfusion induced injury. Cardiovascular Research 2006; 70: 200-211.
7. Murry CE, Jennings RB, Reimer KA. Preconditioning with ischemia: a delay of lethal cell injury in ischemic myocardium. Circulation 1986 ; 74 : 1124-36.
8. Julie Huffmyer , Jacob Raphael. Physiology and Pharmacology of myocardial Preconditioning and postconditioning. Seminars in cardiothoracic and Vascular Anesthesia, Volum 13 Number 1, 3 – 2009, pp 5 – 18.
9. Marber MS, Latchman DS, Walker JM, Yellon DM. Cardiac stress protein elevation 24 hours after brief ischemia or heat stress is associated with resistance to myocardial infarction . Circulation 1993; 88: 1264 – 1272.
10. Hausenloy DJ, Tsang A, Mocanu MM, Yellon DM, Ischemic preconditioning protects by activating prosurvival kinases at reperfusion. Am J Physiol Heart Circ Physiol 2005; 288: H 971 – H 976.
11. Cai Z, Manalo DJ, Wei G, et al. Hearts from rodents exposed to intermittent hypoxia or erythropoietin are protected against ischemia-reperfusion injury. Circulation 2003; 108: 79 – 85.
12. Valen G. Signal transduction through nuclear factor kappa B in ischemia – reperfusion and heart failure . Basic Res Cardiol . 2004; 99: 1 – 7.
13. Zhong C, Zhou Y, Lui H. Nuclear factor kappa B and anesthetic preconditioning during myocardial ischemia- reperfusion . Anesthesiology 2004; 100: 540 – 546.
14.Zaugg M, Lucchinetti E, Uecker M, et al. Anaesthetics and cardiac preconditioning. Part I. Signalling and cytoprotective mechanisms. Br J Anaesth 2003 ; 91 : 551-65.
15.Garlid KD, Paucek P, Yarov – Yarovoy V, et al. Cardioprotective effect of diazoxide and its interaction with mtochondrial ATP- sensitive K+ channels. Possible mechanism of cardioprotection . Circ Res. 1997; 81: 1072 – 1082.
16. Vanden Hoek TL, Becker LB, Shao Z, Li C, Schumacker PT. Reactive oxygen species released from mitochondrial during brief hypoxia induce preconditioning in cardiomyocytes. J Biol Chem. 1998; 273: 18092 – 18098.
17. Yellon DM, Downey JM, Preconditioning the myocardium: from cellular physiology to clinical cardiology . Physiol Rev. 2003; 83: 1113 – 1151
18.Hausenloy DJ, Maddock HL, Baxter GF, Yellon DM. Inhibiting mitochodrial permeability transition pore opening: a new paradigm for myocardial preconditioning ? Cardiovasc Res 2002; 55: 534 – 543.
19. White J.L. Myers A.K. Function recovery of stunned myocardial is grater with halothane than fentanyl anaesthesia in dogs. Br Janaesth 1994; 73 (2): 214 – 219.
20. Ross S., Munoz H. et al. A comparision of the effects of fentanyl and propofol on left ventricular contractility during myocardial stunning . Acta Anaesthesiol . Scand 1998; 42 (1): 23 – 31.
21. Kato R, Foex P. Fentanyl reduces infarction but not stunning via delta-opioid receptors and protein kinase C in rats. Br.J.Anaesth. 2000; 84(5): 608 – 614.
22.Tsuchida A., Miura T., Tanno M., et al. time window for the contribution of the delta – opioid receptor to cardioprotection by ischemic preconditioning in the rat heart. Cardiovascular drugs and therapy sponsored by the International Society of cardiovascular Pharmacotherapy 1998; 12 (4): 365 – 373.
23. Schultz J.J., Hsu A.K., Gross G.J. ischemic preconditioning and morphine -induced cardioprotection involve the delta -opioid receptor in the intact rat heart. J. Mol Cell. Cardiol 1997: 29 (8): 2187 – 2195.
24. Bell S.P., Sack M.N., Patel A. et al. Delta opioid receptor stimulation mimics ischemic preconditioning in human heart muscle. J Am Coll Cardiol 2000; 36 (7): 2296 – 2302.
25. Chien G.L., mohtadi K., Wolf R.A., et al. Naloxone blockade of myocardial ischemic preconditioning does not required central nervous system participation . Bacs Res Vardiol 1999; 94 (2): 136 – 143.
26. B.T., Gross G.J. Direct preconditioning of cardiac myocytes via opioid receptors and KATP channels. Circ. Res. 1999; 84 (12): 1396 – 1400.
27. Aitchison K.A., Baxter G.F., Awan M.M., et al. Opposing effects on infarction of delta and kappa opioid -receptor activation in the isolated rat heart : implications for ischemic preconditioning. Basic Res. Cardiol., 2000 ; 95 (1) : 1 – 10.
28. Fryer R.M., Hsu A.K., Eells J.T. et al. Opioid-induced second window of cardioprotection potential role of mitochondrial KATP channels. Circ Res. 1999; 84 (7): 846 – 851.
29. McPherson B.C., Yao . Signal transduction of opioid -induced cardioprotection in ischemic-reperfusion . Anesthesiology 2001; 94(6): 1082 – 1088.
30. Takasaki Y., Wolff R.A., Chien G.L.. Mẹt-enkephalin protects isolated adult rabbit cardiomyocytes via delta -opioid receptor. Am J physiol 1999; 277 (6 – 2) : H2442 – H 2450.
31.Wang T.L., Chang H., Hung C.R., et al. Attenuation of neutrophil and endothelial activation by intravenous morphine in patients with acute myocardial infarction . Am J cardiol 1997, 80 (12): 1532 – 1535.
32. Szekely A., Heindl B., zahler S, Conzen P.F., Becker B.F. Nonuniform behavior of intravenous anesthetics on postischemic adhesion of neutrophils in the guinea pig heart. Anesth Analg 2000; 90 (6): 1293 – 1300.
33.Murphy P.G., Myers D.S. The antioxidant potential of propofol (2,6 diisoprophylphenol). Br J Anaesth 1992; 68: 613 – 618.
34. Kokita N., Hara A. Propofol attenuates hydrogen peroxide -induced mechanical and metabolic deranements in the isolated rat heart. Anesthesiology 1996; 84: 117 – 127.
35. Ansley D.M., Lee J.U., Godin D.V. et al. Propofol enhances red cell antioxidant capacity in swine anfd human. Can J Anaesth 1998; 45: 233 – 239.
36. Ko SH, yu C.W. et al. Propofol attenuates ischemia -reperfusion injury in the isolated rat heart . Anesth Analg 1997; 85 (4): 719 – 724.
37. Ebel D., Schlack W., Comfère T et al. Effect of propofol on reperfusion injury after regional ischaemia in the isolated rat heart . Br J Anaesth 1999 83 903 – 908
38. Ansley D.M., Sun J., Visser W.A., et al . High dose propofol enhances red cell antioxidant capacity during CBP in humans. Can J Anaesth 1999; 46: 641 – 648
39. Tanaka K, Ludwig LM, Kersten JR, Pagel PS, Warltier DC. Mechenisms of cardioprotection by volatile anesthetics. Anesthesiology 2004; 100: 707 – 721.
40. Kersten JR, Schmeling TJ, Pagel PS, Gross GJ, Warltier DC. Isoflurane mimics ischemic preconditioning via activation of K (ATP) channels: reduction of myocardial infarct size with an acute memory phase. Anesthesiology , 1977; 87: 361 – 370.
41.Perrault LP, Menasche P, Bel A, et al. Ischemic preconditioning in cardiac surgery: a word of caution. J Thorac Cardiovasc Surg 1996 ; 112 : 1378-86.
42. Ludwig LM, Patel HH, Gross GJ. Morphine enhances pharmacological preconditioning by isoflurane : role of mitochondrial K(ATP) channels and opioid receptors. Anesthesiology 2003; 98: 705 – 711.
43. Cason BA, Gamperl AK, Slocum RE, Hickey RF. Anesthetic- induced preconditioning : previous administration of isoflurane decreases myocardial infarct size in rabbits. Anesthesiology 1997; 87: 1182 – 1190
44. Maxwell MP, Hearse DJ, Yellon DM. Species variation in the coronary collateral circulation during regional myocardial ischaemia: a critical determinant of the rate of evolution and extent of myocardial infarction. Cardiovasc Res. 1987; 21: 737 – 746.
45. Zaugg M, Lucchinetti E, Spahn DR, Pasch T, Schaub MC. Volatile anesthetics mimic cardiac preconditioning by priming the activation of mitochondrial K(ATP) channels via multiple signaling pathways. Anesthesiology 2002; 97: 4 – 14.
46. Cason BA, Shubayew I, Hickey RF, Blockade od adenosine triphosphate – sensitive potassium channels eliminates isoflurane -induced coronary artery vasodilation . Anesthesiology 1994; 81: 1245 – 1255.
47.Kersten JR, Schmeling T, Tessmer J, Hettrick DA, Pagel PS, Warltier DC. Sevoflurane selectively increases coronary collateral blood flow independent of KATP channels in vivo. Anesthesiology 1999; 90: 245 – 256.
48.Novalija E, Fujita S, Kampire JP, Stowe DF. Sevoflurane mimics ischemic preconditioning effects on coronary flow and nitric oxide release in isolated hearts. Anesthesiology 1999; 91: 701 – 712.
49. Kowalski C, Zahler S, Becker BF, et al. Halothane, isoflurane and sevoflurane reduce postischemic adhesion of neutrophils in the coronary system. Anesthesiology 1997; 86: 188 – 195.
50. de Klaver MJ, Manning L, Palmer LA, Rich GF. Isoflurane pretreatment inhibits cytoline- induced cell death in cultured rat smooth muscle cells and human endothelial cells. Anesthesiology 2002; 97: 24 – 32.
51. Raphael J, Abedat S, Rivo J et al, Volatile anesthetic preconditioning attenuates myocardial apotosis in rabbits after regional ischemia and reperfusion via Akt signaling and modulation of Bcl-2 family proteins. J. Pharmacol Exp Ther.2006; 318: 186 – 194.
52. Jamnicki -Abegg M, Weihrauch D, Pagel PS, et al. Isoflurane inhibits cardiac myocyte apoptosis during oxidative and inflammatory stress by activating Akt and enhancing Bcl-2 expression. Anesthesiology 2005; 103: 1006 – 1014.
53. Tanaka K, Ludwig LM, Krolikowski JG et al. Isoflurane produces delayed preconditioning against myocardial ischemia and reperfusion injury: role of cyclooxygenase-2. Anesthesiology 2004; 100: 525 – 531.
54. de Klaver MJ, Buckingham MG, Rich GF. Isoflurane pretreatment has immediate and delayed protective effects against cytokine-induced injury in endothelial and vascular smooth muscle cells. Anesthesiology 2003; 99: 896 – 903.
55. Toller WG, Kersten JR, Pagel PS, Hettrick DA, Warltier DC. Sevoflurane reduces myocardial infarct size and decreases the time threshold for ischemic preconditioning in dogs. Anesthesiology 1999; 91: 1437 – 1446.
56. Walker DM, Walker JM, Pugsley WB, Pattison CW. Precondtioning in isoated superfused human muscle. J Mol Cell Cardiol . 1995; 27: 1349 – 1357.
57. Rezkalla SH, Kloner RA. Ischemic preconditiong and preinfarction angina in the clinical arena. Nat Clin Pract Cardiovasc Med 2004; 1: 96 – 102.
58. Tomai F, Crea F, Gaspardone A, et al. Ischemic preconditioning during coronary angioplasty is prevented by glibenclamide, a selective ATP-sensitive K+ channel blocker. Circulation 1994; 90: 700 – 705
59. Laskey WK, Beach D, Frequency and clinical significance of ischemic preconditioning during percutaneous coronary intervention. J Am Coll Cardiol. 2003; 42: 998 – 1003.
60. Mulleheim J, Ebel D, Frassdorf J, Preckel B, Thamer V, Schlack W. Isoflurane precondtions myocardium against infarction via release of free radicals . Anesthesiology 2002; 96: 934 – 940.
61. Tanaka K, Weihrauch D, Kehl F, et al. Mechanism of preconditioning by isoflurane in rabbits : a direct role for reactive oxygen species. Anesthesiology 2002; 97: 1585 – 1490.
62. Ismaeil MS, Tkachenko I, Gamperl AK, Hickey RF, Cason BA. Mechenism of isoflurane – induced myocardial ptrconditioning in rabbits. Anesthesiology 1999; 90: 812 – 821.
63. Belhomme D, Peynet J, Louzy M, et al. Evidence for preconditioning by isoflurane in coronary artery bypass graft surgery. Circulation 1999 ; 100 : II340-4.
64. Tomai F, De Paulis R, Penta de Peppo A, et al. Beneficial impact of isoflurane during coronary bypass surgery on troponin I release. G Ital Cardiol 1999 ; 29 : 1007-14.
65. Haroun-Bizri S, Khoury SS, Chehab IR, et al. Does isoflurane optimize myocardial protection during cardiopulmonary bypass? J Cardiothorac Vasc Anesth 2001 ; 15 : 418-21.
66.Julier K, da Silva R, Garcia C, et al. Preconditioning by sevoflurane decreases biochemical markers for myocardial and renal dysfunction in coronary artery bypass graft surgery: a double-blinded, placebo-controlled, multicenter study. Anesthesiology 2003 ; 98 : 1315-27.
67.Van Der Linden PJ, Daper A, Trenchant A, et al. Cardioprotective effects of volatile anesthetics in cardiac surgery. Anesthesiology 2003 ; 99 : 516-7.
68. De Hert SG, Cromheecke S, ten Broecke PW, et al. Effects of propofol, desflurane, and sevoflurane on recovery of myocardial function after coronary surgery in elderly high-risk patients. Anesthesiology 2003 ; 99 : 314-23.
69. De Hert SG, Van der Linden PJ, Cromheecke S, et al. Choice of primary anesthetic regimen can influence intensive care unit length of stay after coronary surgery with cardiopulmonary bypass. Anesthesiology. 2004 ; 101 : 9-20.
70. Garcia C, Julier K, Bestmann L, et al. Preconditioning with sevoflurane decrease PECAM-1 expression and improves one year cardiovascular outcome in coronary artery bypass graft surgery. Br J Anaesth 2005 ; 94 : 159-65.
71. Stefanie Cromheecke, Veronik Pepermans, Ellen Hendrickx, Sur Lorsomradee et al. Cardioprotective properties of sevoflurane in patients undergoing aortic valve replacement with cardiopulmonary bypass. Anesth Analg 2006, 103 (2): 289 – 296.
72. Symons JA, Myles PS: Myocardial protection with volatile anesthetics during coronary artery bypass surgery: a meta-analysis. Br J Anaesth 2006; 97: 127-136.
73. Yu C, Beattie WS: The effects of volatile anesthetics on cardiac ischemic complications and mortality in CABG: a meta-analysis. Can J Anaesth 2006; 53: 906-918.
74. Seccareccia F, Perucci CA, D’Errigo P, Arca M, Fusco D, Rosato S, Greco D, Research group of the Italian CABG outcome study: The Italian CABG outcome study: short-term outcomes in patients with coronary artery bypass graft surgery. Eur J cardiothorac Surg 2006; 29: 56-62.
75. Landoni G, Biondi-Zoccai CG, Zangrillo A, et al. Desflurane and sevoflurane in cardiac surgery: a meta-analysis of randomized clinical trials. J Cardiothorac Vasc Anesth 2007; 21: 502 – 511.
76. Meco M, Cirri S, Gallazzi C, Magnani G, Cosseta D: Desflurane preconditioning in coronary artery bypass graft surgery: a double-blind, randomized and placebo-controlled study. Eur J Cardiothorac Surg 2007; 32: 319-325.
77. Jakobsen CJ, Berg H, Hindsholm K, Faddy N, Sloth E: The influence of propofol versus sevoflurane anesthesia on outcome in 10,535 cardiac surgical procedures. J Cardiothorac Vasc Anesth 2007; 21: 664-671.
78. De Hertz, D. Vlasselaers , R. Barbé, J-P Ory, D. Dekegel, R. Donnadonni et al. A comparison of volatile and non volatile agents for cardioprotection during on – pump coronary surgery. Anaesthesia 2009; 64 (9): 953 – 960.
79. Haelewyn B, Zhu I, Hanouz JL, Persehaye E, Roussel S, Ducouret P, Gerard JL: Cardioprotective effects of desflurane: effect of timing and duration of administration in rat myocardium. Br J Anaesth 2004; 92: 552-557.
80. Lutz M, Liu H: Inhaled sevoflurane produces better delayed myocardial protection at 48 vs 24 hours after exposure. Anesth Analg 2006; 102: 984-990.
81. Bein B, Renner J, Caliebe D, Hanss R, Bauer M, Fraund S, Scholz J: The effects of interrupted or continuous administration of sevoflurane on preconditioning before cardio-pulmonary bypass in coronary surgery: comparison with continuous propofol. Anaesthesia 2008; 63: 1046-1055.
82. Lange M, Redel A, Smul TM, Lotz C, Nefzger T, Stumpner J, Blomeyer C, Gao F, Roewer N, Kehl F: Desflurane-induced preconditioning has a threshold that is lowered by repetitive application and is mediated by beta2-adrenergic receptors. J Cardiothorac Vasc Anesth 2009; 23: 607-613.
83. Obal D, Scharbatke H, Barthel H, Preckel B, Mullenheim J, Schlack W: Cardioprotection against reperfusion injury is maximal with only two minutes of sevoflurane administration in rats. Can J Anaesth 2003; 50: 940-945.
84. Obal D, Dettwiler S, Favoccia C, Scharbatke S, Preckel B, Schlack W: The influence of mitochondrial KATP channels in the cardioprotection of preconditioning and postconditioning by sevoflurane in the rat in vivo. Anesth Analg 2005; 101: 1252-1260.
85. Landoni G, Fochi O, Tritapepe L, Guarracino F, Belloni I, Bignami E, Zangrillo A: Cardiac protection by volatile anesthetics. A review. Minerva Anesthesiol 2009; 75: 269-273.
86. Landoni G, Fochi O, Zangrillo A: Cardioprotection by volatile anesthetics in non-cardiac surgery? No, not yet at least. J Am Col Cardiol 2008; 51: 1321; Author reply 1321-1323.
87. Fleisher LA, Beckman JA, Brown KA, Calkins H, Chaikof EL, Fleischmann KE, Freeman WK, Froelich JB, Kasper EK, Kersten JR, Riegel B, Robb JF, Smith SC Jr, Jackobs AK, Adams CD, Anderson JL, Antman EM, Buller CE, Creager MA, Ettinger SM, Faxon DP, Fuster V, Halperin JL, Hiratzka LF, Hunt SA, Lytle BW, Nishimura R, Ornato JP, Page RL, Riegel B, Tarkington LG, Yancy CW: ACC/AHA 2007 Guidelines on perioperative cardiovascular evaluation and care for noncardiac surgery: executive summary. A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Col Cardiol 2007; 50: 1707-1732.
88. Hu G, Vasiliauskas T, Salem MR, Rhone DP, Crystal GJ: Neutrophils pretreated with volatile anesthetics lose ability to cause cardiac dysfunction. Anesthesiology 2003; 98: 712-718.
89. El Azab SR, Rossel PMJ, De Lange JJ, Groeneveld AB, Van Strik R, Van Wijk EM, Scheffer GJ: Effect of sevoflurane on the ex vivo secretion of TNF-a during and after coronary artery bypass surgery. Eur J Anaesth 2003; 20: 380-384.
90. Nader ND, Li CM, Khadra WZ, Reedy R, Panos AL: Anesthetic myocardial protection with sevoflurane. J Cardiothorac Vasc Anesth 2004; 18: 269-274.
91. Kawamura T, Kadosaki M, Nara N, Kaise A, Suzuki H, Endo S, Wei J, Inada K: Effects of sevoflurane on cytokine balance in patients undergoing coronary artery bypass graft surgery. J Cardiothorac Vasc Anesth 2006; 20: 503-508. v.v…









