1. Lời nói đầu
Hướng dẫn tổng kết và đánh giá tất cả bằng chứng có sẵn trên một vấn đề cụ thể tại thời điểm quá trình soạn thảo, với mục đích hỗ trợ các chuyên gia y tế trong việc lựa chọn các chiến lược điều chỉnh tốt nhất cho từng bệnh nhân với một điều kiện nhất định, có tính đến tác động vào kết quả, cũng như như tỷ lệ nguy cơ-lợi ích của các phương tiện chẩn đoán hoặc điều trị cụ thể. Hướng dẫn và khuyến cáo có thể giúp các chuyên môn y tế đưa ra quyết định trong thực hành hàng ngày của mình.
TS.Phạm Hữu Văn
Tuy nhiên, quyết định cuối cùng liên quan đến bệnh nhân phải do chuyên môn về chăm sóc khức khỏe thực hiện trong sự tư vấn bênh nhân và người chăm sóc phù hợp.
Một số lượng lớn các hướng dẫn đã được ban hành trong những năm gần đây của Hội Tim Mạch châu Âu (ESC) và Hồi Ngoại khoa Tim – Lồng ngực châu Âu (EACTS), cũng như các Hội xã hội và các tổ chức khác. Do tác động trên thực hành lâm sàng, tiêu chuẩn chất lượng cho sự phát triển hướng dẫn đã được thành lập làm cho tất cả các quyết định minh bạch đến người sử dụng. Các khuyến nghị cho việc xây dựng và ban hành Hướng dẫn ESC có thể được tìm thấy trên trang web của ESC(http://www.escardio.org/Guidelines-&-Education/Clinical-Practice-Guidelines/Guidelines-development/Writing-ESC-Guidelines).Hướng dẫn ESC đại diện cho vị trí chính thức của ESC về một chủ đề nhất định và được cập nhật thường xuyên.
Thành viên của Ban đặc nhiệm này do ESC lựa chọn, gồm đại diện từ Hội Nhịp Tim châu Âu (EHRA), Hội Ngoại khoa Tim – Lồng ngực châu Âu (EACTS) cũng như Tổ chức Đột quỵ châu Âu (ESO) để đại diện cho các chuyên gia tham gia vào việc chăm sóc y tếbệnh nhân với bệnh lý này. Chuyên gia được lựa chọn trong lĩnh vực này đã tiến hành đánh giá toàn diện các chứng cứ được công bố cho điều chỉnh (bao gồm chẩn đoán, điều trị, phòng ngừa và phục hồi chức năng) của điều kiện nhất định theo Ủy ban ESC cho chính sách các Hướng dẫn Thực hành (Commitee for Practice Guidelines: CPG) và sự chấp thuận của EACTS và ESO. Một đánh giá quan trọng của quy trình chẩn đoán và điều trị được thực hiện, gồm đánh giá tỷ lệ nguy cơ-lợi ích. Ước tính kết quả y tế dự kiến cho bao gồm các quần thể lớn hơn, trong đó chứa các tư liệu. Mức độ bằng chứng và sức mạnh khuyến cáo của các lựa chọn điều chỉnh được cân nhắc và phân loại theo quy mô được xác định trước, như được nêu trong Bảng 1 và 2.
Bảng 1. Mức độ mạnh (class) các khuyến cáo
|
Class các khuyến cáo |
Khái niệm |
Từ ngữ gợi ý sử dụng |
|
Class I |
Bằng chứng và / hoặc nhất trí chung điều trị hoặc thủ thuật được cho là có lợi, hữu dụng, hiệu quả |
Được khuyến cáo / được chỉ định |
|
Class II |
Bằng chứng mâu thuẫn và / hoặc khác nhau của lựa chọn về hữu dụng / hiệu quả cảu các điều trị thủ thuật được cho. |
|
|
Class II a |
Cân nhắc bằng chứng / lựa chọn ủng hộ hữu dụng / hiệu quả |
Nên xem xét |
|
Class IIb |
Hữu dụng / hiệu quả được tính toán ít hơn từ các bằng chứng / lựa chọn |
Có thể được xem xét |
|
Class III |
Bằng chứng hoặc nhất trí chung điều trị hoặc thủ thuật đã cho không hữu dụng / hiệu quả, và trong một số trường hợp có thể có hại |
Không được khuyến cáo |
Bảng 2. Mức độ bằng chứng
|
Mức độ bằng chứng A |
Tư liệu được rút ra từ nhiều nghiên cứu lâm sàng ngẫu nhiên hoặc phân tích gộp. |
|
Mức độ chứng cứ B |
Tư liệu được rút ra từ nghiên cứu lâm sàng ngẫu nhiên đơn thuần hoặc các nghiên cứu lớn không ngẫu nhiên |
|
Mức độ chứng cứ C |
Sự đồng thuận lựa chọn của các chuyên gia và / hoặc các nghiên cứu nhỏ, các nghiên cứu hồi cứu, đăng ký. |
Các chuyên gia soạn thảo và nhận danh sách được cung cấp bản khai các hình thức có liên quan cho tất cả các liên hệ có thể được coi là nguồn gốc thực tế hoặc tiềm năng mâu thuẫn lợi ích. Những hình thức này được biên soạn thành một tập tin và có thể được tìm thấy trên trang web của ESC (http://www.escardio.org/guidelines). Bất kỳ thay đổi trong tờ khai có liên quan phát sinh trong giai đoạn soạn thảo cần phải được thông báo cho ESC và EACTS và cập nhật. Tổ công tác đã nhận được toàn bộ hỗ trợ tài chính từ ESC và EACTS mà không cần bất kỳ sự tham gia từ các ngành công nghiệp chăm sóc sức khỏe.
ESC CPG giám sát và phối hợp chuẩn bị các hướng dẫn mới được ban đặc nhiệm, nhóm chuyên gia hoặc danh sách đồng thuận thảo ra. Ủy ban cũng chịu trách nhiệm cho quá trình chứng thực của Hướng dẫn này. Hướng dẫn ESC trải qua xem xét mở rộng do CPG và các chuyên gia bên ngoài, trong trường hợp này do các chuyên gia được bổ nhiệm lại của EACTS và ESO. Sau khi chỉnh cho phù hợp các Hướng dẫn được tất cả các chuyên gia tham gia vào Ban đặc nhiệm chấp thuận. Các tài liệu hoàn chỉnh được CPG, EACTS và ESO chấp thuận cho xuất bản trên Tạp chí Tim châu Âu, Tạo nhịp châu Âu và Tạp chí ngoại khoa Tim – Lồng ngực châu Âu. Hướng dẫn được phát triển sau khi xem xét cẩn thận các kiến thức khoa học, y tế và các bằng chứng sẵn có tại thời điểm biên soạn tài liệu.
Các nhiệm vụ phát triển các Hướng dẫn ESC và EACTS bao chùm không chỉ tích hợp các nghiên cứu gần đây nhất, mà còn tạo ra các công cụ giáo dục và các chương trình thực hiện cho các khuyến cáo. Để thực hiện các Hướng dẫn, các phiên bản hướng dẫn bỏ túi được tĩnh tụ, các slides tóm tắt, số tay với các thông điệp cơ bản, thẻ tóm tắt cho người không chuyên và phiên bản điện tử cho ứng dụng kỹ thuật số (điện thoại thông minh, v.v.) được sản xuất. Những phiên bản được rút gọn và do đó, nếu cần, người ta có thể luôn tham khảo các phiên bản văn bản đầy đủ, có sẵn miễn phí trên trang web của ESC. Các Hội Quốc gia của ESC được khuyến khích để xác nhận, dịch và thực hiện tất cả các hướng dẫn ESC. Chương trình thực hiện là cần thiết do nó đã được chứng minh kết quả bệnh có thể được ảnh hưởng thuận lợi qua việc áp dụng triệt để các khuyến cáo lâm sàng.
Khảo sát và đăng ký là cần thiết để xác minh thực hành cuộc sống thực sự hàng ngày phù hợp với những gì được đề nghị trong hướng dẫn, do đó hoàn thành các vòng lặp giữa nghiên cứu lâm sàng, soạn thảo các hướng dẫn, phổ biến chúng và thực hiện chúng vào thực hành lâm sàng.
Nhân viên y tế được khuyến khích nhận các Hướng dẫn ESC và EACTS đầy đủ vào tài khoản khi thực hiện đánh giá lâm sàng của họ, cũng như trong việc xác định và thực hiện chiến lược y tế dự phòng, chẩn đoán hoặc điều trị. Tuy nhiên, các Hướng dẫn ESC và EACTS không bao chùm trong bất kỳ trách nhiệm cá nhân nào của các chuyên gia y tế để đưa ra quyết định phù hợp và chính xác trong việc xem xét tình trạng sức khỏe của từng bệnh nhân và tham khảo ý kiến với bệnh nhân và người chăm sóc của bệnh nhân thích hợp và / hoặc những nơi cần thiết. Đó cũng là trách nhiệm của các chuyên gia y tế để xác minh các quy tắc và quy định áp dụng đối với các loại thuốc và các thiết bị tại thời điểm kê đơn.
2. Hướng dẫn
Mặc dù có những tiến triển tốt trong việc điều chỉnh bệnh nhân rung nhĩ (AF), rối loạn nhịp tim này vẫn là một trong những nguyên nhân chính của đột quỵ, suy tim, đột tử và bệnh suất tim mạch trên thế giới. Hơn nữa, số lượng bệnh nhân AF được dự đoán sẽ tăng nhanh trong những năm tới. Để đáp ứng nhu cầu ngày càng tăng cho chăm sóc có hiệu quả các bệnh nhân AF, các thông tin mới liên tục được tạo ra và xuất bản, cũng như trong vài năm qua đã chứng kiến sự tiến bộ đáng kể. Do đó, nó dường như kịp thời để xuất bản hướng dẫn của ESC về AF lần 2 này.
Phản ánh đa ngành đưa vào trong điều chỉnh các bệnh nhân AF, Ban Đặc nhiệm gồm các nhà tim mạch học nội khoa với sự thẩm định các đặc tính nhỏ khác nhau, bác sĩ phẫu thuật tim mạch, các nhà thần kinh đột quỵ học, cả các điều dưỡng chuyên khoa giữa các thành viên của Ban Đặc nhiệm. Bổ sung xem xét các bằng chứng như đã nêu trong lời mở đầu, Ban Đặc nhiệm này xác định ba câu hỏi Dân số (Population), Can thiệp (Intervention), So sánh (Comparison), Kết quả (Outcome), Thời gian (Time) (PICOT) về các chủ đề có liên quan để hướng dẫn. Các xem xét hệ thống bên ngoài đã được ESC ủy nhiệm để trả lời các câu hỏi này, cũng như các nhận xét ESC đánh giá có hệ thống bên ngoài để trả lời những câu hỏi này, cả những xem xét có các khuyến cáo cụ thể đã được thăm dò.
Hơn nữa để tôn trọng những tiêu chuẩn cho việc thành lập các khuyến cáo thông thường đối với tất cả các khuyến cáo của ESC (xem lời mở đầu), Ban Đặc nhiệm thảo luận mỗi một khuyến cáo dự thảo trong hội nghị dựa trên cơ sở trang web dành riêng cho các chương cụ thể, tiếp theo bằng sự thay đổi đồng thuận và bầu chọn trực tuyến cho mỗi khuyến cáo. Chỉ các khuyến cáo đã được ít nhất 75% ủng hộ của các thành viên Ban Đặc nhiệm được bao gồm trong hướng dẫn.
Chúng tôi hy vọng những nguyên tắc này sẽ giúp cung cấp chăm sóc tốt cho tất cả bệnh nhân AF dựa trên tiểu ban bằng chứng kỹ thuật hiện nay trong năm 2016.
3. Dịch tễ học và tác động đến các bệnh nhân
3.1.Tần số xuất hiện và sự lưu hành rung nhĩ
Trong năm 2010, các con số ước tính có 20,9 triệu và 12,6 triệu nam giới và nữ giới bị AF trên toàn thế giới, theo thứ tự, tương ứng, với tần số xuất hiện và tần số lưu hành cao hơn ở các nước phát triển. [1,2] Một trong bốn người trung niên ở châu Âu và Mỹ sẽ phát triển AF. [3-5] Đến năm 2030, 14-17 triệu bệnh nhân AF được dự đoán ở Liên minh châu Âu, với 120 000-215 000 bệnh nhân mới được chẩn đoán mỗi năm. [2,6,7] Ước tính cho thấy lưu hành AF khoảng 3% ở người lớn tuổi từ 20 tuổi trở lên, [8,9] có tỷ lệ cao hơn ở người già [1] và ở những bệnh nhân với các trạng thái như tăng huyết áp, suy tim, bệnh động mạch vành (CAD), bệnh van tim, béo phì, tiểu đường, hoặc bệnh thận mãn tính (CKD). [7,10-15] Sự gia tăng tỷ lệ AF có thể được bổ xung cho cả hai phát hiện tốt hơn AF im lặng [16-18], cùng với tuổi tác tăng và điều kiện thúc đẩy AF. [19]
3.2.Bệnh suất, tử suất và gánh nặng rung nhĩ chăm sóc sức khỏe
AF liên quan độc lập với nguy cơ tăng lên 2 lần của tử suất do tất cả nguyên nhân ở nữ và tăng 1.5 lần ở nam [20-22] (Bảng 3). Tử vong do đột quỵ phần lớn có thể được giảm nhẹ bằng thuốc chống đông máu, trong khi trường hợp tử vong tim mạch khác, như do suy tim và đột tử, vẫn còn phổ biến ngay cả ở những bệnh nhân AF được điều trị theo cơ sở bằng chứng hiện thời. [23] AF cũng liên quan với bệnh suất gia tăng, chẳng hạn như suy tim và đột quỵ. [21,24,25] Các nghiên cứu đương đại cho thấy 20-30% bệnh nhân bị đột quỵ thiếu máu cục bộ có AF đã được chẩn đoán trước, trong hoặc sau khi các biến cố khởi đầu. [ 17,26,27] Tổn thương chất trắng trong não, suy giảm nhận thức, [28-30] giảm chất lượng cuộc sống, [31,32] và tâm trạng chán nản [33] thông thường ở các bệnh nhân AF, và giữa 10-40% của bệnh nhân AF phải nhập viện mỗi năm. [23,34,35]
Bảng 3.Tử suất và bệnh suất tim mạch được kết hợp với rung nhĩ
|
Biến cố |
Kết hợp vói AF |
|
Tử vong |
Tử suất được tăng lên, đặc biệt tử suất tim mạch do đột tử, suy tim và đột quỵ. |
|
Đột quỵ |
20 -30% tất cả đột quỵ |
|
Nhập viện |
10 -40% bệnh nhân AF phải nhập viện hàng năm |
|
Chất lượng sống |
Chất lượng sống của bệnh nhân AF suy giảm độc lập với các trạng thái tim mạch khác. |
|
Rối loạn chức năng thất trái và suy tim |
Rối loạn chức năng LV được xác định ở 20 – 30% ở tất cả bệnh nhân AF. AF gây ra hoặc làm nặng thêm rối loạn chức năng thất trái ở nhiều bệnh nhân AF, trong khi các bệnh nhân khác có chức năng LV hoàn toàn bảo tồn, mặc dù AF kéo dài. |
|
Suy giảm nhận thức và sa sút trí tuệ do tuần hoàn |
Suy giảm nhận thức và sa sút trí tuệ do tuần hoàn có thể phát triển thậm chí ở các bệnh nhân AF đã được kháng đông. Tổn thương chất trắng ở não thường thấy ở bệnh nhân AF hơn các bệnh nhân không có AF |
AF: rung nhĩ. LV: thất trái
Các chi phí trực tiếp của AF hiện đã lên đến khoảng 1% tổng chi y tế ở Anh, và giữa 6,0 – 26,0 tỷ USD ở Mỹ năm 2008,[36,37] do biến chứng AF liên quan (ví dụ như đột quỵ) và các chi phí điều trị (ví dụ như nhập viện). Những chi phí này sẽ tăng đáng kể ngoại trừ AF được ngăn chặn và điều trị một cách kịp thời và hiệu quả.
3.3.Ảnh hưởng của điều chỉnh dựa trên cơ sở bằng chứng lên hậu quả ở bệnh nhân rung nhĩ
Hình 1 mô tả các mốc quan trọng trong việc điều chỉnh AF. Mặc dù có tiến bộ, tỷ lệ mắc bệnh đáng kể vẫn còn. Thuốc chống đông đường uống (OAC) với thuốc kháng vitamin K (VKAs) hoặckháng đông uống không phải kháng vitamin K (NOACs) làm giảm rõ rệt đột quỵ và tử vong ở bệnh nhân AF.[38,39] Các can thiệp khác như kiểm soát nhịp và kiểm soát tần số cải thiện triệu chứng có liên quan đến AF và có thể bảo tồn chức năng tim, nhưng chưa thấy giảm bệnh suất và tử suất lâu dài.[40,41]
|
Thời gian nhận định |
Điều trị các bệnh đi kèm và phòng ngừa |
Thuốc chống đông máu |
Điều trị kiểm soát tần số
|
Liệu pháp kiểm soát nhịp |
Phẫu thuật chống rung nhĩ |
|
1995 |
|
VKA ưu thế hơn cho ngăn chặn đột quỵ ở BN AF |
|
PVI có thể ức chế AF |
Phẫu thuật maze đầu tiên được xuất bản |
|
2000 |
ACE-I /ARBs ngăn chặn AF ở BN HF |
Kháng vitamin K giảm đột quỵ ở 2/3 BN AF |
Kiểm soát tần số không kém hơn kiểm soát nhịp |
|
Tần số radio trên cơ sở maze duy trì nhịp xoang sau phẫu thuật tim mạch |
|
2005 |
ARB ngăn chặn AF ở bệnh nhân THA và phì đại LV
ARBs không ngăn chặn AF hoặc hậu quả xấu ở BN không THA |
Ximelagatran hiệu quả như kháng vitamin K
Dabigatran ít nhất hiệu quả như kháng vitamin K trong AF |
Amiodarone không ưu thế hơn kiểm soát tần số trong HF |
PVI duy trì nhịp xoang tốt hơn thuốc chống loạn nhịp Dronedarone cải thiện hậu quả ở BN AF không dai dẳng |
|
|
2010 |
A xít béo không no không ngăn chặn AF
MRA ngăn chặn AF ở BN HFrEF điều trị ACEI / ức chế beta ACEI/ARB ngăn chặn AF ở BN THA |
Rixaroxapan và Apixaban ít nhất hiệu quả như kháng vitamin K trong AF Edoxaban ít nhất như kháng vitamin K ở BN AF |
Dronedarone có hại ở BN AF dai dẳng. |
PVI điều trị đầu tiên duy trì nhịp xoang tốt hơn thuốc chống loạn nhịp |
AF hai cực hiệu quả hơn AF truyền thống cho ngoại khoa AF đơn độc |
|
2015 |
Beta blockers ngăn chặn AF ở BN HFrEF trước khi điều trị ACEI |
Phân tích gộp và các dữ liệu chăm sóc sức khỏe: NOACs an toàn và hiệu quả hơn một chút so với VKA |
Beta blocker không có lợi ích tiên lượng ở BN AF HFrEF |
PVI đơn thuần hiệu quả như triệt phá phức tạp ở bệnh nhân AF dai dẳng
Năng lượng lạnh hiệu quả như RF trong PVI |
Phẫu thuật maze đồng thời duy trì nhịp xoang nhưng tăng nguy cơ tạo nhịp vĩnh viễn. |
Hình 1. Cột đầu tiên biểu hiện thời gian của các nhận định từ các thử nghiệm mang tính bước ngoặt trong điều chỉnh rung nhĩ, bao gồm điều trị các bệnh đi kèm và phòng ngừa, thuốc chống đông máu, điều trị kiểm soát tần số, liệu pháp kiểm soát nhịp, và phẫu thuật rung nhĩ.
Trong cùng một thời gian, các nghiên cứu lâm sàng ngẫu nhiên có đối chứng rõ trong AF, tỷ lệ đột quỵ trung bình hàng năm 1,5% và tỷ lệ tử vong hàng năm khoảng 3% ở các bệnh nhân AF được kháng đông.[40] Trong đời sống thực, tỷ lệ tử vong hàng năm có thể khác nhau (cả cao hơn và thấp hơn) .[42] Một số ít các trường hợp tử vong có liên quan đến đột quỵ, trong khi đột tử tim (SCD) và tử vong do suy tim tiến triển thường nhiều hơn, nhấn mạnh sự cần thiết phải can thiệp ngoài kháng đông.[43,44] Hơn nữa, AF cũng liên quan với tỷ lệ nhập viện cao, thường cho điều chỉnh AF, nhưng thường cũng cho suy tim (HF), nhồi máu cơ tim (MI) và điều trị các biến chứng liên quan.
3.4.Giới
Ở cả hai các nước phát triển và các nước đang phát triển, tỷ lệ điều chỉnh theo tuổi và tỷ lệ AF thấp hơn ở nữ, trong khi nguy cơ tử vong ở nữ với AF là tương đương hoặc cao hơn so với ở nam giới với AF. [1,46,47] Bệnh nhân nữ AF có yếu tố nguy cơ đột quỵ bổ sung (đặc biệt người lớn tuổi) cũng có nguy cơ đột quỵ lớn hơn nam, [48,49] thậm chí chống đông với warfarin. [50] (xem chi tiêt chương 9). Nữ giới chẩn đoán AF có thể có nhiều triệu chứng hơn nam giới và thường lớn tuổi hơn có nhiều bệnh đi kèm hơn. [51.52] Nguy cơ chảy máu do kháng đông giống nhau ở cả hai giới, [49,50,53] nhưng nữ xuất hiện ít có khả năng để nhận được sự chăm sóc chuyên khoa và điều trị kiểm soát nhịp hơn, [54] trong khi các kết quả triệt phá qua catheter hoặc ngoại khoa AF được so sánh với những điều đó ở nam.[55,56] Những quan sát này nêu bật sự cần thiết phải cung cấp các công cụ chẩn đoán hiệu quả và quản lý điều trị như nhau đối với nữ và nam.
|
Các khuyến cáo |
Classa |
Mức độb |
Tham khảo c |
|
Các bác sỹ lâm sàng AF cần thực hiện công cụ chẩn đoán và quản lý điều trị có hiệu quả như nhau ở cả nam và nữ để ngăn chặn đột quỵ và tử vong. |
I |
A |
39,46,57 |
|
Kỹ thuật triệt phá qua catheter hoặc ngoại khoa nên được đánh giá như kết quả tương đương ở nữ và nam, |
IIa |
B |
55.56 |
AF = rung nhĩ.
aClass các khuyến cáo.
bMức độ bằng chứng.
cTài liệu tham khảo ủng hộ khuyến cáo.
Các khuyến cáo liên quan đếngiới
4. các khía cạnh sinh lý bệnh và di truyền hướng dẫn điều chỉnh
4.1 Khuynh hướng di truyền
AF, đặc biệt AF khởi phát sớm, có thành phần di truyền mạnh mẽ, độc lập của các trạng thái tim mạch đi kèm.[58,59] Một vài bệnh nhân AF trẻ bị các bệnh cơ tim qua trung gian các đột biến gây bệnh. Những bệnh đơn gene này cũng di truyền nguy cơ đột tử (xem Chương 6). Lên đến 1/3 các bệnh nhân AF mang các biến thể di truyền phổ biến dẫn đến AF, mặc dù với một nguy cơ gia tăng tương đối thấp. Ít nhất 14 trong số các biến thể phổ biến, thường đa hình thái nucleotide đơn, được biết làm tăng nguy cơ xuất hiện AF. [60-62] Các biến thể quan trọng nhất được đặt gần gene cặp giống như yếu tố phiên mã homeodomain 2 (Pitx2) trên nhiễm sắc thể 4q25.[63,64] Những biến thể làm thay đổi các nguy cơ AF lên đến bảy lần.[64] Một số biến thể nguy cơ AF cũng liên quan với tắc nghẽn tim mạch hoặc đột quỵ thiếu máu cục bộ, có thể do AF im lặng (xem chương 5 và 5.2) .[62,65, 66] Các thay đổi trong đặc tính điện thế hoạt động nhĩ, [67-70] tái cấu trúc nhĩ, cũng như thâm nhập của các khiếm khuyết gene hiếm được sửa đổi [61] đã được gợi ý như cơ chế tiềm tàng làm trung gian cho nguy cơ AF tăng lên ở những người mang các biến thể gene thông thường. Biến thể di truyền có thể, trong tương lai, trở thành hữu ích cho lựa chọn bệnh nhân kiểm soát nhịp hoặc kiểm soát tần số.[71-74] Trong khi phân tích bộ gene có thể cung cấp cơ hội để cải thiện chẩn đoán và điều chỉnh AF trong tương lai, [75,76] xét nghiệm di truyền thường xuyên cho các gen thông thường biến thể kết hợp với AF không được khuyến cáo hiện thời.[77]
4.2 Các cơ chế đưa đến rung nhĩ
4.2.1 Tái cấu trúc cấu trúc nhĩ và chức năng kênh ion
Những căng thẳng bên ngoài chẳng hạn như bệnh tim cấu trúc, tăng huyết áp, có thể bệnh tiểu đường, nhưng cũng tự bản thân AF tạo ra một quá trình tái cấu trúc trong nhĩ chậm nhưng tiến triển (Hình 2). Kích hoạt các nguyên bào sợi, lắng đọng mô liên kết gia tăng, xơ hóa là điểm nổi bật của quá trình này.[78-80] Ngoài ra, thâm nhiễm mỡ trong nhĩ, thâm nhiễm viêm, phì đại tế bào cơ, hoại tử và amyloidosis được tìm thấy ở những bệnh nhân AF với điều kiện đồng thời mở đường cho AF. [81-84] Tái cấu trúc gây ra phân ly điện học giữa các bó cơ và mất sự đồng nhất dẫn truyền khu vực, [85] thúc đẩy vào lại và duy trì rối loạn nhịp .[86] Ở nhiều bệnh nhân, tiến triển tái cấu trúc thực thể biểu hiện trước khởi phát AF. [78] Ở một số tái cấu trúc thực thể sẽ không thể phục hồi, khởi đầu điều trị sớm dường như thất bại. [87] Bảng 4 đưa ra một tổng quan về các thay đổi sinh bệnh lý liên quan phổ biến trong tổ chức nhi kết hợp với AF, cả một danh sách tương ứng với các điều kiện lâm sàng có thể đóng góp vào những thay đổi này.
Bảng 4.Các thay đổi sinh lý bệnh trong tổ chức nhĩ kết hợp với rung nhĩ và các trạng thái lâm sàng có thể đóng góp vào sự thay đổi như vậy
|
Các thay đổi sinh lý bệnh |
Các trạng thái lâm sàng đóng góp vào sự thay đổi |
Cơ chế thúc đẩy loạn nhịp/hậu quả chức năng. |
Tài liệu tham khảo |
|
Các thay đổi của môi trường bên ngoài tế bào, chức năng tế bào sợi, tế bào mỡ. |
|||
|
Sơ tổ chức kẽ và thay thế sợi |
AF (đặc biệt hình thái với gánh nặng AF cao), THA, HF, bệnh van tim (do quá tải thể tích và áp lực) |
Phân ly điện học, block dẫn truyền, biến chứng AF gia tăng |
78,79,90,91 |
|
Thâm nhiễm viêm |
|
Đáp ứng thúc đẩy xơ, biến chứng AF gia tăng. |
81 |
|
Thâm nhiễm mỡ |
Béo phì |
Đáp ứng thúc đẩy xơ / viêm, block dẫn truyền khu vực |
82, 92 |
|
Lắng đọng amyloide |
Tăng tuổi, HF, bệnh động mạch vành (do sẹo nhĩ, các yếu tố di truyền) |
Rối loạn dẫn truyền |
83, 93 |
|
Các thay đổi kênh ions |
|||
|
Tái cấu trúc kênh ions |
AF (đặc biệt hình thái với gánh nặng AF cao), các khuynh hướng di truyền đưa đến AF |
Vòng AF ngắn lại (nếu do nhịp nhanh nhĩ), kéo dài chiều dài vòng AF (nếu do HF), không đồng nhất tái cực nhĩ gia tăng. |
94, 96 |
|
Ca++ xử lý không ổn định. |
AF (Hình thái đặc biệt với gánh nặng AF), HF, THA (có thể qua hoạt động giao cảm gia tăng) |
Xu hướng ngoại vị gia tăng |
97, 98 |
|
Tái phân phối lại các nối khoảng trống. |
AF |
Rối loạn dẫn truyền |
99 |
|
Thay đổi tế bào cơ |
|||
|
Chết theo chương trình và hoại tử |
Bệnh động mạch vành, HF (chuyển qua chết tế bào cơ tim và sẹo nhĩ) |
Có thể tạo ra sợi thay thế |
100 |
|
Phì đại tế bào cơ |
Giãn nhĩ, AF |
Thúc đẩy rối loạn dẫn truyền |
84, 101 |
|
Thay đổi nội mạc và mạch máu |
|||
|
Các thay đổi mạch máu lớn |
Vữa xơ, bệnh mạch động mạch vành và ngoại biên, có thể AF |
Thúc đẩy thiếu máu cục bộ nhĩ, không đồng nhất chức năng điện học, tái cấu trúc thực thể. |
102 |
|
Tái cấu trúc nội tâm mạc |
|
Nguy cơ hình thành huyết khối gia tăng |
103,104 |
|
Các thay đổi hệ thống thần kinh tự động |
|||
|
Cường chức năng chi phối giao cảm |
HF, THA |
Xu hướng ngoại vị gia tăng |
80,105 |
AF: rung nhĩ. HF: suy tim. THA: tăng huyết áp.
Hình 2.Các cơ chế gây rung nhĩ.
Stroke: đột quỵ. Diabetes: tiểu đường. Heart failure: suy tim. Obesity: béo phì. Coronary artery disease: bệnh động mạch vành. Hypertension: tăng huyết áp. Ageing: tuổi già. Genetic predisposition: khuynh hương di truyền. Atrial fibrillation: rung nhĩ. Atrial cavity: khoang nhĩ. Fibrinolysis: tiêu sợi huyết. Hypercoagulability: tăng đông máu. Thrombocyte activity: hoạt hóa tiểu cầu. Hypocontractility: giảm co thắt. Atrial stretch: căng nhĩ. AngII: angiotensin II. Imflammation: viêm. Vascular remodeling: tái cấu trúc mạch. Ischemia: thiếm máu cục bộ. Fatty infiltration: thâm nhiễm mỡ. Fibrosis: xơ hóa. Atrial tachycardia: nhịp nhanh nhĩ. Atrial myocardium: cơ tim nhĩ. Ca++ handing instability: Trao đổi ion canxi bất ổn. Conduction heterogeneity: không đồng nhất dẫn truyền. Ion channel remodeling: tu sửa kênh ion. Ectopy: ngoại vị. Reentry: vào lại.
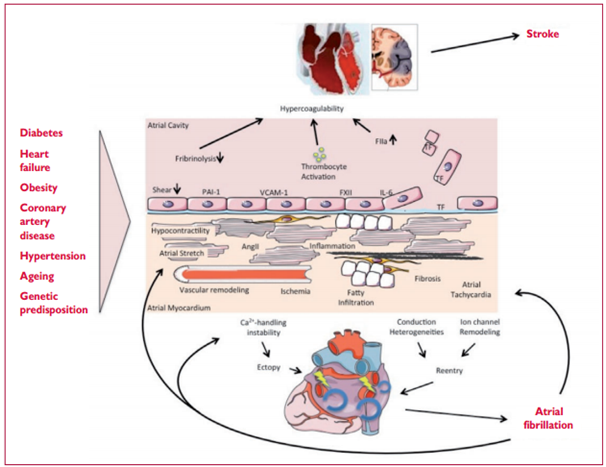
Hình 2 mô tả các cơ chế chính gây rung nhĩ có thể được xem xét khi lựa chọn điều trị. Các yếu tố bệnh căn khác nhau (trái) gây ra một danh sách phức tạp các thay đổi sinh lý bệnh trong nhĩ, gồm cả dầy lên và xơ sẹo (xơ hóa) gây ra do căng giãn nhĩ, giảm co bóp, thâm nhiễm mỡ, viêm, tái cấu trúc mạch máu, thiếu máu cụ bộ, rối loạn chức năng kênh ion, cũng như mất ổn định Ca2+. Những thay đổi này gia tăng các ngoại vị và rối loạn dẫn truyền, làm tăng xu hướng nhĩ để phát triển hoặc duy trì AF. Đồng thời, một số những thay đổi này được tham gia vào sự xuất hiện của trạng thái tăng đông có liên quan với AF. Ví dụ, co bóp giảm làm giảm căng nội mạc đan xen khu vực, trong đó tăng áp lực PAI-1, cả viêm do thiếu máu cục bộ làm gia tăng áp lực các phân tử kết dích nội mạc hoặc làm rối loạn sự bong các tế bào nội mạc, dẫn đến bộc lộ yếu tố tổ chức với dòng máu. Các thay đổi này bổ xung vào môi trường tạo đông máu trong nhĩ ở bệnh nhân AF. AF tự bản thân có thể làm trầm trọng thêm nhiều cơ chế đã được biết, trong đó có thể giải thích bản chất tiến triển của rối loạn nhịp.
Những thay đổi cấu trúc và chức năng trong cơ nhĩ và ứ máu, đặc biệt ở tiểu nhĩ (left atrial appendage: LAA), tạo ra một môi trường thúc đẩy đông máu. Hơn nữa, thậm chí các cơn AF ngắn cũng đưa đến tổn thương nhĩ và bộc lộ các yếu tố thúc đẩy huyết khối trên bề mặt nội mạc tiểu nhĩ, bên cạnh hoạt hóa tiểu cầu và các tế bào viêm, cũng như bổ xung vào trạng thái thúc đẩy huyết khối nói chung. [88,89] Hoạt hóa hệ thống đông máu nhĩ và hệ thống có thể giải thích một phần vì sao các cơn AF ngắn đưa đến nguy cơ đột quỵ kéo dài.
4.2.2 Cơ chế điện sinh lý của rung nhĩ
AF thúc đẩy việc ngắn lại thời kỳ trơ của nhĩ và chiều dài vòng AF trong những ngày đầu tiên của loạn nhịp, phần lớn do giảm điều hòa dòng Ca2 + đi vào và tăng điều hòa dòng K + vào có chỉnh lưu. [94,95] Ngược lai, bệnh tim cấu, có xu hướng kéo dài thời gian trơ nhĩ, giải thích tính chất không đồng nhất của cơ chế gây ra AF ở những bệnh nhân khác nhau. [96] Cường phosphoryl các proteins phân phối Ca2+ có thể đưa đến các biến cố thải tiết Ca2+ tự phát gia tăng và hoạt hóa khởi phát, [97,98] do đó gây ngoại vị và thúc đẩy AF. Mặc dù khái niệm không ổn định phân phối Ca+ + đã được thử thách mới gần đây, [106.107] nó có thể làm trung gian cho AF trong nhĩ được tái cấu trúc thực thể và giải thích trương lực tự động biến đổi như thế nào có thể tạo ra AF. [80.105]
4.2.2.1. Khởi phát ổ và duy trì rung nhĩ
Các quan sát chuyên đề của Haissaguerre và cộng sự. [108] cho thấy nguồn gốc ổ ở các tĩnh mạch phổi có thể khởi kích AF, triệt phá ổ này có thể ngăn chặn AF tài phát nguồn đầu mối trong các tĩnh mạch phổi có thể kích hoạt AF và cắt bỏ các nguồn này có thể ngăn chặn AF tái phát. Cơ chế hoạt động ổ có thể gồm cả hai hoạt động khởi kích và vào lại khu trú. [109.110] Tổ chức thứ bậc của AF với các khu vực kích hoạt nhanh điều khiển loạn nhịp đã được chứng minh ở bệnh nhân AF kịch phát, [111.112] nhưng ít rõ ràng hơn ở những bệnh nhân không được lựa chọn với AF dai dẳng. [113]
4.2.2.2. Giả thuyết đa sóng nhỏ và sự xoay vòng như nguồn gốc của rung nhĩ
Moe và Abildskov [114] đã đề xuất AF có thể được duy trì bằng sự dẫn liên tục của nhiều sóng nhỏ độc lập lan truyền thông qua các hệ thống cơ nhĩ với một phương thức dường như hỗn loạn. Khi số lượng các mặt sóng không giảm xuống dưới một mức độ nguy kịch, chúng sẽ có khả năng duy trì tình trạng loạn nhịp. Nhiều quan sát thực nghiệm và lâm sàng có thể được dung hòa với giả thuyết đa sóng nhỏ. [115] Tất cả các nguồn gốc khu trú của AF (các ổ ngoại vị, xoay vòng , hoặc các vòng vào lại ổn định khác) gây ra dẫn truyền rung từ xa các nguồn, đó là điều khó để phân biệt với lan truyền AF dai dẳng do đa sóng nhỏ, hoặc mỗi một hiện tượng này có thể tạo ra các “xoay vòng” được lên đỉnh từ nhân giống duy trì AF bởi nhiều sóng nhỏ, một trong những hiện tượng này có thể tạo ra ‘rotor’ được đón nhận bằng ghi trong buồng tim [116.117] hoặc bề mặt cơ thể [117].
5. Chẩn đoán và phát hiện kịp thời rung nhĩ
5.1.Rung nhĩ rõ ràng và im lặng
Việc chẩn đoán AF đòi hỏi chứng minh tư liệu nhịp sử dụng điện tâm đồ (ECG) chỉ ra mẫu AF điển hình: các khoảng RR hoàn toàn không đều và không thấy rõ, phân biệt sóng P. AF được chứng minh bằng tư liệu ECG là tiêu chuẩn khởi đầu trong các nghiên cứu hình thành bằng chứng cho các hướng dẫn này. Theo quy ước được chấp nhận, một cơn kéo dài ít nhất 30 giây để chẩn đoán. Các cá thể AF có thể có triệu chứng hoặc không triệu chứng (“AF im lặng”). Nhiều bệnh nhân AF có cả hai AF cơn có triệu chứng và không triệu chứng. [118-121]
Im lặng, AF không bị phát hiện là phổ biến, [120.122] với những hậu quả nghiêm trọng như đột quỵ và tử vong. [123-125] Ghi ECG ngay lập tức là phương pháp có hiệu quả và phương pháp hiện quả – chi phí để chứng minh các hình thái kéo dài của AF. [126] Các công nghệ để phát hiện các cơn AF kịch phát, tự ngừng đang phát triển nhanh chóng (xem Chương 6.1 cho khái niệm các mẫu AF). Có bằng chứng rõ ràng cho việc theo dõi ECG kéo dài làm gia tăng phát hiện AF không được chẩn đoán, như theo dõi 72h sau đột quỵ, [27.127] hoặc thậm chí dai hơn. [18.128] Ghi điện tâm đồ ngắn hạn hàng ngày tăng phát hiện AF ở các quần thể trên 75 tuổi [129] (Hình 1). Các nghiên cứu đang tiếp tục sẽ xác định liệu phát hiện sớm như vậy có làm thay đổi điều chỉnh (như khởi đầu kháng đông) và cải thiện kết cục hay không.
Một khi chẩn đoán AF bằng ECG đã được tính toán, theo dõi điện tâm đồ có thể tiếp tục thông báo điều chỉnh trong bối cảnh: (1) sự thay đổi trong các triệu chứng hoặc triệu chứng mới; (2) nghi ngờ tiến triển AF; (3) theo dõi phản ứng thuốc với tần số thất; và (4) theo dõi hiệu quả thuốc chống loạn nhịp hoặc triệt phá qua catheter để kiểm soát nhịp.
5.2.Tầm soát rung nhĩ im lặng
5.2.1.Tầm soát rung nhĩ bằng điện tâm đồ trong cộng đồng
AF không được chẩn đoán là phổ biến, đặc biệt trong các quần thể lớn tuổi và bệnh nhân bị suy tim. [130] Tầm soát cơ hội AF im lặng dường như hiệu quả trong các quần thể người cao tuổi (ví dụ như > 65 tuổi), [131]các hiệu quả tương tự đã được báo cáo sử dụng tầm soát ECG chuyển đạo đơn ở các quần thể nguy cơ khác. [132.133] Tầm soát các nhóm cao tuổi (tuổi trung bình 64 tuổi) cũng cho thấy tỷ lệ 2,3% đối với các dạng AF mạn tính ở 122.571 người tham gia bằng cách sử dụng hoặc ECG ngắn hạn hoặc xung mạch (pulse palpation) (tiếp theo bằng ECG ở những người có mạch không đều). [134 AF không được chẩn đoán trước đây đã được xác định ở 1,4% số người trong độ tuổi > 65 tuổi, cho thấy một số lượng cần thiết để tầm soát ở tuổi 70. Những phát hiện này khuyến khích việc đánh giá thêm về chương trình tầm soát AF có hệ thống trong các quần thể có nguy cơ cao.
5.2.2.Theo dõi kéo dài rung nhĩ kịch phát
AF kịch phát thường bị bỏ sót. [120] Ghi ECG hàng ngày lặp lại làm tăng phát hiện các cơn AF im lặng, không triệu chứng trong dân số Thụy Điển không được chọn ở độ tuổi > 75 tuổi. [120.135] Một số bệnh nhân được cấy thiết bị (operated devices) [136.137] và theo dõi ECG liên tục được mở rộng sử dụng ghi miếng dán da [138] đã được xác nhận có giá trị cho phát hiện AF kịch phát (Hình 1). [139] Việc phát hiện AF không có triệu chứng của các công nghệ mới, chẳng hạn như trường hợp điện thoại thông minh với các điện cực ECG, đồng hồ thông minh, cả các máy đo huyết áp với các thuật toán phát hiện AF, vẫn chưa được chính thức đánh giá đối với phương pháp phát hiện rối loạn nhịp tim đã được tính toán. [140]
5.2.3.Các bệnh nhân có máy tạo nhịp và các dụng cụ đã được cấy
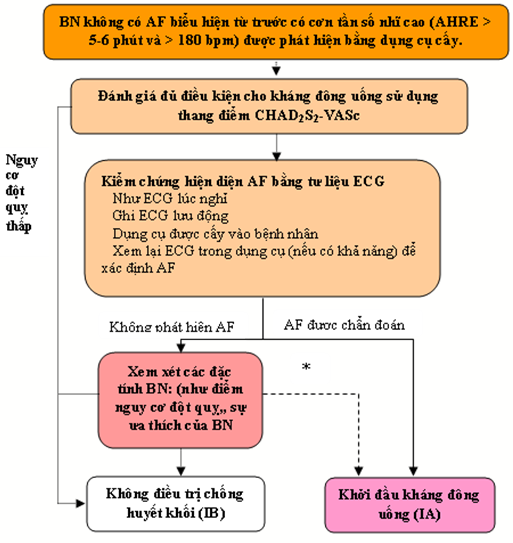
Máy tạo nhịp hoặc máy khử rung tim đã được cấy với điện cực nhĩ cho phép theo dõi liên tục nhịp nhĩ. Sử dụng công nghệ này, các bệnh nhân với các cơn tần số nhĩ cao (atrial high rate episodes: AHRE) có thể được xác định. Tùy thuộc vào mức độ rủi ro của dân số được nghiên cứu, AHRE như vậy được phát hiện ở 10-15% bệnh nhân có máy tạo nhịp. [141] AHRE có liên quan với tăng nguy cơ AF rõ ràng [tỷ lệ rủi ro (HR) 5.56; khoảng lệch chuẩn (confidence interval: CL) 95%: 3,78-8,17; p<0,001] và đột quỵ thiếu máu cục bộ hoặc tắc mạch hệ thống (HR 2,49; 95% CI 1,28-4,85; p = 0,007). Nguy cơ đột quỵ ở những bệnh nhân AHRE dường như thấp hơn so với nguy cơ đột quỵ ở bệnh nhân AF đã được chẩn đoán, không phải tất cả AHRE đại diện AF. [142] Đột quỵ thường xảy ra không có AHRE được phát hiện trong vòng 30 ngày trước khi biến cố này. [143-147] Do đó, vẫn chưa rõ liệu AHRE có ám chỉ các yêu cầu điều trị giống như AF rõ ràng hay không, [148] và các lợi ích của kháng đông ở bệnh nhân AHRE được thử nghiệm trong các nghiên cứu lâm sàng đã diễn ra [ví dụ: Apixaban cho Giảm Thuyên tắc Huyết khối ở các Bệnh nhân có Rung nhĩ Dưới Lâm sàng được phát hiện bằng Dụng cụ (Apixaban for the Reduction of Thrombo-Embolism in Patients With Device-Detected Sub-Clinical Atrial Fibrillation: ARTESiA) (NCT01938248) và kháng đông uống không phải kháng vitamin K (Non vitamin K antagonist Oral anticoagulants: NOAH) ở những bệnh nhân với các cơn tần số nhĩ cao (NCT02618577)]. Hiện nay, máy tạo nhịp và các thiết bị cấy ghép nên được kiểm tra xem thường xuyên về AHRE, bệnh nhân có AHRE nên trải qua đánh giá tiếp theo các yếu tố nguy cơ đột quỵ và AF rõ ràng, gồm theo dõi điện tâm đồ (Hình 3). [149]
Hình 3.Điều chỉnh AHRE được phát hiện bằng dụng cụ.
AF: rung nhĩ, AHRE: cơn tần số nhĩ cao. CHA2DS2-VASc: Suy tim ứ huyết (Congress heart failure). Tăng huyết áp (Hypertention), Tuổi (Age) ≥ 75. (gấp hai lần), Tiểu đường (Diabetes), Đột quỵ (Stroke) (gấp 2 lần), Bệnh mạch máu (Vascular disease), Tuổi (Age) 65–74, và Giới (Sex) (nữ); ECG: điện tâm đồ.
*Tình huống cá thể hiếm, kháng đông uống có thể được xem xét với BN có AHRE, nhưng không có AF được chẩn đoán. Điều này cần rõ rang thảo luận với BN và đánh giá cần thận về lợi ích nguy cơ nhận được.
aPhù hợp với thông báo của hội nghị đồng thuận của AFNET / EHRA (AFNET: German competence NETwork on atrial fibrillation.EHRA = European Heart
Rhythm Association) lần thứ 3 .[150]
5.2.4.Phát hiện rung nhĩ ở những người đột quỵ sống sót.
Theo dõi ECG được phân tầng tuần tự đã phát hiện AF ở 24% (95% CI 17-31) những người đột quỵ sống sót[151] và 11,5% (95% CI 8,9% -14,3%) trong một phân tích gộp, [17] với các biến thể lớn tùy thuộc vào chọn thời gian, khoảng thời gian, và phương pháp theo dõi. Phát hiện AF không phải là hiếm ở những bệnh nhân đột quỵ không được lựa chọn (6.2%, 95% CI 4,4-8,3), [128] nhưng nhiều khả năng ở những bệnh nhân bị đột quỵ chưa rõ nguyên nhân (cryptogenic) đã được cấy ghi vi mạch (loop recorder) hoặc người có ECG đã có theo dõi ECG trong vài tuần. [18.128.152] Đột quỵ chưa rõ nguyên nhân được định nghĩa cơn đột quỵ, trong đó nguyên nhân không thể được xác định sau khi điều tra mở rộng. [153] Một định nghĩa rộng hơn là đột quỵ tắc mạch nguồn không xác định được. [154] Một số nghiên cứu cũng đã tìm thấy AF ở những bệnh nhân nguyên nhân so sánh khác cho đột quỵ đã được xác định về mặt lâm sàng (ví dụ như tăng huyết áp hoặc hẹp động mạch cảnh). [27.127] Do đó, theo dõi điện tâm đồ kéo dài có vẻ hợp lý trong tất cả những người sống sót sau cơn đột quỵ thiếu máu cục bộ mà không được tính toán do AF.
Các khuyến cáo tầm soát rung nhĩ.
|
Các khuyến cáo |
Classa |
Levelb |
Refc |
|
Tầm soát cơ hội cho AF được khuyến cáo bằng lấy xung mạch hoặc bằng ECG nhịp ở bệnh nhân> 65 tuổi |
I |
B |
130, 134, 135 |
|
Ở BN bị TIA hoặc đột qụy thiếu máu cục bộ, tầm soát AF được khuyến cáo bằng ghi ECG ngắn hạn tiếp theo bằng theo dõi ECG liên tục ít nhất 72h |
I |
B |
27, 127 |
|
Người ta khuyến cáo kiểm tra PM và ICD thường xuyên tìm các cơn tần số nhĩ cao (AHRE) nên được thực hiện tiếp theo theo dõi ECG để chứng minh AF trước khi khởi đầu điền trị AF |
I |
B |
141, 156 |
|
Ở BN đột quỵ, theo dõi ECG bổ xung bằng theo dõi ECG không xâm lấn dài hạn hoặc ghi vi mạch được cấy để chứng minh AF im lặng |
IIa |
B |
18, 128 |
|
Tầm soát ECG một cách hệ thống có thể được xem xét để phát hiện AF ở BN > 75 tuổi, hoặc những người có nguy cơ đột quỵ cao. |
IIb |
B |
130, 135, 157 |
AF: rung nhĩ; AHRE: cơn tần số nhĩ cao (atrial high rate episodes); ECG: điện tâm đồ; ICD: máy khử rung tim cấy; TIA: cơn thiều máu cục bộ tạm thời.
a Class khuyến cáo.
b Mức độ bằng chứng.
c Tài liệu tham khảo ủng hộ khuyến cáo.
5.3 Phát hiện điện tâm đồ cuồng nhĩ
Cuồng nhĩ phụ thuộc eo (isthmus) nhĩ phải có mẫu ECG và tần số thất điển hình. [158] Tỷ lệ cuồng nhĩ ít hơn 1/10 tỷ lệ AF. [159] Cuồng nhĩ thường tồn tại cùng hoặc đi trước AF. [160] Trong cuồng nhĩ điển hình phụ thuộc isthmus, các sóng P sẽ thường nhìn thấy hình thái “răng cưa” (saw tooth), đặc biệt các chuyển đạo dưới (II, III, aVF). Tần số thất có thể thay đổi (thường tỷ lệ co bóp nhĩ thất 4:1 đến 2: 1, hiếm các trường hợp 1:1) và nhịp nhanh vào lại vòng lớn (macro reentrant) có thể bỏ sót trong trường hợp dẫn truyền ổn định 2:1. Do đó kích thích phế vị hoặc tiêm tĩnh mạch adenosine có thể hữu ích để làm lộ cuồng nhĩ. Việc điều chỉnh cuồng nhĩ được thảo luận ở chương 13.7. Nhịp nhanh nhĩ trái hoặc phải vòng vào lại lớn chủ yếu được xác định ở các bệnh nhân sau triệt phá AF qua catheter, ngoại khoa, hoặc sau ngoại khoa tim hở. [158]
6. Phân loại rung nhĩ
6.1 Mẫu rung nhĩ
Ở nhiều bệnh nhân, AF tiến triển từ các cơn ngắn, ít thường xuyên sang các đợt công kích dài hơn và thường xuyên hơn. Theo thời gian, nhiều bệnh nhân sẽ phát triển thành các hình thức AF kéo dài. Ở tỷ lệ nhỏ bệnh nhân, AF sẽ vần duy trì các cơn kịch phát quan vài vài thập kỷ (2-3% bệnh nhân AF). [161] Sự phân bố của AF kịch phát tái phát không phải là ngẫu nhiên, mà được gom lại. [162] AF cũng có thể quay trở lại từ AF dai dẳng sang AF kịch phát. Hơn nữa, Các tái phát AF không triệu chứng thường ở các bệnh nhân có AF có triệu chứng. [120]
Trên cơ sở biểu hiện, khoảng thời gian và kết thúc các đợt AF tự phát, 5 loại AF đã được phân biệt theo truyền thống: AF được chẩn đoán lần đầu tiên, cơn kịch phát, dai dẳng, dai dẳng kéo dài và vĩnh viễn (Bảng 5). Nếu bệnh nhân bị cả dai dẳng và cơn, nên phân loại theo loại thường gặp hơn. Các mẫu AF được xác định về mặt lâm sàng không tương ứng hoàn toàn với các chứng cứ AF được đo bằng theo dõi ECG dài hạn.[163] Thậm chí còn ít được biết đến về đáp ứng với điều trị ở những bệnh nhân AF dai dẳng kéo dài hoặc AF cơn dai dẳng kéo dài. Mặc dù sự không chính xác này, sự phân biệt giữa AF kịch phát và dai dẳng đã được sử dụng trong nhiều nghiên cứu và do đó vẫn là cơ sở của một số khuyến cáo.
Bảng 5: Các mẫu rung nhĩ
|
Các mẫu AF |
Khái niệm |
|
AF được chẩn đoán đầu tiên |
AF không được chẩn đoán trước đó, bất kể khoảng thời gian rối loạn nhịp hoặc sự hiện diện và mức độ nặng của triệu chứng liên quan đền AF. |
|
AF kịch phát |
Tự ngừng, ở đại đa số các trường hợp trong phạm vi 48h. Một số cơn AF có thể tiếp diễn đến 7 ngàya. Các cơn AF được chuyển nhịp trong phạm vi 7 ngày nên được xem xét là cơn.a |
|
AF dai dẳng |
AF kéo dài hơn 7 ngày, gồm các cơn được cắt bằng chuyển nhịp, hoặc bằng thuốc hoặc chuyển nhịp bằng điện một chiều, sau 7 ngày hoặc dài hơn. |
|
AF dai dẳng kéo dài |
AF tiếp tục kéo dài ≥ 1 năm khi nó được quyết định để tiếp nhận cho chiến lược kiểm soát nhịp. |
|
AF vĩnh viễn |
AF được chấp nhận bằng cả bệnh nhân (và thày thuốc). Do đó, can thiêp kiểm soát nhịp, theo định nghĩa, không được theo đuổi ở các bệnh nhân AF vĩnh viễn. Chiến lược kiểm soát nhịp có thể được thông qua, rối loạn nhịp sẽ được phân loại lại như “AF dai dẳng kéo dài”. |
AF: rung nhĩ.
aSự phân biệt giữa AF kịch phát và dai dẳng thường không được thực hiện một cách chính xác thiếu cơ hội theo dõi dài hạn không. [163] Do đó, việc phân loại đơn thuần này thường không đủ để lựa chọn phương pháp điều trị cụ thể. Nếu cả hai các cơn kịch phát và dai dẳng hiện diện, nên hướng dẫn phân loại theo loại chiếm ưu thế.
Có một số bằng chứng cho thấy các đoạn AF lắp đi lắp lại có thể ảnh hưởng đến nguy cơ đột quỵ [44.124.164] và có thể sửa đổi đáp ứng về điều trị kiểm soát nhịp. [76.165] Bằng chứng cho điều này còn ít. Vì vậy, các đoạn AF lắp đi lặp lại không phải là một yếu tố quan trọng trong việc quyết định về tính hữu ích của sự can thiệp được coi là phù hợp vì các lý do khác.
6.2 Các loại rung nhĩ phản ảnh các nguyên nhân loạn nhịp khác biệt
Nguy cơ AF phát triển tăng lên trong một loạt các trạng thái sinh lý và bệnh lý (Hình 2), thuật ngữ lịch sử “AF đơn độc” có lẽ là sai lầm và cần phải tránh. [166] Mặc dù mẫu AF có thể giống nhau, cơ chế nền tảng AF thay đổi đáng kể giữa các bệnh nhân [167] (Bảng 6). Điều này cho thấy phân tầng bệnh nhân AF bằng đưa ra nền tảng AF cần thông tim cho điều chỉnh, ví dụ, xem xét đồng bệnh suất tim mạch và hệ thống (như tiểu đường và béo phì [168]), các yếu tố thói quen sống (ví dụ như mức độ hoạt động, hút thuốc lá, uống rượu[169.170]), chỉ dấu tu sửa cấu trúc tim (ví dụ như xơ sợi [171-173] hoặc các thông số điện tim của phức bộ AF[174]), hoặc nền tảng di truyền. Bảng [6] cung cấp như một nguyên tắc phân loại, thông báo do sự đồng thuận của chuyên gia, [76.120.175] nhưng không có nhiều bằng chứng đặt nền móng cho sử dụng lâm sàng. [176] Nghiên cứu có hệ thống xác định các đưa ra AF chủ yếu rõ ràng cần thiết để xác định tốt hơn các loại AF khác nhau. [176]
Bảng 6: Các loại lâm sàng của rung nhĩ a
|
Type AF |
Biểu hiện lâm sàng |
Sinh lý bệnh có khả năng |
|
AF thứ phát do các bệnh tim cấu trúc |
AF ở các BN rối loạn chức năng tâm thu hoặc tâm trương LV, THA kéo dài với LVH, và hoặc các bệnh tim cấu trúc khác. Khởi phát AF ở các BN này là nguyên nhân nhập viện thông thường và dự báo hậu quả xấu. |
Áp lực nhĩ tăng và tái cấu trúc nhĩ, cùng với hoạt hóa hệ thống giao cảm và renin-angiotensin. |
|
AF ổ |
BN với các cơn nhĩ lặp lại, thường xuyên, các cơn AF kịch phát ngắn. Thường triệu chứng nhiều, BN trẻ hơn với các sóng nhĩ có thể phân biệt (AF thô (coarse)), ngoại vị nhĩ, và / hoặc AT thoái hóa thành AF. |
Khởi kích khu vực, trong đại đa số ca nguồn gốc từ các tĩnh mạch phổi, khởi phát AF. |
|
AF đa gene (Polygenic) |
AF ở những người mang biến thể gene phổ biến được kết hợp với AF khởi phát sớm. |
Ngay nay dưới sự nghiên cứu, sự hiện diện của các biến thể gene được lựa chọn có thể cũng ảnh hưởng đến hậu quả điều trị. |
|
AF sau phẫu thuật. |
Khởi phát AF mới (thường tự ngừng) sau phẫu thuật (thường là tim) lớn ở BN có nhịp xoang trước phẫu thuật và không có bệnh sử AF trước đó. |
Các yếu tố cấp: viêm, stress, ô xy hóa nhĩ, trương lực giao cảm cao, các thay đổi điện giải, cả quá tải thể tích, có khả năng tương tác với nền tổn tại trước. |
|
AF với BN có hẹp van 2 lá hoặc van nhân tạo. |
AF ở BN có hẹp van 2 lá, sau phẫu thuật van 2 lá và ở một số trường hợp bệnh van khác. |
Áp lực nhĩ trái (hẹp) và quá tải thể tích (hở) là quá trình đưa đến giãn trước tiên và tái cúc trúc nhĩ trái ở các bệnh nhân này. |
|
AF ở vận động viên. |
Thường là cơn, liên quan đến khoảng thời gian căng thẳng tập luyện. |
Trương lực giao cảm và thể tích nhĩ tăng lên. |
|
AF đơn gene (monogenic). |
AF ở các BN bệnh cơ tim di truyền, gồm các bệnh kênh ion. |
Cơ chế gây loạn nhịp chịu trách nhiệm SD khả năng bổ xung vào sự xuất hiện AF ở các BN này. |
AF: rung nhĩ; LV: thất trái; LVH: phì đại thất trái.BN: bệnh nhân. AT: nhịp nhanh nhĩ. Người ta ghi nhận các type AF này sẽ chồng chéo trong thực hành lâm sàng, ảnh hưởng của chúng đến điều chỉnh cần được đánh giá một cách hệ thống.
6.3 Các khoảng rung nhĩ lắp đi lắp lại có triệu chứng
Bệnh nhân AF có chất lượng sống kém hơn đáng kể so với người khỏe mạnh, trải qua một loạt các triệu chứng bao gồm không muốn làm việc, đánh trống ngực, khó thở, tức ngực, khó ngủ và căng thẳng tâm lý xã hội. [32,177-180] Cải thiện chất lượng sống đã được ghi nhận với cả điều trị bằng thuốc và can thiệp, [181-185] nhưng có ít dữ liệu để so sánh với lợi ích của các phương pháp điều trị khác nhau. [32.186] Đánh giá chất lượng sống tiếp tục hạn chế do thiếu chấp nhận chung của một số thang đánh giá chất lượng sống chuyên biệt cho AF.[187-191] Liên quan đến đánh giá triệu chứng, EHRA đề nghị quy mô triệu chứng của EHRA (Bảng 7) để mô tả mức nghiêm trọng của triệu chứng ở bệnh nhân AF.[192] Một quy mô tương tự (Canadian Cardiovascular Society Severity of Atrial Fibrillation Scale) được sử dụng ở Canada.[193] Quy mô EHRA đã được sử dụng và xác nhận.[194-199] Một sửa đổi được đề xuất trong năm 2014, phân chia class 2 của EHRA vào hai ảnh hưởng, nhẹ (2a) hoặc trung bình (2b). [199] Khi các triệu chứng trong class 2b (triệu chứng ‘khó chịu’) xác định bệnh nhân có lợi ích sức khỏe của kiểm soát nhịp trong nghiên cứu đó, sửa đổi này có thể cung cấp một ngưỡng cho quyết định điều trị tiềm tàng, trong khi chờ xác nhận độc lập. Trong khi một số bệnh nhân AF không có hoặc rất ít triệu chứng (25-40%), nhiều (15-30%) báo cáo về các triệu chứng nghiêm trọng hoặc tàn phế.[194.196] Quy mô EHRA được sửa đổi nên sử dụng để hướng dẫn các quyết định điều trị được hướng theo triệu chứng và cho các bệnh nhân không có triệu chứng theo thời gian.
Bảng 7 : Quy mô triệu chứng của Hội Nhịp Tim Châu Âu được sửa đổ (EHRA) (modified from Wynn et al.199)
|
Thang điểm EHRA sửa đổi |
Các triệu chứng |
Miêutả |
|
1 |
Không |
AF không gây ra bất kỳ triệu chứng nào |
|
2a |
Nhẹ |
Hoạt động hàng ngày bình thường không bị ảnh hưởng do các triệu chứng liên quan đến AF |
|
2b |
Trung bình |
Hoạt động hàng ngày bình thường không bị ảnh hưởng do triệu chứng liên quan đến AF, nhưng bệnh nhân bị khó chịu do các triệu chứng.a |
|
3 |
Nặng |
Hoạt động hàng ngày bị ảnh hưởng do các triệu chứng liên quan đến AF. |
|
4 |
Tàn phế |
Ngừng các hoạt động hành ngày. |
AF: rung nhĩ; EHRA: Hội Nhịp Tim châu Âu.
aEHRA class 2a và 2b có thể được phân biệt do đánh giá bệnh nhân có bị ảnh hưởng do các triệu chứng của AF của họ hay không. Các triệu chứng liên quan AF thông thường nhất mệt mỏi chóang váng (fatigue) / mệt mỏi(tiredness) và khó thở khi gắng sức, hoặc thường ít hồi hộp và đau ngực.[42,194,200–202]
Khuyến cáo về sử dụng quy mô triệu chứng của Hội Nhịp Tim châu Âu được cải biên.
|
Khuyến cáo |
Classa |
Levelb |
Refc |
|
Sử dụng quy mô triệu chứng của EHRA được cải biên được khuyến cáo trong thực hành lâm sàng và các nghiên cứu để định lượng các triệu chứng liên quan đến AF. |
I |
C |
192, 199 |
• AF: rung nhĩ; EHRA: Hội Nhịp Tim châu Âu.
•a Độ mạnh của khuyến cáo.
• bMức độ của bằng chứng.
• c Tài liệu tham khảo ủng hộ các khuyến cáo.
(Còn tiếp)







