Mục tiêu: Nghiên cứu lâm sàng phase III được tiến hành trên những bệnh nhân Nhật Bản đái tháo đường típ 2, điều trị với linagliptin 5 mg và 10 mg, lần lượt so sánh với giả dược và voglibose, cho thấy cải thiện đường huyết có ý nghĩa lâm sàng sau 12 và 26 tuần điều trị. Nghiên cứu kéo dài thêm này nhằm đánh giá tính dung nạp lâu dài của linagliptin sau 52 tuần.
E. Araki1, R. Kawamori2, N. Inagaki3, H. Watada4, N. Hayashi5, Y. Horie6, A. Sarashina7, S. Thiemann8,
M. von Eynatten8, K. Dugi8 & H.-J. Woerle8
1Department of Metabolic Medicine, Kumamoto University Graduate School of Medicine, Kumamoto, Japan
2 Sportology Center, Juntendo University Graduate School of Medicine, Tokyo, Japan
3 Department of Diabetes and Clinical Nutrition, Kyoto University Graduate School of Medicine, Kyoto, Japan
4 Department of Metabolism and Endocrinology, Juntendo University Graduate School of Medicine, Tokyo, Japan
5 Clinical Research, Boehringer Ingelheim, Tokyo, Japan
6 Medical Data Service, Boehringer Ingelheim, Tokyo, Japan
7 Clinical Pharmacokinetics/Pharmacodynamics, Boehringer Ingelheim, Hyogo, Japan
8 Global Medical Affairs, Boehringer Ingelheim, Ingelheim, Germany
Người biên dịch: Bs Trần Việt Thắng
ĐHYD – TP. HCM
Phương pháp: Tuyển chọn vào nghiên cứu những bệnh nhân Nhật Bản đái tháo đường típ 2 đã hoàn tất một trong hai giai đoạn nghiên cứu 12 tuần/26 tuần so sánh giữa đơn trị linagliptin với giả dược hoặc voglibose. Trong nghiên cứu kéo dài thêm, các nhóm so sánh được chuyển sang linagliptin 5 hoặc 10mg, còn các nhóm sử dụng linagliptin vẫn tiếp tục duy trì liều cũ.
Kết quả: Tổng cộng 540 bệnh nhân được uống ít nhất 1 liều linagliptin 5 hoặc 10mg và 494 hoàn tất giai đoạn kéo dài. Linagliptin được dung nạp tốt khi điều trị lâu dài; biến cố ngoại ýđược đặc biệtquan tâm và biến cố ngoại ý nghiêm trọng xảy ra ở tỷ lệ nhỏ bệnh nhân. Biến cố ngoại ý liên quan thuốc lần lượt xảy ra ở nhóm bệnh nhân dùng linagliptin 5 và 10 mg là 10.2 và 10.6%, ngưng thuốc do biến cố ngoại ý liên quan thuốc lần lượt ở 2 nhóm là 1.1 và 0.7%. Chỉ có 1 bệnh nhân (0.4%) trong mỗi nhóm liều linagliptin được xác định hạ đường huyết trong quá trình điều trị (cả 2 đều không nghiêm trọng). Cân nặng ở 2 nhóm không thay đổi có ý nghĩa lâm sàng. Nồng độ HbA1c tương đương nhau ở nhóm linagliptin 5 và 10 mg.
Kết luận: Những kết quả này cung cấp bằng chứng cho thấy tính an toàn và dung nạp của linagliptin ở cả liều 5 hoặc 10 mg trên bệnh nhân Nhật Bản đái tháo đường típ 2 trong 52 tuần mà không làm gia tăng có ý nghĩa lâm sàng nguy cơ hạ đường huyết hoặc tăng cân.
Từ khóa: bệnh nhân Nhật Bản, linagliptin, an toàn lâu dài, típ 2
Giới thiệu
7.3% dân số Nhật Bản mắc đái tháo đường [đa số là đái tháo đường típ 2], và thêm 13.4% bị rối loạn dung nạp glucose [1]. Ước tính tổng cộng có 7 đến 9 triệu bệnh nhân bị đái tháo đường [1,2]
Bệnh thận đái tháo đường và giảm chức năng thận là biến chứng thường gặp của đái tháo đường típ 2 và cần được xem xét đến khi quyết định điều trị bằng thuốc viên hạ đường huyết [3–5]. Tại Nhật, khoảng 30% bệnh nhân đái tháo đường típ 2 có albumin niệu vi lượng hoặc đại lượng [5], và khoảng 44% bệnh nhân phát hiện sớm đái tháo đường típ 2 sẽ diễn tiến đến bệnh thận đái tháo đường trong vòng 30 năm [4].
Các thuốc mới như ức chế dipeptidyl peptidase (DPP)-4, mở ra nhiều lựa chọn không chỉ đơn trị mà còn kết hợp với các thuốc viên khác. Ức chế DPP-4 ngăn cản sự thoái giáng glucagon-like peptide-1 (GLP-1) nội sinh, do đó đẩy mạnh tiết insulin phụ thuộc glucose từ tế bào β và giảm tiết glucagon từ tế bào α, cho phép kiểm soát đường huyết sinh lý hơn với tỷ lệ hạ đường huyết thấp [6,7]. Ức chế DPP-4 được dung nạp tốt và có ít có tác dụng hay không ảnh hưởng đến cân nặng.
Linagliptin là thuốc ức chế DPP-4 có hiệu quả và tính chọn lọc cao, dùng mỗi ngày 1 lần, được chấp thuận trong điều trị đái tháo đường típ 2 tại Hoa Kỳ, Châu Âu và Nhật Bản. Không giống như các thuốc ức chế DPP-4 khác, linagliptin được bài thiết qua mật và ruột chứ không phải qua thận, giúp sử dụng thuận lợi mà không cần điều chỉnh liều ở bệnh nhân có suy giảm chức năng thận [8]. Các thử nghiệm lâm sàng trước đây trên người da trắng và Nhật Bản cho thấy linaglipitin có dược tính ổn định khi uống 1 lần mỗi ngày, có hiệu quả làm giảm đường huyết và có tính dung nạp tương đương giả dược [9–14]. Một nghiên cứu vừa được công bố gần đây tiến hành trên các bệnh nhân đái tháo đường típ 2 bị suy thận nặng cho thấy tính hiệu quả và an toàn của linagliptin ở nhóm bệnh nhân dễ tổn thương này [15].
Nghiên cứu phase III được tiến hành nhằm khẳng định hiệu quả điều trị và liều tối ưu của linagliptin trên bệnh nhân Nhật Bản đái tháo đường típ 2, đồng thời so sánh hiệu quả và an toàn của nó với thuốc voglibose , thuộc nhóm ức chế α-glucosidase (một loại thuốc viên hạ đường huyết hay được dùng ở Nhật Bản). Kết quả của giai đoạn điều trị 12 tuần và 26 tuần trước đây đã được báo cáo [16]. Nói ngắn gọn, linagliptin đơn trị với liều 5 và 10 mg cho thấy giảm HbA1c, đường huyết đói có ý nghĩa lâm sàng so với giả dược và voglibose. Cả 2 liều dùng của linagliptin đều làm giảm HbA1c nhiều hơn có ý nghĩa thống kê so với voglibose. Cả 2 liều linagliptin đều được dung nạp tốt mà không có hạ đường hyyết trong nhóm nghiên cứu. Nghiên cứu mù đôi kéo dài đến 52 tuần được trình bày trong bài báo này nhằm tiếp tục đánh giá thêm về an toàn và hiệu quả lâu dài của linagliptin ở liều 5 và 10 mg.
Đối tượng và phương pháp nghiên cứu
Thiết kế nghiên cứu
Nghiên cứu được tiến hành tại 47 trung tâm ở Nhật từ ngày 1/04/2008 đến ngày 14/01/2010. Nghiên cứu được đăng ký trên clinicalTrials.gov (NCT00654381).Bệnh nhân Nhật Bản đái tháo đường típ 2 đã hoàn tất một trong 2 thử nghiệm lâm sàng phase III so sánh hiệu quả và an toàn của linagliptin đơn trị với giả dược hoặc voglibose trong 12 tuần hoặc 26 tuần trước đây được nhận vào nghiên cứu kéo dài này [17].
Phương pháp phân nhóm ngẫu nhiên cho các giai đoạn nghiên cứu đã được công bố trước đây [16]. Nói ngắn gọn, bệnh nhân được phân nhóm ngẫu nhiên theo tỷ lệ 2 : 2 : 2 : 1 vào nhóm điều trị mù đôi với linagliptin 5 mg 1 lần mỗi ngày, linagliptin 10mg 1 lần mỗi ngày hoặc voglibose 0.2mg 3 lần mỗi ngày trong 26 tuần, hoặc giả dược trong 12 tuần. Tất cả các bệnh nhân có 2 tuần ở giai đoạn chạy thử với giả dược (và bệnh nhân tiền sử dùng thuốc viên phải qua giai đoạn lọc sạch (washout) 2 tuần trước đó). Vào tuần 12, bệnh nhân điều trị giả dược được chuyển sang giai đoạn điều trị mù đôi thứ 2 với linagliptin 5 hoặc 10mg trong 14 tuần tiếp theo.
Trong giai đoạn kéo dài, bệnh nhân đã chuyển từ giả dược sang linagliptin ở bất kỳ liều nào được tiếp tục điều trị trong 26 tuần tiếp theo. Bệnh nhân dùng voglibose đến tuần 26 cũng được chuyển sang linagliptin 5 hoặc 10mg trong 26 tuần tiếp theo. Bệnh nhân mà trước đó đã được phân ngẫu nhiên vào nhóm linagliptin 5 hoặc 10 mg thì vẫn tiếp tục liều cũ trong giai đoạn kéo dài (Hình 1A). Giai đoạn kéo dài này tiếp tục đánh giá tính an toàn, dung nạp và hiệu quả lâu dài của linagliptin trong 52 tuần điều trị với linagliptin.
Nghiên cứu được tiến hành tuân theo tuyên bố Helsinki và nguyên tắc thực hành lâm sàng tốt (Good Clinical Practice -GCP) (tháng 10/1996) cùng với các quy định GCP của Nhật Bản (Pháp lệnh số 28; 27 tháng 03/1997, Bộ Y Tế và Phúc Lợi ). Đề cương nghiên cứu, bản đồng thuận tham gia và bảng thu thập thông tin bệnh nhân được xem xét và chấp thuận bởi các ủy ban xét duyệt địa phương.
Dân số nghiên cứu
Nhận vào nghiên cứu những bệnh nhân đái tháo đường típ 2 trong độ tuổi từ 20 đến 80 có BMI ≤ 40 kg/m2 và có đường huyết chưa kiểm soát (HbA1c 7.0 –10.0% ở bệnh nhân chưa được điều trị thuốc viên; HbA1c 7.0–9.0% lúc sàng lọc và 7.0–10.0% sau giai đoạn lọc sạch (washout) ở bệnh nhân đã được điều trị 1 hoặc 2 thuốc viên trong ≥10 tuần trước đó). Loại khỏi nghiên cứu những bệnh nhân có đường huyết đói >13.3 mmol/l trong giai đoạn lọc sạch hoặc giai đoạn chạy thử với giả dược; nhồi máu cơ tim, đột quỵ, hay thiếu máu não thoáng qua trong vòng 6 tháng trước, suy chức năng gan, điều trị với glitazone, insulin hoặc thuốc giảm béo trong vòng 3 tháng trước, tham gia bất kỳ nghiên cứu thử thuốc nàotrong vòng 2 tháng trước và/hoặc đã biết có tiền sử không dung nạp, dị ứng hoặc quá mẫn với voglibose hoặc bất kỳ thành phần nào của thuốc.
Kết cục nghiên cứu
Kết cục chính trong giai đoạn kéo dài là tính an toàn và dung nạp lâu dài của linagliptin dựa trên tỷ lệ chung các biến cố ngoại ý (biến cố ngoại ý – adverse events -AEs) với tần số ≥ 5% ở bệnh nhân được điều trị với linagliptin 5 hoặc 10 mg 1 lần mỗi ngày cho đến 52 tuần. Kết cục phụ về tính an toàn bao gồm các biến cố ngoại ý liên quan đến thuốc với tần số ≥ 2% được xác định bởi các nghiên cứu viên, biến cố ngoại ý được quan tâm đặc biệt (phản ứng quá mẫn, biến cố ngoại ý trên gan, thận hay viêm tụy), biến cố ngoại ý nghiêm trọng (serious adverse events – SAEs), hạ đường huyết được xác định bởi nghiên cứu viên, biến cố ngoại ý trên tim mạch cũng như các thay đổi hoặc các phát hiện liên quan trên lâm sàng qua việc thăm khám, dấu sinh hiệu, ECG 12 chuyển đạo và các xét nghiệm cận lâm sàng trong suốt thời gian điều trị linagliptin. Tất cả các biến cố ngoại ý được mã hóa thông qua Medical Dictionary for Drug Regulatory Affairs phiên bản 12.1. Biến cố ngoại ý nghiêm trọng được xác định là các biến cố đe dọa tính mạng, gây tử vong hoặc gây ra tàn phế/mất chức năng kéo dài hay nặng nề, phải nằm viện lâu hoặc được coi là nguyên nhân chính gây ra bất kỳ nguy cơ đáng kể nào. Một ủy ban độc lập bên ngoài tiến hành xem xét mù bất kỳ biến cố ngoại ý nào nghi ngờ trên tim mạch và mạch máu não.
Kết cục phụ về hiệu quả là sự thay đổi vào tuần 52 so với ban đầu cùng với thay đổi theo thời gian của HbA1c và đường huyết đói. Các kết cục khảo sát về hiệu quả được lấy từ nghiên cứu 12 và 26 tuần gồm sự ức chế men DPP-4, nồng độ insulin lúc đói, tỷ số proinsulin/insulin, đánh giá mô hình hằng định nội môi đề kháng insulin (HOMA-IR) và bài tiết insulin (HOMA-IS) cũng như chỉ số phân bố (disposition index).
Phân tích thống kê
Kết cục an toàn và sự dung nạp thuốc dựa trên thống kê mô tả mà không có gán dữ liệu mất trong nhóm điều trị (tức là tất cả bệnh nhân phân nhóm ngẫu nhiên được điều trị ít nhất 1 liều thuốc nghiên cứu). Phân tích hiệu quả dựa trên thống kê mô tả tất cả các trường hợp quan sát được khi hoàn tất (gồm tất cả bệnh nhân phân nhóm ngẫu nhiên được đo lường lần đầu và ít nhất 1 lần sau lần đầu mà được uống ít nhất 1 liều thuốc của nghiên cứu). Thống kê suy luận đánh giá kết cục về hiệu quả không được thực hiện vì giai đoạn kéo dài không có so sánh.
Kết quả
Phân bố và đặc điểmbệnh nhânnghiên cứu
Trong nghiên cứu phân nhóm ngẫu nhiên, đối chứng ban đầu, 561 bệnh nhân Nhật Bản đái tháo đường típ 2 được chia ngẫu nhiên vào các nhóm điều trị (linagliptin 5mg:n=159, linagliptin 10 mg:n=160, voglibose:n=162 và giả dược: n=80). Trong dân số nghiên cứu ban đầu, 540 bệnh nhân nhận được ít nhất 1 liều linagliptin 5 hoặc 10 mg, và 494 bệnh nhân (91.5%) hoàn tất 52 tuần điều trị (hình 1B). Đặc điểm nhân trắc và lâm sàng ban đầu được trình bày trong bảng 1. Trung bình [± độ lệch chuẩn] của tuổi, BMI, và HbA1c lần lượt là 60.0 (±9.7) tuổi, 24.8 (±3.7) kg/m2 và 8.0 (±0.9)%, và nam giới chiếm 70.6% dân số nghiên cứu.
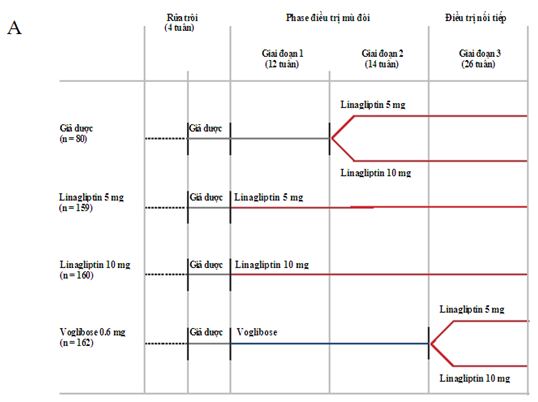
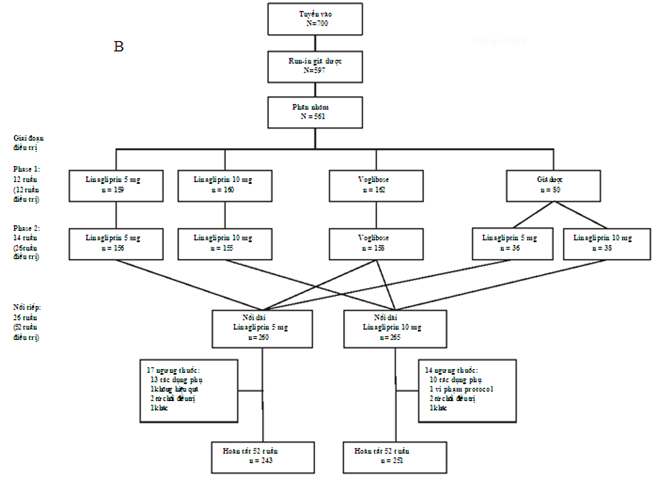
Hình 1.Sơ đồ thời giancủa giai đoạn kéo dài với (A) là thiết kế tổng quát và (B) là phân bố bệnh nhân.
Bảng 1. Đặc điểm nhân chủng học và lâm sàng ban đầu tính từ lúc khởi đầu nghiên cứu và giai đoạn kéo dài
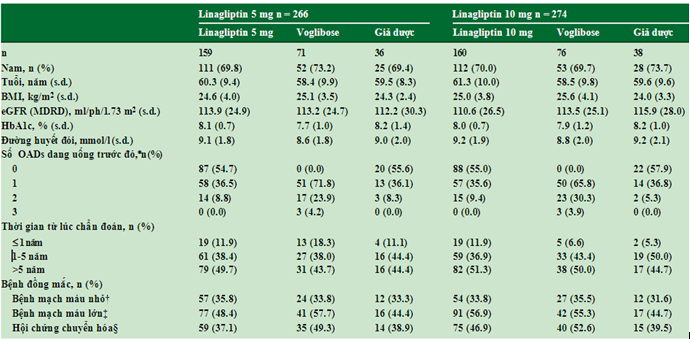
BMI, body mass index: chỉ số khối cơ thể; eGFR, estimated glomerular filtration rate: độ lọc cầu thận ước tính;; HbA1c, glycated haemoglobin A1c; MDRD, modification of diet in renal disease; Thuốc viên, thuốc viên hạ đường huyết.
*Gồm cả voglibose được uống trong 26 tuần. †Gồm cả bệnh võng mạc, bệnh thận, bệnh thần kinh đái tháo đường.
‡Gồm bệnh mạch vành, tắc nghẽn mạch máu ngoại biên, bệnh mạch máu não và tăng huyết áp.
§Định nghĩa hội chứng chuyển hóa theo Nhật Bản: béo phì bụng (vòng eo ³ 85 cm ở nam và ³ 90 cm ở nữ)
Cộng thêm ³2 tiêu chuẩn sau: (i) triglyceride ³1.69 mmol/l hoặc đang điều trị; (ii) HDL- cholesterol < 1.03 mmol/l l hoặc đang điều trị; (iii) huyết áp ³130/85 mmHg hoặc đang điều trị và (iv) đường huyết đói ³6.11 mmol/l (³110 mg/dl) hoặc đường huyết bất kỳ ³7.77 mmol/l (³140 mg/dl).
Tính an toàn và dung nạp
Điều trị linagliptin lâu dài được dung nạp tốt, với tỷ lệ nhỏ bệnh nhân trong mỗi nhóm liều thuốc bị các biến cố ngoại ý được đặc biệt quan tâm và biến cố ngoại ý nghiêm trọng. Biến cố ngoại ý liên quan đến thuốc sau 52 tuần gặp ở 27 trên tổng số 266 (10.2%) bệnh nhân ở nhóm linagliptin 5mg và 29 trên tổng số 274 (10.6%) bệnh nhân ở nhóm linagliptin 5 và 10 mg (bảng 2). Tỷ lệ mới mắc biến cố ngoại ý liên quan đến thuốc ở cả 2 nhóm linagliptin 5 và 10 mg tương đương nhau trong các giai đoạn trước đó của nghiên cứu. Vào tuần 12, biến cố ngoại ý liên quan đến thuốc gặp ở 9.4% trong 159 bệnh nhân điều trị linagliptin 5 mg và 8.8% trong 160 bệnh nhân điều trị linagliptin 10 mg. Vào tuần 26, biến cố ngoại ý liên quan đến thuốc gặp ở 11.3% bệnh nhân điều trị linagliptin 5 mg và 10.3% bệnh nhân điều trị linagliptin 10mg.
Biến cố ngoại ý liên quan đến thuốc được xác định bởi nghiên cứu viên thường gặp nhất 2 nhóm liều linagliptin, (lần lượt ở liều 5 và 10 mg) là rối loạn ở hệ tiêu hóa, mặc dù tỉ lệ mới mắc rất thấp: táo bón (1.9 và 2.2%), đầy hơi (1.5 và 2.6%). Biến cố ngoại ý nghiêm trọng được báo cáo lần lượt là 20 (7.5%) và 14 (5.1%) bệnh nhân trong nhóm linagliptin 5 và 10 mg. Chỉ có 1 trường hợp (0.4%) bị biến cố ngoại ý nghiêm trọng, thoát vị thành bụng phải nhập viện được cho là biến cố ngoại ý liên quan thuốc trong nhóm điều trị linagliptin 5 mg.
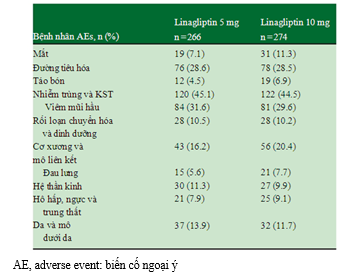
Ngưng thuốc do biến cố ngoại ý liên quan đến thuốc gặp lần lượt ở nhóm 5 và 10 mg linagliptin là 1.1 và 0.7%. 1 trường hợp (0.4%) trong mỗi nhóm liều linagliptin bị hạ đường huyết thỏa định nghĩa do nghiên cứu viên xác nhận (cả 2 đều không nghiêm trọng). Tất cả các biến cố ngoại ý có tỉ lệ mới mắc >5% được trình bày trong bảng 3.
Sau 52 tuần, cân nặng vẫn ổn định trong nhóm điều trị ban đầu với linagliptin. Thay đổi cân nặng trung bình so với ban đầu vào tuần 52 là – 0.11 kg ở nhóm linagliptin 5mg và – 0.07 ở nhóm linagliptin 10mg.
Trong 52 tuần điều trị, các biến cố tim hoặc mạch máu não được ghi nhận ở 12 bệnh nhân trong nhóm linagliptin; trong đó, 7 ở nhóm 5 mg và 5 ở nhóm 10 mg. Trong nhóm linagliptin 5 mg, có 1 bệnh nhân thiếu máu não thoáng qua, 3 bệnh nhân đột quỵ không tử vong và 3 bệnh nhân hội chứng vành cấp không tử vong. Trong nhóm linagliptin 10 mg, có 2 bệnh nhân đột quỵ không tử vong và 3 bệnh nhân hội chứng vành cấp không tử vong. Không có biến cố nào được cho là liên quan đến thuốc. Trong các giai đoạn đầu của nghiên cứu, tỷ lệ mới mắc biến cố ngoại ý tương đương giữa 2 nhóm liều linagliptin và giả dược sau 12 tuần cũng như giữa 2 nhóm liều linagliptin và voglibose sau 26 tuần.
Các xét nghiệm đánh giá trong 52 tuần cho thấy không có thay đổi có ý nghĩa lâm sàng về các thông số huyết học hoặc điện giải. Nồng độ trung bình cholesterol toàn phần, HDL-C, LDL-C, triglyceride nằm trong giới hạn bình thường vào lúc bắt đầu và lúc kết thúc nghiên cứu. Nồng độ AST trung bình tăng nhẹ vào lúc kết thúc so với ban đầu ở cả hai nhóm điều trị linagliptin, nhưng sự tăng này không có ý nghĩa trên lâm sàng:1 U/L đối với nhóm linagliptin 5 mg và 3 U/L đối với nhóm linagliptin 10 mg. Nồng độ ALT trung bình giảm nhẹ ở nhóm linagliptin 5mg (-2U/L) và tăng nhẹ ở nhóm linagliptin 10mg (1U/L). Cả 2 đều không có ý nghĩa lâm sàng. Biến cố ngoại ý trên gan mật lần lượt gặp ở 3.4 và 2.6% ở nhóm linagliptin 5 và 10 mg, nhưng không có bệnh nhân nào thỏa định luật Hy’s. Chỉ có thay đổi nhỏ về phân loại chức năng thận (đánh giá bằng độ lọc cầu thận) được ghi nhận. Tổng cộng, 17 bệnh nhân chuyển từ bình thường
Bảng 2.Biến cố ngoại ý trong nhóm linagliptin 5 và 10 mg trong 52 tuần
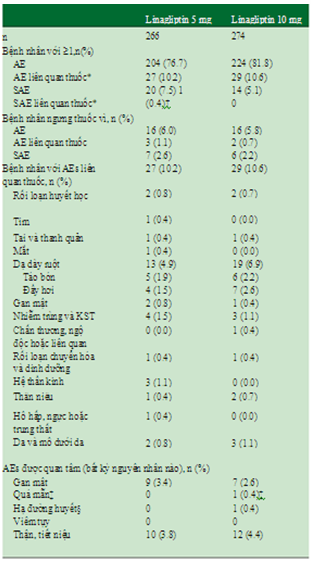
AE, adverse event: biến cố ngoại ý; SAE, serious adverse event: biến cố ngoại ý nghiêm trọng.
* Được xác định bởi nghiên cứu viên là có thể, hầu như chắc chắn hoặc chắc chắn liên quan thuốc.
†SAE liên quan đến thuốc: 1 ca thoát vị thành bụng cần nhập viện.
‡Quá mẫn là hen theo mùa nặng hơn (dị ứng), được cho là do thay đổi theo mùa.
§Không có số liệu về hạ đường huyết được xác định bằng đo glucose máu.
sang suy thận nhẹ, 2 bệnh nhân chuyển từ suy thận nhẹ sang trung bình và 9 bệnh nhân chuyển từ suy thận nhẹ sang bình thường. Biến cố ngoại ý trên thận xảy ra lần lượt là 3.8 và 4.4% ở nhóm bệnh nhân linagliptin 5 và 10 mg. Không có trường hợp suy thận thực sự nào được báo cáo.
Bảng 3.Biến cố ngoại ý chung với tỷ lệ >5%
Tính hiệu quả
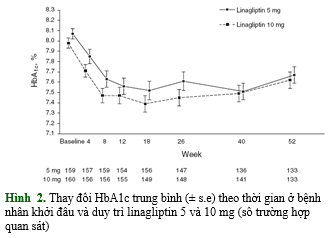
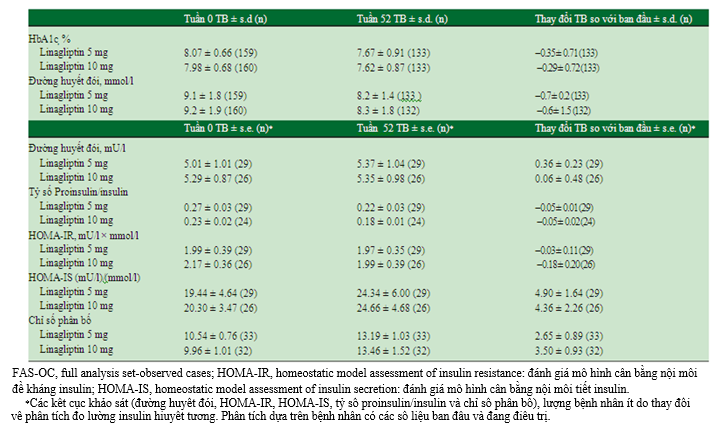
Hiệu quả kiểm soát đường huyết được đo bởi thay đổi HbA1c sau 52 tuần là tương đương nhau ở 2 nhóm liều linagliptin. HbA1c đạt nồng độ ổn định sau 8 tuần và hiệu quả tiếp tục được duy trì đến 52 tuần. Giảm HbA1c, trung bình (± độ lệch chuẩn), sau 52 tuần ở nhóm linagliptin 5 và 10 mg lần lượt là – 0.35 (0.71) và – 0.29 (0.72)% (hình 2). Giảm đường huyết đói tương đương nhau ở 2 nhóm liều linagliptin (bảng 4)
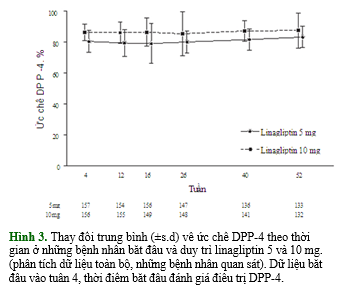
Theo như hình 3, sự ức chế DPP-4 vẫn tiếp tục được duy trì trong giai đoạn kéo dài ở những bệnh nhân được khởi đầu và tiếp tục điều trị linagliptin 5 hoặc 10 mg. Các đo lường chức năng tế bào βsau 52 tuần so với ban đầu cho thấy cải thiện ở cả 2 nhóm liều linagliptin (bảng 4). Trung bình (± độ lệch chuẩn) của chỉ số phân bố tăng lần lượt 2.65 (0.89) và 3.50 (0.93) ở nhóm linagliptin 5 mg (n=33) và 10 mg (n=32). Của chỉ số HOMA-IS tăng lần lượt 4.90 (1.64) và 4.36 (2.26) (mU/l)/(mmol/l) ở nhóm linagliptin 5 mg (n=29) và 10 mg (n=26).
Bảng 4.Tóm tắt kết cục về hiệu quả sau 52 tuần ở bệnh nhân phân nhóm vào linagliptin 5 hoặc 10 mg khi bắt đầu nghiên cứu (FAS-OC)
Thảo luận
Trong giai đoạn kéo dài của thử nghiệm lâm sàng pha III này, tỷ lệ mới mắc toàn bộ các biến cố ngoại ý cho thấy đơn trị lâu dài với linagliptin liều 5 và 10 mg uống 1 lần mỗi ngày trong 52 tuần an toàn và được dung nạp tốt ở bệnh nhân người Nhật đái tháo đường típ 2. Tỷ lệ mới mắc toàn bộ các biến cố ngoại ý sau 52 tuần tương đương nhau ở cả 2 liều linagliptin, cũng như tỷ lệ ngưng điều trị và đồng thời không có khác biệt đáng kể nào đối với các biến cố ngoại ý riêng lẻ khi điều trị với linagliptin 5 và 10 mg. Đa số bệnh nhân có tác dụng ngoại ý không liên quan đến thuốc trong quá trình nghiên cứu. Trong số các tác dụng ngoại ý liên quan đến thuốc được báo cáo, hầu hết được xác định có mức độ từ nhẹ đến trung bình và rất ít dẫn đến phải ngưng thuốc. Tỷ lệ mới mắc biến cố ngoại ý liên quan đến thuốc là hằng định trong cả 3 giai đoạn của nghiên cứu, bao gồm những bệnh nhân khác nhau về thời gian dùng thuốc. Do đó, ít có khả năng là thời gian điều trị linagliptin ở cả 2 liều ảnh hưởng đến tỷ lệ mới mắc của biến cố ngoại ý.
Biến cố ngoại ý hay gặp nhất là nhiễm trùng và viêm nhiễm (như viêm mũi họng), kế tiếp là rối loạn tiêu hóa, nhưng chỉ có một số ít được cho có liên quan đến thuốc. Các thử nghiệm lâm sàng trước đây làm gia tăng mối lo ngại về mối liên quan giữa ức chế DPP-4 với gia tăng nguy cơ biến cố ngoại ý hay gặp là các nhiễm trùng nhẹ, như viêm mũi họng hoặc viêm hô hấp trên [18]. Tuy nhiên, phân tích gộp các thử nghiệm lâm sàng ngẫu nhiên gần đây trên 3572 bệnh nhân đái tháo đường típ 2 điều trị với linagliptin (n=2523) hoặc giả dược (n=1049) kéo dài đến 24 tuần không cho thấy làm gia tăng tỉ lệ nhiễm trùng nói chung do thuốc [19].
Biến cố ngoại ý do thuốc gây bệnh lý ở da và mô dưới, là vấn đề được quan tâm của thuốc ức chế DPP-4, xảy ra ở rất ít bệnh nhân (lần lượt là 0.8 và 1.1% ở nhóm linagliptin 5 và 10 mg). Tính dung nạp tốt của linagliptin được quan sát tương tự như kết quả các phân tích gộp gần đây [19]. Phân tích này cho thấy linagliptin được dung nạp tốt với tỷ lệ mới mắc toàn bộ các biến cố ngoại ý và biến cố ngoại ý nghiêm trọng tương tự với giả dược.
Không có liều linagliptin nào liên quan với tăng cân có ý nghĩa lâm sàng hoặc tỉ lệ mới mắc hạ đường huyết. Tỷ lệ mới mắc hạ đường huyết thấp (0% với linagliptin 5 mg, 0.4% với linagliptin 10 mg) đã được dự đoán trước vì cơ chế tác dụng của linagliptin và phù hợp với dữ liệu từ các nghiên cứu khác [19]. Ức chế DPP-4 khống chế gia tăng đường huyết thông qua việc kích thích tụy sản xuất insulin và ức chế tiết glucagon phụ thuộc nồng độ glucose; do đó, ít xảy ra hạ đường huyết ở nhóm thuốc này [20,21]. Đa số bệnh nhân đái tháo đường trên thế giới bị tăng cân và béo phì, đồng thời có nhiều thuốc điều trị đái tháo đường làm tăng cân (insulin, sulphonylureas và thiazolidinediones) [22], gây ra thách thức trong điều trị bệnh nhân đái tháo đường típ 2 thừa cân hoặc béo phì. Bởi vì các thuốc ức chế DPP-4 như linagliptin cải thiện kiểm soát đường huyết trong khi ít có ảnh hưởng đến cân nặng nên thuốc có tiềm năng lớn trong việc thêm vào các lựa chọn điều trị đái tháo đường típ 2 bằng thuốc uống hiện tại.
Khác biệt về kiểm soát đường huyết giữa 2 liều linagliptin không đáng kể và cũng không có ý nghĩa lâm sàng, do đó củng cố thêm về liều điều trị tối ưu của linagliptin là 5 mg. Cả 2 liều linagliptin đều ức chế kéo dài men DPP-4 >80% trong hơn 24 giờ, và sự ức chế không giảm đi sau 52 tuần, và không có hiệu quả phụ thuộc liều của ức chế men DPP-4 hay kiểm soát đường huyết giữa 2 liều. Các quan sát này có cùng kết quả như các thử nghiệm tiền lâm sàng, với hiệu quả incretin tối đa đạt được sau 24 h,với ức chế men DPP-4 80% kéo dài [23,24]. Trong số các bệnh nhân bắt đầu với liều linagliptin 5 hoặc 10 mg, giảm HbA1c được duy trì đến52 tuần, mặc dù HbA1c trung bình vẫn còn cao hơn mục tiêu 7.0% ở cả 2 nhóm. Giống như các báo cáo trước đây, hiệu quả trên đường huyết có thể bị giảm do hiệu ứng lọc sạch (washout effect) [16]. Khoảng 45% bệnh nhân được điều trị 1 hoặc 2 loại thuốc viên trước khi nhận vào nghiên cứu và chấm dứt điều trị trong 4 tuần lọc sạchtrước khibắt đầu linagliptin 5 hoặc10 mg. Ngoài ra, giá trị trung bình HbA1c ở tuần 26 và 52 được đánh giá qua việc quan sát các bệnh nhânvà có thể bị ảnh hưởng bởi mất mẫu hay sai sót dữ liệu. Trong khi nồng độ HbA1c trung bình cho thấy có xu hướng gia tăng ở nhóm linagliptin10 mg từ tuần thứ 26, sự gia tăng này không rõ ở nhóm liều 5 mg và sai số chuẩn của trung bình chồng chéo nhau ở các thời điểm sau đó.
Trong giai đoạn kéo dài này, các test thống kê không được thực hiện cho các thông số về tính hiệu quả. Tuy nhiên, trong nghiên cứu ban đầu, đã cho thấy kiểm soát đường huyết khác biệt có ý nghĩa thống kê ở nhóm linagliptin 5 và 10 mg so với giả dược ở tuần 12 và so với voglibose ở tuần 26 [16]. Trong những giai đoạn đầu, thay đổi HbA1c với linagliptin trội hơn so với giả dược và voglibose.
Kết quả về các kết cục của được khảo sát của linagliptin 5 và 10 mg đã cho các bằng chứng về hiệu quả có lợi trên chức năng tế bào b. Chỉ số phân bố, giá trị HOMA-IS tăng ở cả 2 nhóm. Tuy nhiên, đối với các kết cục này, số lượng bệnh nhân rất nhỏ do thay đổi về mẫu phân tích đo lường insulin huyết tương. Ban điều hành nghiên cứu cho rằng mẫu phân tích ban đầu là quá cũ để có thể đo lường có giá trị, và các dữ liệu này bị loại khỏi nghiên cứu.
Biến cố tim mạch hiệu chỉnh gặp ở một số nhỏ bệnh nhân trong mỗi nhóm điều trị linagliptin, tỷ lệ mới mắc chung khoảng 1.3%. Bằng chứng từ phân tích gộp được công bố gần đây dựa trên 8 thử nghiệm lâm sàng linagliptin pha III (bao gồm cả dữ liệu 26 tuần của nghiên cứu này) cho thấy rằng thuốc không làm tăng tỷ lệ mới mắc biến cố tim mạch mà còn có thể giúp làm giảm nguy cơ tim mạch so với các thuốc so sánh gộp[25]. Thử nghiệm lâm sàng đa quốc gia CAROLINA (mã số định danh trên ClinicalTrials.gov là NCT01243424) sẽ bổ sung dữ liệu về kết cục lâu dài trên tim mạch của linagliptin so với sulphonylurea.
Nghiên cứu linagliptin dài hạn này nghiên cứu độc nhất đánh giá 1 loại thuốc ức chế DPP-4 đơn trị liệu ở bệnh nhân Nhật Bản đái tháo đường típ 2, các thuốc ức chế DPP-4 khác cũng được đánh giá đơn trị liệu so với metformin trong những thử nghiệm lâm sàng dài hạn ở những quần thể dân số rộng hơn. Trong các nghiên cứu này, thuốc ức chế DPP-4 cải thiện đường huyết lâu dài có ý nghĩa lâm sàng, nhưng chưa được chứng minh là tốt hơn metformin [21].
Các kết quả từ nghiên cứu kéo dài này bị hạn chế bởi đặc tính không có nhóm điều trị đối chứng. Chỉ có so sánh điều trị ở 2 nhóm liều linagliptin mà thôi. Tuy nhiên, dữ liệu về hiệu quả, an toàn đối chứng giả dược và thuốc khác đã được công bố trước đó từ giai đoạn 12 và 26 tuần của nghiên cứu này [16]. Một nghiên cứu khác cũng đang được tiến hành trên đối tượng bệnh nhân Nhật Bản đái tháo đường típ 2 nhằmđánh giá hiệu quả và an toàn của linagliptin khi kết hợp vớithuốc viên khác có trên thị trường, so sánh với metformin trong 52 tuần (mã số định danh trên clinicalTrials.gov là NCT01204294).
Tóm lại, những kết quả này bổ sung thêm dữ liệu về tính an toàn và dung nạp của linagliptin liều 5 hoặc 10 mg dùng 1 lần mỗi ngày trong 52 tuần ở bệnh nhân đái tháo đường típ 2 Nhật Bản. Đơn trị liệu linagliptin sẽ là lựa chọn điều trị quan trọng ở bệnh nhân Nhật Bản đái tháo đường típ 2, giúp giảm đường huyết có ý nghĩa lâm sàng trong 52 tuần mà không có biến cố ngoại ý nghiêm trọng cũng như không ảnh hưởng đến cân nặng và có nguy cơ hạ đường huyết thấp.
Acknowledgements
The authors were fully responsible for all content and editorial decisions, were involved at all stages of manuscript develop- ment and have approved the final version of the manuscript. Medical writing assistance, supported financially by Boehringer Ingelheim, was provided by Mark Poirier of Envision Scientific Solutions during the preparation of this manuscript. These findings were presented in part at the Word Diabetes Congress of the International Diabetes Federation, Dubai, UAE, 1-5 December 2011.
Conflict of Interest
E. A. has received consultancy fees from Boehringer Ingelheim and Novo Nordisk; speaker fees from Ono, Novartis, Novo Nordisk, MSD, Eli Lilly and Takeda; and research support from Novartis. R. K. has received consultancy fees from Boehringer Ingelheim and speaker fees from MSD, Novartis, Takeda, Ono, Novo Nordisk and Eli Lilly. N. I. has received consultancy fees from Boehringer Ingelheim, Takeda and Novo Nordisk; speaker fees from MSD, Novartis, Novo Nordisk, Eli Lilly, Takeda and Ono; and research support from Boehringer Ingelheim, MSD, Novartis, Novo Nordisk, Eli Lilly, Takeda and Ono. H. W. has received consultancy fees from Boehringer Ingelheim; speaker fees from MSD, Novartis, Takeda, Novo Nordisk and Eli Lilly; and research support from MSD, Novartis, Takeda, Boehringer Ingelheim, Novo Nordisk and Eli Lilly. N. H., Y. H., A. S., Y. G., S. T., M. vE., K. D. and H.-J. W. are employees of Boehringer Ingelheim, the study sponsor and manufacturer of linagliptin.
References
1. International Diabetes Federation. IDF Diabetes Atlas. 5 edn. Brussels: International Diabetes Federation, 2011.
2. Morimoto A, Nishimura R, Tajima N. Trends in the epidemiology of patients with diabetes in Japan. JMAJ 2010; 53: 36-40.
3. Bakris GL. Recognition, pathogenesis, and treatment of different stages of nephropathy in patients with típ 2 diabetes mellitus. Mayo Clin Proc 2011; 86: 444-456.
4. Yokoyama H, Okudaira M, Otani T et al. Higher incidence of diabetic nephropathy in típ 2 than in típ 1 diabetes in early-onset diabetes in Japan. Kidney Int 2000; 58: 302-311.
5. Yokoyama H, Sone H, Oishi M, Kawai K, Fukumoto Y, Kobayashi M Prevalence of albuminuria and renal insufficiency and associated clinical factors in típ 2 diabetes: the Japan Diabetes Clinical Data Management study (JDDM15). Nephrol Dial Transplant 2009; 24: 1212-1219.
6. Nauck MA, Vilsboll T, Gallwitz B, Garber A, Madsbad S. Incretin-based therapies: viewpoints on the way to consensus. Diabetes Care 2009; 32: S223-231.
7. Bohannon N. Overview of the gliptin class (dipeptidyl peptidase-4 inhibitors) in clinical practice. Postgrad Med 2009; 121: 40-45.
8. Blech S, Ludwig-Schwellinger E, Grafe-Mody EU, Withopf B, Wagner K. The metabolism and disposition of the oral dipeptidyl peptidase-4 inhibitor, linagliptin, in humans. Drug Metab Dispos 2010; 38: 667-678.
9. Heise T, Graefe-Mody EU, Huttner S, Ring A, Trommeshauser D, Dugi KA. Pharmacokinetics, pharmacodynamics and tolerability of multiple oral doses of linagliptin, a dipeptidyl peptidase-4 inhibitor in male típ 2 diabetes patients. Diabetes Obes Metab 2009; 11: 786-794.
10. Del Prato S, Barnett AH, Huisman H, Neubacher D, Woerle HJ, Dugi KA. Effect of linagliptin monotherapy on glycaemic control and markers of beta-cell function in patients with inadequately controlled típ 2 diabetes: a randomized controlled trial. Diabetes Obes Metab 2011; 13: 258-267.
11. Forst T, Uhlig-Laske B, Ring A et al. Linagliptin (BI 1356), a potent and selective DPP-4 inhibitor, is safe and efficacious in combination with metformin in patients with inadequately controlled típ 2 diabetes. Diabet Med 2010; 27: 1409-1419.
12. Forst T, Uhlig-Laske B, Ring A, Ritzhaupt A, Graefe-Mody U, Dugi KA. The oral DPP-4 inhibitor linagliptin significantly lowers HbA1c after 4 weeks of treatment in patients with típ 2 diabetes mellitus. Diabetes Obes Metab 2011; 13: 542-550.
13. Sarashina A, Sesoko S, Nakashima M et al. Linagliptin, a dipeptidyl peptidase-4 inhibitor in development for the treatment of típ 2 diabetes mellitus: a Phase I, randomized, double-blind, placebo-controlled trial of single and multiple escalating doses in healthy adult male Japanese subjects. Clin Ther 2010; 32: 1188-1204.
14. Horie Y, Kanada S, Watada H et al. Pharmacokinetic, pharmacodynamic, and tolerability profiles of the dipeptidyl peptidase-4 inhibitor linagliptin: a 4-week multicenter, randomized, double-blind, placebo-controlled phase IIa study in Japanese típ 2 diabetes patients. Clin Ther 2011; 33: 973-989.
15. McGill JB, Sloan L, Newman J et al. Long-term efficacy and safety of linagliptin in patients with típ 2 diabetes and severe renal impairment: a 1-year, randomized, double-blind, placebo-controlled study. Diabetes Care; DOI: 10.2337/dc12-0706 [Epub ahead of print].
16. Kawamori R, Inagaki N, Araki E et al. Linagliptin monotherapy provides superior glycaemic control versus placebo or voglibose with comparable safety in Japanese patients with típ 2 diabetes: a randomized, placebo and active comparator-controlled, double-blind study. Diabetes Obes Metab 2012; 14: 348-357.
17. Horie Y, Hayashi N, Dugi K, Takeuchi M. Design, statistical analysis and sample size calculation of a phase IIb/III study of linagliptin versus voglibose and placebo. Trials 2009; 10: 82.
18. Willemen MJ, Mantel-Teeuwisse AK, Straus SM, Meyboom RH, Egberts TC, Leufkens HG. Use of dipeptidyl peptidase-4 inhibitors and the reporting of infections: a disproportionality analysis in the World Health Organization VigiBase. Diabetes Care 2011; 34: 369-374.
19. Schernthaner G, Barnett AH, Emser A et al. Safety and tolerability of linagliptin: a pooled analysis of data from randomized controlled trials in 3572 patients with típ 2 diabetes mellitus. Diabetes Obes Metab 2012; 14: 470-478.
20. Richard KR, Shelburne JS, Kirk JK. Tolerability of dipeptidyl peptidase-4 inhibitors: a review. Clin Ther 2011; 33: 1609-1629.
21. Scheen AJ. DPP-4 inhibitors in the management of típ 2 diabetes: a critical review of head-to-head trials. Diabetes Metab 2012; 38: 89-101.
22. Inzucchi SE. Oral antihyperglycemic therapy for típ 2 diabetes: scientific review. JAMA 2002; 287: 360-372.
23. Krishna R, Herman G, Wagner JA. Accelerating drug development using biomarkers: a case study with sitagliptin, a novel DPP4 inhibitor for típ 2 diabetes. AAPS J 2008; 10: 401-409.
24. Roy RS, Wu J, Eiermann G et al. Plasma DPP-4 inhibition by sitagliptin and other DPP-4 inhibitors correlates with and predicts glucose lowering efficacy. Diabetes 2009; 58: A612.
25. Johansen OE, Neubacher D, von Eynatten M, Patel S, Woerle HJ. Cardiovascular safety with linagliptin in patients with típ 2 diabetes mellitus: a pre-specified, prospective, and adjudicated meta-analysis of a phase 3 programme. Cardiovasc Diabetol 2012; 11:







