TÓM TẮT
Đặt vấn đề: Thuốc ức chế Dipeptidylpeptidase-4 được báo cáo có tác dụng có lợi trong việc thiếu máu cục bộ cơ tim.
Berthold Hocher a,b,*,1, Yuliya Sharkovska b,c,1,
Michael Mark d, Thomas Klein d ,Thiemo Pfab b,e
a. Viện Khoa Học về Dinh Dưỡng, Đại học Potsdam, Potsdam, Berlin, Đức
b. Trung tâm Nghiên cứu về Tim Mạch/Viện Dược, Charite, Berlin, Đức
c. Viện Sinh dưỡng Anatomy, Charité, Đại học Berlin, 10115 Berlin, Đức
d. Viện Dược Boehringer Ingelheim, Nghiên cứu về bệnh tim mạch, Birberach, Đức
e. Trung tâm nghiên cứu về thận, Cơ sở từ thiện Benjamin Franklin, Berlin, Đức
Biên dịch:
ThS.BS. Lại Thị Phương Quỳnh
Bộ môn Nội Tiết, trường ĐHYD TP.HCM
Cơ chế có thể bao gồm sự suy giảm của tế bào mô đệm – dẫn xuất từ yếu tố alpha 1, kết quả gia tăng sự hồi phục của các tế bào gốc trong tuần hoàn và/ hoặc con đường phụ thuộc vào thụ thể incretin. Nghiên cứu này đánh giá ức chế dipeptidylpeptidase-4 mới có gốc xanthin là linagliptin (BI 1356) và BI 14361 trong thiếu máu cơ tim cục bộ.
Phương pháp: Chuột đực Wistar đã được điều trị trước với lignaliptin hoặc BI 14361 và bị thắt nhánh xuống động mạch vành trái trước trong 30 phút.
Kết quả: Chất ức chế của dipeptidylpeptidase-4 làm giảm rõ rệt kích thước vùng nhồi máu sau 7 ngày (-27,7%, p< 0,05) và sau 8 tuần (-18,0%, p< 0.05). Có cải thiện đáng kể về tốc độ tối đa sự suy giảm áp lực ở tâm thất trái (dp/dt/min) trên động vật được điều trị bằng linagliptin 8 tuần sau khi bị thiếu máu cục bộ/ tái tưới máu. Ngoài ra, điều trị không cải thiện chức năng tim ,xác định bằng siêu âm tim và thông tim. Nhuộm hóa mô miễn dịch cho thấy gia tăng đáng kể số lượng các tế bào dương tính với tế bào mô đệm dẫn xuát từ yếu tố alpha 1, CXCR-4 VÀ CD34 ở trong và quanh vùng cơ tim bị nhồi máu trên động vật được điều trị BI 1436.
Kết luận: Lignaliptin và BI 14361 có thể làm giảm kích thước vùng nhồi máu sau khi bị thiếu máu cơ tim cục bộ. Những phát hiện từ hóa mô miễn dịch hỗ trợ cho giả thuyết rằng chất ức chế dipeptidylpeptidase-4 thông qua việc loại bỏ các tế bào đệm có nguồn gốc từ yếu tố alpha 1 có thể đưa đến gia tăng của CXCR-4 và các tế bào progenitor trong tuần hoàn.
- Giới thiệu
Trong thập kỷ qua một số nghiên cứu đang được tiến hành đã chú trọng vào sửa chửa cơ tim bằng sử dụng các tế bào gốc có nguồn gốc từ tủy xương và các tế bàoprogenitors nội mô (1). Một số thí nghiệm trên động vật và con người trong bệnh cơ tim thiếu máu cục bộ cho thấy sự cải thiện chức năng tim và kéo dài thời gian sống sau khi huy động các tế bào gốc hay tiêmtrực tiếp vào cơ tim hay tiêm vào động mạch vành.
Ngoài giả định có biệt hóa chéo ( trans differentiation) với cơ tim, tế bào gốc dường như tăng cường việc sửa chữa cơ tim thông qua tác động cận mô (para crine) ví dụ như trên tân tạo mạch hay ngăn chặn qua trình chết theo chương trình.(6,7). Tất cả các cơ chế này tùy thuộc vào tiếp ứng (homing) hiệu quả của tế bào gốc sau khi có thiếu máu cục bộ cơ tim. Trong mô tim, hệ thống chính của sự tiếp ứng (homing) dường như là sự tương tác giữa yếu tố SDF-1 alpha dẫn xuất từ tế bào mô đệm cơ tim (hay CXCL12), là chất được tiết ra từ các tế bào nội mô trong mô thiếu máu cục bộ và các thụ thể CXCR-4 (hay thụ thể SDF-1) tiếp ứng được bộc lộ trên nhiều tế bào progenitor trong tuần hoàn(8,9).
SDF-1 được loại bỏ bởi dipeptidylpeptidase (DPP)-4 (hay CD26), là một peptidase ngoài tế bào dính màng tế bào (10). DPP-4 được bộc lộ trên nhiều quần thể tế bào tạo máu, bao gồm cả tế bào lympho T và B kích thích, tế bào nội mô, nguyên bào sợi, tế bào biểu mô và các tế bào CD34 + tế bào gốc(11,12). Do đó, hoạt động phân giải protein có thể sẽ hạn chế hiệu quả của SDF α trong môi trường viêm của nhồi máu cơ tim. Bên cạnh đó ,DPP-4 lại hiện diện ở dạng hòa tan hoạt động trong huyết tương (13). Người ta thấy rằng khi tiêm vào cơ tim protein SDF-1 kháng DPP-4 có biến đổi sẽ thúc đẩy hồi phục của CXCR-4 + tế bào gốc và cải thiện chức năng tim sau nhồi máu cơ tim ở chuột (14).
Từ vài năm nay, chất ức chế DPP-4 dạng uống đã được giới thiệu như chất làm giảm đường huyết.Chất này ngăn chặn bất hoạt của 2 hóc -môn incretin (GLP)-1 và GIP. Cả hai đều được phóng thích từ ruột non để đáp ứng với tiêu hóa thức ăn và điều hòa đường huyết(16). Sự hoạt hóa các thụ thể incretin làm tăng nhanh nồng độ cAMP nội bào dẫn đến sự hoạt hóa phosphokinase A và yếu tố đáp ứng với cAMP gắn liền với protein phosphryl hóa(16).Sự hoạt hóa thụ thể của GLP-1 dẫn đến hoạt động của kinase điều hòa tín hiệu ngoại bào (erk) ½, protein kinase C, và phosphatidylinostitol-3 kinase, tất cả đều liên quan đến việc bảo vệ chống lại tổn thương khi thiếu máu cục bộ/ tái tưới máu. Một số nghiên cứu dã chỉ ra rằng GLP-1 hay chất tương tự GLp-1 đã giới hạn kích thước vùng nhồi máu cơ tim trong các mô hình động vật khác nhau. Hai nghiên cứu gần đây đã chứng minh rằng ngừng hoạt động DPP-4 do di truyền hay thuốc ( sitagliptin, diprotinA) có ảnh hưởng rõ lên kích thước vùng nhồi máu hay sống còn sau nhồi máu cơ tim ở chuột.(20,21). Một nghiên cứu khác gần đây cũng phát hiện khi điều trị trước với sitagliptin làm giảm kích thước vùng nhồi máu cơ tim thông qua tăng hoạt hóa phosphokinase phụ thuộc cAMP (22)
Trong nghiên cứu này chúng tôi giả thuyết với thuốc ức chế DPP-4 liều dược lý bằng cách dùng nhóm ức chế DDP-4 mới gốc xanthine có thể có tác dụng có lợi trên kích thước của vùng nhồi máu cơ tim và chức năng tim trong mô hình chuột bị thiếu máu cơ tim cục bộ /tái tưới máu. Cơ chế hoạt động có thể dogiảm SDF-1 alpha dẫn đến gia tăng CXCR-4 + tế bào gốc hoặc qua con đường phụ thuộc vào thụ thể incretin. Linagliptin là một ức chế DPP-4 gốc xathine đã được chấp thuận điều trị bệnh đái tháo đường típ 2 ở Mỹ. Để áp dụng được cho các chất ức chế DDP-4 gốc xanthine, trước hết chúng tôi sẽ nghiên cứu tác dụng ngắn hạn BI 14361, một loại tương tự lignaliptin . Sau khi hoàn tất thành công nghiên cứu ngắn hạn này, chúng tôi bắt đầu nghiên cứu hiệu quả kéo dài của lignaliptin.
2. Vật liệu và phương pháp nghiên cứu:
2.1. Hợp chất ức chế DPP-4
BI14361 (8-[(3R)-3-amino-1-piperidinyl]-7-(2-butyn-1-yl)-1-[(4,6-dimethyl-2-pyrimidinyl)methyl]-3-methyl-xanthine) là một loại chất ức chế DPP-4 gốc xanthine tương tự như lignaliptin (BI 1356; (R)-8-(3-aminopiperidin-1-yl)-7-but-2-ynyl-3-methyl-1-(4-methyl-quinazolin2-ylmethyl)-3,7-dihydro-purine-2,6-dione). Để xem các cấu trúc phân tử xem hình 1. Các IC50 của DPP-4 người là 2nM cho BI 14361 và 1nM cho lignaliptin. Sự chọn lọc của cả hai hợp chất so với các chất khác liên quan đến men DPP (ví dụ như DPP-8, DPP-9) ít nhất là gấp 1000 lần.. Độ mạnh của BI 14361 in vivo trong việc giảm lđường huyết dưới đường cong trong thử nghiệm dung nạp đường glucose ở chuột tương tự như linagliptin (<1 mg/kg)

2.2. Động vật và đề cương nghiên cứu:
Thí nghiệm trên động vật đã được tiến hành phù hợp với các hướng dẫn của các viện nghiên cứu địa phương đưa ra trong việc chăm sóc, sử dụng động vật trong phòng thí nghiệm và được sự chấp thuận của chính quyền điạ phương.Điều này cũng phù hợp với chỉ thị 2010/63/EU của Nghị Viện Châu Âu. Chuột Wistar đực (300–350 g, Phòng Thí nghiệm Charles River, Wilmington, MA, USA) giữ trong điều kiệnmôi trường có kiểm soát (20 ± 20C, chu kỳ 12giờ ngày/đêm), và nuôi bằng một chế độ ăn chuẩn, nước uống tự do. Động vật được nhốt theo cặp trước khi thực hiện các thí nghiệm gây thiếu máu cục bộ/ tái tưới máu và sau đó được nuôi riêng lẻ. Để kiểm lại các khái niệm của thử nghiệm, đầu tiên một nghiên cứu ngắn hạn với các hợp chất BI 143611 đã được thực hiện. Sau khi hoàn tât thành công các nghiên cứu ngắn, một nghiên cứu dài hạn thứ hai với linagliptin (BI 1356) được thực hiện. Để nghiên cứu ngắn hạn, chuột được chia ngẫu nhiên thành 3 nhóm: nhóm 1: sham + vehicle, n=11 ; nhóm 2: thiếu máu cục bộ/ tái tưới máu + vehicle ; n=12 ; nhóm 3: thiếu máu cục bộ/ tái tưới máu + BI 14361, n=14. Với nghiên cứu dài hạn thì chuột được chia làm 2 nhóm ngẫu nhiên: nhóm 1: Thiếu máu cục bộ/ tái tưới máu + giả dược (vehicle), n=20 ; Nhóm 2: Thiếu máu cục bộ / tái tưới máu + lignaliptin, n=20. BI 14361 và lignaliptin (được cung cấp bởi Viện Dược Boehringer Ingelheim, Birberach, Đức) được hòa tan trong dung dịch nước 0,5% methylcellulose, khuấy ở nhiệt độ phòng trong 10 phút và làm lạnh với nhiệt độ âm trong 5phút. Các dung dịch được chuẩn bị mới mỗi ngày. Trong nghiên cứu ngắn hạn BI 14361 (3mg / kg trong lượng pha 2ml/kg) hay giả dược mỗi ngày được cho chuột uống qua ống, bắt đầu 2 ngày trước ngày bắt đầu gây thiếu máu cục bộ/ tái tưới máu và liên tục trong 7 ngày sau thiếu máu cục bộ/ tái tưới máu. Trong nghiên cứu lignaliptin dài hạn (3mg/kg với lượng pha 2ml / kg) hay giả dược được cho uống qua ống, bắt đầu 4 tuần trước ngày bắt đầu gây thiếu máu cục bộ/ tái tưới máu và tiếp tục trong 8 tuần sau thiếu máu cục bộ/ tái tưới máu. Siêu âm tim được thực hiện một ngày trước khi làm thủ thuật thiếu máu cục bộ/ tái tười máu và 1 ngày trước khi kết thúc nghiên cứu trên tất cả động vật nghiên cứu. Dữ liệu huyết động đã được thu thập 7 ngày sau khi gây thiếu máu cục bộ/ tái tưới máu ở nghiên cứu ngắn và sau 8 tuầnđối với nghiên cứu dài. Ngay sau khi đặt thông tim động mạch vành trái bị làm tắc lại ngay và 300ml FluoSpheres (10 µm tinh thể huỳnh quang màu đỏ ; Invitrogen, CA, USA) được tiêm vào khoang thất trái trong khoảng 1 phút cùng lúc đó động mạch chủ được kẹp chéo. Chuột thực nghiệm đượd làm chết bằng tiêm Kali clorua gây ngưng tim thì tâm trương. Sau đó trái tim được lấy ra và sử dụng máy cắt khuôn tim ( Trung tâm Khoa học Braintree, Braintree, MA,USA) và cắt lát từ đỉnh đến đáy thành 5 lát ngang ,dày 1mm. Bốn phần được chuẩn bị để đánh giá vùng có nguy cơ (AAR) và kích thước vùng nhồi máu. Một đường cắt ngang dưới van tim1-2mm được cố định trong dung dich đệm formalin10%. Trước khi tiêm KaliClorua vào tim, một mẫu máu cuối cùng được lấy qua động mạch chủ bụng.Lấy phần huyết tương và cho đông lạnh ở nhiệt độ -800C để dùng khi cần phân tích thêm.Hoạt động của DPP-4 huyết tương được xác định như Boehringer Ingelheim đã mô tả trước đây. Nồng độ của huyết tương GLP-1 được xác định sau nghiên cứu dài(Mouse/Rat Total Active GLP-1 Assay Kit, Meso Scale Discovery, Gaithersburg, MD, USA)
2.3. Thủ thuật gây thiếu máu cục bộ tim/ tái tưới máu:
Chuột được gây mê với 65mg/ kg pentobarbital, i.p., đặt nội khí quản và thông khí (SAR-830, CWE, Admore,PA,USA) Buprenorphine được tiêm trực tiếp i.p. trước và sau khi can thiệp (0,05 mg / kg). Độ sâu của mê được theo dõi bằng toe pinch.Điện tâm đồ được nối màn hình để theo dõi rối loạn nhịp tim trong quá trình thủ thuật gây thiếu máu cục bộ / tái tưới máu ( BioAmp, ADInstruments, Colorado Springs, CO,USA).Việc mổ lồng ngực trái được thực hiện thông qua khoang liên sườn thứ ba. Sau đó lấy phổi ra và được mở màng ngoài tim. Nhánh LAD được thắt lại bằng chỉsilk 6.0 và khâu 4mm từ nơi xuất phát , kết thúc bằng nút thắt. Thiếu máu cục bộ trên timđược xác nhận bởi màu trắng của cơ tim và hình ảnh điện tâm đồ cótổn thương (phức QRS rộng và ST chênh). Sau 30 phút tháo chỉ buộc và nhìn bằng mắt xác định có sự tái tưới máu.Trong nhóm thử nghiệm sham chứng, việc mổ lồng ngực được thực hiện mà LAD không cần thắt.
2.4. Siêu âm tim:
Siêu âm tim được thực hiện một ngày trước thủ thuật gây thiếu máu cục bộ/ tái tưới máu và một ngày trước kết thúc thí nghiệm trên tất cả động vật thực nghiệm. Động vật được gây mê với isoflurance 3%.Lồng ngực được cạo và được bôi gel siêu âm.Máy siêu âm Biosound MyLab30 Gold (Universal Ultrasound, Bedford Hills, NY, USA)có đầu dò tần số 12 MHz được sử dụng. Đường kính cuối tâm thu và cuối tâm trương tâm thất trái được đo qua trục ngắn của cơ nhú sử dụng M-mode. Thời gian tống máu, phân suất tống máu và nhịp tim cũng được ghi nhận.
2.5. Thông tim:
Động vật được gây mê với 65 mg/kg pentobarbital ip và ở động mạch cảnh phải đặt ống thông Millar (SPR-838 2F) Millar Instrument, Houston, TX, USA). Thu thậpdữ liệu áp lực cuối tâm thu và cuối tâm trương tâm thất trái, tốc độbtối đa của tăng nhịp thất (+ dP/dt) và tốc độ tối đa của sự giảm áp lực thất (– dP/dt).
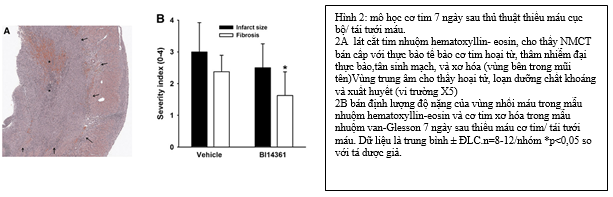
2.6. Thang điểm mô học của kích thước vùng nhồi máu và xơ hóa cơ tim:
Các lát cắt ngang tim cố định formalin được nhúng trong paraffin, cắt thành 5µm và phần đem nhuộm vớiHematoxylin–eosinvà Van Giesson.Kích thước vùng nhồi máu được đánh giá bán định lượng trong mẫu nhuộm hematoxylin–eosin. Chỉ số về mức độ nghiêm trọng được đánh giá từ 0-4 cho mỗi mẫu; 0: mô học bình thường ; 1: ước tính kích thước vùng nhồi máu 1-5% ; 2. 6-10% ‘ 3: 11-30% ; 4: >30%. Mức độ xơ hóa cơ tim được đánh giá trong mẫu nhuộm Van Giesson với cùng một thang điểm. Tất cả các mẫu được đánh giá mù.
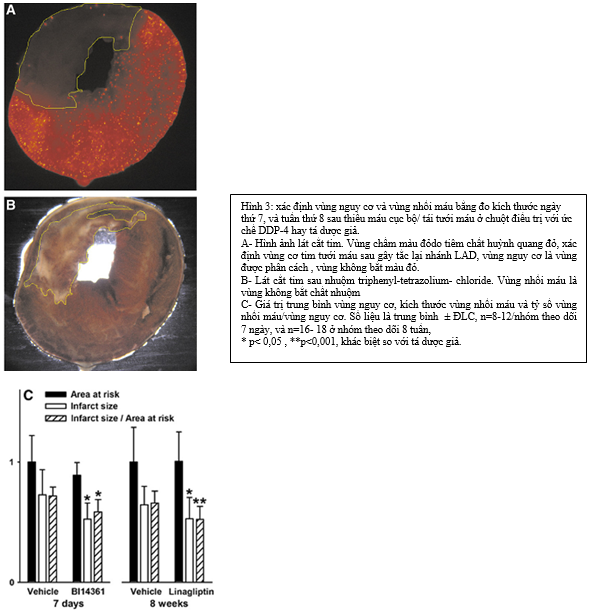
2.7. Xác định vùng tim nguy cơ và vùng nhồi máu:
Lát cắt tim được ủ vào dung dịch đệm 1% triphenyl-terazolium- chloride (pH=7.4) (Sigma-Aldrich, St Louis,MO,USA) ở 370C trong 10 phút. Hình ảnh kỹ thuật số của mẫu nhuộm được chụp và phân tích diện tích dùng chương trình NIH Imagel 1,43 dạng mù. Tinh thể huỳnh quang đỏ (red fluorescent microspheres)chỉ ra mô tim được tưới máu.Định nghĩa AAR là vùng mô tả không có tinh thể đỏ.Vùng nhồi máu định nghĩa là vùng không nhuộm chất triphenyl-terazolium- chloride.Mỗi động vật thực nghiệm tính tóan vùng AAR và vùng nhồi máu bằng trung bình của 4 lát cắt khác nhau.Trên mỗi động vật thực nghiệm,tỷ lệ nhồi máu cơ tim được tính bằng kích thước vùng nhồi máu chia cho AAR.
2.8. Hóa mô miễn dịch:
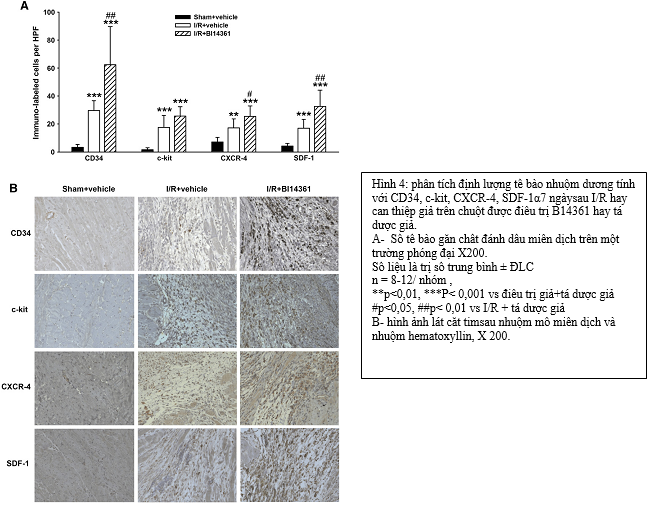
Làm hóa mô miễn dịch sau các nghiên cứungắn để đánh giá vai trò tại chổ của SDF-1 alpha và tế bào gốc trong tuần hoàn đối với sự sửa chữa của cơ tim 1 tuần sau tổn thương do thiếu máu cục bộ. Một mẩu paraffin (3.5 µm) được loại sáp và đun sôi nhẹ trong dung dịch đệm citrate để kháng nguyên lộ ra. Để làm nguội peroxidase nội sinh , các mẫu được ủ trong 10mM với 0.3% H2O2 trong Methanol. Ngăn chặn các kết hợp không đặc hiệu bằng cách sử dụng huyết thanh bình thường 10% của lừa hay dê, tùy theo kháng thể thứ phát dùng sau đó. Anti-CD34 đa dòng của dê (pha loãng 1:50, Santa Cruz Biotechnology, Santa Cruz, CA, USA), anti-c kit đa dòng của dê (pha loãng 1:50, Santa Cruz Biotechnology ), anti CXCR-4đa dòng của thỏ (pha loãng 1:50, Abcam, Cambridge, MA, USA) và anti- SDF-1α (pha loãng 1:100, NMI, Reudinggen, Germany) được cho vào , để qua đêm ở 40C sau đó ủ với kháng thể thứ phát bionylated goat anti- rabbit (pha loãng 1: 250, Glostrup, Denmark) hay ủ với kháng thể thứ phát bionylated donkey anti- rabbit (pha loãng 1: 250 Jackson Immunoresearch, West Grove, PA, USA). Mẫu mô sau đó được nhuộm lần 2 với hematoxyllin. Trên môi trường khuếch đại (X200) , số lượng trung bình các tế bào bắt nhuộm với CD34, c-kit, CXCR-4 và SDF-1 α trong mô cơ tim được xác định. Mô cơ tim bình thường được phân tích trong nhóm sham (chứng), toàn bộ vùng cơ tim nhồi máu kể cả vùng bờ rìa đều được phân tích trong nhóm thiếu máu cục bộ/ tái tưới máu (ít nhất mỗi lát cắt xem trên 8 trường )
2.9. Phân tích thống kê:
Dữ liệu được phân tích với SPSS 19.0(SSPS Inc, Chicago, H, USA). Kết quả được biểu hiện qua số trung bình ± độ lệch chuẩn. test Kruskal- Wallis non parametric và test Mann-Whitney U được dung kiểm tra sực khác biệt ý nghĩa thống kê giữa các nhóm
3- KẾT QUẢ:
3.1. Tử vong:
Tử vong trong phẩu thuật của nghiên cứu ngắn: có 2 trường hợp (18%) trong nhóm chứng , 4 trường hợp (33%) trong nhóm tái tưới máu và giả dược, và 2 trường hợp (14%) trong nhóm thiếu máu/tái tưới máu +B1 14361.
Tử vong trong phẩu thuật của nhóm nghiên cứu dài: 4 trường hợp (20%) trong nhóm tái tưới máu và giả dược và 2 trường hợp (14%) trong nhóm thiếu máu/tái tưới máu +linagliptine. Không có sự khác biệt về biến cố lọan nhịp tim trong thủ thuật trên nhóm thiếu máu cục bộ/tái tưới máu giữa nhóm điều trị linagliptine và giả dược. Không thêm trường hợp tử vong nào trong suốt quá trình thực nghiệm.
3.2. Siêu âm tim:
Đánh giá siêu âm tim ngày 6 và 8 sau khi làm thủ thuật gây thiếu máu cục bộ/ tái tưới máu :cho thấy có sự xấuđi rõ rệt chức năng tim ở nhóm thiếu máu/tái tưới máu trong khi không thay đổi chức năng tim ở nhóm phẩu thuật chứng (sham – operated) Bảng 1. Siêu âm tim không cho thấy sự khác biệt có ý nghĩa chức năng tim ở nhóm dùng ức chế DDP-4 và giả dược (bảng 1).
3.3. Thông tim (catheterization):
Các chỉ số huyết động ngày thứ 7 sau tái tưới máu không khác biệt có ý nghĩa giữa các nhóm điều trị. Kết quả tuần thứ 8 cho thấy có sự giảm rõ dP/dt min ở nhóm điều trị Linagliptine.
3.4. Phân tích mô học:
Đánh giá bán định lượng bởi 1 nhà bệnh học kinh nghiệm cho thấy có giảm kích thước nhồi máu (-17%) và giảm rõ rệt mức độ lan rộng của xơ hóa sợi cơ tim (-31,6% dựa theo bảng điểm bán định lượng ( Semiquantitative Scale ; p<0,05) ở nhóm động vật điều trị B14361 (hình 2).
Đánh giá định lượng AAR và kích thước nhồi máu cho thấy AAR không khác biệt giữa các nhóm điều trị (hình 3).Điều này cũng cùng với sự thật là AAR được quyết định chính ở vùng chủ yếu cung cấp máu bởi động mạch LAD. Các nhóm điều trị với ức chế DDP-4 có kích thước vùng nhồi máu thấp hơn có ý nghĩa (BI 14363 -27.7%, Linagliptine -18.0%), và tỷ lệ mô nhồi máu trong vùng AAR (tỷ lệ nhồi máu/AAR BI 14363 -18,5%, Linagliptine -20.8%) khi so sánh với nhóm điều trị giả dược. (bảng 3)
Bảng 1: Kết quả siêu âm tim trước nghiên cứu ,ngày thứ 6 và tuần thứ 8 sau can thiệp gây thiếu máu/ tái tưới máu (I/R) hay can thiệp giả (sham) trên chuột được điều trị ức chế DDP-4 hay tá dược giả.
|
Theo dõi |
ngày 6 sau can thiệp |
Tuần 8 sau can thiệp |
|||
|
Sham+ tá dược giả |
I/R + tá dược giả |
I/R +B14361 |
I/R + tá dược giả |
I/R + linagliptin |
|
|
Đường kính thất trái cuối tâm trương (mm) |
|
|
|
|
|
|
Ban đầu |
6.5 ± 0.5 |
6.4 ± 0.7 |
6.2 ± 0.8 |
7.6 ± 0.5 |
7.8 ± 0.6 |
|
Theo dõi |
6.3 ± 0.8 |
7.5 ± 0.9 |
7.2 ± 0.7 |
9.0 ± 7.0 |
9.4 ± 0.7 |
|
Đường kính thất Trái cuối tâm thu (mm) |
|
|
|
|
|
|
Ban đầu |
3.2 ± 0.2 |
3.1 ± 0.4 |
3.0 ± 0.5 |
3.9 ± 0.4 |
4.1 ± 0.5 |
|
Theo dõi |
3.0 ± 0.4 |
5.3 ± 1.1 |
5.1 ± 0.6 |
6.4 ± 0.6 |
6.5 ± 0.9 |
|
Phân suất co hồi thất trái FS(%) |
|
|
|
|
|
|
Ban đầu |
51.6 ± 1.2 |
51.1 ± 1.5 |
53.1 ± 3.4 |
48.1 ± 3.7 |
47.3 ± 4.2 |
|
Theo dõi |
51.8 ± 2.6 |
28.9 ± 9.9 |
28.9 ± 5.5 |
29.1 ± 4.0 |
30.7 ± 6.3 |
|
Phân suất tống máu EF |
|
|
|
|
|
|
Ban đầu |
87.2 ± 0.8 |
86.9 ± 1.2 |
88.4 ± 2.5 |
83.9 ± 3.2 |
83.1 ± 3.8 |
|
Theo dõi |
87.3 ± 2.1 |
60.0 ± 15 |
60.8 ± 8.3 |
60.9 ± 6.1 |
62.8 ± 10.4 |
|
Nhịp tim (lần/ phút) |
|
|
|
|
|
|
Ban đầu |
393 ± 15 |
372 ± 26 |
378 ± 30 |
364 ± 30 |
361 ± 37 |
|
Theo dõi |
396 ± 19 |
383 ± 28 |
386 ± 25 |
355 ± 23 |
36 ± 33 |
Số liệu là trị số trung bình ± ĐLC
n = 8-12/ nhóm với theo dõi 6 ngày, n= 16-18 / nhóm với theo dõi 8 tuần
không có sự khác biệt có ý nghĩa thống kê giữa các nhóm điều trị
*p<0,05 so với cùng nhóm trước can thiệp
** p<0,01 so với cùng nhóm trước can thiệp
*** p<0,001 so với cùng nhóm trước can thiệp
Bảng 2: kết quả 7 ngày sau đặt stent tim hay 8 tuần sau khi tái tưới máu hay can thiệp ở chuột được điều trị với ức chế DDP-4 hay giả dược.
|
Theo dõi |
7 ngày sau đặt stent |
8 tuần sau can thiệp |
|||
|
Nhóm giả / tá dược giả |
I/R + tá dược giả |
I/R + BI 14361 |
I/R + tá dược giả |
I/R + linagliptin |
|
|
LVEDP (mm Hg) |
3.1 ± 2.8 |
2.6 ± 1.8 |
4.8 ± 4.0 |
7.1 ± 4.8 |
7.4 ± 1.8 |
|
LVESP (mm Hg) |
122 ± 13 |
116 ± 11 |
106 ± 13 |
112 ± 1.8 |
111 ± 1.8 |
|
dP/dt max (mmHg/s) |
3008 ± 355 |
3341 ± 1710 |
3128 ± 1498 |
5841 ± 95 |
5879 ± 101 |
|
dP/dt min (mm Hg/s) |
-3144 ± 427 |
-3094 ± 1173 |
-2759 ± 908 |
-4771 ± 79 |
4957 ± 73 |
3.5. Hóa mô miễn dịch:
Vào ngày thứ 7 sau 7 ngày thiếu máu cơ tim/ tái tưới máu, phát hiện có gia tăng rõ rẽt của các tế bào dương tính với CD34, c-kit, CXCR-4 và SDF-1α trong và quanh cơ tim bị nhồi máu của động vật điều trị giả dược so với cơ tim khỏe mạnh của nhóm chứng phẩu thuật giả.(hình 4A). một lượng cao hơn nữa các tế bào dương tính với CD34, c-kit, CXCR-4 và SDF-1α được thấy ở cơ tim trong và quanh vùng nhồi máu ở nhóm động vật điều trị B14361 (Hình 4A). Hình ảnh hóa mô miễn dịch trên hiển vi của mẫu cắt ngang thất trái trình bày trên hình 4B.
3.6. Các thông số huyết tương:
Linagliptin làm giảm hoạt động của DDP-4 huyết tương rõ rệt đến 20± 7% so với hoạt động đo được ở nhóm giả dược.
Nồng độ GLP-1 tăng hiệu quả (19 lần) ở nhóm điều trị Linagliptin (5,6 ±2.0 so với 0.3±0.1 ng/l, p<0.00001 ). Đường huyết (10.7±1.8 vs 10.5± 1.6mmol/l, p= 0.66 ) và Creatinin (42.6±13.2 vs 44.8± 9.8 ng/l, p =0.58)tương tự giữa nhóm động vật điều trị linagliptin và nhóm giả dược ở cuối nghiên cứu.
4- Bàn luận:
Mục tiêu chính của nghiên cứu này là đánh giá xem điều trị với một chất ức chế DDP-4 mới linagliptine và BI 14361 có ảnh hưởng đến kích thước vùng nhồi máu và/ hoặc chức năng tim sau thiếu máu cục bộ tái tưới máu nhánh động mạch LAD ở chuột Wistar thực nghiệm điều trị với ức chế DDP-4 giảm kích thước nhồi máu sau 7 ngày và 8 tuần thiếu máu cục bộ/tái tưới máu. Có cải thiện rõ tốc độ tối đa của sự giảm áp lực thất trái (dP/dt min) trong nhóm động vật được điều trị linagliptin sau 8 tuần thiếu máu cục bộ/tái tưới máu. Ngoài ra thì điều trị không cải thiện chức năng tim qua kết quả siêu âm tim và thông tim. Nhuộm hóa mô miễn dịch cho thấy tăng số lượng các tế bào dương tính với mô đệm dẫn xuất yếu tố 1α, CXCR-4 và CD34 ở trong và xung quanh vùng nhồi máu của động vật được điều trị BI 14361.
Hiệu quả trên động vật thực nghiệm được xác định bằng siêu âm tim, cho thấy chức năng tim xấu đi vào ngày thứ 6 và 8 tuần sau thiếu máu cục bộ/tái tưới máu . Sự giảm chức năng không ảnh hưởng trên các thông số huyết động tim khi đo bằng thông tim sau 1 tuần, gợi ý rằng vùng nhồi máu nhỏ đủ để các rối loạn huyết động còn bù trừ.
Ức chế DDP-4
Điều trị ức chế DDP-4 làm giảm liên tục và rõ rệt kích thước nhồi máu cả ngày 7 (-27.7%) và ở tuần 8 (-18%) sau thiếu máu cục bộ/tái tưới máu, cả trong thời gian cũng như tỷ lệ nhồi máu trên AAR, tỷ lệ nhồi máu trên AAR đại diện vùng cung cấp máu bởi nhánh LAD (hình 3).Ở đây cũng có cải thiện rõ tốc độ tối đa của sự giảm áp lực thất trái (dP/dt min)trong nhóm điều trị linagliptin sau 8 tuần thiếu máu cục bộ /tái tưới máu. Điều này phản ánh chức năng tâm trương có cải thiện do giảm kích thước nhồi máu và giảm xơ hóa khi so sánh với nhóm điều trị giả dược. Có thể quá sớm để mong có được một kết quả tương tự từ thực nghiệm ngắn ngày bởi vì kích thước nhồi máu có thể bị lẫn hiện tượng viêm và thâm nhiễm mô cơ tim trong tuần đầu sau thiếu máu cục bộ cơ tim (hình 2) (24).
Giảm kích thước nhồi máu và xơ hóa cơ tim trên động vật điều trị ức chế DDP-4 chưa giảm kích thước đủ nhiều để cho phép khảo sát chức năng tâm thu tim. Siêu âm tim và các thông số huyết động của chức năng tâm thu không thay đổi. Điều này không loại trừ khả năng có hiệu quả lâm sàng vì nhiều bằng chứng gần đây chứng minh rằng kích thước nhồi máu là yếu tố tiên lượng cho các biến cố tương lai( bao gồm cả tử vong) mạnh hơn chức năng tâm thu thất trái(25,27). Tuy nhiên trong nghiên cứu thực nghiệm này tổn thương tim không đủ nặng để gây tử vong trong suốt 8 tuần.
Kết quả nghiên cứu này tương tự một thực nghiệm trước đây trên chuột sử dụng diprotin A ức chế hoạt động DPP-4, khi đó chất này chưa được phát triển để sử dụng điều trị cho người (21). Điều trị với diprotin A gây giảm kích thước nhồi máu sau 4 tuần (nhưng không phải sau 7 ngày) mặc dù phân suất tống máu vẫn không thay đổi. Tác động mạnh hơn – cả trên chức năng tim và thời gian sống còn – được thấy khi thêm vào G- CSF ( yếu tố kích thích bạch cầu hạt), đây là chất thúc đẩy quá trình huy động tế bào gốc (21). Một nghiên cứu khác gần đây cho thấy ích lợi của diprotin A trên phân suất tống máu sau 4 tuần, nhưng chỉ gặp trên chuột có biểu lộ CXCR-4 trong tế bào trung mô gốc (28). Một nghiên cứu rất ngắn khác cho thấy có tác động dương tính của sitagliptine trên kích thước nhồi máu sau 4 giờ (22).Sự khác nhau về các mô hình động vật thực nghiệm và phức hợp sử dụng trong các nghiên cứu tương tự này cũng đã giới hạn lý giải các so sánh của chúng tôi với các nghiên cứu khác ghi nhận gần đây.
Thực hiện nhuộm hóa mô miễn dịch cơ tim vớiSDF-1α, với thụ thể CXCR-4 và chất đánh dấu của các tế bào gốc khác để làm rõ cơ chế qua đó chất ức chế DDP-4 làm giảm kích thước nhồi máu cơ tim. Thấy được chất ức chế DDP-4 đi kèm với gia tăng số lượng tế bào dương tính với SDF-1α, CXCR-4 và CD34 trong và quanh vùng nhồi máu, ủng hộ giả thuyết là ức chế DDP-4 thông qua việc thải trừ SDF-1α sẽ làm tăng sự hồi phục các tế bào nguyên bản (progenitor) CXCR-4+ trong tuần hoàn. SDF-1α cũng là chất hóa học thu hút CD-34 + cell ở người (29). Các tế bào nguyên bản (progenitor) chuyển dạng thành tế bào cơ tim (30,31) hoặc tạo tác dụng cận mô (paracrine effect) trên tế bào cơ tim lân cận, do đó hoạt hóa sự tái tạo cơ tim(7). Tác dụng cận mô ngăn chặn chết theo chương trình và thúc đẩy tân sinh mạch trong vùng giữa bình thường và nhồi máu (penumbra), quanh nơi cơ tim dễ tổn thương, điều này giải thích 1 phần giảm kích thước nhồi máu.
Một cơ chế khác có tiềm năng bảo vệ tim là sự gia tăng rõ GLP-1 trongđộng vật điều trị linagliptine. Chất đồng vận GLP-1 như exaenatide hay liraglutide hoạt hóa gene bảo vệ tim (vd Akt, Bcl-2, GSK3 beta) và giảm kích thước nhồi máu và tử vong trên động vật thực nghiệm nhồi máu cơ tim (18,19). Nồng độ chất đồng vận thụ thể GLP-1 sau dùng exanetidehay liraglutide cao hơn với ức chế DDP-4. Tuy nhiên, sự gia tăng SDF-1αvà hiệu quả trên các chất DDP-4 khác giúp bù trừ với nồng độ GLP-1 thấp hơn và vì thế chứng tỏ hiệu quả tương tự. Các kết quả nghiên cứu lâm sàng cũng cần để quyết định khái niệm nào cần để có lợi hơn cho bệnh nhân có thiếu máu cơ tim cục bộ.
4.1. Giới hạn của nghiên cứu:
Giới hạn của nghiên cứu là nhiều hợp chất khác nhauđược dùng trong nghiên cứu thời gian ngắn và dài. Tuy nhiên cả hai hợp chất đều có tương tự về cấu trúc phân tử(hình 1), về độ mạnh và độ đặc hiệu in vivo và in vitro. Hơn nữa , cả hai nghiên cứu đều tạo ra kết quả tương tự đặc biệt trên kích thước nhồi máu mặc dù sử dụng các hợp chất khác nhau và trong thời gian điều trị khác nhau.
Vì mục đích chính của nghiên cứu là so sánh hai nhóm điều trị nên chúng tôi không đưa nhóm giả (sham) vào nghiên cứu kéo dài và điều này gây 1 hạn chế khác trong nghiên cứu. Do đó không thể xác định các thông số huyết động có xấu hơn không trong 8 tuần sau khi gây thiếu máu cục bộ/ tái tưới máu với nhóm giả được phẫu thuật (sham- operated).
4.2. Kết luận và dự hậu:
Chúng tôi chứng minh rằng ức chế DDP-4 có thể gây giảm kích thước nhồi máu trong chuột thực nghiệm trong mô hình gây thiếu máu cục bộ/tái tưới máu. Tuy nhiên sự giảm kích thước nhồi máu này không đủ lớn để gây cải thiện đáng kể chức năng tim. Chúng ta cũng quan tâm khi muốn đánh giá xem tác động trên sự co cơ tim hay tử vong có xảy ra trong các mô hình gây thiếu máu nặng hơn không? Nhìn qua kết quả của nghiên cứu này cũng nên nghiên cứu xem bệnh nhân đái tháo đường đã được điều trị trước với ức chế DDP-4 có dự hậu tốt hơn sau nhồi máu cơ tim hơn các thuốc điều trị đái tháo đường khác. Cho tới nay không có dữ liệu về thuốc ức chế DDP-4 với thiếu máu cơ tim cục bộ trên người. Tuy nhiên đánh giá dự hậu tim mạch của saxagliptin trong nghiên cứu 3356 bệnh nhân điều trị saxagliptin cho thấy giảm tử vong tim mạch, nhồi máu cơ tim và đột quỵ khi so với các điều trị đái tháo đường khác (32). Một phân tích tính an toàn tim mach gần đây của linagliptin gợi ý cónguy cơ tim mạch tương tự hay mạnh hơn (Johanson,OE et al, American Diabetes Association, Scientific Sessions Late Breaking Abstrct, June 26, 2011, Abtract No. 30_LB). Cơ chế thấy được trong nghiên cứu này có thể góp phần vào tác động có lợi.Dược động học duy nhất của Linagliptin giúp thuốc sử dụng được không chỉnh liều theo GFR (33), nên có thể phân tích kết quả với hợp chất này cả trên thiếu máu cục bộ/ tái tưới máu có tổ thương thận.
Bằng chứng để ức chế DDP-4 như điều trị thêm trong bệnh lý thiếu máu cơ tim thì còn giới hạn và cần nhiều nghiên cứu thêm về lợi ích tiềm năng này.







