Thomas C. Marbury, Pinhas Sareli, Eduardo M. Krieger & Richard A. Reeves,
thay mặt Nhóm Nghiên cứu Đa trung tâm Irbesartan
Tài liệu do Sanofi-Aventis cung cấp
Tất cả bệnh nhân nghiên cứu đều có HA tâm trương khi ngồi trong khoảng từ 115 đến 130 mmHg. Nam giới và phụ nữ vô sinh do phẫu thuật hoặc phụ nữ sau mãn kinh, trên 18 tuổi, có giấy đồng ý tham gia nghiên cứu, được nhận vào thử nghiệm. Tiêu chí loại ra gồm: các bệnh đi kèm gây rủi ro về tính an toàn, đồng thời dùng những thuốc có thể gây cản trở sự đánh giá hiệu quả hoặc độ an toàn (ví dụ những thuốc ảnh hưởng đến HA). Trước khi nghiên cứu, ngưng dùng thuốc lợi tiểu ít nhất 3 ngày và tất cả các thuốc chống tăng áp khác ít nhất 24 giờ. Bệnh nhân có HA tâm trương khi ngồi từ 115 đến 130 mmHg được đưa ngay vào giai đoạn mù đôi của nghiên cứu, trong khi đó bệnh nhân có HA tâm trương khi ngồi <115 mmHg được đưa vào giai đoạn mù đơn dùng giả dược lên đến 7 ngày. Bệnh nhân được loại ra khỏi nghiên cứu nếu HA tâm trương khi ngồi <115 mmHg vào ngày 7. Các đối tượng nghiên cứu được phân lô ngẫu nhiên theo tỉ lệ 2:1 để dùng irbesartan (n = 121) hoặc enalapril (n = 61) theo kiểu mù đôi. Bắt đầu điều trị với viên nang irbesartan 150 mg hoặc enalapril 20 mg mỗi ngày uống một lần. Đến tuần 1, có thể tăng liều lên 300 mg irbesartan hoặc 40 mg enalapril mỗi ngày một lần nếu HA tâm trương khi ngồi ³ 106 mmHg, bắt buộc tăng liều ở tuần 2 nếu HA tâm trương khi ngồi ³ 90 mmHg, và cũng có thể tăng tốc chỉnh liều tùy theo nhận định của nhà nghiên cứu. Sau tuần 4, nếu HA tâm trương khi ngồi ³ 90 mmHg, dùng thêm thuốc chống tăng áp bổ trợ, công khai tên thuốc, mỗi ngày một lần (hydrochlorothiazide 25 đến 50 mg/ngày, tiếp theo là nifedipin tác dụng dài 30 đến 60 mg/ngày, và/hoặc atenolol 50 đến 100 mg/ngày).
Số đo hiệu quả chính là mức giảm HA tâm trương đáy khi ngồi (24 ± 3 giờ sau khi uống liều thuốc của ngày hôm trước) từ lúc ban đầu đến tuần 12. Phân tích hiệp phương sai, với các biến số điều trị, điểm nghiên cứu, và HA ban đầu được dùng để so sánh giữa hai nhóm về mức thay đổi so với ban đầu của HA đáy khi ngồi và khi đứng. Phép kiểm c2 Cochran-Mantel Haenszel, được phân tầng theo điểm nghiên cứu, được dùng để so sánh tỉ lệ bệnh nhân được bình thường hóa HA (HA tâm trương đáy khi ngồi < 90mmHg) ở hai nhóm vào tuần 12. Tỉ lệ bệnh nhân báo cáo ho, bất kể có liên quan với thuốc nghiên cứu hay không, được so sánh bằng test chính xác Fisher. Tất cả các test thống kê đều là test 2 phía và được thực hiện ở mức α = 0,05.
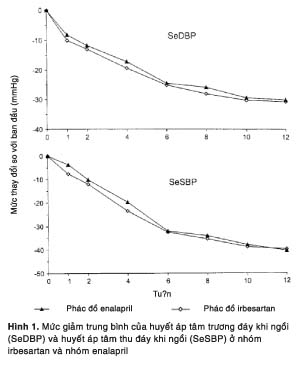
Các đặc trưng dân số học và HA ban đầu tương tự nhau giữa hai nhóm (Bảng 1). Ở tuần 12, cả hai phác đồ irbesartan và enalapril đều tạo ra những mức giảm tương tự nhau về HA tâm trương đáy khi ngồi (theo thứ tự là –29,6 và –30,5 mmHg) và HA tâm thu đáy khi ngồi (theo thứ tự là –40,1 và –39,3 mmHg). Đến khi kết thúc tuần 1, cả hai nhóm irbesartan và enalapril đều có mức giảm HA đáy đáng ghi nhận (theo thứ tự là 8/10 và 4/8 mmHg) và dần dần trở nên cực đại vào khoảng tuần 10 (40/30 mmHg; Hình 1). Các mức giảm HA đáy khi ngồi có xu hướng xảy ra sớm hơn với phác đồ irbesartan so với phác đồ enalapril (theo thứ tự là 12/13 so với 10/12 mmHg ở tuần 2 và 23/19 so với 20/17 mmHg ở tuần 4). Các mức giảm HA đáy khi đứng diễn ra theo kiểu tương tự như đã thấy với các số đo HA khi ngồi (không trình bày số liệu để cho ngắn gọn).
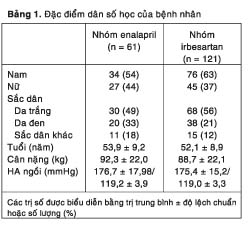
Ở tuần 1, tất cả bệnh nhân (trừ 1 người ở mỗi nhóm) đều dùng irbesartan hoặc enalapril với liều thấp hơn, và ở tuần 2 họ vần chỉ dùng những thuốc có hoạt tính này. Ở tuần 4, hydroclorothiazide bổ trợ được dùng ở khoảng 55% số bệnh nhân ở cả hai nhóm. Ở tuần 12, 9% số bệnh nhân còn dùng đơn liệu pháp irbesartan và 7% số bệnh nhân còn dùng đơn liệu pháp enalapril, trong khi đó 24% số bệnh nhân điều trị irbesartan và 18% số bệnh nhân điều trị enalapril chỉ dùng thêm hydrochlorothiazide bổ trợ. Nhóm irbesartan có ít bệnh nhân cần dung ³ 3 thuốc bổ trợ hơn so với nhóm enalapril (67% so với 75%) kể từ tuần 6 trở đi cho đến tuần 12.
Tần suất tác dụng phụ là 55% ở nhóm irbesartan và 64% ở nhóm enalapril. Các tác dụng phụ thường gặp nhất là nhức đầu (19,7%
enalapril, 17,4% irbesartan), chóng mặt (18,0% enalapril, 9,1% irbesartan), ho (13,1% enalapril, 2,5% irbesartan; p = 0,007), và nhiễm khuẩn đường hô hấp trên/cúm (13,1% enalapril, 9,9% irbesartan). Không có những thay đổi quan trọng về mặt lâm sàng trong các thông số xét nghiệm, kết quả điện tâm đồ hoặc khám thực thể với bất kỳ phác đồ nào.
Irbesartan được dung nạp tốt ở những liều lên đến 300 mg trên bệnh nhân tăng huyết áp nặng và kết hợp với một xuất độ tác dụng phụ thấp hơn so với enalapril (55% so với 64%). Ho xảy ra nhiều hơn một cách có ý nghĩa với enalapril so với irbesartan.(13,1% so với 2,5%; p = 0,007). Nhữg kết quả này gợi ý rằng irbesartan có khả năng được dung nạp thuận lợi hơn so với các thuốc ƯCMC. Sự tuân trị kém của bệnh nhân do các tác dụng phụ đi kèm với các thuốc chống tăng áp hiện có là một trở ngại lớn đối với việc điều trị tăng huyết áp. Người ta đã báo cáo rằng chỉ 32% số bệnh nhân được điều trị thuốc ƯCMC tiếp tục trị liệu >1 năm và sự tuân trị thậm chí còn thấp hơn nữa với những thuốc khác (ví dụ thuốc chẹnh kênh calci, thuốc chẹn b, và thuốc lợi tiểu). Một phác đồ ít phức tạp hơn cũng dẫn đến sự tuân trị tốt hơn, và do vậy sẽ kiểm soát HA tốt hơn. Phác đồ chứa irbesartan có xu hướng cần ít bước chỉnh liều hơn so với phác đồ enalapril. Hơn nữa, cũng có xu hướng cho thấy số bệnh nhân cần dùng ³ 3 thuốc bổ trợ ở nhóm điều trị irbesartan ít hơn so với nhóm điều trị enalapril.
Một phác đồ chứa thuốc đối kháng thụ thể agiotensin II irbesartan có hiệu quả như phác đồ chứa thuốc ƯCMC enalapril ở liều tối đa để hạ thấp HA trong tăng huyết áp nặng. Irbesartan có đặc tính được dung nạp tốt hơn enalapril, được chứng minh bởi một xuất độ tác dụng phụ thấp hơn và ít ho hơn một cách rõ rệt.
1. The Joint National Committee on Detection, Evaluation, and Treatment of High Blood Pressure. The fifth report of the Joint National Committee on Detection, Evaluation, and Treatment of High Blood Pressure (JNCV). Arch Intern Med 1993;153:154-183.
2. Romero R, Castellote E, Ocón J, Wagner B. Controlled multicenter study with quinapril, hydrochlorothiazide, and combination in patients with moderate to severe hypertension. J Cardiovasc Pharmacol 1995;26:114-118.
3. Ruff D, Gazdick LP, Berman R, Goldberg AI, Sweet CS. Comparative effects of combination druf therapy regimes commencing with either losartan potassium, an angiotensin II receptor antagonist, or enalapril maleate for the treatment of severe hy[ertension. J Hypertens 1996;14:263-270.
4. Simon SR, Black HR, Moser M, Berland WE. Cough and ACE inhibitors. Arch Intern Med 1992;152:1698-1700.
5. Cazaubon C, Gougat J, Bousquet F, Guiraudou P, Gayraud R, Lacour C. Roccon A, Galindo G, Barthelemy G, Gautret B, Bernhart C, Perreau P, Breliere J-C, Le Fur G, Nisato D. Pharmacological characterization of SR 47436, a new nonpeptide AT1, subtype angiotensin II receptor antagonist. J Pharmacol Exp Ther 1993;265:826-834.
6. Golberg AI, Dunlay MC, Sweet CS. Safety and tolerability of losartan potassium, atenolol, felodipine ER, and angiotensin-converting enzyme inhibitors for the treatment of systemic hypertension. Am J Cardiol 1995;75:793-795.
7. Holwerda NJ, Fogari R, Angeli P, Porcellati C, Hereng C, Oddon-Stock P, Kealth R, Bodin F. Valsartan, a new angiotensin II antagonist for the treatment of essential hypertension: efficacy and safety compared with placebo and enalapril. J Hypertens 1996;14:1147-1151.
8. Ogihara T, Arakawa K, Jimura O, Abe K, Saruta T, Ishii M, Hiwada K, Fujishima M, Fukiyama J. Open clinical studies on a new angiotensin II receptor antagonist, TCV-116. J Hypertens 1994;12(suppl 9):S35-S38.
9. van den Meiracker AH, Admiral PJJ, Janssen JA, Kroodsma J-M, de Ronde WAM, Boomsma F, Sissmann J, Blankestijn PJ, Mulder PGM< Man in’t Veld AJ, Schalekamp MADH. Hemodynamic and biochemical effects of the AT1 receptor antagonist irbesartan in hypertension. Hypertension 1995;25:22-29.
10. McCombs JS, Nichol MB, Newman CM, Sclar DA. The costs of interrupting antihypertensive drug therapy in a Medicaid population. Med Care 1994;32:214-226.







