TS. PHẠM HỮU VĂN
Tóm tắt
Bệnh nhân tăng huyết áp động mạch thường biểu hiện nhiều rối loạn nhịp tim khác nhau, từ nhịp tim chậm đến ngoại tâm thu trên thất, rung nhĩ hoặc các rối loạn nhịp nhanh trên thất và rồi loạn nhịp thất khác. Những rối loạn nhịp tim này có thể gây ra các triệu chứng hoặc hoàn toàn không có triệu chứng, tùy thuộc vào chức năng cơ bản của tim. Bệnh thoái hóa điện học và phì đại thất trái tạo thành các cơ chế sinh lý bệnh chính. Tổng quan này tóm tắt tất cả các bằng chứng quan trọng hiện có về biểu hiện rối loạn nhịp tim trong bối cảnh tăng huyết áp động mạch, và nêu bật các cơ chế sinh lý bệnh cơ bản đã biết và các cân nhắc điều trị.
1. Mở đầu
Tăng huyết áp động mạch là yếu tố nguy cơ chính gây ra các biến cố tim mạch bất lợi trên toàn thế giới, vì nó dẫn đến xơ vữa động mạch, bệnh động mạch vành (CAD), bệnh thận mãn tính, bệnh động mạch ngoại biên, suy tim và đột quỵ.[1] Ngoài ra, nhiều nghiên cứu dịch tễ học đã nhấn mạnh mối liên hệ giữa tăng huyết áp với nhiều loại rối loạn nhịp tim, có thể ảnh hưởng đáng kể đến tiên lượng thông qua những tác động quan trọng đến tỷ lệ mắc bệnh và thậm chí tử vong của bệnh nhân tăng huyết áp. [2] Bệnh tim tăng huyết áp được đặc trưng bằng những thay đổi về cấu trúc và phì đại thất trái (LVH), [3] những thay đổi điện sinh lý tiếp theo ở mô cơ tâm thất và tâm nhĩ, có thể dẫn đến biểu hiện của nhiều loại rối loạn nhịp, gồm rồi loạn nhịp chậm, các nhắt bóp sớm trên thất (ngoại tâm thu trên thất) và nhịp nhanh nhĩ, đặc biệt là rung nhĩ (AF), rối loạn nhịp thất và đột tử do tim (SCD). Hơn nữa, xem xét vai trò quan trọng của việc tăng cường kích hoạt hệ giao cảm trong cơ chế bệnh sinh của các chứng rối loạn nhịp tim khác nhau, dữ liệu hiện có cho thấy các liệu pháp chống tăng huyết áp, chẳng hạn như hủy bỏ thần kinh giao cảm ở thận, có thể làm giảm gánh nặng của rối loạn nhịp nhĩ và thất, bằng cách điều chỉnh hoạt động giao cảm, mặc dù điều này cần nghiên cứu thêm. [4] Cuối cùng, các thuốc chống tăng huyết áp khác nhau được kê đơn để kiểm soát bệnh nhân tăng huyết áp có thể góp phần gây ra biểu hiện rối loạn nhịp tim, chủ yếu là do rối loạn điện giải. Tổng quan này tóm tắt tất cả các khía cạnh quan trọng của rối loạn nhịp tim trong bối cảnh tăng huyết áp động mạch và nêu bật ý nghĩa điều trị.
2. Rối loạn nhịp chậm
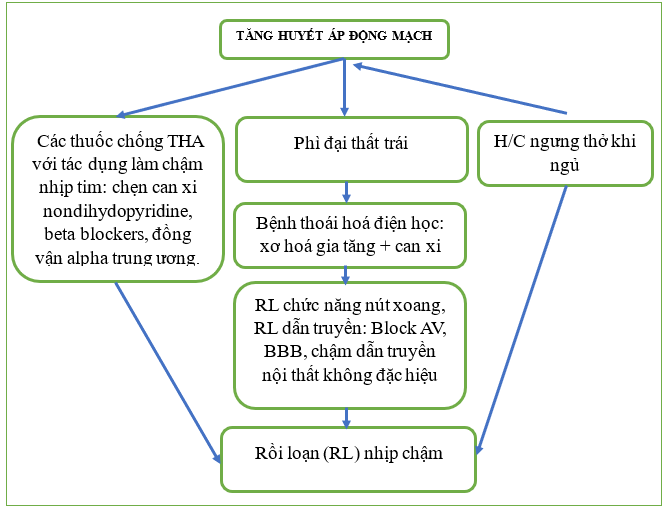
Hình 1: Các cơ chế liên quan đến sự phát triển rối loạn nhịp tim chậm ở bệnh nhân tăng huyết áp động mạch
Bệnh nhân tăng huyết áp có thể biểu hiện nhiều loại rối loạn nhịp tim chậm, điều này có thể ảnh hưởng đáng kể đến tình trạng lâm sàng của bệnh nhân. [2] Mặc dù tỷ lệ lưu hành chính xác chưa được biết, rối loạn nhịp tim chậm trong bối cảnh tăng huyết áp động mạch có thể xảy ra không thường xuyên và có thể có nguyên nhân khác nhau, bao gồm rối loạn nhịp tim liên quan đến thuốc, bệnh thoái hóa điện hoặc hội chứng ngưng thở khi ngủ do tắc nghẽn (obstructive sleep apnea: OSA) (Hình 1). Xác định rối loạn nhịp tim chậm ở bệnh nhân tăng huyết áp có lẽ không khó vì chúng thường có rất nhiều triệu chứng. Các triệu chứng thường gặp có thể gồm mệt mỏi, khó thở ngày càng trầm trọng và tiền ngất hoặc ngất, tùy thuộc vào chức năng cơ bản của tim, trong khi các giá trị huyết áp (HA) tăng và/hoặc giảm không có triệu chứng cũng có thể được quan sát thấy ở những bệnh nhân có huyết áp được kiểm soát tốt trước đó. Trong việc quản lý những bệnh nhân như vậy, trước tiên phải thực hiện mọi nỗ lực để có được chẩn đoán bằng cách ghi lại rối loạn nhịp, thứ hai là xác định và sửa đổi các nguyên nhân có thể khắc phục được, chẳng hạn như điều trị bằng thuốc và hội chứng OSA.
Việc điều trị chống tăng huyết áp thường được cá thể hóa dựa trên tình trạng lâm sàng của bệnh nhân và do đó, nhiều loại thuốc chống tăng huyết áp khác nhau được kết hợp để đạt được sự kiểm soát huyết áp thích hợp. [1]
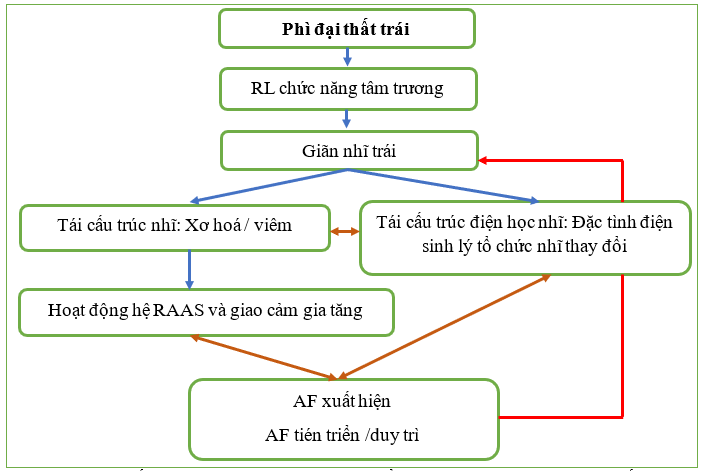
Hình 2: Cơ chế sinh lý bệnh chính của sự phát triển rung nhĩ ở bệnh nhân tăng huyết áp động mạch và phì đại thất trái. AF, rung nhĩ; EP, điện sinh lý; LVH, phì đại thất trái; RAAS, hệ thống renin-angiotensinaldosterone
Có các thuốc chống tăng huyết áp, chẳng hạn như thuốc chẹn kênh canxi nondihydropyridine, thuốc chẹn beta và một số thuốc chủ vận alpha trung ương, có thể có tác dụng làm giảm nhịp tim đáng kể. Đây là lý do tại sao sự kết hợp của chúng nên được sử dụng hết sức thận trọng, do nguy cơ nhịp xoang chậm hoặc block nhĩ thất (AV). Hơn nữa, những bệnh nhân mắc bệnh thận đang điều trị hạ huyết áp gồm thuốc chẹn beta có thể biểu hiện nhịp tim chậm phụ thuộc vào liều, và do đó, nên tránh các thuốc có độ thanh thải chủ yếu qua thận, như atenolol hoặc bisoprolol.
Mối liên hệ chặt chẽ của LVH với bệnh thoái hóa điện đã được chứng minh trong nhiều nghiên cứu khác nhau. Vì vậy, bệnh nhân mắc bệnh tim tăng huyết áp và LVH dường như biểu hiện rối loạn dẫn truyền thường xuyên hơn, chẳng hạn như block nhánh, block AV ở nhiều mức độ khác nhau và đặc biệt là block dưới bó His. [5] Rối loạn chức năng nút xoang cũng có thể xảy ra ở những bệnh nhân này, do xơ hóa và vôi hóa gia tăng, thường đi kèm với bệnh nhân mắc LVH. Hơn nữa, đối với những bệnh nhân bị rung nhĩ vĩnh viễn (AF), tình trạng chậm dẫn truyền có thể xảy ra phổ biến hơn ở những bệnh nhân tăng huyết áp so với thuốc có huyết áp bình thường.[6] Bên cạnh nút xoang và rối loạn dẫn truyền AV, chậm dẫn truyền trong thất cũng là biểu hiện quan trọng của bệnh thoái hóa điện ở những bệnh nhân này. Cần phải nói đến sự hiện diện của thời gian phức hợp QRS tăng lên, và đặc biệt là block nhánh trái, ở bệnh nhân tăng huyết áp có liên quan đến tiên lượng xấu hơn, suy tim (HF) và tăng tỷ lệ tử vong do tim mạch.[7-9]
Biểu hiện rối loạn chậm ở bệnh nhân mắc bệnh tim tăng huyết áp bị ảnh hưởng nhiều hơn do sự hiện diện của hội chứng OSA. Trên thực tế, mối liên quan giữa rối loạn giấc ngủ với rối loạn nhịp tim chậm ở bệnh nhân tăng huyết áp là rất mạnh, trong đó nhiều trường hợp rối loạn nhịp tim chậm đáp ứng tốt, và thậm chí đảo ngược, sau khi điều trị ban đầu hội chứng OSA, ví dụ, bằng áp lực đường thở dương liên tục.[10]
Tổng hợp tất cả lại với nhau, xem xét mối liên quan của bệnh tim tăng huyết áp với bệnh thoái hóa điện, không có gì đáng ngạc nhiên khi nhiều bệnh nhân được cấy máy tạo nhịp tim vĩnh viễn để điều trị chứng rối loạn nhịp tim chậm có triệu chứng đều bị tăng huyết áp trong quá trình điều trị. Mặt khác, không nên quên những tác động trực tiếp đáng kể về huyết động của nhịp tim và tần số lên huyết áp, thông qua sự thay đổi đồng bộ AV và tăng sức cản mạch hệ thống hoặc phản xạ huyết động phụ thuộc tần số thông qua các thụ thể áp suất khác nhau trong hệ thống tim mạch. Những tác động này giải thích tại sao nhiều bệnh nhân có huyết áp bình thường bị rối loạn nhịp tim chậm đáng kể, chẳng hạn như hội chứng suy nút xoang hoặc block nhĩ thất, có thể biểu hiện sự tăng huyết áp bù trừ, tình trạng này sẽ thuyên giảm sau khi điều trị thích hợp chứng rối loạn nhịp tim nguyên phát bằng tạo nhịp tim tạm thời hoặc vĩnh viễn. Ở đây cần đề nhấn mạnh những tương tác huyết động đáng kể này đã được sử dụng trong liệu pháp điều hòa thần kinh tim qua trung gian máy tạo nhịp tim, ở những bệnh nhân có máy điều hòa nhịp tim và tăng huyết áp dai dẳng.[11] Cụ thể hơn, trong hệ thống Moderato (BackBeat CNT; Orchestra BioMed), HA đang được giảm bằng cách nhắm mục tiêu tiền tải tải và hậu tải thông qua việc rút ngắn và kéo dài khoảng ghép AV với điều biến đồng thời các phản ứng của hệ thần kinh tự trị, một công nghệ đã mang lại kết quả đầy hứa hẹn. .[12]
3. Các nhắt bóp sớm trên thất và những cơn nhip nhanh trên thất
Bệnh tim tăng huyết áp được biết có liên quan đến việc tăng số lượng các nhắt bóp sớm trên thất (SVPB).[2] Tăng huyết áp không được kiểm soát, rối loạn chức năng tâm trương nặng hơn, LVH, giãn nhĩ trái (LA), tăng hoạt động giao cảm, lạm dụng caffeine và rượu, hút thuốc và rối loạn điện giải đều là những yếu tố được công nhận rõ ràng liên quan đến SVPB. Hơn nữa, trạng thái giảm huyết áp về ban đêm như cũng liên quan đến số lượng SVPB tăng lên. Các nghiên cứu đã chỉ ra rằng những người không có dipper [13] (có nghĩa là những bệnh nhân không giảm HA vào ban đêm) dường như biểu hiện nhiều SVPB hơn và điều này có thể được giải thích bằng thực tế là những bệnh nhân như vậy có LVH xấu hơn, kích thước LA lớn hơn và hoạt động quá mức của hệ giao cảm. [14] Xem xét thực tế rằng số lượng SVPB tăng lên được biết là có liên quan đến sự xuất hiện của AF và các biến cố đột quỵ do thiếu máu cục bộ ẩn giấu, [15] điều quan trọng nhất là những bệnh nhân như vậy phải thường xuyên được theo dõi để phát hiện AF. Kiểm soát HA đầy đủ bằng cách thay đổi lối sống (bao gồm các khuyến cáo tránh uống quá nhiều rượu và/hoặc caffeine) và điều trị nội khoa, bao gồm thuốc chẹn beta nếu dung nạp, là rất quan trọng để phòng ngừa SVPB, đặc biệt ở bệnh nhân LVH.
Hơn nữa, có nhiều loại nhịp nhanh trên thất kịch phát khác nhau, chẳng hạn như nhịp nhanh vào lại nút AV, nhịp nhanh nhĩ hoặc cuồng nhĩ, có thể xảy ra ở bệnh nhân mắc bệnh tim tăng huyết áp và quan trọng là dẫn đến các triệu chứng nghiêm trọng hoặc thậm chí phù phổi cấp do rối loạn chức năng tâm trương (và/hoặc tâm thu) và rút ngắn thời gian đổ đầy tâm trương trong những cơn rối loạn nhịp tim nhanh đó. Trong những trường hợp này, điều trị bằng thuốc để phòng ngừa các cơn kịch phát như vậy chủ yếu bao gồm thuốc chẹn beta hoặc thuốc chẹn kênh canxi nondihydropyridine. Điều thú vị là, trong y văn có dữ liệu gợi ý việc hạ huyết áp ở bệnh nhân nhịp nhanh trên thất có thể cải thiện các triệu chứng, nhờ cải thiện chức năng tâm trương và cũng làm giảm tần suất các cơn loạn nhịp nhanh. [2] Tuy nhiên, điều trị y tế không phải là điều trị dứt điểm. Đối với nhịp nhanh kịch phát trên thất, cần tư vấn điện sinh lý sớm vì triệt phá qua catheter được đặc trưng do tỷ lệ thành công rất cao trong các rối loạn nhịp nhanh đặc biệt này. [2] Vì vậy, cắt bỏ qua ống thông nên được đưa ra như một lựa chọn điều trị đầu tay, đặc biệt ở những bệnh nhân có triệu chứng cao. Ngoài ra, người ta biết rằng tình trạng rối loạn nhịp nhanh trên thất kịch phát kéo dài hoặc dai dẳng có thể dẫn đến bệnh cơ tim do nhịp tim nhanh.
4. Rung nhĩ
Rung nhĩ được coi là rối loạn nhịp tim lâm sàng phức tạp nhất. Tỷ lệ mắc bệnh này ngày càng tăng theo mỗi thập kỷ tuổi, cũng như nguy cơ tăng huyết áp. Hai thực thể này có mối quan hệ hai chiều và chúng có chung các yếu tố ảnh hưởng tương tự nhau. [16] Rung tâm nhĩ có thể biểu hiện trong bối cảnh bệnh tim tăng huyết áp. Ở bệnh nhân tăng huyết áp, việc phát hiện AF có thể cho thấy sự hiện diện của tổn thương cơ quan đích do tăng huyết áp. [17] Người ta biết rằng tăng huyết áp là yếu tố nguy cơ phổ biến nhất dẫn đến sự phát triển của AF và được biết là làm tăng nguy cơ AF lên khoảng gấp đôi. [18] Tăng huyết áp không được kiểm soát còn tạo thành một yếu tố quan trọng cho sự tiến triển của AF. Bệnh nhân tăng huyết áp có rung nhĩ có nguy cơ đột quỵ, tắc mạch hệ thống, bệnh cơ tim do nhịp tim nhanh, suy tim mạn tính hoặc đợt cấp của suy tim. Hơn nữa, bệnh nhân tăng huyết áp cũng có thể mắc hội chứng OSA tiềm ẩn, hội chứng này cũng liên quan đến các đợt rung nhĩ. Mặt khác, do sự tồn tại thường xuyên của chúng, bệnh nhân AF nên được kiểm tra huyết áp thường xuyên. Việc xác định sớm bệnh tăng huyết áp có thể là rất quan trọng để họ có thể bắt đầu điều trị y tế thích hợp nhằm giảm nguy cơ huyết khối và nguy cơ chảy máu. Mặc dù ở bệnh nhân rung nhĩ vĩnh viễn có thể gặp một số khó khăn trong việc đánh giá huyết áp tâm trương, đặc biệt với các thiết bị sử dụng tại nhà, huyết áp tâm thu có thể được đánh giá chính xác. [19]
Cơ chế sinh lý bệnh chính của rung nhĩ liên quan đến tăng huyết áp bao gồm LVH do tăng huyết áp và sau đó giãn nhĩ trái, trong khi việc kích hoạt hệ thần kinh giao cảm và hệ thống renin-angiotensin-aldosterone (RAAS) cũng góp phần vào sự phát triển của rung nhĩ (Hình 2). Phì đại thất trái được biết là có nguy cơ dẫn đến các rối loạn nhịp nhanh nhĩ khác nhau thông qua rối loạn chức năng tâm trương ngày càng trầm trọng và giãn nhĩ trái. Quá trình tái tạo mô tâm nhĩ tiếp xúc với áp lực cao gồm xơ hóa và viêm, làm thay đổi đặc tính điện sinh lý của tế bào tâm nhĩ. [20] Một “bệnh cơ tim nhĩ” tăng huyết áp đã được mô tả, [21] trong đó các kênh ion và/hoặc phức hợp bộ nối được biểu hiện bất thường, dẫn đến tăng khả năng bị rung nhĩ. Quá trình tái cấu trúc tiếp tục kích hoạt hệ thống giao cảm và RAAS, từ đó làm trầm trọng thêm tình trạng rối loạn chức năng tâm trương và tạo thành một vòng luẩn quẩn. Nồng độ angiotensin II cao hơn đã được quan sát thấy ở bệnh nhân rung nhĩ và có liên quan đến tác động gây loạn nhịp trên mô nhĩ thông qua các chất trung gian gây viêm, chẳng hạn như interleukin-6, các yếu tố tăng trưởng và tăng canxi nội bào. [22] Căng thẳng oxy hóa liên quan đến Aldosterone là một hiệu ứng RAAS khác thúc đẩy quá trình tu sửa ở AF. Hoạt động quá mức giao cảm của hệ thần kinh tự trị cũng đóng một vai trò quan trọng trong sự phát triển cơ chất AF, thông qua việc tăng tốc độ kích hoạt tâm nhĩ, thay đổi độ trơ của tâm nhĩ và tình trạng quá tải canxi của tế bào. Hơn nữa, thể tích LA tăng lên không chỉ liên quan đến sự xuất hiện của AF mà còn liên quan đến việc duy trì AF. Tái cấu trúc điện tâm nhĩ do AF được đặc trưng bằng việc rút ngắn thời gian trơ hiệu quả của tâm nhĩ hơn nữa dẫn đến duy trì rối loạn nhịp tim. Cần phải đề cập rằng xơ hóa tâm nhĩ, thông qua tất cả các cơ chế nêu trên, được biết là có xu hướng gây ra các biến cố huyết khối và tắc mạch, ngay cả khi không có AF. [23,24]
Rung nhĩ được biết là làm tăng đáng kể nguy cơ đột quỵ hoặc thuyên tắc huyết khối hệ thống, độc lập với các triệu chứng (AF có triệu chứng hoặc im lặng). Cùng với tăng huyết áp động mạch, nguy cơ này tăng lên đáng kể. Đây là lý do tại sao trong bối cảnh xác định nguy cơ đột quỵ hoặc tắc mạch hệ thống, tất cả các điểm rủi ro hiện có, được sử dụng rộng rãi nhất là điểm CHA2DS2-VASc, tăng huyết áp là một trong những yếu tố nguy cơ thường gặp và quan trọng nhất. Hơn nữa, tăng huyết áp được biết là có liên quan đến biến chứng chảy máu ở bệnh nhân đang điều trị bằng thuốc chống đông máu. Kết quả là, các điểm xuất huyết khác nhau bao gồm tăng huyết áp là một biến số quan trọng, trong đó nêu bật vai trò chính của việc kiểm soát tăng huyết áp ở bệnh nhân AF. [25]
Liệu điều trị tăng huyết áp có làm giảm nguy cơ rung nhĩ mới khởi phát hay không vẫn chưa rõ ràng, mặc dù có dữ liệu ủng hộ giả định này. Tuy nhiên, người ta biết rằng hậu quả của rung nhĩ sẽ giảm đáng kể khi huyết áp được kiểm soát thỏa đáng. Đặc biệt là các chất ức chế hệ thống angiotensin, nhắm vào RAAS, có thể hoạt động với các cơ chế chống vi khuẩn và chống vi trùng bổ sung, có thể đóng vai trò chính trong quá trình xơ hóa của mô tâm nhĩ. [18,26] Theo nghiên cứu LIFE và VALUE, thuốc ức chế thụ thể angiotensin II có liên quan đến việc giảm tỷ lệ mắc AF ở bệnh nhân tăng huyết áp. [27,28] Tuy nhiên, bằng chứng tích lũy từ các phân tích tổng hợp và các thử nghiệm AF khác nhau dường như đồng ý rằng có lẽ đóng góp quan trọng nhất trong phòng ngừa hoặc điều trị AF ở bệnh nhân tăng huyết áp là kiểm soát HA hiệu quả và lâu dài, độc lập với nhóm thuốc hạ huyết áp. đã sử dụng. Việc đạt được các mục tiêu điều trị do các hướng dẫn quốc tế đề xuất có thể dẫn đến phục hồi LVH với chức năng tâm trương được cải thiện và do đó giảm nguy cơ tái phát AF. Hơn nữa, kiểm soát HA có thể dẫn đến kiểm soát nhịp hiệu quả, vì nó đã được chứng minh tạo điều kiện thuận lợi cho sự thành công lâu dài của việc triệt phá AF. [29]
5. Rồi loạn nhịp thất và đột tử tim
Bệnh nhân tăng huyết áp động mạch có thể biểu hiện nhiều rối loạn nhịp thất. Từ lâu người ta đã thừa nhận rằng nhịp thất sớm hoặc nhịp nhanh thất không kéo dài (VT) có thể làm phức tạp thêm bệnh lý tim tăng huyết áp.[30] Bệnh nhân tăng huyết áp có nhịp thất sớm có thể được chú ý trên lâm sàng vì hai lý do, triệu chứng hoặc phát hiện tình cờ khi khám bệnh. Có rất nhiều triệu chứng khác nhau, từ các triệu chứng nhẹ hơn, chẳng hạn như các cơn đánh trống ngực, choáng váng, buồn nôn, chóng mặt và ho đến ngất xỉu hoặc thậm chí đột tử do tim (SCD).[31] Các triệu chứng phụ thuộc vào bản chất của rối loạn nhịp thất (nhịp sớm đơn độc, cặp đôi tâm thất (ventricular couplets), nhịp đôi (bigeminy), nhịp ba (trigeminy), nhịp nhanh thất tạm thời và dai dẳng), khoảng ghép của các nhịp sớm, tổng gánh nặng rối loạn nhịp và vị trí của chúng. nguồn gốc (đồng nhất hoặc đa ổ, tâm thất phải, trái hoặc vách liên thất).
Trên cơ sở sinh lý bệnh, sự hiện diện của LVH có lẽ là yếu tố quan trọng nhất cho sự phát triển rối loạn nhịp thất ở bệnh nhân tăng huyết áp. Cơ chế sinh lý bệnh với vai trò chính được mô tả trong Hình 3. Mức độ LVH dường như liên quan trực tiếp đến tăng ngoại vị tâm thất. Mức độ xơ hóa ở LVH được biết là có liên quan đến tăng nguy cơ loạn nhịp, do tính đồng nhất điện sinh lý bị thay đổi, có thể tạo điều kiện thuận lợi cho các cơ chế vào lại, hậu khử cực sớm—kích hoạt hoạt động và xuất hiện rối loạn nhịp thất. Những thay đổi điện sinh lý liên quan đến LVH không đồng đều trong toàn bộ mô phì đại và xơ hóa cơ tim gây ra các vùng có tốc độ dẫn truyền chậm, có thể tạo thành chất nền cho chứng rối loạn nhịp tim. Bên cạnh chất nền, những bệnh nhân như vậy thường được điều trị bằng các loại thuốc có thể dẫn đến mất cân bằng điện giải (đặc biệt là hạ kali máu và hạ magiê máu), do đó có thể tạo thành yếu tố kích hoạt trực tiếp quan trọng. Ngoài ra, việc tăng cường kích hoạt hệ thống thần kinh giao cảm và RAAS ở bệnh nhân tăng huyết áp cũng đóng một vai trò quan trọng khiến những bệnh nhân này dễ bị tổn thương trong việc phát triển rối loạn nhịp thất, thông qua việc tăng cường tính tự động và những thay đổi trong thời kỳ trơ của tế bào cơ.
Hơn nữa, người ta biết rằng LVH là một yếu tố nguy cơ mạnh mẽ đối với SCD, thông qua rối loạn nhịp thất ác tính, chẳng hạn như các đợt VT dai dẳng và rung tâm thất, đặc biệt ở bệnh nhân tăng huyết áp có CAD. Tuy nhiên, mối quan hệ nhân quả trực tiếp của LVH liên quan đến tăng huyết áp với SCD chưa được chứng minh. [3] Tăng khối lượng thất trái từ lâu đã có mối tương quan với rối loạn nhịp thất và SCD trong nhiều nghiên cứu khác nhau, [30,32-34] nhưng các nghiên cứu điện sinh lý đã không chứng thực điều này.[35,36] Mặc dù có một số nghiên cứu thực nghiệm báo cáo tính dễ bị tổn thương tăng lên của bệnh này. cơ tim phì đại đến rung thất có thể tạo ra, người ta cho rằng LVH không làm tăng xu hướng rối loạn nhịp vào lại, mà đúng hơn, rối loạn nhịp tim là dấu hiệu của thiếu máu cục bộ cơ tim. [3] Người ta phải xem xét rằng LVH nặng thường đi kèm với tình trạng tự điều hòa mạch vành và dự trữ lưu lượng mạch vành bất thường, khiến những bệnh nhân này dễ bị biến cố thiếu máu cục bộ vi mạch. Vì vậy, LVH có thể được liên kết gián tiếp với SCD. Ngoài ra, tăng huyết áp là yếu tố nguy cơ chính gây xơ vữa động mạch và có thể ảnh hưởng đến động mạch vành thượng tâm mạc, dẫn đến thiếu máu cơ tim dẫn đến biểu hiện rối loạn nhịp thất nguy hiểm như vậy.
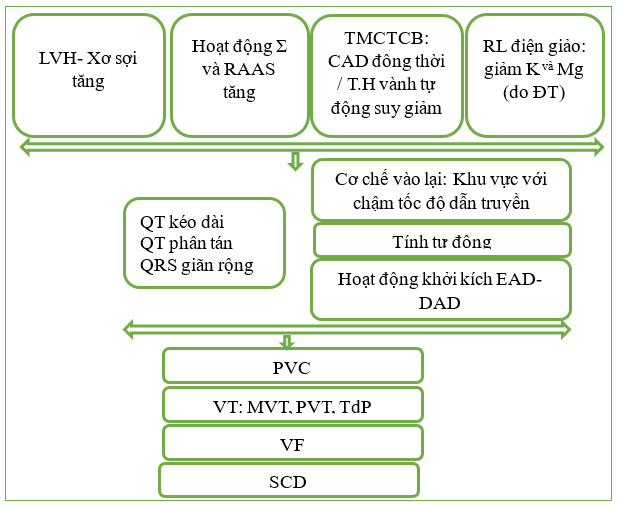
Hình 3: Sự xuất hiện của rối loạn nhịp thất trong tăng huyết áp động mạch. CAD: bệnh động mạch vành; (early afterdepolarizations) EAD: hậu khử cực sớm; (delayed afterdepolarizations) DAD: hậu tái cực trễ; (renin-angiotensin-aldosterone system) RAAS: hệ thống renin-angiotensin-aldosterone; SCD: đột tử do tim; TdP: xoắn đỉnh.
6. Xem xét điều trị
Tỷ lệ tăng huyết áp động mạch ngày càng tăng, nhiều người bị tăng huyết áp ở độ tuổi tương đối trẻ và sự phát triển sớm của LVH là những khía cạnh đòi hỏi các bác sĩ phải nâng cao nhận thức về tầm quan trọng của việc xác định và điều trị sớm chứng rối loạn nhịp tim. Có một số điểm cần được đề cập liên quan đến việc quản lý bệnh nhân tăng huyết áp có biểu hiện rối loạn nhịp tim, có triệu chứng hoặc không có triệu chứng. Vì bệnh tim tăng huyết áp có thể biểu hiện với cả rối loạn nhịp trên thất và rối loạn nhịp thất, nên mọi bệnh nhân có triệu chứng phàn nàn về đánh trống ngực, các cơn yếu hoặc thậm chí ngất, cần được kiểm tra thêm bằng cách theo dõi điện tâm đồ (ECG) kéo dài hoặc thậm chí cấy máy ghi vòng để xác định loại. (loạn nhịp tim nhanh hay chậm), và bản chất của rối loạn nhịp, nguồn gốc trên thất hoặc thất. Hơn nữa, các bệnh nhân không có triệu chứng cũng nên được sàng lọc thường xuyên về rung nhĩ và rối loạn nhịp thất. Như đã nhấn mạnh ở trên, các loại rối loạn nhịp tim chậm khác nhau có thể xảy ra ở bệnh nhân tăng huyết áp dưới dạng rối loạn trong quá trình hình thành xung động hoặc lan truyền xung. Những rối loạn nhịp tim này thường có triệu chứng và do đó bệnh nhân phải được điều trị thích hợp bằng cách tối ưu hóa điều trị nội khoa (tránh thuốc beta blockers và thuốc chẹn kênh canxi không dihydropyridine) và cấy máy tạo nhịp nếu được chỉ định. Luôn luôn lưu ý đến khả năng tồn tại đồng thời của hội chứng OSA, vì tình trạng này là nguyên nhân thường gặp và có khả năng hồi phục được gây ra chứng loạn nhịp tim chậm.
Thực tế là tăng huyết áp và rung nhĩ thường cùng tồn tại và tiên lượng bị ảnh hưởng đáng kể, đòi hỏi phải theo dõi thường xuyên tình trạng tăng huyết áp bằng theo dõi ECG dài hạn hoặc đo điện tâm đồ thường xuyên để phát hiện rung nhĩ. Các bác sĩ điều trị tăng huyết áp phải nhận thức được và có thể mở rộng sàng lọc AF không triệu chứng, vì nhóm bệnh nhân đặc biệt này rất có thể có chỉ định dùng thuốc chống đông đường uống để phòng ngừa huyết khối tắc mạch. Hơn nữa, những bệnh nhân mang máy tạo nhịp tim vĩnh viễn nên được thẩm vấn thiết bị thường xuyên để phát hiện các cơn nhịp nhĩ cao (atrial high-rate episodes ) hoặc rối loạn nhịp tim nhanh và được điều trị phù hợp trên cơ sở cá nhân. Bệnh nhân có SVPB và LVH thường xuyên phải được theo dõi để phát hiện AF “im lặng”. Việc phát hiện AF ở phần lớn bệnh nhân tăng huyết áp bắt buộc phải dùng thuốc chống đông đường uống để phòng ngừa thuyên tắc huyết khối, vì những bệnh nhân này có điểm CHA2DS2-VASc ít nhất là [1] và có nguy cơ gia tăng các biến cố huyết khối tắc mạch. Như đã nhấn mạnh ở trên, giảm huyết áp ở bệnh nhân tăng huyết áp là đóng góp quan trọng nhất trong việc ngăn ngừa rung nhĩ. Tuy nhiên, một khi AF được chẩn đoán, việc kiểm soát HA thích hợp là vô cùng quan trọng để giảm cả nguy cơ huyết khối liên quan đến AF và nguy cơ chảy máu liên quan đến thuốc chống đông máu đường uống. Mục tiêu huyết áp lý tưởng ở bệnh nhân rung nhĩ vẫn chưa được xác định vì không có thử nghiệm lâm sàng quy mô lớn cụ thể. [1,19,25] Theo dữ liệu hiện có và hướng dẫn hiện hành mức huyết áp nên được giảm.
Các bác sĩ điều trị tăng huyết áp với LVH không chỉ nhằm mục đích kiểm soát huyết áp thích hợp mà còn phải lưu ý và luôn sàng lọc những bệnh nhân này để phát hiện rối loạn nhịp thất bằng ECG nhiều lần liên tiếp hoặc theo dõi nhịp kéo dài. Sự xuất hiện của rối loạn nhịp thất phức tạp có thể hoàn toàn không có triệu chứng. Trong mọi trường hợp, cần phải điều tra thêm về sinh hoá máu, xét nghiệm chức năng tuyến giáp, sàng lọc CAD, điều chỉnh bất kỳ nguyên nhân có thể đảo ngược nào (chẳng hạn như hạ kali máu do thuốc và tránh dùng thuốc kéo dài QT), tăng liều điều trị bằng thuốc chẹn beta nếu dung nạp được. và tất nhiên là phân tầng nguy cơ SCD. Đừng bao giờ quên tư vấn cho những bệnh nhân như vậy về những thay đổi lối sống phù hợp và loại bỏ các tác nhân gây ngoại tâm thu thất phổ biến, chẳng hạn như caffeine và thuốc lá, hoặc để kiểm soát căng thẳng và lo lắng có thể xảy ra. Ngoài ra, hoạt động thể chất và tập thể dục nhịp điệu dường như đóng một vai trò có lợi trong việc hồi phục các phức hợp tâm thất sớm. [37]
Xét LVH đại diện cho cơ chế sinh lý bệnh quan trọng nhất gây ra rối loạn nhịp thất, nó tự động trở thành mục tiêu điều trị quan trọng. Điều trị chống huyết áp và kiểm soát HA hiệu quả nhằm làm giảm LVH và catecholamine trong huyết tương góp phần làm giảm hoặc ngăn ngừa rối loạn nhịp thất. [38] Nhiều nghiên cứu khác nhau đã báo cáo thuốc ức chế hệ thống angiotensin rất hữu ích trong việc làm giảm LVH, thông qua các hoạt động chống xơ hóa và chống viêm, trong khi thuốc đối kháng thụ thể mineralocorticoid và thuốc chẹn beta là những thuốc có liên quan đến tác dụng chống loạn nhịp tim. Tuy nhiên, điều quan trọng cần nhấn mạnh là kiểm soát HA (với bất kỳ nhóm thuốc nào) bản thân nó là mục tiêu quan trọng, khi đạt được mục tiêu này có thể mang lại lợi ích tiên lượng thông qua sự hồi phục LVH. Điều trị bằng thuốc chống loạn nhịp để điều trị rối loạn nhịp thất nên được bắt đầu như một lựa chọn thứ hai, trên cơ sở cá nhân hóa, có tính đến nhiều loại thuốc chống loạn nhịp bị chống chỉ định ở LVH nặng, như đã nêu ở trên. Cuối cùng, dữ liệu hiện có cho thấy vai trò có lợi của việc hủy bỏ thần kinh giao cảm ở thận trong việc giảm gánh nặng rối loạn nhịp tim và cụ thể hơn là các cơn VT ở bệnh nhân tăng huyết áp kèm suy tim thiếu máu cục bộ hoặc tổng số rối loạn nhịp thất ở bệnh nhân tăng huyết áp kháng trị. [4] Mặc dù các cơ chế sinh lý bệnh đã được đề xuất, như việc điều chỉnh sự cân bằng giao cảm và giảm hoạt động giao cảm cũng như nồng độ angiotensin II, vẫn còn thiếu dữ liệu mạnh mẽ từ các thử nghiệm lâm sàng chất lượng cao, được cung cấp đầy đủ.
Quan trọng hơn, các bác sĩ điều trị bệnh nhân tăng huyết áp có rối loạn nhịp thất phải phân loại nguy cơ SCD và đánh giá khả năng cấy máy khử rung tim (ICD), đặc biệt trong trường hợp rối loạn chức năng bệnh động mạch vành hoặc LV đồng thời. Mặc dù có bằng chứng hỗ trợ trong y văn việc điều trị những bệnh nhân như vậy bằng việc sử dụng thuốc chẹn RAAS hoặc thuốc chẹn beta là có lợi và thậm chí có thể làm giảm nguy cơ SCD, [2] thường cực kỳ khó để thực sự phân tầng những bệnh nhân đó. Có nguy cơ cao hơn về SCD ở những bệnh nhân có LVH nặng hoặc tăng gánh nặng rối loạn nhịp thất, và do đó, tư vấn của bác sĩ rối loạn nhịp tim có thể được biện minh trong những trường hợp này. Trong mọi trường hợp, các đợt đánh trống ngực hoặc ngất nặng hơn là những triệu chứng cảnh báo và cần được điều tra kỹ lưỡng. Nghiên cứu điện sinh lý có thể hữu ích trong việc phân tầng nguy cơ cho phòng ngừa SCD tiên phát. Liên quan đến việc sử dụng ICD, theo hướng dẫn do các hiệp hội tim mạch quốc tế đề xuất, cấy ICD được chỉ định để phòng ngừa SCD thứ phát. Mặt khác, liên quan đến phòng ngừa SCD tiên phát, dữ liệu sẵn có thu được từ các thử nghiệm lâm sàng ngẫu nhiên không hoàn toàn thiên về lợi ích tiên lượng mạnh, đối với các bệnh nhân có bệnh tim tăng huyết áp, LVH, nhưng không có bệnh CAD đi kèm. [2,32,39] Mặc dù LVH có liên quan đến việc tăng nguy cơ rối loạn nhịp thất nói chung, như đã nêu ở trên, việc phân tầng nguy cơ ở nhóm bệnh nhân cụ thể này là không dễ dàng. Vì vậy, chúng ta phải dựa vào các dấu hiệu rủi ro truyền thống, chẳng hạn như sự hiện diện hay vắng mặt của bệnh động mạch vành, phân suất tống máu thất trái giảm, gánh nặng ngoại tâm thư thất cao và kết quả của nghiên cứu điện sinh lý. Các thông số ECG không xâm lấn bổ sung, chẳng hạn như độ phân tán khoảng QT, điện thế muộn, biến thiên nhịp tim, và sự thay đổi sóng T, chưa được chứng minh là có thể dự đoán chính xác nguy cơ SCD.
7. Kết luận
Bệnh nhân tăng huyết áp có thể biểu hiện một loạt các rối loạn nhịp tim, từ rối loạn nhịp tim chậm, do rối loạn hình thành xung động và lan truyền, đến rối loạn nhịp tim nhanh có nguồn gốc trên thất hoặc thất. Hầu hết các rối loạn nhịp tim liên quan đến tăng huyết áp động mạch kéo dài đều có liên quan đến LVH, do hoạt động quá mức của hệ giao cảm, do điều trị chống tăng huyết áp hoặc do các bệnh đi kèm, chẳng hạn như hội chứng OSA hoặc CAD. Do tỷ lệ mắc bệnh và tử vong bị ảnh hưởng đáng kể, các bác sĩ điều trị phải điều tra kỹ lưỡng từng bệnh nhân có triệu chứng nhưng cũng sàng lọc những bệnh nhân không có triệu chứng để phát hiện rối loạn nhịp tim.
Tài liệu tham khảo
- Angeli F, Reboldi G, Trapasso M, et al. European and US guidelines for arterial hypertension: similarities and differences. Eur J Intern Med. 2019;63:3-8.
- Lip GY, Coca A, Kahan T, et al. Hypertension and cardiac arrhythmias: a consensus document from the European Heart Rhythm Association (EHRA) and ESC Council on Hypertension, endorsed by the Heart Rhythm Society (HRS), Asia-Pacific Heart Rhythm Society (APHRS) and Sociedad Latinoamericana de Estimulación Cardíaca y Electrofisiología (SOLEACE). Europace. 2017;19(6):891-911.
- Lip GY, Felmeden DC, Li-Saw-Hee FL, Beevers DG. Hypertensive heart disease. A complex syndrome or a hypertensive ‘cardiomyopathy’? Eur Heart J. 2000;21(20):1653-1665.
- Bazoukis G, Korantzopoulos P, Tsioufis C. The impact of renal sympathetic denervation on cardiac electrophysiology and arrhythmias: a systematic review of the literature. Int J Cardiol. 2016;220:87-101.
- Alexopoulos A, Perpinia A, Michelakakis N, Kossyvakis C, Deftereos S, Pyrgakis V. Evaluation of left ventricular hypertrophy in patients requiring permanent pacing. Ther Adv Cardiovasc Dis. 2010;4:295-299.
- Rienstra M, Van Veldhuisen DJ, Crijns HJ, Van Gelder IC, RACE Investigators. Enhanced cardiovascular morbidity and mortality during rhythm control treatment in persistent atrial fibrillation in hypertensives: data of the RACE study. Eur Heart J. 2007;28:741-751.
- Li Z, Dahlof B, Okin PM, et al. Left bundle branch block and cardiovascular morbidity and mortality in hypertensive patients with left ventricular hypertrophy: the Losartan intervention for endpoint reduction in hypertension study. J Hypertens. 2008;26:1244-1249.
- Oikarinen L, Nieminen MS, Viitasalo M, et al. QRS duration and QT interval predict mortality in hypertensive patients with left ventricular hypertrophy: the Losartan Intervention for Endpoint Reduction in Hypertension Study. Hypertension. 2004;43:1029-1034.
- Morin DP, Oikarinen L, Viitasalo M, et al. QRS duration predicts sudden cardiac death in hypertensive patients undergoing intensive medical therapy: the LIFE study. Eur Heart J. 2009;30:2908-2914.
- Somers VK, White DP, Amin R, et al. Sleep apnea and cardiovascular disease: an American Heart Association/American College of Cardiology Foundation Scientific Statement from the American Heart Association Council for High Blood Pressure Research Professional Education Committee, Council on Clinical Cardiology, Stroke Council, and Council on Cardiovascular Nursing. J Am Coll Cardiol. 2008;52:686-717.
- Neuzil P, Merkely B, Erglis A et al Pacemaker-Mediated Programmable Hypertension Control Therapy. J Am Heart Assoc. 2017;6(12):e006974.
- Kuck KH. Safety and efficacy of BackBeat cardiac neuromodulation therapy (CNTTM) in patients with hypertension: final results of a double-blind randomized trial. 2019. Presented at the TCT Congress Scientific Symposium. San Francisco.
- Ijiri H, Kohno I, Yin D, et al. Cardiac arrhythmias and left ventricular hypertrophy in dipper and nondipper patients with essential hypertension. Jpn Circ J. 2000;64:499-504.
- Manolis A, Poulimenos L, Kallistratos M, Gavras I, Gavras H. Sympathetic overactivity in hypertension and cardiovascular disease. Curr Vasc Pharmacol. 2014;12(1):4-15.
- Larsen BS, Kumarathurai P, Falkenberg J, Nielsen OW, Sajadieh A. Excessive atrial ectopy and short atrial runs increase the risk of stroke beyond incident atrial fibrillation. J Am Coll Cardiol. 2015;66:232-241.
- Dan GA, Badila E, Weiss E, et al. Arterial hypertension in patients with atrial fibrillation in Europe: a report from the EURObservational Research Programme pilot survey on atrial fibrillation. Int J Cardiol. 2018;254:136-141.
- Lip GY. Atrial fibrillation in patients with hypertension: trajectories of risk factors in yet another manifestation of hypertensive target organ damage. Hypertension. 2016;68:544-545.
- Manolis AJ, Kallistratos M, Poulimenos L. Recent clinical trials in atrial fibrillation in hypertensive patients. Curr Hyperts Rep. 2012;14:350-359.
- Kallistratos MS, Poulimenos LE, Manolis AJ. Atrial fibrillation and arterial hypertension. Pharmacol Res. 2018;128:322-326.
- Kalogeropoulos A, Tsiodras S, Rigopoulos A, et al. Novel association patterns of cardiac remodeling markers in patients with essential hypertension and atrial fibrillation. BMC Cardiovasc Disord. 2011;11:77.
- Goette A, Kalman JM, Aguinaga L, et al. EHRA/HRS/APHRS/SOLAECE expert consensus on atrial cardiomyopathies: definition, characterization, and clinical implication. Europace. 2016;18:1455-1490.
- Kumagai K, Nakashima H, Urata H, Gondo N, Arakawa K, Saku K. Effects of angiotensin II type 1 receptor antagonist on electrical and structural remodeling in atrial fibrillation. J Am Coll Cardiol. 2003;41:2197-2204.
- Hirsh BJ, Copeland-Halperin RS, Halperin JL. Fibrotic atrial cardiomyopathy, atrial fibrillation, and thromboembolism: mechanistic links and clinical inferences. J Am Coll Cardiol. 2015;65:2239-2251.
- Dzeshka MS, Shahid F, Shantsila A, Lip GY. Hypertension and atrial fibrillation: an intimate association of epidemiology, pathophysiology, and outcomes. Am J Hypertens. 2017;30(8):733-755.
- Manolis AJ, Doumas M, Poulimenos L, Kallistratos M, Mancia G. The unappreciated importance of blood pressure in recent and older atrial fibrillation trials. J Hypertens. 2013;31:2109-2117.
- Afzal MR, Savona S, Mohamed O, Mohamed-Osman A, Kalbfleisch SJ. Hypertension and arrhythmias. Heart Fail Clin. 2019;15:543-550.
- Wachtell K, Bella JN, Rokkedal J, et al. Change in diastolic left ventricular filling after one year of antihypertensive treatment: the Losartan Intervention For Endpoint Reduction in Hypertension (LIFE) Study. Circulation. 2002;105:1071-1076.
- Kjeldsen SE, Julius S, Mancia G, et al. Effects of valsartan compared to amlodipine on preventing type 2 diabetes in high-risk hypertensive patients: the VALUE trial. J Hypertens. 2006;24:1405-1412.
- Pathak RK, Middeldorp ME, Lau DH, et al. Aggressive risk factor reduction study for atrial fibrillation and implications for the outcome of ablation: the ARREST-AF cohort study. J Am Coll Cardiol. 2014;64(21):2222-2231.
- McLenachan JM, Henderson E, Morris KI, Dargie HJ. Ventricular arrhythmias in patients with hypertensive left ventricular hypertrophy. N Engl J Med. 1987;317:787-792.
- Zehender M, Faber T, Koscheck U, Meinertz T, Just H. Ventricular tachyarrhythmias, myocardial ischemia, and sudden cardiac death in patients with hypertensive heart disease. Clin Cardiol. 1995;18(7):377-383.
- Chatterjee S, Bavishi C, Sardar P, et al. Meta-analysis of left ventricular hypertrophy and sustained arrhythmias. Am J Cardiol. 2014;114:1049-1052.
- Simpson RJ Jr, Cascio WE, Crow RS, et al. Association of ventricular premature complexes with electrocardiographic-estimated left ventricular mass in a population of African-American and white men and women (The Atherosclerosis Risk in Communities). Am J Cardiol. 2001;87:49-53.
- Ghali JK, Kadakia S, Cooper RS, Liano YL. Impact of left ventricular hypertrophy on ventricular arrhythmias in the absence of coronary artery disease. J Am Coll Cardiol. 1991;17:1277-1282.
- Kowey PR, Friechling TD, Sewter J, et al. Electrophysiological effects of left ventricular hypertrophy. Effect of calcium and potassium channel blockade. Circulation. 1991;83:2067-2075.
- Vester EG, Kuhls S, Ochiulet-Vester J, Vogt M, Strauer BE. Electrophysiological and therapeutic implications of cardiac arrhythmias in hypertension. Eur Heart J. 1992;13(Suppl D):70-81.
- Marcus GM. Evaluation and management of premature ventricular complexes. Circulation. 2020;141(17):1404-1418.
- Novo S, Abrignani MG, Novo G, et al. Effects of drug therapy on cardiac arrhythmias and ischemia in hypertensives with LVH. Am J Hypertens. 2001;14:637-643.
- Køber L, Thune JJ, Nielsen JC, et al. Defibrillator implantation in patients with nonischemic systolic heart failure. N Engl J Med. 2016;375(13):1221-1230.







