NGUYỄN THANH HIỀN
TRẦN DUY BÁCH
MỞ ĐẦU
Tăng huyết áp phổ biến hơn ở những bệnh nhân điều trị ung thư so với dân số chung do nhiều cơ chế, bao gồm tác dụng trực tiếp lên mạch máu và thận của liệu pháp chống ung thư. Tăng huyết áp và sự bất ổn huyết áp bắt đầu tại thời điểm khởi trị ung thư và kéo dài suốt đời, điều này có thể dẫn đến sự gián đoạn trong điều trị và đặt bệnh nhân vào tình trạng tăng nguy cơ mắc bệnh tim mạch và tử vong. Nhiều phương pháp điều trị ung thư hiện đại có liên quan đến độc tính trên tim mạch, dẫn đến bệnh tim, thuyên tắc huyết khối và tăng huyết áp. Quản lý tăng huyết áp ở bệnh nhân đang điều trị ung thư phần lớn là theo kinh nghiệm, hiện tại chưa có dữ liệu từ các thử nghiệm hỗ trợ các thuốc hoặc mục tiêu điều trị cụ thể ở quần thể đặc biệt này. Bài này chúng tôi đưa ra cái nhìn tổng quan về cơ chế và điều trị lâm sàng tăng huyết áp do liệu pháp điều trị ung thư gây ra.
DỊCH TỄ HỌC
Tăng huyết áp và ung thư là những nguyên nhân chính của tàn phế và tử vong toàn cầu
Ung thư và bệnh tim mạch là nguyên nhân chính gây tàn phế và tử vong trên toàn cầu. Tăng huyết áp là một trong những yếu tố nguy cơ chính tiến triển bệnh tim mạch, bao gồm bệnh tim thiếu máu cục bộ, suy tim, đột quỵ và bệnh thận. Tỷ lệ tăng huyết áp trên toàn thế giới đang gia tăng, đạt 1.3 tỷ người trưởng thành vào năm 2019. Mặc dù có sẵn các thuốc hạ huyết áp hiệu quả, nhưng huyết áp vẫn không được kiểm soát đầy đủ ở gần 50% số người tăng huyết áp. Các định nghĩa hiện nay về huyết áp bình thường, huyết áp bình thường cao và tăng huyết áp dựa trên hướng dẫn thực hành lâm sàng và điều trị tăng huyết áp của trường môn tim mạch Hoa Kỳ/Hiệp hội tim mạch Hoa Kỳ năm 2017 và các hướng dẫn khác được trình bày trong Bảng 1. Tỷ lệ mắc ung thư cũng ngày càng tăng, theo trung tâm giám sát ung thư toàn cầu ước tính rằng số ca ung thư mới trên toàn thế giới sẽ tăng từ 19.3 triệu vào năm 2020 lên >28 triệu vào năm 20401,2.
Các yếu tố nguy cơ thường gặp của tăng huyết áp và ung thư
Một mối quan hệ hai chiều giữa ung thư và tăng huyết áp đã được đặt ra. Tăng huyết áp có liên quan đến tăng nguy cơ ung thư, điều này được thể hiện rõ ràng nhất qua việc tăng nguy cơ ung thư biểu mô tế bào thận ở bệnh nhân bị tăng huyết áp.
Một nghiên cứu đoàn hệ từ 2013-2017 dựa trên dân số tại các trung tâm chăm sóc sức khỏe cộng đồng quận Trường Ninh, Thượng Hải, Trung Quốc cho thấy, trong số 101,370 bệnh nhân tăng huyết áp theo dõi trung bình 5.1 năm (SD 1.3); 4,970 trường hợp ung thư được chẩn đoán mới và CCB (ức chế canxi) là thuốc hạ huyết áp được sử dụng thường xuyên nhất có liên quan đến tăng mức độ trung bình nguy cơ ung thư chung (HR=1.11, KTC 95%: 1.05–1.18). Thuốc ARB (ức chế thụ thể Angiotensin) được sử dụng phổ biến thứ hai cũng có liên quan đến tăng nguy cơ ung thư chung (HR=1.10, 95%CI: 1.03–1.17) cũng như ung thư phổi và tuyến giáp (tương ứng HR=1.21, 95%CI:1.05–1.39; HR=1.62 95% CI: 1.18–2.21). Không tìm thấy mối liên quan đáng kể nào giữa bệnh ung thư và thuốc hạ huyết áp khác. Bệnh nhân tăng huyết áp sử dụng nhiều hơn một nhóm thuốc hạ huyết áp có nguy cơ ung thư chung cao hơn (HR: 1.22, 95%CI: 1.10–1.35 cho hai nhóm thuốc; HR: 1.22, 95%CI: 1.03–1.45 cho ba nhóm thuốc trở lên) và các nhà nghiên cứu cũng nghĩ đến một mối tương quan liều lượng-đáp ứng có thể có (P xu hướng <0.001). Nguy cơ ung thư tuyến giáp cao hơn ở bệnh nhân tăng huyết áp được chỉ định dùng ba nhóm thuốc hạ huyết áp trở lên. Từ đó nghiên cứu này kết luận việc sử dụng ARB hoặc CCB có thể làm tăng nguy cơ mắc bệnh ung thư chung. Dùng nhiều hơn một nhóm thuốc hạ huyết áp dường như làm tăng nguy cơ mắc ung thư chung4.
Ngoài ra, tỷ lệ tăng huyết áp ở những bệnh nhân mắc bệnh ung thư và những người sống sót sau ung thư cao hơn trong dân số chung. Một nghiên cứu đoàn hệ tiến cứu trong số > 17,000 bệnh nhân ung thư phát hiện tăng huyết áp là bệnh đi kèm phổ biến nhất (với tỷ lệ 38%). Sự đồng hành của ung thư và tăng huyết áp và tăng nguy cơ tim mạch ở bệnh nhân ung thư có thể được giải thích bởi sự hiện diện chung các yếu tố nguy cơ và cơ chế sinh lý bệnh, bao gồm hút thuốc, đái tháo đường, bệnh thận mạn tính, ít hoạt động thể chất, béo phì, stress oxy hóa và viêm nhiễm. Tỷ lệ tàn phế và tử vong của bệnh tim mạch tăng lên ở những bệnh nhân ung thư và những người sống sót sau ung thư. Ngoài ra, có nhiều thuốc ung thư gây tăng huyết áp thông qua tác động đa cơ chế5-7. Tỉ lệ THA liên quan đến nhóm thuốc điều trị ung thư nêu ở hình 18
THUỐC CHỐNG UNG THƯ GÂY NGUYÊN NHÂN TĂNG ÁP VÀ CƠ CHẾ TIỀM ẨN
1. Chất ức chế đường dẫn truyền tín hiệu yếu tố tăng trưởng nội mô mạch máu (VEGF)
Chất ức chế đường dẫn truyền tín hiệu (VSPIs) của yếu tố tăng trưởng nội mô mạch máu (VEGF) phát huy tác dụng chống ung thư bằng cách ức chế tăng sinh mạch khối u qua trung gian VEGF, cô lập nguồn cung cấp oxy và chất dinh dưỡng cho tế bào u. Các chất này hoạt động thông qua ức chế trực tiếp VEGF hoặc bằng cách ức chế thụ thể tyrosine kinase (hình 2). Đánh giá gần đây bởi Camarda và cộng sự, họ đã công bố các điều trị hiệu quả ở nhiều bệnh ung thư, đặc biệt là thận, tế bào gan, tuyến giáp, mô đệm đường tiêu hóa và các bệnh ung thư khác.
VSPIs có liên quan đến các tác dụng phụ về tim mạch trong đó tăng huyết áp là thường gặp nhất. Các thuốc này gây ra tình trạng tăng huyết áp cấp tính và kéo dài trong thời gian điều trị ở phần lớn bệnh nhân. Tỷ lệ tăng huyết áp do VSPIs được báo cáo dao động từ 20% đến 90% và thay đổi tùy theo hiệu lực và liều lượng của VSPIs, và cũng tùy theo định nghĩa tăng huyết áp. Trong một phân tích tổng hợp 29,000 bệnh nhân ung thư, nguy cơ tương đối của tăng huyết áp cao gấp 3.8 lần ở những người được điều trị bằng chất ức chế tyrosine kinase (TKI) của VEGF so với nhóm chứng. Tăng huyết áp liên quan đến VSPIs có thể đảo ngược và giải quyết khi ngừng thuốc, cho thấy tác dụng đánh trúng đích. Theo đó, tăng huyết áp do VSPIs được đề xuất là một yếu tố dự đoán hoặc dấu ấn sinh học về điều trị ung thư có hiệu quả.
VEGF là một chất giãn mạch mạnh và thiếu chất này liên quan đến việc giảm sinh khả dụng của oxit nitric (NO)- một chất giãn mạch khác- và tăng nồng độ của 1 chất co mạch mạnh là endothelin-1 (1 chất quan trọng trong sinh lý bệnh tăng huyết áp) (Hình 2). Sự ức chế đường truyền tín hiệu của VEGF cũng liên quan đến việc tăng tạo ra các phản ứng với các phân tử oxy, bao gồm phản ứng với các phân tử nitơ, H2O2 và O2−, gây ra các stress oxy hóa trên mạch máu. Khi sự giảm mật độ vi mạch xảy ra (trước đây được quan sát thấy ở da và niêm mạc miệng) thì kháng lực mạch máu tăng dẫn đến tăng huyết áp. VSPI liên quan đến độc tính trên thận, điều này cũng có thể góp phần vào tác dụng làm tăng huyết áp do suy giảm bài niệu natri. Bằng chứng hiện tại không cho thấy vai trò chính của hệ thống renin-angiotensin-aldosterone trong sinh lý bệnh của bệnh tăng huyết áp liên quan đến VSPI. VSPI cũng can thiệp vào con đường của yếu tố tăng trưởng khác, bao gồm yếu tố tăng trưởng có nguồn gốc từ tiểu cầu, yếu tố tăng trưởng nguyên bào sợi, tyrosine kinase 3 giống fms và c-Kit. Sự ức chế của những con đường này gợi lên thêm cơ chế tăng huyết áp tiềm ẩn khác3,5,8.
| Hội tim mạch- ung thư quốc tế
|
Bình thường HATT ≤130 mmHg HATTr ≤80 mmHg |
Ngưỡng điều trị
– Nếu nguy cơ bệnh tim mạch hoặc bệnh lý tim mạch do xơ vữa ≥10%: HATT ≥130 mmHg hay HATTr ≥80 mmHg – Các trường hợp khác: HATT ≥140 mmHg hay HATTr ≥90 mmHg |
Ngưỡng giữ liệu pháp điều trị ung thư
HATT ≥180 mmHg hoặc HATTr ≥110 mmHg |
Đáp ứng tăng huyết áp quá mức
Tăng HATT >20 mmHg hoặc huyết áp động mạch trung bình tăng >15 mm Hg |
Đáp ứng tăng huyết áp cấp cứu
Tăng huyết áp rất cao liên quan đến tổn thương cơ quan do tăng huyết áp cấp tính (tim, não, thận) cần hạ áp ngay lập tức để hạn chế tổn thương cơ quan đích. |
|
| Viện ung thư quốc gia
Tiêu chuẩn thông dụng để đánh giá các biến cố bất lợi phiên bản 5 |
Độ 1
HATT 120–139 mmHg hoặc HATTr 80–89 mmHg |
Độ 2
HATT 140–159 mmHg hoặc HATTr 90–99 mmHg nếu trước đó bình thường Có chỉ định thay đổi can thiệp y tế cơ bản; Có chỉ định dùng 1 thuốc huyết áp khi mức huyết áp cao này tái phát hoặc dai dẳng (24 giờ); tăng >20 mmHg (tâm trương) hoặc >140/90 mmHg kèm triệu chứng; |
Độ 3
HATT ≥160 mmHg hoặc HATTr ≥100 mm Hg Có chỉ định can thiệp y tế; Có chỉ định dùng > 1 loại thuốc hoặc liệu pháp điều trị tích cực hơn trước đó. |
Độ 4
Các biến chứng đe dọa tính mạng (tức là suy giảm thần kinh thoáng qua hoặc vĩnh viễn, cơn tăng huyết áp). Có chỉ định can thiệp khẩn cấp. |
||
| Trường môn tim mạch Hoa Kỳ/ Hội tim mạch Hoa Kỳ 2017 | Bình thường
HATT <120 mmHg HATTr <80 mmHg |
Bình thường cao
HATT 120–129 mmHg HATTr <80 mmHg |
Giai đoạn 1
HATT 130–139 mmHg HATTr 80–90 mmHg Có chỉ định điều trị bằng thuốc nếu nguy cơ ASCVD > 10%. |
Giai đoạn 2
HATT >140 mmHg HATTr >90 mmHg Mục tiêu điều trị với mục tiêu HA <130/80 mmHg |
Cơn tăng huyết áp
HATT >180 mmHg HATTr >120 mmHg Bắt đầu điều trị bằng thuốc hạ áp khẩn cấp. |
|
| Hội tim mạch châu Âu 2018 | Tối ưu
HATT <120 mmHg HATTr <80 mmHg
|
Bình thường
HATT 120–129 mmHg HATTr 80–84 mmHg |
Bình thường cao
HATT 130–139 mmHg HATTr 85–89 mmHg Cân nhắc điều trị bằng thuốc nếu nguy cơ ASCVD >10% hoặc đã xác định mắc bệnh tim mạch, bệnh thận mạn hoặc đái tháo đường. |
Độ 1
HATT 140–159 mm Hg HATTr 90–99 mm Hg Mục tiêu điều trị bằng thuốc đầu tiên <140/90 mmHg; cân nhắc <130/80 mmHg nếu dung nạp được nhưng HATT không <120 mmHg Ở bệnh nhân >65 tuổi, mục tiêu HATT là 130–140 mmHg và HATTr <80 mmHg; bắt đầu bằng phối hợp 2 thuốc. |
Độ 2
HATT 160–179 mm Hg HATTr 100–109 mmHg Mục tiêu điều trị bằng thuốc như độ 1
|
Độ 3
HATT ≥180 mm Hg HATTr ≥110 mm Hg Điều trị bằng thuốc khẩn cấp, mục tiêu như độ 1 |
| Hội tăng huyết áp quốc tế 2020 | Bình thường
HATT <130 mmHg HATT <85 mmHg |
Bình thường cao
HATT 130–139 mmHg Huyết áp tâm trương 85–89 mmHg |
Độ 1
HATT 140–159 mmHg HATTr 90–99 mm Hg Điều trị bằng thuốc được chỉ định nếu nguy cơ ASCVD >10% hoặc đã xác định có bệnh tim mạch, bệnh thận mạn, đái tháo đường. Mục tiêu giảm huyết áp 20/10 mmHg, lý tưởng nhất là <140/90 mmHg Mục tiêu tối ưu: <65 tuổi: 120–130/ 70–79 mmHg ≥65 tuổi: <140/90 mm Hg |
Độ 2
HATT ≥160 mmHg HATTr ≥100 mmHg Điều trị bằng thuốc ngay lập tức ở tất cả các bệnh nhân |
||
| Bảng 1. Định nghĩa tăng huyết áp ở bệnh nhân ung thư và người trưởng thành trong dân số chung theo hướng dẫn chính3.
HATT- huyết áp tâm thu; HATTr- huyết áp tâm trương; ASCVD- bệnh tim mạch do xơ vữa |
||||||
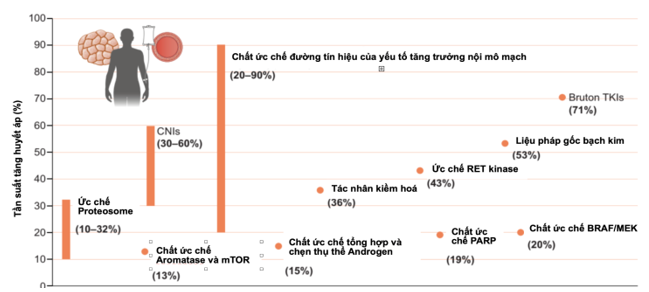
Hình 1. Tần suất tăng huyết áp liên quan các nhóm thuốc điều trị ung thư8
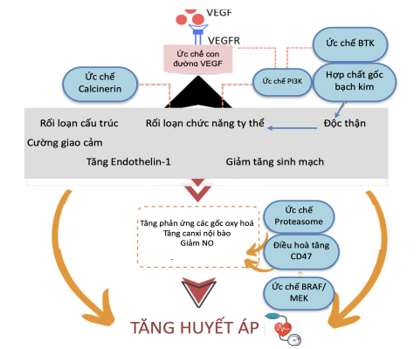
Hình 2. Cơ chế tăng huyết áp của chất ức chế đường dẫn truyền tín hiệu yếu tố tăng trưởng nội mô mạch máu (VEGF)3
2. Thuốc (nhóm) ức chế đột biến BRAF/MEK
Sarcoma sợi BRAF dương tính và thuốc ức chế men được kích hoạt bằng Mitogen (MEK) được sử dụng trong điều trị ung thư mô liên kết BRAF dương và ung thư đại trực tràng BRAF dương. Những thuốc này thường được kê đơn kết hợp. Khoảng 60% bệnh nhân ung thư mô sợi BRAF dương điều trị bằng tác nhân ức chế MEK (hình 1). Đây cũng là những con đường sinh lý bình thường của hệ tim mạch.
Tăng huyết áp là biến cố tim mạch thường gặp nhất khi dùng thuốc ức chế BRAF/MEK. Một phân tích tổng hợp từ 5 thử nghiệm lâm sàng ngẫu nhiên (RCT) báo cáo tăng nguy cơ tăng huyết áp xảy ra ở 19.5% bệnh nhân được điều trị kết hợp với chất ức chế BRAF/MEK và 14% những người đơn trị liệu bằng thuốc ức chế BRAF. Tăng huyết áp liên quan đến chất ức chế BRAF/MEK có thể do hậu quả giảm sinh khả dụng của NO. Thuốc ức chế BRAF và MEK có liên quan đến việc tăng biểu hiện của cụm biệt hóa số 47 của tế bào ung thư trong ống nghiệm. Cụm biệt hóa số 47 ức chế NO/ tín hiệu cGMP thông qua Thrombospondin-1, dẫn đến giảm sinh khả dụng NO dẫn đến co mạch và tăng huyết áp9.
3. Nhóm (thuốc) ức chế TKi Bruton
Bruton TKIs được sử dụng trong điều trị lymphoma mạn dòng bạch cầu và lymphoma tế bào áo nang. Ibrutinib có nhiều tác động trong tiền tăng huyết áp. Trong một nghiên cứu 562 bệnh nhân, điều trị bằng ibrutinib có liên quan đến khởi phát tăng huyết áp ở 71% bệnh nhân có huyết áp ban đầu bình thường và tăng huyết áp trầm trọng hơn ở 83% có tăng huyết áp trước đó. Một phân tích tổng hợp bao gồm 2,580 người cho thấy nguy cơ tăng huyết áp tăng gấp 2.8 lần ở bệnh nhân điều trị bằng ibrutinib. Cả tăng huyết áp và Bruton TKIs đều làm tăng nguy cơ rung nhĩ, tác động tăng huyết áp của những thuốc này càng làm nguy cơ rung nhĩ tăng thêm. Bệnh nhân thường được điều trị bằng Bruton TKIs trong nhiều năm nên nguy cơ tăng huyết áp sẽ tồn tại trong suốt quá trình đó. Các cơ chế của tăng huyết áp liên quan đến Bruton TKIs vẫn chưa rõ ràng, nhưng có thể liên quan đến sự giảm tín hiệu sốc nhiệt của protein số 70 và ức chế sản xuất NO phụ thuộc phosphatidylinositol 3-kinase5.
4. Thụ thể tái cấu trúc di truyền – TKIs
Thụ thể tái cấu trúc di truyền – TKIs được chỉ định điều trị ung thư phổi không phải tế bào nhỏ và ung thư tuyến giáp có đột biến ở thụ thể tái cấu di truyền trên gen tiền ung thư. Trong một nghiên cứu trên 162 bệnh nhân ung thư tuyến giáp được điều trị bằng selpercatinib, 43% đã tiến triển tăng huyết áp và 21% có huyết áp >160/100 mmHg. Trong nghiên cứu ngẫu nhiên có đối chứng ARROW (Giai đoạn 1 nghiên cứu về thuốc ức chế RET có tính chọn lọc cao, Pralsetinib [BLU-667], ở những người tham gia mắc bệnh ung thư tuyến giáp, ung thư phổi không phải tế bào nhỏ và các khối u đông đặc tiến triển khác), 21% những người được điều trị bằng pralsetinib tiến triển tăng huyết áp. Các cơ chế gây tăng huyết áp dưới ảnh hưởng của thụ thể tái cấu trúc di truyền– TKIs vẫn chưa biết rõ10,11.
5. Poly (ADP-ribose) polymerase inhibitors: nhóm thuốc ức chế PARP
Các chất ức chế polymerase poly (ADP-ribose) được sử dụng trong điều trị ung thư vú (BRCA) và buồng trứng kèm ung thư vú có đột biến. Trong nhóm thuốc này, chỉ có niraparib có liên quan với tác dụng tăng huyết áp. Trong nghiên cứu ngẫu nhiên có đối chứng NOVA (Liệu pháp duy trì Niraparib trong bệnh ung thư buồng trứng tái phát nhạy cảm với platinum)‚ 19% bệnh nhân được điều trị bằng niraparib bị tăng huyết áp so với với 5% bệnh nhân dùng giả dược. Thời gian gần đây, nghiên cứu ngẫu nhiên có đối chứng NORA (Một nghiên cứu duy trì với Niraparib so với giả dược ở bệnh nhân ung thư buồng trứng nhạy cảm với platinum), tăng huyết áp xảy ra ở 11% bệnh nhân được điều trị bằng niraparib so với chỉ 1% bệnh nhân nhận dùng giả dược. Khi dùng niraparib kết hợp với VSPI bevacizumab để điều trị ung thư buồng trứng, tăng huyết áp xảy ra ở 56% bệnh nhân. Cơ chế tăng huyết áp do niraparib gây ra vẫn chưa rõ ràng12.
6. Nhóm thuốc ức chế Proteasome
Các chất ức chế proteasome (bortezomib, carfilzomib và ixazomib) đã trở thành nền tảng của điều trị bệnh đa u tủy. Các biến cố bất lợi về tim mạch xảy ra với tất cả các chất ức chế proteasome nhưng chủ yếu liên quan đến carfilzomib. Trong thử nghiệm ENDEAVOR (Carfilzomib và Dexamethasone so với Bortezomib và Dexamethasone cho bệnh nhân tái phát hoặc u tủy kháng trị), tăng huyết áp tiến triển ở 32% bệnh nhân dùng carfilzomib so với 10% dùng bortezomib. Trong một nghiên cứu tiến cứu trên 70 bệnh nhân mắc bệnh đa u tủy được điều trị bằng carfilzomib, 33% đã tiến triển các biến cố tim mạch bất lợi, 91% trong số họ bị tăng huyết áp không kiểm soát được. Tăng huyết áp thường hồi phục sau ngừng sử dụng các thuốc này.
Chất ức chế Proteasome làm trung gian cho stress oxy hóa bằng cách tăng sản xuất các gốc oxy hóa hoạt động và ngăn chặn các con đường chống oxy hóa. Bằng cách gắn với lõi phân giải protein 20S của proteasome và làm ức chế hoạt động xúc tác của nó, ức chế proteasome sẽ dẫn đến sự tích lũy nội bào của các protein tổng hợp có thể gây độc cho các tế bào ác tính. Điều này cũng có tác dụng phụ ảnh hưởng đến tim mạch, bao gồm rối loạn chức năng nội mô và giảm sinh khả dụng NO. Mạch máu khi đã có sẵn các yếu tố nguy cơ thì liệu pháp chống ung thư liên quan đến stress oxy hóa làm cho mạch máu dễ bị tổn thương hơn bởi những tác dụng phụ này13,14.
7. Nhóm hóa trị platinum
Các hợp chất gốc bạch kim (cisplatin, carboplatin, oxaliplatin) được sử dụng để điều trị ung thư tinh hoàn, bàng quang, phụ khoa, vú, đại trực tràng và phổi, cũng như ung thư trung biểu mô. Tác dụng chống ung thư của chúng là nhờ bạch kim hấp thụ DNA dẫn đến chết tế bào theo chương trình. Tăng huyết áp có liên quan đến việc tiếp xúc với các hợp chất có gốc bạch kim nhưng có xu hướng xảy ra tác dụng muộn, có thể xảy ra nhiều năm sau khi điều trị ung thư. Hóa trị liệu dựa trên bạch kim có liên quan đến khả năng sống sót lâu dài cho bệnh nhân ung thư tinh hoàn, bệnh ung thư phổ biến nhất ở nam giới trẻ tuổi. Trong một nghiên cứu của những người sống sót sau ung thư tinh hoàn có thời gian theo dõi trung bình là 11 năm, tăng huyết áp được quan sát thấy ở 53% số người được điều trị bằng cisplatin và tần suất cao gấp 2.3 lần hơn ở nhóm chứng khỏe mạnh.
Cisplatin huyết thanh được phát hiện ngay cả sau 13 năm tiếp xúc với thuốc và điều này có thể là nguyên nhân cho tổn thương và rối loạn chức năng nội mô mạn tính. Tăng nồng độ bạch kim huyết thanh có liên quan đến tăng nguy cơ tăng huyết áp. Ống lượn gần cầu thận là nơi chủ yếu bị tổn thương do cisplatin và cisplatin tích tụ trong thận có thể đạt mức cao gấp 5 lần so với nồng độ trong huyết thanh. Độc tính trên thận của cisplatin phụ thuộc liều và được cho là do ty thể của tế bào bị tổn thương, stress oxy hóa, chết theo chương trình và giảm sinh khả dụng của NO15,16.
8. Nhóm hóa trị alkyl
Các chất chống ung thư kiềm hóa như busulfan, ifosfamide và cyclophosphamide được sử dụng trong điều trị ung thư máu và tạng đặc. Đây là những tác nhân hóa trị liệu cổ điển có liên quan đến tăng huyết áp. Tuy nhiên, việc sử dụng đồng thời glucocorticoid có thể là một yếu tố gây nhiễu trong những quan sát này.
Busulfan được sử dụng chủ yếu như một phần của chế độ ổn định trước khi cấy ghép cho cả trẻ em và người lớn trong các bệnh ung thư máu. Tăng huyết áp đã được ghi nhận ở 36% người trưởng thành và ở tới 58% trẻ em được điều trị bằng busulfan. Tỷ lệ tăng huyết áp sau khi dùng ifosfamide được báo cáo là 15% sau 5 năm theo dõi ở nghiên cứu sống sót sau ung thư ở trẻ em.
Ở những bệnh nhân ung thư vú được điều trị bằng cyclophosphamide, nồng độ VEGF giảm đã được chứng minh là có liên quan đến rối loạn chức năng nội mô. Điều này có thể giải thích một phần sự tiến triển tăng huyết áp ở bệnh nhân dùng cyclophosphamide. Ngoài ra, độc tính trực tiếp trên mạch máu và độc tính trên thận có thể góp phần lên tác dụng tăng huyết áp của các thuốc này3.
9. Thuốc ức chế calcineurin
Thuốc ức chế calcineurin như tacrolimus và cyclosporin thường được dùng đồng thời với thuốc ung thư khác, chủ yếu sau khi ghép tế bào gốc tạo máu để ngăn ngừa hoặc điều trị chống thải ghép. Chất ức chế calcineurin góp phần vào sự tiến triển tăng huyết áp hoặc làm cho tình trạng huyết áp xấu đi ở bệnh nhân có tiền sử tăng huyết áp. Ở những bệnh nhân trải qua ghép tủy xương, tỷ lệ chẩn đoán tăng huyết áp tăng thêm từ 30% đến 60% sau khi cyclosporin trở thành phương pháp điều trị chính. Thuốc ức chế calcineurin gây co mạch diện rộng, kích hoạt hệ renin-angiotensin-aldosterone, stress oxy hóa và tăng sản xuất endothelin-1 và tăng hoạt giao cảm. Ngoài ra, chúng còn ức chế tổng hợp NO và giãn mạch qua trung gian NO17.
10. Nhóm ức chế mTOR
Chất ức chế mTOR (bao gồm everolimus và sirolimus) là những lựa chọn điều trị hàng hai trong ung thư tế bào thận. Trong một RCT bao gồm các bệnh nhân ung thư tế bào thận di căn, everolimus có liên quan tới 10% tỉ lệ mắc mới của tăng huyết áp. Ở các nghiên cứu trong ống nghiệm, phần lớn các dòng tế bào ung thư cho thấy sự giảm tiết VEGF khi có mặt chất ức chế mTOR. Do đó, chất ức chế mTOR có thể có tác dụng tăng huyết áp tương tự như VSPIs. Sự kết hợp của everolimus với thuốc VSPI lenvatinib có liên quan đến tăng huyết áp ở 41% bệnh nhân và mức độ tăng huyết áp cao hơn 14% so với dùng riêng từng loại thuốc5,18.
11. Liệu pháp nội tiết (kháng androgen /nhóm ức chế Aromatase hay nhóm AI – )
Tỷ lệ sống sót ở bệnh nhân ung thư tuyến tiền liệt di căn được cải thiện nhờ liệu pháp điều trị thiếu hụt androgen. Những thuốc ngăn chặn tác dụng dinh dưỡng của androgen trên tế bào ung thư tuyến tiền liệt. Chất đối vận với hormon giải phóng Gonadotropin ức chế trực tiếp việc sản xuất và truyền tín hiệu của androgen và có liên quan đến các tác dụng phụ có hại cho tim mạch, bao gồm tăng lipid máu, giảm độ nhạy cảm insulin và béo phì. Cả hai chất abiraterone (chất ức chế tổng hợp androgen) và enzalutamide (một chất đối kháng thụ thể androgen) đều liên quan đến tăng huyết áp. Abiraterone ức chế sản xuất testosterone thông qua sự ức chế enzyme cytochrome P450 dẫn đến tích tụ tiền chất mineralocorticoid. Tác dụng này góp phần trong tiền tăng huyết áp. Còn các cơ chế gây tăng huyết áp do enzalutamide vẫn chưa rõ ràng.
Tác dụng độc tim mạch của abiraterone và enzalutamide được đánh giá trong phân tích tổng hợp 8,660 bệnh nhân bị ung thư tuyến tiền liệt. Tăng huyết áp mọi mức độ và tăng huyết áp mức độ cao thường xuyên hơn trong nhóm abiraterone (lần lượt là 26% và 7%) so với nhóm giả dược (lần lượt là 15% và 4%). Kết quả tương tự đã được báo cáo với enzalutamide (tương ứng là 11% và 5%) so với giả dược (4% và 2%). Tỷ lệ tăng huyết áp này xảy ra bất kể việc sử dụng corticosteroid (hay được dùng đồng thời).
Các chất ức chế aromatase, bao gồm các chất không steroid (anastrozole và letrozole) và steroid (exemestane), làm giảm tỷ lệ tử vong liên quan đến ung thư vú ở phụ nữ sau mãn kinh có ung thư vú estrogen dương. Mối liên quan giữa chất ức chế aromatase và nguy cơ tim mạch đang còn tranh cãi, với một số nghiên cứu xác định tăng nguy cơ tăng huyết áp và tăng tỷ lệ tử vong liên quan đến tim mạch3,5.
12. Liệu pháp bổ trợ được sử dụng trong điều trị ung thư
Ngoài các tác dụng về huyết áp liên quan đến các loại thuốc chống ung thư được nêu ở trên, còn nhiều thuốc khác kê đơn cho bệnh nhân ung thư có thể góp phần vào tác dụng phụ không mong muốn của huyết áp. Corticosteroid thường là thành phần của các phác đồ điều trị ung thư hiện đại và thường được sử dụng trong chăm sóc hỗ trợ. Corticosteroid có thể gây tăng huyết áp đáng kể, cả khi sử dụng riêng lẻ và phối với các thuốc có tác dụng tăng huyết áp khác. Tương tự, erythropoietin ngoại sinh và thuốc chống viêm không steroid cũng là các chất thường gây tăng huyết áp5.
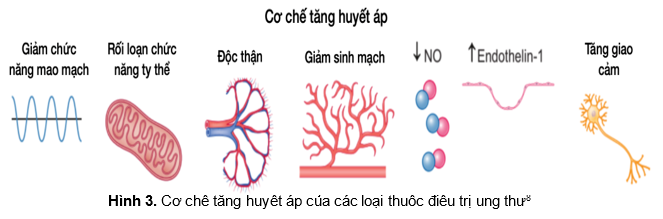
Tóm tắt cơ chế THA của các thuốc điều trị ung thư nêu ở hình 3
CHẨN ĐOÁN VÀ ĐIỀU TRỊ TĂNG HUYẾT ÁP DO ĐIỀU TRỊ UNG THƯ
Chẩn đoán tăng huyết áp do điều trị ung thư
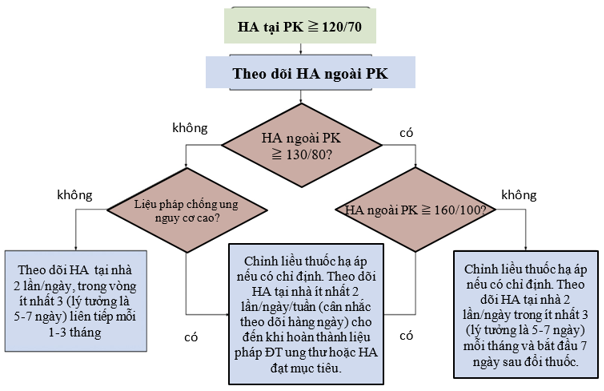
Hình 4 Tiếp cận theo dõi huyết áp tại nhà ở BN ung thư và sau ung thư21
Đo huyết áp chính xác là rất quan trọng đối với chẩn đoán và quản lý bệnh tăng huyết áp và cần đặc biệt chú ý kiểm soát tối ưu tình trạng lo lắng và đau ở bệnh nhân. Nói chung, khi đo bệnh nhân nên ngồi yên lặng trong 3 đến 5 phút trước khi thực hiện bất kỳ lần đo nào; không có dấu hiệu bí tiểu, tránh gắng sức, bàng quang của bệnh nhân phải trống và tránh gắng sức, dùng caffeine và hút thuốc trước đó 30 phút. Cần tuân thủ quy trình đo huyết áp gống như các hướng dẫn hiện hành. Tăng huyết áp nên được xác minh ít nhất 1 lần trước khi chẩn đoán tăng huyết áp. Holter huyết áp 24h được khuyến khích để xác nhận sau kết quả ban đầu có huyết áp tăng cao nhưng không phải lúc nào cũng khả thi. Theo dõi huyết áp tại nhà (tự theo dõi huyết áp) với máy đo chuẩn được sử dụng trong các tình huống cần đo huyết áp thường xuyên trong khoảng thời gian dài hơn, ví dụ, trong khi bắt đầu điều trị hoặc chỉnh liều ở bệnh nhân dùng VSPI, khi đó tình trạng tăng huyết áp trầm trọng hơn thường xảy ra trong vài ngày và có thể tiến triển đến tăng huyết áp cấp cứu. Đo mức huyết áp nền trước khi bắt đầu điều trị các thuốc chống ung thư gây tăng huyết áp là bắt buộc vì một số bệnh nhân có thể biểu hiện huyết áp tăng đáng chú ý khi sử dụng các thuốc này, đòi hỏi phải khởi trị hoặc tăng dần liều thuốc hạ áp19,20. Tiếp cận bệnh nhân tăng HA nêu ở hình 4
Mục tiêu huyết áp
Bệnh nhân ung thư thường ít được quan tâm hoặc được loại ra khỏi các RCT chính về tim mạch hoặc tăng huyết áp. RCT là cần thiết để xác định mục tiêu huyết áp trong bối cảnh đang dùng các liệu pháp chống ung thư cụ thể hoặc ở bệnh nhân ung thư nói chung. Xác định mục tiêu huyết áp để điều trị và chẩn đoán ở bệnh nhân ung thư là một điều quan trọng nhưng chưa được đáp ứng nhu cầu hiện tại. Định nghĩa tăng huyết áp khác nhau giữa các hướng dẫn (Bảng 1). Theo Hướng dẫn tăng huyết áp trên thực hành lâm sàng của trường môn tim mạch Mỹ 2017/Hiệp hội tim mạch Mỹ, tăng huyết áp được phân loại là bình thường, bình thường cao hoặc tăng huyết áp giai đoạn 1, giai đoạn 2. Huyết áp bình thường được định nghĩa là <120/<80 mmHg; bình thường cao từ 120 đến 129/<80 mmHg; tăng huyết áp giai đoạn 1 là huyết áp tâm thu 130 đến 139 mmHg hoặc huyết áp tâm trương 80 đến 89 mmHg và tăng huyết áp giai đoạn 2 là ≥140 hoặc ≥90 mmHg. Đối với bệnh nhân có nguy cơ mắc bệnh tim mạch xơ vữa 10 năm ≥10% hoặc bệnh đi kèm như bệnh thận mạn và đái tháo đường, thì nên bắt đầu điều trị từ giai đoạn 1 của tăng huyết áp. Đối với những trường hợp khác, nên bắt đầu điều trị ở giai đoạn 2. Huyết áp mục tiêu là <130/80 mmHg cho tất cả các trường hợp. Cho đến nay, không có hướng dẫn cụ thể về tăng huyết áp cho bệnh nhân bị ung thư, mặc dù Hiệp hội Tim mạch-Ung thư Quốc tế gần đây đã công bố một đồng thuận về định nghĩa tăng huyết áp trong bệnh ung thư, điều đó thể hiện nỗ lực đa ngành. Ngưỡng điều trị được xác định trong khuyến nghị của trường môn tim mạch Mỹ 2017/Hiệp hội tim mạch Mỹ và mục tiêu điều trị phù hợp theo từng ngưỡng điều trị. Ngưỡng khuyến cáo từ chối điều trị ung thư là huyết áp tâm thu ≥180 mmHg hoặc huyết áp tâm trương ≥110 mmHg, tương tự như định nghĩa cơn tăng huyết áp ở Hướng dẫn thực hành lâm sàng trong tăng huyết áp của trường môn tim mạch Mỹ 2017/Hiệp hội tim mạch Mỹ (huyết áp tâm thu ≥180 mmHg và huyết áp tâm trương ≥120 mmHg). Chỉ dẫn điều trị tóm tắt ở hình 5-63,20-25
Quản lý tăng huyết áp do điều trị ung thư

Hình 5. Những khuyến cáo trong thực hành về chẩn đoán và quản lý bệnh tăng huyết áp trước, trong và sau khi bắt đầu điều trị ung thư3.
Thuốc hạ huyết áp
Ở những bệnh nhân tăng huyết áp, điều trị hạ huyết áp nên được tối ưu hóa trước khi bắt đầu dùng thuốc chống ung thư, tốt nhất là với sự tham gia đa ngành từ nhóm chăm sóc tim mạch-ung thư (Hình 4). Bệnh nhân nên được được tư vấn về khả năng có thể lên thang điều trị hạ áp nếu kế hoạch điều trị ung thư có khả năng gây tăng huyết áp. Hiện tại không có đủ bằng chứng hỗ trợ chiến lược dùng thuốc hạ huyết áp đặc thù cho bệnh nhân tăng huyết áp do điều trị ung thư. Vì vậy, việc điều trị hạ huyết áp nên tuân theo các hướng dẫn hiện hành cho dân số chung. Liệu pháp đầu tay nên bao gồm thuốc chẹn thụ thể angiotensin hoặc thuốc ức chế men chuyển angiotensin, thuốc chẹn kênh canxi dihydropyridine, hoặc thuốc lợi tiểu thiazide hoặc thiazide-like. Ngoài ra, việc lựa chọn thuốc hạ áp nên dựa trên các yếu tố nguy cơ của từng bệnh nhân. Ví dụ, bệnh nhân có protein niệu nên được điều trị bằng thuốc ức chế thụ thể angiotensin hoặc thuốc ức chế men chuyển; những người có nguy cơ cao giảm thể tích nên tránh sử dụng thuốc lợi tiểu. Cũng như trong dân số chung, thuốc đối kháng thụ thể mineralocorticoid nên là thuốc được lựa chọn đầu tay để điều trị tăng huyết áp kháng trị trừ khi có chống chỉ định như tăng kali máu. Không nên sử dụng thuốc chẹn beta như điều trị hạ huyết áp hàng đầu và nên dành riêng dành cho những bệnh nhân có chỉ định cụ thể (ví dụ: rung nhĩ, nhồi máu cơ tim gần đây, suy tim với phân suất tống máu giảm), những người đã được tối ưu hóa thuốc hạ huyết áp đầu tay hoặc những người có chống chỉ định thuốc hạ huyết áp đầu tay. Thuốc chẹn kênh canxi nondihydropyridine (ví dụ diltiazem, verapamil) nên được sử dụng thận trọng ở nhóm bệnh nhân này vì các thuốc hạ huyết áp này dễ tương tác với một số liệu pháp chống ung thư được chuyển hóa bởi P-glycoprotein và cytochrome P450 3A4. Lưu ý tương tác giữa thuốc điều trị hạ áp và ung thư (bảng 2)21-25 hạ huyết áp đầu tay hoặc những người có chống chỉ định thuốc hạ huyết áp đầu tay. Thuốc chẹn kênh canxi nondihydropyridine (ví dụ diltiazem, verapamil) nên được sử dụng thận trọng ở nhóm bệnh nhân này vì các thuốc hạ huyết áp này dễ tương tác với một số liệu pháp chống ung thư được chuyển hóa bởi P-glycoprotein và cytochrome P450 3A4. Lưu ý tương tác giữa thuốc điều trị hạ áp và ung thư (bảng 2)21-25
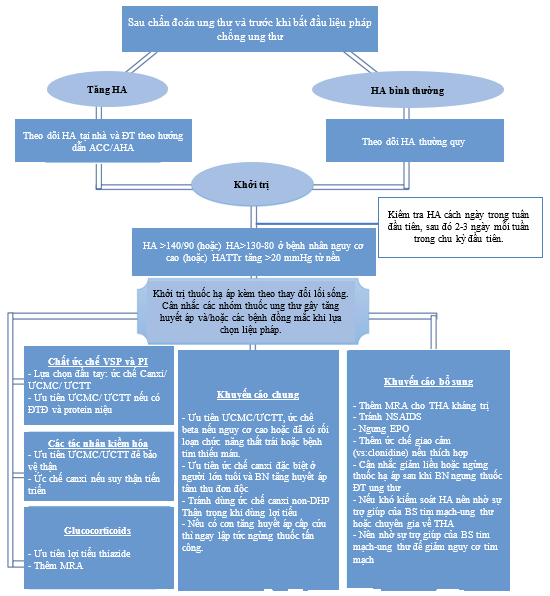
Hình 6. Lưu đồ tiếp cận và quản lý THA mới chẩn đoán ở BN ung thư22.
HA: huyết áp; VSP: con đường tín hiệu VEGF; PI: chất ức chế proteasome; DHP: dihrydropyridine; ƯCMC: ức chế men chuyển; U7CTT: ức chế thụ thể; MRA: chất đối kháng thụ thể mineralocorticoid; NSAID: kháng viêm non-steroid; EPO: erythropoein
Bảng 2. Các tương tác thuốc thường gặp với thuốc hạ áp 25
| Các nhóm thuốc hạ áp | Tương tác phổ biến với thuốc ĐT ung thư |
| Thuốc chẹn beta | – Nồng độ Metoprolol có thể tăng do các thuốc ức chế tyrosine kinase (TKIs) như imatinib và gefitinib.
– Các TKIs như ceritinib và crizotinib có thể gây nhịp tim chậm khi dùng chung với tất cả các thuốc chẹn beta. – Nguy cơ kéo dài QTc khi dùng chung thuốc chẹn beta với tất cả các TKIs kéo dài QT. – Carvedilol tương tác với afatinib và venetoclax, nên tránh dùng chung. |
| Thuốc chẹn kênh canxi | – Tránh dùng chung với các thuốc ức chế CYP3A như diltiazem, verapamil, và felodipine vì làm tăng nồng độ các TKIs.
– Verapamil làm giảm bài tiết doxorubicin, paclitaxel và irinotecan, gây ra nhiều độc tính cho tim từ các thuốc này. – Felodipine làm trầm trọng thêm tình trạng tăng huyết áp với sorafenib thông qua CYP3A4. – Tránh dùng amlodipine với idealisib, vì làm tăng nồng độ amlodipine. – Tránh dùng amlodipine trong các trường hợp gây độc gan liên quan đến TKIs |
| Thuốc ức chế men chuyển | – Nguy cơ cao gây phù mạch khi dùng chung với thuốc ức chế mTOR |
| Thuốc lợi tiểu thiazide | – Có thể làm tăng tác dụng ức chế tủy xương của phác đồ CMF (Cyclophosphamide, Fluorouracil, và Methotrexate.) |
| Thuốc lợi tiểu quai | – Có thể làm tăng độc tính trên thận và tai liên quan đến cisplatin.
– Có thể gây mất cân bằng điện giải, làm kéo dài QT khi dùng chung với các TKIs. – Furosemide làm tăng độc tính của methotrexate. |
| Thuốc lợi tiểu giữ kali | – Dùng đồng thời các thuốc đối kháng thụ thể mineralocorticoid như spironolactone và eplerenone với một số thuốc kháng androgen như abiraterone acetate có thể liên quan đến tiến triển ung thư tuyến tiền liệt. |
Thay đổi lối sống
Bệnh nhân nên được tư vấn sự quan trọng của việc thay đổi lối sống có thể giúp cải thiện kiểm soát huyết áp, bao gồm hạn chế lượng natri nạp vào (có cân nhắc nguy cơ giảm thể tích nội mạch), hạn chế sử dụng thuốc chống viêm không steroid, caffeine, hạn chế sử dụng rượu và tăng cường hoạt động thể chất và tăng lượng kali. Khi đánh giá tình trạng huyết áp trong liệu trình điều trị ung thư, bác sĩ lâm sàng cần nhìn nhận vai trò tiềm tàng của việc kiểm soát cơn đau không đầy đủ và các liệu pháp bổ trợ có thể làm trầm trọng thêm tình trạng tăng huyết áp như thuốc erythropoietin và corticosteroid. Đánh giá các bệnh đi kèm có thể làm tăng huyết áp (ví dụ, ngưng thở khi ngủ) cũng rất quan trọng21-24.
Quản lý lâu dài tăng huyết áp do điều trị ung thư ở những người sống sót sau ung thư
Sau khi hoàn thành điều trị ung thư với các thuốc làm tăng huyết áp đã biết, bệnh nhân có thể cần giảm điều trị hạ áp để tránh hạ huyết áp dội ngược và biến cố thiếu máu cục bộ. Ở những bệnh nhân điều trị chống ung thư đòi hỏi từ đầu phải lên thang đáng kể liệu pháp hạ áp, có thể cần vài ngày để giảm liều thuốc hạ áp trước khi ngừng điều trị ung thư và nên theo dõi huyết áp tại nhà hàng ngày. Về lâu dài, tỷ lệ tăng huyết áp ở những người sống sót sau ung thư cao hơn so với dân số nói chung. Do đó, những người này có khả năng được hưởng lợi từ việc theo dõi chặt chẽ tiến triển của bệnh tăng huyết áp so với dân số chung, bao gồm theo dõi huyết áp tại phòng khám kết hợp tại nhà. Tương tự với bệnh nhân đang điều trị chống ung thư giai đoạn hoạt động thì không có đủ bằng chứng về cách tiếp cận cụ thể hoặc mục tiêu để quản lý tăng huyết áp ở những người sống sót sau ung thư. Vì thế, những bệnh nhân này nên được điều trị theo phác đồ hiện hành với bằng chứng tốt nhất cho dân số chung21-24.
TÓM TẮT (hình 7)
- Nhiều loại thuốc chống ung thư có độc tính trên tim mạch, bao gồm cả tăng huyết áp.
- Tăng huyết do điều trị ung thư, đặc biệt là do VSPI và chất ức chế proteasome gây ra, thường hồi phục sau khi ngừng sử dụng các thuốc này.
- Nhiều loại thuốc chống ung thư có thể làm xấu đi việc kiểm soát huyết áp ở bệnh nhân đã bị tăng huyết áp.
- Kiểm soát huyết áp là quan trọng trong giai đoạn trước, trong và sau khi hoàn thành điều trị ung thư.
- Nên theo dõi huyết áp ít nhất là hàng tuần trong 4 đến 8 tuần đầu tiên đối với bệnh nhân đang dùng thuốc điều trị ung thư gây tăng huyết áp và khi ngừng sử dụng các thuốc này hoặc có nguy cơ rõ rệt về tình trạng huyết áp không ổn định; việc duy trì các chỉ số và liều lượng thuốc hạ huyết áp không điển hình có thể cần thiết.
- Khuyến khích theo dõi huyết áp tại nhà.
- Những người sống sót sau ung thư có nguy cơ cao bị các biến chứng liên quan đến tăng huyết áp như rung nhĩ, suy tim và bệnh thận mạn tính, đòi hỏi một cách tiếp cận đa ngành để quản lý tối ưu.

Hình 7. Quản lý tăng huyết áp ở bệnh nhân ung thư8
YTNC-yếu tố nguy cơ; HA-huyết áp; OSA: ngưng thở khi ngủ; ĐTĐ-đái tháo đường
TÀI LIỆU THAM KHẢO
- GBD 2019 Diseases and Injuries Collaborators. Global burden of 369 diseases and injuries in 204 countries and territories, 1990–2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet. 2020; 396:1204–1222. doi: 10.1016/S0140-6736(20)30925-9
- NCD Risk Factor Collaboration (NCD-RisC). Worldwide trends in hypertension prevalence and progress in treatment and control from 1990 to 2019: a pooled analysis of 1201 population-representative studies with 104 million participants. Lancet. 2021; 398:957–980. doi: 10.1016/
S0140-6736(21)01330-1 - Jordana B. Cohen et al. AHA SCIENTIFIC STATEMENT Cancer Therapy–Related Hypertension: A Scientific Statement From the American Heart Association. 2023;80:e46–e57
- Wang et al. Association between use of antihypertensive drugs and the risk of cancer: a population-based cohort study in Shanghai. BMC Cancer (2023) 23: https://doi.org/10.1186/s12885-023-10849-8.
- van Dorst DCH et al. Hypertension and prohypertensive antineoplastic therapies in cancer patients. Circ Res. 2021; 128:1040–1061. doi: 10.1161/CIRCRESAHA.121.318051
- Koene RJ, Prizment AE, Blaes A, Konety SH. Shared risk factors in cardiovascular disease and cancer. 2016;133:1104–1114. doi: 10.1161/CIRCULATIONAHA.115.020406
- Sturgeon KM, et al. A population-based study of cardiovascular disease mortality risk in US cancer patients. Eur Heart J. 2019; 40:3889–3897. doi:1093/eurheartj/ehz766
- Pandey.S et al. Management of hypertension in patients with cancer: challenges and considerations. Clinical Kidney Journal, Volume 16, Issue 12, December 2023, Pages 2336–2348, https://doi.org/10.1093/ckj/sfad195
- Dickerson T, et al. Hypertension and incident cardiovascular events following ibrutinib initiation. 2019;134:1919–1928. doi: 10.1182/blood.2019000840
- Wirth LJ et al. Efficacy of selpercatinib in RET-altered thyroid cancers. N Engl J Med. 2020; 383:825– doi: 10.1056/NEJMoa2005651
- Gainor JF et al. Pralsetinib for RET fusion-positive non-small-cell lung cancer (ARROW): a multi-cohort, open-label, phase 1/2 study. Lancet Oncol. 2021; 22:959– doi:
10.1016/S1470-2045(21)00247-3 - Ison G et al. FDA approval summary: niraparib for the maintenance treatment of patients with recurrent ovarian cancer in response to platinum-based chemotherapy. Clin Cancer Res.
2018; 24:4066– doi: 10.1158/1078-0432.CCR-18-0042 - Bruno G et al. Cardiovascular organ damage and blood pressure levels predict adverse events in multiple myeloma patients undergoing carfilzomib therapy. Cancers (Basel). 2019;11:E622. doi:
3390/cancers11050622 - Wei Q, Xia Y. Proteasome inhibition down-regulates endothelial nitricoxide synthase phosphorylation and function. J Biol Chem. 2006; 281:21652–21659. doi: 10.1074/jbc.M602105200
- Boer H et al. Long-term exposure to circulating platinum is associated with late effects of treatment in testicular cancer survivors. Ann Oncol. 2015; 26:2305– doi: 10.1093/annonc/mdv369
- Choi YM et al. Mechanism of cisplatin-induced cytotoxicity is correlated to impaired metabolism due to mitochondrial ROS generation. PLoS One. 2015; 10: doi: 10.1371/journal.pone.0135083
- Hošková L et al. Pathophysiological mechanisms of calcineurin inhibitor-induced nephrotoxicity and arterial hypertension. Physiol Res. 2017;66:167– doi: 10.33549/physiolres.933332
- Motzer RJ et al. Lenvatinib, everolimus, and the combination in patients with metastatic renal cell carcinoma: a randomised, phase 2, open-label, multicentre trial. Lancet Oncol. 2015; 16:1473–1482.
doi: 10.1016/S1470-2045(15)00290-9 - Herrmann J et al. Defining cardiovascular toxicities of cancer therapies: an International Cardio-Oncology Society (IC-OS) consensus statement. Eur Heart J. 2022; 43:280– doi: 10.1093/eurheartj/ehab674
- Whelton PK et al. 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ASH/ASPC/
NMA/PCNA guideline for the prevention, detection, evaluation, and management of high blood pressure in adults: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines [published correction appears in Hypertension. 2018;71:e140–e144]. 2018; 71: e13–e115. doi: 10.1161/HYP.0000000000000065 - Cohen et al. Hypertension in Cancer Patients and Survivors Epidemiology, Diagnosis, and Management. J Am Coll Cardiol CardioOnc 2019;1:238–51
- Mohammed.T et al. Etiology and management of hypertension in patients with cancer. Cardio-Oncology (2021) 7:14. https://doi.org/10.1186/s40959-021-00101-2
- Lyon. AR, Fernández. TR et al. 2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS). European Heart Journal (2022) 43, 4229–4361
- JW, McCarthy. CP et al. 2024 ESC Guidelines for the management of elevated blood pressure and hypertension. European Heart Journal (2024) 00, 1–107. https://doi.org/10.1093/eurheartj/ehae178
- G. Onco-Hypertension: Changing Paradigm of Treating Hypertension in Patients With Cancer. Journal of Clinical Oncology. 2022. DOI https://doi.org/10.1200/JCO.22. 01875







