Trưởng ban: PGS.TS PHẠM NGUYỄN VINH
Đồng trưởng ban: TS.BS NGUYỄN THỊ THU HOÀI
(…)
4.4 Chụp cắt lớp điện toán tim
| Loại | MCC | Khuyến cáo về chụp cắt lớp điện toán tim ở bệnh nhân bị bệnh cơ tim phì đại |
| 2b | C-LD | 1. Đối với bệnh nhân người lớn nghi ngờ bệnh cơ tim phì đại, có thể xem xét chụp cắt lớp điện toán tim để chẩn đoán nếu siêu âm tim chưa đủ để chẩn đoán và chụp cộng hưởng từ tim không khả dụng. |
Chụp cắt lớp điện toán tim có độ phân giải rất cao cho phép đánh giá rõ nét cấu trúc thất trái (bao gồm dạng phì đại, đo độ dầy thành thất trái, phát hiện màng dưới van động mạch chủ và huyết khối trong các buồng tim). Các nghiên cứu nhỏ cho thấy khả năng đánh giá sợi hóa cơ tim của chụp cắt lớp điện toán, mặc dù kỹ thuật này dẫn đến bệnh nhân bị phơi nhiễm tia X và cũng cần nghiên cứu chứng minh giá trị. Ngoài cấu trúc cơ tim, chụp cắt lớp điện toán tim còn đánh giá giải phẫu động mạch vành bao gồm hẹp, bất thường xuất phát các động mạch vành. Nhược điểm của chụp cắt lớp điện toán là sử dụng bức xạ ion hóa và thuốc cản quang chứa iod với độ phân giải thời gian thấp hơn siêu âm tim. Chụp cắt lớp điện toán mạch máu sẽ được bàn luận trong phần 4.6
Mặc dù ít được sử dụng, chụp cắt lớp điện toán tim có thể mang lại thông tin có giá trị khi hình ảnh siêu âm tim hạn chế và chụp cộng hưởng từ tim bị chống chỉ định hoặc không khả dụng và là một trong các phương tiện để đánh giá giải phẫu động mạch vành.
4.5 Đánh giá rối loạn nhịp
| Loại | MCC | Khuyến cáo về đánh giá rối loạn nhịp |
| 1 | B-NR | 1. Đối với bệnh nhân bị bệnh cơ tim phì đại, khuyến cáo sử dụng điện tâm đồ 12 chuyển đạo để đánh giá ban đầu và theo dõi định kỳ (mỗi 1 – 2 năm) (Hình 1, Bảng 3). |
| 1 | B-NR | 2. Đối với bệnh nhân bị bệnh cơ tim phì đại, theo dõi điện tâm đồ lưu động 24 – 48 giờ được khuyến cáo để đánh giá ban đầu và theo dõi định kỳ (mỗi 1 – 2 năm) để xác định những bệnh nhân có nguy cơ đột tử do tim và hướng dẫn xử trí các rối loạn nhịp (Hình 1). |
| 1 | B-NR | 3. Đối với bệnh nhân bị bệnh cơ tim phì đại xuất hiện hồi hộp đánh trống ngực hoặc cảm giác lâng lâng, khuyến cáo theo dõi điện tâm đồ trên 24 giờ hoặc dùng thiết bị theo dõi biến cố, không có ý nghĩa chẩn đoán nếu bệnh nhân không có triệu chứng trong quá trình theo dõi. |
| 1 | B-NR | 4. Đối với họ hàng bậc 1 của bệnh nhân bị bệnh cơ tim phì đại, điện tâm đồ 12 chuyển đạo được khuyến cáo là một thăm dò trong quá trình sàng lọc (Hình 1, Bảng 3). |
| 2a | B-NR | 5. Đối với bệnh nhân bị bệnh cơ tim phì đại có thêm các yếu tố nguy cơ gây rung nhĩ như dãn nhĩ trái, tuổi cao, suy tim NYHA III- IV có chỉ định dùng thuốc chống đông, nên theo dõi điện tâm đồ lưu động trong thời gian dài hơn để sàng lọc rung nhĩ trong lần đánh giá đầu tiên cũng như theo dõi định kỳ (mỗi 1 – 2 năm) (Hình 1). |
| 2b | C-EO | 6. Đối với bệnh nhân bị bệnh cơ tim phì đại không có các yếu tố nguy cơ gây rung nhĩ nhưng có chỉ định dùng thuốc chống đông, có thể xem xét theo dõi điện tâm đồ lưu động trong thời gian dài hơn để phát hiện cơn rung nhĩ kịch phát không có triệu chứng trong lần đánh giá đầu tiên cũng như theo dõi định kỳ (mỗi 1 – 2 năm). |
Nội dung khuyến cáo
Điện tâm đồ 12 chuyển đạo và theo dõi điện tâm đồ lưu động là những thăm dò cần thiết đối với bệnh nhân bị bệnh cơ tim phì đại. Điện tâm đồ 12 chuyển đạo có thể cung cấp thông tin về dầy thất trái và những bất thường về tái cực cũng như các rối loạn nhịp bao gồm rối loạn nhịp nhanh và rối loạn nhịp chậm. Ngoài ra, điện tâm đồ còn cho thấy những rối loạn về dẫn truyền ngay từ lần thăm khám đầu tiên cũng như trong quá trình theo dõi người bệnh. Theo dõi điện tâm đồ lưu động rất cần thiết để đánh giá nguy cơ đột tử do tim. Nên ghi điện tâm đồ lưu động trong 24 đến 48 giờ. Theo dõi điện tâm đồ lưu động trong thời gian dài hơn hữu ích nhất khi cần xác định nguyên nhân gây ra triệu chứng hoặc chẩn đoán rung nhĩ.
- 75 – 95% bệnh nhân bị bệnh cơ tim phì đại trên kiểu hình có bất thường trên điện tâm đồ 12 chuyển đạo, ít nhất là hình ảnh dầy thất trái hoặc rối loạn về tái cực. Tuy nhiên, những bất thường này không tương quan chặt chẽ với mức độ nặng hoặc dạng phì đại cơ tim. Điện tâm đồ 12 chuyển đạo cũng rất có ích để chẩn đoán hội chứng Wolf – Parkinson – White, gợi ý một số dạng kiểu hình tương tự (phenocopy) của bệnh cơ tim phì đại. Điện tâm đồ còn giúp chẩn đoán các bệnh lý cơ tim khác như bệnh cơ tim thâm nhiễm amyloid nếu có hình ảnh điện thế thấp và chậm trễ dẫn truyền. Ngoài ra, hình ảnh giả nhồi máu cơ tim trên điện tâm đồ có thể xuất hiện trước khi có dầy thất trái trên siêu âm tim. Điện tâm đồ 12 chuyển đạo thường được sử dụng để sàng lọc bệnh cơ tim phì đại, bao gồm những thành viên trong gia đình không có dầy thất trái. Hiện nay việc sử dụng điện tâm đồ 12 chuyển đạo để sàng lọc bệnh cơ tim phì đại cho trẻ vị thành niên khỏe mạnh như một phần sàng lọc vận động viên dự bị vẫn là một vấn đề tranh luận gay gắt.
- Theo dõi điện tâm đồ lưu động (Holter ECG) để phát hiện rối loạn nhịp thất có vai trò quan trọng trong phân tầng nguy cơ cho bệnh nhân bị bệnh cơ tim phì đại. Bệnh nhân có những cơn nhịp nhanh thất không kéo dài (NSVT) có nguy cơ đột tử do tim cao hơn một cách có nghĩa. Ngày càng có nhiều bằng chứng cho thấy nhịp nhanh thất không kéo dài ở bệnh nhân bị bệnh cơ tim phì đại trẻ tuổi có giá trị tiên lượng đột tử do tim lớn hơn bệnh nhân trên 35 tuổi, cơn nhịp nhanh thất không kéo dài dài hơn và nhanh hơn đi kèm với tỷ lệ phải cấy máy phá rung cấy được lớn hơn. Ngoài ra, có bằng chứng cho thấy thời gian theo dõi điện tâm đồ lưu động dài hơn giúp chẩn đoán nhiều cơn nhịp nhanh thất không kéo dài hơn; tuy nhiên phát hiện nhịp nhanh thất không kéo dài- một yếu tố nguy cơ đột tử thường dựa trên điện tâm đồ lưu động 24 – 48h. Thời gian ghi điện tâm đồ lưu động tói ưu chưa được xác định và do đó, tại thời điểm hiện tại, nên ghi điện tâm đồ lưu động định kỳ mỗi 1 – 2 năm cho bệnh nhân bị bệnh cơ tim phì đại chưa phải cấy máy phá rung cấy được.
- Nếu bệnh nhân có triệu chứng, cần tiếp tục ghi điện tâm đồ lưu động cho bệnh nhân đến khi bệnh nhân có triệu chứng trong thời gian đeo máy. Đối với những bệnh nhân ít triệu chứng, có thể sử dụng máy theo dõi điện tâm đồ lưu động cấy dưới da hoặc thiết bị theo dõi biến cố cầm tay.
- Điện tâm đồ (12 chuyển đạo hoặc lưu động) được coi là thăm dò thường quy (standard) trong sàng lọc bước đầu đối với họ hàng của bệnh nhân bị bệnh cơ tim phì đại.
- Rung nhĩ đi kèm với các biến cố (bao gồm đột quỵ) ở bệnh nhân bị bệnh cơ tim phì đại. Mặc dù một số nghiên cứu cho thấy có tới 50% các bệnh nhân bị rung nhĩ không có triệu chứng. Chưa rõ các cơn rung nhĩ không triệu chứng, đặc biệt là cơn rung nhĩ ngắn có gây ra biến cố hay không. Các yếu tố dự báo rung nhĩ bao gồm: dãn nhĩ trái, tuổi cao, suy tim NYHA III – IV. Do đó, những bệnh nhân có các đặc điểm trên cần được đánh giá thường xuyên hơn và có thể ghi điện tâm đồ lưu động trong thời gian dài hơn.
4.6 Chụp mạch và thăm dò huyết động xâm nhập
| Loại | MCC | Khuyến cáo về chụp mạch và thăm dò huyết động xâm nhập |
| 1 | B-NR | 1. Khuyến cáo đánh giá huyết động xâm nhập trên thông tim đối với bệnh nhân bị bệnh cơ tim phì đại được lựa chọn để can thiệp / phẫu thuật làm mỏng vách liên thất và những bệnh nhân chưa rõ mức độ tắc nghẽn đường ra thất trái trên các thăm dò không xâm nhập. |
| 1 | B-NR | 2. Khuyến cáo chụp động mạch vành qua da đối với bệnh nhân bị bệnh cơ tim phì đại có triệu chứng hoặc bằng chứng thiếu máu cục bộ cơ tim. |
| 1 | B-NR | 3. Khuyến cáo chụp động mạch vành (qua da hoặc MSCT) trước phẫu thuật giải phóng tắc nghẽn đường ra thất trái đối với bệnh nhân bị bệnh cơ tim phì đại có nguy cơ bệnh mạch vành do xơ vữa. |
Nội dung khuyến cáo
Siêu âm tim vẫn là phương tiện thăm dò huyết động không xâm nhập chuẩn và đáng tin cậy trong đánh giá tắc nghẽn đường ra thất trái ở bệnh cơ tim phì đại. Vì vậy, không có lý do thuyết phục để thăm dò huyết động xâm nhập một cách thường quy ở bệnh nhân bị bệnh cơ tim phì đại tắc nghẽn cũng như chụp động mạch vành một cách thường quy ở bệnh nhân bị bệnh cơ tim phì đại nói chung. Thăm dò huyết động xâm nhập chỉ được thực hiện khi các thông tin về lâm sàng và thăm dò không xâm nhập chưa đủ để chẩn đoán hoặc các thông tin thăm dò huyết động xâm nhập có thể làm thay đổi chiến lược điều trị bệnh nhân. Do đó, chỉ một số nhóm nhỏ bệnh nhân chọn lọc được hưởng lợi từ các thăm dò này. Điều quan trọng là bác sỹ thực hiện chụp mạch hoặc thăm dò huyết động xâm nhập phải có kinh nghiệm và sử dụng các loại ống thông phù hợp để tránh các cạm bẫy như kẹt ống thông.
- Ở bệnh nhân có bệnh sử lâm sàng hoặc triệu chứng suy tim (NYHA II – IV) nhưng chưa rõ có / không có tắc nghẽn đường ra thất trái hoặc mức độ tắc nghẽn trên thăm dò hình ảnh tim mạch, thăm dò huyết động xâm nhập có thể làm rõ tình trạng tắc nghẽn đường ra thất trái lúc nghỉ (resting) hoặc tiềm tàng (latent) cũng như cung cấp các thông tin về cung lượng tim và áp lực đổ đầy thất. Những tình huống này đặt ra khi hình ảnh siêu âm tim có độ tin cậy hạn chế do hình ảnh siêu âm tim chưa rõ nét, phổ doppler không phân biệt được tăng tốc qua đường ra thất trái với hở hai lá hoặc do chênh áp qua đường ra thất trái có sự biến thiên động học lớn liên quan tới sự thay đổi nội tại về sức co bóp cơ tim, các tình trạng tiền gánh, hậu gánh tại thời điểm làm siêu âm.
Một số nghiệm pháp kích thích được sử dụng trong phòng thông tim để phát hiện tình trạng tắc nghẽn đường ra thất trái tiềm tàng bao gồm nghiệm pháp Valsalva, nghiệm pháp gây ngoại tâm thu thất để đánh giá dấu hiệu Brokenbrough – Braunwald – Morrow (tăng mạnh chênh áp qua đường ra thất trái nhưng giảm áp lực sóng mạch động mạch chủ sau nhát ngoại tâm thu), nghiệm pháp nâng cao hoặc hạ thấp chi và nghiệm pháp ngửi amyl nitrite. Có thể truyền tĩnh mạch liều thấp isoproterenol để phát hiện tắc nghẽn đường ra thất trái tiềm tàng nhưng thuốc này được sử dụng một cách hạn chế bởi các chuyên gia can thiệp tim mạch có kinh nghiệm trong đánh giá huyết động bệnh cơ tim phì đại. Dobutamine đã được sử dụng sớm hơn với mục đích này nhưng việc tăng liều dobutamine khi làm siêu âm tim gắng sức có thể tạo ra chênh áp ở bệnh nhân không bị bệnh cơ tim phì đại, dẫn tới một tỷ lệ dương tính giả có ý nghĩa.
Một bệnh cảnh lâm sàng khác cần thăm dò huyết động xâm nhập là bệnh nhân bị bệnh cơ tim phì đại tắc nghẽn kèm theo hẹp van động mạch chủ. Trong trường hợp này, cần sử dụng ống thông phù hợp (ví dụ: ống thông pigtail có lỗ tận, ống thông halo) để tránh cạm bẫy như mắc ống thông. Cần đo chênh áp qua đường ra thất trái lúc nghỉ, nếu mức độ tắc nghẽn không nặng (≥ 50 mmHg) sau khi làm các nghiệm pháp kích thích có thể giúp hướng dẫn điều trị.
- Đau ngực là triệu chứng thường gặp trong bệnh cơ tim phì đại. Cần lưu ý khả năng đồng mắc bệnh động mạch vành dưới thượng tâm mạc (epicarrdial CAD) ở bệnh nhân có yếu tố nguy cơ bệnh mạch vành do xơ vữa hoặc những bệnh nhân đau ngực không đáp ứng với điều trị nội khoa. Cần nghi ngờ bệnh động mạch vành dưới thượng tâm mạc dựa trên các thăm dò không xâm nhập mặc dù tỷ lệ dương tính giả khá cao khi làm nghiệm pháp gắng sức trên hình ảnh tim mạch hạt nhân. Chụp động mạch vành rất hữu ích ở bệnh nhân bị bệnh cơ tim phì đại nếu việc chẩn đoán xác định bệnh lý động mạch vành có thể giúp điều trị cho người bệnh.
- Chụp động mạch vành thường được tiến hành ở bệnh nhân có kế hoạch phẫu thuật giải phóng tắc nghẽn đường ra thất trái và có yếu tố nguy cơ của bệnh động mạch vành do xơ vữa. Chẩn đoán xác định bệnh lý động mạch vành có ý nghĩa sẽ thanh đổi chiến lược phẫu thuật như kết hợp bắc cầu nối chủ vành với cắt gọt cơ vách liên thất. Chụp động mạch vành cũng là một bước không thể thiếu trong can thiệp làm mỏng vách liên thất bằng cồn nhằm đánh giá giải phẫu động mạch vành vùng vách lên thất và phát hiện bệnh lý động mạch vành đồng mắc để lên kế hoạch can thiệp đồng thời.
4.7 Nghiệm pháp gắng sức
| Loại | MCC | Khuyến cáo về đánh giá rối loạn nhịp |
| 1 | B-NR | 1. Đối với bệnh nhân bị bệnh cơ tim phì đại có triệu chứng không có chênh áp qua đường ra thất trái ≥ 50 mmHg lúc nghỉ và sau nghiệm pháp kích thích trên siêu âm tim qua thành ngực, siêu âm tim gắng sức qua thành ngực được khuyến cáo để phát hiện và lượng hóa tắc nghẽn đường ra thất trái. |
| 1 | B-NR | 2. Đối với bệnh nhân bị bệnh cơ tim phì đại không tắc nghẽn và suy tim rất nặng (NHYA II – IV dù đã điều trị nội khoa tối ưu), nên tiến hành nghiệm pháp gắng sức tim phổi để lượng hóa mức độ hạn chế cơ năng của người bệnh và giúp lựa chọn bệnh nhân cần ghép tim hay đặt thiết bị hỗ trợ tuần hoàn cơ học. |
| 2a | B-NR | 3. Đối với bệnh nhân bị bệnh cơ tim phì đại, nên thực hiện nghiệm pháp gắng sức thể lực để xác định mức độ cơ năng và tiên lượng bệnh nhân trong lần đánh giá đầu tiên. |
| 2a | C-LD | 4. Đối với bệnh nhân bị bệnh cơ tim phì đại chưa có triệu chứng và không có chênh áp qua đường ra thất trái ≥ 50 mmHg lúc nghỉ và sau nghiệm pháp kích thích trên siêu âm tim qua thành ngực, nên tiến hành siêu âm tim gắng sức qua thành ngực để phát hiện và lượng hóa tắc nghẽn đường ra thất trái. |
| 2b | C-EO | 5. Nên làm nghiệm pháp gắng sức thể lực đối với bệnh nhân bị bệnh cơ tim phì đại tắc nghẽn được xem xét can thiệp hoặc phẫu thuật làm mỏng vách liên thất với tình trạng cơ năng hoặc triệu chứng không rõ ràng (Hình 1). |
| 2b | C-EO | 6. Có thể xem xét làm nghiệm pháp gắng sức thể lực mỗi 2 – 3 năm đối với bệnh nhân bị bệnh cơ tim phì đại có tình trạng cơ năng hoặc triệu chứng không rõ ràng (Hình 1). |
Nội dung khuyến cáo
Bằng chứng cho thấy nghiệm pháp gắng sức thể lực đặc biệt khi cùng lúc kết hợp phân tích khí thở (ví dụ: nghiệm pháp gắng sức tim phổi) an toàn đối với bệnh nhân bị bệnh cơ tim phì đại và cung cấp các thông tin về mức độ nặng và cơ chế gây giới hạn cơ năng của bệnh nhân. Giá trị của nghiệm pháp gắng sức thể lực trong đánh giá thiếu máu cục bộ cơ tim rất hạn chế do bất thường trên điện tâm đồ lúc nghỉ và rối loạn vận động thành tim. Chụp cắt lớp phóng xạ tưới máu cơ tim đơn photon (SPECT) hoặc positron (PET) phát hiện bất thường tưới máu cơ tim ở trên 50% bệnh nhân nhưng đa số các bệnh nhân này không bị bệnh lý động mạch vành có ý nghĩa.
- Chênh áp qua đường ra thất trái có sự thay đổi động học và các nghiệm pháp được sử dụng khi làm siêu âm tim lúc nghỉ để tạo ra chênh áp qua đường ra thất trái (như nghiệm pháp Valsalva) có thể cho kết quả rất thay đổi do bệnh nhân có thể không phối hợp được với hướng dẫn của bác sỹ. Siêu âm tim gắng sức là phương pháp kích thích sinh lý nhất, rất hữu ích đối với bệnh nhân chưa xác định rõ mức độ tắc nghẽn đường ra thất trái trên siêu âm tim lúc nghỉ. Chênh áp qua đường ra thất trái sau bữa ăn cao hơn lúc đói và điều trị bằng thuốc chẹn beta giao cảm làm giảm mức độ tắc nghẽn đường ra thất trái liên quan đến gắng sức. Mặc dù rất ít dữ liệu so sánh giữa siêu âm tim gắng sức thảm chạy với xe đạp lực kế, cả hai phương thức này đều được chấp nhận tại các đơn vị có kinh nghiệm. Nghiệm pháp gắng sức thường hữu ích hơn ở trẻ lớn, thường trên 7-8 tuổi do trẻ nhỏ khó hợp tác khi làm nghiệm pháp.
- Nghiệm pháp gắng sức tim phổi (CPET) là một thăm dò chuẩn trong đánh giá bệnh nhân có triệu chứng nặng, bao gồm các bệnh nhân được xem xét ghép tim. CPET có thể giúp ích trong phân biệt các nguyên nhân khác gây dầy thất trái như tim của vận động viên.
- Nghiệm pháp gắng sức tim phổi với việc đo đồng thời khí thở, cung cấp các bằng chứng khách quan về mức độ cũng như cơ chế gây giảm khả năng gắng sức của người bệnh. Dữ liệu từ trên 3000 bệnh nhân cho thấy giảm đỉnh tiêu thụ oxy và các thông số gắng sức dưới mức tối đa như hiệu suất thông khí và ngưỡng chuyển hóa yếm khí đi kèm với quá trình diễn tiến tới suy tim rất nặng và tử vong do mọi nguyên nhân.
- Ở bệnh nhân chưa có triệu chứng, biết bệnh nhân có tắc nghẽn đường ra thất trái lúc nghỉ hay sau khi làm nghiệm pháp giúp hiểu thấu đáo cơ chế bệnh sinh của từng cá thể. Dù bệnh nhân chưa có triệu chứng, tắc nghẽn đường ra thất trái sau làm nghiệm pháp làm thay đổi các nội dung tư vấn sức khỏe (ví dụ: uống đủ nước) cũng như phác đồ điều trị các bệnh lý đi kèm (ví dụ: thuốc lợi tiểu hoặc thuốc dãn mạch điều trị tăng huyết áp). Có thể phát hiện tắc nghẽn đường ra thất trái tiêm tàng- một nguyên nhân gây ngất khi gắng sức bằng siêu âm tim gắng sức. Tới 1/3 bệnh nhân bệnh cơ tim phì đại người lớn bị tụt huyết áp hoặc không tăng được huyết áp khi gắng sức do tình trạng giảm sức cản mạch hệ thống không thỏa đáng hoặc cung lượng tim thấp. Bất thường đáp ứng huyết áp khi gắng sức thể lực (huyết áp tâm thu không tăng ít nhất 20 mmHg hoặc tụt huyết áp tâm thu trong quá trình gắng sức thể lực trên 20 mmHg so với giá trị đỉnh ghi nhận được) có thể đi kèm với nguy cơ đột tử do tim ở bệnh nhân ≤ 40 tuổi. Giá trị của thông số này như một yếu tố nguy cơ độc lập đối với đột tử bị lu mờ do sự xuất hiện của các chỉ dấu nguy cơ mới hơn.
- Nghiệm pháp gắng sức có thể cung cấp bằng chứng khách quan về mức độ cơ năng của người bệnh. Thông tin này có thể ảnh hưởng tới quyết định tăng bậc điều trị, đặc biệt trong trường hợp triệu chứng của bệnh nhân không rõ ràng khi khai thác bệnh sử lâm sàng.
4.8 Di truyền học và tầm soát gia đình
| Loại | MCC | Khuyến cáo về di truyền và tầm soát gia đình |
| 1 | B | 1. Ở người BCTPĐ, cần đánh giá sự di truyền trong gia đình qua việc tìm hiểu tiền căn gia đình 3 thế hệ(27–33) |
| 1 | B | 2. Ở người BCTPĐ, xét nghiệm di truyền giúp phát hiện thành viên gia đình có nguy cơ phát triển BCTPĐ (9,34,35) |
| 1 | B | 3. Ở người bệnh có biểu hiện lâm sàng không điển hình hoặc nghi ngờ nguyên nhân di truyền khác BCTPĐ, xét nghiệm di truyền phát hiện bệnh lý có kiểu hình BCTPĐ nên được chỉ định(36–38) |
| 1 | B | 4. Ở người BCTPĐ được chỉ định xét nghiệm di truyền, tư vấn di truyền trước và sau khi có kết quả xét nghiệm nên được thực hiện bởi chuyên gia về di truyền trong bệnh tim mạch để cùng với người bệnh đưa ra quyết định đúng đắn(27–29) |
| 1 | B | 5. Khi thực hiện xét nghiệm di truyền ở người BCTPĐ, bộ gene ban đầu được chỉ định nên bao gồm các gene có bằng chứng mạnh mẽ liên quan đến BCTPĐ(39,40) |
| 1 | B | 6. Những người thân trực hệ hàng thứ nhất của người BCTPĐ mang đột biến gây bệnh hoặc có khả năng gây bệnh nên được tầm soát lâm sàng (điện tâm đồ và siêu âm tim 2 chiều) và tầm soát di truyền(29,36,41) |
| 1 | B | 7. Ở gia đình với tiền căn có người đột tử không rõ nguyên nhân và được chẩn đoán BCTPĐ sau tử vong, xét nghiệm di truyền nên được chỉ định nhằm dễ dàng tầm soát di truyền và lâm sàng cho người thân trực hệ hàng thứ nhất(42,43) |
| 1 | B | 8. Ở những người BCTPĐ đã làm xét nghiệm di truyền, việc tái phân loại biến thể nên thực hiện nhiều lần và kết quả tái đánh giá có thể làm thay đổi cách tầm soát lâm sàng và di truyền trong gia đình họ(44–46) |
| 1 | B | 9. Ở những gia đình BCTPĐ, tư vấn trước thụ thai, trước sinh và di truyền nên được thực hiện(27–29) |
| 2b | B | 10. Ở người BCTPĐ được chỉ định xét nghiệm di truyền, tư vấn di truyền trước và sau khi có kết quả xét nghiệm nên được thực hiện bởi chuyên gia về di truyền trong bệnh tim mạch để cùng với người bệnh đưa ra quyết định (46,47) |
| 2b | B | 11. Ở người BCTPĐ mang VUS, sự hữu ích của xét nghiệm di truyền về mặt lâm sàng cho những người thân có kiểu hình âm vì mục đích tái phân loại biến thể là không chắc chắn(30,33,34) |
| 3 | B | 12. Người BCTPĐ có kết quả xét nghiệm di truyền không mang đột biến gây bệnh (biến thể lành tính, có khả năng lành tính), tầm soát di truyền gia đình không hữu ích(30,34) |
| 3 | B | 13. Tầm soát gia đình không được chỉ định cho những người thân có kiểu gene âm ở những gia đình có BCTPĐ kiểu gene dương, trừ khi biến thể hạ bậc trong tái phân loại thành VUS, biến thể lành tính, có khả năng lành tính trong thời gian theo dõi(48,49) |
| VUS, Variant Of Unknown Significance , Biến thể không rõ ý nghĩa | ||
BCTPĐ là bệnh lý di truyền trội trên nhiễm sắc thể thường. Vì vậy, mỗi người con của người mắc BCTPĐ có 50% cơ hội di truyền đột biến và phát triển bệnh(29). Do đó, tiền căn gia đình mắc BCTPĐ và đột tử cần được điều tra ít nhất 3 thế hệ và nên lập cây phả hệ để làm rõ mối liên hệ giữa các dữ liệu vì các đặc điểm này liên quan đến chẩn đoán và điều trị. Như vậy, xét nghiệm di truyền được xem là tiêu chuẩn không thể thiếu trong đánh giá toàn diện bệnh nhân BCTPĐ. Người bệnh cần được tư vấn trước và sau xét nghiệm di truyền bởi đội ngũ tư vấn viên được huấn luyện về di truyền trong bệnh tim mạch. Những khía cạnh liên quan đến tâm lý, đạo đức, tính hợp pháp, đạo đức cần được chú trọng ở bệnh lý di truyền. Xét nghiệm di truyền nên được thực hiện ở những trung tâm có kinh nghiệm về việc thực hiện xét nghiệm và tư vấn di truyền.
Xét nghiệm di truyền giúp xác định chẩn đoán, chẩn đoán phân biệt, tầm soát di truyền gia đình người mắc BCTPĐ, hướng dẫn quyết định sinh sản(9,50).
Xác định chẩn đoán: Thông qua việc xác định đột biến ở bệnh nhân BCTPĐ, người thân trực hệ hàng thứ nhất của người bệnh bao gồm con cái, anh chị em ruột, cha mẹ có thể được phát hiện mang gene đột biến dù không có bất cứ biểu hiện của BCTPĐ bằng xét nghiệm di truyền. Nói cách khác, xét nghiệm di truyền giúp phát hiện bệnh ở giai đoạn tiền lâm sàng. Bên cạnh đó, những bệnh nhân có chẩn đoán BCTPĐ không chắc chắn trên lâm sàng cần được chỉ định xét nghiệm di truyền để xác định chẩn đoán.
Chẩn đoán phân biệt: Có một số bệnh có kiểu hình giống BCTPĐ. Những bệnh lý này do đột biến gene không phải protein liên quan đến sự co cơ, các đột biến đó bao gồm đột biến trên gene PRKAG2, tiểu đơn vị điều hòa của adenosine monophosphate-activated protein kinase (AMPK); và gene LAMP2 (bệnh Danon)(37), protein màng liên quan lysosome trên nhiễm sắc thể giới tính X; gene mã hóa lysosomal hydrolase, α-galactosidase GLA (bệnh Fabry)(51), bệnh cơ tim do thâm nhiễm amyloidosis liên quan transthyretin và bệnh liên quan đến RASopathies. Kết quả xét nghiệm di truyền trong một số trường hợp làm thay đổi phương pháp điều trị như trong bệnh Fabry với điều trị thay thế men và điều trị lâm sàng tích cực hơn với bệnh Danon.
Tầm soát di truyền gia đình: Đột biến gây bệnh và có khả năng gây bệnh ở người BCTPĐ được phát hiện sau kết quả xét nghiệm di truyền rất có ý nghĩa lâm sàng. Kết quả này giúp làm sáng tỏ chẩn đoán ở người BCTPĐ và thực hiện tầm soát di truyền ở những người trong gia đình có nguy cơ mắc bệnh(29,36,52). Những thành viên có nguy cơ mắc bệnh là những người thân trực hệ hàng thứ nhất bao gồm cha mẹ, anh chị và con cái của người BCTPĐ. Khi thực hiện tầm soát di truyền gia đình, những người thân không mang đột biến gây bệnh hoặc có khả năng gây bệnh có thể không cần theo dõi lâm sàng lâu dài. Những người thân mang đột biến gây bệnh hoặc có khả năng gây bệnh sẽ được tầm soát lâm sàng (hỏi bệnh sử, thăm khám lâm sàng, điện tâm đồ 12 chuyển đạo, siêu âm tim) định kỳ. Khi người BCTPĐ có kết quả xét nghiệm di truyền âm tính (có nghĩa là không mang đột biến gây bệnh hoặc có khả năng gây bệnh) hoặc xét nghiệm di truyền không được thực hiện, người thân của họ cũng cần được tầm soát lâm sàng định kỳ vì tuổi khởi phát và biểu hiện lâm sàng của bệnh thay đổi ngay cả ở các thành viên trong cùng một gia đình.
Kết quả VUS ở người BCTPĐ không có giá trị lâm sàng nhiều. Cách tầm soát gia đình tương tự như trong trường hợp kết quả âm tính. VUS cần được tái đánh giá và cách tầm soát gia đình thay đổi tùy vào kết quả tái đánh giá biến thể.
Tư vấn di truyền: Xét nghiệm di truyền cần được tư vấn đầy đủ trước khi thực hiện về lợi ích và nguy cơ (tâm lý, đạo đức,bảo hiểm) khi đột biến gây bệnh được xác định. Kết quả xét nghiệm di truyền cần được giải thích rõ ràng dù kết quả dương tính hay âm tính vì kết quả này liên quan đến việc chẩn đoán bệnh ở người BCTPĐ và tầm soát di truyền gia đình. Vì tính thấm di truyền trong BCTPĐ thay đổi nên trước khi mang thai, cặp đôi có người BCTPĐ nên được tư vấn đầy đủ về khả năng truyền bệnh cho con. Tư vấn di truyền nên được thực hiện cả cho trường hợp sau sinh.
Xét nghiệm di truyền trong BCTPĐ có thể được thực hiện với giải trình tự bộ gene, toàn bộ exon, toàn bộ bộ gene. BCTPĐ là bệnh di truyền do đột biến trên các gene liên quan đến đơn vị co cơ (sarcomere). Vì vậy, bộ gene được chỉ định trong xét nghiệm di truyền mang các gene mã hóa protein trên đơn vị co cơ(50). Bộ 8 gene gồm MYH7, MYBPC3, TNNI3, TNNT2, TPM1, MYL2, MYL3 và ACTC1 có khả năng phát hiện đột biến liên quan đến bệnh ở 30% số bệnh nhân không có tiền căn gia đình BCTPĐ và 60% số bệnh nhân có tiền căn gia đình bệnh lý này(34). Ở thời điểm hiện tại, nhiều nghiên cứu cho thấy, việc mở rộng bộ gene lớn hơn không làm tăng khả năng chẩn đoán bệnh(34,40). Những nghiên cứu gần đây cho thấy có khoảng 40% số người BCTPĐ không mang đột biến trên gene mã hóa protein của đơn vị co cơ, những đột biến trên gene không liên quan đơn vị co cơ được phát hiện. Vì vậy, trong trường hợp người bệnh BCTPĐ âm tính sau khi làm xét nghiệm di truyền với bộ gene ban đầu, giải toàn bộ exon hoặc toàn bộ bộ gene có thể được chỉ định tiếp theo sau khi tư vấn cho người bệnh về khả năng dương tính thấp và phát hiện thêm những đột biến liên quan bệnh lý khác.
Xác định và phân loại biến thể: Tiêu chí trong khuyến cáo của tổ chức “The American College of Medical Genetics and Genomics (ACMG) 2015(53) được sử dụng trong xếp loại biến thể hiện nay, các biến thể có thể được xếp thành năm loại: gây bệnh (pathogenic), có thể gây bệnh (likely pathogenic), biến thể không rõ ý nghĩa (VUS), có thể lành tính (likely benign) và lành tính (benign). Sự xếp loại này được tiến hành dựa trên nhiều loại bằng chứng bao gồm: tần suất của biến thể trong cộng đồng, sự di truyền trong gia đình của biến thể liên quan đến bệnh, dự đoán về hậu quả của biến thể lên chức năng sinh học. Trong đó, bằng chứng lâm sàng như mức độ liên quan giữa biến thể với bệnh trong cộng đồng và sự di truyền của biến thể trong gia đình cùng với bệnh là nhóm bằng chứng được ưu tiên xem xét. Vì vậy, kết quả xếp loại biến thể có thể thay đổi theo thời gian. Thời gian tái đánh giá được khuyên là mỗi vài năm(53). Kết quả tái đánh giá có thể là tăng cấp độ (từ VUS sang đột biến gây bệnh hoặc có khả năng gây bệnh) hoặc giảm cấp độ (từ đột biến đột biến gây bệnh hoặc có khả năng gây bệnh thành VUS, lành tính hoặc có khả năng lành tính). Kết quả này làm thay đổi cách theo dõi tầm soát gia đình. Trong một báo cáo, có khoảng 11% biến thể tăng hoặc giảm cấp độ sau 6 năm khi được tái phân loại(48). Điều này càng cho thấy, việc diễn dịch kết quả xét nghiệm di truyền có thể thay đổi theo thời gian và cần có kế hoạch thông báo kết quả tái đánh giá biến thể cho người bệnh bởi bác sĩ điều trị, phòng xét nghiệm, nhân viên tư vấn di truyền.
Cho đến thời điểm hiện tại, chưa có bằng chứng mạnh mẽ xác nhận mối liên hệ kiểu gene – kiểu hình; dù một số nghiên cứu cho thấy nhiều đột biến trên cùng một bệnh nhân cho thấy làm tăng khả năng suy tim(47), đột biến TNNT2 có liên quan đến xuất độ đột tử cao dù phì đại không nhiều như những đột biến khác(54), bệnh nhân BCTPĐ đã được xác định đột biến gene mã hóa protein trên đơn vị co cơ có biến chứng lâm sàng nặng hơn BCTPĐ không rõ nguyên nhân kể cả đột tử(55). Vì vậy, kết quả của xét nghiệm di truyền không ảnh hưởng đến quyết định đặt Máy phá rung cấy được cho người bệnh (ICD).
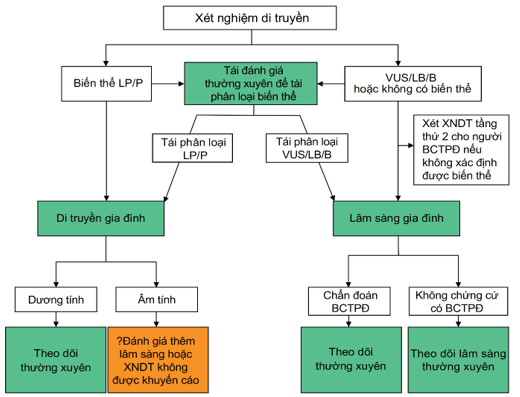
Hình 2. Tầm soát gia đình người bệnh cơ tim phì đại(26)
LP, Likely Pathogenic, Có khả năng gây bệnh; P, Parthogenic, Gây bệnh; VUS, Variant Of Unknown Significance, Biến thể không rõ ý nghĩa; LB, Likely Benign, Có khả năng lành tính; B, Benign, lành tính; BCTPĐ, Bệnh cơ tim phì đại. XNDT, Xét nghiệm di truyền.
4.9 Kiểu gene dương – kiểu hình âm
Những người kiểu gene dương – kiểu hình âm là những người mang biến thể gây bệnh hoặc có khả năng gây BCTPĐ nhưng không có triệu chứng và không có chứng cứ dầy thất trái trên hình ảnh học tim mạch. Người kiểu gene dương – kiểu hình âm cũng được gọi là tình trạng BCTPĐ tiền lâm sàng. Ở giai đoạn này, nhiều nghiên cứu đã cho thấy có sự bất thường thư dãn thất trái, sự biến dạng cơ tim, bất thường van hai lá, bất thường cơ bè, sẹo cơ tim, bất thường trên điện tâm đồ, bất thường nồng độ NT-BNP trong huyết thanh(56–59). Tuy nhiên, những bất thường này chưa ảnh hưởng đến những quyết định điều trị. Vì vậy, những người kiểu gene dương – kiểu hình âm cần theo dõi lâu dài để phát hiện bệnh ở giai đoạn biểu hiện lâm sàng.
Việc theo dõi lâu dài người kiểu gene dương – kiểu hình âm nên được áp dụng ở mọi độ tuổi. Những nghiên cứu gần đây cho thấy có khoảng 5% – 10% kiểu hình dương vào lần tầm soát đầu tiên và 3% – 5% hiểu hiện dầy thành tim trước 18 tuổi(33,60). Có khoảng 1/3 bệnh nhân biểu hiện lâm sàng cần điều trị nội khoa, phẫu thuật, dụng cụ trước 18 tuổi(33). Ngoài ra, BCTPĐ có thể biểu hiện ở lứa tuổi trung niên; vì vậy, việc theo dõi những người kiểu gene dương – kiểu hình âm có thể kéo dài đến lứa tuổi 50.
Đột tử xảy ra ở người kiểu gene dương – kiểu hình âm là hiếm(61). Do đó, hiện tại, người mang đặc điểm này không bị giới hạn về mức độ tham gia các môn thể thao chuyên nghiệp cũng như không đánh giá điện tâm đồ và trắc nghiệm gắng sức hoạt động thể lực định kỳ trừ khi tiền căn gia đình có người đột tử hoặc khi tầm soát trước thi đấu.
ICD không được đề nghị trong phòng ngừa đột tử tiên phát ở người kiểu gene dương – kiểu hình âm vì khả năng đột tử thấp. Tương tự, hiện nay chưa có biện pháp điều trị nội khoa nào được khuyên dùng cho những người này.
| Loại | MCC | Khuyến cáo về người kiểu gene dương – kiểu hình âm |
| 1 | B | 1. Người kiểu gene dương – kiểu hình âm cần được đánh giá định kỳ lâm sàng bao gồm điện tâm đồ và hình ảnh học tim mạch mỗi 1 – 2 năm ở trẻ em và thanh thiếu niên; mỗi 3 – 5 năm ở người lớn và khi tình trạng lâm sàng thay đổi(33,41,60,62,63) |
| 2a | C |
2. Người kiểu gene dương – kiểu hình âm có thể tham gia thi đấu thể thao chuyên nghiệp ở bất kỳ mức hoạt động thể lực nào(61) |
| 3 | B | 3. Ở người kiểu gene dương – kiểu hình âm, ICD không được chỉ định đề phòng ngừa đột tử tiên phát (33,60–64). |
Xem tiếp kỳ sau…
TÀI LIỆU THAM KHẢO
- Geske JB, Ommen SR, Gersh BJ. Hypertrophic Cardiomyopathy: Clinical Update. JACC: Heart Failure. 2018;6(5):364-375. https://doi.org/10.1016/J.JCHF.2018.02.010
- Marian AJ, Braunwald E. Hypertrophic Cardiomyopathy. Circulation Research. 2017;121(7):749-770. https://doi.org/10.1161/CIRCRESAHA.117.311059
- Maron BJ, Ommen SR, Semsarian C, Spirito P, Olivotto I, Maron MS. Hypertrophic Cardiomyopathy: Present and Future, With Translation Into Contemporary Cardiovascular Medicine. J Am Coll Cardiol. 2014;64(1):83-99. https://doi.org/10.1016/J.JACC.2014.05.003
- Maron BJ. Clinical Course and Management of Hypertrophic Cardiomyopathy. New England Journal of Medicine. 2018;379(7):655-668. https://doi.org/10.1056/NEJMRA1710575
- Semsarian C, Ingles J, Maron MS, Maron BJ. New Perspectives on the Prevalence of Hypertrophic Cardiomyopathy. J Am Coll Cardiol. 2015;65(12):1249-1254. https://doi.org/10.1016/J.JACC.2015.01.019
- Maron M, Hellawell J, cardiology JL… journal of, 2016 undefined. Occurrence of clinically diagnosed hypertrophic cardiomyopathy in the United States. Elsevier. Accessed May 4, 2022. https://www.sciencedirect.com/science/article/pii/S0002914916303046
- Burke MA, Cook SA, Seidman JG, Seidman CE. Clinical and Mechanistic Insights Into the Genetics of Cardiomyopathy. J Am Coll Cardiol. 2016;68(25):2871-2886. https://doi.org/10.1016/J.JACC.2016.08.079
- Ingles J, Burns C, Bagnall RD, et al. Nonfamilial Hypertrophic Cardiomyopathy. Circulation: Cardiovascular Genetics. 2017;10(2). https://doi.org/10.1161/CIRCGENETICS.116.001620
- Ho CY, Day SM, Ashley EA, et al. Genotype and lifetime burden of disease in hypertrophic cardiomyopathy insights from the sarcomeric human cardiomyopathy registry (SHaRe). Circulation. 2018;138(14):1387-1398. https://doi.org/10.1161/CIRCULATIONAHA.117.033200
- Maron B, Rowin E, Casey S, cardiology MMJ, 2016 undefined. How hypertrophic cardiomyopathy became a contemporary treatable genetic disease with low mortality: shaped by 50 years of clinical research and practice. jamanetwork.com. Accessed May 4, 2022. https://jamanetwork.com/journals/jamacardiology/article-abstract/2498963
- Maron MS, Olivotto I, Zenovich AG, et al. Hypertrophic cardiomyopathy is predominantly a disease of left ventricular outflow tract obstruction. Circulation. 2006;114(21):2232-2239. https://doi.org/10.1161/CIRCULATIONAHA.106.644682
- Sorajja P, Nishimura RA, Gersh BJ, et al. Outcome of Mildly Symptomatic or Asymptomatic Obstructive Hypertrophic Cardiomyopathy. A Long-Term Follow-Up Study. J Am Coll Cardiol. 2009;54(3):234-241. https://doi.org/10.1016/J.JACC.2009.01.079
- Pellikka PA, Oh JK, Bailey KR, Nichols BA, Monahan KH, Tajik AJ. Dynamic intraventricular obstruction during dobutamine stress echocardiography: A new observation. Circulation. 1992;86(5):1429-1432. https://doi.org/10.1161/01.CIR.86.5.1429
- Villemain O, Correia M, Mousseaux E, et al. Myocardial Stiffness Evaluation Using Noninvasive Shear Wave Imaging in Healthy and Hypertrophic Cardiomyopathic Adults. JACC: Cardiovascular Imaging. 2019;12(7):1135-1145. https://doi.org/10.1016/J.JCMG.2018.02.002
- Paulus WJ, Lorell BH, Craig WE, Wynne J, Murgo JP, Grossman W. Comparison of the effects of nitroprusside and nifedipine on diastolic properties in patients with hypertrophic cardiomyopathy: Altered left ventricular loading or improved muscle inactivation? J Am Coll Cardiol. 1983;2(5):879-886. https://doi.org/10.1016/S0735-1097(83)80235-6
- Chan RH, Maron BJ, Olivotto I, et al. Prognostic value of quantitative contrast-enhanced cardiovascular magnetic resonance for the evaluation of sudden death risk in patients with hypertrophic cardiomyopathy. Circulation. 2014;130(6):484-495. https://doi.org/10.1161/CIRCULATIONAHA.113.007094
- Sherrid M v., Balaram S, Kim B, Axel L, Swistel DG. The Mitral Valve in Obstructive Hypertrophic Cardiomyopathy: A Test in Context. J Am Coll Cardiol. 2016;67(15):1846-1858. https://doi.org/10.1016/J.JACC.2016.01.071
- Maron MS, Olivotto I, Harrigan C, et al. Mitral valve abnormalities identified by cardiovascular magnetic resonance represent a primary phenotypic expression of hypertrophic cardiomyopathy. Circulation. 2011;124(1):40-47. https://doi.org/10.1161/CIRCULATIONAHA.110.985812
- Hodges K, Rivas CG, Aguilera J, et al. Surgical management of left ventricular outflow tract obstruction in a specialized hypertrophic obstructive cardiomyopathy center. The Journal of Thoracic and Cardiovascular Surgery. 2019;157(6):2289-2299. https://doi.org/10.1016/J.JTCVS.2018.11.148
- Hong JH, Schaff H v., Nishimura RA, et al. Mitral Regurgitation in Patients With Hypertrophic Obstructive Cardiomyopathy: Implications for Concomitant Valve Procedures. J Am Coll Cardiol. 2016;68(14):1497-1504. https://doi.org/10.1016/J.JACC.2016.07.735
- Rowin EJ, Maron BJ, Haas TS, et al. Hypertrophic Cardiomyopathy With Left Ventricular Apical Aneurysm: Implications for Risk Stratification and Management. J Am Coll Cardiol. 2017;69(7):761-773. https://doi.org/10.1016/J.JACC.2016.11.063
- Patel V, Critoph CH, Finlay MC, Mist B, Lambiase PD, Elliott PM. Heart Rate Recovery in Patients With Hypertrophic Cardiomyopathy. The American Journal of Cardiology. 2014;113(6):1011-1017. https://doi.org/10.1016/J.AMJCARD.2013.11.062
- Olivotto I, Maron BJ, Montereggi A, Mazzuoli F, Dolara A, Cecchi F. Prognostic value of systemic blood pressure response during exercise in a community-based patient population with hypertrophic cardiomyopathy. J Am Coll Cardiol. 1999;33(7):2044-2051. https://doi.org/10.1016/S0735-1097(99)00094-7
- Frenneaux MP, Counihan PJ, Caforio ALP, Chikamori T, McKenna WJ. Abnormal blood pressure response during exercise in hypertrophic cardiomyopathy. Circulation. 1990;82(6):1995-2002. https://doi.org/10.1161/01.CIR.82.6.1995
- Sadoul N, Prasad K, Elliott PM, Bannerjee S, Frenneaux MP, McKenna WJ. Prospective Prognostic Assessment of Blood Pressure Response During Exercise in Patients With Hypertrophic Cardiomyopathy. Circulation. 1997;96(9):2987-2991. https://doi.org/10.1161/01.CIR.96.9.2987
- Ommen SR, Mital S, Burke MA, et al. 2020 AHA/ACC Guideline for the Diagnosis and Treatment of Patients With Hypertrophic Cardiomyopathy: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2020;142(25):e558-e631. https://doi.org/10.1161/CIR.0000000000000937
- Ahmad F, McNally EM, Ackerman MJ, et al. Establishment of Specialized Clinical Cardiovascular Genetics Programs: Recognizing the Need and Meeting Standards: A Scientific Statement From the American Heart Association. Circ Genom Precis Med. 2019;12(6):286-305. https://doi.org/10.1161/HCG.0000000000000054
- Charron P, Arad M, Arbustini E, et al. Genetic counselling and testing in cardiomyopathies: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J. 2010;31(22):2715-2728. https://doi.org/10.1093/EURHEARTJ/EHQ271
- Maron BJ, Maron MS, Semsarian C. Genetics of hypertrophic cardiomyopathy after 20 years: clinical perspectives. J Am Coll Cardiol. 2012;60(8):705-715. https://doi.org/10.1016/J.JACC.2012.02.068
- Ingles J, Sarina T, Yeates L, et al. Clinical predictors of genetic testing outcomes in hypertrophic cardiomyopathy. Genet Med. 2013;15(12):972-977. https://doi.org/10.1038/GIM.2013.44
- van Velzen HG, Schinkel AFL, Baart SJ, et al. Outcomes of Contemporary Family Screening in Hypertrophic Cardiomyopathy. Circ Genom Precis Med. 2018;11(4):e001896. https://doi.org/10.1161/CIRCGEN.117.001896
- Ranthe MF, Carstensen L, Øyen N, et al. Risk of Cardiomyopathy in Younger Persons With a Family History of Death from Cardiomyopathy: A Nationwide Family Study in a Cohort of 3.9 Million Persons. Circulation. 2015;132(11):1013-1019. https://doi.org/10.1161/CIRCULATIONAHA.114.013478
- Lafreniere-Roula M, Bolkier Y, Zahavich L, et al. Family screening for hypertrophic cardiomyopathy: Is it time to change practice guidelines? Eur Heart J. 2019;40(45):3672-3681. https://doi.org/10.1093/EURHEARTJ/EHZ396
- Alfares AA, Kelly MA, McDermott G, et al. Results of clinical genetic testing of 2,912 probands with hypertrophic cardiomyopathy: expanded panels offer limited additional sensitivity. Genet Med. 2015;17(11):880-888. https://doi.org/10.1038/GIM.2014.205
- Bagnall RD, Ingles J, Dinger ME, et al. Whole Genome Sequencing Improves Outcomes of Genetic Testing in Patients With Hypertrophic Cardiomyopathy. J Am Coll Cardiol. 2018;72(4):419-429. https://doi.org/10.1016/J.JACC.2018.04.078
- Ingles J, Burns C, Funke B. Pathogenicity of Hypertrophic Cardiomyopathy Variants. Circulation: Cardiovascular Genetics. 2017;10(5). https://doi.org/10.1161/CIRCGENETICS.117.001916
- Maron BJ, Roberts WC, Arad M, et al. Clinical outcome and phenotypic expression in LAMP2 cardiomyopathy. JAMA. 2009;301(12):1253-1259. https://doi.org/10.1001/JAMA.2009.371
- Desai MY, Ommen SR, McKenna WJ, Lever HM, Elliott PM. Imaging phenotype versus genotype in hypertrophic cardiomyopathy. Circ Cardiovasc Imaging. 2011;4(2):156-168. https://doi.org/10.1161/CIRCIMAGING.110.957936
- Richards S, Aziz N, Bale S, et al. Standards and guidelines for the interpretation of sequence variants: a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology. Genet Med. 2015;17(5):405-424. https://doi.org/10.1038/GIM.2015.30
- Ouellette AC, Mathew J, Manickaraj AK, et al. Clinical genetic testing in pediatric cardiomyopathy: Is bigger better? Clin Genet. 2018;93(1):33-40. https://doi.org/10.1111/CGE.13024
- Jensen MK, Havndrup O, Christiansen M, et al. Penetrance of hypertrophic cardiomyopathy in children and adolescents: a 12-year follow-up study of clinical screening and predictive genetic testing. Circulation. 2013;127(1):48-54. https://doi.org/10.1161/CIRCULATIONAHA.111.090514
- Semsarian C, Ingles J, Wilde AAM. Sudden cardiac death in the young: the molecular autopsy and a practical approach to surviving relatives. Eur Heart J. 2015;36(21):1290-1296. https://doi.org/10.1093/EURHEARTJ/EHV063
- Bagnall RD, Weintraub RG, Ingles J, et al. A prospective study of sudden cardiac death among children and young adults. New England Journal of Medicine. 2016;374(25):2441-2452.
- Jipin Das K, Ingles J, Bagnall RD, Semsarian C. Determining pathogenicity of genetic variants in hypertrophic cardiomyopathy: importance of periodic reassessment. Genet Med. 2014;16(4):286-293. https://doi.org/10.1038/GIM.2013.138
- Manrai AK, Funke BH, Rehm HL, et al. Genetic Misdiagnoses and the Potential for Health Disparities. N Engl J Med. 2016;375(7):655-665. https://doi.org/10.1056/NEJMSA1507092
- Mathew J, Zahavich L, Lafreniere-Roula M, et al. Utility of genetics for risk stratification in pediatric hypertrophic cardiomyopathy. Clin Genet. 2018;93(2):310-319. https://doi.org/10.1111/CGE.13157
- Ingles J, Doolan A, Chiu C, Seidman J, Seidman C, Semsarian C. Compound and double mutations in patients with hypertrophic cardiomyopathy: implications for genetic testing and counselling. J Med Genet. 2005;42(10). https://doi.org/10.1136/JMG.2005.033886
- Aronson SJ, Clark EH, Varugheese M, Baxter S, Babb LJ, Rehm HL. Communicating new knowledge on previously reported genetic variants. Genet Med. 2012;14(8):713-719. https://doi.org/10.1038/GIM.2012.19
- Semsarian C, Ingles J, Maron MS, Maron BJ. New perspectives on the prevalence of hypertrophic cardiomyopathy. J Am Coll Cardiol. 2015;65(12):1249-1254. https://doi.org/10.1016/J.JACC.2015.01.019
- Ingles J, Goldstein J, Thaxton C, et al. Evaluating the Clinical Validity of Hypertrophic Cardiomyopathy Genes. Circulation: Genomic and Precision Medicine. 2019;12(2):57-64. https://doi.org/10.1161/CIRCGEN.119.002460
- Elliott P, Baker R, Pasquale F, et al. Prevalence of Anderson-Fabry disease in patients with hypertrophic cardiomyopathy: the European Anderson-Fabry Disease survey. Heart. 2011;97(23):1957-1960. https://doi.org/10.1136/HEARTJNL-2011-300364
- Lafreniere-Roula M, Bolkier Y, Zahavich L, et al. Family screening for hypertrophic cardiomyopathy: Is it time to change practice guidelines? Eur Heart J. 2019;40(45):3672-3681. https://doi.org/10.1093/EURHEARTJ/EHZ396
- Richards S, Aziz N, Bale S, et al. Standards and guidelines for the interpretation of sequence variants: a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology. Genet Med. 2015;17(5):405-424. https://doi.org/10.1038/GIM.2015.30
- Watkins H, McKenna WJ, Thierfelder L, et al. Mutations in the genes for cardiac troponin T and alpha-tropomyosin in hypertrophic cardiomyopathy. N Engl J Med. 1995;332(16):1058-1065. https://doi.org/10.1056/NEJM199504203321603
- Olivotto I, Girolami F, Ackerman MJ, et al. Myofilament protein gene mutation screening and outcome of patients with hypertrophic cardiomyopathy. Mayo Clin Proc. 2008;83(6):630-638. https://doi.org/10.4065/83.6.630
- Captur G, Lopes LR, Mohun TJ, et al. Prediction of sarcomere mutations in subclinical hypertrophic cardiomyopathy. Circ Cardiovasc Imaging. 2014;7(6):863-871. https://doi.org/10.1161/CIRCIMAGING.114.002411
- Ho CY, Day SM, Colan SD, et al. The Burden of Early Phenotypes and the Influence of Wall Thickness in Hypertrophic Cardiomyopathy Mutation Carriers: Findings From the HCMNet Study. JAMA Cardiol. 2017;2(4):419-428. https://doi.org/10.1001/JAMACARDIO.2016.5670
- Vigneault DM, Yang E, Jensen PJ, et al. Left Ventricular Strain Is Abnormal in Preclinical and Overt Hypertrophic Cardiomyopathy: Cardiac MR Feature Tracking. Radiology. 2019;290(3):640-648. https://doi.org/10.1148/RADIOL.2018180339
- Williams LK, Misurka J, Ho CY, et al. Multilayer Myocardial Mechanics in Genotype-Positive Left Ventricular Hypertrophy-Negative Patients With Hypertrophic Cardiomyopathy. Am J Cardiol. 2018;122(10):1754-1760. https://doi.org/10.1016/J.AMJCARD.2018.08.008
- Norrish G, Jager J, Field E, et al. Yield of Clinical Screening for Hypertrophic Cardiomyopathy in Child First-Degree Relatives. Circulation. 2019;140(3):184-192. https://doi.org/10.1161/CIRCULATIONAHA.118.038846
- Christiaans I, Birnie E, Bonsel GJ, et al. Manifest disease, risk factors for sudden cardiac death, and cardiac events in a large nationwide cohort of predictively tested hypertrophic cardiomyopathy mutation carriers: determining the best cardiological screening strategy. Eur Heart J. 2011;32(9):1161-1170. https://doi.org/10.1093/EURHEARTJ/EHR092
- Maurizi N, Michels M, Rowin EJ, et al. Clinical Course and Significance of Hypertrophic Cardiomyopathy Without Left Ventricular Hypertrophy. Circulation. 2019;139(6):830-833. https://doi.org/10.1161/CIRCULATIONAHA.118.037264
- Vermeer AMC, Clur SAB, Blom NA, Wilde AAM, Christiaans I. Penetrance of Hypertrophic Cardiomyopathy in Children Who Are Mutation Positive. J Pediatr. 2017;188:91-95. https://doi.org/10.1016/J.JPEDS.2017.03.033
- Gray B, Ingles J, Semsarian C. Natural history of genotype positive-phenotype negative patients with hypertrophic cardiomyopathy. Int J Cardiol. 2011;152(2):258-259. https://doi.org/10.1016/J.IJCARD.2011.07.095
- Maron MS, Rowin EJ, Wessler BS, et al. Enhanced American College of Cardiology/American Heart Association Strategy for Prevention of Sudden Cardiac Death in High-Risk Patients With Hypertrophic Cardiomyopathy. JAMA Cardiol. 2019;4(7):644-657. https://doi.org/10.1001/JAMACARDIO.2019.1391
- O’Mahony C, Jichi F, Ommen SR, et al. International External Validation Study of the 2014 European Society of Cardiology Guidelines on Sudden Cardiac Death Prevention in Hypertrophic Cardiomyopathy (EVIDENCE-HCM). Circulation. 2018;137(10):1015-1023. https://doi.org/10.1161/CIRCULATIONAHA.117.030437
- Elliott PM, Sharma S, Varnava A, Poloniecki J, Rowland E, McKenna WJ. Survival after cardiac arrest or sustained ventricular tachycardia in patients with hypertrophic cardiomyopathy. J Am Coll Cardiol. 1999;33(6):1596-1601. https://doi.org/10.1016/S0735-1097(99)00056-X
- Spirito P, Autore C, Rapezzi C, et al. Syncope and risk of sudden death in hypertrophic cardiomyopathy. Circulation. 2009;119(13):1703-1710. https://doi.org/10.1161/CIRCULATIONAHA.108.798314
- Bos JM, Maron BJ, Ackerman MJ, et al. Role of family history of sudden death in risk stratification and prevention of sudden death with implantable defibrillators in hypertrophic cardiomyopathy. Am J Cardiol. 2010;106(10):1481-1486. https://doi.org/10.1016/J.AMJCARD.2010.06.077
- Dimitrow PP, Chojnowska L, Rudziński T, et al. Sudden death in hypertrophic cardiomyopathy: old risk factors re-assessed in a new model of maximalized follow-up. Eur Heart J. 2010;31(24):3084-3093. https://doi.org/10.1093/EURHEARTJ/EHQ308
- Spirito P, Bellone P, Harris KM, Bernabò P, Bruzzi P, Maron BJ. Magnitude of left ventricular hypertrophy and risk of sudden death in hypertrophic cardiomyopathy. N Engl J Med. 2000;342(24):1778-1785. https://doi.org/10.1056/NEJM200006153422403
- Autore C, Bernabò P, Barillà CS, Bruzzi P, Spirito P. The prognostic importance of left ventricular outflow obstruction in hypertrophic cardiomyopathy varies in relation to the severity of symptoms. J Am Coll Cardiol. 2005;45(7):1076-1080. https://doi.org/10.1016/J.JACC.2004.12.067
- Elliott PM, Gimeno Blanes JR, Mahon NG, Poloniecki JD, McKenna WJ. Relation between severity of left-ventricular hypertrophy and prognosis in patients with hypertrophic cardiomyopathy. Lancet. 2001;357(9254):420-424. https://doi.org/10.1016/S0140-6736(00)04005-8
- Harris KM, Spirito P, Maron MS, et al. Prevalence, clinical profile, and significance of left ventricular remodeling in the end-stage phase of hypertrophic cardiomyopathy. Circulation. 2006;114(3):216-225. https://doi.org/10.1161/CIRCULATIONAHA.105.583500
- Rowin EJ, Maron BJ, Haas TS, et al. Hypertrophic Cardiomyopathy With Left Ventricular Apical Aneurysm: Implications for Risk Stratification and Management. J Am Coll Cardiol. 2017;69(7):761-773. https://doi.org/10.1016/J.JACC.2016.11.063
- Ichida M, Nishimura Y, Kario K. Clinical significance of left ventricular apical aneurysms in hypertrophic cardiomyopathy patients: the role of diagnostic electrocardiography. J Cardiol. 2014;64(4):265-272. https://doi.org/10.1016/J.JJCC.2014.02.011
- Monserrat L, Elliott PM, Gimeno JR, Sharma S, Penas-Lado M, McKenna WJ. Non-sustained ventricular tachycardia in hypertrophic cardiomyopathy: an independent marker of sudden death risk in young patients. J Am Coll Cardiol. 2003;42(5):873-879. https://doi.org/10.1016/S0735-1097(03)00827-1
- Wang W, Lian Z, Rowin EJ, Maron BJ, Maron MS, Link MS. Prognostic Implications of Nonsustained Ventricular Tachycardia in High-Risk Patients With Hypertrophic Cardiomyopathy. Circ Arrhythm Electrophysiol. 2017;10(3). https://doi.org/10.1161/CIRCEP.116.004604
- Corona-Villalobos CP, Sorensen LL, Pozios I, et al. Left ventricular wall thickness in patients with hypertrophic cardiomyopathy: a comparison between cardiac magnetic resonance imaging and echocardiography. Int J Cardiovasc Imaging. 2016;32(6):945-954. https://doi.org/10.1007/S10554-016-0858-4
- Bois JP, Geske JB, Foley TA, Ommen SR, Pellikka PA. Comparison of Maximal Wall Thickness in Hypertrophic Cardiomyopathy Differs Between Magnetic Resonance Imaging and Transthoracic Echocardiography. Am J Cardiol. 2017;119(4):643-650. https://doi.org/10.1016/J.AMJCARD.2016.11.010
- Maron MS, Lesser JR, Maron BJ. Management implications of massive left ventricular hypertrophy in hypertrophic cardiomyopathy significantly underestimated by echocardiography but identified by cardiovascular magnetic resonance. Am J Cardiol. 2010;105(12):1842-1843. https://doi.org/10.1016/J.AMJCARD.2010.01.367
- Weng Z, Yao J, Chan RH, et al. Prognostic Value of LGE-CMR in HCM: A Meta-Analysis. JACC Cardiovasc Imaging. 2016;9(12):1392-1402. https://doi.org/10.1016/J.JCMG.2016.02.031
- Chan RH, Maron BJ, Olivotto I, et al. Prognostic value of quantitative contrast-enhanced cardiovascular magnetic resonance for the evaluation of sudden death risk in patients with hypertrophic cardiomyopathy. Circulation. 2014;130(6):484-495. https://doi.org/10.1161/CIRCULATIONAHA.113.007094
- Mentias A, Raeisi-Giglou P, Smedira NG, et al. Late Gadolinium Enhancement in Patients With Hypertrophic Cardiomyopathy and Preserved Systolic Function. J Am Coll Cardiol. 2018;72(8):857-870. https://doi.org/10.1016/J.JACC.2018.05.060
- Ismail TF, Jabbour A, Gulati A, et al. Role of late gadolinium enhancement cardiovascular magnetic resonance in the risk stratification of hypertrophic cardiomyopathy. Heart. 2014;100(23):1851-1858. https://doi.org/10.1136/HEARTJNL-2013-305471
- O’Mahony C, Jichi F, Pavlou M, et al. A novel clinical risk prediction model for sudden cardiac death in hypertrophic cardiomyopathy (HCM risk-SCD). Eur Heart J. 2014;35(30):2010-2020. https://doi.org/10.1093/EURHEARTJ/EHT439
- Binder J, Attenhofer Jost CH, Klarich KW, et al. Apical hypertrophic cardiomyopathy: prevalence and correlates of apical outpouching. J Am Soc Echocardiogr. 2011;24(7):775-781. https://doi.org/10.1016/J.ECHO.2011.03.002
- Rowin EJ, Maron BJ, Carrick RT, et al. Outcomes in Patients With Hypertrophic Cardiomyopathy and Left Ventricular Systolic Dysfunction. J Am Coll Cardiol. 2020;75(24):3033-3043. https://doi.org/10.1016/J.JACC.2020.04.045
- Marstrand P, Han L, Day SM, et al. Hypertrophic Cardiomyopathy With Left Ventricular Systolic Dysfunction: Insights From the SHaRe Registry. Circulation. 2020;141(17):1371-1383. https://doi.org/10.1161/CIRCULATIONAHA.119.044366
- Chan RH, Maron BJ, Olivotto I, et al. Prognostic value of quantitative contrast-enhanced cardiovascular magnetic resonance for the evaluation of sudden death risk in patients with hypertrophic cardiomyopathy. Circulation. 2014;130(6):484-495. https://doi.org/10.1161/CIRCULATIONAHA.113.007094
- Östman-Smith I, Wettrell G, Keeton B, et al. Age- and gender-specific mortality rates in childhood hypertrophic cardiomyopathy. Eur Heart J. 2008;29(9):1160-1167. https://doi.org/10.1093/EURHEARTJ/EHN122
- Miron A, Lafreniere-Roula M, Steve Fan CP, et al. A Validated Model for Sudden Cardiac Death Risk Prediction in Pediatric Hypertrophic Cardiomyopathy. Circulation. 2020;142(3):217-229. https://doi.org/10.1161/CIRCULATIONAHA.120.047235
- Norrish G, Ding T, Field E, et al. Development of a Novel Risk Prediction Model for Sudden Cardiac Death in Childhood Hypertrophic Cardiomyopathy (HCM Risk-Kids). JAMA Cardiol. 2019;4(9):918-927. https://doi.org/10.1001/JAMACARDIO.2019.2861
- Wells S, Rowin EJ, Bhatt V, Maron MS, Maron BJ. Association Between Race and Clinical Profile of Patients Referred for Hypertrophic Cardiomyopathy. Circulation. 2018;137(18):1973-1975. https://doi.org/10.1161/CIRCULATIONAHA.117.032838
- Norrish G, Cantarutti N, Pissaridou E, et al. Risk factors for sudden cardiac death in childhood hypertrophic cardiomyopathy: A systematic review and meta-analysis. Eur J Prev Cardiol. 2017;24(11):1220-1230. https://doi.org/10.1177/2047487317702519
- Maron BJ, Rowin EJ, Casey SA, et al. Hypertrophic Cardiomyopathy in Adulthood Associated With Low Cardiovascular Mortality With Contemporary Management Strategies. J Am Coll Cardiol. 2015;65(18):1915-1928. https://doi.org/10.1016/J.JACC.2015.02.061
- Maron BJ, Rowin EJ, Casey SA, et al. Risk stratification and outcome of patients with hypertrophic cardiomyopathy >=60 years of age. Circulation. 2013;127(5):585-593. https://doi.org/10.1161/CIRCULATIONAHA.112.136085
- Norrish G, Ding T, Field E, et al. A validation study of the European Society of Cardiology guidelines for risk stratification of sudden cardiac death in childhood hypertrophic cardiomyopathy. Europace. 2019;21(10):1559-1565. https://doi.org/10.1093/EUROPACE/EUZ118
- Maron BJ, Rowin EJ, Casey SA, et al. Hypertrophic Cardiomyopathy in Children, Adolescents, and Young Adults Associated With Low Cardiovascular Mortality With Contemporary Management Strategies. Circulation. 2016;133(1):62-73. https://doi.org/10.1161/CIRCULATIONAHA.115.017633
- Rowin EJ, Sridharan A, Madias C, et al. Prediction and Prevention of Sudden Death in Young Patients (. Am J Cardiol. 2020;128:75-83. https://doi.org/10.1016/J.AMJCARD.2020.04.042
- O’Mahony C, Tome-Esteban M, Lambiase PD, et al. A validation study of the 2003 American College of Cardiology/European Society of Cardiology and 2011 American College of Cardiology Foundation/American Heart Association risk stratification and treatment algorithms for sudden cardiac death in patients with hypertrophic cardiomyopathy. Heart. 2013;99(8):534-541. https://doi.org/10.1136/HEARTJNL-2012-303271
- Vriesendorp PA, Schinkel AFL, van Cleemput J, et al. Implantable cardioverter-defibrillators in hypertrophic cardiomyopathy: patient outcomes, rate of appropriate and inappropriate interventions, and complications. 2013;166(3):496-502. https://doi.org/10.1016/J.AHJ.2013.06.009
- Maron BJ, Spirito P, Shen WK, et al. Implantable cardioverter-defibrillators and prevention of sudden cardiac death in hypertrophic cardiomyopathy. JAMA. 2007;298(4):405-412. https://doi.org/10.1001/JAMA.298.4.405
- Balaji S, DiLorenzo MP, Fish FA, et al. Risk factors for lethal arrhythmic events in children and adolescents with hypertrophic cardiomyopathy and an implantable defibrillator: an international multicenter study. Heart Rhythm. 2019;16(10):1462-1467.
- Decker JA, Rossano JW, Smith EO, et al. Risk factors and mode of death in isolated hypertrophic cardiomyopathy in children. J Am Coll Cardiol. 2009;54(3):250-254.
- Kamp AN, von Bergen NH, Henrikson CA, et al. Implanted defibrillators in young hypertrophic cardiomyopathy patients: a multicenter study. Pediatr Cardiol. 2013;34(7):1620-1627.
- Smith BM, Dorfman AL, Yu S, et al. Clinical significance of late gadolinium enhancement in patients< 20 years of age with hypertrophic cardiomyopathy. The American Journal of Cardiology. 2014;113(7):1234-1239.
- Raja AA, Farhad H, Valente AM, et al. Prevalence and progression of late gadolinium enhancement in children and adolescents with hypertrophic cardiomyopathy. Circulation. 2018;138(8):782-792. https://doi.org/10.1161/CIRCULATIONAHA.117.032966
- Maron BJ, Spirito P, Shen WK, et al. Implantable Cardioverter-Defibrillators and Prevention of Sudden Cardiac Death in Hypertrophic Cardiomyopathy. JAMA. 2007;298(4):405-412. https://doi.org/10.1001/JAMA.298.4.405
- Vriesendorp PA, Schinkel AFL, van Cleemput J, et al. Implantable cardioverter-defibrillators in hypertrophic cardiomyopathy: Patient outcomes, rate of appropriate and inappropriate interventions, and complications. American Heart Journal. 2013;166(3):496-502. https://doi.org/10.1016/J.AHJ.2013.06.009
- Lampert R, Olshansky B, Heidbuchel H, et al. Safety of sports for athletes with implantable cardioverter-defibrillators: Results of a prospective, multinational registry. Circulation. 2013;127(20):2021-2030. https://doi.org/10.1161/CIRCULATIONAHA.112.000447
- Okamura H, Friedman PA, Inoue Y, et al. Single-Coil Defibrillator Leads Yield Satisfactory Defibrillation Safety Margin in Hypertrophic Cardiomyopathy. Circulation Journal. 2016;80(10):CJ-16-0428. https://doi.org/10.1253/CIRCJ.CJ-16-0428
- Killu AM, Park JY, Sara JD, et al. Cardiac resynchronization therapy in patients with end-stage hypertrophic cardiomyopathy. EP Europace. 2018;20(1):82-88. https://doi.org/10.1093/EUROPACE/EUW327
- Gu M, Jin H, Hua W, et al. Clinical outcome of cardiac resynchronization therapy in dilated-phase hypertrophic cardiomyopathy. Journal of Geriatric Cardiology : JGC. 2017;14(4):238. https://doi.org/10.11909/J.ISSN.1671-5411.2017.04.002
- Rogers DPS, Marazia S, Chow AW, et al. Effect of biventricular pacing on symptoms and cardiac remodelling in patients with end-stage hypertrophic cardiomyopathy. Eur J Heart Fail. 2008;10(5):507-513. https://doi.org/10.1016/J.EJHEART.2008.03.006
- Maron BJ, Spirito P, Ackerman MJ, et al. Prevention of sudden cardiac death with implantable cardioverter-defibrillators in children and adolescents with hypertrophic cardiomyopathy. J Am Coll Cardiol. 2013;61(14):1527-1535.
- Bettin M, Larbig R, Rath B, et al. Long-Term Experience With the Subcutaneous Implantable Cardioverter-Defibrillator in Teenagers and Young Adults. JACC Clin Electrophysiol. 2017;3(13):1499-1506. https://doi.org/10.1016/J.JACEP.2017.08.017
- Silvetti MS, Pazzano V, Verticelli L, et al. Subcutaneous implantable cardioverter-defibrillator: is it ready for use in children and young adults? A single-centre study. Europace. 2018;20(12):1966-1973. https://doi.org/10.1093/EUROPACE/EUY139
- Pettit SJ, McLean A, Colquhoun I, Connelly D, McLeod K. Clinical experience of subcutaneous and transvenous implantable cardioverter defibrillators in children and teenagers. Pacing Clin Electrophysiol. 2013;36(12):1532-1538. https://doi.org/10.1111/PACE.12233
- Yancy CW, Jessup M, Bozkurt B, et al. 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation/American Heart Association Task Force on practice guidelines. Circulation. 2013;128(16). https://doi.org/10.1161/CIR.0B013E31829E8776
- Rowin EJ, Mohanty S, Madias C, Maron BJ, Maron MS. Benefit of Cardiac Resynchronization Therapy in End-Stage Nonobstructive Hypertrophic Cardiomyopathy. JACC Clin Electrophysiol. 2019;5(1):131-133. https://doi.org/10.1016/J.JACEP.2018.08.018
- Cappelli F, Morini S, Pieragnoli P, et al. Cardiac Resynchronization Therapy for End-Stage Hypertrophic Cardiomyopathy: The Need for Disease-Specific Criteria. J Am Coll Cardiol. 2018;71(4):464-466. https://doi.org/10.1016/J.JACC.2017.11.040
- Friedman PA, McClelland RL, Bamlet WR, et al. Dual-chamber versus single-chamber detection enhancements for implantable defibrillator rhythm diagnosis: the detect supraventricular tachycardia study. Circulation. 2006;113(25):2871-2879. https://doi.org/10.1161/CIRCULATIONAHA.105.594531
- Theuns DAMJ, Klootwijk APJ, Goedhart DM, Jordaens LJLM. Prevention of inappropriate therapy in implantable cardioverter-defibrillators: results of a prospective, randomized study of tachyarrhythmia detection algorithms. J Am Coll Cardiol. 2004;44(12):2362-2367. https://doi.org/10.1016/J.JACC.2004.09.039
- Kolb C, Sturmer M, Sick P, et al. Reduced risk for inappropriate implantable cardioverter-defibrillator shocks with dual-chamber therapy compared with single-chamber therapy: results of the randomized OPTION study. JACC Heart Fail. 2014;2(6):611-619. https://doi.org/10.1016/J.JCHF.2014.05.015
- Peterson PN, Greenlee RT, Go AS, et al. Comparison of Inappropriate Shocks and Other Health Outcomes Between Single- and Dual-Chamber Implantable Cardioverter-Defibrillators for Primary Prevention of Sudden Cardiac Death: Results From the Cardiovascular Research Network Longitudinal Study of Implantable Cardioverter-Defibrillators. J Am Heart Assoc. 2017;6(11). https://doi.org/10.1161/JAHA.117.006937
- Defaye P, Boveda S, Klug D, et al. Dual- vs. single-chamber defibrillators for primary prevention of sudden cardiac death: long-term follow-up of the Défibrillateur Automatique Implantable-Prévention Primaire registry. Europace. 2017;19(9):1478-1484. https://doi.org/10.1093/EUROPACE/EUW230
- Hu ZY, Zhang J, Xu ZT, et al. Efficiencies and Complications of Dual Chamber versus Single Chamber Implantable Cardioverter Defibrillators in Secondary Sudden Cardiac Death Prevention: A Meta-analysis. Heart Lung Circ. 2016;25(2):148-154. https://doi.org/10.1016/J.HLC.2015.07.008
- COHEN LS, BRAUNWALD E. Amelioration of angina pectoris in idiopathic hypertrophic subaortic stenosis with beta-adrenergic blockade. Circulation. 1967;35(5):847-851.
- Adelman AG, Shah PM, Gramiak R, Wigle ED. Long-term propranolol therapy in muscular subaortic stenosis. Heart. 1970;32(6):804-811.
- Stenson RE, Flamm Jr MD, Harrison DC, Hancock EW. Hypertrophic subaortic stenosis: clinical and hemodynamic effects of long-term propranolol therapy. Am J Cardiol. 1973;31(6):763-773.
- Bonow RO, Rosing DR, Bacharach SL, et al. Effects of verapamil on left ventricular systolic function and diastolic filling in patients with hypertrophic cardiomyopathy. Circulation. 1981;64(4):787-796. https://doi.org/10.1161/01.CIR.64.4.787
- TOSHIMA H, KOGA Y, NAGATA H, TOYOMASU K, ITAYA K ichi, MATOBA T. Comparable Effects of Oral Diltiazem and Verapamil in the Treatment of Hypertrophic Cardiomyopathy Double-blind Crossover Study. Jpn Heart J. 1986;27(5):701-715.
- Rosing DR, Kent KM, Maron BJ, Epstein SE. Verapamil Therapy: A New Approach to the Pharmacologic Treatment of Hypertrophic Cardiomyopathy II. Effects on Exercise Capacity and Symptomatic Status. Accessed May 16, 2022. http://ahajournals.org
- Sherrid M v, Barac I, McKenna WJ, et al. Multicenter study of the efficacy and safety of disopyramide in obstructive hypertrophic cardiomyopathy. J Am Coll Cardiol. 2005;45(8):1251-1258.
- Sherrid M v, Shetty A, Winson G, et al. Treatment of obstructive hypertrophic cardiomyopathy symptoms and gradient resistant to first-line therapy with β-blockade or verapamil. Circulation: Heart Failure. 2013;6(4):694-702.
- Adler A, Fourey D, Weissler‐Snir A, et al. Safety of outpatient initiation of disopyramide for obstructive hypertrophic cardiomyopathy patients. J Am Heart Assoc. 2017;6(6):e005152.
- Maron BJ, Dearani JA, Ommen SR, et al. Low operative mortality achieved with surgical septal myectomy: role of dedicated hypertrophic cardiomyopathy centers in the management of dynamic subaortic obstruction. J Am Coll Cardiol. 2015;66(11):1307-1308.
- Ommen SR, Maron BJ, Olivotto I, et al. Long-term effects of surgical septal myectomy on survival in patients with obstructive hypertrophic cardiomyopathy. J Am Coll Cardiol. 2005;46(3):470-476.
- Braunwald E, Ebert PA. Hemodynamic alterations in idiopathic hypertrophic subaortic stenosis induced by sympathomimetic drugs∗. The American Journal of Cardiology. 1962;10(4):489-495. https://doi.org/10.1016/0002-9149(62)90373-9
- Maron MS, Olivotto I, Zenovich AG, et al. Hypertrophic cardiomyopathy is predominantly a disease of left ventricular outflow tract obstruction. Circulation. 2006;114(21):2232-2239.
- Kirk CR, Gibbs JL, Thomas R, Radley-Smith R, Qureshi SA. Cardiovascular collapse after verapamil in supraventricular tachycardia. Arch Dis Child. 1987;62(12):1265-1266.
- Moran AM, Colan SD. Verapamil therapy in infants with hypertrophic cardiomyopathy. Cardiol Young. 1998;8(3):310-319.
- Florian Rader. EXPLORER-LTE cohort of the MAVA-LTE extension study . In: Presented at: ACC April 3. ACC; 2022.
- Florian Rader. EXPLORER-HCM Presented at the American College of Cardiology Annual Scientific Session (ACC 2022). In: Presented at: ACC April 3. ; 2022.
- VALOR-HCM: Mavacamten Significantly Reduces Need For Surgical Intervention in Patients With Obstructive HCM – American College of Cardiology. Accessed May 5, 2022. https://www.acc.org/Latest-in-Cardiology/Articles/2022/03/31/20/23/Sat-930am-VALOR-HCM-acc-2022
- Rowin EJ, Maron BJ, Lesser JR, Rastegar H, Maron MS. Papillary muscle insertion directly into the anterior mitral leaflet in hypertrophic cardiomyopathy, its identification and cause of outflow obstruction by cardiac magnetic resonance imaging, and its surgical management. Am J Cardiol. 2013;111(11):1677-1679. https://doi.org/10.1016/J.AMJCARD.2013.01.340
- di Tommaso L, Stassano P, Mannacio V, et al. Asymmetric septal hypertrophy in patients with severe aortic stenosis: the usefulness of associated septal myectomy. J Thorac Cardiovasc Surg. 2013;145(1):171-175. https://doi.org/10.1016/J.JTCVS.2011.10.096
- Teo EP, Teoh JG, Hung J. Mitral valve and papillary muscle abnormalities in hypertrophic obstructive cardiomyopathy. Curr Opin Cardiol. 2015;30(5):475-482. https://doi.org/10.1097/HCO.0000000000000200
- Batzner A, Pfeiffer B, Neugebauer A, Aicha D, Blank C, Seggewiss H. Survival After Alcohol Septal Ablation in Patients With Hypertrophic Obstructive Cardiomyopathy. J Am Coll Cardiol. 2018;72(24):3087-3094. https://doi.org/10.1016/J.JACC.2018.09.064
- Nguyen A, Schaff H v., Hang D, et al. Surgical myectomy versus alcohol septal ablation for obstructive hypertrophic cardiomyopathy: A propensity score-matched cohort. J Thorac Cardiovasc Surg. 2019;157(1):306-315.e3. https://doi.org/10.1016/J.JTCVS.2018.08.062
- Kimmelstiel C, Zisa DC, Kuttab JS, et al. Guideline-Based Referral for Septal Reduction Therapy in Obstructive Hypertrophic Cardiomyopathy Is Associated With Excellent Clinical Outcomes. Circ Cardiovasc Interv. 2019;12(7). https://doi.org/10.1161/CIRCINTERVENTIONS.118.007673
- Mitra A, Ghosh RK, Bandyopadhyay D, Ghosh GC, Kalra A, Lavie CJ. Significance of Pulmonary Hypertension in Hypertrophic Cardiomyopathy. Curr Probl Cardiol. 2020;45(6). https://doi.org/10.1016/J.CPCARDIOL.2018.10.002
- Ong KC, Geske JB, Hebl VB, et al. Pulmonary hypertension is associated with worse survival in hypertrophic cardiomyopathy. European heart journal Cardiovascular Imaging. 2016;17(6):604-610. https://doi.org/10.1093/EHJCI/JEW024
- Desai MY, Bhonsale A, Patel P, et al. Exercise echocardiography in asymptomatic HCM: Exercise capacity, and not LV outflow tract gradient predicts long-term outcomes. JACC: Cardiovascular Imaging. 2014;7(1):26-36. https://doi.org/10.1016/J.JCMG.2013.08.010
- Nguyen A, Schaff H v., Nishimura RA, et al. Determinants of Reverse Remodeling of the Left Atrium After Transaortic Myectomy. Ann Thorac Surg. 2018;106(2):447-453. https://doi.org/10.1016/J.ATHORACSUR.2018.03.039
- Finocchiaro G, Haddad F, Kobayashi Y, et al. Impact of Septal Reduction on Left Atrial Size and Diastole in Hypertrophic Cardiomyopathy. Echocardiography. 2016;33(5):686-694. https://doi.org/10.1111/ECHO.13158
- Blackshear JL, Kusumoto H, Safford RE, et al. Usefulness of Von Willebrand Factor Activity Indexes to Predict Therapeutic Response in Hypertrophic Cardiomyopathy. Am J Cardiol. 2016;117(3):436-442. https://doi.org/10.1016/J.AMJCARD.2015.11.016
- Blackshear JL, Stark ME, Agnew RC, et al. Remission of recurrent gastrointestinal bleeding after septal reduction therapy in patients with hypertrophic obstructive cardiomyopathy-associated acquired von Willebrand syndrome. J Thromb Haemost. 2015;13(2):191-196. https://doi.org/10.1111/JTH.12780
- Desai MY, Smedira NG, Dhillon A, et al. Prediction of sudden death risk in obstructive hypertrophic cardiomyopathy: Potential for refinement of current criteria. J Thorac Cardiovasc Surg. 2018;156(2):750-759.e3. https://doi.org/10.1016/J.JTCVS.2018.03.150
- McLeod CJ, Ommen SR, Ackerman MJ, et al. Surgical septal myectomy decreases the risk for appropriate implantable cardioverter defibrillator discharge in obstructive hypertrophic cardiomyopathy. Eur Heart J. 2007;28(21):2583-2588. https://doi.org/10.1093/EURHEARTJ/EHM117
- Nishimura RA, Otto CM, Bonow RO, et al. 2017 AHA/ACC Focused Update of the 2014 AHA/ACC Guideline for the Management of Patients With Valvular Heart Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation. 2017;135(25):e1159-e1195. https://doi.org/10.1161/CIR.0000000000000503
- Kim LK, Swaminathan R v., Looser P, et al. Hospital Volume Outcomes After Septal Myectomy and Alcohol Septal Ablation for Treatment of Obstructive Hypertrophic Cardiomyopathy: US Nationwide Inpatient Database, 2003-2011. JAMA Cardiol. 2016;1(3):324-332. https://doi.org/10.1001/JAMACARDIO.2016.0252
- Pelliccia F, Pasceri V, Limongelli G, … CAI journal of, 2017 undefined. Long-term outcome of nonobstructive versus obstructive hypertrophic cardiomyopathy: a systematic review and meta-analysis. Elsevier. Accessed May 12, 2022. https://www.sciencedirect.com/science/article/pii/S016752731730726X
- Gersh BJ, Maron BJ, Bonow RO, et al. 2011 ACCF/AHA Guideline for the Diagnosis and Treatment of Hypertrophic Cardiomyopathy: A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines Developed in Collaboration With the American Association for Thoracic Surgery, American Society of Echocardiography, American Society of Nuclear Cardiology, Heart Failure Society of America, Heart Rhythm Society, Society for Cardiovascular Angiography and Interventions, and Society of Thoraci. J Am Coll Cardiol. 2011;58(25):e212-e260. https://doi.org/10.1016/J.JACC.2011.06.011
- Yancy CW, Mariell Jessup C, Chair Biykem Bozkurt V, et al. 2017 ACC/AHA/HFSA Focused Update of the 2013 ACCF/AHA Guideline for the Management of Heart Failure: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Failure Society of America. J Am Coll Cardiol. 2017;70(6):776-803. https://doi.org/10.1016/J.JACC.2017.04.025
- Spoladore R, Maron MS, D’Amato R, Camici PG, Olivotto I. Pharmacological treatment options for hypertrophic cardiomyopathy: high time for evidence. European Heart Journal. 2012;33(14):1724-1733. https://doi.org/10.1093/EURHEARTJ/EHS150
- Axelsson A, Iversen K, Vejlstrup N, et al. Efficacy and safety of the angiotensin II receptor blocker losartan for hypertrophic cardiomyopathy: the INHERIT randomised, double-blind, placebo-controlled trial. Lancet Diabetes Endocrinol. 2015;3(2):123-131. https://doi.org/10.1016/S2213-8587(14)70241-4
- Nguyen A, Schaff H v., Nishimura RA, et al. Apical myectomy for patients with hypertrophic cardiomyopathy and advanced heart failure. The Journal of Thoracic and Cardiovascular Surgery. 2020;159(1):145-152. https://doi.org/10.1016/J.JTCVS.2019.03.088
- Bourmayan C, Razavi A, Fournier C, et al. Effect of propranolol on left ventricular relaxation in hypertrophic cardiomyopathy: An echographic study. American Heart Journal. 1985;109(6):1311-1316. https://doi.org/10.1016/0002-8703(85)90357-6
- Alvares RF, Goodwin JF. Non-invasive assessment of diastolic function in hypertrophic cardiomyopathy on and off beta adrenergic blocking drugs. Br Heart J. 1982;48(3):204-212. https://doi.org/10.1136/HRT.48.3.204
- Wilmshurst PT, Thompson DS, Juul SM, Jenkins BS, Webb-Peploe MM. Effects of verapamil on haemodynamic function and myocardial metabolism in patients with hypertrophic cardiomyopathy. Br Heart J. 1986;56(6):544-553. https://doi.org/10.1136/HRT.56.6.544
- Udelson JE, Bonow RO, O’Gara PT, et al. Verapamil prevents silent myocardial perfusion abnormalities during exercise in asymptomatic patients with hypertrophic cardiomyopathy. Circulation. 1989;79(5):1052-1060. https://doi.org/10.1161/01.CIR.79.5.1052
- Pacileo G, de Cristofaro M, Russo MG, Sarubbi B, Pisacane C, Calabrò R. Hypertrophic cardiomyopathy in pediatric patients: effect of verapamil on regional and global left ventricular diastolic function. The Canadian Journal of Cardiology. 2000;16(2):146-152.
- Guttmann OP, Pavlou M, O’Mahony C, et al. Prediction of thrombo-embolic risk in patients with hypertrophic cardiomyopathy (HCM Risk-CVA). Eur J Heart Fail. 2015;17(8):837-845. https://doi.org/10.1002/EJHF.316
- Jung H, Yang PS, Jang E, et al. Effectiveness and Safety of Non-Vitamin K Antagonist Oral Anticoagulants in Patients With Atrial Fibrillation With Hypertrophic Cardiomyopathy: A Nationwide Cohort Study. Chest. 2019;155(2):354-363. https://doi.org/10.1016/J.CHEST.2018.11.009
- Noseworthy PA, Yao X, Shah ND, Gersh BJ. Stroke and Bleeding Risks in NOAC- and Warfarin-Treated Patients With Hypertrophic Cardiomyopathy and Atrial Fibrillation. J Am Coll Cardiol. 2016;67(25):3020-3021. https://doi.org/10.1016/J.JACC.2016.04.026
- Dominguez F, Climent V, Zorio E, et al. Direct oral anticoagulants in patients with hypertrophic cardiomyopathy and atrial fibrillation. Int J Cardiol. 2017;248:232-238. https://doi.org/10.1016/J.IJCARD.2017.08.010
- Page RL, Joglar JA, Caldwell MA, et al. 2015 ACC/AHA/HRS guideline for the management of adult patients with supraventricular tachycardia: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society. Heart Rhythm. 2016;13(4):e136-e221. https://doi.org/10.1016/J.HRTHM.2015.09.019
- Wilke I, Witzel K, MÜnch J, et al. High Incidence of De Novo and Subclinical Atrial Fibrillation in Patients With Hypertrophic Cardiomyopathy and Cardiac Rhythm Management Device. J Cardiovasc Electrophysiol. 2016;27(7):779-784. https://doi.org/10.1111/JCE.12982
- Mahajan R, Perera T, Elliott AD, et al. Subclinical device-detected atrial fibrillation and stroke risk: a systematic review and meta-analysis. Eur Heart J. 2018;39(16):1407-1415. https://doi.org/10.1093/EURHEARTJ/EHX731
- Rowin EJ, Hausvater A, Link MS, et al. Clinical Profile and Consequences of Atrial Fibrillation in Hypertrophic Cardiomyopathy. Circulation. 2017;136(25):2420-2436. https://doi.org/10.1161/CIRCULATIONAHA.117.029267
- Tanel RE, Walsh EP, Lulu JA, Saul JP. Sotalol for refractory arrhythmias in pediatric and young adult patients: initial efficacy and long-term outcome. Am Heart J. 1995;130(4):791-797. https://doi.org/10.1016/0002-8703(95)90079-9
- Zhao DS, Shen Y, Zhang Q, et al. Outcomes of catheter ablation of atrial fibrillation in patients with hypertrophic cardiomyopathy: a systematic review and meta-analysis. Europace. 2016;18(4):508-520. https://doi.org/10.1093/EUROPACE/EUV339
- Lapenna E, Pozzoli A, de Bonis M, et al. Mid-term outcomes of concomitant surgical ablation of atrial fibrillation in patients undergoing cardiac surgery for hypertrophic cardiomyopathy†. Eur J Cardiothorac Surg. 2017;51(6):1112-1118. https://doi.org/10.1093/EJCTS/EZX017
- Guttmann OP, Rahman MS, O’Mahony C, Anastasakis A, Elliott PM. Atrial fibrillation and thromboembolism in patients with hypertrophic cardiomyopathy: systematic review. Heart. 2014;100(6):465-472. https://doi.org/10.1136/HEARTJNL-2013-304276
- Noseworthy PA, Yao X, Shah ND, Gersh BJ. Stroke and Bleeding Risks in NOAC- and Warfarin-Treated Patients With Hypertrophic Cardiomyopathy and Atrial Fibrillation. J Am Coll Cardiol. 2016;67(25):3020-3021. https://doi.org/10.1016/J.JACC.2016.04.026
- Dominguez F, Climent V, Zorio E, et al. Direct oral anticoagulants in patients with hypertrophic cardiomyopathy and atrial fibrillation. Int J Cardiol. 2017;248:232-238. https://doi.org/10.1016/J.IJCARD.2017.08.010
- Maron BJ, Olivotto I, Bellone P, et al. Clinical profile of stroke in 900 patients with hypertrophic cardiomyopathy. J Am Coll Cardiol. 2002;39(2):301-307. https://doi.org/10.1016/S0735-1097(01)01727-2
- van Velzen HG, Theuns DAMJ, Yap SC, Michels M, Schinkel AFL. Incidence of Device-Detected Atrial Fibrillation and Long-Term Outcomes in Patients With Hypertrophic Cardiomyopathy. Am J Cardiol. 2017;119(1):100-105. https://doi.org/10.1016/J.AMJCARD.2016.08.092
- Wilke I, Witzel K, MÜnch J, et al. High Incidence of De Novo and Subclinical Atrial Fibrillation in Patients With Hypertrophic Cardiomyopathy and Cardiac Rhythm Management Device. J Cardiovasc Electrophysiol. 2016;27(7):779-784. https://doi.org/10.1111/JCE.12982
- Santangeli P, Biase L di, Themistoclakis S, et al. Catheter ablation of atrial fibrillation in hypertrophic cardiomyopathy: long-term outcomes and mechanisms of arrhythmia recurrence. Circ Arrhythm Electrophysiol. 2013;6(6):1089-1094. https://doi.org/10.1161/CIRCEP.113.000339
- Providencia R, Elliott P, Patel K, et al. Catheter ablation for atrial fibrillation in hypertrophic cardiomyopathy: a systematic review and meta-analysis. Heart. 2016;102(19):1533-1543. https://doi.org/10.1136/HEARTJNL-2016-309406
- Bogachev-Prokophiev A v., Afanasyev A v., Zheleznev SI, et al. Concomitant ablation for atrial fibrillation during septal myectomy in patients with hypertrophic obstructive cardiomyopathy. J Thorac Cardiovasc Surg. 2018;155(4):1536-1542.e2. https://doi.org/10.1016/J.JTCVS.2017.08.063
- Rowin EJ, Maron BJ, Abt P, et al. Impact of Advanced Therapies for Improving Survival to Heart Transplant in Patients with Hypertrophic Cardiomyopathy. Am J Cardiol. 2018;121(8):986-996. https://doi.org/10.1016/J.AMJCARD.2017.12.044
- Rowin EJ, Maron BJ, Kiernan MS, et al. Advanced heart failure with preserved systolic function in nonobstructive hypertrophic cardiomyopathy: under-recognized subset of candidates for heart transplant. Circ Heart Fail. 2014;7(6):967-975. https://doi.org/10.1161/CIRCHEARTFAILURE.114.001435
- Connolly SJ, Dorian P, Roberts RS, et al. Comparison of beta-blockers, amiodarone plus beta-blockers, or sotalol for prevention of shocks from implantable cardioverter defibrillators: the OPTIC Study: a randomized trial. JAMA. 2006;295(2):165-171. https://doi.org/10.1001/JAMA.295.2.165
- Santangeli P, Muser D, Maeda S, et al. Comparative effectiveness of antiarrhythmic drugs and catheter ablation for the prevention of recurrent ventricular tachycardia in patients with implantable cardioverter-defibrillators: A systematic review and meta-analysis of randomized controlled trials. Heart Rhythm. 2016;13(7):1552-1559. https://doi.org/10.1016/J.HRTHM.2016.03.004
- Baquero GA, Banchs JE, Depalma S, et al. Dofetilide reduces the frequency of ventricular arrhythmias and implantable cardioverter defibrillator therapies. J Cardiovasc Electrophysiol. 2012;23(3):296-301. https://doi.org/10.1111/J.1540-8167.2011.02183.X
- Gao D, van Herendael H, Alshengeiti L, et al. Mexiletine as an adjunctive therapy to amiodarone reduces the frequency of ventricular tachyarrhythmia events in patients with an implantable defibrillator. J Cardiovasc Pharmacol. 2013;62(2):199-204. https://doi.org/10.1097/FJC.0B013E31829651FE
- Link MS, Bockstall K, Weinstock J, et al. Ventricular Tachyarrhythmias in Patients With Hypertrophic Cardiomyopathy and Defibrillators: Triggers, Treatment, and Implications. J Cardiovasc Electrophysiol. 2017;28(5):531-537. https://doi.org/10.1111/JCE.13194
- Wilkoff BL, et al. 2015 HRS/EHRA/APHRS/SOLAECE expert consensus statement on optimal implantable cardioverter-defibrillator programming and testing. Europace. 2017;19(4):580. https://doi.org/10.1093/EUROPACE/EUW260
- Santangeli P, di Biase L, Lakkireddy D, et al. Radiofrequency catheter ablation of ventricular arrhythmias in patients with hypertrophic cardiomyopathy: safety and feasibility. Heart Rhythm. 2010;7(8):1036-1042. https://doi.org/10.1016/J.HRTHM.2010.05.022
- Igarashi M, Nogami A, Kurosaki K, et al. Radiofrequency Catheter Ablation of Ventricular Tachycardia in Patients With Hypertrophic Cardiomyopathy and Apical Aneurysm. JACC: Clinical Electrophysiology. 2018;4(3):339-350. https://doi.org/10.1016/J.JACEP.2017.12.020
- Dukkipati SR, D’Avila A, Soejima K, et al. Long-term outcomes of combined epicardial and endocardial ablation of monomorphic ventricular tachycardia related to hypertrophic cardiomyopathy. Circ Arrhythm Electrophysiol. 2011;4(2):185-194. https://doi.org/10.1161/CIRCEP.110.957290
- Borne RT, Varosy PD, Masoudi FA. Implantable cardioverter-defibrillator shocks: epidemiology, outcomes, and therapeutic approaches. JAMA Intern Med. 2013;173(10):859-865. https://doi.org/10.1001/JAMAINTERNMED.2013.428
- Mehra MR, Canter CE, Hannan MM, et al. The 2016 International Society for Heart Lung Transplantation listing criteria for heart transplantation: A 10-year update. J Heart Lung Transplant. 2016;35(1):1-23. https://doi.org/10.1016/J.HEALUN.2015.10.023
- Raskin JS, Liu JJ, Abrao A, Holste K, Raslan AM, Balaji S. Minimally invasive posterior extrapleural thoracic sympathectomy in children with medically refractory arrhythmias. Heart Rhythm. 2016;13(7):1381-1385. https://doi.org/10.1016/J.HRTHM.2016.03.041
- Maron BJ, Shen WK, Link MS, et al. Efficacy of implantable cardioverter-defibrillators for the prevention of sudden death in patients with hypertrophic cardiomyopathy. N Engl J Med. 2000;342(6):365-373. https://doi.org/10.1056/NEJM200002103420601
- Nguyen A, Schaff H v. Electrical storms in patients with apical aneurysms and hypertrophic cardiomyopathy with midventricular obstruction: A case series. J Thorac Cardiovasc Surg. 2017;154(6):e101-e103. https://doi.org/10.1016/J.JTCVS.2017.06.002
- Hebl VB, Miranda WR, Ong KC, et al. The Natural History of Nonobstructive Hypertrophic Cardiomyopathy. Mayo Clin Proc. 2016;91(3):279-287. https://doi.org/10.1016/J.MAYOCP.2016.01.002
- Rowin EJ, Maron MS, Chan RH, et al. Interaction of Adverse Disease Related Pathways in Hypertrophic Cardiomyopathy. Am J Cardiol. 2017;120(12):2256-2264. https://doi.org/10.1016/J.AMJCARD.2017.08.048
- Melacini P, Basso C, Angelini A, et al. Clinicopathological profiles of progressive heart failure in hypertrophic cardiomyopathy. Eur Heart J. 2010;31(17):2111-2123. https://doi.org/10.1093/EURHEARTJ/EHQ136
- Pasqualucci D, Fornaro A, Castelli G, et al. Clinical Spectrum, Therapeutic Options, and Outcome of Advanced Heart Failure in Hypertrophic Cardiomyopathy. Circ Heart Fail. 2015;8(6):1014-1021. https://doi.org/10.1161/CIRCHEARTFAILURE.114.001843
- Coats CJ, Rantell K, Bartnik A, et al. Cardiopulmonary Exercise Testing and Prognosis in Hypertrophic Cardiomyopathy. Circ Heart Fail. 2015;8(6):1022-1031. https://doi.org/10.1161/CIRCHEARTFAILURE.114.002248
- Magrì D, Re F, Limongelli G, et al. Heart Failure Progression in Hypertrophic Cardiomyopathy – Possible Insights From Cardiopulmonary Exercise Testing. Circ J. 2016;80(10):2204-2211. https://doi.org/10.1253/CIRCJ.CJ-16-0432
- Kato TS, Takayama H, Yoshizawa S, et al. Cardiac transplantation in patients with hypertrophic cardiomyopathy. Am J Cardiol. 2012;110(4):568-574. https://doi.org/10.1016/J.AMJCARD.2012.04.030
- Topilsky Y, Pereira NL, Shah DK, et al. Left ventricular assist device therapy in patients with restrictive and hypertrophic cardiomyopathy. Circ Heart Fail. 2011;4(3):266-275. https://doi.org/10.1161/CIRCHEARTFAILURE.110.959288
- Killu AM, Park JY, Sara JD, et al. Cardiac resynchronization therapy in patients with end-stage hypertrophic cardiomyopathy. Europace. 2018;20(1):82-88. https://doi.org/10.1093/EUROPACE/EUW327
- Rogers DPS, Marazia S, Chow AW, et al. Effect of biventricular pacing on symptoms and cardiac remodelling in patients with end-stage hypertrophic cardiomyopathy. Eur J Heart Fail. 2008;10(5):507-513. https://doi.org/10.1016/J.EJHEART.2008.03.006
- Gu M, Jin H, Hua W, et al. Clinical outcome of cardiac resynchronization therapy in dilated-phase hypertrophic cardiomyopathy. J Geriatr Cardiol. 2017;14(4):238-244. https://doi.org/10.11909/J.ISSN.1671-5411.2017.04.002
- Cappelli F, Morini S, Pieragnoli P, et al. Cardiac Resynchronization Therapy for End-Stage Hypertrophic Cardiomyopathy: The Need for Disease-Specific Criteria. J Am Coll Cardiol. 2018;71(4):464-466. https://doi.org/10.1016/J.JACC.2017.11.040
- Musumeci MB, Russo D, Limite LR, et al. Long-Term Left Ventricular Remodeling of Patients With Hypertrophic Cardiomyopathy. Am J Cardiol. 2018;122(11):1924-1931. https://doi.org/10.1016/J.AMJCARD.2018.08.041
- Yancy CW, Jessup M, Bozkurt B, et al. 2016 ACC/AHA/HFSA Focused Update on New Pharmacological Therapy for Heart Failure: An Update of the 2013 ACCF/AHA Guideline for the Management of Heart Failure: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Failure Society of America. Circulation. 2016;134(13):e282-e293. https://doi.org/10.1161/CIR.0000000000000435
- Grupper A, Park SJ, Pereira NL, et al. Role of ventricular assist therapy for patients with heart failure and restrictive physiology: Improving outcomes for a lethal disease. J Heart Lung Transplant. 2015;34(8):1042-1049. https://doi.org/10.1016/J.HEALUN.2015.03.012
- Muthiah K, Phan J, Robson D, et al. Centrifugal continuous-flow left ventricular assist device in patients with hypertrophic cardiomyopathy: a case series. ASAIO J. 2013;59(2):183-187. https://doi.org/10.1097/MAT.0B013E318286018D
- Patel SR, Saeed O, Naftel D, et al. Outcomes of Restrictive and Hypertrophic Cardiomyopathies After LVAD: An INTERMACS Analysis. J Card Fail. 2017;23(12):859-867. https://doi.org/10.1016/J.CARDFAIL.2017.09.011
- Saberi S, Wheeler M, Bragg-Gresham J, et al. Effect of moderate-intensity exercise training on peak oxygen consumption in patients with hypertrophic cardiomyopathy: a randomized clinical trial. Jama. 2017;317(13):1349-1357.
- Maron BJ, Levine BD, Washington RL, Baggish AL, Kovacs RJ, Maron MS. Eligibility and Disqualification Recommendations for Competitive Athletes with Cardiovascular Abnormalities: Task Force 2: Preparticipation Screening for Cardiovascular Disease in Competitive Athletes: A Scientific Statement from the American Heart Association and American College of Cardiology. Circulation. 2015;132(22):e267-e272. https://doi.org/10.1161/CIR.0000000000000238
- Turkowski KL, Martijn Bos J, Ackerman NC, Rohatgi RK, Ackerman MJ. Return-to-play for athletes with genetic heart diseases. Circulation. 2018;137(10):1086-1088. https://doi.org/10.1161/CIRCULATIONAHA.117.031306
- US Department of Transportation FAAdministration. Medical Certification. Accessed June 25, 2022. https://www.faa.gov/licenses_certificates/medical_certification/
- Bateman BT. What’s New in Obstetric Anesthesia: a focus on maternal morbidity and mortality. Int J Obstet Anesth. 2019;37:68-72. https://doi.org/10.1016/J.IJOA.2018.09.004
- Sillesen M, Hjortdal V, Vejlstrup N, Sørensen K. Pregnancy with prosthetic heart valves – 30 years’ nationwide experience in Denmark. Eur J Cardiothorac Surg. 2011;40(2):448-454. https://doi.org/10.1016/J.EJCTS.2010.12.011
- Eleid MF, Konecny T, Orban M, et al. High prevalence of abnormal nocturnal oximetry in patients with hypertrophic cardiomyopathy. J Am Coll Cardiol. 2009;54(19):1805-1809. https://doi.org/10.1016/J.JACC.2009.07.030
- Claes GRF, van Tienen FHJ, Lindsey P, et al. Hypertrophic remodelling in cardiac regulatory myosin light chain (MYL2) founder mutation carriers. Eur Heart J. 2016;37(23):1815-1822. https://doi.org/10.1093/EURHEARTJ/EHV522
- Regitz-Zagrosek V, Roos-Hesselink JW, Bauersachs J, et al. 2018 ESC Guidelines for the management of cardiovascular diseases during pregnancy. Eur Heart J. 2018;39(34):3165-3241. https://doi.org/10.1093/EURHEARTJ/EHY340
- Fumagalli C, Maurizi N, Day SM, et al. Association of Obesity With Adverse Long-term Outcomes in Hypertrophic Cardiomyopathy. JAMA Cardiol. 2020;5(1):65-72. https://doi.org/10.1001/JAMACARDIO.2019.4268
- Smith JR, Medina-Inojosa JR, Layrisse V, Ommen SR, Olson TP. Predictors of Exercise Capacity in Patients with Hypertrophic Obstructive Cardiomyopathy. J Clin Med. 2018;7(11). https://doi.org/10.3390/JCM7110447
- Thaman R, Varnava A, Hamid MS, et al. Pregnancy related complications in women with hypertrophic cardiomyopathy. Heart. 2003;89(7):752-756. https://doi.org/10.1136/HEART.89.7.752
- Claes GRF, van Tienen FHJ, Lindsey P, et al. Hypertrophic remodelling in cardiac regulatory myosin light chain (MYL2) founder mutation carriers. Eur Heart J. 2016;37(23):1815-1822. https://doi.org/10.1093/EURHEARTJ/EHV522
- Wang S, Cui H, Song C, et al. Obstructive sleep apnea is associated with nonsustained ventricular tachycardia in patients with hypertrophic obstructive cardiomyopathy. Heart Rhythm. 2019;16(5):694-701. https://doi.org/10.1016/J.HRTHM.2018.12.017
- Miller CAS, Maron MS, Estes NAM, et al. Safety, Side Effects and Relative Efficacy of Medications for Rhythm Control of Atrial Fibrillation in Hypertrophic Cardiomyopathy. Am J Cardiol. 2019;123(11):1859-1862. https://doi.org/10.1016/J.AMJCARD.2019.02.051
- Elliott PM, Anastasakis A, Borger MA, et al. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy. Kardiologia Polska (Polish Heart Journal). 2014;72(11):1054-1126.
- Colan SD, Lipshultz SE, Lowe AM, et al. Epidemiology and cause-specific outcome of hypertrophic cardiomyopathy in children: findings from the Pediatric Cardiomyopathy Registry. Circulation. 2007;115(6):773-781. https://doi.org/10.1161/CIRCULATIONAHA.106.621185
- Nugent AW, Daubeney PEF, Chondros P, et al. The epidemiology of childhood cardiomyopathy in Australia. N Engl J Med. 2003;348(17):1639-1646. https://doi.org/10.1056/NEJMOA021737
- Limongelli G, Monda E, Tramonte S, et al. Prevalence and clinical significance of red flags in patients with hypertrophic cardiomyopathy. Int J Cardiol. 2020;299:186-191. https://doi.org/10.1016/J.IJCARD.2019.06.073
- Maron BJ, Doerer JJ, Haas TS, Tierney DM, Mueller FO. Sudden deaths in young competitive athletes analysis of 1866 deaths in the united states, 1980-2006. Circulation. 2009;119(8):1085-1092. https://doi.org/10.1161/CIRCULATIONAHA.108.804617
- Wilkinson JD, Lowe AM, Salbert BA, et al. Outcomes in children with Noonan syndrome and hypertrophic cardiomyopathy: a study from the Pediatric Cardiomyopathy Registry. Am Heart J. 2012;164(3):442-448. https://doi.org/10.1016/J.AHJ.2012.04.018
- Lai WW, Cohen MS, Geva T, Mertens L (Eds), Colan SD. Normal echocardiographic values for cardiovascular structures, Appendix 1. Echocardiography in Pediatric and Congenital Heart Disease,. Wiley-Blackwell, West Sussex, UK. Published online August 5, 2009:p.765. https://doi.org/10.1002/9781444306309.FMATTER
- Shapiro LM, McKenna WJ. Distribution of left ventricular hypertrophy in hypertrophic cardiomyopathy: a two-dimensional echocardiographic study. J Am Coll Cardiol. 1983;2(3):437-444. https://doi.org/10.1016/S0735-1097(83)80269-1
- Moak JP, Leifer ES, Tripodi D, Mohiddin SA, Fananapazir L. Long-term follow-up of children and adolescents diagnosed with hypertrophic cardiomyopathy: risk factors for adverse arrhythmic events. Pediatr Cardiol. 2011;32(8):1096-1105. https://doi.org/10.1007/S00246-011-9967-Y
- Jhaveri S, Komarlu R, Worley S, Shahbah D, Gurumoorthi M, Zahka K. Left Atrial Strain and Function in Pediatric Hypertrophic Cardiomyopathy. J Am Soc Echocardiogr. 2021;34(9):996-1006. https://doi.org/10.1016/J.ECHO.2021.04.014
- Dallaire F, Slorach C, Hui W, et al. Reference values for pulse wave Doppler and tissue Doppler imaging in pediatric echocardiography. Circ Cardiovasc Imaging. 2015;8(2). https://doi.org/10.1161/CIRCIMAGING.114.002167
- Mozaffarian D, Caldwell JH. Right ventricular involvement in hypertrophic cardiomyopathy: a case report and literature review. Clin Cardiol. 2001;24(1):2-8. https://doi.org/10.1002/CLC.4960240102
- Bos JM, Will ML, Gersh BJ, Kruisselbrink TM, Ommen SR, Ackerman MJ. Characterization of a phenotype-based genetic test prediction score for unrelated patients with hypertrophic cardiomyopathy. Mayo Clin Proc. 2014;89(6):727-737. https://doi.org/10.1016/J.MAYOCP.2014.01.025
- Tadros R, Francis C, Xu X, et al. Shared genetic pathways contribute to risk of hypertrophic and dilated cardiomyopathies with opposite directions of effect. Nat Genet. 2021;53(2):128-134. https://doi.org/10.1038/S41588-020-00762-2
- Ackerman MJ, VanDriest SL, Ommen SR, et al. Prevalence and age-dependence of malignant mutations in the beta-myosin heavy chain and troponin T genes in hypertrophic cardiomyopathy: a comprehensive outpatient perspective. J Am Coll Cardiol. 2002;39(12):2042-2048. https://doi.org/10.1016/S0735-1097(02)01900-9
- Moolman JC, Corfield VA, Posen B, et al. Sudden death due to troponin T mutations. J Am Coll Cardiol. 1997;29(3):549-555. https://doi.org/10.1016/S0735-1097(96)00530-X
- Spirito P, Seidman CE, McKenna WJ, Maron BJ. The management of hypertrophic cardiomyopathy. N Engl J Med. 1997;336(11):195-202. https://doi.org/10.1056/NEJM199703133361107
- Spirito P, Maron BJ. Relation between extent of left ventricular hypertrophy and occurrence of sudden cardiac death in hypertrophic cardiomyopathy. J Am Coll Cardiol. 1990;15(7):1521-1526. https://doi.org/10.1016/0735-1097(90)92820-R
- Suda K, Kohl T, Kovalchin JP, Silverman NH. Echocardiographic predictors of poor outcome in infants with hypertrophic cardiomyopathy. Am J Cardiol. 1997;80(5):595-600. https://doi.org/10.1016/S0002-9149(97)00428-1
- Nagueh SF, Mikati I, Kopelen HA, Middleton KJ, Quiñones MA, Zoghbi WA. Doppler estimation of left ventricular filling pressure in sinus tachycardia. A new application of tissue doppler imaging. Circulation. 1998;98(16):1644-1650. https://doi.org/10.1161/01.CIR.98.16.1644
- Arghami A, Dearani JA, Said SM, O’Leary PW, Schaff H v. Hypertrophic cardiomyopathy in children. Ann Cardiothorac Surg. 2017;6(4):376-385. https://doi.org/10.21037/ACS.2017.07.04
- Quality A for HR and. Strategy 6I: Shared Decision Making. In: The CAHPS Ambulatory Care Improvement Guide: Practical Strategies for Improving Patient Experience. Accessed May 10, 2022. https://www. ahrq.gov/cahps/quality-improvement/improvement-guide/6-strategiesfor-improving/communication/strategy6i-shared-decisionmaking.html.
- AHRQ Health Literacy Universal Precautions Toolkit | Agency for Healthcare Research and Quality. Accessed May 11, 2022. https://www.ahrq.gov/health-literacy/improve/precautions/index.html
- Greenfield S, Kaplan SH, Ware Jr JE, Yano EM, Frank HJ. Patients’ participation in medical care: Effects on blood sugar control and quality of life in diabetes. Journal of General Internal Medicine. 1988;3:448-457.
- Greenfield S, Kaplan S, Ware JE. Expanding patient involvement in care: Effects on patient outcomes. Annals of Internal Medicine. 1985;102(4):520-528. https://doi.org/10.7326/0003-4819-102-4-520
- Assessing the Effects of Physician-Patient Interactions on the Outcomes of Chronic Disease on JSTOR. Accessed May 11, 2022. https://www.jstor.org/stable/3765658
- Guadagnoli E, Ward P. Patient participation in decision-making. Social Science & Medicine. 1998;47(3):329-339. https://doi.org/10.1016/S0277-9536(98)00059-8







