PGS.TS ĐỖ QUANG HUÂN, PGS.TS. HỒ HUỲNH QUANG TRÍ,
ThS.BS LÊ PHÁT TÀI, TS.BS ĐỖ THỊ NAM PHƯƠNG,
BS.CK II. NGUYỄN TRUNG QUỐC, BS.CK II BÙI NGUYỄN HỮU VĂN,
BS.CK II TRẦN THỊ HUỲNH NGA, ThS.BS MAI QUỐC DŨNG,
ThS.BS NGUYỄN NHO TIẾN, ThS.BS ĐẶNG DUY PHƯƠNG
Viện Tim TP. Hồ Chí Minh
1. Giới thiệu
- Hội chứng hô hấp cấp tính nặng do virus chủng mới coronavirus 2 (SARS-CoV 2) gây bệnh coronavirus 2019 (COVID-19) đã đạt đến mức độ đại dịch;
- Bệnh nhân có các yếu tố nguy cơ tim mạch và bệnh tim mạch có sẵn là nhóm dân số dễ bị tổn thương khi bị COVID-19;
- Bệnh nhân bị tổn thương tim trong bệnh cảnh COVID-19 có nguy cơ biến chứng và tử vong cao hơn.
SARS-CoV-2 gây COVID-19 đã đạt đến mức đại dịch từ tháng 03 năm 2020. Trong khi chúng ta vẫn chưa có vắc-xin hoặc phương pháp chữa trị hiệu quả, COVID-19 đã gây sức ảnh hưởng toàn cầu chưa từng có đối với sức khỏe cộng đồng và hệ thống chăm sóc sức khỏe. Do nhu cầu lớn và đột ngột về số lượng giường bệnh tại các Đơn vị chăm sóc tích cực, các dụng cụ hỗ trợ hô hấp và máy thở, việc tổ chức và phân bố lại tạm thời các nguồn lực trong bệnh viện đã trở nên cần thiết với tất cả các chuyên khoa y tế. Ngoài ra, các biện pháp bảo vệ chống lại SARS-CoV‑2 có ý nghĩa đặc biệt đối với nhân viên chăm sóc sức khỏe (HCP) tiếp xúc trực tiếp với bệnh nhân COVID-19 và những bệnh nhân lành chưa nhiễm bệnh. Trước các nguồn lực chăm sóc sức khỏe hữu hạn, hệ thống y tế phải đối mặt với những cân nhắc về đạo đức về cách ưu tiên tiếp cận chăm sóc cho từng bệnh nhân cũng như chăm sóc bệnh nhân COVID-19 trong khi không bỏ qua các trường hợp khẩn cấp đe dọa đến tính mạng. Lưu ý, các xét nghiệm phát hiện virus ở bệnh nhân không có hoặc có triệu chứng có những hạn chế về độ nhạy, độ đặc hiệu và sẽ được bổ sung bằng các xét nghiệm tìm kháng thể để xác định những người đã bị nhiễm trước đó.
SARS-CoV 2 không chỉ gây viêm phổi do virus mà còn tác động lớn đối với hệ tim mạch. Bệnh nhân có các yếu tố nguy cơ tim mạch như nam, tuổi cao, đái tháo đường, tăng huyết áp và béo phì cũng như đã mắc bệnh tim mạch và bệnh mạch máu não là những quần thể “đặc biệt dễ bị tổn thương” với tăng nguy cơ mắc bệnh và tử vong khi bị COVID-19. Hơn nữa, một tỷ lệ đáng kể bệnh nhân có thể đưa đến tổn thương tim trong bệnh cảnh COVID-19, điều này báo trước tăng nguy cơ tử vong tại bệnh viện. Ngoài các biến chứng huyết khối động-tĩnh mạch biểu hiện như hội chứng mạch vành cấp và huyết khối tĩnh mạch, viêm cơ tim đóng vai trò quan trọng ở bệnh nhân suy tim cấp tính. Hơn nữa, một loạt các rối loạn nhịp tim đã làm phức tạp quá trình điều trị COVID-19 bao gồm cả tiềm năng ảnh hưởng loạn nhịp của thuốc điều trị nhắm vào COVID-19 và các bệnh liên quan. Do phải phân bố lại các nguồn lực chăm sóc sức khỏe, việc tiếp cận điều trị cấp cứu bao gồm liệu pháp tái tưới máu có thể bị ảnh hưởng tùy thuộc vào mức độ nghiêm trọng của dịch tại mỗi địa phương. Điều này càng gia tăng mối lo lắng về việc trì hoãn cấp cứu tim mạch khi bệnh nhân ngại phải tìm kiếm sự chăm sóc y tế trong đại dịch.
Vì những lý do này, Hội Tim mạch châu Âu đã tập hợp một nhóm các chuyên gia và thầy thuốc đang thực hành có kinh nghiệm điều trị bệnh nhân COVID-19 để đưa ra một tài liệu hướng dẫn phù hợp cho tất cả các khía cạnh điều trị bệnh tim mạch trong đại dịch COVID-19.
- Tài liệu này không phải là một hướng dẫn đầy đủ (guideline) mà chỉ là một tài liệu hướng dẫn (guidance document). Các khuyến cáo là kết quả của các nghiên cứu quan sát và kinh nghiệm từ các chuyên gia y tế nơi tuyến đầu đại dịch COVID-19. Bằng chứng hiện tại liên quan đến SARS-CoV 2 và các biểu hiện bệnh của nó là kết quả của những nghiên cứu quan sát và can thiệp tiến cứu và do đó không đủ để tạo cơ sở cho việc đưa ra các khuyến cáo dựa trên bằng chứng khoa học;
- Tài liệu hướng dẫn này không thay thế bất kỳ hướng dẫn chính thức nào của Hội Tim mạch châu Âu và chỉ có hiệu lực chừng nào tình trạng đại dịch vẫn được duy trì bởi Tổ chức Y tế Thế giới (WHO);
- Hướng dẫn được cung cấp trong tài liệu không nên can thiệp vào các khuyến cáo của các cơ quan chăm sóc sức khỏe địa phương và Quốc gia;
- Đại dịch diễn ra với đặc điểm thay đổi khác nhau giữa các mốc thời gian và giữa các khu vực khác nhau trên toàn thế giới. Theo đó, một số khía cạnh được thảo luận trong tài liệu này chỉ có thể áp dụng cho các khu vực bị ảnh hưởng nặng nề nhất bởi đại dịch COVID-19, trong khi các tiêu chí khác có thể áp dụng cho các khu vực địa lý ít bị ảnh hưởng hơn;
- Tài liệu chỉ cung cấp ngắn gọn hiện trạng với thông tin sơ bộ có thể thay đổi và hoàn thiện theo thời gian với sự gia tăng hiểu biết, bằng chứng từ các nghiên cứu tiến cứu và những thay đổi trong đại dịch. Do đó, các bình luận có thể được đặt trên trang web để các tác giả xem xét cập nhật trong tương lai;
- Hiện tại không có điều trị dựa trên bằng chứng trong nhiễm COVID-19 và điều trị thử nghiệm có thể có tác dụng phụ trên tim. Chúng tôi khuyến khích các phương pháp điều trị thử nghiệm là một phần của các thử nghiệm đối chứng bất cứ khi nào có thể.
2. Dịch tễ học
2.1. Tác động của bệnh tim mạch đi kèm đến kết cục nhiễm COVID-19
Những điểm chính
- Bệnh tim mạch kèm theo thường gặp ở bệnh nhân COVID-19;
- Sự hiện diện của bệnh tim mạch làm tăng tỷ lệ tử vong ở bệnh nhân COVID-19;
- Các yếu tố nguy cơ mắc bệnh tim mạch và bệnh tim mạch thì tăng theo tuổi
Đến ngày 10 tháng 3 năm 2020, có 4296 người trên toàn thế giới đã chết vì COVID-19. Đến ngày 7 tháng 5, có 3,67 triệu người đã thử nghiệm dương tính và hơn 250 000 người đã chết [1]. Tỷ lệ tử vong ca bệnh (case fatality rate: CFR) chung đối với nhiễm COVID-19 rất đặc trưng cho mỗi quốc gia và tùy thuộc vào giai đoạn dịch bệnh, xét nghiệm, thống kê báo cáo, nhân khẩu học, năng lực chăm sóc y tế và các quyết định của chính phủ [2]. Tỷ lệ nhiễm COVID-19 tương tự ở cả hai giới; tuy nhiên, tỷ lệ tử vong cao hơn ở nam giới [3]. Báo cáo tình hình hàng ngày về đại dịch COVID-19 được WHO đăng trên trang web.
Sau khi bắt đầu đại dịch COVID-19 tại Vũ Hán, Trung Quốc, tâm chấn của đại dịch hiện đang ở Châu Âu. Hình 1 đưa ra một cái nhìn tổng quan về sự tiến triển các trường hợp xét nghiệm xác định COVID-19 ở Châu Âu.
Một nghiên cứu lớn ở Trung Quốc đã tiến hành phân tích trên 72314 hồ sơ bệnh nhân bao gồm 44672 (61,8%) trường hợp được khẳng định chẩn đoán COVID-19, 16186 (22,4%) trường hợp nghi ngờ và 889 (1,2%) trường hợp không có triệu chứng [3]. Trong số các trường hợp được khẳng định COVID-19, tăng huyết áp chiếm 12,8%, đái tháo đường 5,3% và bệnh tim mạch 4,2% [3]. Đáng chú ý, những con số này thấp hơn tỷ lệ mắc yếu tố nguy cơ tim mạch trong dân số chung tại Trung Quốc, tuy nhiên điều quan trọng là số liệu này chưa được điều chỉnh theo độ tuổi và có 53% trường hợp bị mất dữ liệu về bệnh lý đi kèm [5]. Một nghiên cứu bao gồm 5700 bệnh nhân từ thành phố New York, Long Island và hạt Westchester (Hoa Kỳ) đã cho thấy tăng huyết áp 56,6%, béo phì 41,7%, đái tháo đường 33,8%, bệnh động mạch vành 11,1% và suy tim sung huyết 6,9% là những bệnh đi kèm phổ biến nhất [6]. So sánh, tỷ lệ tăng huyết áp, béo phì và đái tháo đường trong dân số chung ở Hoa Kỳ tương ứng là 45%, 42,4% và 10,5% [7-9]. Trong phân tích hồi cứu gần đây dựa trên dữ liệu của 138 bệnh nhân ở Vũ Hán, khoảng 50% bệnh nhân bị nhiễm COVID-19 có một hoặc nhiều bệnh đi kèm, ở những bệnh nhân nặng, tỷ lệ này lên đến 72% [5]. Vẫn còn mơ hồ, liệu đái tháo đường, tăng huyết áp và bệnh tim mạch có liên quan với nhau hay do liên quan đến tuổi tác. Tuy nhiên, một thông điệp quan trọng là bệnh nhân tiến triển nặng dễ bị tổn thương hơn bởi bệnh đồng hành, bao gồm cả bệnh tim mạch.
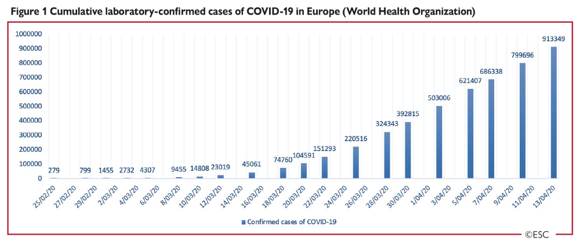
Hình 1: Số trường hợp xét nghiệm xác định COVID-19 luỹ tích tại Châu Âu (WHO)
Dân tộc dường như có liên quan đến tính nhạy cảm và kết cục của nhiễm trùng COVID-19 [11, 12]. Dữ liệu từ Vương quốc Anh cho thấy một phần ba số bệnh nhân được đưa vào một đơn vị chăm sóc tích cực do nhiễm COVID-19 là từ một nhóm dân tộc thiểu số [11, 13]. Báo cáo từ Hoa Kỳ cho thấy các nhóm dân tộc thiểu số cũng bị ảnh hưởng không tương xứng bởi nhiễm trùng COVID-19 [12]. Có nhiều cơ chế tiềm năng như các yếu tố kinh tế xã hội, văn hóa hoặc lối sống và khuynh hướng di truyền. Ngoài ra, sự khác biệt về sinh lý bệnh học về tính nhạy cảm hoặc đáp ứng với nhiễm trùng như tăng nguy cơ nhập viện do bệnh đường hô hấp cấp tính, tăng tỷ lệ thiếu vitamin D, tăng gánh nặng viêm nhiễm, và tỷ lệ mắc các yếu tố nguy cơ tim mạch cao hơn như kháng insulin và béo phì so với dân số da trắng.
Nghiên cứu của Verity và cộng sự ước tính tỷ lệ tử vong ca bệnh (case-fatality) ở Trung Quốc (được điều chỉnh theo nhân khẩu học) là 1,38% nhưng tỷ lệ tử vong trường hợp ước tính phụ thuộc rất nhiều vào chiến lược xét nghiệm các trường hợp bệnh không nặng vì nhiều trường hợp vẫn chưa được xác minh. Tử vong ca bệnh cao nhất ở nhóm bệnh nhân lớn tuổi: Tỷ lệ tử vong ca bệnh là 0,32 ở bệnh nhân < 60 tuổi so với 6,4% ở bệnh nhân > 60 tuổi [6]. Ở Ý, tỷ lệ tử vong ca bệnh dao động từ 0% dưới 30 tuổi, 3,5% cho độ tuổi 60-69 và 20% ở độ tuổi trên 80 [7]. Điều này nhấn mạnh rằng việc tuổi càng cao là một yếu tố nguy cơ quan trọng đối với quá trình nhiễm COVID-19 nặng. Bệnh tim mạch nền cũng có liên quan đến nguy cơ cao hơn bị COVID-19 nặng. Trong một nghiên cứu đoàn hệ hồi cứu trên 72314 trường hợp ở Trung Quốc bệnh nhân mắc bệnh tim mạch kèm theo có nguy cơ tử vong cao gấp năm lần (10,5%), tuy nhiên, phân tích này chưa được điều chỉnh tuổi. Các phân tích đoàn hệ đa quốc gia sẽ cung cấp thêm thông tin chi tiết về tỷ lệ lưu hành và nguy cơ của bệnh tim mạch đồng mắc trong nhiễm COVID-19. Có một số cơ chế có khả năng giải thích tại sao tiến trình của bệnh nghiêm trọng hơn ở những bệnh nhân có các yếu tố nguy cơ tim mạch và bệnh tim mạch nền [9] (được mô tả trong phần 3 và 9).
2.2. Biểu hiện tim mạch và diễn biến lâm sàng của nhiễm trùng COVID-19
Những điểm chính
- Nhiễm COVID-19 nặng có liên quan đến tổn thương cơ tim và rối loạn nhịp tim;
- Nên theo dõi độc tính trên tim của thuốc kháng siêu vi
Các dịch coronavirus bùng phát trước đó như hội chứng hô hấp cấp tính nặng (SARS) và hội chứng hô hấp Trung Đông (MERS) có liên quan đến gánh nặng đáng kể bệnh tim mạch đi kèm và biến chứng của nó [9, 10]. Biến chứng tim thường gặp ở SARS là hạ huyết áp, viêm cơ tim, rối loạn nhịp tim và đột tử do tim [11, 12]. Chẩn đoán trong quá trình nhiễm SARS cho thấy những thay đổi về điện tâm đồ, suy chức năng tâm trương thất trái dưới lâm sàng và tăng troponin.
Trên mẫu tử thiết bệnh nhân nhiễm COVID-19 cho thấy sự xâm nhập mô kẻ cơ tim bởi các tế bào viêm đơn nhân [13] và tăng dấu ấn sinh học tim do tổn thương cơ tim [13-15]. Tổn thương cơ tim và tăng dấu ấn sinh học tim liên quan đến viêm cơ tim do nhiễm trùng và thiếu máu cục bộ [16]. Trong một nghiên cứu của Shi et al [15] ở 416 bệnh nhân trong đó có 57 bệnh nhân tử vong, tổn thương cơ tim chiếm 19,7%. Ở những bệnh nhân tử vong, 10,6% mắc bệnh động mạch vành, 4,1% suy tim và 5,3% bị bệnh mạch máu não [15]. Ngoài ra, phân tích mô hình hồi quy đa biến có hiệu chỉnh cho thấy tổn thương tim có liên quan đáng kể và độc lập với tỷ lệ tử vong (HR: 4.26) [15]. Tương tự, nghiên cứu của Guo et al [14] cho thấy tăng nồng độ troponin T do tổn thương tim có liên quan đến tỷ lệ tử vong cao hơn đáng kể. Những bệnh nhân này thường là nam giới, lớn tuổi và mắc nhiều bệnh đồng hành như tăng huyết áp, bệnh mạch vành. Nhiễm COVID-19 nặng cũng có khả năng gây rối loạn nhịp tim do biến chứng của viêm cơ tim trong bệnh cảnh nhiễm trùng.
Bên cạnh các biến chứng cấp tính, nhiễm COVID-19 cũng có thể liên quan đến tăng nguy cơ tim mạch dài hạn. Những bệnh nhân với viêm phổi, tăng đông và viêm hệ thống có thể tồn tại trong một thời gian dài [2, 9]. Một nghiên cứu tiếp theo về bệnh SARS đã chứng minh rằng những bệnh nhân có tiền sử nhiễm SARS-coronavirus thường bị tăng lipid máu, bất thường hệ tim mạch hoặc rối loạn chuyển hóa glucose [9-11]. Tuy nhiên, SARS được điều trị bằng methylprednisolone có thể là lời giải thích cho sự rối loạn chuyển hóa lipid lâu dài hơn là hậu quả của nhiễm trùng [13]. Tất nhiên, ảnh hưởng lâu dài của nhiễm COVID-19 chưa được biết tuy nhiên những ảnh hưởng của nhiễm SARS-coronavirus đã ủng hộ cho việc tiếp tục theo dõi những bệnh nhân nhiễm COVID-19 đã hồi phục.
3. Sinh lý bệnh – Cơ chế gây bệnh liên quan đến hệ tim mạch
Những điểm chính
- Sinh bệnh học của nhiễm coronavirus liên quan đến SARS-CoV 2 xâm nhập vào tế bào vật chủ qua trung gian gắn kết với thụ thể enzyme chuyển đổi angiotensin 2 (ACE2)
- ACE2, được tìm thấy nhiều ở phổi, tim và mạch, là thành phần chủ chốt của hệ thống renin angiotensin (RAS), có vai trò quan trọng trong sinh lý bệnh học của bệnh tim mạch;
- Bệnh tim mạch liên quan đến COVID-19, có khả năng liên quan đến sự rối loạn điều hòa của hệ thống RAS / ACE2 do nhiễm SARS-CoV 2 và do bệnh lý đi kèm như tăng huyết áp;
- Bệnh tim mạch có thể là một hiện tượng nguyên phát trong COVID-19, nhưng có thể là thứ phát sau tổn thương phổi cấp tính, dẫn đến tăng tải trên tim, điều này sẽ đưa đến các vấn đề bất lợi ở bệnh nhân mắc suy tim trước đó;
- Cơn bão phóng thích Cytokine, bắt nguồn từ sự mất cân bằng kích hoạt tế bào T với sự rối loạn điều hòa trong giải phóng interleukin-6 (IL-6), IL-17 và các cytokine khác, có thể góp phần vào bệnh tim mạch trong COVID-19. Đích nhắm IL-6 đang được thử nghiệm về mặt trị liệu;
- Kích hoạt hệ thống miễn dịch cùng với sự thay đổi chuyển hóa miễn dịch có thể dẫn đến mất ổn định mảng xơ vữa, góp phần tiến triển các biến cố mạch vành cấp tính.
COVID-19 được gây ra bởi một loại betacoronavirus mới được WHO đặt tên chính thức là SARS-CoV 2. Các coronavirus được bao bọc bởi các sợi đơn RNA virus với bề mặt tương ứng là các que nhọn protein nhô ra xung quanh [17]. Nguồn mang SARS-CoV 2 trong tự nhiên dường như là loài dơi hoa cúc nhưng vật chủ trung gian vẫn chưa rõ. SARS-CoV 2 có độc lực và khả năng truyền bệnh cao hơn virus SARS trước đó (bùng phát năm 2003), ở những người nhiễm bệnh, có khoảng một tỷ bản sao RNA / mL đàm và virus tồn tại ổn định lâu dài trên bề mặt bị ô nhiễm [19].
SARS-CoV 2 ổn định hơn trên nhựa và thép không gỉ so với đồng và bìa cứng, và khả năng tồn tại của virus đã được phát hiện lên đến 72 giờ [19]. Liệu khả năng lây nhiễm của SARS-CoV 2 lớn hơn cúm hoặc SARS-coronavirus, giả thiết này cần nhiều dữ liệu hơn để đánh giá chính xác [20]. Sự lây truyền xảy ra chủ yếu bởi sự kết hợp lây lan bởi giọt bắn, tiếp xúc trực tiếp hoặc gián tiếp, và cũng có thể là trong không khí (airborne). Thời gian ủ bệnh là 2 -14 ngày, (phần lớn là 3 -7 ngày) [21]. Nó ngấm ngầm lây lan cho đến khi bắt đầu được phát hiện 1 -2 ngày trước có triệu chứng đường hô hấp trên. Các trường hợp nhẹ được phát hiện có độ thanh thải virus sớm, với 90% bệnh nhân này liên tục thử nghiệm âm tính với phản ứng chuỗi polymerase sao chép ngược (RT-PCR) vào ngày thứ 10 sau khởi phát. Ngược lại, tất cả các trường hợp nặng vẫn có xét nghiệm dương tính trong hoặc sau ngày 10 từ khi khởi phát [22]. Thời gian trung bình của sự phát tán virus là 20 ngày (Khoảng tứ vị phân vị: 17-24) ở những người sống sót. Thời gian quan sát lâu nhất của sự phát tán virus ở những người sống sót là 37 ngày [23].
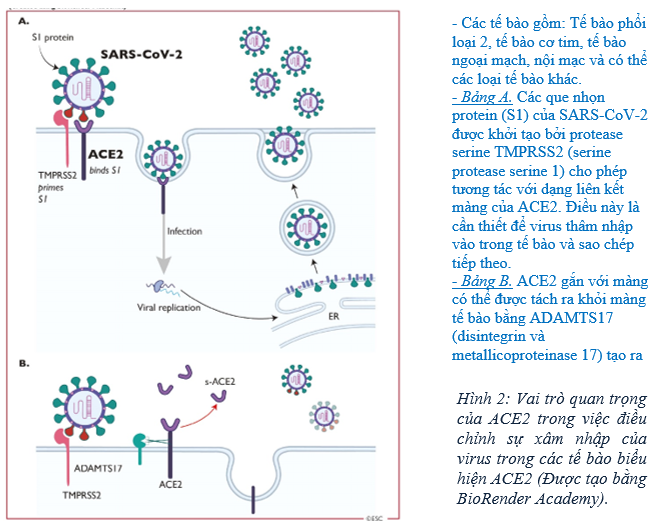
SARS-CoV 2 xâm nhập vào các tế bào để kích hoạt nhiễm trùng thông qua các thụ thể ACE2 trên vật chủ (Hình 2) [24, 25]. ACE2 là một protein đa chức năng. Vai trò sinh lý chính của nó là chuyển đổi enzyme của angiotensin (Ang) II thành Ang- (1-7) và Ang I thành Ang- (1-9), là các peptide bảo vệ tim mạch [26]. Tuy nhiên, trong bệnh cảnh COVID-19, ACE2 cũng tham gia vào SARS thông qua chức năng của nó với tư cách là thụ thể coronavirus [27]. Sự gắn kết các que nhọn protein trên SARS-CoV 2 với ACE2 tạo điều kiện cho virus xâm nhập vào tế bào biểu mô phế nang phổi (nơi nó được biểu hiện nhiều nhất) thông qua các quá trình liên quan đến bề mặt tế bào kết hợp với protein xuyên màng serine 2 (TMPRSS2) [28] (Hình 2). Trong tế bào chất của tế bào vật chủ, RNA hệ gen của virus được giải phóng và sao chép dẫn đến hình thành RNA bộ gen mới. Sau đó tiến trình được xử lý thành các túi chứa hạt virus hoàn chỉnh rồi hợp nhất với màng tế bào để phóng thích virus. SARS-CoV 2 lây lan chủ yếu qua đường hô hấp bằng các giọt bắn nhỏ, dịch tiết đường hô hấp và tiếp xúc trực tiếp. RAS / ACE2 dường như bị phá vỡ bởi nhiễm SARS-CoV 2, có khả năng đóng vai trò gây bệnh trong tổn thương phổi nặng và suy hô hấp ở COVID-19 [29]. Ngoài phổi, ACE2 được tìm thấy nhiều ở tim, mạch và đường tiêu hóa của người [30, 31].
COVID-19 chủ yếu là một bệnh về đường hô hấp, nhưng nhiều bệnh nhân cũng có bệnh tim mạch, bao gồm tăng huyết áp, tổn thương tim cấp tính và viêm cơ tim (Hình 3) [10, 32]. Đây có thể là thứ phát sau bệnh phổi, vì chính tổn thương phổi cấp tính dẫn đến tăng công của tim và có thể gây ra vấn đề bất lợi trên tim, đặc biệt là ở những bệnh nhân suy tim trước đó. Bệnh tim mạch cũng có thể được xem là vai trò sinh lý bệnh quan trọng của RAS /ACE2 trong hệ thống tim mạch và thực tế là ACE2 hiện diện trong tim, tế bào mạch máu và tế bào ngoại mạch [33].
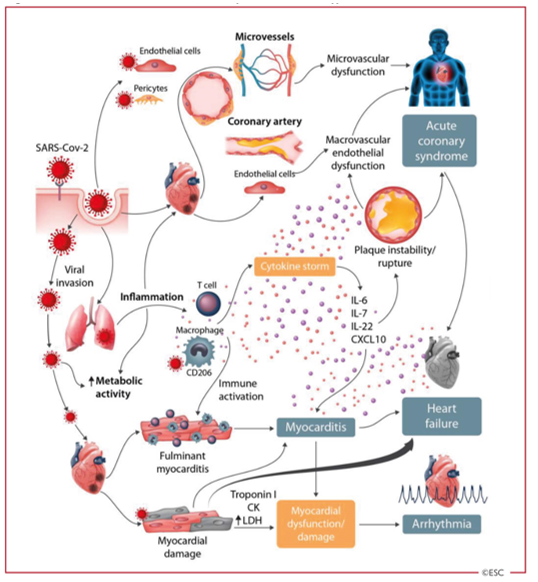
Hình 3: Sự liên quan đến tim mạch trong COVID-19 – Các biểu hiện chính và giả thuyết về cơ chế bệnh sinh
3.1. Mối quan hệ giữa tăng huyết áp, ACE2 và COVID-19
Tỷ lệ tăng huyết áp tồn tại từ trước dường như cao hơn ở những bệnh nhân COVID-19 nặng so với những người không nặng [23, 46]. Điều này cũng đúng với Hội chứng nguy ngập hô hấp cấp (ARDS) hoặc tử vong. Các cơ chế tiềm ẩn mối quan hệ giữa tăng huyết áp và COVID-19 vẫn chưa được biết nhưng có ý kiến cho rằng vai trò quan trọng của hệ renin-angiotensin-aldosterone (RAAS) / ACE2 trong sinh lý bệnh của tăng huyết áp, có thể do rối loạn điều hòa hệ thống nghiêm trọng. Trước vấn đề này, người ta đã lập luận rằng điều trị tăng huyết áp bằng thuốc ức chế RAS có thể ảnh hưởng đến SARS-CoV 2 gắn với ACE2, thúc đẩy bệnh tiến triển [35]. Một số phát hiện thực nghiệm cho thấy các chất ức chế RAS gây ra sự gia tăng bù trừ ở cấp độ mô học của ACE2 [36], và các chất ức chế men chuyển có thể gây bất lợi ở những bệnh nhân tiếp xúc với SARS-CoV-2 [37]. Tuy nhiên, điều quan trọng là không có bằng chứng nào cho thấy việc sử dụng các chất ức chế men chuyển angiotensin hoặc thuốc ức chế thụ thể angiotensin (ARB) dẫn đến sự “điều hòa tăng” ACE2 trong các mô ở người. Dữ liệu có sẵn từ các mẫu máu cho thấy không có mối liên quan giữa cấp độ tuần hoàn của ACE2 và việc sử dụng chất đối kháng RAAS [38]. Trong mô hình thử nghiệm có vẻ như ARB có tiềm năng tác động bảo vệ [39, 40]. Cho đến nay không có bằng chứng lâm sàng nào cho thấy việc sử dụng thuốc ức chế RAS ở bệnh nhân COVID-19 sẽ mang lại lợi ích hoặc gây ra các bất lợi cho người bệnh và theo hướng dẫn từ các Hiệp hội tim mạch lớn trên Thế giới, bệnh nhân COVID-19 đang dùng các thuốc ức chế men chuyển hoặc ức chế thụ thể không nên ngừng điều trị [38, 41].
3.2. Tổn thương tim cấp tính và viêm cơ tim ở COVID-19
Viêm cơ tim xuất hiện ở bệnh nhân COVID-19 vài ngày sau khi bắt đầu sốt. Điều này cho thấy tổn thương cơ tim do nhiễm virus. Các cơ chế của tổn thương cơ tim do SARS-CoV-2 gây ra có thể liên quan đến sự điều hòa tăng của ACE2 trong tim và mạch vành [32, 41]. Suy hô hấp và thiếu oxy trong COVID-19 cũng có thể gây tổn thương cơ tim và cơ chế miễn dịch của viêm cơ tim có thể đặc biệt quan trọng [16, 32, 41]. Ví dụ, tổn thương tim dẫn đến kích hoạt phản ứng miễn dịch với phóng thích các cytokine tiền viêm, cũng như kích hoạt các cơ chế miễn dịch tự động thích ứng thông qua mô phỏng phân tử.
3.3. Rối loạn điều hòa hệ thống miễn dịch và bệnh tim mạch trong COVID-19
Các cơ chế gây viêm và kích hoạt các phản ứng miễn dịch làm cơ sở gây ra hàng loạt các vấn đề về bệnh tim mạch bao gồm xơ vữa động mạch, suy tim và tăng huyết áp [62.63]. Rối loạn điều hòa này có thể có các mức độ khác nhau trong COVID-19. Đầu tiên, SARS-CoV 2 xâm nhập vào các tế bào cụm biệt hóa 209 (CD209) qua các thụ thể trên màng [45]. CD209 được biểu hiện trong các đại thực bào thúc đẩy sự xâm nhập của virus vào các tế bào miễn dịch trong các mô tim và mạch máu. Quan trọng hơn, trong những trường hợp COVID-19 nặng, sự gia tăng toàn thân của cytokine IL-6 IL-2, IL-7, yếu tố kích thích dòng bạch cầu hạt, CXC motif chemokine 10 (CXCL10), chemokine (CC motif) ligand 2, và TNF-α tất cả đã được tìm thấy ở bệnh nhân COVID-19 [46], tương ứng với các đặc điểm của hội chứng phóng thích cytokine (CRS).
Thay đổi tính thấm của mạch máu có thể dẫn đến phù phổi không do tim và thúc đẩy ARDS cũng như rối loạn chức năng đa cơ quan. Nồng độ IL-6 huyết thanh cao là một đặc điểm phổ biến trong hội chứng phóng thích cytokine. IL-6 là một yếu tố dự đoán lâm sàng về tỷ lệ tử vong trong COVID-19 [66]. Do đó, đích nhắm IL-6 có thể được sử dụng trong COVID-19 để giải quyết hội chứng phóng thích cytokine. Cuối cùng, người ta đã chứng minh rằng tăng huyết áp có liên quan đến các tế bào lympho lưu hành ở bệnh nhân và rối loạn chức năng tế bào T CD8 với sự phát triển bệnh tim mạch [49]. T CD8 là một trụ cột của miễn dịch chống virus, do đó rối loạn chức năng của chúng có thể làm cho cơ quan bảo vệ mất khả năng tiêu diệt các tế bào bị nhiễm virus.
- Chiến lược chẩn đoán SARS-CoV-2
Những điểm chính
- Chẩn đoán COVID-19 dựa trên sự kết hợp các tiêu chuẩn dịch tễ học (tiếp xúc trong thời gian ủ bệnh), triệu chứng lâm sàng, xét nghiệm (xét nghiệm khuếch đại axit nucleic) và hình ảnh học;
- Các xét nghiệm miễn dịch dựa kháng nguyên SARS-CoV 2 và kháng thể (ELISA) thì đang được phát triển và chưa được xác nhận có giá trị đầy đủ;
- Xét nghiệm rộng rãi chứng tỏ hiệu quả trong giai đoạn ngăn chặn dịch;
- Chất lượng của việc lấy mẫu (phết mũi sâu bằng tăm bông) và vận chuyển (thời gian) đến các phòng thí nghiệm là rất cần thiết để tránh kết quả âm tính giả;
- Chụp CT phổi có thể được sử dụng như là một cận lâm sàng chẩn đoán trong COVID 19.
Qua các bằng chứng từ các dịch bệnh trước đây, bao gồm SARS và MERS, xét nghiệm chẩn đoán có độ nhạy và độ đặc hiệu cao rất cần thiết để xác định bệnh, truy tìm nguồn tiếp xúc (contact tracing), tìm nguồn động vật và các biện pháp ngăn chặn hiệu quả [50]. Xác định trường hợp chính xác là rất cần thiết để cách ly các cá nhân dễ bị tổn thương. Dựa trên phân tích dịch tễ học hiện nay, bệnh tim mạch cho thấy nguy cơ đưa đến COVID-19 nặng hơn [10, 32]; do đó, xét nghiệm nên được áp dụng rộng rãi ở bệnh nhân tim mạch. Hơn nữa, xét nghiệm người chăm sóc và những người tiếp xúc với bệnh nhân có nguy cơ cao cho phép bảo vệ các đối tượng mắc nhiều bệnh đi kèm. Quyết định xét nghiệm phải dựa trên các yếu tố lâm sàng, dịch tễ học và đánh giá khả năng nhiễm trùng, đặc biệt là khi nguồn cung xét nghiệm bị hạn chế. Các chiến lược thử nghiệm có sẵn được nêu dưới đây (Bảng 1).
Mặc dù việc phân lập virus bằng kính hiển vi điện tử sẽ là chẩn đoán chính xác nhất, nhưng nó đòi hỏi các cơ sở xét nghiệm phải đạt mức an toàn sinh học cấp 3. Tuy nhiên trong thực tế hầu hết các cơ sở y tế không đảm bảo tiêu chí này. Các xét nghiệm phát hiện kháng nguyên và kháng thể trong huyết thanh dễ dàng và nhanh chóng nhưng chưa được xác nhận là có giá trị (not yet been validated), và có thể có phản ứng chéo với các coronavirus khác, đặc biệt là SARS-coronavirus. Hơn nữa, các kháng thể không thể đo được trong giai đoạn đầu của nhiễm trùng. Do đó, real-time PCR vẫn là xét nghiệm chẩn đoán hữu ích nhất đối với COVID-19 trên toàn thế giới.
Khi so sánh độ đặc hiệu và độ nhạy của các xét nghiệm này cần được đánh giá cẩn thận. Điều quan trọng cần lưu ý là kết quả âm tính của xét nghiệm phân tử (RT-PCR) không loại trừ nhiễm SARS-CoV‑2 và không nên được sử dụng làm cơ sở duy nhất cho các quyết định xử trí bệnh nhân mà phải được kết hợp với quan sát lâm sàng, tiền sử và thông tin dịch tễ học. Một số yếu tố có thể dẫn đến kết quả âm tính bao gồm của mẫu thử kém chất lượng, lấy mẫu muộn hoặc rất sớm trong giai đoạn nhiễm trùng, xử lý/vận chuyển kém cũng như các lý do kỹ thuật vốn có trong xét nghiệm như đột biến vi rút hoặc ức chế PCR. Do đó, khuyến cáo nên kiểm tra lại sau 48 giờ trong các trường hợp nghi ngờ lâm sàng có kết quả xét nghiệm âm tính.
Bảng 1: Các kiểu tiếp cận chẩn đoán trong COVID-19- vẫn đang trong giai đoạn thử nghiệm, hiện đã có sẵn để nghiên cứu- Xét nghiệm tại chỗ (Point of Care: POC)
|
Xét nghiệm |
Cơ chế phát hiện |
Vật liệu/bệnh phẫm xét nghiệm | Sẵn có cho Xét nghiệm tại chỗ | Xét nghiệm dương tính | Sử dụng xét nghiệm |
| Các xét nghiệm khuếch đại axit nucleic | RT-PCR và phát hiện trình tự thế hệ tiếp theo của các chuỗi gen của virus, ví dụ: Các gen N, E, S và RdRP. Hai chuỗi độc lập cần được phát hiện | Xe cứu thương: tăm bông mũi họng, đàm. Trong bệnh viện: đàm, hút nội khí quản, máu rửa phế quản, phân | Không; Cần phải được thực hiện trong phòng xét nghiệm | Khẳng định hiện tại nhiễm SARS-CoV2 | Kiểm tra cá nhân |
| Xét nghiệm miễn dịch dựa trên kháng thể | ELISA phát hiện kháng thể IgM/ IgG kháng SARS-CoV 2 | Huyết thanh | Có (tùy thuộc vào thiết kế xét nghiệm) | IgM +: 3-5 ngày sau khi khởi phát IgG: nhiễm trong quá khứ | Tỷ lệ nhiễm / miễn dịch tổng thể trong cộng đồng |
| Xét nghiệm miễn dịch dựa trên kháng nguyên | ELISA phát hiện protein virus, ví dụ protein S (spike protein) hoặc protein N (nucleocapsid) | Tăm bông mũi họng, đàm và các chất tiết đường hô hấp dưới khác, máu rửa phế quản, phân. | Có (tùy thuộc vào thiết kế xét nghiệm) | Xác định hiện tại nhiễm SARS-CoV 2 | Kiểm tra cá nhân |
|
Xét nghiệm lâm sàng |
Triệu chứng lâm sàng (sốt /ho). Tiền sử dịch tễ học. Hình ảnh (CT phổi) | CT-phát hiện các đặc điểm X quang | Có | Có thể bị nhiễm | Sàng lọc nhận diện các bệnh nhân cần làm thêm xét nghiệm |
Điều cần thiết là các quy trình vận hành chuẩn đầy đủ đang được sử dụng và nhân viên được đào tạo để lấy mẫu xét nghiệm, lưu trữ, đóng gói và vận chuyển mẫu thích hợp. Điều này phải được tôn trọng để xét nghiệm đảm bảo đáng tin cậy và an toàn cho nhân viên và bệnh nhân.
Các mẫu thử nghiệm tối ưu bao gồm tăm bông mũi thay vì hầu họng. Để phết mũi bằng tăm bông đủ sâu, mẫu phải được lấy bởi đội ngũ nhân viên được đào tạo và có kinh nghiệm. Theo một nghiên cứu so sánh sử dụng CT phổi làm cận lâm sàng đối chiếu, độ nhạy của tăm bông mũi họng giới hạn ở mức 60 -70% (ví dụ các đối tượng thõa tiêu chí dịch tễ học và lâm sàng dương tính). Tuy nhiên, điều này không có nghĩa rằng các xét nghiệm không nên thực hiện để xác định nhiễm trùng, nhưng điều quan trọng là xét nghiệm được lặp lại nếu có nghi ngờ lâm sàng nhiễm COVID-19. CT phổi có độ nhạy cao để chẩn đoán COVID-19 ở bệnh nhân nhập viện dương tính với RT-PCR. Trong một nghiên cứu được thực hiện từ 06/01 đến 06/02 năm 2020 tại Bệnh viện Tongji, Vũ Hán (Trung Quốc), trên 1014 bệnh nhân COVID-19 khi sử dụng RT-PCR làm tham chiếu, độ nhạy của hình ảnh CT phổi là 97% [53]. Điều quan trọng là 60-93% bệnh nhân có CT phổi dương tính ban đầu phù hợp với COVID-19 trước khi có kết quả RT-PCR dương tính ban đầu.
Sự phóng thích axit nucleic cũng là một công cụ quan trọng để xác định sự cải thiện của bệnh nhân, mặc dù 42% bệnh nhân cho thấy sự cải thiện trên CT phổi trước khi kết quả RT-PCR chuyển sang âm tính [53]. Tuy nhiên, việc sự phóng thích axit nucleic không phải lúc nào cũng cho thấy sự hiện diện của virus sống.
Với chiến lược xét nghiệm rộng rãi được áp dụng tại Hàn Quốc, một số nơi không có khả năng đáp ứng đủ. Do đó, các ưu tiên xét nghiệm đã được đề xuất bởi Trung tâm Kiểm soát Bệnh tật Hoa Kỳ (Bảng 2). Chiến lược tổng hợp mẫu đã được đề xuất liên quan đến thu thập mẫu như là công cụ tiết kiệm chi phí nhất để sàng lọc toàn dân, ví dụ như tại các sân bay.
Bảng 2: Các ưu tiên xét nghiệm đối với đại dịch COVID-19 theo Trung tâm Kiểm soát dịch bệnh, Hoa Kỳ.
| ƯU TIÊN 1
Đảm bảo các lựa chọn chăm sóc tối ưu cho tất cả bệnh nhân nhập viện, giảm nguy cơ nhiễm khuẩn bệnh viện và duy trì tính toàn vẹn của hệ thống chăm sóc sức khỏe |
| • Bệnh nhân nhập viện
• Nhân viên cơ sở chăm sóc sức khỏe có triệu chứng |
| ƯU TIÊN 2
Đảm bảo những người có nguy cơ cao nhất bị biến chứng sẽ nhanh chóng được nhận diện và xử lý thích hợp |
| • Bệnh nhân ở các cơ sở chăm sóc dài hạn có triệu chứng
• Bệnh nhân từ 65 tuổi trở lên có triệu chứng • Bệnh nhân với bệnh nền từ trước có triệu chứng • Người của đội phản ứng nhanh phòng chống dịch có triệu chứng |
| ƯU TIÊN 3
Khi các nguồn lực cho phép, kiểm tra các cá nhân trong cộng đồng xung quanh bệnh viện đang có các ca bệnh gia tăng nhanh chóng để giảm sự lây lan cho cộng đồng và đảm bảo sức khỏe của nguồn nhân lực lao động thiết yếu |
| • Công nhân cơ sở hạ tầng quan trọng có triệu chứng
• Những người không đáp ứng bất kỳ phân loại nào ở trên có triệu chứng • Nhân viên y tế và người của đội phản ứng nhanh phòng chống dịch • Những người có triệu chứng nhẹ trong cộng đồng có tỉ lệ nhập viện cao vì COVID-19 |
| KHÔNG ƯU TIÊN
• Cá nhân không có triệu chứng |
5. Các biện pháp bảo vệ cho nhân viên y tế và bệnh nhân tim mạch
5.1. Đánh giá nguy cơ chung và các biện pháp bảo vệ
Tài liệu hướng dẫn của Hội tim mạch Châu Âu đã xem xét tài liệu của WHO [54], hướng dẫn của Trung tâm kiểm soát và phòng ngừa dịch bệnh Hoa Kỳ về COVID-19 [55], Trung tâm kiểm soát dịch bệnh Châu Âu về COVID-19 [56]; những dữ liệu từ Trung Quốc [57, 58] và kinh nghiệm của các nước Châu Âu trong đối phó với dịch COVID-19 bùng phát lớn nhất. Điều quan trọng, tài liệu Hướng dẫn của Hội tim mạch Châu Âu nhằm mục đích đề xuất mức độ bảo vệ cao đối với nhân viên và chuyên gia y tế, trong trường hợp sự lây truyền SARS-CoV 2 xãy ra nghiêm trọng nhất.
Mỗi vùng miền, Quốc gia khác nhau có tình hình bệnh tật COVID-19 khác nhau, mỗi nơi nên đánh giá động học về các rủi ro và thay đổi nhanh chóng các định nghĩa theo tình hình địa phương của họ, tùy thuộc vào giai đoạn dịch bệnh, đặc điểm dân số, năng lực chăm sóc sức khỏe và các quyết định của cơ quan y tế chính phủ / địa phương.
5.1.1. Nguy cơ nhiễm SARS-CoV-2 ở nhân viên y tế
Trong một báo cáo gần đây liên quan đến 138 trường hợp COVID-19, 41,3% được xem là nhiễm trùng mắc phải từ bệnh viện và hơn 70% số bệnh nhân này là các nhân viên hoặc chuyên gia y tế [59]. Nhân viên y tế trên thực tế có nguy cơ nhiễm virus cao hơn, theo báo cáo của Wu và cộng sự trong số 44672 trường hợp bị nhiễm COVID-19 có 1716 là các chuyên gia y tế (3,8%) [8].
Nói chung, việc bảo vệ chống lại COVID-19 cần được phân biệt theo mức độ nguy cơ dựa trên sự biểu hiện lâm sàng của bệnh nhân, loại thủ thuật và tương tác giữa nhân viên/chuyên gia y tế và tình trạng nguy cơ có thể gặp phải. Bảng 3 cung cấp các khuyến cáo chung.
Bảng 3: Các khuyến cáo chung cho Nhân viên y tế, với sự thích ứng khác nhau theo mức độ nguy cơ và những chiến lược ngăn chặn của cộng đồng địa phương
| * Theo dõi và ghi lại tình trạng sức khỏe, bao gồm nhiệt độ cơ thể và các triệu chứng hô hấp, của tất cả các Nhân viên y tế. |
| * Trong trường hợp có bất kỳ triệu chứng liên quan nào, Nhân viên y tế nên được cách ly ngay lập tức, ngừng các hoạt động chăm sóc bệnh nhân và thực hiện xét nghiệm phết mũi họng bằng tăm bông hoặc xét nghiệm axit nucleic (NAT), nếu có. |
| Các triệu chứng tương thích với nhiễm SARS-CoV-2 bao gồm:
· sốt (> 37,2 ° C, có thể không liên tục hoặc có thể không xuất hiện ở một số bệnh nhân) · ho · khó thở · đau họng · mất mùi và / hoặc vị · đau cơ · buồn nôn và / hoặc nôn · tiêu chảy · đau bụng · đau đầu · sổ mũi · mệt mỏi |
| * Nhân viên y tế nên đeo khẩu trang phẫu thuật trong bệnh viện (ít nhất là trong thời kỳ lây truyền xấu nhất của nhiễm SARS-CoV-2, chẳng hạn như các quốc gia có lây truyền trong cộng đồng). |
| * Sử dụng khẩu trang bảo vệ Cấp II hoặc III (FFP2, FFP3 hoặc N95) khi đánh giá một trường hợp có thể xảy ra / nghi ngờ hoặc điều trị một trường hợp được khẳng định COVID-19 |
| * Nhấn mạnh vệ sinh tay; giới hạn số lượng nhân viên chăm sóc, thực hiện các chiến lược tối ưu hóa thiết bị phòng hộ cá nhân (PPE). |
| * Nhân viên y tế nên cố gắng tránh lây truyền cho các thành viên trong gia đình (các biện pháp vệ sinh: ví dụ như giãn cách, rửa tay) đặc biệt nếu họ sống với người có nguy cơ (ví dụ: lớn tuổi, có nhiều bệnh đồng hành). Trong trường hợp thiếu khẩu trang y tế, họ có thể sử dụng khẩu trang tự chế tại nhà và tại nơi công cộng. |
| * Hạn chế sự lây nhiễm virus từ ngoài vào bệnh viện để giảm nguy cơ nhiễm trùng cho cả Nhân viên y tế và bệnh nhân: hủy bỏ/hoãn các cuộc hẹn tái khám ngoại trú, thay bằng dịch vụ chăm sóc y tế từ xa khi có thể, hạn chế điểm vào bệnh viện và số lượng người chăm sóc. Nên tổ chức các con đường trong bệnh viện tách biệt nhau ngay cả khi nguy cơ đã giảm, tách biệt nhóm bệnh nhân dương tính với SARS-CoV-2 khỏi bệnh nhân âm tính. |
| * Tôn trọng vai trò giãn cách xã hội trong bệnh viện. |
| * Các biện pháp phòng ngừa có liên quan nên được thực hiện tại địa phương để hạn chế phơi nhiễm COVID-19 cho Nhân viên y tế có bệnh đồng mắc và /hoặc mang thai. |
Các biện pháp phòng ngừa được thực hiện tùy thuộc vào định nghĩa trường hợp COVID-19 như được định nghĩa trong Bảng 4.
Bảng 4: Tình trạng nguy cơ của bệnh nhân
| Trường hợp khẳng định
(Confirmed case) |
Một người có xét nghiệm xác định nhiễm SARS-CoV-2, bất chấp các dấu hiệu và triệu chứng lâm sàng. |
| Trường hợp có thể có
(Probable case) |
A) Xét nghiệm virus SARS-CoV-2 không thể kết luận được, HOẶC
B) Xét nghiệm không thể được thực hiện vì bất kỳ lý do gì |
|
Trường hợp nghi ngờ (Suspected case) |
A) Một bệnh nhân bị sốt hoặc có ít nhất một dấu hiệu / triệu chứng tương thích với nhiễm SARS-CoV-2 VÀ tiền sử đi lại hoặc cư trú ở nơi được báo là có lây truyền COVID-19 trong cộng đồng trong thời gian 14 ngày trước khi khởi phát triệu chứng, HOẶC
B) Một bệnh nhân bị sốt hoặc có ít nhất một dấu hiệu / triệu chứng tương thích với nhiễm SARS-CoV-2 VÀ đã tiếp xúc với trường hợp được khẳng định COVID-19 hoặc có thể xảy ra trong 14 ngày qua trước khi khởi phát triệu chứng, HOẶC C) Một bệnh nhân mắc bệnh hô hấp cấp tính nặng VÀ phải nhập viện VÀ trong trường hợp không có chẩn đoán thay thế giải thích đầy đủ về biểu hiện lâm sàng. |
|
Trường hợp âm tính (Negative case) |
A) Người không có triệu chứng COVID-19 có tiếp xúc với người có thể có hoặc được khẳng định COVID-19 a, và người này có xét nghiệm SARS-CoV-2 âm tính, HOẶC
B) Trường hợp nghi ngờ với hai xét nghiệm SARS-Cov-2 âm tính, HOẶC C) Bệnh nhân COVID-19 a đã hồi phục và qua 2 lần xét nghiệm âm tính với khoảng cách giữa hai xét nghiệm ít nhất 48 giờ. |
|
* Định nghĩa người tiếp xúc (người có thể truyền bệnh vì đã tiếp xúc với người bệnh)
|
Người tiếp xúc là người đã trải qua bất kỳ một trong những sự phơi nhiễm sau đây trong 2 ngày trước và 14 ngày sau khi xuất hiện các triệu chứng của một trường hợp có thể hoặc được khẳng định:
· Tiếp xúc trực tiếp với trường hợp có thể hoặc được khẳng định trong vòng 1 mét và hơn 15 phút; · Tiếp xúc trực tiếp với cơ thể – chạm vào (bao gồm cả quan hệ tình dục) một người có thể hoặc đã bị nhiễm bệnh · Chăm sóc trực tiếp cho bệnh nhân có thể hoặc bị nhiễm SARS-CoV-2 mà không sử dụng dụng cụ phòng hộ cá nhân đúng cách; HOẶC LÀ · Các tình huống khác như được chỉ định bởi các đánh giá rủi ro địa phương. |
Mức độ bảo vệ nhân viên và chuyên gia y tế phụ thuộc vào tình trạng rủi ro của bệnh nhân, bối cảnh lâm sàng và thủ thuật được thực hiện (Bảng 5). Ngoài dụng cụ phòng hộ cá nhân cho nhân viên, chuyên gia y tế, tất cả bệnh nhân nghi ngờ / có thể hoặc đã được xác định SARS-CoV‑2 nên đeo khẩu trang phẫu thuật dùng một lần khi ở trong phòng có nhân viên, chuyên gia y tế hoặc người khác.
Bảng 5: Sự chăm sóc bảo vệ các cá nhân liên quan đến SARS-CoV-2 [54, 62]
| Cấp độ bảo vệ
|
Dụng cụ phòng hộ cá nhân
|
Thủ thuật/tình huống áp dụng
|
| Bảo vệ cấp I | • Mũ phẫu thuật dùng một lần
• Khẩu trang phẫu thuật dùng một lần • Găng tay cao su đồng phục |
Sàng lọc trước khi khám, khoa ngoại trú (không nghi ngờ / không thể bệnh nhân SARS-CoV-2) a |
| Bảo vệ cấp II | • Mũ phẫu thuật dùng một lần
• Khẩu trang phòng hộ y tế (N95 / FFP2) • Đồng phục làm việc • Áo choàng • Găng tay phẫu thuật dùng một lần • Kính bảo hộ |
• Tất cả bệnh nhân nghi ngờ/có thể hoặc đã xác định SARS-CoV-2 nên mang khẩu trang phẫu thuật dùng một lần b
• Khoa ngoại trú (bệnh nhân nghi ngờ/có thể hoặc đã được xác định SARS-CoV-2) • Khu vực cách ly và khoa ICU • Kiểm tra mẫu bệnh phẩm không hô hấp ở bệnh nhân nghi ngờ / có thể hoặc được xác định SARS-CoV-2 • Siêu âm qua thực quản ở bệnh nhân nghi ngờ/có thể hoặc đã xác định SARS-CoV-2 • Các thủ thuật xâm lấn qua da (chụp mạch vành, PCI, EP) ở bệnh nhân nghi ngờ/có thể hoặc đã xác định SARS-CoV-2 • Vệ sinh dụng cụ phẫu thuật hoặc chẩn đoán (đầu dò siêu âm tim qua thành ngực/thực quản, ống nghe) được sử dụng ở bệnh nhân nghi ngờ / có thể hoặc đã xác định SARS-CoV-2 |
| Bảo vệ cấp III | • Mũ phẫu thuật dùng một lần
• Khẩu trang phòng hộ y tế (FFP3) • Đồng phục làm việc • Áo choàng • Găng tay phẫu thuật dùng một lần • Thiết bị phòng hộ hô hấp toàn mặt (Full-face respiratory protective devices) hoặc mặt nạ làm sạch không khí được cấp nguồn, nếu có |
Thủ thuật tạo khí dung: Phết mũi họng bằng tăm bông, đặt nội khí quản hoặc các thủ thuật khác trong đó bệnh nhân nghi ngờ/có thể hoặc đã xác định SARS-CoV-2 có thể phun hoặc văng dịch tiết hô hấp, dịch cơ thể hoặc máu |
|
a Ở một số quốc gia, mặt nạ được đeo rộng rãi theo quy định hoặc khuyến nghị của chính quyền trong bối cảnh COVID-19. Ở những khu vực có tỷ lệ mắc trong cộng đồng cao việc mang khẩu trang phẫu thuật trong tất cả các trường hợp tiếp xúc giữa bệnh nhân và nhân viên y tế. Tuy nhiên điều này có thể không cần thiết ở những khu vực có tỷ lệ mắc thấp trong cộng đồng. b Bệnh nhân nghi ngờ/có thể hoặc đã xác định SARS-CoV-2 nên mang khẩu trang phẫu thuật: · FFP2 và FFP3: Khẩu trang phòng hộ y tế 2 và 3 phin lọc · Trong trường hợp thiếu, FFP2 và FFP3 có thể được đeo đến 6 giờ · Nếu có thể, thủ thuật siêu âm tim qua thực quản nên mang mặt nạ FFP3 để tăng tính an toàn · Nên thay găng tay cho mọi lần thăm khám bệnh nhân · Mắt kính cá nhân và kính áp tròng KHÔNG được xem là bảo vệ mắt đầy đủ · Tất cả nhân viên chăm sóc sức khỏe nên tránh chạm vào mặt trong khi làm việc
|
||
Khẩu trang phòng hộ y tế 2 và 3 phin lọc (FFP3, FFP2) và N95 được thiết kế để đạt được sự phù hợp với khuôn mặt và lọc các hạt trong không khí rất hiệu quả. Mặt nạ làm sạch không khí được cấp nguồn (PAPR) là một loại PPE bao gồm mặt nạ phòng độc ở dạng mũ trùm, lấy không khí xung quanh bị nhiễm mầm bệnh, chủ động lọc các không khí nguy hại và đưa không khí sạch vào mặt và miệng của người dùng (Hình 4).

Hình 4: Các loại mặt nạ khác nhau được sử dụng theo loại thủ thuật và mức độ nguy cơ
Tất cả nhân viên, chuyên gia y tế nên thành thạo các kỹ thuật mặc vào và tháo ra PPE bao gồm kính bảo vệ mắt (Hình 5 và Hình 6) [58].
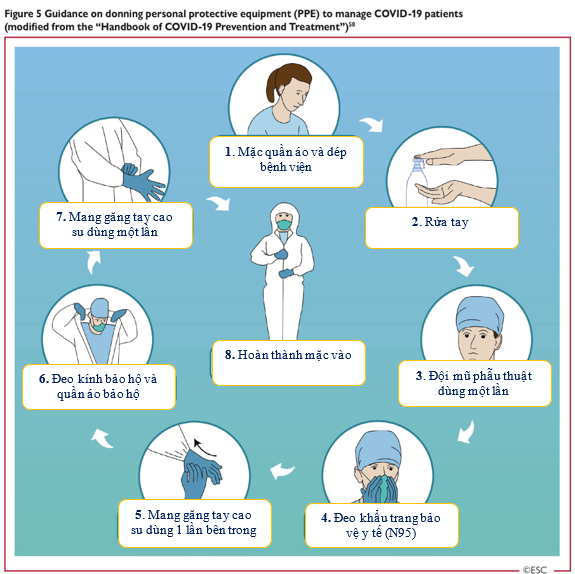
Hình 5: Hướng dẫn về việc mang thiết bị phòng hộ cá nhân trong quá trình chăm sóc và điều trị bệnh nhân COVID-19 (được sửa đổi từ ‘Sổ tay về phòng ngừa và điều trị COVID-19’)
| 1. Mặc quần áo và mang dép bệnh viện
2. Rửa tay 3. Đội mũ phẫu thuật dùng một lần 4. Đeo khẩu trang phòng hộ y tế (N95) |
5. Mang găng tay cao su dùng một lần bên trong
6. Đeo kính bảo hộ và quần áo bảo hộ 7. Mang găng tay cao su dùng một lần 8. Hoàn thành các bước mặc vào |
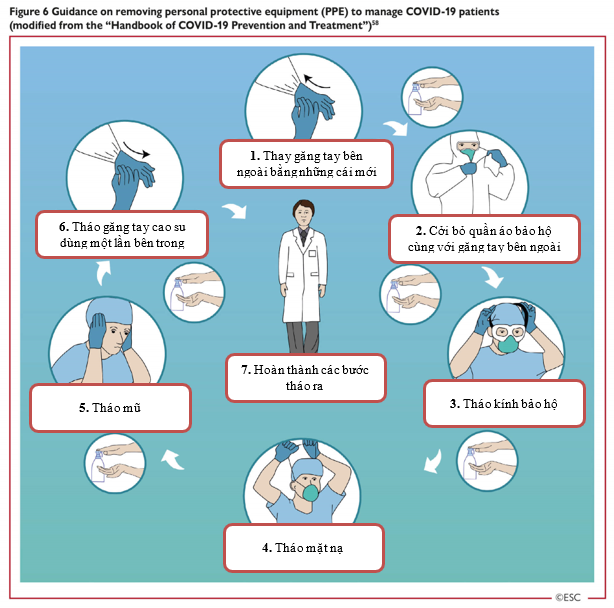
Hình 6: Hướng dẫn tháo thiết bị phòng hộ cá nhân (PPE) trong quá trình chăm sóc và điều trị bệnh nhân COVID-19 (được sửa đổi từ ‘Sổ tay phòng ngừa và điều trị COVID-19’) [58]
| 1. Thay găng tay bên ngoài bằng đôi mới
2. Cởi quần áo bảo hộ cùng với găng tay bên ngoài 3. Tháo kính bảo hộ |
4. Tháo mặt nạ
5. Tháo mũ 6. Tháo găng tay cao su dùng một lần bên trong 7. Hoàn thành các bước tháo ra |
5.2. Các khu vực chăm sóc
5.2.1 Khu vực ngoại trú
- Nếu có thể, nên cung cấp khẩu trang phẫu thuật cho bệnh nhân ngoại trú và nhân viên y tế, đặc biệt là ở các quốc gia có lây truyền trong cộng đồng;
- Các cơ sở y tế nên thực hiện việc sàng lọc để đánh giá tình trạng nguy cơ của bệnh nhân (Bảng 4) [55]
- Điều này sẽ cho phép phân biệt hai nhóm bệnh nhân
-
- Trường hợp có thể / nghi ngờ (the probable/suspected case) hoặc
- Trường hợp không thể xảy ra / không nghi ngờ hoặc âm tính.
Trường hợp thứ nhất nên được xử trí trong khu khám ngoại trú chuyên dụng với cấp độ bảo vệ nhân viên y tế cấp II, trong khi trường hợp thứ hai được phân vào khu khám ngoại trú khác với cấp độ bảo vệ nhân viên y tế cấp I (Bảng 5).
5.2.2 Khu vực nội trú
- Nếu có thể, nên cung cấp khẩu trang phẫu thuật cho bệnh nhân nội trú và nhân viên y tế, đặc biệt là ở các quốc gia có lây truyền trong cộng đồng [56-58].
- Bệnh nhân mới nhập viện vào Khoa tim mạch nên xem như có thể bị nhiễm SARS-CoV‑2 theo Bảng 4 [63]. Trong những trường hợp này, bệnh nhân nên xét nghiệm phết mũi họng bằng tăm bông (swab test) tầm soát COVID-19 và nên được xử trí trong thời gian đó với các biện pháp bảo vệ cấp II hoặc III (Bảng 5). Những bệnh nhân này cần được quản lý trong một khu vực dành riêng của Khoa;
- Các trường hợp đã xác định là COVID-19 nên được xử trí với bảo vệ cấp II hoặc III nếu có thể. Để phòng ngừa lây nhiễm trong không khí nên bố trí phòng đơn với phòng tắm chuyên dụng. Tuy nhiên, hầu hết các bệnh viện không đủ khả để đáp ứng tiêu chí cách ly cá nhân này mà thường những trường hợp đã xác định COVID-19 sẽ phải nằm chung phòng khi tình trạng quá tải xãy ra.
- Việc sử dụng các thiết bị y tế chuyên dụng (ví dụ: máy đo huyết áp, ống nghe và nhiệt kế) cho các trường hợp COVID-19 đã xác định / có thể xảy ra / nghi ngờ được khuyến cáo [56]. Nếu không thể, thiết bị phải được khử trùng theo hướng dẫn tại địa phương;
- Nếu phết mũi họng bằng tăm bông tầm soát COVID-19 âm tính, nhưng vẫn nghi ngờ nhiễm SARS-CoV ‑ 2, nên lập lại swab test lần thứ hai, hút dịch nội khí quản và / hoặc chụp CT phổi, tùy thuộc vào triệu chứng và khả năng tại địa phương, lưu ý độ nhạy hạn chế của phết mũi họng bằng tăm bông. Những bệnh nhân này nên được duy trì trong một khu vực riêng của Khoa, có phòng và nhà tắm riêng, cách ly cho đến khi có kết quả xét nghiệm mới [46].
- Các trường hợp khác nên được xử trí với bảo vệ cấp I (Bảng 5), trong khu vực “sạch” của Khoa [55].
- Nếu có đủ xét nghiệm, việc xét nghiệm tầm soát trên bệnh nhân không có triệu chứng COVID-19, ở những khu vực có tỷ lệ mắc cao cũng mang lại lợi ích phòng bệnh.
5.2.3 Khoa cấp cứu
- Nên cung cấp khẩu trang phẫu thuật cho mọi bệnh nhân của khoa cấp cứu, đặc biệt là ở các quốc gia có lây truyền trong cộng đồng;
- Sự an toàn của nhân viên/chuyên gia y tế trong môi trường làm việc tại khoa cấp cứu và ICU là một thách thức lớn và đòi hỏi phải được đào tạo chặt chẻ và chuyên nghiệp về việc sử dụng PPE thích hợp;
- Việc sàng lọc COVID-19 nên được thực hiện và xác định các khu vực dành riêng để quản lý những trường hợp không nghi ngờ từ các trường hợp nghi ngờ / có thể [55].
- Trước khi tiến hành hội chẩn/tư vấn tim mạch trong Khoa cấp cứu, nên thực hiện một cuộc phỏng vấn nhanh qua điện thoại để đánh giá xem bệnh nhân có nghi ngờ các triệu chứng COVID-19 hoặc các yếu tố nguy cơ COVID-19 (xem Bảng 3) hoặc hình ảnh X-quang / CT nghi ngờ [55].
- Nếu có bất kỳ nghi ngờ nào và tư vấn về tim mạch là khẩn cấp, mà không có cơ hội hoãn lại cho đến khi kết quả phết mũi họng bằng tăm bông, bệnh nhân nên được coi là dương tính với nhiễm SARS-CoV‑2 và phải thực hiện các biện pháp bảo vệ tối đa (Bảo vệ Cấp II, III trong trường hợp thực hiện thủ thuật có tạo khí dung (Bảng 5);
- Các trường hợp khác ở Khoa cấp cứu nên được xử trí với bảo vệ cấp I (Bảng 5).
5.2.4 Khoa hồi sức tích cực
- Vì bệnh nhân nhập viện ICU đa số là nguy kịch và có thể được hỗ trợ bằng thông khí (VD thở áp lực dương liên tục [CPAP], đặt nội khí quản thở máy), nên áp dụng ngưỡng bảo vệ cao đối với bệnh nhân đã xác định/nghi ngờ/có thể COVID-19 với mức bảo vệ cấp II hoặc bảo vệ cấp III trong trường hợp thực hiện thủ thuật có tạo khí dung (Bảng 5);
- Khuyến cáo mọi bệnh nhân đều có phòng riêng và bệnh nhân không COVID-19 nên được xử trí với bảo vệ cấp I (Bảng 5) bởi nhân viên y tế chăm sóc riêng khác với những người chăm sóc bệnh nhân COVID-19 [57, 58].
5.2.5. Phòng thông tim
- Nhân viên và chuyên gia y tế cần phải thành thạo các kỹ thuật mặc vào và tháo ra PPE bao gồm kính bảo vệ mắt (Hình 5 và Hình 6) [58]. Người quản lý phòng thông tim cần đảm bảo tính sẵn có, thay thế và đào tạo về việc sử dụng thiết bị này;
- Tất cả bệnh nhân vào phòng thông tim nên đeo khẩu trang phẫu thuật.
5.2.5.1. Nhồi máu cơ tim cấp ST chênh lên
Do không có thời gian chờ kết quả xét nghiệm phết mũi họng bằng tăm bông, do đó thủ thuật chụp và/hoặc can thiệp mạch vành nên thực hiện trong phòng thông tim chuyên dụng cho COVID-19, nếu có thể và bệnh nhân nên được xử lý theo Bảng 4. Ở những vùng có tỷ lệ lây truyền trong cộng đồng cao, điều đó là hợp lý xem như tất cả bệnh nhân có thể dương tính với SARS-CoV 2 và nhân viên y tế được bảo vệ tương ứng (Bảng 5).
5.2.5.2. Nhồi máu cơ tim cấp không ST chênh lên
- Nhồi máu cơ tim cấp không ST chênh lên có nguy cơ rất cao phải tiếp cận đánh giá như nhồi máu cơ tim cấp ST chênh lên và nhân viên y tế được bảo vệ phù hợp.
- Những bệnh nhân thuộc nhóm khác phải trải qua xét nghiệm phết mũi họng bằng tăm bông ngay sau khi nhập viện (Hình 12). Trong khi chờ kết quả xét nghiệm phết mũi họng bằng tăm bông, bệnh nhân phải được cách ly trong khu vực khoa cấp cứu chuyên dụng và được theo dõi vì tỷ lệ bệnh nhân nhiễm SARS-CoV ‑ 2 không có triệu chứng khá cao, với mục đích giảm nguy cơ lây nhiễm trong bệnh viện. Khi có hai kết quả âm tính trong vòng 48 giờ và không có triệu chứng nghi ngờ nhiễm virus, chụp mạch vành và can thiệp mạch vành qua da có thể được thực hiện trong phòng thông tim dành cho bệnh nhân SARS-CoV ‑ 2 âm tính.
- Bệnh nhân có xét nghiệm dương tính SARS-CoV‑2
- Nếu bệnh nhân được chỉ định điều trị can thiệp, thủ thuật này phải được thực hiện trong phòng thông tim chuyên dụng cho COVID-19 nếu có;
- Chỉ định đặt nội khí quản ở nhóm bệnh nhân này nên được sớm hơn và nên thực hiện ở khoa cấp cứu/ICU, tránh thực hiện trong phòng thông tim vì khả năng tạo khí dung lây nhiễm cao.
- Vì việc vận chuyển bệnh nhân từ phòng bệnh đến phòng thông tim có thể có nguy cơ lây truyền trong bệnh viện, nên một số thủ thuật như đặt ống thông Swan-Ganz, dẫn lưu màng ngoài tim và đặt bóng đối xung động mạch chủ nên xem xét thực hiện tại giường;
- Nhân viên phòng thông tim nên giảm tối thiểu và trong trường hợp bệnh nhân bất ổn huyết động, mọi nhân viên tham gia can thiệp và hồi sức nên đeo PPE cấp II hoặc cấp III (Bảng 5), bao gồm áo choàng, găng tay, kính bảo hộ (hoặc khiên) và mặt nạ FFP2 / FFP3 (Hình 4);
- Bất kỳ thủ thuật hút hoặc đặt nội khí quản hoặc hồi sức tim phổi có thể gây ra sự phát tán khí dung của dịch tiết đường hô hấp sẽ tăng khả năng phơi nhiễm cho nhân viên. Vì lý do này, việc sử dụng hệ thống mặt nạ làm sạch không khí được cấp nguồn có thể hợp lý (Hình 4), nếu có sẵn;
- Trong trường hợp thông khí bằng tay trong hồi sức tim phổi, bộ lọc khí hiệu quả cao HEPA có thể được đặt giữa ống và mặt nạ van túi để giảm nguy cơ phân tán khí dung;
- Bởi vì hầu hết các phòng thông tim không được thiết kế để cách ly nhiễm trùng với áp lực âm, nên việc làm sạch triệt để bề mặt và các thiết bị trong phòng phải được thực hiện sau mỗi thủ thuật. Lưu ý, thời gian trao đổi không khí của phòng thông tim nên được kiểm tra (tối thiểu 15 trao đổi mỗi giờ, lý tưởng là 30 trao đổi mỗi giờ).
5.2.6. Phòng thủ thuật điện sinh lý
Hầu hết các hoạt động điện sinh lý đang bị giảm hoặc trì hoãn ở các khu vực đã bị ảnh hưởng nghiêm trọng bởi sự bùng phát COVID-19. Hoạt động điện sinh lý còn lại nên được duy trì cho các loại bệnh nhân được chọn (Bảng 7 và Bảng 13).
Bảo vệ nhân viên và chuyên gia y tế [64]:
- Các phòng thủ thuật EP dành riêng cho bệnh nhân có khả năng nhiễm SARS-CoV‑2 thì không có sẵn ở hầu hết các cơ sở y tế nhưng nên được áp dụng bất cứ khi nào có thể;
- Tất cả bệnh nhân có chỉ định lâm sàng cho thủ thuật EP nên xét nghiệm phết mũi họng bằng tăm bông ngay sau khi nhập viện;
- Trong trường hợp bất ổn định huyết động và có thể mắc COVID-19 (Bảng 3), thủ thuật này phải được thực hiện bằng các biện pháp bảo vệ Cấp II (Bảng 5).
- Trong các tình huống nguy cấp như ngất và blốc nhĩ thất hoàn toàn, bệnh nhân cần được chuyển ngay đến phòng EP và tiến hành cấy máy tạo nhịp với các biện pháp bảo vệ cấp II (Bảng 5). Sau thủ thuật, những bệnh nhân này nên được chuyển đến khu vực COVID-19 chuyên dụng cho đến khi sàng lọc nhiễm SARS-CoV 2 được thực hiện;
- Trong trường hợp có hai kết quả âm tính trong vòng 48 giờ và không có triệu chứng nghi ngờ nhiễm COVID-19, thủ thuật chương trình có thể được thực hiện bằng các công cụ bảo vệ tiêu chuẩn;
- Bệnh nhân có xét nghiệm dương tính SARS-CoV‑2:
- Trong trường hợp huyết động ổn định, các thủ thuật cắt đốt nên được hoãn lại bằng cách sử dụng thuốc chống loạn nhịp tĩnh mạch như chỉ định rối loạn nhịp cơ bản;
- Việc bệnh nhân đến và đi từ phòng EP “chung” nên được vận hành bằng cách sử dụng các đường dẫn bên trong thích hợp;
- Số lượng nhân viên tham gia thủ thuật nên được giới hạn đến mức cần thiết. Lý tưởng nhất, một kỹ thuật viên/y tá, một thủ thuật viên chính, một trợ lý tại bàn điều khiển và một bác sĩ gây mê, khi được chỉ định;
- Không có hướng dẫn cụ thể nào liên quan đến loại kỹ thuật cấy và các thiết bị cấy, tuy nhiên, cần có công nghệ điều khiển từ xa;
Làm sạch và vệ sinh phòng EP nên được thực hiện sau mỗi thủ thuật.
5.2.7. Siêu âm tim qua thực quản, thở áp lực dương liên tục và đặt nội khí quản
Vấn đề chính là tải lượng virus trong đường thở có thể rất cao và rất dễ lây. Điều này gây ra nguy cơ đáng kể cho nhân viên y tế thực hiện thông khí không xâm lấn bằng CPAP hoặc thông khí xâm lấn bằng đặt nội khí quản. Theo đó, cần có sự thận trọng cao độ để ngăn ngừa lây nhiễm khi tiến hành thở CPAP, đặt nội khí quản hoặc khi đưa đầu dò siêu âm tim qua thực quản (TEE).
- Kiểm tra tình trạng SARS-CoV ‑ 2 trước khi thực hiện siêu âm tim qua thực quản
- Trong trường hợp có hai kết quả âm tính trong vòng 48 giờ và không có triệu chứng nghi ngờ nhiễm COVID-19, thủ thuật dự kiến có thể được thực hiện bằng các công cụ bảo vệ tiêu chuẩn.
- Ở những bệnh nhân có xét nghiệm SARS-CoV ‑ 2 dương tính hoặc không rõ tình trạng:
-
- Siêu âm tim tại giường thay thế siêu âm tim qua thực quản nhằm hạn chế nguy cơ lây nhiễm cho nhân viên y tế;
- Trong trường hợp thông khí xâm lấn và CPAP, nên sử dụng biện pháp bảo vệ Cấp III, trong khi đối với siêu âm tim qua thực quản, bảo vệ Cấp II có thể là đủ (Bảng 5).
5.3. Bệnh nhân
- Bệnh nhân tim mạch phải luôn được bảo vệ khỏi sự phơi nhiễm với nhiễm SARS-CoV‑2, vì kết quả sẽ tồi tệ hơn đối với nhóm bệnh nhân này khi họ nhiễm bệnh;
- Bệnh nhân nên được giáo dục về cách tự bảo vệ mình khỏi sự tiếp xúc từ virus và thông tin tốt nhất nên được cung cấp ở định dạng minh họa (ví dụ như bên dưới Hình 7).
- Thời gian bệnh nhân nằm viện nên ngắn nhất có thể, nhằm giảm thiểu sự phơi nhiễm cho cả chuyên gia y tế và bệnh nhân;
- Nếu có đủ nguồn lực nên được duy trì hoạt động để đối phó với tất cả các trường hợp cấp cứu tim mạch cả cho bệnh nhân mắc và không mắc COVID-19
- Bất kỳ sự nhập viện được hẹn trước nào cho mục đích chẩn đoán hoặc điều trị có thể trì hoãn được thì không nên thực hiện trong quá trình bùng phát dịch;
- Nhân viên nên được giáo dục để tôn trọng các biện pháp phòng ngừa lây nhiễm và bệnh viện phòng chờ chuyên dụng nơi có thể đảm bảo giãn cách xã hội.
Hiện tại, người ta biết rằng bệnh nhân tim mạch bị nhiễm COVID-19 có nguy cơ cao hơn kết cục xấu trong thời gian nằm bệnh viện [9]. Đây là lý do tại sao bắt buộc phải bảo vệ họ một cách hiệu quả khi tiếp xúc với các đối tượng bị nhiễm mà các triệu chứng liên quan đến COVID-19 vẫn không rõ ràng hoặc không chuyên biệt.
Các thủ thuật chương trình nên tránh trong đại dịch COVID-19 vào thời điểm hiện tại để không làm quá tải hệ thống y tế hoặc làm tăng nguy cơ lan truyền bệnh. Trong bối cảnh này, để giảm thiểu rủi ro lây truyền COVID-19, việc sử dụng chăm sóc y tế từ xa (telemedicine) là rất cần thiết đặc biệt đối với nhóm bệnh nhân dễ bị tổn thương như bệnh nhân lớn tuổi. Ngoài ra, chăm sóc y tế từ xa mang lại cơ hội cho người bệnh được nhiều chuyên gia và bác sĩ chuyên khoa khác nhau tư vấn, do đó cho phép bệnh nhân nhận được phương pháp trị liệu toàn diện mà không cần di chuyển từ nhà đến phòng khám ngoại trú hoặc đến bệnh viện. Ngoài ra, phục hồi chức năng từ xa (telerehabilitation) (hoặc phục hồi chức năng tại nhà với liên lạc qua điện thoại với nhóm phục hồi chức năng) là một lựa chọn cho bệnh nhân xuất viện sau một biến cố cấp tính. Cuối cùng, việc theo dõi chăm sóc từ xa bệnh nhân suy tim và bệnh nhân đã được cấy thiết bị tim mạch (máy tạo nhịp) ngày càng trở nên chuẩn hơn và có thể được xem xét áp dụng. Chăm sóc y tế từ xa đã được xem là có liên quan trong việc góp phần ngăn chặn sự bùng phát virus trong khi ngăn ngừa sức khỏe bệnh nhân xấu đi vì chẩn đoán sai hoặc điều trị sai bệnh tim mạch [67].
Ngoài việc chăm sóc y tế từ xa, “chăm sóc tại nhà” và “phòng khám di động” (‘home care’ and ‘mobile clinics’) hiện đang được đề xuất như một cách để ngăn chặn sự di chuyển không cần thiết của bệnh nhân tới bệnh viện, với điều kiện y tá và bác sĩ phải mặc PPE thích hợp. Giải pháp này có thể ngăn ngừa sự bất ổn lâm sàng của nhiều bệnh tim mạch (ví dụ suy tim mạn tính), đảm bảo sự tuân thủ điều trị lâu dài của bệnh nhân và đóng góp vào hình thức chăm sóc ‘tập trung vào cộng đồng’ (‘community-centred’) có thể có lợi hơn so với mô hình chăm sóc hoàn toàn ‘tập trung vào bệnh nhân’, nơi chỉ có bệnh nhân bị nhiễm bệnh, nhập viện tiêu thụ hầu hết các nguồn lực sẵn có của hệ thống chăm sóc sức khỏe.
Khi bệnh nhân tim mạch đến bệnh viện vì lý do chẩn đoán hoặc điều trị, họ phải luôn tự bảo vệ mình bằng cách đeo khẩu trang phẫu thuật (surgical masks), thực hiện giãn cách xã hội và rửa tay thích hợp bằng dung dịch cồn. Những yêu cầu này cần được nhân viên bệnh viện nhắc nhở hoặc cung cấp cho bệnh nhân [60] và ngược lại để bảo vệ bệnh nhân, nhân viên y tế cần mang khẩu trang phẫu thuật nghiêm túc cùng các biện pháp phòng ngừa lây nhiễm khác khi tiếp xúc người bệnh, tùy thuộc vào tỷ lệ lưu hành của COVID-19 trong cộng đồng địa phương.
Hình 7: Làm thế nào để tôi bảo vệ bản thân?
(Xem tiếp trong kỳ sau)
TÀI LIỆU THAM KHẢO
- Dong E, Du H, Gardner L. An interactive web-based dashboard to track COVID-19 in real Lancet Infect Dis 2020. https://doi.org/10.1016/S1473-3099(20)30120-1
- Clerkin KJ, Fried JA, Raikhelkar J, Sayer G, Griffin JM, Masoumi A, Jain SS, Burkhoff D, Kumaraiah D, Rabbani L, Schwartz A, Uriel N. Coronavirus Disease 2019 (COVID-19) and Cardiovascular Disease. Circulation https://doi.org/10.1161/CIRCULATIONAHA.120.046941
- Novel Coronavirus Pneumonia Emergency Response Epidemiology T. [The epidemiological characteristics of an outbreak of 2019 novel coronavirus diseases (COVID-19) in China]. Zhonghua Liu Xing Bing Xue Za Zhi 2020;41(2):145- https://doi.org/10.3760/cma.j.issn.0254-6450.2020.02.003
- Zhao D, Liu J, Wang M, Zhang X, Zhou M. Epidemiology of cardiovascular disease in China: current features and implications. Nat Rev Cardiol 2019;16(4):203- https://doi.org/10.1038/s41569-018-0119-4
- Wang D, Hu B, Hu C, Zhu F, Liu X, Zhang J, Wang B, Xiang H, Cheng Z, Xiong Y, Zhao Y, Li Y, Wang X, Peng Z. Clinical Characteristics of 138 Hospitalized Patients With 2019 Novel Coronavirus-Infected Pneumonia in Wuhan, China. JAMA https://doi.org/10.1001/jama.2020.1585
- Verity R, Okell LC, Dorigatti I, Winskill P, Whittaker C, Imai N, Cuomo-Dannenburg G, Thompson H, Walker PGT, Fu H, Dighe A, Griffin JT, Baguelin M, Bhatia S, Boonyasiri A, Cori A, Cucunubá Z, FitzJohn R, Gaythorpe K, Green W, Hamlet A, Hinsley W, Laydon D, Nedjati-Gilani G, Riley S, van Elsland S, Volz E, Wang H, Wang Y, Xi X, Donnelly CA, Ghani AC, Ferguson NM. Estimates of the severity of coronavirus disease 2019: a model-based The Lancet Infectious Diseases 2020. https://doi.org/10.1016/S1473- 3099(20)30243-7
- Onder G, Rezza G, Brusaferro S. Case-Fatality Rate and Characteristics of Patients Dying in Relation to COVID-19 in Italy. JAMA 2020. https://doi.org/10.1001/jama.2020.4683
- Wu Z, McGoogan JM. Characteristics of and Important Lessons From the Coronavirus Disease 2019 (COVID-19) Outbreak in China: Summary of a Report of 72314 Cases From the Chinese Center for Disease Control and Prevention. JAMA https://doi.org/10.1001/jama.2020.2648
- Driggin E, Madhavan MV, Bikdeli B, Chuich T, Laracy J, Bondi-Zoccai G, Brown TS, Nigoghossian C, Zidar DA, Haythe J, Brodie D, Beckman JA, Kirtane AJ, Stone GW, Krumholz HM, Parikh SA. Cardiovascular Considerations for Patients, Health Care Workers, and Health Systems During the Coronavirus Disease 2019 (COVID-19) J Am Coll Cardiol 2020. https://doi.org/10.1016/j.jacc.2020.03.031
- Zheng YY, Ma YT, Zhang JY, Xie X. COVID-19 and the cardiovascular system. Nat Rev Cardiol 2020. https://doi.org/10.1038/s41569-020-0360-5
- Xiong TY, Redwood S, Prendergast B, Chen M. Coronaviruses and the cardiovascular system: acute and long-term implications. Eur Heart J https://doi.org/10.1093/eurheartj/ehaa231
- Yu CM, Wong RS, Wu EB, Kong SL, Wong J, Yip GW, Soo YO, Chiu ML, Chan YS, Hui D, Lee N, Wu A, Leung CB, Sung JJ. Cardiovascular complications of severe acute respiratory Postgrad Med J 2006;82(964):140-4. https://doi.org/10.1136/pgmj.2005.037515
- Xu Z, Shi L, Wang Y, Zhang J, Huang L, Zhang C, Liu S, Zhao P, Liu H, Zhu L, Tai Y, Bai C, Gao T, Song J, Xia P, Dong J, Zhao J, Wang F-S. Pathological findings of COVID-19 associated with acute respiratory distress syndrome. The Lancet Respiratory Medicine https://doi.org/10.1016/S2213-2600(20)30076-X.
- Guo T, Fan Y, Chen M, Wu X, Zhang L, He T, Wang H, Wan J, Wang X, Lu Z. Cardiovascular Implications of Fatal Outcomes of Patients With Coronavirus Disease 2019 (COVID-19). JAMA Cardiol 2020. https://doi.org/10.1001/jamacardio.2020.1017
- Shi S, Qin M, Shen B, Cai Y, Liu T, Yang F, Gong W, Liu X, Liang J, Zhao Q, Huang H, Yang B, Huang C. Association of Cardiac Injury With Mortality in Hospitalized Patients With COVID-19 in Wuhan, China. JAMA Cardiology
- https://doi.org/10.1001/jamacardio.2020.0950
- Madjid M, Safavi-Naeini P, Solomon SD, Vardeny O. Potential Effects of Coronaviruses on the Cardiovascular System: A Review. JAMA Cardiol
- https://doi.org/10.1001/jamacardio.2020.1286
- Cui J, Li F, Shi ZL. Origin and evolution of pathogenic coronaviruses. Nat Rev Microbiol 2019;17(3):181-192. https://doi.org/10.1038/s41579-018-0118-9
- Zhou P, Yang XL, Wang XG, Hu B, Zhang L, Zhang W, Si HR, Zhu Y, Li B, Huang CL, Chen HD, Chen J, Luo Y, Guo H, Jiang RD, Liu MQ, Chen Y, Shen XR, Wang X, Zheng XS, Zhao K, Chen QJ, Deng F, Liu LL, Yan B, Zhan FX, Wang YY, Xiao GF, Shi ZL. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature 2020;579(7798):270-273. https://doi.org/10.1038/s41586-020-2012-7
- van Doremalen N, Bushmaker T, Morris DH, Holbrook MG, Gamble A, Williamson BN, Tamin A, Harcourt JL, Thornburg NJ, Gerber SI, Lloyd-Smith JO, de Wit E, Munster VJ. Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1. N Engl J Med 2020. https://doi.org/10.1056/NEJMc2004973
- Zhao S, Lin Q, Ran J, Musa SS, Yang G, Wang W, Lou Y, Gao D, Yang L, He D, Wang MH. Preliminary estimation of the basic reproduction number of novel coronavirus (2019- nCoV) in China, from 2019 to 2020: A data-driven analysis in the early phase of the Int J Infect Dis 2020;92:214-217. https://doi.org/10.1016/j.ijid.2020.01.050
- Guo YR, Cao QD, Hong ZS, Tan YY, Chen SD, Jin HJ, Tan KS, Wang DY, Yan Y. The origin, transmission and clinical therapies on coronavirus disease 2019 (COVID-19) outbreak – an update on the status. Mil Med Res 2020;7(1):11. https://doi.org/10.1186/s40779- 020-00240-0
- Liu Y, Yang Y, Zhang C, Huang F, Wang F, Yuan J, Wang Z, Li J, Li J, Feng C, Zhang Z, Wang L, Peng L, Chen L, Qin Y, Zhao D, Tan S, Yin L, Xu J, Zhou C, Jiang C, Liu L. Clinical and biochemical indexes from 2019-nCoV infected patients linked to viral loads and lung Sci China Life Sci 2020;63(3):364-374. https://doi.org/10.1007/s11427-020- 1643-8
- Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z, Xiang J, Wang Y, Song B, Gu X, Guan L, Wei Y, Li H, Wu X, Xu J, Tu S, Zhang Y, Chen H, Cao B. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet https://doi.org/10.1016/S0140-6736(20)30566-3
- Walls AC, Park YJ, Tortorici MA, Wall A, McGuire AT, Veesler D. Structure, Function, and Antigenicity of the SARS-CoV-2 Spike Glycoprotein. Cell https://doi.org/10.1016/j.cell.2020.02.058
- Yan R, Zhang Y, Li Y, Xia L, Guo Y, Zhou Q. Structural basis for the recognition of SARS- CoV-2 by full-length human ACE2. Science 2020;367(6485):1444-
- https://doi.org/10.1126/science.abb2762
- Santos RAS, Sampaio WO, Alzamora AC, Motta-Santos D, Alenina N, Bader M, Campagnole-Santos MJ. The ACE2/Angiotensin-(1-7)/MAS Axis of the Renin- Angiotensin System: Focus on Angiotensin-(1-7). Physiol Rev 2018;98(1):505- https://doi.org/10.1152/physrev.00023.2016
- Li W, Moore MJ, Vasilieva N, Sui J, Wong SK, Berne MA, Somasundaran M, Sullivan JL, Luzuriaga K, Greenough TC, Choe H, Farzan M. Angiotensin-converting enzyme 2 is a functional receptor for the SARS coronavirus. Nature 2003;426(6965):450- https://doi.org/10.1038/nature02145
- Hoffmann M, Kleine-Weber H, Schroeder S, Kruger N, Herrler T, Erichsen S, Schiergens TS, Herrler G, Wu NH, Nitsche A, Muller MA, Drosten C, Pohlmann S. SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Cell 2020. https://doi.org/10.1016/j.cell.2020.02.052
- Wu Y. Compensation of ACE2 Function for Possible Clinical Management of 2019-nCoV- Induced Acute Lung Injury. Virol Sin 2020. https://doi.org/10.1007/s12250-020- 00205-6
- Hamming I, Timens W, Bulthuis ML, Lely AT, Navis G, van Goor H. Tissue distribution of ACE2 protein, the functional receptor for SARS coronavirus. A first step in understanding SARS pathogenesis. J Pathol 2004;203(2):631- https://doi.org/10.1002/path.1570
- Zou X, Chen K, Zou J, Han P, Hao J, Han Z. Single-cell RNA-seq data analysis on the receptor ACE2 expression reveals the potential risk of different human organs vulnerable to 2019-nCoV infection. Front Med 2020. https://doi.org/10.1007/s11684- 020-0754-0
- Chen C, Zhou Y, Wang DW. SARS-CoV-2: a potential novel etiology of fulminant Herz 2020. https://doi.org/10.1007/s00059-020-04909-z
- Chen L, Li X, Chen M, Feng Y, Xiong C. The ACE2 expression in human heart indicates new potential mechanism of heart injury among patients infected with SARS-CoV-2. Cardiovascular Research 2020. https://doi.org/10.1093/cvr/cvaa078
- Fang L, Karakiulakis G, Roth M. Are patients with hypertension and diabetes mellitus at increased risk for COVID-19 infection? Lancet Respir Med https://doi.org/10.1016/S2213-2600(20)30116-8
- Kuster GM, Pfister O, Burkard T, Zhou Q, Twerenbold R, Haaf P, Widmer AF, Osswald S. SARS-CoV2: should inhibitors of the renin-angiotensin system be withdrawn in patients with COVID-19? Eur Heart J 2020. https://doi.org/10.1093/eurheartj/ehaa235
- Ferrario CM, Jessup J, Chappell MC, Averill DB, Brosnihan KB, Tallant EA, Diz DI, Gallagher PE. Effect of angiotensin-converting enzyme inhibition and angiotensin II receptor blockers on cardiac angiotensin-converting enzyme 2. Circulation 2005; 111(20) : 2605-10. https://doi.org/10.1161/CIRCULATIONAHA.104.510461
- Deshotels MR, Xia H, Sriramula S, Lazartigues E, Filipeanu CM. Angiotensin II mediates angiotensin converting enzyme type 2 internalization and degradation through an angiotensin II type I receptor-dependent mechanism. Hypertension 2014;64(6):1368- https://doi.org/10.1161/HYPERTENSIONAHA.114.03743
- Vaduganathan M, Vardeny O, Michel T, McMurray JJV, Pfeffer MA, Solomon SD. Renin- Angiotensin-Aldosterone System Inhibitors in Patients with Covid-19. N Engl J Med https://doi.org/10.1056/NEJMsr2005760
- Sun ML, Yang JM, Sun YP, Su GH. [Inhibitors of RAS Might Be a Good Choice for the Therapy of COVID-19 Pneumonia]. Zhonghua Jie He He Hu Xi Za Zhi 2020;43(3):219- https://doi.org/10.3760/cma.j.issn.1001-0939.2020.03.016
- Danser AHJ, Epstein M, Batlle D. Renin-Angiotensin System Blockers and the COVID-19 Pandemic: At Present There Is No Evidence to Abandon Renin-Angiotensin System Hypertension 2020: HYPERTENSIONAHA12015082. https://doi.org/10.1161/HYPERTENSIONAHA.120.15082
- Inciardi RM, Lupi L, Zaccone G, Italia L, Raffo M, Tomasoni D, Cani DS, Cerini M, Farina D, Gavazzi E, Maroldi R, Adamo M, Ammirati E, Sinagra G, Lombardi CM, Metra M. Cardiac Involvement in a Patient With Coronavirus Disease 2019 (COVID-19). JAMA Cardiol https://doi.org/10.1001/jamacardio.2020.1096
- Guzik TJ, Mohiddin SA, Dimarco A, Patel V, Savvatis K, Marelli-Berg F, Madhur MS, Tomaszewski M, Maffia P, D’Acquisto F, Nicklin S, Marian AJ, R. N, Murray E, Guzik B, Berry C, Touyz RM, Kreutz R, Wang DW, Sagliocco O, Crea F, Thomson EC, McInnes I. COVID-19 and the cardiovascular system – implications for risk assessment, diagnosis and treatment options. Cardiovasc Res. 2020;In https://doi.org/10.1093/cvr/cvaa106
- Drummond GR, Vinh A, Guzik TJ, Sobey CG. Immune mechanisms of hypertension. Nat Rev Immunol 2019;19(8):517-532. https://doi.org/10.1038/s41577-019-0160-5
- Maffia P, Guzik TJ. When, where, and how to target vascular inflammation in the post- CANTOS era? Eur Heart J 2019;40(30):2492- https://doi.org/10.1093/eurheartj/ehz133
- Li Z, Guo X, Hao W, Wu Y, Ji Y, Zhao Y, Liu F, Xie X. The relationship between serum interleukins and T-lymphocyte subsets in patients with severe acute respiratory syndrome. Chinese medical journal 2003;116:981-4.
- Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, Zhang L, Fan G, Xu J, Gu X, Cheng Z, Yu T, Xia J, Wei Y, Wu W, Xie X, Yin W, Li H, Liu M, Xiao Y, Gao H, Guo L, Xie J, Wang G, Jiang R, Gao Z, Jin Q, Wang J, Cao B. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. The Lancet 2020;395(10223):497- https://doi.org/10.1016/S0140-6736(20)30183-5
- Ruan Q, Yang K, Wang W, Jiang L, Song J. Clinical predictors of mortality due to COVID- 19 based on an analysis of data of 150 patients from Wuhan, China. Intensive Care Med https://doi.org/10.1007/s00134-020-05991-x
- Siedlinski M, Jozefczuk E, Xu X, Teumer A, Evangelou E, Schnabel RB, Welsh P, Maffia P, Erdmann J, Tomaszewski M, Caulfield MJ, Sattar N, Holmes MV, Guzik TJ. White Blood Cells and Blood Pressure: A Mendelian Randomization Study. Circulation https://doi.org/10.1161/CIRCULATIONAHA.119.045102
- Youn JC, Yu HT, Lim BJ, Koh MJ, Lee J, Chang DY, Choi YS, Lee SH, Kang SM, Jang Y, Yoo OJ, Shin EC, Park S. Immunosenescent CD8+ T cells and C-X-C chemokine receptor type 3 chemokines are increased in human hypertension. Hypertension 2013;62(1):126- ttps://doi.org/10.1161/HYPERTENSIONAHA. 113.00689
- Chan JF, Yip CC, To KK, Tang TH, Wong SC, Leung KH, Fung AY, Ng AC, Zou Z, Tsoi HW, Choi GK, Tam AR, Cheng VC, Chan KH, Tsang OT, Yuen KY. Improved molecular diagnosis of COVID-19 by the novel, highly sensitive and specific COVID-19-RdRp/Hel real-time reverse transcription-polymerase chain reaction assay validated in vitro and with clinical specimens. J Clin Microbiol 2020. https://doi.org/10.1128/JCM.00310-20
- World Health Organization. Laboratory testing for coronavirus disease 2019 (COVID-19) in suspected human cases: interim guidance, 2 March 2020. (2020; date last accessed). https://apps.who.int/iris/handle/10665/331329
- China National Health Commission. National health commission of the people’s republic of China. Chinese clinical guidance for covid-19 pneumonia diagnosis and treatment (7th edition). (March 16, 2020; date last accessed). http://kjfy.meetingchina.org/msite/news/show/cn/3337.html
- Ai T, Yang Z, Hou H, Zhan C, Chen C, Lv W, Tao Q, Sun Z, Xia L. Correlation of Chest CT and RT-PCR Testing in Coronavirus Disease 2019 (COVID-19) in China: A Report of 1014 Cases. Radiology 2020:200642. https://doi.org/10.1148/radiol.2020200642
- World Health Organization. Global surveillance for COVID-19 caused by human infection with COVID-19 virus: interim guidance, 20 March 2020. (2020; date last accessed). https://extranet.who.int/iris/restricted/handle/10665/331506
- Center for Disease Control and Prevention. Coronavirus (COVID- 19). https://www.cdc.gov/coronavirus/2019-nCoV/index.html
- European Centre for Disease Prevention and Control. ECDC technical report- Infection prevention and control for COVID-19 in healthcare settings – first update 12 March 2020 (March 12, 2020; date last accessed). https://www.ecdc.europa.eu/sites/default/files/documents/COVID-19-infection- prevention-and-control-healthcare-settings-march-2020.pdf
- Chen X. Protecting cardiologists during the COVID-19 epidemic – lessons from Wuhan, (March 26, 2020; date last accessed). https://www.escardio.org/Education/COVID-19-and-Cardiology/protecting- cardiologists-during-the-covid-19-epidemic-lessons-from-wuhan
- Editor-in-Chief P, Yu L. Handbook of COVID-19 Prevention and Treatment; 2020. https://covid-19.alibabacloud.com/
- Luo M, Cao S, Wei L, Tang R, Hong S, Liu R, Wang Y. Precautions for Intubating Patients with COVID-19. Anesthesiology: The Journal of the American Society of Anesthesiologists 2020. https://doi.org/10.1097/aln.0000000000003288
- Center for Disease Control and Prevention. Coronavirus disease 2019 (COVID-19) – symptoms of Coronavirus. (March 20, 2020; date last accessed). https://www.cdc.gov/coronavirus/2019-ncov/symptoms-testing/symptoms.html
- Guan WJ, Ni ZY, Hu Y, Liang WH, Ou CQ, He JX, Liu L, Shan H, Lei CL, Hui DSC, Du B, Li LJ, Zeng G, Yuen KY, Chen RC, Tang CL, Wang T, Chen PY, Xiang J, Li SY, Wang JL, Liang ZJ, Peng YX, Wei L, Liu Y, Hu YH, Peng P, Wang JM, Liu JY, Chen Z, Li G, Zheng ZJ, Qiu SQ, Luo J, Ye CJ, Zhu SY, Zhong NS, China Medical Treatment Expert Group for C. Clinical Characteristics of Coronavirus Disease 2019 in China. N Engl J Med
- https://doi.org/10.1056/NEJMoa2002032
- World Health Organization. Advice on the use of masks in the context of COVID-
- (April 6, 2020; date last accessed). https://www.who.int/publications- detail/advice-on-the-use-of-masks-in-the-community-during-home-care-and-in- healthcare-settings-in-the-context-of-the-novel-coronavirus-(2019-ncov)-outbreak
- Shi H, Han X, Jiang N, Cao Y, Alwalid O, Gu J, Fan Y, Zheng C. Radiological findings from 81 patients with COVID-19 pneumonia in Wuhan, China: a descriptive study. The Lancet Infectious Diseases 2020;20(4):425-434. https://doi.org/10.1016/S1473- 3099(20)30086-4
- Zeng J, Huang J, Pan L. How to balance acute myocardial infarction and COVID-19: the protocols from Sichuan Provincial People’s Hospital. Intensive Care Medicine https://doi.org/10.1007/s00134-020-05993-9
- Chen N, Zhou M, Dong X, Qu J, Gong F, Han Y, Qiu Y, Wang J, Liu Y, Wei Y, Xia Ja, Yu T, Zhang X, Zhang L. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. The Lancet 2020;395(10223):507-513. https://doi.org/10.1016/S0140-6736(20)30211-7
- Lee IK, Wang CC, Lin MC, Kung CT, Lan KC, Lee CT. Effective strategies to prevent coronavirus disease-2019 (COVID-19) outbreak in hospital. J Hosp Infect 2020. https://doi.org/10.1016/j.jhin.2020.02.022
- Hollander JE, Carr BG. Virtually Perfect? Telemedicine for Covid-19. N Engl J Med https://doi.org/10.1056/NEJMp2003539
- N, Ciocca A, Giupponi A, Brambillasca P, Lussana F, Pisano M, Goisis G, Bonacina D, Fazzi F, Naspro R, Longhi L, Cereda M, Montaguti C. At the Epicenter of the Covid-19 Pandemic and Humanitarian Crises in Italy: Changing Perspectives on Preparation and Mitigation. Catalyst non-issue content
- 2020;1(2). https://doi.org/10.1056/CAT.20.0080
- Rombola G, Heidempergher M, Pedrini L, Farina M, Aucella F, Messa P, Brunori G. Practical indications for the prevention and management of SARS-CoV-2 in ambulatory dialysis patients: lessons from the first phase of the epidemics in Lombardy. J Nephrol 2020;33(2):193-196. https://doi.org/10.1007/s40620-020-00727-y
- Arentz M, Yim E, Klaff L, Lokhandwala S, Riedo FX, Chong M, Lee M. Characteristics and Outcomes of 21 Critically Ill Patients With COVID-19 in Washington State. JAMA https://doi.org/10.1001/jama.2020.4326
- Adams JG, Walls RM. Supporting the Health Care Workforce During the COVID-19 Global JAMA 2020. https://doi.org/10.1001/jama.2020.3972
- World Health Organization. COVID 19: Occupational Health. (March 9, 2020; date last accessed). https://www.who.int/news-room/detail/09-03-2020-covid-19- occupational-health
- Lippi G, Lavie CJ, Sanchis-Gomar F. Cardiac troponin I in patients with coronavirus disease 2019 (COVID-19): Evidence from a meta-analysis. Prog Cardiovasc Dis https://doi.org/10.1016/j.pcad.2020.03.001
- Vergano MBGG, A.; Gristina, G.; Livigni, S.; Mistraletti, G.; Petrini, F. Clinical Ethics Recommendations for the Allocation of Intensive Care Treatments in exceptional, resource-limited circumstances – Version n. 1. (Mar 16, 2020; date last accessed). http://www.siaarti.it/SiteAssets/News/COVID19%20-
- %20documenti%20SIAARTI/SIAARTI%20-%20Covid-19%20-
- %20Clinical%20Ethics%20Reccomendations.pdf
- Regione Lombardia. Coronavirus – Ultimi provvedimenti. (March 30, 2020; date last accessed). https://www.regione.lombardia.it/wps/portal/istituzionale/HP/DettaglioRedazionale/servizi-e-informazioni/cittadini/salute-e-prevenzione/Prevenzione-e-benessere/red- coronavirusnuoviaggiornamenti
- Grasselli G, Pesenti A, Cecconi M. Critical Care Utilization for the COVID-19 Outbreak in Lombardy, Italy: Early Experience and Forecast During an Emergency Response. JAMA https://doi.org/10.1001/jama.2020.4031
- National Health Committee of the People’s Republic of China. Notice of the general office of the national health and health commission on printing and distributing the work plan for the transport of pneumonia cases with new coronavirus infection
- (trial). (January 27, 2020; date last accessed). http://www.nhc.gov.cn/yzygj/s7653p/202001/ccee6ec0942a42a18df8e5ce6329b6f5. shtml
- Han Y, Zeng H, Jiang H, Yang Y, Yuan Z, Cheng X, Jing Z, Liu B, Chen J, Nie S, Zhu J, Li F, Ma CSC Expert Consensus on Principles of Clinical Management of Patients with Severe Emergent Cardiovascular Diseases during the COVID-19 Epidemic. Circulation 2020. https://doi.org/10.1161/CIRCULATIONAHA.120.047011
- Porcheddu R, Serra C, Kelvin D, Kelvin N, Rubino S. Similarity in Case Fatality Rates (CFR) of COVID-19/SARS-COV-2 in Italy and China. J Infect Dev Ctries 2020;14(2):125- https://doi.org/10.3855/jidc.12600
- Biddison LD, Berkowitz KA, Courtney B, De Jong CM, Devereaux AV, Kissoon N, Roxland BE, Sprung CL, Dichter JR, Christian MD, Powell T, Task Force for Mass Critical C, Task Force for Mass Critical C. Ethical considerations: care of the critically ill and injured during pandemics and disasters: CHEST consensus statement. Chest 2014;146(4 Suppl):e145S-55S. https://doi.org/10.1378/chest.14-0742
- Bonnefoy-Cudraz E, Bueno H, Casella G, De Maria E, Fitzsimons D, Halvorsen S, Hassager C, Iakobishvili Z, Magdy A, Marandi T, Mimoso J, Parkhomenko A, Price S, Rokyta R, Roubille F, Serpytis P, Shimony A, Stepinska J, Tint D, Trendafilova E, Tubaro M, Vrints C, Walker D, Zahger D, Zima E, Zukermann R, Lettino M. Editor’s Choice – Acute Cardiovascular Care Association Position Paper on Intensive Cardiovascular Care Units: An update on their definition, structure, organisation and function. Eur Heart J Acute Cardiovasc Care 2018;7(1):80-95. https://doi.org/10.1177/2048872617724269
- Wu C, Chen X, Cai Y, Xia Ja, Zhou X, Xu S, Huang H, Zhang L, Zhou X, Du C, Zhang Y, Song J, Wang S, Chao Y, Yang Z, Xu J, Zhou X, Chen D, Xiong W, Xu L, Zhou F, Jiang J, Bai C, Zheng J, Song Y. Risk Factors Associated With Acute Respiratory Distress Syndrome and Death in Patients With Coronavirus Disease 2019 Pneumonia in Wuhan, China. JAMA Internal Medicine 2020. https://doi.org/10.1001/jamainternmed.2020.0994
- Ferguson ND, Fan E, Camporota L, Antonelli M, Anzueto A, Beale R, Brochard L, Brower R, Esteban A, Gattinoni L, Rhodes A, Slutsky AS, Vincent JL, Rubenfeld GD, Thompson BT, Ranieri VM. The Berlin definition of ARDS: an expanded rationale, justification, and supplementary material. Intensive Care Med 2012;38(10):1573- https://doi.org/10.1007/s00134-012-2682-1
- Thiele H, Ohman EM, de Waha-Thiele S, Zeymer U, Desch S. Management of cardiogenic shock complicating myocardial infarction: an update 2019. Eur Heart J 2019;40(32):2671-2683. https://doi.org/10.1093/eurheartj/ehz363
- Yang X, Yu Y, Xu J, Shu H, Xia Ja, Liu H, Wu Y, Zhang L, Yu Z, Fang M, Yu T, Wang Y, Pan S, Zou X, Yuan S, Shang Y. Clinical course and outcomes of critically ill patients with SARS- CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational The Lancet Respiratory Medicine. https://doi.org/10.1016/S2213- 2600(20)30079-5
- Baran DA, Grines CL, Bailey S, Burkhoff D, Hall SA, Henry TD, Hollenberg SM, Kapur NK, O’Neill W, Ornato JP, Stelling K, Thiele H, van Diepen S, Naidu SS. SCAI clinical expert consensus statement on the classification of cardiogenic shock: This document was endorsed by the American College of Cardiology (ACC), the American Heart Association (AHA), the Society of Critical Care Medicine (SCCM), and the Society of Thoracic Surgeons (STS) in April 2019. Catheter Cardiovasc Interv 2019;94(1):29- https://doi.org/10.1002/ccd.28329
- Hu H, Ma F, Wei X, Fang Y. Coronavirus fulminant myocarditis saved with glucocorticoid and human immunoglobulin. Eur Heart J https://doi.org/10.1093/eurheartj/ehaa190
- Musher DM, Abers MS, Corrales-Medina VF. Acute Infection and Myocardial Infarction. N Engl J Med 2019;380(2):171-176. https://doi.org/10.1056/NEJMra1808137
- Kwong JC, Li P, Redelmeier DA. Influenza morbidity and mortality in elderly patients receiving statins: a cohort study. PLoS One
- 2009;4(11):e8087. https://doi.org/10.1371/journal.pone.0008087
- Corrales-Medina VF, Musher DM, Wells GA, Chirinos JA, Chen L, Fine MJ. Cardiac complications in patients with community-acquired pneumonia: incidence, timing, risk factors, and association with short-term mortality. Circulation 2012;125(6):773- https://doi.org/10.1161/CIRCULATIONAHA.111.040766
- Corrales-Medina VF, Alvarez KN, Weissfeld LA, Angus DC, Chirinos JA, Chang CC, Newman A, Loehr L, Folsom AR, Elkind MS, Lyles MF, Kronmal RA, Yende S. Association between hospitalization for pneumonia and subsequent risk of cardiovascular disease. JAMA 2015;313(3):264-74. https://doi.org/10.1001/jama.2014.18229
- Madjid M, Miller CC, Zarubaev VV, Marinich IG, Kiselev OI, Lobzin YV, Filippov AE, Casscells SW, 3rd. Influenza epidemics and acute respiratory disease activity are associated with a surge in autopsy-confirmed coronary heart disease death: results from 8 years of autopsies in 34,892 subjects. Eur Heart J 2007;28(10):1205- https://doi.org/10.1093/eurheartj/ehm035
- Peiris JS, Chu CM, Cheng VC, Chan KS, Hung IF, Poon LL, Law KI, Tang BS, Hon TY, Chan CS, Chan KH, Ng JS, Zheng BJ, Ng WL, Lai RW, Guan Y, Yuen KY, Group HUSS. Clinical progression and viral load in a community outbreak of coronavirus-associated SARS pneumonia: a prospective study. Lancet 2003;361(9371):1767- https://doi.org/10.1016/s0140-6736(03)13412-5
- Gao C, Wang Y, Gu X, Shen X, Zhou D, Zhou S, Huang JA, Cao B, Guo Q, Community- Acquired Pneumonia-China N. Association Between Cardiac Injury and Mortality in Hospitalized Patients Infected With Avian Influenza A (H7N9) Virus. Crit Care Med 2020;48(4):451-458. https://doi.org/10.1097/CCM.0000000000004207
- Flores F, Walter J, Wussler D, Kozhuharov N, Nowak A, Dinort J, Badertscher P, Martin J, Sabti Z, du Fay de Lavallaz J, Nestelberger T, Boeddinghaus J, Zimmermann T, Koechlin L, Glatz B, Czmok R, Michou E, Gualandro DM, Breidthardt T, Mueller C. Direct comparison of high-sensitivity cardiac troponin t and i for prediction of mortality in patients with pneumonia. J Clin Chem Lab Med 2019;2(2):1000131.
- Roffi M, Patrono C, Collet JP, Mueller C, Valgimigli M, Andreotti F, Bax JJ, Borger MA, Brotons C, Chew DP, Gencer B, Hasenfuss G, Kjeldsen K, Lancellotti P, Landmesser U, Mehilli J, Mukherjee D, Storey RF, Windecker S, Group ESCSD. 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: Task Force for the Management of Acute Coronary Syndromes in Patients Presenting without Persistent ST-Segment Elevation of the European Society of Cardiology (ESC). Eur Heart J 2016;37(3):267- https://doi.org/10.1093/eurheartj/ehv320
- Ibanez B, James S, Agewall S, Antunes MJ, Bucciarelli-Ducci C, Bueno H, Caforio ALP, Crea F, Goudevenos JA, Halvorsen S, Hindricks G, Kastrati A, Lenzen MJ, Prescott E, Roffi M, Valgimigli M, Varenhorst C, Vranckx P, Widimsky P, Group ESCSD. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST- segment elevation: The Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J 2018;39(2):119-177. https://doi.org/10.1093/eurheartj/ehx393
- Christ-Crain M, Breidthardt T, Stolz D, Zobrist K, Bingisser R, Miedinger D, Leuppi J, Tamm M, Mueller B, Mueller C. Use of B-type natriuretic peptide in the risk stratification of community-acquired pneumonia. J Intern Med 2008;264(2):166- https://doi.org/10.1111/j.1365-2796.2008.01934.x
- Mueller C, Laule-Kilian K, Frana B, Rodriguez D, Scholer A, Schindler C, Perruchoud AP. Use of B-type natriuretic peptide in the management of acute dyspnea in patients with pulmonary disease. Am Heart J 2006;151(2):471- https://doi.org/10.1016/j.ahj.2005.03.036
- Mueller C, McDonald K, de Boer RA, Maisel A, Cleland JGF, Kozhuharov N, Coats AJS, Metra M, Mebazaa A, Ruschitzka F, Lainscak M, Filippatos G, Seferovic PM, Meijers WC, Bayes-Genis A, Mueller T, Richards M, Januzzi JL, Jr., Heart Failure Association of the European Society of C. Heart Failure Association of the European Society of Cardiology practical guidance on the use of natriuretic peptide concentrations. Eur J Heart Fail 2019;21(6):715-731. https://doi.org/10.1002/ejhf.1494
- Giannitsis E, Mair J, Christersson C, Siegbahn A, Huber K, Jaffe AS, Peacock WF, Plebani M, Thygesen K, Mockel M, Mueller C, Lindahl B, Biomarker Study Group of the European Society of Cardiology Acute Cardiovascular Care A. How to use D-dimer in acute cardiovascular care. Eur Heart J Acute Cardiovasc Care 2017;6(1):69- https://doi.org/10.1177/2048872615610870
- Konstantinides SV, Meyer G, Becattini C, Bueno H, Geersing GJ, Harjola VP, Huisman MV, Humbert M, Jennings CS, Jimenez D, Kucher N, Lang IM, Lankeit M, Lorusso R, Mazzolai L, Meneveau N, Ainle FN, Prandoni P, Pruszczyk P, Righini M, Torbicki A, Van Belle E, Zamorano JL, The Task Force for the d, management of acute pulmonary embolism of the European Society of C. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS): The Task Force for the diagnosis and management of acute pulmonary embolism of the European Society of Cardiology (ESC). Eur Respir J 2019;54(3). https://doi.org/10.1183/13993003.01647-2019
- Kearon C, de Wit K, Parpia S, Schulman S, Afilalo M, Hirsch A, Spencer FA, Sharma S, D’Aragon F, Deshaies JF, Le Gal G, Lazo-Langner A, Wu C, Rudd-Scott L, Bates SM, Julian JA, Investigators PES. Diagnosis of Pulmonary Embolism with d-Dimer Adjusted to Clinical Probability. N Engl J Med 2019;381(22):2125- https://doi.org/10.1056/NEJMoa1909159
- van der Hulle T, Cheung WY, Kooij S, Beenen LFM, van Bemmel T, van Es J, Faber LM, Hazelaar GM, Heringhaus C, Hofstee H, Hovens MMC, Kaasjager KAH, van Klink RCJ, Kruip M, Loeffen RF, Mairuhu ATA, Middeldorp S, Nijkeuter M, van der Pol LM, Schol- Gelok S, Ten Wolde M, Klok FA, Huisman MV, group Ys. Simplified diagnostic management of suspected pulmonary embolism (the YEARS study): a prospective, multicentre, cohort study. Lancet 2017;390(10091):289- https://doi.org/10.1016/S0140-6736(17)30885-1
- van der Pol LM, Tromeur C, Bistervels IM, Ni Ainle F, van Bemmel T, Bertoletti L, Couturaud F, van Dooren YPA, Elias A, Faber LM, Hofstee HMA, van der Hulle T, Kruip M, Maignan M, Mairuhu ATA, Middeldorp S, Nijkeuter M, Roy PM, Sanchez O, Schmidt J, Ten Wolde M, Klok FA, Huisman MV, Artemis Study I. Pregnancy-Adapted YEARS Algorithm for Diagnosis of Suspected Pulmonary Embolism. N Engl J Med 2019;380(12):1139-1149. https://doi.org/10.1056/NEJMoa1813865
- Patel AB, Verma A. COVID-19 and Angiotensin-Converting Enzyme Inhibitors and Angiotensin Receptor Blockers: What Is the Evidence? JAMA https://doi.org/10.1001/jama.2020.4812
- Boeddinghaus J, Nestelberger T, Twerenbold R, Neumann JT, Lindahl B, Giannitsis E, Sorensen NA, Badertscher P, Jann JE, Wussler D, Puelacher C, Rubini Gimenez M, Wildi K, Strebel I, Du Fay de Lavallaz J, Selman F, Sabti Z, Kozhuharov N, Potlukova E, Rentsch K, Miro O, Martin-Sanchez FJ, Morawiec B, Parenica J, Lohrmann J, Kloos W, Buser A, Geigy N, Keller DI, Osswald S, Reichlin T, Westermann D, Blankenberg S, Mueller C, Apace B, Investigators T-A. Impact of age on the performance of the ESC 0/1h- algorithms for early diagnosis of myocardial infarction. Eur Heart J 2018;39(42):3780- https://doi.org/10.1093/eurheartj/ehy514
- Nestelberger T, Wildi K, Boeddinghaus J, Twerenbold R, Reichlin T, Gimenez MR, Puelacher C, Jaeger C, Grimm K, Sabti Z, Hillinger P, Kozhuharov N, du Fay de Lavallaz J, Pinck F, Lopez B, Salgado E, Miro O, Bingisser R, Lohrmann J, Osswald S, Mueller C. Characterization of the observe zone of the ESC 2015 high-sensitivity cardiac troponin 0h/1h-algorithm for the early diagnosis of acute myocardial infarction. Int J Cardiol 2016;207:238-45. https://doi.org/10.1016/j.ijcard.2016.01.112
- Twerenbold R, Badertscher P, Boeddinghaus J, Nestelberger T, Wildi K, Puelacher C, Sabti Z, Rubini Gimenez M, Tschirky S, du Fay de Lavallaz J, Kozhuharov N, Sazgary L, Mueller D, Breidthardt T, Strebel I, Flores Widmer D, Shrestha S, Miro O, Martin- Sanchez FJ, Morawiec B, Parenica J, Geigy N, Keller DI, Rentsch K, von Eckardstein A, Osswald S, Reichlin T, Mueller C. 0/1-Hour Triage Algorithm for Myocardial Infarction in Patients With Renal Dysfunction. Circulation 2018;137(5):436- https://doi.org/10.1161/CIRCULATIONAHA.117.028901
- Gluckman TJ. General guidance on deferring non-urgent cv testing and procedures during the COVID-19 pandemic. (March 24, 2020; date last accessed).
- Skulstad H, Cosyns B, Popescu BA, Galderisi M, Di Salvo G, Donal E, Petersen SE, Gimelli A, Haugaa KH, Muraru D, Almeida AG, Schulz-Menger J, Dweck MR, Pontone G, Sade LE, Gerber B, Maurovich-Horvat P, Bharucha T, Cameli M, Magne J, Westwood M, Maurer G. COVID-19 pandemic and cardiac imaging. EACVI recommendations on precautions, indications, prioritisation and protection for patients and healthcare Eur Heart J Cardiovasc Imaging
- https://doi.org/10.1093/ehjci/jeaa072
- Soldati G, Smargiassi A, Inchingolo R, Buonsenso D, Perrone T, Briganti DF, Perlini S, Torri E, Mariani A, Mossolani EE, Tursi F, Mento F, Demi L. Is there a role for lung ultrasound during the COVID-19 pandemic? J Ultrasound Med
- https://doi.org/10.1002/jum.15284
- Choi AD, Abbara S, Branch KR, Feuchtner GM, Ghoshhajra B, Nieman K, Pontone G, Villines TC, Williams MC, Blankstein R. Society of Cardiovascular Computed Tomography Guidance for Use of Cardiac Computed Tomography Amidst the COVID-19 Journal of Cardiovascular Computed
- https://doi.org/10.1016/j.jcct.2020.03.002
- American College of Cardiology. ACR recommendations for the use of chest radiography and computed tomography (ct) for suspected COVID-19 infection. (March 22, 2020; date last accessed). https://www.acr.org/Advocacy-and-Economics/ACR- Position-Statements/Recommendations-for-Chest-Radiography-and-CT-for-Suspected- COVID19-Infection
- Skali H, Murthy VL, Al-Mallah MH, Bateman TM, Beanlands R, Better N, Calnon DA, Dilsizian V, Gimelli A, Pagnanelli R, Polk DM, Soman P, Thompson RC, Einstein AJ, Dorbala S. Guidance and Best Practices for Nuclear Cardiology Laboratories during the Coronavirus Disease 2019 (COVID-19) Pandemic: An Information Statement from ASNC and SNMMI. Zenodo 2020;Preprint. https://doi.org/10.5281/zenodo.3738020
- Society for Cardiovascular Magnetic Resonance. SCMR’s covid-19 preparedness (March 25, 2020; date last accessed). https://scmr.org/page/COVID19
- Ferreira VM, Schulz-Menger J, Holmvang G, Kramer CM, Carbone I, Sechtem U, Kindermann I, Gutberlet M, Cooper LT, Liu P, Friedrich MG. Cardiovascular Magnetic Resonance in Nonischemic Myocardial Inflammation: Expert Recommendations. J Am Coll Cardiol 2018;72(24):3158-3176. https://doi.org/10.1016/j.jacc.2018.09.072
- Stefanini GG, Azzolini E, Condorelli G. Critical Organizational Issues for Cardiologists in the COVID-19 Outbreak: A Frontline Experience From Milan, Italy. Circulation
- https://doi.org/10.1161/CIRCULATIONAHA.120.047070
- Neumann FJ, Sousa-Uva M, Ahlsson A, Alfonso F, Banning AP, Benedetto U, Byrne RA, Collet JP, Falk V, Head SJ, Juni P, Kastrati A, Koller A, Kristensen SD, Niebauer J, Richter DJ, Seferovic PM, Sibbing D, Stefanini GG, Windecker S, Yadav R, Zembala MO, Group 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J 2019;40(2):87-165. https://doi.org/10.1093/eurheartj/ehy394
- Baumgartner H, Falk V, Bax JJ, De Bonis M, Hamm C, Holm PJ, Iung B, Lancellotti P, Lansac E, Rodriguez Munoz D, Rosenhek R, Sjogren J, Tornos Mas P, Vahanian A, Walther T, Wendler O, Windecker S, Zamorano JL, Group ESCSD. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J 2017;38(36):2739-2791. https://doi.org/10.1093/eurheartj/ehx391
- Kucharski AJ, Russell TW, Diamond C, Liu Y, Edmunds J, Funk S, Eggo RM, Sun F, Jit M, Munday JD. Early dynamics of transmission and control of COVID-19: a mathematical modelling study. The lancet infectious diseases 2020.
- Mebazaa A, Combes A, van Diepen S, Hollinger A, Katz JN, Landoni G, Hajjar LA, Lassus J, Lebreton G, Montalescot G, Park JJ, Price S, Sionis A, Yannopolos D, Harjola VP, Levy B, Thiele H. Management of cardiogenic shock complicating myocardial infarction. Intensive Care Med 2018;44(6):760-773. https://doi.org/10.1007/s00134-018-5214- 9
- Perkins GD, Olasveengen TM, Maconochie I, Soar J, Wyllie J, Greif R, Lockey A, Semeraro F, Van de Voorde P, Lott C, Monsieurs KG, Nolan JP, European Resuscitation C. European Resuscitation Council Guidelines for Resuscitation: 2017 update. Resuscitation 2018;123:43-50. https://doi.org/10.1016/j.resuscitation.2017.12.007
- Christian MD, Hawryluck L, Wax RS, Cook T, Lazar NM, Herridge MS, Muller MP, Gowans DR, Fortier W, Burkle FM. Development of a triage protocol for critical care during an influenza pandemic. CMAJ 2006;175(11):1377-
- https://doi.org/10.1503/cmaj.060911
- Deng SQ, Peng HJ. Characteristics of and Public Health Responses to the Coronavirus Disease 2019 Outbreak in China. J Clin Med
- 2020;9(2). https://doi.org/10.3390/jcm9020575
- Basille D, Plouvier N, Trouve C, Duhaut P, Andrejak C, Jounieaux V. Non-steroidal Anti-inflammatory Drugs may Worsen the Course of Community-Acquired Pneumonia: A Cohort Study. Lung 2017;195(2):201-208. https://doi.org/10.1007/s00408-016- 9973-1
- Douglas I, Evans S, Smeeth L. Effect of statin treatment on short term mortality after pneumonia episode: cohort study. BMJ 2011;342:d1642. https://doi.org/10.1136/bmj.d1642
- Fleming DM, Verlander NQ, Elliot AJ, Zhao H, Gelb D, Jehring D, Nguyen-Van-Tam JS. An assessment of the effect of statin use on the incidence of acute respiratory infections in England during winters 1998-1999 to 2005-2006. Epidemiol Infect 2010; 138(9): 1281-8. https://doi.org/10.1017/S0950268810000105
- Xu L, Liu J, Lu M, Yang D, Zheng X. Liver injury during highly pathogenic human coronavirus infections. Liver Int 2020. https://doi.org/10.1111/liv.14435
- Knuuti J, Wijns W, Saraste A, Capodanno D, Barbato E, Funck-Brentano C, Prescott E, Storey RF, Deaton C, Cuisset T, Agewall S, Dickstein K, Edvardsen T, Escaned J, Gersh BJ, Svitil P, Gilard M, Hasdai D, Hatala R, Mahfoud F, Masip J, Muneretto C, Valgimigli M, Achenbach S, Bax JJ, Group ESCSD. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J 2020;41(3):407- https://doi.org/10.1093/eurheartj/ehz425
- Maron DJ, Hochman JS, Reynolds HR, Bangalore S, O’Brien SM, Boden WE, Chaitman BR, Senior R, Lopez-Sendon J, Alexander KP, Lopes RD, Shaw LJ, Berger JS, Newman JD, Sidhu MS, Goodman SG, Ruzyllo W, Gosselin G, Maggioni AP, White HD, Bhargava B, Min JK, Mancini GBJ, Berman DS, Picard MH, Kwong RY, Ali ZA, Mark DB, Spertus JA, Krishnan MN, Elghamaz A, Moorthy N, Hueb WA, Demkow M, Mavromatis K, Bockeria O, Peteiro J, Miller TD, Szwed H, Doerr R, Keltai M, Selvanayagam JB, Steg PG, Held C, Kohsaka S, Mavromichalis S, Kirby R, Jeffries NO, Harrell FE, Jr., Rockhold FW, Broderick S, Ferguson TB, Jr., Williams DO, Harrington RA, Stone GW, Rosenberg Y, Group IR. Initial Invasive or Conservative Strategy for Stable Coronary Disease. N Engl J Med 2020;382(15):1395-1407. https://doi.org/10.1056/NEJMoa1915922
- Li B, Yang J, Zhao F, Zhi L, Wang X, Liu L, Bi Z, Zhao Y. Prevalence and impact of cardiovascular metabolic diseases on COVID-19 in China. Clin Res Cardiol
- https://doi.org/10.1007/s00392-020-01626-9
- Yang W, Cao Q, Qin L, Wang X, Cheng Z, Pan A, Dai J, Sun Q, Zhao F, Qu J, Yan F. Clinical characteristics and imaging manifestations of the 2019 novel coronavirus disease (COVID-19):A multi-center study in Wenzhou city, Zhejiang, China. J Infect 2020;80(4):388-393. https://doi.org/10.1016/j.jinf.2020.02.016
- Celutkiene J, Lainscak M, Anderson L, Gayat E, Grapsa J, Harjola VP, Manka R, Nihoyannopoulos P, Filardi PP, Vrettou R, Anker SD, Filippatos G, Mebazaa A, Metra M, Piepoli M, Ruschitzka F, Zamorano JL, Rosano G, Seferovic P. Imaging in patients with suspected acute heart failure: timeline approach position statement on behalf of the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail 2020;22(2):181-195. https://doi.org/10.1002/ejhf.1678
- Furuhashi M, Moniwa N, Mita T, Fuseya T, Ishimura S, Ohno K, Shibata S, Tanaka M, Watanabe Y, Akasaka H, Ohnishi H, Yoshida H, Takizawa H, Saitoh S, Ura N, Shimamoto K, Miura T. Urinary angiotensin-converting enzyme 2 in hypertensive patients may be increased by olmesartan, an angiotensin II receptor blocker. Am J Hypertens 2015;28(1):15-21. https://doi.org/10.1093/ajh/hpu086
- Halliday BP, Wassall R, Lota AS, Khalique Z, Gregson J, Newsome S, Jackson R, Rahneva T, Wage R, Smith G, Venneri L, Tayal U, Auger D, Midwinter W, Whiffin N, Rajani R, Dungu JN, Pantazis A, Cook SA, Ware JS, Baksi AJ, Pennell DJ, Rosen SD, Cowie MR, Cleland JGF, Prasad SK. Withdrawal of pharmacological treatment for heart failure in patients with recovered dilated cardiomyopathy (TRED-HF): an open-label, pilot, randomised trial. The Lancet 2019;393(10166):61- https://doi.org/10.1016/S0140-6736(18)32484-X
- Seferovic PM, Ponikowski P, Anker SD, Bauersachs J, Chioncel O, Cleland JGF, de Boer RA, Drexel H, Ben Gal T, Hill L, Jaarsma T, Jankowska EA, Anker MS, Lainscak M, Lewis BS, McDonagh T, Metra M, Milicic D, Mullens W, Piepoli MF, Rosano G, Ruschitzka F, Volterrani M, Voors AA, Filippatos G, Coats AJS. Clinical practice update on heart failure 2019: pharmacotherapy, procedures, devices and patient management. An expert consensus meeting report of the Heart Failure Association of the European Society of Eur J Heart Fail 2019;21(10):1169-1186. https://doi.org/10.1002/ejhf.1531
- Kumar D, Tellier R, Draker R, Levy G, Humar A. Severe Acute Respiratory Syndrome (SARS) in a liver transplant recipient and guidelines for donor SARS screening. Am J Transplant 2003;3(8):977-81. https://doi.org/10.1034/j.1600-6143.2003.00197.x
- AlGhamdi M, Mushtaq F, Awn N, Shalhoub S. MERS CoV infection in two renal transplant recipients: case report. Am J Transplant 2015;15(4):1101- https://doi.org/10.1111/ajt.13085
- Li F, Cai J, Dong N. First Cases of COVID-19 in Heart Transplantation From China. The Journal of Heart and Lung Transplantation. https://doi.org/10.1016/j.healun.2020.03.006
- Ren Z-L, Hu R, Wang Z-W, Zhang M, Ruan Y-L, Wu Z-Y, Wu H-B, Hu X-P, Hu Z-P, Ren W, Li L-C, Dai F-F, Liu H, Cai X. Epidemiological and clinical characteristics of heart transplant recipients during the 2019 coronavirus outbreak in Wuhan, China: A descriptive survey report. The Journal of Heart and Lung
- https://doi.org/10.1016/j.healun.2020.03.008
- Mehta P, McAuley DF, Brown M, Sanchez E, Tattersall RS, Manson JJ. COVID-19: consider cytokine storm syndromes and immunosuppression. The Lancet 2020;395(10229):1033-1034. https://doi.org/10.1016/S0140-6736(20)30628-0
- Rosenhek R, Binder T, Porenta G, Lang I, Christ G, Schemper M, Maurer G, Baumgartner H. Predictors of outcome in severe, asymptomatic aortic stenosis. N Engl J Med 2000;343(9):611-7. https://doi.org/10.1056/NEJM200008313430903
- Rosenhek R, Zilberszac R, Schemper M, Czerny M, Mundigler G, Graf S, Bergler-Klein J, Grimm M, Gabriel H, Maurer G. Natural history of very severe aortic stenosis. Circulation 2010;121(1):151- https://doi.org/10.1161/CIRCULATIONAHA.109.894170
- Zlotnick DM, Ouellette ML, Malenka DJ, DeSimone JP, Leavitt BJ, Helm RE, Olmstead EM, Costa SP, DiScipio AW, Likosky DS, Schmoker JD, Quinn RD, Sisto D, Klemperer JD, Sardella GL, Baribeau YR, Frumiento C, Brown JR, O’Rourke DJ, Northern New England Cardiovascular Disease Study G. Effect of preoperative pulmonary hypertension on outcomes in patients with severe aortic stenosis following surgical aortic valve Am J Cardiol 2013;112(10):1635-40. https://doi.org/10.1016/j.amjcard.2013.07.025
- Bergler-Klein J, Klaar U, Heger M, Rosenhek R, Mundigler G, Gabriel H, Binder T, Pacher R, Maurer G, Baumgartner H. Natriuretic peptides predict symptom-free survival and postoperative outcome in severe aortic stenosis. Circulation 2004;109(19):2302-8. https://doi.org/10.1161/01.CIR.0000126825.50903.18
- Chin CW, Shah AS, McAllister DA, Joanna Cowell S, Alam S, Langrish JP, Strachan FE, Hunter AL, Maria Choy A, Lang CC, Walker S, Boon NA, Newby DE, Mills NL, Dweck MR. High-sensitivity troponin I concentrations are a marker of an advanced hypertrophic response and adverse outcomes in patients with aortic stenosis. Eur Heart J 2014;35(34):2312-21. https://doi.org/10.1093/eurheartj/ehu189
- Clavel MA, Malouf J, Michelena HI, Suri RM, Jaffe AS, Mahoney DW, Enriquez-Sarano B-type natriuretic peptide clinical activation in aortic stenosis: impact on long-term survival. J Am Coll Cardiol 2014;63(19):2016-25. https://doi.org/10.1016/j.jacc.2014.02.581
- Otto CM, Prendergast B. Aortic-valve stenosis–from patients at risk to severe valve N Engl J Med 2014;371(8):744-56. https://doi.org/10.1056/NEJMra1313875
- Yang J, Zheng Y, Gou X, Pu K, Chen Z, Guo Q, Ji R, Wang H, Wang Y, Zhou Y. Prevalence of comorbidities in the novel Wuhan coronavirus (COVID-19) infection: a systematic review and meta-analysis. Int J Infect Dis https://doi.org/10.1016/j.ijid.2020.03.017
- Leon MB, Smith CR, Mack MJ, Makkar RR, Svensson LG, Kodali SK, Thourani VH, Tuzcu EM, Miller DC, Herrmann HC, Doshi D, Cohen DJ, Pichard AD, Kapadia S, Dewey T, Babaliaros V, Szeto WY, Williams MR, Kereiakes D, Zajarias A, Greason KL, Whisenant BK, Hodson RW, Moses JW, Trento A, Brown DL, Fearon WF, Pibarot P, Hahn RT, Jaber WA, Anderson WN, Alu MC, Webb JG, Investigators P. Transcatheter or Surgical Aortic- Valve Replacement in Intermediate-Risk Patients. N Engl J Med 2016;374(17):1609- https://doi.org/10.1056/NEJMoa1514616
- Makkar RR, Thourani VH, Mack MJ, Kodali SK, Kapadia S, Webb JG, Yoon SH, Trento A, Svensson LG, Herrmann HC, Szeto WY, Miller DC, Satler L, Cohen DJ, Dewey TM, Babaliaros V, Williams MR, Kereiakes DJ, Zajarias A, Greason KL, Whisenant BK, Hodson RW, Brown DL, Fearon WF, Russo MJ, Pibarot P, Hahn RT, Jaber WA, Rogers E, Xu K, Wheeler J, Alu MC, Smith CR, Leon MB, Investigators P. Five-Year Outcomes of Transcatheter or Surgical Aortic-Valve Replacement. N Engl J Med 2020;382(9):799- https://doi.org/10.1056/NEJMoa1910555
- Mack MJ, Leon MB, Thourani VH, Makkar R, Kodali SK, Russo M, Kapadia SR, Malaisrie SC, Cohen DJ, Pibarot P, Leipsic J, Hahn RT, Blanke P, Williams MR, McCabe JM, Brown DL, Babaliaros V, Goldman S, Szeto WY, Genereux P, Pershad A, Pocock SJ, Alu MC, Webb JG, Smith CR, Investigators P. Transcatheter Aortic-Valve Replacement with a Balloon-Expandable Valve in Low-Risk Patients. N Engl J Med 2019;380(18):1695- https://doi.org/10.1056/NEJMoa1814052
- Popma JJ, Deeb GM, Yakubov SJ, Mumtaz M, Gada H, O’Hair D, Bajwa T, Heiser JC, Merhi W, Kleiman NS, Askew J, Sorajja P, Rovin J, Chetcuti SJ, Adams DH, Teirstein PS, Zorn GL, 3rd, Forrest JK, Tchetche D, Resar J, Walton A, Piazza N, Ramlawi B, Robinson N, Petrossian G, Gleason TG, Oh JK, Boulware MJ, Qiao H, Mugglin AS, Reardon MJ, Evolut Low Risk Trial I. Transcatheter Aortic-Valve Replacement with a Self-Expanding Valve in Low-Risk Patients. N Engl J Med 2019;380(18):1706- https://doi.org/10.1056/NEJMoa1816885
- Arora S, Strassle PD, Kolte D, Ramm CJ, Falk K, Jack G, Caranasos TG, Cavender MA, Rossi JS, Vavalle JP. Length of Stay and Discharge Disposition After Transcatheter Versus Surgical Aortic Valve Replacement in the United States. Circ Cardiovasc Interv 2018;11(9):e006929. https://doi.org/10.1161/CIRCINTERVENTIONS.118.006929.
- Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JGF, Coats AJS, Falk V, Gonzalez- Juanatey JR, Harjola VP, Jankowska EA, Jessup M, Linde C, Nihoyannopoulos P, Parissis JT, Pieske B, Riley JP, Rosano GMC, Ruilope LM, Ruschitzka F, Rutten FH, van der Meer P, Group ESCSD. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC)Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J 2016;37(27):2129-2200. https://doi.org/10.1093/eurheartj/ehw128
- Asgar AW, Mack MJ, Stone GW. Secondary mitral regurgitation in heart failure: pathophysiology, prognosis, and therapeutic considerations. J Am Coll Cardiol 2015;65(12):1231-1248. https://doi.org/10.1016/j.jacc.2015.02.009
- Kang DH, Park SJ, Shin SH, Hong GR, Lee S, Kim MS, Yun SC, Song JM, Park SW, Kim JJ. Angiotensin Receptor Neprilysin Inhibitor for Functional Mitral Regurgitation. Circulation 2019;139(11):1354-
- https://doi.org/10.1161/CIRCULATIONAHA.118.037077
- Zilberszac R, Heinze G, Binder T, Laufer G, Gabriel H, Rosenhek R. Long-Term Outcome of Active Surveillance in Severe But Asymptomatic Primary Mitral JACC Cardiovasc Imaging 2018;11(9):1213-
- https://doi.org/10.1016/j.jcmg.2018.05.014
- Sorajja P, Vemulapalli S, Feldman T, Mack M, Holmes DR, Jr., Stebbins A, Kar S, Thourani V, Ailawadi G. Outcomes With Transcatheter Mitral Valve Repair in the United States: An STS/ACC TVT Registry Report. J Am Coll Cardiol 2017;70(19):2315- https://doi.org/10.1016/j.jacc.2017.09.015
- Zhang JJ, Dong X, Cao YY, Yuan YD, Yang YB, Yan YQ, Akdis CA, Gao YD. Clinical characteristics of 140 patients infected with SARS-CoV-2 in Wuhan, China. Allergy https://doi.org/10.1111/all.14238
- Williams B, Mancia G, Spiering W, Agabiti Rosei E, Azizi M, Burnier M, Clement DL, Coca A, de Simone G, Dominiczak A, Kahan T, Mahfoud F, Redon J, Ruilope L, Zanchetti A, Kerins M, Kjeldsen SE, Kreutz R, Laurent S, Lip GYH, McManus R, Narkiewicz K, Ruschitzka F, Schmieder RE, Shlyakhto E, Tsioufis C, Aboyans V, Desormais I, Group 2018 ESC/ESH Guidelines for the management of arterial hypertension. Eur Heart J 2018;39(33):3021-3104. https://doi.org/10.1093/eurheartj/ehy339
- Sommerstein R, Grani C. Rapid Response: Re: Preventing a covid-19 pandemic: ACE inhibitors as a potential risk factor for fatal Covid-19. BMJ 2020;368:m810. https://doi.org/10.1136/bmj.m810
- Chen Y, Guo Y, Pan Y, Zhao ZJ. Structure analysis of the receptor binding of 2019- Biochem Biophys Res Commun 2020. https://doi.org/10.1016/j.bbrc.2020.02.071
- Burrell LM, Risvanis J, Kubota E, Dean RG, MacDonald PS, Lu S, Tikellis C, Grant SL, Lew RA, Smith AI, Cooper ME, Johnston CI. Myocardial infarction increases ACE2 expression in rat and humans. Eur Heart J 2005;26(4):369-75; discussion 322- https://doi.org/10.1093/eurheartj/ehi114
- Ishiyama Y, Gallagher PE, Averill DB, Tallant EA, Brosnihan KB, Ferrario CM. Upregulation of angiotensin-converting enzyme 2 after myocardial infarction by blockade of angiotensin II receptors. Hypertension 2004;43(5):970- https://doi.org/10.1161/01.HYP.0000124667.34652.1a
- Imai Y, Kuba K, Rao S, Huan Y, Guo F, Guan B, Yang P, Sarao R, Wada T, Leong-Poi H, Crackower MA, Fukamizu A, Hui CC, Hein L, Uhlig S, Slutsky AS, Jiang C, Penninger JM. Angiotensin-converting enzyme 2 protects from severe acute lung failure. Nature 2005;436(7047):112-6. https://doi.org/10.1038/nature03712
- Kuba K, Imai Y, Rao S, Gao H, Guo F, Guan B, Huan Y, Yang P, Zhang Y, Deng W, Bao L, Zhang B, Liu G, Wang Z, Chappell M, Liu Y, Zheng D, Leibbrandt A, Wada T, Slutsky AS, Liu D, Qin C, Jiang C, Penninger JM. A crucial role of angiotensin converting enzyme 2 (ACE2) in SARS coronavirus-induced lung injury. Nat Med 2005;11(8):875- https://doi.org/10.1038/nm1267
- Rodrigues Prestes TR, Rocha NP, Miranda AS, Teixeira AL, Simoes ESAC. The Anti- Inflammatory Potential of ACE2/Angiotensin-(1-7)/Mas Receptor Axis: Evidence from Basic and Clinical Research. Curr Drug Targets 2017;18(11):1301-
- https://doi.org/10.2174/1389450117666160727142401
- gov [Internet]. Bethesda (MD): National Library of Medicine (US). Identifier NCT04287686, Recombinant Human Angiotensin-converting Enzyme 2 (rhACE2) as a Treatment for Patients With COVID-19. (March 17, 2020; date last accessed). https://clinicaltrials.gov/ct2/show/NCT04287686
- Gurwitz D. Angiotensin receptor blockers as tentative SARS-CoV-2 therapeutics. Drug Dev Res 2020. https://doi.org/10.1002/ddr.21656
- de Simone G, ESC Council on Hypertension, On behalf of the Nucleus Members. Position Statement of the ESC Council on Hypertension on ACE-Inhibitors and Angiotensin Receptor Blockers. (March 13, 2020; date last accessed). https://www.escardio.org/Councils/Council-on-Hypertension-(CHT)/News/position- statement-of-the-esc-council-on-hypertension-on-ace-inhibitors-and-ang
- Lip GYH, Coca A, Kahan T, Boriani G, Manolis AS, Olsen MH, Oto A, Potpara TS, Steffel J, Marin F, de Oliveira Figueiredo MJ, de Simone G, Tzou WS, Chiang CE, Williams B, Reviewers, Dan GA, Gorenek B, Fauchier L, Savelieva I, Hatala R, van Gelder I, Brguljan- Hitij J, Erdine S, Lovic D, Kim YH, Salinas-Arce J, Field M. Hypertension and cardiac arrhythmias: a consensus document from the European Heart Rhythm Association (EHRA) and ESC Council on Hypertension, endorsed by the Heart Rhythm Society (HRS), Asia-Pacific Heart Rhythm Society (APHRS) and Sociedad Latinoamericana de Estimulacion Cardiaca y Electrofisiologia (SOLEACE). Europace 2017;19(6):891- https://doi.org/10.1093/europace/eux091
- Tsang OT, Chau TN, Choi KW, Tso EY, Lim W, Chiu MC, Tong WL, Lee PO, Lam BH, Ng TK, Lai JY, Yu WC, Lai ST. Coronavirus-positive nasopharyngeal aspirate as predictor for severe acute respiratory syndrome mortality. Emerg Infect Dis 2003;9(11):1381- https://doi.org/10.3201/eid0911.030400
- Chen D, Li X, Song Q, Hu C, Su F, Dai J. Hypokalemia and Clinical Implications in Patients with Coronavirus Disease 2019 (COVID-19). medRxiv 2020:2020.02.27.20028530. https://doi.org/10.1101/2020.02.27.20028530
- Danzi GB, Loffi M, Galeazzi G, Gherbesi E. Acute pulmonary embolism and COVID-19 pneumonia: a random association? Eur Heart J https://doi.org/10.1093/eurheartj/ehaa254
- Xie Y, Wang X, Yang P, Zhang S. COVID-19 Complicated by Acute Pulmonary Radiology: Cardiothoracic Imaging 2020;2(2):e200067. https://doi.org/10.1148/ryct.2020200067
- Chen J, Wang X, Zhang S, Liu B, Wu X, Wang Y, Wang X, Yang M, Sung J, Xie Y. Findings of Acute Pulmonary Embolism in COVID-19 Patients. The Lancet
- 2020;Preprints. https://doi.org/%20http://dx.doi.org/10.2139/ssrn.3548771
- Huisman MV, Barco S, Cannegieter SC, Le Gal G, Konstantinides SV, Reitsma PH, Rodger M, Vonk Noordegraaf A, Klok FA. Pulmonary embolism. Nat Rev Dis Primers 2018;4:18028. https://doi.org/10.1038/nrdp.2018.28
- Cardiac Society of Australia and New Zealand. COVID-19 resources. (April 1, 2020; date last accessed). https://www.csanz.edu.au/resources/
- Hearth Rythm Society. HRS COVID-19 Task Force Message. (March 20, 2020; date last accessed). https://www.hrsonline.org/COVID19-Challenges-Solutions/Message
- National Health Society. NHS Clinical guide for the management of cardiology patients during the coronavirus pandemic. (April 1, 2020; date last accessed). https://www.england.nhs.uk/coronavirus/publication/specialty-guides/
- Kirchhof P, Benussi S, Kotecha D, Ahlsson A, Atar D, Casadei B, Castella M, Diener HC, Heidbuchel H, Hendriks J, Hindricks G, Manolis AS, Oldgren J, Popescu BA, Schotten U, Van Putte B, Vardas P, Agewall S, Camm J, Baron Esquivias G, Budts W, Carerj S, Casselman F, Coca A, De Caterina R, Deftereos S, Dobrev D, Ferro JM, Filippatos G, Fitzsimons D, Gorenek B, Guenoun M, Hohnloser SH, Kolh P, Lip GY, Manolis A, McMurray J, Ponikowski P, Rosenhek R, Ruschitzka F, Savelieva I, Sharma S, Suwalski P, Tamargo JL, Taylor CJ, Van Gelder IC, Voors AA, Windecker S, Zamorano JL, Zeppenfeld
- 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Europace 2016;18(11):1609-1678. https://doi.org/10.1093/europace/euw295
- Brugada J, Katritsis DG, Arbelo E, Arribas F, Bax JJ, Blomstrom-Lundqvist C, Calkins H, Corrado D, Deftereos SG, Diller GP, Gomez-Doblas JJ, Gorenek B, Grace A, Ho SY, Kaski JC, Kuck KH, Lambiase PD, Sacher F, Sarquella-Brugada G, Suwalski P, Zaza A, Group 2019 ESC Guidelines for the management of patients with supraventricular tachycardiaThe Task Force for the management of patients with supraventricular tachycardia of the European Society of Cardiology (ESC). Eur Heart J 2020;41(5):655- 720. https://doi.org/10.1093/eurheartj/ehz467
- Priori SG, Blomstrom-Lundqvist C, Mazzanti A, Blom N, Borggrefe M, Camm J, Elliott PM, Fitzsimons D, Hatala R, Hindricks G, Kirchhof P, Kjeldsen K, Kuck KH, Hernandez- Madrid A, Nikolaou N, Norekval TM, Spaulding C, Van Veldhuisen DJ, Group ESCSD. 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: The Task Force for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death of the European Society of Cardiology (ESC). Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC). Eur Heart J 2015;36(41):2793- https://doi.org/10.1093/eurheartj/ehv316
- Monsieurs KG, Nolan JP, Bossaert LL, Greif R, Maconochie IK, Nikolaou NI, Perkins GD, Soar J, Truhlar A, Wyllie J, Zideman DA, Group ERCGW. European Resuscitation Council Guidelines for Resuscitation 2015: Section 1. Executive summary. Resuscitation 2015;95:1-80. https://doi.org/10.1016/j.resuscitation.2015.07.038
- Priori SG, Wilde AA, Horie M, Cho Y, Behr ER, Berul C, Blom N, Brugada J, Chiang CE, Huikuri H, Kannankeril P, Krahn A, Leenhardt A, Moss A, Schwartz PJ, Shimizu W, Tomaselli G, Tracy C, Document R, Ackerman M, Belhassen B, Estes NA, 3rd, Fatkin D, Kalman J, Kaufman E, Kirchhof P, Schulze-Bahr E, Wolpert C, Vohra J, Refaat M, Etheridge SP, Campbell RM, Martin ET, Quek SC, Heart Rhythm S, European Heart Rhythm A, Asia Pacific Heart Rhythm S. Executive summary: HRS/EHRA/APHRS expert consensus statement on the diagnosis and management of patients with inherited primary arrhythmia syndromes. Europace 2013;15(10):1389- https://doi.org/10.1093/europace/eut272
- European Society of Cardiology, European Heart Rhythm A, Brignole M, Auricchio A, Baron-Esquivias G, Bordachar P, Boriani G, Breithardt OA, Cleland J, Deharo JC, Delgado V, Elliott PM, Gorenek B, Israel CW, Leclercq C, Linde C, Mont L, Padeletti L, Sutton R, Vardas PE. 2013 ESC guidelines on cardiac pacing and cardiac resynchronization therapy: the task force on cardiac pacing and resynchronization therapy of the European Society of Cardiology (ESC). Developed in collaboration with the European Heart Rhythm Association (EHRA). Europace 2013;15(8):1070- https://doi.org/10.1093/europace/eut206
- Boriani G, Fauchier L, Aguinaga L, Beattie JM, Blomstrom Lundqvist C, Cohen A, Dan GA, Genovesi S, Israel C, Joung B, Kalarus Z, Lampert R, Malavasi VL, Mansourati J, Mont L, Potpara T, Thornton A, Lip GYH, Group ESCSD. European Heart Rhythm Association (EHRA) consensus document on management of arrhythmias and cardiac electronic devices in the critically ill and post-surgery patient, endorsed by Heart Rhythm Society (HRS), Asia Pacific Heart Rhythm Society (APHRS), Cardiac Arrhythmia Society of Southern Africa (CASSA), and Latin American Heart Rhythm Society (LAHRS). Europace 2019;21(1):7-8. https://doi.org/10.1093/europace/euy110
- Ambrus DB, Benjamin EJ, Bajwa EK, Hibbert KA, Walkey AJ. Risk factors and outcomes associated with new-onset atrial fibrillation during acute respiratory distress J Crit Care 2015;30(5):994-7. https://doi.org/10.1016/j.jcrc.2015.06.003
- Klein Klouwenberg PM, Frencken JF, Kuipers S, Ong DS, Peelen LM, van Vught LA, Schultz MJ, van der Poll T, Bonten MJ, Cremer OL, * MC. Incidence, Predictors, and Outcomes of New-Onset Atrial Fibrillation in Critically Ill Patients with Sepsis. A Cohort Am J Respir Crit Care Med 2017;195(2):205-
- https://doi.org/10.1164/rccm.201603-0618OC
- Walkey AJ, Hammill BG, Curtis LH, Benjamin EJ. Long-term outcomes following development of new-onset atrial fibrillation during sepsis. Chest 2014;146(5):1187- https://doi.org/10.1378/chest.14-0003
- Madjid M, Connolly AT, Nabutovsky Y, Safavi-Naeini P, Razavi M, Miller CC. Effect of High Influenza Activity on Risk of Ventricular Arrhythmias Requiring Therapy in Patients With Implantable Cardiac Defibrillators and Cardiac Resynchronization Therapy Defibrillators. Am J Cardiol 2019;124(1):44-
- https://doi.org/10.1016/j.amjcard.2019.04.011
- Wu C-I, Postema PG, Arbelo E, Behr ER, Bezzina CR, Napolitano C, Robyns T, Probst V, Schulze-Bahr E, Remme CA, Wilde AAM. SARS-CoV-2, COVID-19 and inherited arrhythmia syndromes. Heart Rhythm. https://doi.org/10.1016/j.hrthm.2020.03.024
- Chang D, Saleh M, Garcia-Bengo Y, Choi E, Epstein L, Willner J. COVID-19 Infection Unmasking Brugada Syndrome. HeartRhythm Case https://doi.org/10.1016/j.hrcr.2020.03.012
- Alexander LK, Keene BW, Yount BL, Geratz JD, Small JD, Baric RS. ECG changes after rabbit coronavirus infection. J Electrocardiol 1999;32(1):21- https://doi.org/10.1016/s0022-0736(99)90018-3
- Wang M, Cao R, Zhang L, Yang X, Liu J, Xu M, Shi Z, Hu Z, Zhong W, Xiao G. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019- nCoV) in vitro. Cell Research 2020;30(3):269-271. https://doi.org/10.1038/s41422- 020-0282-0
- Yao X, Ye F, Zhang M, Cui C, Huang B, Niu P, Liu X, Zhao L, Dong E, Song C, Zhan S, Lu R, Li H, Tan W, Liu D. In Vitro Antiviral Activity and Projection of Optimized Dosing Design of Hydroxychloroquine for the Treatment of Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2). Clinical Infectious Diseases https://doi.org/10.1093/cid/ciaa237
- Gautret P, Lagier J-C, Parola P, Hoang VT, Meddeb L, Mailhe M, Doudier B, Courjon J, Giordanengo V, Vieira VE, Dupont HT, Honoré S, Colson P, Chabrière E, La Scola B, Rolain J-M, Brouqui P, Raoult D. Hydroxychloroquine and azithromycin as a treatment of COVID-19: results of an open-label non-randomized clinical trial. International Journal of Antimicrobial Agents 2020:105949. https://doi.org/https://doi.org/10.1016/j.ijantimicag.2020.10594
- Colson P, Rolain J-M, Lagier J-C, Brouqui P, Raoult D. Chloroquine and hydroxychloroquine as available weapons to fight COVID-19. International Journal of Antimicrobial Agents 2020:105932. https://doi.org/10.1016/j.ijantimicag.2020.105932
- Smith T, Bushek J, Prosser T. COVID-19 Drug Therapy – Potential Options. (March 26, 2020; date last accessed). https://www.elsevier.com/connect/coronavirus- information-center
- Gautret P, Lagier JC, Parola P, Hoang VT, Meddeb L, Mailhe M, Doudier B, Courjon J, Giordanengo V, Vieira VE, Dupont HT, Honore S, Colson P, Chabriere E, La Scola B, Rolain JM, Brouqui P, Raoult D. Hydroxychloroquine and azithromycin as a treatment of COVID-19: results of an open-label non-randomized clinical trial. Int J Antimicrob Agents 2020:105949. https://doi.org/10.1016/j.ijantimicag.2020.105949
- Haeusler IL, Chan XHS, Guérin PJ, White NJ. The arrhythmogenic cardiotoxicity of the quinoline and structurally related antimalarial drugs: a systematic review. BMC Medicine 2018;16(1):200. https://doi.org/10.1186/s12916-018-1188-2
- de Wilde AH, Jochmans D, Posthuma CC, Zevenhoven-Dobbe JC, van Nieuwkoop S, Bestebroer TM, van den Hoogen BG, Neyts J, Snijder EJ. Screening of an FDA-Approved Compound Library Identifies Four Small-Molecule Inhibitors of Middle East Respiratory Syndrome Coronavirus Replication in Cell Culture. Antimicrobial Agents and Chemotherapy 2014;58(8):4875-4884. https://doi.org/10.1128/aac.03011-14
- Chan JF-W, Yao Y, Yeung M-L, Deng W, Bao L, Jia L, Li F, Xiao C, Gao H, Yu P, Cai J-P, Chu H, Zhou J, Chen H, Qin C, Yuen K-Y. Treatment With Lopinavir/Ritonavir or Interferon-β1b Improves Outcome of MERS-CoV Infection in a Nonhuman Primate Model of Common Marmoset. The Journal of Infectious Diseases 2015;212(12):1904- https://doi.org/10.1093/infdis/jiv392
- Arabi YM, Alothman A, Balkhy HH, Al-Dawood A, AlJohani S, Al Harbi S, Kojan S, Al Jeraisy M, Deeb AM, Assiri AM, Al-Hameed F, AlSaedi A, Mandourah Y, Almekhlafi GA, Sherbeeni NM, Elzein FE, Memon J, Taha Y, Almotairi A, Maghrabi KA, Qushmaq I, Al Bshabshe A, Kharaba A, Shalhoub S, Jose J, Fowler RA, Hayden FG, Hussein MA, Arabi YM, Alothman A, Balkhy HH, Al-Dawood A, AlJohani S, Al Harbi S, Kojan S, Al Jeraisy M, Deeb AM, Jose J, Hussein MA, Al Muhaidib M, Sadat M, Al Anizi H, Dael R, Assiri AM, AlMazroa M, Asiri A, Memish ZA, Ghazal SS, Alfaraj SH, Bafaqeeh F, Al Harthy A, Al Sulaiman M, Mady A, Mandourah Y, AlMekhlafi GA, Sherbeeni NM, Elzein FE, Muhammed R, Al Samirrai S, Awad S, Cabal RC, Malibary AA, Al Onazi B, Aljuhani M, Vince M, Almotairi A, Al Enani M, Alqurashi A, Alenezi F, Alkhani N, Maghrabi KA, Al- Hameed F, AlSaedi A, Thaqafi A, Al Oraabi O, Rifai J, Elsamadisi P, Hendy MS, Basher SA, Abduldhaher M, Bajhamoum W, Qushmaq I, Shalhoub S, Taha Y, Memon J, Bashir S, Al- Dossary I, Al Mekhloof S, Al-Muhainy B, Suliman S, Alshahrani MS, Al Bshabshe A, Kharaba A, Al Jabri A, Farid M, Alaidarous A, Alseraihi W, Shahada H, Shimi J, Riaz S, Alharthi B, Yasin O, Khathlan M, Fowler RA, Hayden FG, And the Mtg. Treatment of Middle East Respiratory Syndrome with a combination of lopinavir-ritonavir and interferon-β1b (MIRACLE trial): study protocol for a randomized controlled trial. Trials 2018;19(1):81. https://doi.org/10.1186/s13063-017-2427-0
- Park SY, Lee JS, Son JS, Ko JH, Peck KR, Jung Y, Woo HJ, Joo YS, Eom JS, Shi H. Post- exposure prophylaxis for Middle East respiratory syndrome in healthcare workers. Journal of Hospital Infection 2019;101(1):42- https://doi.org/10.1016/j.jhin.2018.09.005
- Cao B, Wang Y, Wen D, Liu W, Wang J, Fan G, Ruan L, Song B, Cai Y, Wei M, Li X, Xia J, Chen N, Xiang J, Yu T, Bai T, Xie X, Zhang L, Li C, Yuan Y, Chen H, Li H, Huang H, Tu S, Gong F, Liu Y, Wei Y, Dong C, Zhou F, Gu X, Xu J, Liu Z, Zhang Y, Li H, Shang L, Wang K, Li K, Zhou X, Dong X, Qu Z, Lu S, Hu X, Ruan S, Luo S, Wu J, Peng L, Cheng F, Pan L, Zou J, Jia C, Wang J, Liu X, Wang S, Wu X, Ge Q, He J, Zhan H, Qiu F, Guo L, Huang C, Jaki T, Hayden FG, Horby PW, Zhang D, Wang C. A Trial of Lopinavir–Ritonavir in Adults Hospitalized with Severe Covid-19. New England Journal of Medicine https://doi.org/10.1056/NEJMoa2001282
- Sheahan TP, Sims AC, Graham RL, Menachery VD, Gralinski LE, Case JB, Leist SR, Pyrc K, Feng JY, Trantcheva I, Bannister R, Park Y, Babusis D, Clarke MO, Mackman RL, Spahn JE, Palmiotti CA, Siegel D, Ray AS, Cihlar T, Jordan R, Denison MR, Baric RS. Broad- spectrum antiviral GS-5734 inhibits both epidemic and zoonotic coronaviruses. Science Translational Medicine 2017; 9(396):eaal3653. https://doi.org/10.1126/scitranslmed.aal3653
- de Wit E, Feldmann F, Cronin J, Jordan R, Okumura A, Thomas T, Scott D, Cihlar T, Feldmann H. Prophylactic and therapeutic remdesivir (GS-5734) treatment in the rhesus macaque model of MERS-CoV infection. Proceedings of the National Academy of Sciences 2020;117(12):6771-6776. https://doi.org/10.1073/pnas.1922083117
- Sheahan TP, Sims AC, Leist SR, Schäfer A, Won J, Brown AJ, Montgomery SA, Hogg A, Babusis D, Clarke MO, Spahn JE, Bauer L, Sellers S, Porter D, Feng JY, Cihlar T, Jordan R, Denison MR, Baric RS. Comparative therapeutic efficacy of remdesivir and combination lopinavir, ritonavir, and interferon beta against MERS-CoV. Nature Communications 2020;11(1):222. https://doi.org/10.1038/s41467-019-13940-6
- Howard PA. Azithromycin-Induced Proarrhythmia and Cardiovascular Death. Annals of Pharmacotherapy 2013;47(11):1547- https://doi.org/10.1177/1060028013504905
- Poluzzi E, Raschi E, Motola D, Moretti U, De Ponti F. Antimicrobials and the Risk of Torsades de Pointes. Drug Safety 2010;33(4):303- https://doi.org/10.2165/11531850-000000000-00000
- Sagara I, Oduro AR, Mulenga M, Dieng Y, Ogutu B, Tiono AB, Mugyenyi P, Sie A, Wasunna M, Kain KC, Djimdé AA, Sarkar S, Chandra R, Robbins J, Dunne MW. Efficacy and safety of a combination of azithromycin and chloroquine for the treatment of uncomplicated Plasmodium falciparum malaria in two multi-country randomised clinical trials in African adults. Malaria Journal 2014;13(1):458. https://doi.org/10.1186/1475-2875-13-458
- Kimani J, Phiri K, Kamiza S, Duparc S, Ayoub A, Rojo R, Robbins J, Orrico R, Vandenbroucke P. Efficacy and Safety of Azithromycin-Chloroquine versus Sulfadoxine- Pyrimethamine for Intermittent Preventive Treatment of Plasmodium falciparum Malaria Infection in Pregnant Women in Africa: An Open-Label, Randomized Trial. PLOS ONE 2016;11(6):e0157045. https://doi.org/10.1371/journal.pone.0157045
- Vicente J, Zusterzeel R, Johannesen L, Ochoa-Jimenez R, Mason JW, Sanabria C, Kemp S, Sager PT, Patel V, Matta MK, Liu J, Florian J, Garnett C, Stockbridge N, Strauss DG. Assessment of Multi-Ion Channel Block in a Phase I Randomized Study Design: Results of the CiPA Phase I ECG Biomarker Validation Study. Clin Pharmacol Ther 2019;105(4):943-953. https://doi.org/10.1002/cpt.1303
- Mzayek F, Deng H, Mather FJ, Wasilevich EC, Liu H, Hadi CM, Chansolme DH, Murphy HA, Melek BH, Tenaglia AN, Mushatt DM, Dreisbach AW, Lertora JJ, Krogstad DJ. Randomized dose-ranging controlled trial of AQ-13, a candidate antimalarial, and chloroquine in healthy volunteers. PLoS Clin Trials 2007;2(1):e6. https://doi.org/10.1371/journal.pctr.0020006
- Wozniacka A, Cygankiewicz I, Chudzik M, Sysa-Jedrzejowska A, Wranicz JK. The cardiac safety of chloroquine phosphate treatment in patients with systemic lupus erythematosus: the influence on arrhythmia, heart rate variability and repolarization Lupus 2006;15(8):521-5. https://doi.org/10.1191/0961203306lu2345oa
- Teixeira RA, Martinelli Filho M, Benvenuti LA, Costa R, Pedrosa AA, Nishioka SA. Cardiac damage from chronic use of chloroquine: a case report and review of the Arq Bras Cardiol 2002;79(1):85-8. https://doi.org/10.1590/s0066- 782×2002001000009
- Lee JH, Chung WB, Kang JH, Kim HW, Kim JJ, Kim JH, Hwang HJ, Lee JB, Chung JW, Kim HL, Choi YS, Park CS, Youn HJ, Lee MY. A case of chloroquine-induced cardiomyopathy that presented as sick sinus syndrome. Korean Circ J 2010;40(11):604-8. https://doi.org/10.4070/kcj.2010.40.11.604
- McGhie TK, Harvey P, Su J, Anderson N, Tomlinson G, Touma Z. Electrocardiogram abnormalities related to anti-malarials in systemic lupus erythematosus. Clin Exp Rheumatol 2018;36(4):545-551.
- Teixeira RA, Borba EF, Pedrosa A, Nishioka S, Viana VS, Ramires JA, Kalil-Filho R, Bonfa E, Martinelli Filho M. Evidence for cardiac safety and antiarrhythmic potential of chloroquine in systemic lupus erythematosus. Europace 2014;16(6):887- https://doi.org/10.1093/europace/eut290
- Yogasundaram H, Putko BN, Tien J, Paterson DI, Cujec B, Ringrose J, Oudit GY. Hydroxychloroquine-induced cardiomyopathy: case report, pathophysiology, diagnosis, and treatment. Can J Cardiol 2014;30(12):1706-15. https://doi.org/10.1016/j.cjca.2014.08.016
- Capel RA, Herring N, Kalla M, Yavari A, Mirams GR, Douglas G, Bub G, Channon K, Paterson DJ, Terrar DA, Burton RA. Hydroxychloroquine reduces heart rate by modulating the hyperpolarization-activated current If: Novel electrophysiological insights and therapeutic potential. Heart Rhythm 2015;12(10):2186- https://doi.org/10.1016/j.hrthm.2015.05.027
- Mollerach FB, Scolnik M, Catoggio LJ, Rosa J, Soriano ER. Causes of fetal third-degree atrioventricular block and use of hydroxychloroquine in pregnant women with Ro/La Clin Rheumatol 2019;38(8):2211-2217. https://doi.org/10.1007/s10067- 019-04556-8
- Zhang M, Xie M, Li S, Gao Y, Xue S, Huang H, Chen K, Liu F, Chen L. Electrophysiologic Studies on the Risks and Potential Mechanism Underlying the Proarrhythmic Nature of Cardiovasc Toxicol 2017;17(4):434-440. https://doi.org/10.1007/s12012-017-9401-7
- Choi Y, Lim HS, Chung D, Choi JG, Yoon D. Risk Evaluation of Azithromycin-Induced QT Prolongation in Real-World Practice. Biomed Res Int 2018;2018:1574806. https://doi.org/10.1155/2018/1574806
- S. Food and Drug Administration. ZITHROMAX (azithromycin) for IV infusion only. Highlights of prescribing information. Reference ID: 4051690 https://www.accessdata.fda.gov/drugsatfda_docs/label/2017/050693s27- 050730s35lbl.pdf
- Ray WA, Murray KT, Hall K, Arbogast PG, Stein CM. Azithromycin and the risk of cardiovascular death. N Engl J Med 2012;366(20):1881- https://doi.org/10.1056/NEJMoa1003833
- Poluzzi E, Raschi E, Motola D, Moretti U, De Ponti F. Antimicrobials and the risk of torsades de pointes: the contribution from data mining of the US FDA Adverse Event Reporting System. Drug Saf 2010;33(4):303-14. https://doi.org/10.2165/11531850- 000000000-00000
- Cheng YJ, Nie XY, Chen XM, Lin XX, Tang K, Zeng WT, Mei WY, Liu LJ, Long M, Yao FJ, Liu J, Liao XX, Du ZM, Dong YG, Ma H, Xiao HP, Wu SH. The Role of Macrolide Antibiotics in Increasing Cardiovascular Risk. J Am Coll Cardiol 2015;66(20):2173- https://doi.org/10.1016/j.jacc.2015.09.029
- Maisch NM, Kochupurackal JG, Sin J. Azithromycin and the risk of cardiovascular J Pharm Pract 2014;27(5):496-500. https://doi.org/10.1177/0897190013516503
- Lu ZK, Yuan J, Li M, Sutton SS, Rao GA, Jacob S, Bennett CL. Cardiac risks associated with antibiotics: azithromycin and levofloxacin. Expert Opin Drug Saf 2015;14(2):295- https://doi.org/10.1517/14740338.2015.989210
- Rao GA, Mann JR, Shoaibi A, Bennett CL, Nahhas G, Sutton SS, Jacob S, Strayer SM. Azithromycin and levofloxacin use and increased risk of cardiac arrhythmia and death. Ann Fam Med 2014;12(2):121-7. https://doi.org/10.1370/afm.1601
- Rathbun CR, Liedtke MD, Blevins SM, Harrison D, Lockhart SM, Salvaggio M, Acosta Electrocardiogram abnormalities with atazanavir and lopinavir/ritonavir. HIV Clin Trials 2009;10(5):328-36. https://doi.org/10.1310/hct1005-328
- Grange S, Schmitt C, Banken L, Kuhn B, Zhang X. Thorough QT/QTc study of tocilizumab after single-dose administration at therapeutic and supratherapeutic doses in healthy subjects. Int J Clin Pharmacol Ther 2011;49(11):648- https://doi.org/10.5414/cp201549
- Akbulak RO, Rosenkranz SC, Schaeffer BN, Pinnschmidt HO, Willems S, Heesen C, Hoffmann BA. Acute and long-term effects of fingolimod on heart rhythm and heart rate variability in patients with multiple sclerosis. Mult Scler Relat Disord 2018;19:44- https://doi.org/10.1016/j.msard.2017.10.020
- Gold R, Comi G, Palace J, Siever A, Gottschalk R, Bijarnia M, von Rosenstiel P, Tomic D, Kappos L, Investigators FS. Assessment of cardiac safety during fingolimod treatment initiation in a real-world relapsing multiple sclerosis population: a phase 3b, open-label J Neurol 2014;261(2):267-76. https://doi.org/10.1007/s00415-013-7115-8
- Limmroth V, Ziemssen T, Lang M, Richter S, Wagner B, Haas J, Schmidt S, Gerbershagen K, Lassek C, Klotz L, Hoffmann O, Albert C, Schuh K, Baier-Ebert M, Wendt G, Schieb H, Hoyer S, Dechend R, Haverkamp W. Electrocardiographic assessments and cardiac events after fingolimod first dose – a comprehensive monitoring study. BMC Neurol 2017;17(1):11. https://doi.org/10.1186/s12883-016-0789-7
- Brown B, Weiss JL, Kolodny S, Meng X, Williams IM, Osborne JA. Analysis of cardiac monitoring and safety data in patients initiating fingolimod treatment in the home or in BMC Neurol 2019;19(1):287. https://doi.org/10.1186/s12883-019-1506-0
- Jacobs M, Rodger A, Bell DJ, Bhagani S, Cropley I, Filipe A, Gifford RJ, Hopkins S, Hughes J, Jabeen F, Johannessen I, Karageorgopoulos D, Lackenby A, Lester R, Liu RS, MacConnachie A, Mahungu T, Martin D, Marshall N, Mepham S, Orton R, Palmarini M, Patel M, Perry C, Peters SE, Porter D, Ritchie D, Ritchie ND, Seaton RA, Sreenu VB, Templeton K, Warren S, Wilkie GS, Zambon M, Gopal R, Thomson EC. Late Ebola virus relapse causing meningoencephalitis: a case report. Lancet 2016;388(10043):498- https://doi.org/10.1016/S0140-6736(16)30386-5
- Sodero A, Squitieri M, Mazzeo S, Pasca M, Mata S, Pieri F, Bessi V, Sorbi S. Acute Symptomatic Sinus Bradycardia in High-Dose Methylprednisolone Therapy in a Woman With Inflammatory Myelitis: A Case Report and Review of the Literature. Clin Med Insights Case Rep
- 2019;12:1179547619831026. https://doi.org/10.1177/1179547619831026
- Vasheghani-Farahani A, Sahraian MA, Darabi L, Aghsaie A, Minagar A. Incidence of various cardiac arrhythmias and conduction disturbances due to high dose intravenous methylprednisolone in patients with multiple sclerosis. J Neurol Sci 2011;309(1-2):75- https://doi.org/10.1016/j.jns.2011.07.018
- Giudicessin JR, Noseworthy PA, Friedman PA, Ackerman MJ. Urgent guidance for navigating and circumventing the QTc prolonging and torsadogenic potential of possible pharmacotherapies for COVID-19. Mayo Clin Proc 2020;[published online ahead of print March 25, 2020]. https://doi.org/10.1016/j.mayocp.2020.03.024.
- Yang T, Roden DM. Extracellular potassium modulation of drug block of IKr. Implications for torsade de pointes and reverse use-dependence. Circulation 1996;93(3):407-11. https://doi.org/10.1161/01.cir.93.3.407
- Garabelli P, Stavrakis S, Albert M, Koomson E, Parwani P, Chohan J, Smith L, Albert D, Xie R, Xie Q, Reynolds D, Po S. Comparison of QT Interval Readings in Normal Sinus Rhythm Between a Smartphone Heart Monitor and a 12-Lead ECG for Healthy Volunteers and Inpatients Receiving Sotalol or Dofetilide. J Cardiovasc Electrophysiol 2016;27(7):827-32. https://doi.org/10.1111/jce.12976
- Steffel J, Verhamme P, Potpara TS, Albaladejo P, Antz M, Desteghe L, Haeusler KG, Oldgren J, Reinecke H, Roldan-Schilling V, Rowell N, Sinnaeve P, Collins R, Camm AJ, Heidbuchel H, Group ESCSD. The 2018 European Heart Rhythm Association Practical Guide on the use of non-vitamin K antagonist oral anticoagulants in patients with atrial Eur Heart J 2018;39(16):1330-1393. https://doi.org/10.1093/eurheartj/ehy136
- Duchin K, Duggal A, Atiee GJ, Kidokoro M, Takatani T, Shipitofsky NL, He L, Zhang G, Kakkar T. An Open-Label Crossover Study of the Pharmacokinetics of the 60-mg Edoxaban Tablet Crushed and Administered Either by a Nasogastric Tube or in Apple Puree in Healthy Adults. Clin Pharmacokinet 2018;57(2):221- https://doi.org/10.1007/s40262-017-0554-0
- Moore KT, Krook MA, Vaidyanathan S, Sarich TC, Damaraju CV, Fields LE. Rivaroxaban crushed tablet suspension characteristics and relative bioavailability in healthy adults when administered orally or via nasogastric tube. Clin Pharmacol Drug Dev 2014;3(4):321-7. https://doi.org/10.1002/cpdd.123
- Song Y, Chang M, Suzuki A, Frost RJ, Kelly A, LaCreta F, Frost C. Evaluation of Crushed Tablet for Oral Administration and the Effect of Food on Apixaban Pharmacokinetics in Healthy Adults. Clin Ther 2016;38(7):1674-1685 https://doi.org/10.1016/j.clinthera.2016.05.004
- Song Y, Wang X, Perlstein I, Wang J, Badawy S, Frost C, LaCreta F. Relative Bioavailability of Apixaban Solution or Crushed Tablet Formulations Administered by Mouth or Nasogastric Tube in Healthy Subjects. Clin Ther 2015;37(8):1703- https://doi.org/10.1016/j.clinthera.2015.05.497
- Drug interaction checker. https://reference.medscape.com/drug- interactionchecker
- University of Liverpool. COVID-19 Drug Interactions – Prescribing resources. (March 20, 2020; date last accessed). https://www.covid19-druginteractions.org/
- Faragon JJ, Budak JZ. National HIV curriculum. Section 3. Antiretroviral therapy/Topic 3. Drug Interactions with Antiretroviral Medications. (February 7, 2020; date last accessed). https://www.hiv.uw.edu/go/antiretroviral-therapy/drug-drug- interactions/core-concept/all
- Lipsitch M, Swerdlow DL, Finelli L. Defining the Epidemiology of Covid-19 – Studies N Engl J Med 2020;382(13):1194-1196. https://doi.org/10.1056/NEJMp2002125
- Emanuel EJ, Persad G, Upshur R, Thome B, Parker M, Glickman A, Zhang C, Boyle C, Smith M, Phillips JP. Fair Allocation of Scarce Medical Resources in the Time of Covid- N Engl J Med 2020. https://doi.org/10.1056/NEJMsb2005114
- Piepoli MF, Hoes AW, Agewall S, Albus C, Brotons C, Catapano AL, Cooney MT, Corra U, Cosyns B, Deaton C, Graham I, Hall MS, Hobbs FDR, Lochen ML, Lollgen H, Marques- Vidal P, Perk J, Prescott E, Redon J, Richter DJ, Sattar N, Smulders Y, Tiberi M, van der Worp HB, van Dis I, Verschuren WMM, Binno S, Group ESCSD. 2016 European Guidelines on cardiovascular disease prevention in clinical practice: The Sixth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of 10 societies and by invited experts)Developed with the special contribution of the European Association for Cardiovascular Prevention & Rehabilitation (EACPR). Eur Heart J 2016;37(29):2315-2381. https://doi.org/10.1093/eurheartj/ehw106







