ThS.BS. TRẦN CÔNG DUY1
BS. HÀ THỊ NGỌC BÍCH2
1Giảng viên Bộ môn Nội Tổng Quát
2Bác sĩ nội trú Bộ môn Nội Tiết
Đại học Y Dược TP. Hồ Chí Minh
(…)
Thử nghiệm CREDENCE
Trong 3 thử nghiệm đã đề cập ở trên, kết cục thận được xem như là kết cục phụ. Ngược lại, thử nghiệm CREDENCE đặc biệt thực hiện để đánh giá hiệu quả bảo vệ thận trên bệnh nhân đái tháo đường và bệnh thận mạn có albumin niệu gồm dân số có nguy cơ cao bị suy thận và kết cục thận nặng là kết cục chính [21]. Kết cục gộp chính gồm bệnh thận giai đoạn cuối (lọc máu, ghép thận hoặc eGFR < 15ml/phút/1,73m2), tăng gấp đôi creatinin huyết thanh, tử vong do thận hoặc tim mạch. Thử nghiệm được kết thúc sớm sau khi phân tích giữa kỳ theo khuyến cáo của Ủy Ban giám sát dữ liệu và tính an toàn với thời gian theo dõi trung vị là 2,62 năm.
Nguy cơ tương đối của kết cục chính giảm 30% ở nhóm điều trị canagliflozin so với giả dược (HR 0,7; P = 0,00001). Nguy cơ tương đối của kết cục gộp thận ở bệnh thận mạn giai đoạn cuối (tăng gấp đôi creatinin huyết thanh, tử vong do thận) giảm 34% (HR 0,68; P = 0,002). Nhóm sử dụng canagliflozin cũng giảm nguy cơ kết cục phụ, tử vong do tim mạch, nhồi máu cơ tim, đột quỵ và nhập viện do suy tim. Giá trị trung bình của tỉ số albumin/creatinin niệu trong quá trình theo dõi ở nhóm điều trị canagliflozin thấp hơn 31% so với nhóm giả dược. Sự khác nhau giữa 2 nhóm về mức đường huyết, cân nặng và huyết áp ở mức thấp. Hiệu quả bảo vệ thận của canagliflozin đã được công nhận ở các nghiên cứu (Hình 1) [25]. Phân tích dưới nhóm cho thấy canagliflozin giảm có ý nghĩa biến cố tim mạch nặng, thậm chí ở những bệnh nhân không có tiền sử bệnh tim mạch (dự phòng tiên phát) [26]. Một tổng quan và phân tích gộp được tiến hành đã chỉ ra rằng thuốc ức chế SGLT2 làm giảm nguy cơ lọc máu, ghép thận hay tử vong do thận ở bệnh nhân đái tháo đường típ 2 [27].
Thử nghiệm DAPA-CKD
Bệnh nhân bệnh thận mạn có nguy cơ cao biến cố thận và tim mạch nặng. Thử nghiệm DAPDA-CKD đánh giá tác dụng của dapagliflozin ở bệnh nhân bệnh thận mạn có hoặc không có đái tháo đường [28]. Nghiên cứu này phân nhóm ngẫu nhiên 4304 người tham gia với độ lọc cầu thận ước đoán 25 đến 75 ml/ph/1,73 m2 và tỉ số albumin/creatinine niệu 200 đến 5000 mg/g sử dụng dapagliflozin hoặc giả dược. Kết cục chính là kết cục gộp của giảm kéo dài eGFR ít nhất 50%, bệnh thận giai đoạn cuối hoặc tử vong do nguyên nhân thận hoặc tim mạch. Tuổi trung bình là 61,8 ± 12,1 và 1425 người tham gia (33,1%) là nữ. Độ lọc cầu thận ước đoán trung bình là 43,1 ± 12,4 ml/ph/1,73 m2, tỉ số albumin/creatinine niệu trung vị là 949; và 32,5% bệnh nhân bệnh thận mạn không có đái tháo đường.
Ủy Ban giám sát dữ liệu độc lập khuyến cáo ngưng thử nghiệm vì hiệu quả của dapagliflozin được chứng minh. Trong thời gian trung vị 2,4 năm, biến cố kết cục chính xảy ra ở 197 trong 2152 người tham gia (9,2%) ở nhóm dapagliflozin và 312 trong 2152 người tham gia (14,5%) ờ nhóm giả dược (HR 0,61; KTC 95%: 0,51 – 0,72; P < 0,001; số người cần điều trị để dự phòng một biến cố kết cục chính (NNT) là 19 [KTC 95%: 15 – 27]). Tỉ số nguy hại của kết cục gộp giảm kéo dài eGFR ít nhất 50%, bệnh thận giai đoạn cuối hoặc tử vong do nguyên nhân thận là 0,56 (KTC 95%: 0,45 – 0,68; P < 0,001); và tỉ số nguy hại của kết cục gộp tử vong do nguyên nhân tim mạch hoặc nhập viện do suy tim là 0,71 (KTC 95%: 0,55 – 0,92; P = 0,009). Tử vong xảy ra ở 101 người tham gia (4,7%) trong nhóm dapagliflozin và 146 người tham gia (6,8%) trong nhóm giả dược (HR 0,69; KTC 95%: 0,53 – 0,88; P = 0,004). Tác dụng của dapagliflozin tương tự ở bệnh nhân đái tháo đường típ 2 lẫn bệnh nhân không có đái tháo đường típ 2. Như vậy, thử nghiệm DAPA-CKD chứng minh rằng ở bệnh nhân bệnh thận mạn bất kể có hay không có đái tháo đường sử dụng dapagliflozin, nguy cơ kết cục gộp giảm kéo dài eGFR ít nhất 50%, bệnh thận giai đoạn cuối và tử vong do nguyên nhân thận hoặc tim mạch thấp hơn giả dược có ý nghĩa thống kê.
Sự thành công của thử nghiệm DAPA-CKD đã dẫn đến sự chấp thuận của FDA vào ngày 30/04/2021 cho dapagliflozin trong điều trị giảm nguy cơ của tình trạng giảm chức năng thận, suy thận, tử vong do tim mạch và nhập viện do suy tim ở người lớn bệnh thận mạn có nguy cơ tiến triển bệnh.
- CƠ CHẾ BẢO VỆ THẬN CỦA THUỐC ỨC CHẾ KÊNH ĐỒNG VẬN NATRI-GLUCOSE 2
Các cơ chế lý giải tác dụng bảo vệ thận của thuốc ức chế SGLT2 vẫn chưa được hiểu rõ ràng; nhiều cơ chế được đưa ra là giả thuyết có liên quan [29]. Tác dụng bảo vệ thận có thể là một phần gián tiếp qua cải thiện các yếu tố nguy cơ như kiểm soát đường huyết, huyết áp và cân nặng. Tuy nhiên dữ liệu từ các nghiên cứu lâm sàng cho thấy rằng thuốc ức chế SGLT2 có thể trực tiếp đem lại hiệu quả bảo vệ thận.
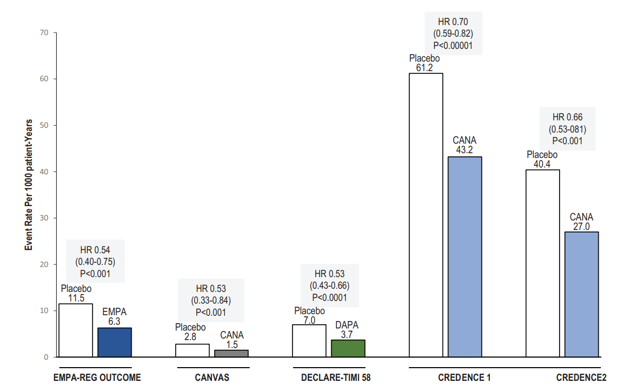
Hình 1. Kết cục thận trong các thử nghiệm EMPA-REG OUTCOME, CANVAS Program, DECLARE–TIMI 58 và CREDENCE.
Tỉ lệ kết cục gộp thận được biểu thị bằng tỉ lệ mới mắc mỗi năm trên 1000 bệnh nhân (Event Rate Per 1000 patient-years) được điều trị thuốc ức chế SGLT2 và giả dược. Kết cục thận trong các thử nghiệm: EMPA-REG OUTCOME (tăng gấp đôi creatinine huyết thanh, eGFR ≤ 45 ml/ph/1,73 m2, điều trị thay thế thận và tử vong do thận); CANVAS (tăng gấp đôi creatinine huyết thanh); DECLARE-TIMI 58 (giảm ≥ 40% eGFR đến < 60 ml/ph/1,73 m2, bệnh thận giai đoạn cuối và tử vong do thận); CREDENCE 1 (tăng gấp đôi creatinine huyết thanh và bệnh thận giai đoạn cuối); CREDENCE 2 (tăng gấp đôi creatinine huyết thanh). So sánh trực tiếp giữa các thử nghiệm này nên được giải thích một cách thận trọng bởi vì có sự khác nhau trong thiết kế nghiên cứu (ví dụ phân tích hậu kiểm, thứ phát, thăm dò và tiên phát) và đối tượng nghiên cứu. HR (hazard ratio): tỉ số nguy hại; Placebo: giả dược. (Chụp từ tài liệu gốc) [55].
Ảnh hưởng huyết động
Cơ chế tự điều chỉnh tuần hoàn trong thận giúp duy trì lưu lượng máu thận và GFR mà không phụ thuộc vào áp lực tưới máu thận trong một giới hạn nhất định ở điều kiện bình thường [30-33]. Sự tự điều chỉnh ở thận bao gồm hai yếu tố chính là phản ứng của các tế bào cơ trơn mạch máu và điều hòa ngược vết đặc-ống thận-cầu thận. Ở bệnh nhân đái tháo đường, sự tự điều chỉnh vi tuần hoàn thận bị suy giảm bởi nhiều cơ chế khác nhau. Do đó, hiện tượng tăng lọc thường xảy ra ở giai đoạn sớm của bệnh đái tháo đường và được xem là một yếu tố góp phần vào sự tiến triển của bệnh thận do đái tháo đường típ 2, ngoài ra cũng có thể liên quan với các bệnh tim mạch và tử vong. Suy giảm cơ chế điều hòa ngược vết đặc-ống thận-cầu thận có liên quan với cơ chế khởi phát và tiến triển của bệnh thận do đái tháo đường [36-39].
Sự tăng biểu hiện kênh SGLT2 ở bệnh nhân đái tháo đường được cho là đóng vai trò quan trọng trong việc truyền tín hiệu điều hòa ngược vết đặc-ống thận-cầu thận bằng cách tăng tái hấp thu natri ở ống lượn gần, do đó giảm phân bố natri đến các tế bào nhạy natri ở vết đặc ở phức hợp cạnh cầu thận [40]. Sự giảm phân bố natri ở đoạn xa được hiểu như là sự giảm thể tích tuần hoàn hiệu quả, điều này dẫn đến dãn tiểu động mạch đến để duy trì áp lực trong cầu thận và GFR.
Ở bệnh nhân đái tháo đường típ 2, những tác dụng điều hòa ngược vết đặc-ống thận-cầu thận dẫn đến tăng áp lực trong cầu thận và tăng lọc, thúc đẩy quá trình diễn tiến bệnh thận do đái tháo đường và suy giảm chức năng thận, cuối cùng tăng nguy cơ tim mạch và nguy cơ tử vong [41]. Ngược lại, ức chế kênh SGLT2 về mặt dược lý làm giảm tưới máu thận và giảm tình trạng tăng lọc ở động vật và người, có thể giúp bảo tồn chức năng thận, do đó giảm nguy cơ diễn tiến bệnh thận do đái tháo đường [42,43].
Các con đường truyền tín hiệu liên kết việc phân bố natri ở các tế bào vết đặc với những thay đổi trương lực tiểu động mạch đến chưa được hiểu rõ. Khi natri clorua đến các tế bào vết đặc, chủ yếu qua kệnh đồng vận chuyển Na/K/2Cl ở bờ niêm mạc, các chất vận mạch cận tiết được phóng thích bởi các tế bào vết đặc.
Thuốc ức chế SGLT2 cũng làm vết đặc tăng sản xuất adenosine để đáp ứng với sự tăng tái hấp thu natri clorua. Có giả thuyết cho rằng điều này gây co tiểu động mạch đến, do đó ức chế quá trình tăng lọc ở cầu thận, nhưng vẫn chưa được chứng minh trên in vivo [3], [44]. Các kỹ thuật hình ảnh trên in-vivo đã phát triển thành công việc đo lường GFR của một đơn vị nephron bằng kính hiển vi laser nhiều photon ở chuột [45,46,47]. Empagliflozin giảm nhanh quá trình tăng lọc ở cầu thận và lượng albumin bài tiết ra nước tiểu. Ngoài việc đo lường GFR của từng nephron trên con chuột đái tháo đường, đường kính tiểu động mạch đến lớn hơn 50-60% so với con chuột không bệnh và đường kính này giảm khoảng 15% khi chuột bệnh được điều trị bằng empagliflozin. Hơn nữa, ở chuột đái tháo đường, khi dùng empagliflozin thì thấy có sự tăng bài tiết adenosine trong nước tiểu tăng đáng kể so với nhóm điều trị bằng giả dược. Việc cải thiện quá trình tăng lọc ở cầu thận và đường kính tiểu động mạch đến với empagliflozin đã ngừng lại sau khi điều trị với thuốc đối kháng thụ thể adenosine típ 1. Vì vậy, luận điểm này phù hợp với giả thuyết tăng sản xuất adenosine của các tế bào vết đặc để đáp ứng lại với sự ức chế tăng lọc của thuốc ức chế SGLT2 (Hình 2).
Tác dụng trực tiếp trên mô thận
Vì kênh SGLT2 phân bố chủ yếu ở ống lượn gần nên có vẻ hợp lý khi nói rằng thuốc ức chế SGLT2 có thể tác động trực tiếp lên các tế bào ống thận thông qua việc cải thiện nhiễm độc glucose. Các bằng chứng tiền lâm sàng ủng hộ giả thuyết này.
Một phân tích chuyển hóa dựa trên quang phổ khối cho thấy sự tích tụ các chất trung gian của chu trình Krebs như citrate ở vỏ thận của chuột bị đái tháo đường. Thuốc ức chế SGLT2 cải thiện những thay đổi chuyển hóa cùng với quá trình stress oxy hóa, giảm albumin niệu và tăng sinh trung mô [48]. Ức chế SGLT2 cũng làm giảm sự thay đổi kiểu hình của đại thực bào mô mỡ, từ kiểu hình tiền viêm giống M1 đến kiểu hình kháng viêm giống M2 [49]. Tác động này có thể liên quan với tác dụng có lợi trên người béo phì của thuốc ức chế SGLT2.
Sự biểu hiện protein SGLT2 và mRNA đã được tìm thấy ở tế bào trung mô chuột được nuôi cấy [50]. Thuốc ức chế SGLT2 ức chế nồng độ cao glucose, làm ức chế hoạt hóa protein kinase C và con đường NADPH-oxidase trong các tế bào trung mô, do đó thuốc này cũng có tác dụng chống oxy hóa.
Một cách tiếp cận thông tin sinh học, sử dụng công nghệ omics kết hợp với tích hợp dữ liệu hai chiều lớn, đã xác định các dấu ấn sinh học liên quan đến cơ chế của canagliflozin. Điều trị canagliflozin có liên quan với cải thiện viêm, thay đổi chất nền ngoại bào và xơ hóa [51]. Những dữ liệu thực nghiệm đã góp phần chứng minh tác dụng bảo vệ thận của nhóm thuốc ức chế SGLT2 trong các thử nghiệm lâm sàng.
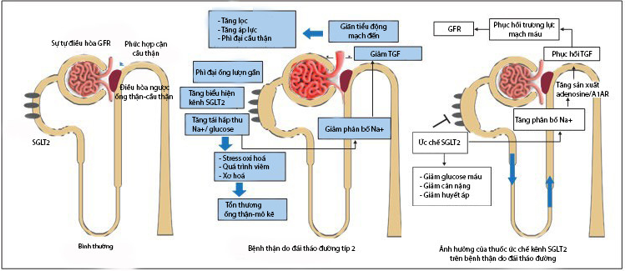
Hình 2. Hệ thống điều hòa ngược ống thận–cầu thận và hiệu quả của ức chế kênh đồng vận chuyển natri-glucose 2.
(a) Lưu lượng máu qua thận và độ lọc cầu thận được duy trì ở mức ổn định nhờ vào cơ chế tự điều chỉnh gồm phản ứng cơ trơn tiểu động mạch đến và hệ thống điều hòa ngược vết đặc-ống thận-cầu thận. Các tế bào vết đặc nhạy cảm với nồng độ muối trong ống lượn xa và truyền tín hiệu đến tiểu động mạch đến để điều chỉnh trương lực mạch máu. (b) Trong bệnh đái tháo đường típ 2, các tế bào ống lượn gần bị phì đại, đây là hậu quả của tăng biểu hiện và chức năng của protein SGLT. Sự tăng tái hấp thu natri và glucose làm suy giảm điều hòa ngược vết đặc-ống thận-cầu thận và gây dãn tiểu động mạch đến, làm tăng lượng máu qua cầu thận. (c) Thuốc ức chế SGLT2 ức chế tái hấp thu glucose và natri tại ống thận dẫn đến tăng sự phân bố natri đến vết đặc và phục hồi tình trạng tăng lọc của cầu thận. Nhóm thuốc này cũng làm giảm tình trạng nhiễm độc glucose trong ống thận.
- KẾT LUẬN
Đái tháo đường típ 2 vẫn là nguyên nhân hàng đầu gây suy thận trên toàn cầu [52]. Ức chế hệ renin-angiotensin-aldosterone làm chậm diễn tiến của bệnh thận do đái tháo đường [53,54]. Tất cả các nhóm thuốc tiếp theo sau đó đã không chứng minh được lợi ích đối với kết cục xấu trên thận khi điều trị trên nền thuốc ức chế hệ renin-angiotensin-aldosterone. Trong những năm gần đây, thuốc ức chế SGLT2 xuất hiện dường như là thuốc đầu tiên và hứa hẹn nhất giúp giảm tiến triển bệnh thận mạn ở bệnh nhân đái tháo đường. Những nghiên cứu trong tương lai về cơ chế bảo vệ thận của thuốc ức chế SGLT2 sẽ cung cấp cho chúng ta một cái nhìn sâu sắc và toàn diện hơn về tác dụng có lợi này ở bệnh nhân bệnh thận mạn có hoặc không có đái tháo đường.
TÀI LIỆU THAM KHẢO
- Wright EM, Loo DD, Hirayama BA. Biology of human sodium glucose transporters. Physiol Rev 2011; 91:733– 794.
- Sharma A, Cooper LB, Fiuzat M, et al. Antihyperglycemic therapies to treat patients with heart failure and diabetes mellitus. JACC Heart Fail 2018; 6:813–822.
- Heerspink HJ, Perkins BA, Fitchett DH, et al. Sodium glucose cotransporter 2 inhibitors in the treatment of diabetes mellitus: cardiovascular and kidney effects, potential mechanisms, and clinical applications. Circulation 2016; 134:752– 772.
- Alicic RZ, Neumiller JJ, Johnson EJ, et al. Sodium-glucose cotransporter 2 inhibition and diabetic kidney disease. Diabetes 2019; 68:248–257.
- Kliger AS, Brosius FC; Diabetic kidney disease task force of the American Society of N. Preserving kidney function instead of replacing it. Clin J Am Soc Nephrol 2020; 15 (1): 129-131.
- Ghezzi C, Loo DDF, Wright EM. Physiology of renal glucose handling via SGLT1, SGLT2 and GLUT2. Diabetologia 2018; 61:2087 –2097.
- Wang XX, Levi J, Luo Y, et al. SGLT2 protein expression is increased in human diabetic nephropathy: SGLT2 protein inhibition decreases renal lipid accumulation, inflammation, and the development of nephropathy in diabetic mice. J Biol Chem 2017; 292:5335–5348.
- Pandey J, Tamrakar AK. SGLT2 inhibitors for the treatment of diabetes: a patent review (2013–2018). Expert Opin Ther Pat 2019; 29:369–384.
- Zaccardi F, Webb DR, Htike ZZ, et al. Efficacy and safety of sodium-glucose co-transporter-2 inhibitors in type 2 diabetes mellitus: systematic review and network meta-analysis. Diabetes Obes Metab 2016; 18:783–794.
- Yamada T, Shojima N, Noma H, et al. Sodium-glucose co-transporter-2 inhibitors as add-on therapy to insulin for type 1 diabetes mellitus: systematic review and meta-analysis of randomized controlled trials. Diabetes Obes Metab 2018; 20:1755– 1761.
- Cherney DZI, Cooper ME, Tikkanen I, et al. Pooled analysis of phase III trials indicate contrasting influences of renal function on blood pressure, body weight, and HbA1c reductions with empagliflozin. Kidney Int 2018; 93:231–244.
- Cai X, Yang W, Gao X, et al. The association between the dosage of SGLT2 inhibitor and weight reduction in type 2 diabetes patients: a meta-analysis. Obesity (Silver Spring) 2018; 26:70–80.
- Ribola FA, Cancado FB, Schoueri JH, et al. Effects of SGLT2 inhibitors on weight loss in patients with type 2 diabetes mellitus. Eur Rev Med Pharmacol Sci 2017; 21:199– 211.
- Ferrannini E, Baldi S, Frascerra S, et al. Renal handling of ketones in response to sodium-glucose cotransporter 2 inhibition in patients with type 2 diabetes. Diabetes Care 2017; 40:771–776.
- Weber MA, Mansfield TA, Cain VA, et al. Blood pressure and glycaemic effects of dapagliflozin versus placebo in patients with type 2 diabetes on combination antihypertensive therapy: a randomised, double-blind, placebo- controlled, phase 3 study. Lancet Diabetes Endocrinol 2016; 4:211– 220.
- Kario K, Bohm M, Mahfoud F, et al. Twenty-four-hour ambulatory blood pressure reduction patterns after renal denervation in the SPYRAL HTN-OFF MED Trial. Circulation 2018; 138:1602–1604.
- Zinman B, Wanner C, Lachin JM, et al. EMPA-REG OUTCOME Investigators. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes. N Engl J Med 2015; 373:2117 –2128.
- Wanner C, Inzucchi SE, Zinman B. Empagliflozin and progression of kidney disease in type 2 diabetes. N Engl J Med 2016; 375:1801–1802.
- Neal B, Perkovic V, Mahaffey KW, et al. Canagliflozin and cardiovascular and renal events in type 2 diabetes. N Engl J Med 2017; 377:644 –657.
- Perkovic V, de Zeeuw D, Mahaffey KW, et al. Canagliflozin and renal outcomes in type 2 diabetes: results from the CANVAS Program randomised clinical trials. Lancet Diabetes Endocrinol 2018; 6:691–704.
- Perkovic V, Jardine MJ, Neal B, et al, CREDENCE Trial Investigators. Canagliflozin and renal outcomes in type 2 diabetes and nephropathy. N Engl J Med 2019; 380:2295 –2306.
- Wiviott SD, Raz I, Bonaca MP, et al. Dapagliflozin and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2019; 380:347– 357.
- Mosenzon O, Wiviott SD, Cahn A, et al. Effects of dapagliflozin on develop-ment and progression of kidney disease in patients with type 2 diabetes: an analysis from the DECLARE-TIMI 58 randomised trial. Lancet Diabetes Endocrinol 2019; 7:606–617.
- Zelniker TA, Wiviott SD, Raz I, et al. SGLT2 inhibitors for primary and secondary prevention of cardiovascular and renal outcomes in type 2 diabetes: a systematic review and meta-analysis of cardiovascular outcome trials. Lancet 2019; 393:31–39.
- Cherney DZI, Odutayo A, Verma S. A big win for diabetic kidney disease: CREDENCE. Cell Metab 2019; 29:1024– 1027.
- Mahaffey KW, Jardine MJ, Bompoint S, et al. Canagliflozin and cardiovascular and renal outcomes in type 2 diabetes and chronic kidney disease in primary and secondary cardiovascular prevention groups: Results from the randomized CREDENCE Trial. Circulation 2019; 140:739 –750.
- Neuen BL, Young T, Heerspink HJL, et al. SGLT2 inhibitors for the prevention of kidney failure in patients with type 2 diabetes: a systematic review and meta-analysis. Lancet Diabetes Endocrinol 2019; 7:845–854.
- Heerspink HJL, Stefánsson BV, Correa-Rotter R, et al. Dapagliflozin in Patients with Chronic Kidney Disease. N Engl J Med 2020; 383:1436-1446.
- Alicic RZ, Johnson EJ, Tuttle KR. SGLT2 inhibition for the prevention and treatment of diabetic kidney disease: a review. Am J Kidney Dis 2018; 72:267–277.
- Carlstrom M, Wilcox CS, Arendshorst WJ. Renal autoregulation in health and disease. Physiol Rev 2015; 95:405–511.
- Helal I, Fick-Brosnahan GM, Reed-Gitomer B, et al. Glomerular hyperfiltration: definitions, mechanisms and clinical implications. Nat Rev Nephrol 2012; 8:293–300.
- Fattah H, Layton A, Vallon V. How do kidneys adapt to a deficit or loss in nephron number? Physiology (Bethesda) 2019; 34:189–197.
- Chen Y, Burnett JC. Particulate guanylyl cyclase A/cGMP signaling pathway in the kidney: physiologic and therapeutic indications. Int J Mol Sci 2018; 19; pii: E1006.
- Molitch ME, Gao X, Bebu I, et al., Diabetes Control and Complications Trial/ Epidemiology of Diabetes Interventions and Complications (DCCT/EDIC) Research Group. Early glomerular hyperfiltration and long-term kidney outcomes in type 1 diabetes: the DCCT/EDIC Experience. Clin J Am Soc Nephrol 2019; 14:854–861.
- Kanbay M, Ertuglu LA, Afsar B, et al. Renal hyperfiltration defined by high estimated glomerular filtration rate: a risk factor for cardiovascular disease and mortality. Diabetes Obes Metab 2019; 21:2368 –2383.
- Lytvyn Y, Bjornstad P, Pun N, et al. New and old agents in the management of diabetic nephropathy. Curr Opin Nephrol Hypertens 2016; 25:232–239.
- Hallow KM, Gebremichael Y, Helmlinger G, et al. Primary proximal tubule hyperreabsorption and impaired tubular transport counterregulation determine glomerular hyperfiltration in diabetes: a modeling analysis. Am J Physiol Renal Physiol 2017; 312: F819–F835.
- Zhang J, Wei J, Jiang S, et al. Macula Densa SGLT1-NOS1-tubuloglomerular feedback pathway, a new mechanism for glomerular hyperfiltration during hyperglycemia. J Am Soc Nephrol 2019; 30:578–593.
- Fioretto P, Zambon A, Rossato M, et al., DERIVE Study Investigators. SGLT2 inhibitors and the diabetic kidney. Diabetes Care 2016; 39 Suppl 2: S165–S171.
- Vallon V, Richter K, Blantz RC, et al. Glomerular hyperfiltration in experimental diabetes mellitus: potential role of tubular reabsorption. J Am Soc Nephrol 1999; 10:2569 –2576.
- Cherney DZ, Perkins BA, Soleymanlou N, et al. Renal hemodynamic effect of sodium-glucose cotransporter 2 inhibition in patients with type 1 diabetes mellitus. Circulation 2014; 129:587– 597.
- Vallon V, Gerasimova M, Rose MA, et al. SGLT2 inhibitor empagliflozin reduces renal growth and albuminuria in proportion to hyperglycemia and prevents glomerular hyperfiltration in diabetic Akita mice. Am J Physiol Renal Physiol 2014; 306: F194–F204.
- Dekkers CCJ, Gansevoort RT, Heerspink HJL. New diabetes therapies and diabetic kidney disease progression: the role of SGLT-2 inhibitors. Curr Diab Rep 2018; 18:27.
- Rajasekeran H, Lytvyn Y, Bozovic A, et al. Urinary adenosine excretion in type 1 diabetes. Am J Physiol Renal Physiol 2017; 313: F184–F191.
- Kidokoro K, Cherney DZI, Bozovic A, et al. Evaluation of glomerular hemo-dynamic function by empagliflozin in diabetic mice using in vivo imaging. Circulation 2019; 140:303 –315.
- Peti-Peterdi J, Kidokoro K, Riquier-Brison A. Intravital imaging in the kidney. Curr Opin Nephrol Hypertens 2016; 25:168–173.
- Kidokoro K, Satoh M, Channon KM, et al. Maintenance of endothelial guanosine triphosphate cyclohydrolase I ameliorates diabetic nephropathy. J Am Soc Nephrol 2013; 24:1139 –1150.
- Tanaka S, Sugiura Y, Saito H, et al. Sodium-glucose cotransporter 2 inhibition normalizes glucose metabolism and suppresses oxidative stress in the kidneys of diabetic mice. Kidney Int 2018; 94:912–925.
- Miyachi Y, Tsuchiya K, Shiba K, et al. A reduced M1-like/M2-like ratio of macrophages in healthy adipose tissue expansion during SGLT2 inhibition. Sci Rep 2018; 8:16113.
- Maki T, Maeno S, Maeda Y, et al. Amelioration of diabetic nephropathy by SGLT2 inhibitors independent of its glucose-lowering effect: A possible role of SGLT2 in mesangial cells. Sci Rep 2019; 9:4703.
- Heerspink HJL, Perco P, Mulder S, et al. Canagliflozin reduces inflammation and fibrosis biomarkers: a potential mechanism of action for beneficial effects of SGLT2 inhibitors in diabetic kidney disease. Diabetologia 2019; 62:1154– 1166.
- Tuttle KR, Bakris GL, Bilous RW, et al. Diabetic kidney disease: a report from an ADA Consensus Conference. Diabetes Care 2014; 37:2864–2883.
- Lewis EJ, Hunsicker LG, Clarke WR, et al. Renoprotective effect of the angiotensin-receptor antagonist irbesartan in patients with nephropathy due to type 2 diabetes. N Engl J Med 2001; 345:851 –860.
- Brenner BM, Cooper ME, de Zeeuw D, et al. Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy. N Engl J Med 2001; 345:861 –869.
- Kashihara N, Kidokoro K, and Kanda E. Renoprotective effects of sodium-glucose cotransporter-2 inhibitors and underlying mechanisms. Curr Opin Nephrol Hypertens 2020, 29:112–118.







