Ức chế hệ renin-angiotensin với các thuốc chẹn thụ thể angiotensin II đem lại nhiều lợi ích trên toàn bộ chuỗi bệnh lý tim mạch mà không thông qua tác dụng hạ huyết áp. Trong thử nghiệm lâm sàng quan trọng ONTARGET
Thomas Unger
Viện Nghiên cứu Tim mạch CARIM
Đại học Maastricht, Hà Lan
Dịch thuật: Ths BS Nguyễn Hữu Khoa Nguyên
Đại học Y Dược TPHCM
Ức chế hệ renin-angiotensin với các thuốc chẹn thụ thể angiotensin II đem lại nhiều lợi ích trên toàn bộ chuỗi bệnh lý tim mạch mà không thông qua tác dụng hạ huyết áp. Trong thử nghiệm lâm sàng quan trọng ONTARGET (ONgoing Telmisartan Alone and in combination with Ramipril Global Endpoint Trial), telmisartan có tác dụng giảm biến cố tim mạch ở bệnh nhân nguy cơ cao, tương tự như thuốc ức chế men chuyển ramipril. Hiệu quả giảm biến cố tim mạch này không phụ thuộc vào tác dụng hạ áp, mà do tác động của thuốc trên quá trình sinh lý bệnh đã từng được chứng minh qua các nghiên cứu tiền lâm sàng và lâm sàng. Các dấu ấn của tình trạng viêm (interleukin-6 và C-reactive protein) giảm hẳn và thông số chức năng mạch máu (vận tốc sóng mạch) cải thiện đáng kể nhờ sử dụng telmisartan. Đây chính là những yếu tố gắn liền với tổn thương cơ quan đích. Telmisartan cũng có nhiều tác dụng khả dĩ có lợi trên chuyển hoá qua các nghiên cứu tiền lâm sàng. Telmisartan còn hạn chế sự tiến triển của bệnh lý thận, phì đại thất trái, và nguy cơ rung nhĩ nguyên phát hay thứ phát. Những thuốc ức chế hệ renin-angiotensin khác cũng có các tác dụng tương tự. Tuy nhiên, một số nghiên cứu ghi nhận hiệu quả khác nhau giữa telmisartan và các thuốc chẹn thụ thể angiotensin II khác. Những khác biệt này có thể do đặc tính dược lý độc đáo của telmisartan như thời gian bán hủy dài nhất, ái lực cao với thụ thể, và tính ái mỡ cao nhất trong nhóm thuốc này. Vì lẽ đó, khó có thể mở rộng kết quả của telmisartan trong ONTARGET sang các thuốc chẹn thụ thể angiotensin II khác.
1. Giới thiệu
Hệ renin-angiotensin, quan trọng nhất là angiotensin II, đóng vai trò trung tâm trong sinh bệnh học của nhiều bệnh cảnh lâm sàng của chuỗi bệnh lý tim mạch, từ các yếu tố nguy cơ như tăng huyết áp và đái tháo đường, đến xơ vữa động mạch và phì đại thất trái và cuối cùng là nhồi máu cơ tim, đột quỵ và suy tim (Hình 1) [1-3]. Hệ renin-angiotensin có thể bị ức chế tại nhiều vị trí khác nhau bởi các thuốc ức chế renin, ức chế men chuyển và chẹn thụ thể angiotensin II. Không như các thuốc ức chế hệ renin-angiotensin khác, nhóm chẹn thụ thể angiotensin ngăn chận tác động của angiotensin II trên thụ thể AT1 nhưng không ảnh hưởng đến sự hoạt hoá các thụ thể khác – đáng chú ý nhất là AT2. Trong khi có rất ít bằng chứng cho thấy thuốc ức chế renin làm giảm biến cố tim mạch ngoài tác dụng hạ huyết áp, một số thuốc ức chế men chuyển và chẹn thụ thể angiotensin II đã được khẳng định có lợi ích phòng ngừa biến cố tim mạch ở những bệnh nhân nhiều nguy cơ như tăng huyết áp, xơ vữa động mạch, phì đại thất trái, bệnh động mạch vành, suy tim, hoặc đái tháo đường có biến chứng thận [4-9].
Trong thử nghiệm lâm sàng ONTARGET (ONgoing Telmisartan Alone and in combination with Ramipril Global Endpoint Trial), telmisartan là thuốc chẹn thụ thể angiotensin II đầu tiên được chứng minh có khả năng phòng ngừa biến cố tim mạch ở bệnh nhân nguy cơ cao, với hiệu quả tương đương và đặc biệt là được dung nạp tốt hơn ramipril [6, 10]. Telmisartan là thuốc chẹn thụ thể angiotensin II duy nhất có chỉ định sử dụng trong điều trị dự phòng biến cố cho người đã mắc bệnh tim mạch do huyết khối vữa xơ (bệnh động mạch vành, đột quỵ hay bệnh mạch máu ngoại biên) hoặc đái tháo đường type 2 với tổn thương cơ quan đích [11]. Các thuốc trong nhóm chẹn thụ thể angiotensin II khác nhau về đặc tính dược lý học [12, 13]. Telmisartan có thời gian phân ly khỏi thụ thể AT1 khá dài và thời gian bán thải kéo dài (24 giờ), do đó đạt tác dụng hạ huyết áp ổn định trong suốt thời gian giữa các liều [14]. Trong nhóm chẹn thụ thể angiotensin II, telmisartan có ái lực cao với thụ thể AT1 và rất ái mỡ nên có thể tích phân phối lớn nhất [14]. Sự khác biệt về đặc tính dược lý học có thể dẫn đến khác biệt về hiệu quả lâm sàng giữa telmisartan và các thuốc chẹn thụ thể angiotensin II khác. Mặc dù chỉ có vài thử nghiệm lâm sàng đối đầu giữa các thuốc chẹn thụ thể angiotensin II về hiệu quả trên biến cố tim mạch, tác dụng trên tiêu chí trung gian và thông số sinh lý bệnh của những thuốc này thường được so sánh với nhau qua nhiều nghiên cứu. Những điều này có thể giúp lý giải hiệu quả của telmisartan trong ONTARGET, và đặc biệt là trả lời câu hỏi liệu có thể mở rộng kết quả của nghiên cứu đó cho các thuốc chẹn thụ thể angiotensin II khác được hay không.
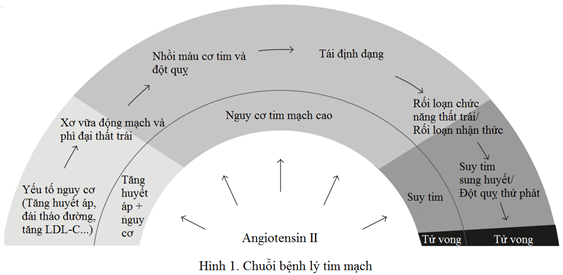

Bài điểm báo này có mục đích đánh giá tác dụng của nhóm chẹn thụ thể angiotensin II trên sinh lý bệnh học của chuỗi bệnh lý tim mạch. Trọng tâm bàn luận sẽ là các chứng cứ về ảnh hưởng trực tiếp của telmisartan trên diễn tiến của bệnh tim mạch, đây là những cơ chế có thể góp phần cải thiện tiên lượng ghi nhận trong ONTARGET. Nhiều nghiên cứu trước đó đã khảo sát tác dụng của telmisartan trên các phương diện khác nhau của bệnh lý tim mạch, chẳng hạn như hiện tượng viêm, chức năng mạch máu, tình trạng chuyển hoá, và tổn thương cơ quan đích gồm thận, tim mạch và mạch máu não. Mỗi phần dưới đây sẽ tóm tắt bằng chứng về nhóm chẹn thụ thể angiotensin II nói chung, sau đó đánh giá hiệu quả tiền lâm sàng và lâm sàng của telmisartan, cuối cùng đề cập đến những nghiên cứu so sánh telmisartan với các thuốc chẹn thụ thể angiotensin II khác nếu có. Các nghiên cứu về chẹn thụ thể angiotensin II được tìm kiếm bằng cách tra cứu MEDLINE với từ khoá liên quan đến chủ đề được xem xét.
2. Hiện tượng viêm
Hiện tượng viêm tham gia vào bệnh sinh và diễn tiến của xơ vữa động mạch, và góp phần thúc đẩy sự tiến triển và các biến chứng của tăng huyết áp [15]. Với vai trò là một cytokine tiền viêm, angiotensin II gây tình trạng viêm qua cơ chế gia tăng hoạt tính của các gốc oxy phản ứng, phân tử kết dính, và các cytokines viêm [16]. Do đó, việc ức chế hệ renin-angiotensin có khả năng làm giảm đáp ứng viêm ở những trường hợp nguy cơ tim mạch cao, và quan điểm này được ủng hộ bởi một số nghiên cứu in vitro. Với liều thường dùng trên lâm sàng, losartan có tác dụng kháng viêm mạnh, đánh giá qua nồng độ interleukin-1 beta tiết bởi bạch cầu đa nhân của bệnh nhân tăng huyết áp vô căn [17]. Captopril và amlodipine cũng có tác dụng tương tự, nhưng atenolol hoặc hydrochlorothiazide thì không [17].
Hoạt tính kháng viêm trên cơ thể người của chẹn thụ thể angiotensin II cũng đã được khẳng định qua nhiều nghiên cứu. Valsartan và candesartan đều làm giảm CRP siêu nhạy (hs-CRP) và interleukin-6 (IL-6) sau 6 tháng sử dụng trên các đối tượng tăng huyết áp [18, 19]. Ở 54 bệnh nhân đái tháo đường kèm tăng huyết áp với nồng độ IL-6 cơ bản cao (> 2.0 ng/L), IL-6 giảm (từ 3.5 xuống còn 2.4) với liệu pháp vasartan 320 mg/ngày trong 16 tuần, trong khi đó tăng (từ 3.2 lên 3.5) với giả dược, p = 0.035 [20]. Trong trường hợp tăng huyết áp kèm bệnh động mạch vành, irbesartan và enalapril đều làm giảm nồng độ metalloprotease 9 protein (p < 0.001 và p < 0.05), nhưng chỉ có irbesartan hạ được hs-CRP (p < 0.01) và IL-6 (p < 0.01) [21]. Olmesartan, trên điều trị nền tảng với hydrochlorothiazide, có khả năng chống viêm mạch vi thể vì các thông số viêm sau đây đều thấp hơn nhóm giả dược: hs-CRP (–15.1%; p < 0.05), hs-tumor necrosis factor (hs-TNF) α (–8.9%; p< 0.02), IL-6 (–14.0%; p< 0.05), và monocyte chemotactic protein-1 (MCP-1) (–6.5%; p < 0.01) [22].
Các nghiên cứu trên động vật cũng ghi nhận telmisartan làm giảm nồng độ một số dấu ấn viêm như interleukin và TNF α. Trên chuột, telmisartan giúp chống lại viêm cơ tim tự miễn thực nghiệm, một phần nhờ ức chế các cytokines viêm và stress oxy hóa [23]. So với nhóm chuột chứng, tế bào cơ tim của chuột sử dụng telmisartan hạn chế phóng thích cytokines viêm (IL-6 và TNF α), tiểu đơn vị NADPH (nicotinamide adenine dinucleotide phosphate) oxidase, và mạng lưới nội chất ít bị kích thích hơn. Ở chuột mập phì, telmisartan hoặc captopril giảm nguy cơ ung thư đại tràng do hoá chất, nhờ kiểm soát tình trạng viêm mãn tính và stress oxy hoá [24]. Nhóm chuột sử dụng telmisartan hoặc captopril giảm biểu hiện mRNA mã hóa TNF ở niêm mạc đại tràng, và có dấu ấn tổn thương DNA thấp hơn nhóm chứng.
Một vài bằng chứng khác còn cho thấy tác dụng kháng viêm của telmisartan mạnh hơn những thuốc ức chế hệ renin-angiotensin khác. Trên chuột, tác dụng làm chậm diễn tiến xơ vữa và hạn chế phóng thích các yếu tố viêm của telmisartan mạnh hơn ramipril [25]. Theo thí nghiệm in vitro, telmisartan kiểm soát tốt tình trạng viêm và tổn thương tế bào do oxy hoá ở tế bào nội mạc tĩnh mạch rốn của người, khác với losartan và sản phẩm chuyển hoá có hoạt tính EXP-3174 và EXP-3179 [26].
Tương tự như các nghiên cứu tiền lâm sàng, tác dụng trên người của telmisartan có những điểm khác biệt với các thuốc chẹn thụ thể angiotensin II khác. Ở các bệnh nhân tăng huyết áp kèm hẹp nặng động mạch vành, 8 tháng điều trị bằng telmisartan làm giảm IL-6, TNF α, và hạn chế hiện tượng mất muộn trong stent (p = 0.001) so với giả dược; trong khi valsartan không có những lợi ích như vậy [27]. Ở bệnh nhân bị hội chứng chuyển hoá, chuyển từ valsartan sang telmisartan giúp cải thiện hs-CRP (0.77 so với 0.60 mg/L; p = 0.022) cũng như vi albumin niệu (28.1 so với 18.9 mg/g·Cr; P = 0.001) [28]. Theo một nghiên cứu nhỏ ở bệnh nhân đái tháo đường type 2 có vi albumin niệu, tác dụng chống oxy hoá của telmisartan mạnh hơn losartan, nhờ khả năng tăng cường hoạt tính superoxide dismutase. Stress oxy hoá do tăng quá mức superoxide đóng vai trò trung tâm trong sinh bệnh học của bệnh thận do đái tháo đường.
3. Tình trạng cứng thành động mạch và những biến đổi của mạch máu
Hiện tượng viêm mạch máu khởi phát một loạt các thay đổi sinh lý bệnh, chẳng hạn như rối loạn chức năng nội mạc, tăng trưởng và tái định dạng mạch máu [29]. Những biến đổi này, phần lớn thông qua tác dụng của angiotensin II, có thể dẫn đến tình trạng cứng thành động mạch, đây chính là một yếu tố độc lập tiên đoán nguy cơ biến cố tim mạch ở bệnh nhân tăng huyết áp [30].
Bằng chứng chính về tác dụng của telmisartan trên độ cứng mạch máu là từ các nghiên cứu về vận tốc sóng mạch, đây cũng là một dấu ấn độc lập phản ánh tổn thương cơ quan đích [31]. Theo nghiên cứu Framingham Heart, khi vận tốc sóng mạch ở động mạch cảnh-đùi tăng một độ lệch chuẩn, nguy cơ (đã hiệu chỉnh) bị biến cố tim mạch nghiêm trọng lần đầu tăng 48% (tỉ số rủi ro HR [hazard ratio] = 1.48; khoảng tin cậy [KTC] 95%: 1.16 – 1.91; p = 0.002) [30]. Các nghiên cứu lâm sàng ghi nhận rằng telmisartan làm giảm vận tốc sóng mạch trong các trường hợp tăng huyết áp [32-35], tăng huyết áp kèm đái tháo đường type 2 [36, 37], và tăng huyết áp kèm bệnh thận mạn [38]. Một phương pháp khác để đo độ cứng động mạch là chỉ số mạch tim-gót. Ở các bệnh nhân tăng huyết áp, 12 tháng điều trị với telmisartan giúp cải thiện chỉ số mạch tim-gót, albumin niệu, huyết áp 24 giờ, và rối loạn chuyển hoá tốt hơn so với thuốc chẹn kênh calcium [39].
Angiotensin II cũng tham gia vào quá trình hình thành túi phình mạch [40], và hai thực nghiệm trên động vật đã chứng tỏ lợi ích phòng ngừa phình mạch của telmisartan. Trên chuột bị thiếu hụt RGS2 (Regulator of G-protein signaling 2, một chất ức chế thụ thể AT1), telmisartan làm giảm tỉ lệ phình mạch máu [41]. Trong mô động mạch chủ của chuột, telmisartan ngăn ngừa tiến triển của phình động mạch chủ bụng, không nhờ tác dụng hạ áp mà thông qua việc ức chế các hiện tượng như ly giải protein, chết tế bào theo chương trình và viêm [42].
Các nghiên cứu so sánh tác dụng trên mạch máu của các thuốc chẹn thụ thể angiotensin II chủ yếu thực hiện trên động vật. Ở chuột bị tăng huyết áp có nguy cơ đột quỵ, telmisartan kiểm soát tái định dạng mạch máu tốt hơn losartan, có thể nhờ giảm hoạt tính NADPH oxidase [43]. Với liều thường dùng trên lâm sàng, telmisartan ức chế đáng kể sự tăng sinh của cơ trơn mạch máu và nguyên bào sợi cơ tim trong môi trường nuôi cấy, trong khi đó những thuốc khác (candesartan, irbesartan, hoặc eprosartan) không có tác dụng này [44]. Ít nhất một nghiên cứu so sánh đã được thực hiện trên người. Ở bệnh nhân Nhật Bản bị tăng huyết áp, tác dụng bảo vệ mạch máu (thể hiện qua tiến triển của độ dày lớp nội-trung mạc tại động mạch cảnh trong) của telmisartan tốt hơn losartan sau 1 năm sử dụng, mặc dù hiệu quả hạ áp là như nhau [45].
4. Đề kháng insulin và đái tháo đường mới mắc
Hiện tượng viêm và co mạch với hậu quả xơ hoá, chết tế bào theo chương trình và hủy tế bào beta tuyến tụy là những cơ chế gây rối loạn chuyển hoá (đề kháng insulin và đái tháo đường) do angiotensin II gây ra [46]. Ức chế hệ renin-angiotensin đem lại những lợi ích như: cải thiện lưu lượng máu và vi tuần hoàn đến cơ vân nhờ đó cải thiện sự phân phối insulin và glucose đến những mô nhạy insulin, tăng cường đường dẫn tín hiệu insulin ở mức độ tế bào, và cải thiện sự bài tiết insulin bởi tế bào beta [47]. Thuốc ức chế hệ renin-angiotensin cũng được mong chờ có thể đảo ngược tác dụng có hại của angiotensin II trên tuyến tụy như xơ hoá, viêm, chết tế bào theo chương trình và hủy tế bào beta [46].
Theo nhiều thử nghiệm lâm sàng và phân tích tổng hợp, các thuốc ức chế hệ renin-angiotensin có tác dụng hữu ích trên chuyển hoá, trong khi thuốc lợi tiểu và chẹn beta có thể làm trầm trọng hơn tình trạng đề kháng insulin và rối loạn dung nạp đường [47]. Một phân tích tổng hợp 22 nghiên cứu (n = 143153 bệnh nhân không bị đái tháo đường) cho thấy nguy cơ đái tháo đường mới mắc thấp nhất ở nhóm sử dụng chẹn thụ thể angiotensin II (8.4%; tỉ số chênh OR [odds ratio] = 0.57; KTC 95% 0.46–0.72; p< 0.0001), tiếp theo sau là ức chế men chuyển (7.1%; OR = 0.67; KTC 95%: 0.56–0.80; p< 0.0001), chẹn kênh calcium (7.2%; OR = 0.75; KTC 95%: 0.62–0.90; p = 0.002), giả dược (6.8%; OR = 0.77; KTC 95%: 0.63–0.94; p = 0.009), và chẹn beta (7.6%; OR = 0.90; KTC 95%; 0.75–1.09; p = 0.30) [48].
Nhìn chung, các thuốc chẹn thụ thể angiotensin II làm giảm nguy cơ đái tháo đường mới mắc trong đa số các nghiên cứu lâm sàng quy mô lớn về tăng huyết áp. Nguy cơ tương đối bị đái tháo đường mới mắc giảm 25% (p=0.001) với losartan (so với atenolol) trong LIFE (Losartan Intervention For Endpoint reduction in hypertension) [4], 23% (p< 0.0001) với valsartan (so với amlodipine) trong VALUE (Valsartan Antihypertensive Long-term Use Evaluation) [49], và 25% (p=0.09) với candersartan (so với giả dược) theo SCOPE (Study on COgnition and Prognosis in the Elderly) [47]. Trong NAVIGATOR (Nateglinide And Valsartan in Impaired Glucose Tolerance Outcomes Research) gồm những bệnh nhân rối loạn dung nạp đường kèm ít nhất một yếu tố nguy cơ tim mạch (nếu ≥ 55 tuổi), hoặc kèm bệnh tim mạch thật sự (nếu ≥ 50 tuổi), nguy cơ diễn tiến đến đái tháo đường ở nhóm valsartan thấp hơn nhóm giả dược (33.1% so với 36.8%; HR = 0.86; KTC 95%: 0.80–0.92; p< 0.001) [50].
ONTARGET ghi nhận tỉ lệ đái tháo đường mới mắc của nhóm telmisartan tương tự nhóm ramipril (telmisartan 7.5%, ramipril và telmisartan + ramipril 6.1%) [6]. Tuy nhiên, trong nghiên cứu song hành với ONTARGET là TRANSCEND (Telmisartan Randomised AssessmeNt Study in ACE iNtolerant subjects with cardiovascular Disease) gồm 5926 bệnh nhân không dung nạp ức chế men chuyển, telmisartan không cải thiện tỉ lệ mới mắc đái tháo đường so với giả dược: 21.8% so với 22.4%; nguy cơ tương đối RR (relative risk) = 0.95; KTC 95%: 0.83–1.10; p = 0.51 [52]. Tuy nhiên, phân tích kết hợp hai nghiên cứu TRANSCEND và ProFESS (Prevention Regimen For Effectively Avoiding Second Strokes) lại cho thấy tỉ lệ đái tháo đường mới mắc giảm 16% ở nhóm telmisartan với giả dược [53].
Ngoài tác dụng ngăn chặn hoạt động của angiotensin II trên thụ thể, telmisartan còn tác động như là hoạt chất đồng vận một phần với thụ thể PPARγ (Peroxisome proliferator-activated receptor gamma) [54, 55]. Một vài thuốc chẹn thụ thể angiotensin II có tác dụng trên PPARγ nhưng khác nhau về mức độ ảnh hưởng, mạnh nhất là telmisartan, kế đến là irbesartan và losartan [54-56]. Hơn nữa, telmisartan là thuốc chẹn thụ thể angiotensin II duy nhất có khả năng điều hoà sự hoạt hoá PPARγ ở liều thường dùng trong lâm sàng, có lẽ nhờ tính ái mỡ cao của thuốc này. Theo một số nghiên cứu, telmisartan có thể ảnh hưởng đến biểu hiện của gene mã hoá PPARγ. Ở các trường hợp tăng huyết áp chưa điều trị, 3 tháng sử dụng telmisartan (nhưng amlodipine thì không) làm tăng có ý nghĩa (p = 0.006) sự biểu hiện của mRNA mã hoá PPARγ trong đơn bào [57]. Gene mã hoá PPARγ trong đơn bào của bệnh nhân hội chứng chuyển hoá chưa điều trị cũng tăng biểu hiện với sử dụng telmisartan liều cao (160 mg một lần mỗi ngày) trong 14 tuần [58]. Thực nghiệm in vitro cũng cho kết quả là telmisartan (candersartan và losartan thì không) có tác dụng gia tăng biểu hiện của gene mã hoá PPARγ [59]. Tuy nhiên, một nghiên cứu trên người nhận thấy các thuốc chẹn thụ thể angiotensin II khác cũng ảnh hưởng đến hoạt tính PPARγ: gene mã hoá PPARγ trong đơn bào tăng biểu hiện sau 2 tháng dùng losartan, có lẽ do chất chuyển hoá trung gian của thuốc này EXP 3719 [60].
Ảnh hưởng đến chuyển hoá của telmisartan được so sánh với các thuốc ức chế hệ renin-angiotensin khác trong nhiều nghiên cứu in vitro và trên động vật. Telmisartan và perindopril đều bảo vệ chức năng tiểu đảo tụy của chuột được nuôi dưỡng bằng chế độ ăn nhiều mỡ; nhờ cơ chế giảm các tình trạng viêm tiểu đảo tụy, stress oxy hóa và chết tế bào theo chương trình [61]. Ở chuột, telmisartan và irbesartan (eprosartan thì không) kích thích adiponectin trong tế bào mỡ, từ đó giúp cải thiện sự nhạy cảm với insulin [62]. Telmisartan làm tăng nồng độ chất vận chuyển glucose 4 tại màng tế bào bề mặt huyết tương in vitro, còn candesartan thì không [63]. Trong một nghiên cứu trên chuột mập phì do chế độ ăn, telmisartan và chất đồng vận PPARγ là rosiglitazone đều có tác dụng giảm viêm mô mỡ (đánh giá qua MCP-1), cũng như cải thiện tình trạng đề kháng insulin và rối loạn dung nạp đường [64]. Tương tự, telmisartan lẫn rosiglitazone, nhưng valsartan thì không, có lợi ích kiểm soát tình trạng tăng đường huyết và rối loạn chuyển hóa ở chuột bị tăng huyết áp, thông qua cơ chế điều hòa PPARγ [65].
Một số cứu so sánh các thuốc chẹn thụ thể angiotensin II với nhau được thực hiện trên người, nhưng đa số chỉ có cỡ mẫu nhỏ [66]. Nói chung, các kết quả cho thấy ảnh hưởng trên chuyển hóa đường của telmisartan tốt hơn các thuốc chẹn thụ thể angiotensin II khác [66]. Trong một nghiên cứu ngẫu nhiên theo kiểu nhãn mở trong 24 tuần ở bệnh nhân tăng huyết áp kèm rối loạn dung nạp đường huyết lúc đói và rối loạn lipid máu, telmisartan/rosuvastatin có tác dụng tốt hơn olmesartan/rosuvastatin trên chuyển hóa đường [67]. Telmsartan, nhưng olmesartan thì không, cải thiện nồng độ adiponectin ở bệnh nhân tăng huyết áp bị rối loạn dung nạp đường [68]. Với bệnh nhân bị hội chứng chuyển hóa, hiệu quả cải thiện tình trạng dung nạp đường của telmisartan tốt hơn losartan [69], valsartan [70], và irbesartan [71]. Ở người tăng huyết áp không bị đái tháo đường nhưng mập phì và đề kháng insulin, sự dung nạp đường của nhóm telmisartan cũng tốt hơn nhóm irbesartan [71, 72]. Một nghiên cứu khác cũng phản ánh lợi ích của telmisartan so với olmesartan ở bệnh nhân quá cân/mập phì [73]. Ngoài ra, thay thế valsartan hoặc candesartan bằng telmisartan giúp cải thiện insulin hoặc đường huyết lúc đói [74-76].
Tóm lại, các nghiên cứu đã khẳng định lợi ích trên chuyển hóa của nhóm chẹn thụ thể angiotensin II nói chung, nhưng cũng cho thấy telmisartan và các thuốc khác trong nhóm khác nhau về hiệu quả cải thiện rối loạn chuyển hóa. Sự khác biệt này có thể liên quan đến tác dụng đồng vận PPARγ của telmisartan, hoặc có thể do đặc tính dược lý khác. Tuy nhiên, ý nghĩa lâm sàng của những dị biệt này vẫn chưa sáng tỏ, vì không có bằng chứng rõ ràng từ các nghiên cứu lâm sàng quy mô lớn.
5. Albumin niệu và bệnh thận
Tương tự với tác động trên tổn thương cơ quan đích khác, lợi ích nổi bật trên thận của nhóm chẹn thụ thể angiotensin II không phụ thuộc tác dụng hạ áp, mà liên quan đến cơ chế giảm viêm và stress oxy hóa [77, 78], ngoài ra tác dụng kích thích thụ thể AT2 của nhóm thuốc này cũng có thể đóng vai trò quan trọng [79].
Có nhiều bằng chứng về hiệu quả giảm vi albumin niệu, và làm chậm diễn tiến đến protein niệu và bệnh thận toàn phát của nhóm chẹn thụ thể angiotensin. Nhóm thuốc này ưu thế hơn chẹn kênh calcium qua những thử nghiệm lâm sàng IDNT (Irbesartan Diabetic Nephropathy Trial) [9], MARVAL (MicroAlbuminuria Reduction with VALsartan) [80]; và gần đây là nghiên cứu VART (Valsartan Amlodipine Randomized Trial) tại Nhật Bản, trong đó valsartan cải thiện đáng kể tỉ lệ albumin/creatinine trong nước tiểu so với amlodipine (–61.3% so với +34.9%; p< 0.0001) [81]. Nghiên cứu ngẫu nhiên ROADMAP (Randomized Olmesartan And Diabetes Microalbuminuria Prevention) đánh giá liệu olmesartan có thể phòng ngừa vi albumin niệu ở bệnh nhân đái tháo đường type 2 hay không [82]. Sau thời gian theo dõi trung bình khoảng 3.2 năm, olmesartan không làm chậm xuất hiện vi albumin niệu (p > 0.05) sau khi hiệu chỉnh sự khác biệt về mức độ hạ áp. Tuy nhiên, tử vong do tim mạch ở nhóm olmesartan cao hơn nhóm giả dược (0.7% so với 0.1%, p = 0.01).
Những nghiên cứu tiền lâm sàng đã chứng tỏ telmisartan cũng có tác dụng trực tiếp bảo vệ thận. Ở chuột bị viêm cầu thận, telmisartan liều cao làm giảm tổn thương cầu thận và ống thận mô kẽ [83]. Cơ chế bảo vệ thận của telmisartan gồm: đường dẫn tín hiệu của yếu tố tăng trưởng, đường dẫn tín hiệu của rapamycin trong tế bào đích của động vật có vú, sự đánh dấu protein, đường Wnt/β catenin, và đường dẫn tín hiệu do tình trạng giảm oxy mô. Ở chuột bị bệnh cầu thận do aldosterone, hiệu quả giảm tốc độ bài tiết albumin trong nước tiểu và protein niệu của telmisartan tốt hơn amlodipine [84]. Trên chuột bị tăng huyết áp tự phát ăn chế độ nhiều mỡ, telmisartan ưu thế hơn valsartan trong việc giảm trọng lượng cơ thể, tình trạng viêm thận (MCP-1) và tổn thương thận (tốc độ bài tiết albumin trong nước tiểu và tổn thương cầu thận) [85].
Ở người, telmisartan cải thiện chức năng nội mạc thận tương tự như ramiptril, theo một nghiên cứu ngẫu nhiên mù đôi gồm 96 bệnh nhân tăng huyết áp kèm đái tháo đường type 2 điều trị trong 9 tuần [86]. Kết quả cho thấy hoạt tính nitric oxide của nội mạc thận (phản ánh tình trạng oxy hóa) giảm có ý nghĩa khi dùng telmisartan (p < 0.001) và ramipril (p = 0.018). Telmisartan làm chậm tiến triển từ bệnh thận giai đoạn đầu sang gian đoạn toàn phát so với giả dược trong nghiên cứu INNOVATION. Nghiên cứu này thu nhận 527 người Nhật Bản bị tăng huyết áp kèm theo đái tháo đường type 2, và được điều trị với telmisartan hoặc giả dược trong 52 tuần [87]. Tiêu chí chính (tỉ lệ diễn tiến từ bệnh thận giai đoạn đầu sang giai đoạn toàn phát) ở nhóm telmisartan 80 mg (16.7%) và telmisartan 40 mg (22.6%) thấp hơn nhóm giả dược (49.9%), cả hai trị số p < 0.001. Nghiên cứu DETAIL (Diabetics Exposed to Telmisartan and EnalaprIL) cho thấy hiệu quả làm chậm tiến trình giảm độ lọc cầu thận ở bệnh nhân đái tháo đường của telmisartan và enalapril tương đương nhau [88]. 250 bệnh nhân với bệnh thận giai đoạn sớm (độ lọc cầu thận bình thường, nhưng tốc độ bài tiết albumin trong nước tiểu vào khoảng 11-999 μg/phút) được phân ngẫu nhiên dùng telmisartan 80 mg hoặc enalapril 20 mg hàng ngày trong 5 năm [88]. Mức độ thay đổi độ lọc cầu thận ở hai nhóm telmisartan và enalapril không khác nhau (–17.9 so với –14.9 mL/phút/1.73 m2, p > 0.05) [88]. Phân tích nhóm của ONTARGET cho thấy tỉ lệ tiêu chí thận chính (phối hợp các biến cố chạy thận, creatinine tăng gấp đôi, và tử vong) của hai nhóm telmisartan và ramipril tương tự nhau (13.4% so với 13.5%; HR = 1.00; KTC 95%: 0.92-1.09) [89]. Trong TRANSCEND, tỉ lệ albumin niệu tiến triển của nhóm telmisartan thấp hơn nhóm giả dược (32% so với 63%; p < 0.001) [89].
Tác dụng phòng ngừa protein niệu của telmisartan tốt hơn losartan. Trong nghiên cứu AMADEO (A telmisartan 80 mg versus losartan 100 mg in hypertensive type-2 diabetic patients
with overt nephropathy), 860 bệnh nhân bị bệnh thận do đái tháo đường được điều trị với telmisartan hoặc losartan trong 1 năm. Mặc dù mức độ hạ huyết áp tương tự nhau, nhóm telmisartan có tỉ lệ albumin/creatinin trong nước tiểu thấp hơn nhóm losartan (29.8% so với 21.4%; p = 0.03) [90]. Nghiên cứu VIVALDI (inVestIgate the efficacy of telmIsartan versus VALsartan in hypertensive type 2 DIabetic patients with overt nephropathy) thu nhận 885 bệnh nhân bị tăng huyết áp với bệnh thận do đái tháo đường, với kết quả là tốc độ bài tiết albumin trong nước tiểu đều giảm khoảng 33% ở hai nhóm telmisartan 80 mg/ngày và valsartan 160 mg, mặc dù nhóm valsartan cần phối hợp thêm thuốc hạ áp [91]. Tuy nhiên, các thông số về tình trạng viêm, sự bài tiết 8-iso-prostaglandin F2α trong nước tiểu của nhóm telmisartan cải thiện nhiều hơn nhóm valsartan (giảm 14% so với giảm 7%, p = 0.04).
6. Phì đại thất trái và tái định dạng tim
Phì đại thất trái là dạng tổn thương cơ quan đích thường gặp trong tăng huyết áp, và làm tăng nguy cơ bệnh tật và tử vong do tim mạch [92]. Tương tự như các dạng tổn thương cơ quan đích khác, tác động của angiotensin II đóng vai trò trung tâm trong quá trình phì đại thất trái [93]. Nhóm thuốc chẹn thụ thể angiotensin là một trong những thuốc hạ áp hiệu quả nhất để cải thiện tình trạng này [94], thông qua việc ngăn chặn tác động gây xơ hoá và phì đại của angiotensin II [95].
Trên chuột bị phì đại thất trái, telmisartan có lợi ích giảm kích thích mạng lưới nội chất, chết tế bào theo chương trình, và các chỉ số đánh giá phì đại tim [96, 97]. Quá trình hình thành phì đại thất trái ở chuột kèm theo những biến đổi về hoạt tính của 17 protein, chủ yếu liên quan đến cấu trúc, chuyển hoá, stress, và truyền tín hiệu của tế bào. Một điểm đáng lưu ý là telmisartan ngăn chặn hoặc hạn chế các biến đổi này [98]. Telmisartan cũng cải thiện đáng kể chức năng thất trái và làm chậm diễn tiến quá trình tái định dạng tim ở chuột bị suy tim mạn [99]. Một quá trình thông qua PPARgđược cho là có tham gia vào diễn tiến của phì đại thất trái, và vài nghiên cứu đã đánh giá liệu tác dụng điều hoà PPARgcủa telmisartan có góp phần vào lợi ích cải thiện phì đại thất trái hay không. Ở chuột bị nhồi máu cơ tim, telmisartan ngăn ngừa hiện tượng tái định dạng tim nhờ hạn chế sự phì đại và xơ hoá tim; nghiên cứu này gợi ý rằng cơ chế cải thiện phì đại thất trái còn có tác dụng kháng viêm và hoạt hoá PPARg, ngoài tác động ức chế hoạt tính của angiotensin II [100]. Telmisartan giảm thiểu tổn thương do thiếu máu cục bộ/tái tưới máu ở chuột bị đái tháo đường, trong khi tình trạng xấu hơn nếu dùng chất đối kháng PPARg, điều này gợi ý rằng sự hoạt hoá PPARggóp phần vào lợi ích telmisartan [101]. Trên chuột bị tăng huyết áp, telmisartan và olmesartan đều giúp cấu trúc và chức năng tim trở nên tốt hơn [102]. Do olmesartan ít tác động đến PPARg, nên hiệu quả của thuốc này có thể liên quan đến việc kiểm soát áp lực hoặc phụ thuộc vào thụ thể AT1; và theo kết quả của những nghiên cứu gần đây thì pioglitazone có thể không làm giảm sự tiến triển của phì đại thất trái [103].
Telmisartan tốt hơn hydrochlorothiazide và carvedilol trong việc làm thoái triển tình trạng phì đại thất trái, và điều này một lần nữa cho thấy rằng các thuốc ức chế hệ renin-angiotensin có hiệu quả đặc biệt trong tình huống này [104, 105]. Theo TRANSCEND, nguy cơ phì đại thất trái của nhóm telmisartan giảm 21% (OR = 0.79; KTC 95%: 0.68–0.91; p = 0.0017) so với nhóm giả dược (trong nhóm giả dược bệnh nhân sử dụng thuốc hạ áp không phải ức chế thụ thể angiotensin/ức chế men chuyển) [106]. Nhìn chung, hiệu quả của telmisartan trên phì đại thất trái tương tự như các thuốc ức chế hệ renin-angiotensin khác. Ở bệnh nhân bị nhồi máu cơ tim cấp, dụng ức chế viêm mạch máu và giảm dày thất trái của telmisartan tương tự enalapril [107]. Theo phân tích nhóm gồm 287 bệnh nhân được chụp cộng hưởng từ trong ONTARGET, telmisartan tương đương với ramipril trong việc cải thiện khối cơ và thể tích thất trái sau 2 năm [108]. Ở các bệnh nhân tăng huyết áp, mức giảm khối cơ thất trái ở hai nhóm telmisartan (11.4%) và ramipril (9.9%) tương tự nhau, với mức độ giảm huyết áp tương đương nhau giữa các nhóm [109]. Với nghiên cứu mù đôi quy mô nhỏ ở các bệnh nhân tăng huyết áp (9 trường hợp có dày thất trái), mức độ giảm chỉ số khối cơ thất trái và huyết áp của telmisartan và losartan là như nhau sau 6 tháng điều trị [110].
7. Rung nhĩ
Một trong những hệ quả của việc ức chế hệ renin-angiotensin là giảm tỉ lệ rung nhĩ mới mắc. Nghiên cứu LIFE theo dõi 8851 bệnh nhân tăng huyết áp có nguy cơ rung nhĩ trong 5 năm. Tỉ lệ rung nhĩ mới mắc ở nhóm losartan thấp hơn nhóm atenolol (6.8 so với 10.1/1000 bệnh nhân-năm; RR = 0.67; KTC 95%: 0.55–0.83; p< 0.001), mặc dù mức hạ huyết áp tương đương nhau [111]. Kết quả này sau đó được củng cố bởi hai phân tích tổn hợp. Trong phân tích thứ nhất gồm 23 nghiên cứu ngẫu nhiên có đối chứng (n = 87048), thuốc chẹn thụ thể angiotensin II và ức chế men chuyển giảm 33% nguy cơ (OR) bị rung nhĩ nguyên phát hay thứ phát (p < 0.00001) [112]. Theo phân tích tổng hợp thứ hai gồm 11 thử nghiệm lâm sàng ngẫu nhiên có đối chứng (n = 56308), nguy cơ tương đối (RR) bị rung nhĩ nguyên phát hay thứ phát giảm với cả hai loại thuốc chẹn thụ thể angiotensin II (giảm 29%, p = 0.00002) và ức chế men chuyển (giảm 28%, p = 0.01) [113].
Tuy nhiên, gần đây các nghiên cứu ngẫu nhiên về valsartan, olmesartan và irbesartan đối chứng với giả dược lại cho kết quả không như mong đợi [114-116]. Ở bệnh nhân có tiền sử rung nhĩ cũng như bệnh tim mạch, đái tháo đường, hoặc lớn nhĩ, nhóm valsartan và giả dược có tỉ lệ rung nhĩ tái phát trong một năm như nhau (51.4% so với 52.1%; HR hiệu chỉnh = 0.97; KTC 95%: 0.83–1.14; p= 0.73) [114]. Nhóm olmesartan và giả dược có gánh nặng rung nhĩ (tỉ lệ phần trăm số ngày bị rung nhĩ kịch phát) trong 12 tháng tương tự nhau, theo một nghiên cứu trên bệnh nhân rung nhĩ kịch phát không có bệnh tim thực thể [115]. Ở bệnh nhân rung nhĩ với nguy cơ cao, sử dụng irbesartan hoặc giả dược trong 4 năm không khác nhau về tỉ lệ phối hợp biến cố tim mạch (đột quỵ, nhồi máu cơ tim hoặc tử vong do tim mạch) (5.4% so với 5.4% trên 100 bệnh nhân – năm; HR = 0.99; KTC 95%: 0.91–1.08; p= 0.85), cũng như tiêu chí phối hợp các biến cố tim mạch và nhập viện (7.3% so với 7.7% trên 100 bệnh nhân-năm; HR = 0.94; KTC 95%:0.87–1.02; p= 0.12) [116].
Trái lại, tỉ lệ rung nhĩ mới mắc giảm khi sử dụng telmisartan. Ở các bệnh nhân nhiều nguy cơ tim mạch trong nghiên cứu ONTARGET, telmisartan cũng có hiệu quả tương đương ramipril xét về tỉ lệ rung nhĩ mới mắc (6.7% so với 6.9%) [6]. Trong trường hợp tăng huyết áp với hội chứng chuyển hóa và tiền sử rung nhĩ, tỉ lệ rung nhĩ tái phát trong 1 năm ở nhóm telmisartan thấp hơn nhóm ramipril (12.9% so với 25.5%, p < 0.05) [117]. Trên bệnh nhân tăng huyết áp với tiền sử rung nhĩ, nhóm telmisartan có tỉ lệ rung nhĩ mới mắc thấp hơn nhóm chẹn beta carvedilol (14.3% so với 37.1%, p < 0.003), với mức độ hạ huyết áp tương đương nhau [118].
8. Bệnh mạch máu não
Angiotensin II có thể góp phần vào sinh bệnh học của đột quỵ [119]. Trong một nghiên cứu gần đây trên chuột bị tăng huyết áp có nguy cơ đột quỵ, sử dụng telmisartan, ramipril và telmisartan phối hợp ramipril có lợi ích tương tự nhau về khía cạnh tỉ lệ đột quỵ mới mắc. Tuy nhiên, trong một nghiên cứu trên chuột có huyết áp bình thường với thiếu máu não cục bộ do thực nghiệm, telmisartan và phối hợp telmisartan/ramipril có hiệu quả bảo vệ thần kinh tốt hơn ramipril, thể hiện qua sự cải thiện các yếu tố như nitric oxide, thể tích vùng nhồi máu, tình trạng viêm (TNF a), hoạt hóa thụ thể neurotrophin và đời sống của neurone [120]. Trong nghiên cứu PRoFESS (n = 20332), sử dụng sớm telmisartan ngay sau nhồi máu não không làm giảm có ý nghĩa tỉ lệ đột quỵ tái phát, biến cố tim mạch nghiêm trọng, hoặc đái tháo đường mới mắc so với điều trị chuẩn sau 2.5 năm theo dõi [121]. Tuy nhiên, phân tích hậu kiểm cho thấy tỉ lệ đột quỵ tái phát trong 6 tháng ở nhóm telmisartan thấp hơn nhóm điều trị chuẩn (5.3% so với 6%, HR = 0.88; KTC 95%: 0.78-0.99) [121].
Điều trị hạ áp có thể làm giảm tỉ lệ bệnh Alzheimer mới mắc. Trong một nghiên cứu ngẫu nhiên trên người lớn tuổi bị tăng huyết áp và có nguy cơ bị bệnh Alzheimer, mức độ sa sút nhận thức giảm chậm hơn ở nhóm dùng telmisartan so với amlodipine sau 6 tháng điều trị [122]. Điểm số đánh giá chức năng nhận thức không đổi ở nhóm telmisartan, nhưng lại tăng có ý nghĩa ở nhóm amlodipine. Ngoài ra, telmisartan làm tăng lưu lượng tưới máu não ởtiểu thùy đỉnh lên, hồi chêm, và hồi lưỡi so với amlodipine, trong khi amlodipine chỉ làm tăng lưu lượng máu đến hồi đai phải so với telmisartan.
9. Kết luận
ONTARGET là một nghiên cứu lâm sàng có ý nghĩa rất quan trọng cho thực hành lâm sàng, vì lần đầu tiên chứng minh rằng thuốc chẹn thụ thể angiotensin, đại diện là telmisartan, có hiệu quả tương đương ramipril trong phòng ngừa biến cố tim mạch ở bệnh nhân nguy cơ cao. Vì bệnh tim mạch diễn tiến theo tiến trình liên tục, lợi ích của telmisartan trên biến cố tim mạch phản ánh tác dụng của thuốc này trên sinh lý bệnh nền tảng cũng như các tiêu chí trung gian (tổn thương cơ quan đích). Bài điểm báo này khảo sát chứng cứ về tác động của telmisartan trên các khâu trong diễn tiến của bệnh tim mạch, với mục đích góp phần lý giải kết quả của thử nghiệm lâm sàng ONTARGET.
Có rất nhiều bằng chứng đã được xem xét, và đều cho thấy chẹn thụ thể angiotensin II với telmisartan có tác dụng trực tiếp và hữu ích trên các khía cạnh then chốt của chuỗi bệnh lý tim mạch. Tương tự với các thuốc ức chế hệ renin-angiotensin khác, telmisartan chống lại tác động trực tiếp và quan trọng nhất của angiotensin II, đó là tình trạng viêm và stress oxy hóa. Điều này giúp giải thích vì sao telmisartan cải thiện độ cứng động mạch và tổn thương cơ quan đích (albumin niệu và rối loạn chức năng thận, phì đại thất trái, rung nhĩ. Telmisartan cũng cải thiện tình trạng chuyển hóa, một tác dụng có thể do ức chế hệ renin-angiotensin, nhưng cũng có thể liên quan đến khả năng điều hòa PPARγ.
Mặc dù khó có thể khẳng định liệu những khác biệt về đặc tính dược lý giữa các thuốc chẹn thụ thể angiotensin II có ý nghĩa như thế nào về mặt lâm sàng, những chứng cứ được điểm lại cho thấy telmisartan vượt trội hơn một số thuốc chẹn angiotensin II khác – đặc biệt là ưu thế của telmisartan so với losartan trong việc giảm đạm niệu theo nghiên cứu AMADEO. Vì đạm niệu là một yếu tố nguy cơ tim mạch quan trọng, sẽ là hợp lý khi dự đoán rằng hai thuốc này có hiệu quả khác nhau trên biến cố tim mạch.
Tóm lại, lợi ích phòng ngừa biến cố tim mạch của telmisartan trong nghiên cứu ONTARGET có thể là do tác dụng trực tiếp của thuốc này trên sinh bệnh học, nhất là hiệu quả kháng viêm và cải thiện tổn thương cơ quan đích. Các thuốc chẹn thụ thể angiotensin II khác nhau về tác dụng trên các tiêu chí trung gian này, có lẽ do khác biệt về đặc tính dược lý học. Hiện chưa rõ liệu các thuốc chẹn thụ thể angiotensin II khác cũng có những tác dụng trên biến cố tim mạch tương tự như telmisartan hay không, và vấn đề này cần phải được tiếp tục kiểm chứng.
Tài liệu tham khảo
[1] T. Unger, “The role of the renin-angiotensin system in the development of cardiovascular disease,” American Journal of Cardiology, vol. 89, no. 2, pp. 3A–9A, 2002.
[2] B. J. Hoogwerf, “Renin-angiotensin system blockade and cardiovascular and renal protection,” American Journal of Cardiology, vol. 105, no. 1, supplement, pp. 30A–35A, 2010.
[3] V. Dzau and E. Braunwald, “Resolved and unresolved issues in the prevention and treatment of coronary artery disease: a workshop consensus statement,” American Heart Journal, vol.121, no. 4, pp. 1244–1263, 1991.
[4] B. Dahl¨of, R. B. Devereux, S. E. Kjeldsen et al., “Cardiovas-cular morbidity and mortality in the Losartan Intervention For Endpoint reduction in hypertension study (LIFE): a randomised trial against atenolol,” The Lancet, vol. 359, no. 9311, pp. 995–1003, 2002.
[5] T.Sawada,H.Yamada,B.Dahl¨of, and H. Matsubara, “Effects of valsartan on morbidity and mortality in uncontrolled hypertensive patients with high cardiovascular risks: KYOTO heart study,” European Heart Journal, vol. 30, no. 20, pp.2461–2469, 2009.
[6] S. Yusuf, K. K. Teo, J. Pogue et al., “Telmisartan, ramipril, or both in patients at high risk for vascular events. ONTARGET Investigators,” The New England Journal of Medicine, vol. 358, no. 15, pp. 1547–1559, 2008.
[7] S. Mochizuki, B. Dahl¨of, M. Shimizu et al., “Valsartan in a Japanese population with hypertension and other cardiovascular disease (Jikei Heart Study): a randomised, open-label, blinded endpoint morbidity-mortality study,” The Lancet, vol. 369, no. 9571, pp. 1431–1439, 2007.
[8] M. A. Pfeffer, J. J. V. McMurray, E. J. Velazquez et al., “Valsar-tan, captopril, or both in myocardial infarction complicated by heart failure, left ventricular dysfunction, or both,” The New England Journal of Medicine, vol. 349, no. 20, pp. 1893–1906, 2003.
[9] E. J. Lewis, L. G. Hunsicker, W. R. Clarke et al., “Renoprotec-tive effect of the angiotensin-receptor antagonist irbesartan in patients with nephropathy due to type 2 diabetes,” The New England Journal of Medicine, vol. 345, no. 12, pp. 851–860, 2001.
[10] G. Mancia, T. Unger, and A. Zanchetti, “Introduction: reducing cardiovascular risk: ONTARGET a new standard in cardiovascular protection,” Journal of Hypertension, vol. 27, no. 5, p. S1, 2009. [11] Micardis(Telmisartan) Tablets, Prescribing Information, Boehringer Ingelheim International GmbH, Ingelheim, Germany, 2011, http://bidocs.boehringer-ingelheim.com/BI-WebAccess/ViewServlet.ser ? docBase=renetnt&folderPath=/ Prescribing+Information/PIs/Micardis+Tabs/MICARDIS20-40-80mg.PDF.
[12] D. L. Keefe, “Clinical pharmacology of telmisartan,” Journal of Clinical Pharmacology, vol. 40, no. 12, part 1, p. 1311, 2000.
[13] A. Chiolero and M. Burnier, “Pharmacology of valsartan, an angiotensin II receptor antagonist,” Expert Opinion on Investigational Drugs, vol. 7, no. 11, pp. 1915–1925, 1998.
[14] D. Galzerano, C. Capogrosso, S. di Michele et al., “New stan-dards in hypertension and cardiovascular risk management: focus on telmisartan,” Vascular Health and Risk Management, vol. 6, no. 1, pp. 113–133, 2010.
[15] V. Mauno, K. Hannu, and K. Esko, “Proinflammation and hypertension: a population-based study,” Mediators of In-flammation, vol. 2008, Article ID 619704, 2008.
[16] M.Ekholm,T.Kahan,G.J¨orneskog,A.Br¨oijersen, and N. H.Wallen, “Angiotensin II infusion in man is proinflammatory but has no short-term effects on thrombin generation in vivo,” Thrombosis Research, vol. 124, no. 1, pp. 110–115, 2009.
[17] F. Nemati, N. Rahbar-Roshandel, F. Hosseini, M. Mahmoudian, and M. Shafiei, “Anti-inflammatory effects of anti-hypertensive agents: influence on interleukin-1β secretion by peripheral blood polymorphonuclear leuko-cytes from patients with essential hypertension,” Clinical and Experimental Hypertension, vol. 33, no. 2, pp. 66–76, 2011.
[18] T. Shishido, T. Konta, S. Nishiyama et al., “Suppressive effects of valsartan on microalbuminuria and CRP in patients with metabolic syndrome (Val-Mets),” Clinical and Experimental Hypertension, vol. 33, no. 2, pp. 117–123, 2011.
[19] G.Derosa,P.Maffioli,S.A.T.Salvadeoetal.,“Candesartan effect on inflammation in hypertension,” Hypertension Re-search, vol. 33, no. 3, pp. 209–213, 2010.
[20] U. Kintscher, N. Marx, P. Martus et al., “Effect of high-dose valsartan on inflammatory and lipid parameters in patients with Type 2 diabetes and hypertension,” Diabetes Research and Clinical Practice, vol. 89, no. 3, pp. 209–215, 2010.
[21] B. Schieffer, C. B ¨unte, J. Witte et al., “Comparative effects of AT1-antagonism and angiotensin-converting enzyme inhibi-tion on markers of inflammation and platelet aggregation in patients with coronary artery disease,” Journal of the American College of Cardiology, vol. 44, no. 2, pp. 362–368, 2004.
[22] D. Fliser, K. Buchholz, and H. Haller, “Antiinflammatory effects of angiotensin II subtype 1 receptor blockade in hypertensive patients with microinflammation,” Circulation, vol. 110, no. 9, pp. 1103–1107, 2004.
[23] V. Sukumaran, K. Watanabe, P. T. Veeraveedu et al., “Telmis-artan ameliorates experimental autoimmune myocarditis associated with inhibition of inflammation and oxidative stress,” European Journal of Pharmacology, vol. 652, no. 1–3, pp. 126–135, 2011.
[24] M. Kubota, M. Shimizu, H. Sakai et al., “Renin-angiotensin system inhibitors suppress azoxymethane-induced colonic preneoplastic lesions in C57BL/KsJ-db/db obese mice,” Bio-chemical and Biophysical Research Communications, vol. 410, no. 1, pp. 108–113, 2011.
[25] E. Blessing, M. Preusch, R. Kranzh¨ofer et al., “Anti-athero-sclerotic properties of telmisartan in advanced atheroscle-rotic lesions in apolipoprotein E deficient mice,” Atheroscle-rosis, vol. 199, no. 2, pp. 295–303, 2008.
[26] S. Cianchetti, A. Del Fiorentino, R. Colognato, R. Di Stefano, F. Franzoni, and R. Pedrinelli, “Anti-inflammatory and anti-oxidant properties of telmisartan in cultured human umbili-cal vein endothelial cells,” Atherosclerosis, vol. 198, no. 1, p.22–28, 2008.
[27] S. J. Hong, W. J. Shim, J. I. Choi et al., “Comparison of effects of telmisartan and valsartan on late lumen loss and inflam-matory markers after sirolimus-eluting stent implantation in hypertensive patients,” American Journal of Cardiology, vol.
100, no. 11, pp. 1625–1629, 2007.
[28] Y. Yano, S. Hoshide, J. Ishikawa et al., “The differential effects of angiotensin II type 1 receptor blockers on microalbu-minuria in relation to low-grade inflammation in metabolic hypertensive patients,” American Journal of Hypertension, vol. 20, no. 5, pp. 565–572, 2007.
[29] R. A. Payne, I. B. Wilkinson, and D. J. Webb, “Arterial stiffness and hypertension: emerging concepts,” Hypertension, vol. 55, no. 1, pp. 9–14, 2010.
[30] G.F.Mitchell,S.J.Hwang,R.S.Vasanetal.,“Arterialstiffness and cardiovascular events: the framingham heart study,” Circulation, vol. 121, no. 4, pp. 505–511, 2010.
[31] T. Coutinho, S. T. Turner, and I. J. Kullo, “Aortic pulse wave velocity is associated with measures of subclinical target organ damage,” JACC: Cardiovascular Imaging, vol. 4, no. 7, pp. 754–761, 2011.
[32] Y. Ono, Y. Nakaya, S. Bando, T. Soeki, S. Ito, and M. Sata, “Telmisartan decreases plasma levels of asymmetrical dimethyl-L-arginine and improves lipid and glucose metabo-lism and vascular function,” International Heart Journal, vol.50, no. 1, pp. 73–83, 2009.
[33] D. Chujo, K. Yagi, A. Asano et al., “Telmisartan treatment decreases visceral fat accumulation and improves serum levels of adiponectin and vascular inflammation markers in Japanese hypertensive patients,” Hypertension Research, vol. 30, no. 12, pp. 1205–1210, 2007.
[34] S. Morimoto, Y. Yano, K. Maki, and K. Sawada, “Renal and vascular protective effects of telmisartan in patients with essential hypertension,” Hypertension Research, vol. 29, no. 8, pp. 567–572, 2006.
[35] H. Uchida, Y. Nakamura, M. Kaihara et al., “Practical efficacy of telmisartan for decreasing morning home blood pressure and pulse wave velocity in patients with mild-to-moderate hypertension,” Hypertension Research, vol. 27, no. 8, pp. 545–550, 2004.
[36] R. Asmar, P. Gosse, J. Topouchian, G. N’tela, A. Dudley, and G. L. Shepherd, “Effects of telmisartan on arterial stiffness in type 2 diabetes patients with esssential hypertension,” JRAAS—Journal of the Renin-Angiotensin-Aldosterone Sys-tem, vol. 3, no. 3, pp. 176–180, 2002.
[37] R. Asmar, “Effect of telmisartan on arterial distensibility and central blood pressure in patients with mild to moderate hypertension and Type 2 diabetes mellitus,” JRAAS—Journal of the Renin-Angiotensin-Aldosterone System,vol.2,no.2, supplement, pp. S8–S11, 2001.
[38] T. Nakamura, T. Inoue, T. Suzuki et al., “Comparison of renal and vascular protective effects between telmisartan and amlodipine in hypertensive patients with chronic kidney disease with mild renal insufficiency,” Hypertension Research, vol. 31, no. 5, pp. 841–850, 2008.
[39] K. Kinouchi, A. Ichihara, M. Sakoda, A. Kurauchi-Mito, K. Murohashi-Bokuda, and H. Itoh, “Effects of telmisartan on arterial stiffness assessed by the cardio-ankle vascular index in hypertensive patients,” Kidney and Blood Pressure Research, vol. 33, no. 4, pp. 304–312, 2010.
[40] A. Daugherty and L. A. Cassis, “Mechanisms of abdominal aortic aneurysm formation,” Current Atherosclerosis Reports, vol. 4, no. 3, pp. 222–227, 2002.
[41] S. Matsumoto, K. Kamide, F. Banno et al., “Impact of RGS2 deficiency on the therapeutic effect of telmisartan in angiotensin II-induced aortic aneurysm,” Hypertension Research, vol. 33, no. 12, pp. 1244–1249, 2010.
[42] E. Kaschina, F. Schrader, M. Sommerfeld et al., “Telmisartan prevents aneurysm progression in the rat by inhibiting prote-olysis, apoptosis and inflammation,” Journal of Hypertension, vol. 26, no. 12, pp. 2361–2373, 2008.
[43] S. Takai, K. Kirimura, D. Jin et al., “Significance of angiotens-in II receptor blocker lipophilicities and their protective effect against vascular remodeling,” Hypertension Research, vol. 28, no. 7, pp. 593–600, 2005.
[44] S. C. Benson, R. Iguchi, C. I. Ho, K. Yamamoto, and T.W. Kurtz, “Inhibition of cardiovascular cell proliferation by angiotensin receptor blockers: are all molecules the same?” Journal of Hypertension, vol. 26, no. 5, pp. 973–980, 2008.
[45] H. Hasegawa, H. Takano, H. Narumi et al., “Effects of telmisartan and losartan on cardiovascular protection in Japanese hypertensive patients,” Hypertension Research, vol.34, no. 11, pp. 1179–1184, 2011.
[46] K. A. M. Jandeleit-Dahm, C. Tikellis, C. M. Reid, C. I.Johnston, and M. E. Cooper, “Why blockade of the renin-angiotensin system reduces the incidence of new-onset diabetes,” Journal of Hypertension, vol. 23, no. 3, pp. 463–473, 2005. [47] A. J. Scheen, “Prevention of type 2 diabetes mellitus through inhibition of the renin-angiotensin system,” Drugs, vol. 64, no. 22, pp. 2537–2565, 2004.
[48] W. J. Elliott and P. M. Meyer, “Incident diabetes in clinical trials of antihypertensive drugs: a network meta-analysis,” The Lancet, vol. 369, no. 9557, pp. 201–207, 2007.
[49] S. Julius, S. E. Kjeldsen, M. Weber et al., “Outcomes in hypertensive patients at high cardiovascular risk treated with regimens based on valsartan or amlodipine: the VALUE randomised trial,” The Lancet, vol. 363, no. 9426, pp. 2022–2031, 2004.
[50] J.J.McMurray,R.R.Holman,S.M.Haffner et al., “Effect of valsartan on the incidence of diabetes and cardiovascular events,” The New England Journal of Medicine, vol. 362, no. 16, pp. 1477–1490, 2010.
[51] S. Yusuf, K. Teo, C. Anderson et al., “Effects of the angiotensin-receptor blocker telmisartan on cardiovascu-lar events in high-risk patients intolerant to angiotensin-converting enzyme inhibitors: a randomised controlled trial,” The Lancet, vol. 372, no. 9644, pp. 1174–1183, 2008.
[52] J.I.Barzilay,P.Gao,L.Ryd´en et al., “Effects of telmisartan on glucose levels in people at high risk for cardiovascular disease butfreefromdiabetes:theTRANSCENDstudy,” Diabetes Care, vol. 34, no. 9, pp. 1902–1907, 2011.
[53] T. W. Kurtz and U. Klein, “Next generation multifunctional angiotensin receptor blockers,” Hypertension Research, vol. 32, no. 10, pp. 826–834, 2009.
[54] M. Clemenz, N. Frost, M. Schupp et al., “Liver-specific perox-isome proliferator-activated receptor α target gene regulation by the angiotensin type 1 receptor blocker telmisartan,” Diabetes, vol. 57, no. 5, pp. 1405–1413, 2008.
[55] M. Schupp, M. Clemenz, R. Gineste et al., “Molecular char-acterization of new selective peroxisome proliferator—activated receptor γ modulators with angiotensin receptor blocking activity,” Diabetes, vol. 54, no. 12, pp. 3442–3452, 2005.
[56] M. Schupp, J. Janke, R. Clasen, T. Unger, and U. Kintscher, “Angiotensin type 1 receptor blockers induce peroxisome proliferator-activated receptor-gamma activity,” Circulation, vol. 109, no. 17, pp. 2054–2057, 2004.
[57] M.E.Marketou,J.E.Kontaraki,N.A.Tsakountakisetal., “Differential effect of telmisartan and amlodipine on mono-cyte chemoattractant protein-1 and peroxisome proliferator-activated receptor-gamma gene expression in peripheral monocytes in patients with essential hypertension,” American Journal of Cardiology, vol. 107, no. 1, pp. 59–63, 2011.
[58] I.-N. B¨ahr, P. Tretter, J. Kr ¨uger et al., “High-dose treatment with telmisartan induces monocytic peroxisome proliferator-activated receptor-γ target genes in patients with the metabolic syndrome,” Hypertension, vol. 58, no. 4, pp. 725–732, 2011.
[59] H. He, D. Yang, L. Ma et al., “Telmisartan prevents weight gain and obesity through activation of peroxisome prolifera-tor-activated receptor-δ-dependent pathways,” Hypertension,vol. 55, no. 4, pp. 869–879, 2010.
[60] K. Kappert, O. Tsuprykov, J. Kaufmann et al., “Chronic treatment with losartan results in sufficient serum levels of the metaboliteEXP3179 for PPARγ activation,” Hypertension, vol. 54, no. 4, pp. 738–743, 2009.
[61] L. Yuan, X. Li, J. Li, H. L. Li, and S. S. Cheng, “Effects of renin-angiotensin system blockade on the islet morphology and function in rats with long-term high-fat diet,” Acta Diabetologica. In press.
[62] R. Clasen, M. Schupp, A. Foryst-Ludwig et al., “PPARγ-activating angiotensin type-1 receptor blockers induce adiponectin,” Hypertension, vol. 46, no. 1, pp. 137–143, 2005.
[63] H. Furukawa, K. Mawatari, K. Koyama et al., “Telmisartan increases localization of glucose transporter 4 to the plasma membrane and increases glucose uptake via peroxisome proliferator-activated receptor γ in 3T3-L1 adipocytes,” European Journal of Pharmacology, vol. 660, no. 2-3, pp. 485–491, 2011.
[64] A. Foryst-Ludwig, M. Hartge, M. Clemenz et al., “PPARgamma activation attenuates T-lymphocyte-depend-ent inflammation of adipose tissue and development of insulin resistance in obese mice,” Cardiovascular Diabetology, vol. 9, article 64, 2010.
[65] F. Younis, N. Stern, R. Limor, Y. Oron, S. Zangen, and T. Rosenthal, “Telmisartan ameliorates hyperglycemia and metabolic profile in nonobese Cohen-Rosenthal diabetic hypertensive rats via peroxisome proliferator activator recep-tor-γ activation,” Metabolism, vol. 59, no. 8, pp. 1200–1209, 2010.
[66] P. Ernsberger and R. J. Koletsky, “Metabolic actions of angiot-ensin receptor antagonists: PPAR-γ agonist actions or a class effect?” Current Opinion in Pharmacology, vol. 7, no. 2, pp. 140–145, 2007.
[67] C. V. Rizos, H. J. Milionis, M. S. Kostapanos et al., “Effects of rosuvastatin combined with olmesartan, irbesartan, or telmisartan on indices of glucose metabolism in greek adults with impaired fasting glucose, hypertension, and mixed hyperlipidemia: a 24-week, randomized, open-label, prospective study,” Clinical Therapeutics,vol.32,no.3,pp. 492–505, 2010.
[68] S.Makita,A.Abiko,Y.Naganuma,Y.Moriai,andM.Naka-mura, “Effects of telmisartan on adiponectin levels and body weight in hypertensive patients with glucose intolerance,” Metabolism, vol. 57, no. 10, pp. 1473–1478, 2008.
[69] C. Vitale, G. Mercuro, C. Castiglioni et al., “Metabolic effect of telmisartan and losartan in hypertensive patients with metabolic syndrome,” Cardiovascular Diabetology, vol. 4, article 6, 2005.
[70] Y. Ichikawa, “Comparative effects of telmisartan and val-sartan on insulin resistance in hypertensive patients with metabolic syndrome,” Internal Medicine, vol. 46, no. 17, pp. 1331–1336, 2007.
[71] G.Derosa,A.F.G.Cicero,A.D’Angeloetal.,“Telmisartan and irbesartan therapy in type 2 diabetic patients treated with rosiglitazone: effects on insulin-resistance, leptin and tumor necrosis factor-α,” Hypertension Research, vol. 29, no. 11, pp. 849–856, 2006.
[72] R. Negro, G. Formoso, and H. Hassan, “The effects of irbe-sartan and telmisartan on metabolic parameters and blood pressure in obese, insulin resistant, hypertensive patients,” Journal of Endocrinological Investigation, vol. 29, no. 11, pp. 957–961, 2006.
[73] D.A.DeLuis,R.Conde,M.Gonz ´alez-Sagrado et al., “Effects of telmisartan vs olmesartan on metabolic parameters, insulin resistance and adipocytokines in hypertensive obese patients,” Nutricion Hospitalaria, vol. 25, no. 2, pp. 275–279,2010.
[74] M. Watanabe, K. Inukai, T. Sumita et al., “Effects of telmisar-tan on insulin resistance in Japanese Type 2 diabetic patients,” Internal Medicine, vol. 49, no. 17, pp. 1843–1847, 2010.
[75] Y. Miura, N. Yamamoto, S. Tsunekawa et al., “Replacement of valsartan and candesartan by telmisartan in hypertensive patients with type 2 diabetes: metabolic and antiatherogenic consequences,” Diabetes Care, vol. 28, no. 3, pp. 757–758, 2005.
[76] Y. Mori, T. Tanaka, K. Matsuura, J. Yokoyama, and K. Utsunomiya, “Influence of telmisartan on insulin response after glucose loading in obese patients with hypertension: ARB Trial of hypertension in obese patients with hyperinsu-linemia assessed by oral glucose tolerance test (ATHLETE),” Advances in Therapy, vol. 28, no. 8, pp. 698–706, 2011.
[77] V. Kon, M. F. Linton, and S. Fazio, “Atherosclerosis in chronic kidney disease: the role of macrophages,” Nature Reviews Nephrology, vol. 7, no. 1, pp. 45–54, 2011.
[78] G. Remuzzi, N. Perico, M. Macia, and P. Ruggenenti, “The role of renin-angiotensin-aldosterone system in the progression of chronic kidney disease,” Kidney International, vol. 68, no. 99, pp. S-57–S-65, 2005.
[79] U. O. Wenzel, C. Krebs, and R. Benndorf, “The angiotensin II type 2 receptor in renal disease,” JRAAS—Journal of the Renin-Angiotensin-Aldosterone System,vol.11,no.1,pp.37–41, 2010.
[80] G. Viberti and N. M. Wheeldon, “Microalbuminuria reduc-tion with valsartan in patients with type 2 diabetes mellitus: a blood pressure-independent effect,” Circulation, vol. 106, no.6, pp. 672–678, 2002.
[81] H. Narumi, H. Takano, S. Shindo et al., “Effects of valsartan and amlodipine on cardiorenal protection in Japanese hyper-tensive patients: the Valsartan Amlodipine Randomized Trial,” Hypertension Research, vol. 34, no. 1, pp. 62–69, 2011.
[82] H. Haller, S. Ito, J. L. Izzo Jr. et al., “Olmesartan for the delay or prevention of microalbuminuria in type 2 diabetes,” The New England Journal of Medicine, vol. 364, no. 10, pp. 907–917, 2011.
[83] L. Villa, P. Boor, A. Konieczny et al., “Effects and mechanisms of angiotensin II receptor blockade with telmisartan in a normotensive model of mesangioproliferative nephritis,” Nephrology Dialysis Transplantation, vol. 26, no. 10, pp.3131–3143, 2011.
[84] W. Liang, C. Chen, J. Shi et al., “Disparate effects of eplerenone, amlodipine and telmisartan on podocyte injury in aldosterone-infused rats,” Nephrology Dialysis Transplan-tation, vol. 26, no. 3, pp. 789–799, 2011.
[85] M. A. H. Khan and J. D. Imig, “Telmisartan provides better renal protection than Valsartan in a rat model of metabolic syndrome,” American Journal of Hypertension, vol. 24, no. 7, pp. 816–821, 2011.
[86] R. E. Schmieder, C. Delles, A. Mimran, J. P. Fauvel, and L. M. Ruilope, “Impact of telmisartan versus ramipril on renal endothelial function in patients with hypertension and type 2 diabetes,” Diabetes Care, vol. 30, no. 6, pp. 1351–1356, 2007.
[87] H. Makino, M. Haneda, T. Babazono et al., “Prevention of transition from incipient to overt nephropathy with telmisartan in patients with type 2 diabetes,” Diabetes Care, vol. 30, no. 6, pp. 1577–1578, 2007.
[88] A. H. Barnett, S. C. Bain, P. Bouter et al., “Angiotensin-receptor blockade versus converting-enzyme inhibition in type 2 diabetes and nephropathy,” The New England Journal of Medicine, vol. 351, no. 19, pp. 1952–1961, 2004.
[89] J. F. E. Mann, R. E. Schmieder, L. Dyal et al., “Effect of telmisartan on renal outcomes: a randomized trial,” Annals of Internal Medicine, vol. 151, no. 1, pp. 1–10, 2009.
[90] G. Bakris, E. Burgess, M. Weir, G. Davidai, and S. Koval, “Telmisartan is more effective than losartan in reducing proteinuria in patients with diabetic nephropathy,” Kidney International, vol. 74, no. 3, pp. 364–369, 2008.
[91] J. Galle, E. Schwedhelm, S. Pinnetti, R. H. B ¨oger, and C. Wan-ner, “Antiproteinuric effects of angiotensin receptor blockers: telmisartan versus valsartan in hypertensive patients with type 2 diabetes mellitus and overt nephropathy,” Nephrology Dialysis Transplantation, vol. 23, no. 10, pp. 3174–3183, 2008.
[92] P. Verdecchia, G. Carini, A. Circo et al., “Left Ventricular mass and cardiovascular morbidity in essential hypertension: the MAVI study,” Journal of the American College of Cardiology, vol. 38, no. 7, pp. 1829–1835, 2001.
[93] P. J. Lijnen, V. V. Petrov, and R. H. Fagard, “Angiotensin II-induced stimulation of collagen secretion and production in cardiac fibroblasts is mediated via angiotensin II sub-type 1 receptors,” JRAAS—Journal of the Renin-Angiotensin-Aldosterone System, vol. 2, no. 2, pp. 117–122, 2001.
[94] R. H. Fagard, H. Celis, L. Thijs, and S. Wouters, “Regression of left ventricular mass by antihypertensive treatment: a meta-analysis of randomized comparative studies,” Hyper-tension, vol. 54, no. 5, pp. 1084–1091, 2009.
[95] C. Cuspidi, F. Negri, and A. Zanchetti, “Angiotensin II receptor blockers and cardiovascular protection: focus on left ventricular hypertrophy regression and atrial fibrillation prevention,” Vascular Health and Risk Management, vol. 4,no. 1, pp. 67–73, 2008.
[96] H. S. Guan, H. J. Shangguan, Z. Shang, L. Yang, X. M. Meng, and S. B. Qiao, “Endoplasmic reticulum stress caused by left ventricular hypertrophy in rats: effects of telmisartan,” The American Journal of the Medical Sciences, vol. 342, no. 4, pp. 318–323, 2011.
[97] M. H. Krieger, A. Di Lorenzo, C. Teutsch, K. Kauser, and W. C. Sessa, “Telmisartan regresses left ventricular hypertrophy in caveolin-1-deficient mice,” Laboratory Investigation, vol.90, no. 11, pp. 1573–1581, 2010.
[98] L. Liu, W. Wang, X. Meng et al., “Left ventricular hypertrophy induced by abdominal aortic banding and its prevention by angiotensin receptor blocker telmisartan—a proteomic analysis,” Journal of Physiology and Biochemistry, vol. 66, no. 4, pp. 329–338, 2010.
[99] V. Sukumaran, K. Watanabe, P. T. Veeraveedu et al., “Telmisartan, an angiotensin-II receptor blocker ameliorates cardiac remodeling in rats with dilated cardiomyopathy,” Hypertension Research, vol. 33, no. 7, pp. 695–702, 2010.
[100] Y. Maejima, H. Okada, G. Haraguchi et al., “Telmisartan, a unique ARB, improves left ventricular remodeling of infarcted heart by activating PPAR gamma,” Laboratory Investigation, vol. 91, no. 6, pp. 932–944, 2011.
[101] S. N. Goyal, S. Bharti, J. Bhatia, T. C. Nag, R. Ray, and D. S. Arya, “Telmisartan, a dual ARB/partial PPAR-γ agonist, protects myocardium from ischaemic reperfusion injury in experimental diabetes,” Diabetes, Obesity and Metabolism, vol. 13, no. 6, pp. 533–541, 2011.
[102] V. G. DeMarco, M. S. Johnson, J. Habibi et al., “Comparative analysis of telmisartan and olmesartan on cardiac function in the transgenic (mRen2)27 rat,” American Journal of Physiology, vol. 300, no. 1, pp. H181–H190, 2011.
[103] C. S. Weiss, M. Hagenm ¨uller, M. Pichler et al., “Activation of PPARγ by pioglitazone does not attenuate left ventricular hypertrophy following aortic banding in rats,” Naunyn-Schmiedeberg’s Archives of Pharmacology, vol. 381, no. 4, pp. 285–295, 2010.
[104] D. Galzerano, P. Tammaro, A. Cerciello et al., “Freehand three-dimensional echocardiographic evaluation of the effect of telmisartan compared with hydrochlorothiazide on left ventricular mass in hypertensive patients with mild-to-mode rate hypertension: a multicentre study,” Journal of Human Hypertension, vol. 18, no. 1, pp. 53–59, 2004.
[105] D. Galzerano, P. Tammaro, L. Del Viscovo et al., “Three-dimensional echocardiographic and magnetic resonance assessment of the effect of telmisartan compared with carv-edilol on left ventricular mass: a multicenter, randomized, longitudinal study,” American Journal of Hypertension, vol.18, no. 12, pp. 1563–1569, 2005.
[106] P. Verdecchia, P. Sleight, G. Mancia et al., “Effects of telmis-artan, ramipril, and their combination on left ventricular hypertrophy in individuals at high vascular risk in the ongoing telmisartan alone and in combination with ramipril lobal end point trial and the telmisartan randomized assess-ment study in ACE intolerant subjects with cardiovascular disease,” Circulation, vol. 120, no. 14, pp. 1380–1389, 2009.
[107] T. Yokota, T. Osanai, K. Hanada et al., “Effects of telmisartan on markers of ventricular remodeling in patients with acute myocardial infarction: comparison with enalapril,” Heart and Ve s s e l s, vol. 25, no. 6, pp. 460–468, 2010.
[108] B. R. Cowan, A. A. Young, C. Anderson et al., “Left ventric-ular mass and volume with telmisartan, ramipril, or com-bination in patients with previous atherosclerotic events or with diabetes mellitus (from the ONgoing Telmisartan Alone and in Combination With Ramipril Global Endpoint Trial [ONTARGET]),” American Journal of Cardiology, vol. 104,no. 11, pp. 1484–1489, 2009.
[109] J. Petrovic, D. Petrovic, N. Vukovic et al., “Ventricular and vascular remodelling—effects of the angiotensin II recep-tor blocker telmisartan and/or the angiotensin-converting enzyme inhibitor ramipril in hypertensive patients,” Journal
of International Medical Research, vol. 33, no. 1, pp. 39A–49A, 2005.
[110] B. Martina, T. Dieterle, J. P. Sigle, C. Surber, and E. Battegay, “Effects of telmisartan and losartan on left ventricular mass in mild-to-moderate hypertension: a randomized, double-blind trial,” Cardiology, vol. 99, no. 3, pp. 169–170, 2003.
[111] K. Wachtell, M. Lehto, E. Gerdts et al., “Angiotensin II receptor blockade reduces new-onset atrial fibrillation and subsequent stroke compared to atenolol: the Losartan Inter-vention for End point reduction in hypertension (LIFE) study,” Journal of the American College of Cardiology, vol. 45,no. 5, pp. 712–719, 2005.
[112] M. P. Schneider, T. A. Hua, M. B¨ohm, K. Wachtell, S. E. Kjeld-sen, and R. E. Schmieder, “Prevention of atrial fibrillation by Renin-Angiotensin system inhibition a meta-analysis,” Journal of the American College of Cardiology, vol. 55, no. 21, pp. 2299–2307, 2010.
[113] J. S. Healey, A. Baranchuk, E. Crystal et al., “Prevention of atrial fibrillation with angiotensin-converting enzyme inhibitors and angiotensin receptor blockers: a meta-analy-sis,” Journal of the American College of Cardiology, vol. 45, no.11, pp. 1832–1839, 2005.
[114] M. Disertori, R. Latini, S. Barlera et al., “Valsartan for preven-tion of recurrent atrial fibrillation,” The New England Journal of Medicine, vol. 360, no. 16, pp. 1606–1617, 2009.
[115] A. Goette, N. Kirchof, G. Breithardt et al., “ANTIPAF:angiotensin II-antagonist in paroxysmal atrial fibrillation trial,” Presented at the European Sociuety of Cardiology (ESC), Stockholm, Sweden, August 2010, http://www.escar-dio.org/congresses/esc-2010/congress-reports/Pages/708-5-TIPAF.aspx.
[116] S. Yusuf, J. S. Healey, J. Pogue et al., “Irbesartan in patients with atrial fibrillation,” The New England Journal of Medicine, vol. 364, no. 10, pp. 928–938, 2011.
[117] R. Fogari, A. Mugellini, A. Zoppi et al., “Effectoftelmis-artan and ramipril on atrial fibrillation recurrence and severity in hypertensive patients with metabolic syndrome and recurrent symptomatic paroxysmal and persistent atrial fibrillation,” Journal of Cardiovascular Pharmacology and Therapeutics, vol. 17, no. 1, pp. 34–43, 2012.
[118] D. Galzerano, S. Di Michele, G. Paolisso et al., “A multicenter, randomized study of telmisartan vs. carvedilol for prevention of atrial fibrillation recurrence in hypertensive patients,”Journal of Renin-Angiotensin-Aldosterone System. In press.
[119] S. G. Chrysant, “Possible pathophysiologic mechanisms sup-porting the superior stroke protection of angiotensin recep-tor blockers compared to angiotensin-converting enzyme inhibitors: clinical and experimental evidence,” Journal of Human Hypertension, vol. 19, no. 12, pp. 923–931, 2005.
[120] C. Thoene-Reineke, K. Rumsch ¨ussel, K. Schmerbach et al., “Prevention and intervention studies with telmisartan, ramipril and their combination in different rat stroke models,” PLoS ONE, vol. 6, no. 8, article e23646, 2011.
[121] S. Yusuf, H.-C. Diener, R. L. Sacco et al., “Telmisartan to prevent recurrent stroke and cardiovascular events,” The New England Journal of Medicine, vol. 359, no. 12, pp. 1225–1237, 2008.
[122] K. Kume, H. Hanyu, H. Sakurai, Y. Takada, T. Onuma, and T. Iwamoto, “Effects of telmisartan on cognition and regional cerebral blood flow in hypertensive patients with Alzheimer’s disease,” Geriatrics and Gerontology International, vol. 12, no. 2, pp. 207–214, 2012.







