ThS.BS.NGUYỄN VĂN THẢO1,2
THƯỢNG THANH NAM1,3
1 Phòng khám Đa Khoa Cardio
2Nghiên cứu viên trẻ Hiệp hội Tăng huyết áp Quốc tế
3Trường Đại học Y Dược Huế
3.2 Cơ chế tác động cải thiện chức năng hiệu quả của tim:
Hãy nhớ rằng quá trình tái cấu trúc là một sự đáp ứng của khối cơ tim còn hoạt động để nâng cao hiệu quả hoạt động của tim vậy nên bên cạnh việc chống tái cấu trúc cơ tim nhờ tác động trực tiếp lên ty thể và phản ứng viêm nêu trên, tác dụng của thuốc SGLT2-i còn phải biểu hiện trên các chất chuyển hóa tham gia vào hoạt động co bóp của cơ tim, giúp cơ tim có thể năng cao hiệu quả làm việc. Thật vậy, thuốc SGLT2-i có thể cải thiện việc tiêu thụ năng lượng của cơ tim và cân bằng nội môi cho cơ tim.
Trong bệnh đái tháo đường type 2 hoặc suy tim, có sự rối loạn điều hòa quá trình oxy hóa axit béo cũng như quá trình hấp thu, oxy hóa glucose, do đó gây ra rối loạn chức năng cơ tim. Lúc này, các thể ketone là một “siêu nhiên liệu”, sản xuất ATP hiệu quả hơn so với glucose hoặc axit béo tự do.
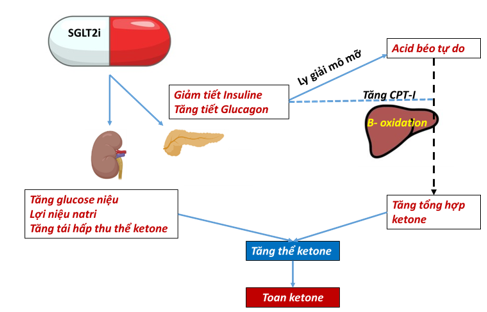
Sơ đồ 4. Cơ chế tăng thể ketone khi sử dụng SGLT2-i
Liệu pháp ức chế SGLT2 làm tăng tổng hợp ở gan và giảm bài tiết ketone trong nước tiểu, tạo ra một trạng thái tăng kali máu nhẹ và lâu dài. Trong những điều kiện này, beta-hydroxybutyrate (thể keton) được tim oxy hóa thành các nhiên liệu chu chu trình Kreb để cung cấp năng lượng cho hoạt động của tế bào cơ tim, thể ketone không chỉ cải thiện chức năng tim ở người bị suy tim mà còn tăng hiệu suất cơ học của vùng cơ tim chưa nhồi máu .23 Các nghiên cứu sơ bộ được thực hiện trên lợn sau khi bị nhồi máu cơ tim, chứng minh rằng empagliflozin làm tăng tiêu thụ ketone của cơ tim, và giảm mức tiêu thụ glucose và sản xuất lactate tại chỗ. Điều này mở ra một hướng đi mới trong điều trị chống tái cấu trúc cơ tim về lâu dài vì chính những rối loạn trong hoạt động ty thể sản sinh ra quá mức các gốc oxy hóa là mấu chốt quả phản ứng viêm mạn tính và xơ hóa cho mô cơ tim xung quanh.
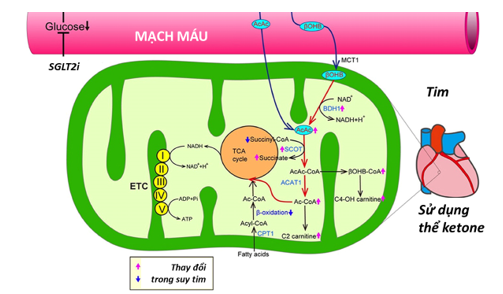
Hình 1. Thuốc ức chế SGLT2 làm tăng thể ketone, có lợi cho tim mạch
Thuốc ức chế SGLT2 làm giảm nồng độ glucose trong huyết tương, do đó thúc đẩy quá trình ly giải lipid trong mô mỡ, tăng cường tạo ra các thể ketone, là chất nền thuận lợi trong sản sinh năng lượng vì việc chuyển đổi thành acetyl-CoA dễ dàng hơn nhiều so với việc chuyển đổi từ acid béo tự do hay glucose. Hơn nữa, sự thay đổi mức độ phiên mã của các gen liên quan đến oxy hóa ketone sẽ liên quan đến sự chuyển hóa các cơ chất sang thể ketone trong suy tim. Cả hai mũi tên màu hồng và màu xanh đều cho thấy những thay đổi thuận lợi. *AcAc CoA, Acetoacetyl CoA; ACAT1, Acetyl-CoA acetyltransferase; ADP, Adenosine diphosphate; ATP, Adenosine triphosphate; BDH1, Mitochondrial β-hydroxybutyrate dehydrogenase; βOHB, β-hydroxybutyrate; βOHB CoA, β-hydroxybutyryl CoA; C2-carnitine, Acetylcarnitine; C4-OH carnitine, Hydroxybutyrylcarnitine; CPT1, Carnitine palmitoyltransferase 1; ETC, Electron transport chain; HMGCL, 3-hydroxy-3-methylglutaryl-coenzyme A lyase; HMGCS2, 3-hydroxy-3-methylglutaryl-coenzyme A synthase 2; and SCOT, Succinyl-CoA:3-oxoacid-CoA transferase.24
Cân bằng nội môi canxi trong cơ tim là một cơ chế cân bằng tinh vi, cần thiết cho sự kết hợp kích thích – co bóp hiệu quả. Điều này sẽ kích hoạt các protein co bóp nhạy cảm với canxi (troponin C, troponin NC) dẫn đến co cơ tim. Khi mắc bệnh đái tháo đường type 2 và suy tim, có sự điều tiết của kênh đối vận natri-hydro 1 dẫn đến hàm lượng natri trong tế bào tăng lên rõ rệt. Hàm lượng canxi nội bào cơ bản tăng cao dẫn đến giảm quá trình trao đổi và dự trữ canxi trong lưới cơ chất nhỏ hơn, do đó ức chế chức năng co bóp. 25Liệu pháp ức chế SGLT2 làm giảm hàm lượng natri trong tế bào tim bằng cách ức chế chất trao đổi natri-hydro 1, do đó đảo ngược tình trạng quá tải canxi. 26Điều đáng ngạc nhiên là tác động này lên chất trao đổi natrihydro 1 không phụ thuộc vào tình trạng bệnh đái tháo đường. 27
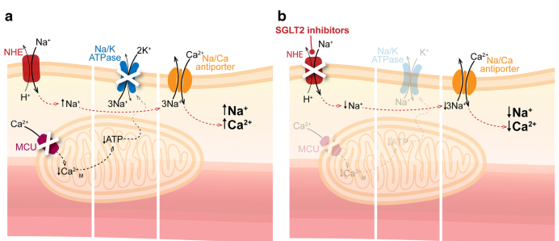
Hình 2 (a) Suy tim liên quan đến bệnh đái tháo đường được đặc trưng bởi sự gia tăng biểu hiện kênh đối vận Natri-Hydro NHEs (Na+/H+ exchanger) trong cơ tim. Điều này có thể dẫn đến tăng nồng độ natri và canxi trong tế bào chất, có thể góp phần vào bệnh lý suy tim. (b) Dữ liệu gần đây cho thấy rằng chất ức chế SGLT2 ngăn chặn NHE, do đó làm giảm natri và canxi trong tế bào chất, do đó có tác dụng bảo vệ tim mạch. Ca2 + M: mitochondrial calcium, canxi ti thể; MCU (mitochondrial Ca2+ uniporte): đơn vị hợp nhất Ca2 + của ty thể. 28.29
3.3. Nghiên cứu về hiệu quả của thuốc SGLT2-i lên cấu trúc cơ tim trên bệnh nhân Suy tim
Để đánh giá về lợi ích của SGLT2-i để cân nhắc việc đưa nhóm thuốc này vào liệu pháp điều trị chính, các thiết kế nghiên cứu chủ yếu đánh giá trên kết cục kết cục thứ phát, như tỷ lệ mới mắc suy tim, tần suất nhập viện và tử vong do bệnh tim mạch, trong đó tỷ lệ này chiếm lần lượt là 27%, 25% và 18% cho các đối tượng trên 18 tuổi có tiền sử suy tim NYHA II,III,IV và phân suất tống máu giảm so với nhóm giả dược, kết quả được báo cáo dựa trên nghiên cứu DECLARE và DAPA-HF. 30,31 Với những kết quả to lớn như vậy, việc đưa liệu pháp mới này trở thành khuyến cáo đầu tay cho bệnh nhân suy tim là điều có thể chấp chận. Chưa dừng lợi ở đó, với sự phát triển chất lượng trong kỹ thuật hình ảnh và tính phổ biến của chúng, hiện nay các thang đo lâm sàng cũng được quan tâm hơn.
Những chỉ số liên quan đến cấu trúc thành thất được theo dõi thường xuyên trên siêu âm hoặc MRI tim gồm:
IVSd: Độ dày vách liên thất kỳ tâm trương (Interventricular Septal Diastolic)
IVSs: Độ dày vách liên thất kỳ tâm thu (Interventricular Septal Systolic)
LVEDd : Đường kính thất trái tâm trương (Left Ventricular End Diastolic Dimension)
LVEDs: Đường kính thất trái tâm thu (Left Ventricular End Systolic Dimension)
LVPWd: Độ dày thành sau thất trái tâm trương (Left ventricular posterior wall diastolic)
LVPWs: Độ dày thành sau thất trái tâm thu (Left ventricular posterior wall systolic)
LVMI: Chỉ số khối cơ thất trái (Left ventricular mass index)
E/e’, tỷ lệ vận tốc tâm thu/vận tốc tâm trương tĩnh mạch phổi
Khối lượng cơ thất trái (LV Mass) có thể được tính theo công thức:
Qua đó có thể tính được Chỉ số khối cơ thất trái khi chia chỉ số trên cho tổng diện tích da cơ thể BSA (Body Surface Area), với
![]()
Kết quả nghiên cứu của DAPA-LVH vừa chứng mình được thuốc cải thiện cấu trúc của tâm thất trái nhưng vẫn đem lại hiệu quả điều trị liên quan đến phân suất tống máu và tiên lượng tốt hơn qua nt-proBNP.Cụ thể, trong nghiên cứu ngẫu nhiên trên 66 đối tượng trong độ tuổi trung bình 67 ± 7, gồm 38 nam giới bị ĐTD type II, phì đại thất trái và được kiểm soát huyết áp tốt , khi được dùng dapagliflozin 10 mg một lần mỗi ngày, trọng lượng và chỉ số khối cơ thất trái được ghi nhận là cải thiện rõ rệt sau 12 tháng điều trị so với nhóm giả dược .3
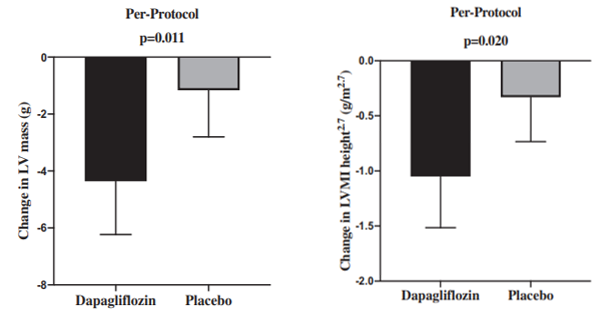
Biểu đồ 2. Biểu đồ cột thể hiện lợi ích của Dapagliflozin lên chỉ số khối cơ thất trái và chỉ só khối cơ thất trái theo chiều cao so với nhóm giả dược trên các đối tượng hoàn thành thử nghiệm.
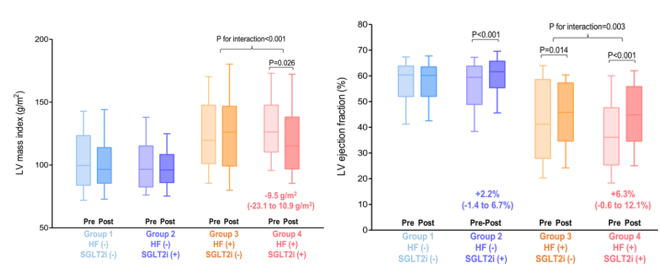
Chưa dừng lại ở đó, tác động cải thiện cấu trúc cơ tim còn biểu hiện tốt trên nhiều nhóm nghiên cứu khác nhau với cỡ mẫu lớn hơn. 32 Theo kết quả nghiên cứu về các tác dụng khác nhau của thuốc ức chế SGLT2 tùy theo sự hiện diện của suy tim ở bệnh nhân đái tháo đường type 2, chỉ số khối cơ tim được cải thiện xuống thêm 9.5 g/m2 ở nhóm bệnh nhân có suy tim sau khi điều trị 10 tháng và có lợi ích vượt trội hơn so với nhóm chứng chứng không dùng thuốc này. Thêm vào đó, phân suất tống máu thất trái ở nhóm trên cũng được cải thiện thêm 6.3% trong cùng khoảng thời gian và cũng vượt trội hơn so với nhóm bệnh nhân suy tim dùng giả dược. Một điểm thú vị khi kết quả nghiên cứu cũng chỉ ra nhóm đối tượng phì đại cơ tim không có suy tim vẫn có thể cải thiện được phân suất tống máu 2.2% sau 5-15 tháng sử dụng SGLT2-i.
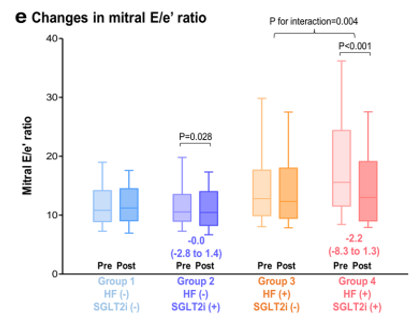
Tương tự, tỷ số E/e’ van hai lá liên quan với áp lực đổ đầy thất trái, có thể theo dõi chức năng tâm trương cũng được ghi nhận là có giảm đáng kể ở nhóm bệnh nhân suy tim được điều trị bằng thuốc SGLT2-i , trung bình 2.2, và vượt trội hơn nhóm bệnh nhân suy tim dùng giả dược.
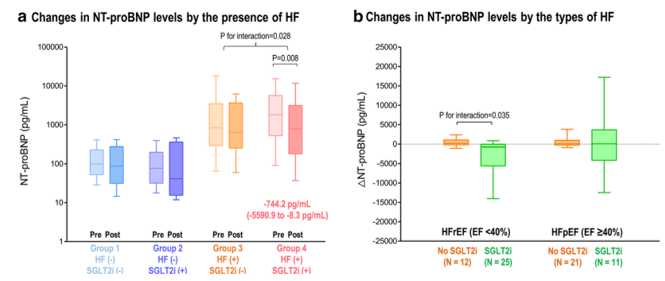
Cuối cùng, đánh giá tiên lượng về tần suất nhập viện tương lai của bệnh nhân suy tim, nhóm được sử dụng liệu pháp mới sẽ giúp cải thiện mức nt-proBNP đáng kể sau 10 tháng sử dụng và hơn hẳn nhóm dùng giả dược, đặc biệt là những bệnh nhân có suy tim phân suất tống máu giảm dưới 40%.
III. KẾT LUẬN
Những cơ chế tiềm năng của nhóm thuốc SGLT2-i đã vượt xa những lợi ích kinh điển trong điều trị hạ đường huyết hay tác dụng lợi tiểu natri đơn thuần có thể áp dụng cho bệnh nhân Suy tim có kèm đái tháo đường, điều này được minh chứng thông qua nhiều nghiên cứu ngẫu nhiên, đã trung tâm, bù đôi có đối chứng với các kết quả khả quan từ giảm tần suất nhập viện và tỷ lệ tử vong do bệnh tim mạch. Những lợi ích này được đánh giá cụ thể cả về phương diện cấu trúc cơ tim thông qua các kỹ thuật hình ảnh tiên tiến lẫn phương diện chức năng thông qua phân suất tống máu và tỷ lệ E/e’ qua van hai lá. Ngay cả những bệnh nhân chưa có suy tim, tình trạng phì đại cơ tim cũng được cải thiện khi sử dụng thuốc sớm và được theo dõi đầy đủ, ít nhất 6 tháng từ lúc điều trị. Những thử nghiệm được phân tích ở trên cũng phản ánh tính hữu hiệu và an toàn cho bệnh nhân Suy tim trong một thời gian dài và những nghiên cứu dựa trên các thang đo cận lâm sàng cũng được quan tâm hơn, phù hợp với sự phát triển không ngừng của các công cụ hỗ trợ thăm khám và chẩn đoán.
TÀI LIỆU THAM KHẢO
- Salah, Husam M., et al. “Trends and characteristics of hospitalizations for heart failure in the United States from 2004 to 2018.” ESC Heart Failure2 (2022): 947-952
- Xu D, Chandler O, Wee C, Ho C, Affandi JS, Yang D, Liao X, Chen W, Li Y, Reid C, Xiao H. Sodium-Glucose Cotransporter-2 Inhibitor (SGLT2i) as a Primary Preventative Agent in the Healthy Individual: A Need of a Future Randomised Clinical Trial? Front Med (Lausanne). 2021 Aug 23;8:712671. DOI: 10.3389/fmed.2021.712671. PMID: 34497814; PMCID: PMC8419219
- Alexander J M Brown, Stephen Gandy, Rory McCrimmon, John Graeme Houston, Allan D Struthers, Chim C Lang, A randomized controlled trial of dapagliflozin on left ventricular hypertrophy in people with type two diabetes: the DAPA-LVH trial, European Heart Journal, Volume 41, Issue 36, 21 September 2020, Pages 3421–3432
- Heart Outcomes Prevention Evaluation Study Investigators, Yusuf S, Sleight P, Pogue J, Bosch J, Davies R, Dagenais G. Effects of an angiotensin-converting-enzyme inhibitor, ramipril, on cardiovascular events in high-risk patients. N Engl J Med. 2000 Jan 20;342(3):145-53. DOI: 10.1056/NEJM200001203420301. Erratum in: 2000 May 4;342(18):1376. Erratum in: N Engl J Med 2000 Mar 9;342(10):748. PMID: 10639539.
- Pitt, Bertram, et al. “The effect of spironolactone on morbidity and mortality in patients with severe heart failure.” New England Journal of Medicine10 (1999): 709-717
- US Carvedilol Heart Failure Study Group. “The effect of carvedilol on morbidity and mortality in patients with chronic heart failure.” N Engl J Med334 (1996): 1355
- Ferrannini E, Ramos SJ, Salsali A, Tang W, List JF. Dapagliflozin monotherapy in type 2 diabetic patients with inadequate glycemic control by diet and exercise: a randomized, double-blind, placebo-controlled, phase 3 trial. Diabetes Care. 2010;33:2217-24.
- Bailey CJ, Gross JL, Pieters A, Bastien A, List JF. Effect of dapagliflozin in patients with type 2 diabetes who have inadequate glycaemic control with metformin: a randomized, double-blind, placebo-controlled trial. Lancet. 2010;375:2223-33.
- Bailey CJ, Iqbal N, T’Joen C, List JE. Dapagliflozin monotherapy in drug-naive patients with diabetes: a randomized- controlled trial of low-dose range. Diabetes Obes Metab. 2012;14:951-9.
- Strojek K, Yoon KH, Hruba V, Elze M, Langkilde AM, Parikh S. Effect of dapagliflozin in patients with type 2 diabetes who have inadequate glycaemic control with glimepiride: a randomized, 24-week, double-blind, placebo-controlled trial. Diabetes Obes Metab. 2011;13:928-38.
- Rosenstock J, Vico M, Wei L, Salsali A, List JF. Effects of dapagliflozin, a sodium-glucose cotransporter-2 inhibitor, on hemoglobin A1c, body weight, and hypoglycemia risk in patients with type 2 diabetes inadequately controlled on pioglitazone monotherapy. Diabetes Care. 2012;35:1473-8.
- Wilding JPH, Woo V, Soler NG, Pahor A, Sugg J, Rohwedder K, et al. Long-term efficacy of dapagliflozin in patients with type 2 diabetes mellitus receiving high doses of insulin: a randomized trial. Ann Intern Med. 2012;156:405-15.
- Ito D, Inoue K, Saito D, Hamaguchi K, Kaneko K, Sumita T, Inukai K, Inoue I, Shimada A. Effects of Dapagliflozin Compared with Sitagliptin and Metformin in Drug-Naïve Japanese Patients with Type 2 Diabetes: A 12-Week, Open-Label, Randomized, Active-Controlled Trial. Diabetes Ther. 2021 Dec;12(12):3201-3215. DOI: 10.1007/s13300-021-01176-x. Epub 2021 Oct 28. PMID: 34709582; PMCID: PMC8586398.
- McMurray JJV, Solomon SD, Inzucchi SE, Køber L, Kosiborod MN, Martinez FA, Ponikowski P, Sabatine MS, Anand IS, Bělohlávek J, Böhm M, Chiang CE, Chopra VK, de Boer RA, Desai AS, Diez M, Drozdz J, Dukát A, Ge J, Howlett JG, Katova T, Kitakaze M, Ljungman CEA, Merkely B, Nicolau JC, O’Meara E, Petrie MC, Vinh PN, Schou M, Tereshchenko S, Verma S, Held C, DeMets DL, Docherty KF, Jhund PS, Bengtsson O, Sjöstrand M, Langkilde AM; DAPA-HF Trial Committees and Investigators. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med. 2019 Nov 21;381(21):1995-2008. DOI: 10.1056/NEJMoa1911303. Epub 2019 Sep 19. PMID: 31535829.
- Maiuri MC, Zalckvar E, Kimchi A, et al. Self-eating and self-killing: crosstalk between autophagy and apoptosis. Nat Rev Mol Cell Biol 2007;8:741–52.
- Santulli G. Cardioprotective effects of autophagy: eat your heart out, heart failure! Sci Transl Med 2018;10:eaau0462.
- Luo G, Jian Z, Zhu Y. Sirt1 promotes autophagy and inhibits apoptosis to protect cardiomyocytes from hypoxic stress. Int J Mol Med 2020.
- Packer M. Molecular, Cellular, and Clinical Evidence That Sodium-Glucose Cotransporter 2 Inhibitors Act as Neurohormonal Antagonists When Used for the Treatment of Chronic Heart Failure. J Am Heart Assoc. 2020 Aug 18;9(16):e016270. DOI: 10.1161/JAHA.120.016270. Epub 2020 Aug 1. PMID: 32791029; PMCID: PMC7660825.
- Ghantous CM, Azrak Z, Hanache S, et al. Differential role of leptin and adiponectin in the cardiovascular system. Int J Endocrinol 2015;2015:1–13.
- Iacobellis G, Ribaudo MC, Zappaterreno A, et al. Relation between epicardial adipose tissue and left ventricular mass. Am J Cardiol 2004;94:1084–7.
- Schulze PC, Kratzsch J, Linke A, et al. Elevated serum levels of leptin and soluble leptin receptor in patients with advanced chronic heart failure. Eur J Heart Fail 2003;5:33–40.
- Wu P, Wen W, Li J, et al. Systematic review and meta-analysis of randomized controlled trials on the effect of SGLT2 inhibitor on blood leptin and adiponectin level in patients with type 2 diabetes. Horm Metab Res 2019;51:487–94.
- Gormsen LC, Svart M, Thomsen HH, et al (2017) Ketone body infusion with 3-hydroxybutyrate reduces myocardial glucose uptake and increases blood flow in humans: a positron emission tomography study. J Am Heart Assoc 6:e005066.].
- Maejima Y. SGLT2 Inhibitors Play a Salutary Role in Heart Failure via Modulation of the Mitochondrial Function. Front Cardiovasc Med. 2020 Jan 8;6:186. DOI: 10.3389/fcvm.2019.00186. PMID: 31970162; PMCID: PMC6960132
- Lee T-I, Chen Y-C, Lin Y-K, et al. Empagliflozin attenuates myocardial sodium and calcium dysregulation and reverses cardiac remodeling in streptozotocin-induced diabetic rats. Int J Mol Sci 2019;20.
- Uthman L, Baartscheer A, Bleijlevens B, et al. Class effects of SGLT2 inhibitors in mouse cardiomyocytes and hearts: inhibition of Na+ /H+ exchanger, lowering of cytosolic Na+ and vasodilation. Diabetologia 2018;61:722–6
- Iborra-Egea O, Santiago-Vacas E, Yurista SR. Unraveling the molecular mechanism of action of empagliflozin in heart failure with reduced ejection fraction with or without diabetes. JACC Basic to Transl Sci 2019;4:831–40
- Packer M, Anker SD, Butler J, Filippatos G, Zannad F (2017) Effects of sodium-glucose cotransporter 2 inhibitors for the treatment of patients with heart failure: proposal of a novel mechanism of action. JAMA Cardiol 2:1025–1029
- Uthman L, Baartscheer A, Bleijlevens B, et al (2018) Class effects of SGLT2 inhibitors in mouse cardiomyocytes and hearts: inhibition of Na+/H+exchanger, lowering of cytosolic Na+ and vasodilation. Diabetologia 61:722–726.
- Wiviott SD, Raz I, Bonaca MP, Mosenzon O, Kato ET, Cahn A, Silverman MG, Zelniker TA, Kuder JF, Murphy SA, Bhatt DL, Leiter LA, McGuire DK, Wilding JPH, Ruff CT, Gause-Nilsson IAM, Fredriksson M, Johansson PA, Langkilde AM, Sabatine MS; DECLARE–TIMI 58 Investigators.
- Dapagliflozin and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med. 2019 Jan 24;380(4):347-357. DOI: 10.1056/NEJMoa1812389. Epub 2018 Nov 10. PMID: 30415602.
- Hwang, IC., Cho, GY., Yoon, Y.E. et al.Different effects of SGLT2 inhibitors according to the presence and types of heart failure in type 2 diabetic patients. Cardiovasc Diabetol 19, 69 (2020). https://doi.org/10.1186/s12933-020-01042-3.







