ĐẠI CƯƠNG
Albumin niệu là một yếu tố nguy cơ tim mạch và thận ở các bệnh nhân đái tháo đường, tăng huyết áp, và dân số chung. Nguy cơ này sẽ gia tăng liên tục cùng với sự gia tăng nồng độ albumin niệu, bắt đầu từ mức albumin niệu vi lượng. Mối liên quan này vẫn tồn tại sau khi đã hiệu chỉnh nhiều yếu tố gây nhiễu khác.
ThS.BS TRẦN CÔNG DUY
Khoa Nội Tim Mạch, Bệnh Viện Trưng Vương
Bộ môn Nội tổng quát, Đại học Y Dược TP. Hồ Chí Minh
Các nghiên cứu cũng cho thấy giảm albumin niệu sẽ dẫn đến cải thiện các kết cục tim mạch và thận [1-3]. Do đó, chúng ta cần hiểu rõ dấu ấn nguy cơ quan trọng này để có chiến lược tầm soát, phân tầng nguy cơ và điều trị thích hợp. Bài báo này sẽ tập trung đề cập đến mối liên quan giữa albumin niệu vi lượng và các biến cố tim mạch cũng như vai trò của các thuốc ức chế men chuyển và ức chế thụ thể angiotensin II trong việc giảm albumin niệu vi lượng giúp cải thiện các kết cục tim mạch.
TỈ LỆ HIỆN MẮC CỦA ALBUMIN NIỆU VI LƯỢNG
Các nghiên cứu dịch tễ ở Hoa Kỳ như khảo sát NHANES III báo cáo tỉ lệ albumin niệu vi lượng chiếm 28,8% ở bệnh nhân đái tháo đường; 16,0% ở bệnh nhân tăng huyết áp và 5,1% ở nhóm dân số không có yếu tố nguy cơ [4]. Ở châu Á, nghiên cứu The Microalbuminuria Prevalence Study tầm soát 5.549 bệnh nhân trưởng thành mắc tăng huyết áp và đái tháo đường típ 2 mà không có tiền sử albumin niệu đại lượng và phát hiện 40% bệnh nhân có albumin niệu vi lượng [5]. Tượng tự, một nghiên cứu cắt ngang The Developing Education on Microalbuminuria for Awareness of Renal and Cardiovascular Risk in Diabetes Study ở 24.151 bệnh nhân thuộc 33 quốc gia cho thấy tỉ lệ hiện mắc toàn cầu của albumin niệu vi lượng là 39% [6]. Rõ ràng đây là một tỉ lệ hiện mắc cao của albumin niệu vi lượng.
ĐỊNH NGHĨA VÀ CÁC PHƯƠNG PHÁP XÉT NGHIỆM ALBUMIN NIỆU VI LƯỢNG
Albumin niệu vi lượng là tình trạng nồng độ albumin niệu từ 30 đến 300 mg trong mẫu nước tiểu 24 giờ, trong khi albumin niệu đại lượng là sự bài xuất albumin niệu ≥ 300 mg/24 giờ (Bảng 1) [7].
Xét nghiệm albumin niệu vi lượng có thể được thực hiện bằng nhiều phương pháp: (1) xét nghiệm tỉ số albumin-creatinine trong mẫu nước tiểu bất kỳ hoặc hoặc đầu tiên vào buổi sáng, (2) mẫu nước tiểu 24 giờ với xét nghiệm creatinine để kiểm tra độ chính xác của mẫu nước tiểu, và (3) mẫu nước tiểu theo thời gian (4 giờ hoặc qua đêm). Theo hướng dẫn của K-DOQI (The Kidney Disease Outcomes Quality Initiative), trong hầu hết tình huống, xét nghiệm tỉ số albumin-creatinine trong mẫu nước tiểu đầu tiên buổi sáng là đầy đủ và không cần thu thập nước tiểu theo thời gian [8]. Xét nghiệm albumin niệu trong mẫu nước tiểu bất kỳ chỉ bằng que nhúng chuyên biệt cho albumin mà không đo lường creatinine niệu sẽ dễ bị âm giả và dương giả do sự biến thiên nồng độ gây ra bời thể tích nước tiểu. Phụ nữ bài tiết creatinine ít hơn nam nên có thể định nghĩa albumin niệu vi lượng dựa vào tỉ số albumin-creatinine niệu sẽ khác nhau giữa nam và nữ.
Bảng 1. Định nghĩa và phương pháp xét nghiệm albumin niệu
|
|
Phương pháp xét nghiệm nước tiểu |
||||
|
Định nghĩa |
Que nhúng |
Protein 24 giờ (mg) |
Albumin 24 giờ (mg) |
Mẫu theo thời gian (ug/ph) |
Mẫu bất kỳ (ug albumin/mg creatinine) |
|
Bình thường |
– |
< 150 |
< 30 |
< 20 |
< 30 |
|
Albumin niệu vi lượng |
– |
< 500 |
30 – 300 |
20 – 200 |
30 – 300 |
|
Albumin niệu đại lượng |
+ |
≥ 500 |
> 300 |
> 200 |
> 300 |
CƠ CHẾ BỆNH SINH CỦA ALBUMIN NIỆU VI LƯỢNG
Albumin niệu là dấu ấn nguy cơ độc lập của cả bệnh tim mạch và bệnh thận. Mặc dù cơ chế bệnh sinh của albumin niệu vẫn còn chưa rõ nhưng một số giả thuyết được đặt ra. Albumin niệu được cho là phản ánh rối loạn chức năng nội mô mà tình trạng đó biểu hiện ở thận dưới dạngalbumin niệu và biểu hiện ở mạch máu dưới dạng xơ vữa động mạch. Ritz cho rằng tăng nguy cơ tim mạch với abumin niệu vi lượng có thể do rối loạn chức năng nội mô tác động qua nhiều cơ chế khác nhau, bao gồm tăng nồng độ các dấu ấn viêm (protein phản ứng C, fibrinogen, interleukin 6 và phân tử kết dính liênbào) cũng như tăng các chỉ điểm của tình trạng tiền đông (yếu tố VIII, D-dimer) [9].
Một giả thuyết khác là abumin niệu gây ra tình trạng viêm. Russo và cộng sự (cs) chỉ ra rằng tăng các yếu tố tăng trưởng và cytokine chuyên biệt có thể đóng vai trò trong tổn thương mô và xơ hóa hệ mạch máu của thận bởi vì nồng độ yếu tố tăng trưởng chuyển dạng β tương quan với tăng nồng độ abumin niệu [10]. Họ cho rằng yếu tố tăng trưởng chuyển dạng β có thể ảnh hưởng sự thu nhận albumin và sự phá vỡ albumin lọc qua ống thận gần tại lysosome trước khi bài tiết. Ở các bệnh nhân bệnh tim mạch và bệnh thận do đái tháo đường, abumin niệu có thể phản ánh sự thay đổi của con đường thoái giáng albumin lọc ngoài tác dụng nguyên phát của tính thấm cầu thận.
Một khả năng khác là sự thay đổi tính thấm và lực tĩnh điện của cầu thận gây ra albumin niệu [11]. Các bệnh nhân đái tháo đường và tiểu đạm có các lỗ lớn ở màng đáy cầu thận cho phép các protein huyết tương lớn đi qua không giới hạn. Màng đáy cầu thận cũng mất lực tĩnh điện âm do giảm heparan sulfate proteoglycans tạimàng đáy cầu thận ở các bệnh nhân bệnh thận do đái tháo đường tiến triển. Có mối tương quan nghịch giữa duy trì heparan sulfate ở màng đáy cầu thận và protein niệu.
Albumin niệu cũng phản ánh bất thường của hệ renin – angiotensin – aldosterone(RAA). Giả thuyết Steno cho rằng albumin niệu vi lượng là dấu ấn của rối loạn chức năng nội mô và hoạt hóa hệ RAA thông qua tác dụng của angiotensin II lên thụ thể angiotensin II típ 1 có vai trò chính trong sự phát triển của rối loạn chức năng nội mô và xơ vữa động mạch [12]. Sự kích thích thụ thể angiotensin II típ 1 hoạt hóa nhiều con đường có thể dẫn đến tổn thương nội mô bao gồm tổng hợp và phóng thích cytokine viêm interleukin 6, tăng sản xuất nhóm oxygen phản ứng, tăng các thụ thể của lipoprotein tỉ trọng thấp oxy hóa, và tăng các phân tử kết dính như phân tử kết dính liên bào 1. Như vậy hoạt hóa hệ RAA có thể dẫn đến rối loạn chức năng nội mô, làm tiểu albumin ở thận và xơ vữa động mạch ở hệ mạch máu.
Bệnh nhân đái tháo đường có bất thường trong hệ RAA. Miller nghiên cứu 10 bệnh nhân đái tháo đường típ 1,không có chứng cứ của albumin niệu vi lượng và độ thanh lọc creatinine bình thường [13]. Khi các bệnh nhân này tăng đường huyết, tính đề kháng mạch máu thận và phân suất lọc tăng. Điều trị bằng ức chế thụ thể angiotensin losartan hủy bỏ tác dụng này của tăng đường huyết. Một nghiên cứu về sự đề kháng mạch máu trong thận ở 40 bệnh nhân đái tháo đường típ 2 và 15 người khỏe mạnh ghép cặp theo tuổi và giới được thực hiện bằng siêu âm Doppler duplex[14]. Ức chế hoạt hóa hệ RAA bằng ức chế men chuyển captoril làm giảm tính đề kháng mạch máu trong thận ở các bệnh nhân đái tháo đường nhưng không giảm ở người chứng khỏe mạnh.
Chứng cứ khác về hệ RAA quan trọng trong bệnh sinh của albumin niệu là các nghiên cứu vềức chế hệ RAA làm giảm albumin niệu. Một nghiên cứu 9 bệnh nhân đái tháo đường típ 1 cho thấy điều trị bằng losartan giảm phân suất lọc cầu thận và các thay đổi này song song với thay đổi trong bài xuất albumin niệu [15]. Nghiên cứu MARVAL (the Microalbuminuria Reduction with Valsartan Study) tiến hành ở 332 bệnh nhân đái tháo đường típ 2 và albumin niệu vi lượng, có hoặc không có tăng huyết áp[16]. Bệnh nhân được phân ngẫu nhiên vào nhóm điều trị ức chế thụ thể angiotensin II losartan (80 mg/ngày) hoặc ức chế canxi amlodipin (5 mg/ngày) trong 6 tháng. Mục tiêu huyết áp (135/85 mmHg) đạt được bằng cách thêm bendrofluazide và doxazosin. Valsartan làm giảm tốc độ bài xuất albumin niệu 44%, trong khi amlodipine làm giảm tốc độ bài xuất albumin niệu chỉ khoảng 8% mặc dù không có sự khác biệt ý nghĩa về trị số huyết áp giữa hai nhóm. Nghiên cứu IRMA-2 (the Irbesartan in Patients With Type 2 Diabetes and Microalbuminuria Study) đánh giá tác dụng của ức chế thụ thể angiotensin II irbersatan (150 và 300 mg/ngày) lên tiến triển của albumin niệu ở 590 bệnh nhân tăng huyết áp có đái tháo đường típ 2 và albumin niệu vi lượng[17]. Trong nghiên cứu IRMA-2, irbesartan làm giảm tốc độ bài xuất albumin niệu và làm chậm khởi phát tiểu đạm lâm sàng và bệnh thận tiến triển, tác dụng này độc lập với kiểm soát huyết áp.
Mặc dù nhiều nghiên cứu được trích dẫn trong bài báo này minh họa rõ ràng albumin niệu vi lượng có liên quan với kết cục thận và tim mạch nhưng cần thêm nhiều nghiên cứu nữa để hiểu rõ hơn về quá trình sinh lý bệnh của albumin niệu.
MỐI LIÊN QUAN GIỮA ALBUMIN NIỆU VI LƯỢNG VÀ CÁC BIẾN CỐ TIM MẠCH
1. Nghiên cứu trong dân số chung
Albumin niệu có liên quan với các biến cố tim mạch trong nhiều nghiên cứu và phân tích cơ sở dữ liệu lớn (Bảng 2). Damsgaard và cs[19] nghiên cứu 216 bệnh nhân lớn tuổi không mắc đái tháo đường và phát hiện mối liên quan giữa albumin niệu và tử vong, trong đó chủ yếu là do nguyên nhân tim mạch. Yudkin và cs[20] nghiên cứu 187 bệnh nhân hơn 40 tuổi tham gia một dự án tầm soát đái tháo đường và phát hiện albumin niệu có liên quan với bệnh mạch vành (tỉ số số chênh (TSSC) 6,38; khoảng tin cậy (KTC) 95% 1,91 – 21,4) và tử vong (TSSC 24,33; KTC 95% 5,40 – 109,7). Culleton và cs [21] xét nghiệm protein niệu bằng que nhúng ở 2.586 người tham gia nghiên cứu Framingham và theo dõi họ trong 17 năm. Các tác giả phát hiện rằng ở phụ nữ, protein niệu vết có liên quan với tử vong do nguyên nhân tim mạch (tỉ số nguy cơ (TSNC) 1,6; KTC 95% 1,1 – 2,4). Miettinen và cs[22] nghiên cứu các đối tượng đái tháo đường và không đái tháo đường ở Phần Lan và xét nghiệm nồng độ protein niệu trong 7 năm. Họ phát hiện rằng tử vong do nguyên nhân tim mạch ở các đối tượng tiểu protein thuộc nhóm đái tháo đường lẫn nhóm không đái tháo đường nhiều hơn các đối tượng không tiểu protein.
Trong nghiên cứu PREVEND (the Prevention of Renal and Vascular End-Stage Disease Study) với 40.856 người, albumin niệu vi lượng hiện diện ở 7% đối tượng và có liên quan độc lập với tiền sử nhồi máu cơ tim và đột quỵ [23]. Nghiên cứu này phát hiện rằng albumin niệu vi lượng là yếu tố tiên lượng tử vong do mọi nguyên nhân trong dân số chung. Nguy cơ này chủ yếu gồm tử vong do nguyên nhân tim mạch và độc lập với tác dụng của các yếu tố nguy cơ tim mạch khác. Dữ liệu từ nghiên cứu Framingham cho thấy ở 1.568 người tham gia không tăng huyết áp và không đái tháo đường, albumin niệu dưới ngưỡng albumin niệu vi lượng tiên đoán sự phát triển của bệnh tim mạch [24]. Các nhà nghiên cứu Framingham cũng có thể chỉ ra nồng độ albumin niệu dự đoán sự tiến triển huyết áp ở những cá nhân không tăng huyết áp và không đái tháo đường và có thể là dấu ấn sinh học hữu ích để xác định những người có khả năng nhiều nhất xuất hiện tăng huyết áp.
Klausen và cs[25] thực hiện một nghiên cứu dưới nhóm của Third Copenhagen city Heart Study bao gồm 2.762 người tham gia không có tiền sử bệnh mạch vành. Các tác giả phát hiện albumin niệu vi lượng là yếu tố quyết định mạnh và độc lập của bệnh mạch vành và tử vong.
Nghiên cứu EPIC-Norfolk (the European Prospective Investigation into Cancer in Norfolk Study), một nghiên cứu đoàn hệ tiến cứu ở 20.911 người, phát hiện tử vong do mọi nguyên nhân và do nguyên nhân tim mạch gia tăng cùngvới tăng nồng độ albumin niệu vi lượng [26]. Tỉ số nguy cơ đa biến đối với tử vong tim mạch là 2,03 (KTC 95% 1,55 – 2,67).
Tóm lại trong dân số chung, albumin niệu vi lượng có mối liên quan mạnh và lặp lại với sự gia tăng nguy cơ các biến cố tim mạch.
Bảng2. Các nghiên cứu về tác dụng của điều trị giảm albumin niệu vi lượng lên các biến cố tim mạch dài hạn
|
Thử nghiệm |
Số bệnh nhân |
Đối tượng nghiên cứu |
Thời gian theo dõi trung bình (năm) |
Kết cục tim mạch |
Tỉ số nguy cơ của albumin niệu vi lượng (KTC 95%) |
|
DIABHYCAR[27] |
4.912 |
Đái tháo đường típ 2 |
5 |
Suy tim mạn hoặc bệnh mạch vành tử vong hoặc không tử vong |
2,3 (1,71 – 3,09) |
|
EPIC-Norfolk[26] |
23.630 |
Dân số chung |
7,2 |
Tử vong do nguyên nhân tim mạch Đột quỵ |
1,23 ( 1,16 – 1,31)
1,49 (1,13 – 2,14) |
|
FHS[21] |
2.586 |
Dân số chung |
17 |
Tử vong do nguyên nhân tim mạch |
1,4 (1,0 – 2,0) |
|
HOPE [28], [29] |
9.043 |
Tiền sử bệnh tim mạch hoặc đái tháo đường cộng ít nhất 1 yếu tố nguy cơ tim mạch khác |
4,5 |
Nhồi máu cơ tim, đột quỵ, đau thắt ngực hoặc tử vong do nguyên nhân tim mạch Suy tim mạn hoặc bệnh mạch vành tử vong hoặc không tử vong |
1,83 (1,64 – 2,05)
3,23 ( 2,54 – 4,10) |
|
IDNT[30] |
1.715 |
Đái tháo đường với bệnh thận hoặc tăng huyết áp |
3 |
Tử vong do tim mạch, nhồi máu cơ tim không tử vong, đột quỵ, nhập viện do suy tim, đoạn chi, tái thông động mạch vành hoặc động mạch ngoại biên |
1,29 (1,13 – 1,48) |
|
LIFE[31] |
960 8.206 |
Tăng huyết áp |
5 |
Nhồi máu cơ tim, đột quỵ, đau thắt ngực hoặc tử vong do nguyên nhân tim mạch |
1,35 (1,05 – 1,74) 2,3 |
|
Miettinen và cs[22] |
2.431 |
Có hoặc không có đái tháo đường típ 2 |
7 |
Đột quỵ |
2,81 (1,73 – 4,58) |
|
MONICA[32] |
204 |
Tăng huyết áp |
1.978 người-năm |
Nhồi máu cơ tim, đột quỵ, đau thắt ngực hoặc tử vong do nguyên nhân tim mạch |
3,5 (1,0 – 12,1) |
|
Nakamura và cs[33] |
599 |
Tăng huyết áp |
8 |
Nhồi máu cơ tim, đột quỵ, đau thắt ngực hoặc tử vong do nguyên nhân tim mạch |
1,10 (1,00 – 1,20) |
|
PREVEND[34] |
6.669 |
Dân số chung |
4 |
Suy tim mạn hoặc bệnh mạch vành tử vong hoặc không tử vong |
1,6 (1,17 – 2,18) |
|
Rachmani và cs[35] |
599 |
Đái tháo đường típ 2 |
8 |
Nhồi máu cơ tim, đột quỵ, đau thắt ngực hoặc tử vong do nguyên nhân tim mạch |
9,8 (6,7 – 12,3) |
2. Nghiên cứu ở bệnh nhân đái tháo đường
Nghiên cứu HOPE (the Heart Outcomes Prevention Evaluation Study), một thử nghiệm ngẫu nhiên khảo sát ảnh hưởng của ramipril và vitamin E trên 9.541 bệnh nhân (≥ 55 tuổi) với tiền sử bệnh tim mạch hoặc đái tháo đường và ít nhất 1 yếu tố nguy cơ tim mạch, kết luận albumin niệu vi lượng làm tăng nguy cơ biến cố mạch máu lớn (tỉ số nguy cơ 1,83; KTC 95% 1,64 – 2,05)[28]. Đối với tăng mỗi 0,4 mg/mmol tỉ số albumin-creatinine niệu, nguy cơ hiệu chỉnh của biến cố mạch máu lớn tăng 6% (KTC 95% 4,9 – 7,0).
Nghiên cứu IDNT cho thấy albumin niệu là yếu tố nguy cơ độc lập của các biến cố tim mạch (kết cục tổ hợp bao gồm tử vong do nguyên nhân tim mạch, nhồi máu cơ tim không tử vong, nhập viện vì suy tim, đột quỵ, đoạn chi, và tái thông động mạch vành và động mạch ngoai biên)[30]. Đối với tăng mỗi 1 đơn vị trong logarit tự nhiên của tỉ số albumin – creatinine niệu, tỉ số nguy cơ hiệu chỉnh là 1,29 đối với biến cố tim mạch (KTC 95% 1,13 – 1,48; p = 0,0002).
Nghiên cứu RENAAL phát hiện rằng các bệnh nhân với albumin niệu ban đầu (albumin ≥ 3 g/g creatinine) tăng nguy cơ các kết cục tim mạch (TSNC 1,92; KTC 95% 1,54 – 2,38) và suy tim (TSNC 2,7; KTC 95% 1,94 – 3,75) so với albumin niệu thấp (albumin < 1,5 g/g creatinine)[36]. Nguy cơ biến cố tim mạch và suy tim lần lượt giảm 18% và 27% đối với giảm mỗi 50% albumin niệu.
3. Nghiên cứu ở bệnh nhân tăng huyết áp
Nghiên cứu LIFE (the Losartan Intervention For Endpoint Reduction in Hypertension Study) cho thấy ở bệnh nhân tăng huyết áp có phì đại thất trái và không có đái tháo đường, nguy cơ kết cục tổ hợp tim mạch (tử vong do nguyên nhân tim mạch, đột quỵ tử vong hoặc không tử vong, nhồi máu cơ tim tử vong hoặc không tử vong) tăng liên tục khi albumin niệu tăng (p< 0,001)[31].
Albumin niệu vi lượng được giả thuyết là yếu tố nguy cơ tim mạch quan trọng như các yếu tố nguy cơ truyền thống như nồng độ cholesterol. Jensen và cstiến hành nghiên cứu tiến cứu ở 204 bệnh nhân tăng huyết áp không có bệnh tim thiếu máu cục bộ hoặc đái tháo đường lúc ban đầu [32]. Họ theo dõi các đối tượng này trong 20 năm và phát hiện albumin niệu vi lượng ban đầu có tỉ số nguy cơ 4,2 (KTC 95% 1,5 – 11,9; p = 0,006) đối với biến cố bệnh tim thiếu máu cục bộ. Khi hiệu chỉnh tuổi, giới tính, huyết áp, nồng độ lipoprotein, chỉ số khối cơ thể và hút thuốc lá, tỉ số nguy cơ là 3,5 (KTC 95% 1,0 – 12,1; p = 0,05).
4. Nghiên cứu ở bệnh nhân sau nhồi máu cơ tim
Một phân tích dưới nhóm ở 583 bệnh nhân sau nhồi máu cơ tim với rối loạn chức năng thất trái trong thử nghiệm SAVE (the Survival and Ventricular Enlargement trial) cho thấy tiểu protein (được đánh giá bằng que nhúng phân tích nước tiểu lúc ban đầu) hiện diện ở 20,9% bệnh nhân [37]. Các bệnh nhân tiểu protein lớn tuổi hơn, tăng huyết áp nhiều hơn, có phân suất tống máu giảm và độ lọc cầu thận giảm nhiều hơn so với bệnh nhân không tiểu protein. Trong phân tích đa biến, các bệnh nhân tiểu protein tăng nguy cơ tử vong toàn bộ (TSNC 1,73; KTC 95% 1,15 – 2,59) và tử vong do nguyên nhân tim mạch (TSNC 1,81; KTC 95% 1,16 – 2,81). Lợi ích tuyệt đối của điều trị bằng ức chế men chuyển captoril trong nghiên cứu SAVE lớn hơn ở các bệnh nhân có protein niệu so với bệnh nhân không có protein niệu (p= 0,02). Các nhà nghiên cứu kết luận rằng protein niệu có thể xác định một nhóm bệnh nhân có lợi ích nhiều hơn từ điều trị ức chế men chuyển sau nhồi máu cơ tim
VAI TRÒ CỦA THUỐC ỨC CHẾ MEN CHUYỂN VÀ ỨC CHẾ THỤ THỂ ANGIOTENSIN II TRONG GIẢM ALBUMIN NIỆU VI LƯỢNG VÀ CÁC BIẾN CỐ TIM MẠCH
Hiệu lực giảm albumin niệu vi lượng của các thuốc ức chế hệ RAA đã được chứng minh qua nhiều thử nghiệm lâm sàng lớn. Các nghiên cứu EUCLID (EURODIAB Controlled trial of Linsinopril in Insulin dependent Diabetes) trên bệnh nhân đái tháo đườngtíp 1 [38] và BRILLIANT (Blood pressure, Renal effects, Insulin control, Lipids, Lisinopril And Nifedipine Trial) trên bệnh nhân đái tháo đườngtíp 2 [39] cho thấy thuốc ức chế men chuyển có tác dụng giảm mức bài xuất albumin trong nước tiểu.Tương tự, các nghiên cứu IRMA 2 (Irbesartan in patients with type 2 diabetes and Microalbuminuria study) [17], INNOVATION (Incipient to Overt: Angiotensin II Blocker, Telmisartan, Investigation on Type 2 Diabetic Nephropathy) [40] và MARVAL (MicroAlbuminuria Reduction with VALsartan) chứng tỏ thuốc ức chế thụ thể angiotensin II cũng có tác dụng giảm mức bài xuất albumin trong nước tiểu và ngăn tiến triển đến albumin niệu đại lượng[16].
Nghiên cứu EUCLID là một thử nghiệm ngẫu nhiên, mù đôi, có đối chứng lisinopril với giả dược, tiến hành ở 530 nam và nữ đái tháo đường típ 1 từ 20 đến 59 tuổi có albumin niệu bình thường hoặc vi lượng[38]. Các bệnh nhân được tuyển chọn từ 18 trung tâm ở châu Âu và không đang điều trị thuốc hạáp. Huyết áp tâm trương lúc nhận vào ít nhất 75 và không hơn 90 mmHg, và huyết áp tâm thu không hơn 155 mmHg. Tốc độ bài xuất albumin niệu được đánh giá bằng phương pháp lấy hai mẫu nước tiểu qua đêm tại thời điểm ban đầu, 6, 12, 18 và 24 tháng. Tỉ lệ albumin niệu vi lượng ban đầu ở nhóm giả dược và lisinopril lần lượt là 13% và 17%. Phân tích theo ý định điều trị tại thời điểm 2 năm cho thấy tốc độ bài xuất albumin niệu ở nhóm lisinopril thấp hơn nhóm giả dược 2,2 ug/ph; sự khác biệt phần trăm 18,8% (KTC 95% 2,0 – 32,7; p = 0,03). Ở nhóm bệnh nhân có albumin niệu vi lượng, sự khác biệt điều trị là 34,2 ug/ph (49,7% [-14,5 – 77,9], p=0,1; tương tác p = 0,04)(Hình 1). Đối với các bệnh nhân hoàn thành đủ 24 tháng thử nghiệm, sự khác biệt điều trị cuối cùng về tốc độ bài xuất albumin niệu là 38,5 ug/ph ở nhóm có albumin niệu vi lượng ban đầu (p = 0,001). Như vậy, nghiên cứu EUCLID cho thấy lisinopril làm giảm có ý nghĩa albumin niệu vi lượng ở bệnh nhân đái tháo đường típ 1.
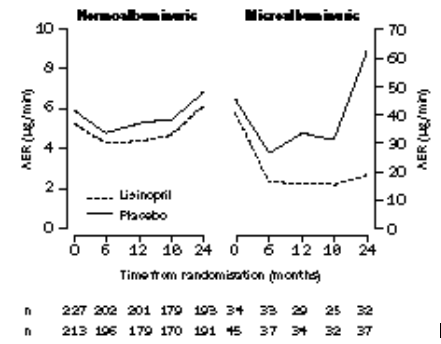
Hình 1.Tốc độ bài xuất albumin niệu theo thời gian trong nghiên cứu EUCLID(Chụp từ tài liệu gốc)
Agardh CD và cs thực hiện nghiên cứu BRILLIANT, một thử nghiệm mù đôi, ngẫu nhiên, nhóm song song, đa trung tâm, đa quốc gia so sánh tác dụng của điều trị 12 tháng với lisinopril (10 – 20 mg 1 lần/ngày) hoặc nifedipine retard (20 – 40 mg 2 lần/ngày) ở 239 nam (18 – 75 tuổi) và 96 nữ sau mãn kinh (40 – 75 tuổi)[39]. Tất cả bệnh nhân có tiền sử đái tháo đường típ 2 ổn định lâm sàng hơn 3 tháng, albumin niệu vi lượng và bệnh thận do đái tháo đường sớm (albumin niệu 20 – 300 ug/ph) và huyết áp tâm trương lúc ngồi 90 – 100 mmHg. Sau 12 tháng, tốc độ bài xuất albumin niệu trung vị ở nhóm lisinopril giảm từ 65,5 (20 – 297) ug/ph lúc đầu xuống 39,0 (2 – 510) ug/ph. Ở nhóm nifedipine, albumin niệu trung vị giảm từ 63,0 (20 – 289) ug/ph lúc đầu xuống 58,0 (9 – 1192) ug/ph sau 12 tháng. Sự khác biệt trung vị ước đoán giữa 2 nhóm điều trị là 20 ug/ph (p = 0,0006) (Hình 2). Nghiên cứu này kết luận lisinopril có lợi ích rõ ràng trong giảm albumin niệu vi lượng hơn nifedipine mặc dù tác dụng tương tự nhau trên kiểm soát huyết áp và đường huyết ở bệnh nhân đái tháo đường típ 2 cótăng huyết áp.
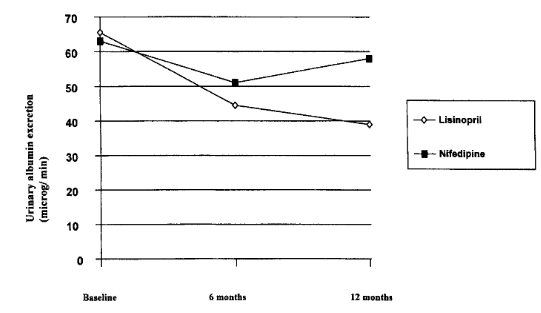
Hình2.Albumin niệu ở nhóm lisinopril và nifedipine lúc ban đầu, 6 tháng và 12 tháng của nghiên cứu BRILLIANT. Tại thời điểm 12 tháng, sự khác biệt điều trị là 20 ug/ph, lợi ích thiên về lisinopril (p = 0,0006).(Chụp từ tài liệu gốc)
Các thuốc ức chế men chuyển và ức chế thụ thể Angiotensin II có tác dụng làm giảm albumin niệu vi lượng, dẫn đến cải thiện các kết cục tim mạch. Lợi ích đó đã được chứng minh qua nhiều thử nghiệm lâm sàng. Nghiên cứu HOPE phát hiện tỉ lệ suy tim tăng có ý nghĩa với albumin niệu vi lượng (TSNC 1,82; KTC 95% 1,58 – 2.10) [1]. Thuốc ức chế men chuyển ramipril làm giảm có ý nghĩa albumin niệu vi lượng và nguy cơ suy tim.
Chứng cứ đáng tin cậy hơn về lợi ích trên kết cục tim mạch của giảm albumin niệu vi lượng cũng được cung cấp bởi nghiên cứu LIFE [2]. Thử nghiệm này bao gồm 8.206 nam và nữ tăng huyết áp có phì đại thất trái được phân nhóm ngẫu nhiên điều trị atenolol hoặc losartan. Các bệnh nhân với tỉ số albumin/creatinine niệu lớn hơn trị số trung vị ban đầu (1,21 mg/mmol) và có thể giảm dưới trị số trung vị vào thời điểm 1 năm (0,67 mg/mmol) sẽ giảm nguy cơ tử vong do nguyên nhân tim mạch, đột quỵ và nhồi máu cơ tim so với các bệnh nhân không thể giảm tỉ số albumin/creatinine niệu (p< 0,001). Tác dụng này độc lập với mức độ huyết áp được điều trị.
Nghiên cứu PREVEND IT (the Prevention of Renal and Vascular Endstage Disease Intervention Trial) cho thấy điều trị với ức chế men chuyển fosinopril dẫn đến giảm có ý nghĩa albumin niệu và xu hướng giảm các biến cố tim mạch ở bệnh nhân albumin niệu vi lượng [3]. PREVEND IT là một nghiên cứu dưới nhóm của chương trình PREVEND. Mục tiêu của chương trình PREVEND là đánh giá giá trị của albumin niệu vi lượng với vai trò chất chỉ điểm của tăng nguy cơ tim mạch và thận trong dân số chung. Từ năm 1997 đến 1998, tất cả cư dân của thành phố Groningen, Hà Lan, tuổi từ 28 đến 75 (n = 85.421) được yêu cầu gửi một mẫu nước tiểu buổi sáng và điền vào một bản câu hỏi ngắn về đặc điểm dân số và tiền sử tim mạch. 8.592 người hoàn thành chương trình tầm soát. Tiêu chuẩn nhận vào của nghiên cứu PREVEND IT là albumin niệu vi lượng kéo dài (nồng độ albumin niệu > 10 mg/L trong một mẫu nước tiểu buổi sáng và 15 – 300 mg/24 giờ trong 2 mẫu nước tiểu 24 giờ), huyết áp < 160/100 mmHg và không sử dụng thuốc hạ áp, nồng độ cholesterol toàn phần < 8,0 mmol/L hoặc < 5,0 mmol/L trong trường hợp tiền sử nhồi máu cơ tim và không sử dụng thuốc hạ lipid. Tiêu chuẩn loại trừ bao gồm độ thanh lọc creatinine > 60% trị số bình thường theo tuổi và sử dụng thuốc ức chế men chuyển hoặc ức chế thụ thể angiotensin II. Tổng cộng 1.439 người thỏa tiêu chuẩn nhận vào. Nghiên cứu PREVEND IT là một thử nghiệm đơn trung tâm, mù đôi, ngẫu nhiên, có đối chứng giả dược, thiết kế giai thừa 2 x 2.864 đối tượng tham gia được phân ngẫu nhiên vào nhóm fosinipril 20 mg hoặc giả dược, pravastatin 40 mg hoặc giả dược. Kết cục chính là tỉ lệ tổ hợp của tử vong do nguyên nhân tim mạch và nhập viện do bệnh tim mạch (nhồi máu cơ tim hoặc thiếu máu cục bộ cơ tim không tử vong, suy tim, bệnh động mạch ngoại biên và/hoặc tai biến mạch máu não). Tuổi trung bình là 51 ± 12; 65% đối tượng là nam, và 3,4% có tiền sử biến cố tim mạch. Nồng độ cholesterol trung bình là 5,8 ± 1,0 mmol/L, huyết áp tâm thu/tâm trương trung bình là 130 ± 18 / 76 ± 10 mmHg, và tốc độ bài xuất albumin niệu trung vị là 22,8 (15,8 – 41,3) mg/24 giờ. Fosinopril làm giảm 26% nồng độ albumin niệu (p < 0,001). Trong thời gian theo dõi trung bình 46 ± 7 tháng, kết cục chính xảy ra ở 45 người (5,2 %). Các đối tượng được điều trị bằng fosinopril có tỉ lệ mới mắc kết cục chính thấp hơn nhóm giả dược 40% (3,9% so với 6,5%) (TSNC 0,06 [KTC 95% 0,33 – 1,10], p = 0,098, log-rank) (Hình 3). Như vậy, ở những bệnh nhân có albumin niệu vi lượng, fosinopil làm giảm có ý nghĩa albumin niệu và có xu hướng làm giảm các biến cố tim mạch. Điều ấn tượng là tai biến mạch máu não giảm 90% ở nhóm fosinopril (nguy cơ tương đối 0,1 [KTC 95% 0,01 – 0,78], p = 0,03). Tỉ lệ tử vong không do nguyên nhân tim mạch là 1,9% ở nhóm fosinopril so với 2,1% ở nhóm giả dược. Khi phân tích hồi quy Cox hậu kiểm, tác dụng của lisinopril không thay đổi đáng kể sau khi hiệu chỉnh huyết áp tâm thu và tâm trương và nồng độ cholesterol toàn phần. Các đối tượng với nồng độ albumin niệu ở khoảng tứ phân vị cao nhất và nhận giả dược có nguy cơ biến cố tim mạch gia tăng (p = 0,008). Ở những người có nồng độ albumin niệu dưới 50 mg/24 giờ, fosinopril giảm nguy cơ biến cố từ 5,1% xuống 3,6% với nguy cơ tương đối giảm 29%; trong khi ở những đối tượng có nồng độ albumin niệu cao, fosinopril giảm tỉ lệ biến cố từ 13,0% xuống 5,2% với nguy cơ tương đối giảm 60%. Những người với tốc độ bài xuất albumin niệu ở khoảng tứ phân vị cao nhất được điều trị fosinopril có tỉ lệ sống còn không biến cố tương đương với những người có tốc độ bài xuất albumin niệu ở khoảng tứ phân vị thấp nhất (Hình 4).
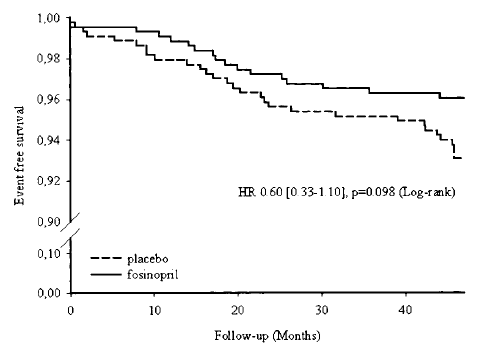
Hình 3.Đường cong Kaplan-Meier ước đoán tỉ lệ mới mắc các biến cố tim mạch ở nhóm fosinopril và nhóm giả dược trong nghiên cứu PREVEND IT. (Chụp từ tài liệu gốc)
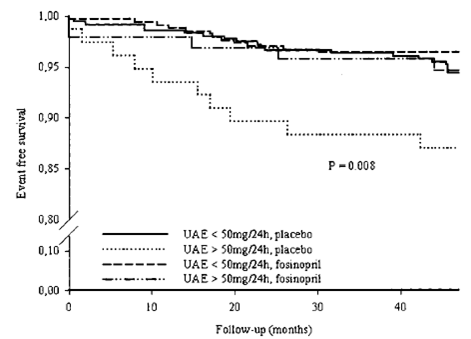
Hình 4.Đường cong Kaplan-Meier ước đoán tỉ lệ mới mắc các biến cố tim mạch ở nhóm fosinopril và nhóm giả dược theo tốc độ bài xuất albumin niệu lớn hơn hoặc nhỏ hơn 50 mg/24 giờ trong nghiên cứu PREVEND IT. (Chụp từ tài liệu gốc)
Mặc dù cần có thêm các thử nghiệm lâm sàng trong đó albumin niệu đại diện cho mục tiêu điều trị nhưng các phát hiện qua một số thử nghiệm trên cũng chỉ ra rằng giảm albumin niệu vi lượng do điều trị bằng các thuốc ức chế men chuyển hoặc ức chế thụ thể angiotensin II có thể làm giảm nguy cơ tim mạch. Có các chứng cớ rõ ràng về mối liên quan giữa albumin niệu vi lượng và các kết cục tim mạch cũng như giảm albumin niệu vi lượng dẫn đến giảm các nguy cơ tim mạch. Vì vậy, giảm albumin niệu vi lượng là một mục tiêu điều trị quan trọng ở các bệnh nhân tăng huyết áp, đái tháo đường hoặc có tiền sử bệnh tim mạch. Albumin niệu cần được xét nghiệm thường xuyên ở các đối tượng này để phân tầng nguy cơ và xem xét khởi trị bằng ức chế men chuyển hoặc ức chế thụ thể angiotensin II nếu bệnh nhân chưa được điều trị hoặc tăng liều nếu đã được điều trị bằng một trong các thuốc này. Ngoài ra, albumin niệu vi lượng là một yếu tố nguy cơ quan trọng đối với các biến cố tim mạch trong tương lai nên việc đo lường albumin niệu vi lượng nên là một phần của việc đánh giá nguy cơ tim mạch trong dân số chung.
KẾT LUẬN
Albumin niệu vi lượng rõ ràng là một yếu tố tiên lượng mạnh và quan trọng của nguy cơ tim mạch ở các bệnh nhân đái tháo đường, tăng huyết áp, cũng như dân số chung. Các nghiên cứu có những thiết kế và phương pháp xét nghiệm albumin niệu khác nhau nhưng đều đạt đến kết luận tương tựđó. Cơ chế bệnh sinh của albumin niệu chưa được hiểu rõ hoàn toàn nhưng có thể liên quan với rối loạn chức năng nội mô, viêm và/hoặc bất thường của hệ renin – angiotensin – aldosteron. Điều trị giảm albumin niệu vi lượng bằng các thuốc ức chế men chuyển hoặc ức chế thụ thể angiotensin II sẽ không chỉ cải thiện các kết cục thận mà còn giảm các biến cố tim mạch. Do đó, albumin niệu vi lượng cũng là một tiêu điều trị quan trọng. Các bác sĩ cần tầm soát thường quy albumin niệu vi lượng trong thực hành lâm sàng tương tự như thực hiện các biện pháp tầm soát khác nhưđo huyết áp, xét nghiệm bilan lipid máu và đường huyết.
TÀI LIỆU THAM KHẢO
1. Arnold JM, Yusuf S, Young J, et al. Prevention of Heart Failure in Patients in the Heart Outcomes Prevention Evaluation(HOPE)Study.Circulation 2003; 107:1284-1290.
2. Ibsen H, Olsen MH, Wachtell K, et al. Reduction in albuminuria translates to reduction in cardiovascular events in hypertensive patients: Losartan intervention for endpoint reduction in hypertension study. Hypertension 2005; 45:198-202.
3. AsselbergsFW,DiercksGF,HillegeHL,etal. Effects of fosinopril and pravastatin on cardiovascular events in subjects with microalbuminuria. Circulation 2004; 110: 2809- 2816.
1. 4. Jones CA, Francis ME, Eberhardt MS, et al. Microalbuminuria in the US population: Third NationalHealth and Nutrition Examination Survey. Am J Kidney Dis 2002; 39: 445-459.
5. Wu AY, Kong NC, de Leon FA, et al. An alarmingly high prevalence of diabetic nephropathy in Asian type 2 diabetic patients: The MicroAlbuminuria Prevalence(MAP) Study. Diabetologia 2005; 48:17-26.
6. Parving HH, Lewis JB, Wajman A. Prevalence and risk factors for microalbuminuria in type 2 diabeticpatients: Aglobal perspective. Kidney Int 2006 (in press).
7. American Diabetes Association. Standards of Medical Care in Diabetes [published erratum in Diabetes Care 28:990, 2005]. Diabetes Care 2005; 28: S4-S36 (suppl1).
8. National Kidney Foundation: K/DOQI Clinical Practice Guidelines for Chronic Kidney Disease: Evaluation, Classification, and Stratification. Am J Kidney Dis 2002; 39: S1- S266, 2002 (suppl1).
9. Ritz E. Renal dysfunction as a novel risk factor: Microalbuminuriaandcardiovascularrisk.KidneyIntSuppl 2005; 93: S25-S28.
10. Russo LM, Comper WD, Osicka TM. Mechanism of albuminuria associated with cardiovascular disease and kidney disease. Kidney Int Suppl 2004; 92: S67-S68.
11. Myers BD, Winetz JA, Chui F, Michaels AS.Mechanisms of proteinuria in diabetic nephropathy: A study of glomerular barrier function. Kidney Int 1982; 21: 633-641.
12. Deckert T, Feldt-Rasmussen B, Borch-Johnsen K, JensenT,Kofoed-EnevoldsenA.Albuminuriareflectswidespread vascular damage. The Steno hypothesis. Diabetologia 1989; 32: 219-226.
13. Miller JA. Impact of hyperglycemia on the renin angiotensin system in early human type 1 diabetes mellitus. J Am Soc Nephrol 1999; 10:1778-1785.
14. Taniwaki H, Ishimura E, Kawagishi T, et al. Intrarenal hemodynamic changes after captopril test in patients with type 2 diabetes: A duplex Doppler sonography study. Diabetes Care 2003; 26:132-137.
15. Buter H, Navis G, Dullaart RP, de Zeeuw D, de Jong PE. Time course of the antiproteinuric and renal haemodynamic responses to losartan in microalbuminuric IDDM. Nephrol Dial Transplant 2001; 16: 771-775.
16. Viberti G, Wheeldon NM. Microalbuminuria reduction with valsartan in patients with type 2 diabetes mellitus: A blood pressure-independent effect. Circulation 2002; 106: 672- 678.
17. ParvingHH,LehnertH,Brochner-MortensenJ,Gomis R, Andersen S, Arner P. The effect of irbesartan on the development of diabetic nephropathy in patients with type2 diabetes. N Engl J Med 2001; 345: 870-878.
18. Basi S, Lewis JB. Microalbuminuria as a target to improve cardiovascular and renal outcomes. Am J Kidney Dis 2006; 47 (6): 927-946.
19. Damsgaard EM, Froland A, Jorgensen OD, Mo- gensen CE. Microalbuminuria as predictor of increased mortality in elderly people. BMJ 1990; 300: 297-300.
20. Yudkin JS, Forrest RD, Jackson CA. Microalbuminuriaaspredictorofvasculardiseaseinnon-diabeticsubjects. Islington Diabetes Survey. Lancet 1988; 2: 530-533.
21. Culleton BF, Larson MG, Parfrey PS, Kannel WB, Levy D. Proteinuria as a risk factor for cardiovascular disease and mortality in older people: A prospective study. Am J Med 2000; 109: 1-8.
22. Miettinen H, Haffner SM, Lehto S, Ronnemaa T, Pyorala K, Laakso M. Proteinuria predicts stroke and other atherosclerotic vascular disease events in nondiabetic and non-insulin-dependent diabetic subjects. Stroke 1996; 27: 2033- 2039.
23. Verhave JC, Gansevoort SJ, de Zeeuw D, de Jong PE. An elevated urinary albumin excretion predicts de novo development of renal function impairment in the general population. Kidney Int Suppl 2004; 92: S18-S21.
24. Arnlov J, Evans JC, Meigs JB, et al. Low-grade albuminuria and incidence of cardiovascular disease events in nonhypertensive and nondiabetic individuals: The FraminghamHeartStudy.Circulation 2005; 112: 969-975.
25. Klausen K, Borch-Johnsen K, Feldt-Rasmussen B, et al. Very low levels of microalbuminuria are associated with increased risk of coronary heart disease and death independentlyofrenalfunction,hypertension,anddiabetes.Circulation 2004; 110: 32-35.
26. Yuyun MF, Khaw KT, Luben R, et al. Microalbuminuria and stroke in a British population: The European Prospective Investigation into Cancer in Norfolk (EPIC- Norfolk) population study. J Intern Med 2004; 255: 247-256.
27. Vaur L, Gueret P, Lievre M, Chabaud S, Passa P. Development of congestive heart failure in type 2 diabetic patients with microalbuminuria or proteinuria:Observations from the DIABHYCAR (type 2 DIABetes, Hypertension, CArdiovascular Events and Ramipril) Study [erratum in Diabetes Care 26:2489, 2003]. Diabetes Care 2003; 26: 855-860.
28. Gerstein HC, Mann JF, Yi Q, et al. Albuminuria and risk of cardiovascular events, death, and heart failure in diabetic and nondiabetic individuals. JAMA 2001; 286: 421-426.
29. Mann JF, Lonn EM, Yi Q, et al. Effects of vitamin E on cardiovascular outcomes in people with mild-to-moderate renal insufficiency: Results of the HOPE Study. Kidney Int 2004; 65:1375-1380.
30. Anavekar NS, Gans DJ, Berl T, et al. Predictors of cardiovasculareventsinpatientswithtype2diabeticnephropathyandhypertension:Acaseforalbuminuria.Kidney Int Suppl 2004; 92: S50-S55.
31. Wachtell K, Ibsen H, Olsen MH, et al. Albuminuria and cardiovascular risk in hypertensive patients with left ventricular hypertrophy: The LIFE Study. Ann Intern Med 2003; 139:901-906.
32. JensenJS,Feldt-RasmussenB,StrandgaardS,Schroll M, Borch-Johnsen K. Arterial hypertension, microalbuminuria,andriskofischemicheartdisease.Hypertension 2000; 35:898 – 903.
33. Nakamura S, Kawano Y, Inenaga T, et al: Microalbuminuria and cardiovascular events in elderly hypertensive patients without previous cardiovascular complications.Hypertens Res 2003; 26: 603-608.
34. Stuveling EM, Hillege HL, Bakker SJ, et al. C-Reactive protein and microalbuminuria differ in their associationswithvariousdomainsofvasculardisease.Atherosclerosis 2004; 172: 107-114.
35. Rachmani R, Levi Z, Lidar M, Slavachevski I, Half- Onn E, Ravid M. Considerations about the threshold value of microalbuminuria in patients with diabetes mellitus: Lessons from an 8-year follow-up study of 599 patients. Diabetes Res Clin Pract 2000; 49: 187-194.
36. de Zeeuw D, Remuzzi G, Parving HH, et al. Proteinuria, a target for renoprotection in patients with type 2 diabetic nephropathy: Lessons from RENAAL. Kidney Int 2004; 65: 2309-2320.
37. Jose P, Tomson C, Skali H. Influence of proteinuria on outcomes and response to ACE inhibitor therapy after myocardial infarction. Eur Heart J 2005; 26:S48A (suppl 1; abstr).
38. The EUCLID Study Group. Randomised placebo-controlled trial of lisinopril in normotensive patients with insulin-dependent diabetes and normoalbuminuria or microalbuminuria. Lancet 1997;349:1787-1792.
39. Agardh CD, Garcia-Puig J, Charbonnel B, Angelkort , Barnett AH. Greater reduction of urinary albumin excretion in hypertensive type 2 diabetic patients with incipient nephropathy by lisinopril than by nifedipine. J Hum Hypertens 1996;10:185-192.
40. Makino H, Haneda M, Babazono T, et al, for the INNOVATION Study Group. Prevention of transition from incipient to overt nephropathy with telmisartan in patients with type 2 diabetes. Diabetes Care 2007;30:1577-1578.







