Lược dịch và hiệu đính: BS.CKI Phạm Minh Khôi
Khoa Nội Thận – Bệnh viện Chợ Rẫy
TÓM TẮT
CƠ SỞ
Những bệnh nhân có bệnh thận mạn có nguy cơ cao có các kết cục bất lợi về thận và tim mạch. Hiệu quả của dapagliflozin ở những bệnh nhân bệnh thận mạn, có hoặc không có đái tháo đường típ 2, thì chưa được biết rõ.
PHƯƠNG PHÁP
Chúng tôi phân ngẫu nhiên 4304 những người bệnh tham gia nghiên cứu với độ lọc cầu thận ước đoán (eGFR) từ 25 – 75 ml/phút/1.73m2 da và tỉ lệ albumin/creatinin niệu (với albumin tính bằng miligram và creatinin tính bằng gram) từ 200 – 5000 để sử dụng dapagliflozin (10mg, một lần mỗi ngày) hoặc giả dược. Kết cục chính được định nghĩa là một đa hợp các biến cố gồm một sự giảm ổn định eGFR ít nhất 50%, bệnh thận giai đoạn cuối, hoặc tử vong do nguyên nhân thận hoặc tim mạch.
KẾT QUẢ
Hội đồng giám sát dữ kiện độc lập đã khuyến nghị dừng thử nghiệm vì tính hiệu quả. Qua khoảng thời gian trung vị là 2.4 năm, các biến cố kết cục chính xảy ra ở 197 trong 2152 bệnh nhân (9.2%) ở nhóm dapagliflozin và 312 trong số 2152 bệnh nhân (14.5%) ở nhóm giả dược (tỉ số rủi ro (hazard ratio), 0.61; khoảng tin cậy (KTC) 95%, 0.51 – 0.72; P<0.001; số lượng cần điều trị để ngăn ngừa một biến cố kết cục chính xảy ra (NNT, number needed to treat) là 19 [KTC 95%, 15 – 27]. Tỉ số rủi ro đa hợp của một sự giảm ổn định eGFR ít nhất 50%, bệnh thận giai đoạn cuối, hoặc tử vong do nguyên nhân thận là 0.56 (KTC 95%, 0.45 – 0.68; P<0.001), và tỉ số rủi ro đa hợp của tử vong do nguyên nhân tim mạch hoặc nhập viện vì suy tim là 0.71 (KTC 95%, 0.55 – 0.92); P=0.009). Tử vong xảy ra ở 101 bệnh nhân (4.7%) ở nhóm dapagliflozin và 146 bệnh nhân (6.8%) ở nhóm giả dược (tỉ số rủi ro 0.69, KTC 95%, 0.53 – 0.88; P=0.004). Hiệu quả của dapagliflozin là tương tự như nhau ở những bệnh nhân đái tháo đường típ 2 và ở những bệnh nhân không mắc đái tháo đường típ 2. Hồ sơ an toàn đã biết của dapagliflozin đã được xác nhận.
KẾT LUẬN
Trong số những bệnh nhân có bệnh thận mạn, bất chấp sự có hoặc không của đái tháo đường, nguy cơ đa hợp của một sự giảm eGFR ít nhất 50%, bệnh thận giai đoạn cuối, hoặc tử vong do nguyên nhân thận hoặc tim mạch đã giảm đáng kể với dapagliflozin hơn là với giả dược.
Ước tính trên toàn cầu có khoảng gần 700 triệu người có bệnh thận mạn.Bệnh thận mạn là một phần đóng góp quan trọng vào tình trạng bệnh tật và liên quan đến sự giảm chất lượng cuộc sống và giảm kỳ vọng sống. Bất chấp sự sẵn có rộng rãi của các xét nghiệm đơn giản để xác định người bệnh có suy giảm chức năng thận, có ít hơn các thử nghiệm lâm sàng đã từng được thiết kế cho bệnh thận hơn là cho những tình trạng y khoa phổ biến khác. Cho đến gần đây, chỉ có các nhóm thuốc đã cho thấy làm chậm sự suy giảm chức năng thận là các chất ức chế men chuyển angiotensin và các chất chẹn thụ thể angiotensin; tuy nhiên, hầu hết các bằng chứng có được là ở những người bệnh mắc đái tháo đường típ 2.
Chất ức chế đồng vận chuyển natri-glucose 2 (SGLT2) làm giảm mức độ hemoglobin glycate hóa và cho thấy các hiệu quả tích cực trên kết cục thận và tim mạch ở các thử nghiệm lâm sàng lớn liên quan đến những bệnh nhân đái tháo đường típ 2. Thử nghiệm CREDENCE cho thấy rằng sử dụng lâu dài canagliflozin cung cấp sự bảo vệ thận và tim mạch ở những bệnh nhân đái tháo đường típ 2 có bệnh thận mạn. Mặc dù cơ chế tiềm ẩn vẫn chưa được hoàn toàn hiểu rõ, những lợi ích của chất ức chế SLGT2 dường như là độc lập với tác dụng hạ đường huyết của chúng, và có thể là qua trung gian thải natri và lợi tiểu thẩm thấu do glucose, dẫn đến một sự giảm trong áp lực tại cầu thận. Hiệu ứng huyết động có lợi này có thể cũng bảo tồn chức năng thận ở những người mắc bệnh thận do nguyên nhân không phải là đái tháo đường típ 2. Chúng tôi thiết kế nghiên cứu thử nghiệm “Dapagliflozin và Sự bảo vệ trước các kết cục bất lợi trong bệnh thận mạn” [The Dapagliflozin and Prevention of Adverse Outcomes in Chronic Kidney Disease (DAPA-CKD) trial] để tiếp cận tính hiệu quả và an toàn lâu dài của ức chế SGLT2 dapagliflozin ở những bệnh nhân bệnh thận mạn, có hoặc không có đái tháo đường típ 2.
PHƯƠNG PHÁP
THIẾT KẾ NGHIPHƯƠNG PHÁPN CỨU VÀ GIÁM SÁT
Thử nghiệm của chúng tôi là một thử nghiệm lâm sàng đa trung tâm, ngẫu nhiên, mù đôi, có đối chứng giả dược; các chi tiết liên quan đến thiết kế nghiên cứu và những đặc tính cơ bản của dân số nghiên cứu đã được xuất bản trước đây. Thử nghiệm được tài trợ bởi Astra Zeneca và đã tiến hành tại 386 điểm nghiên cứu ở 21 quốc gia từ ngày 02/02/2017 đến ngày 12/06/2020. Một hội đồng điều hành bao gồm chín thành viên chuyên gia và hai nhân viên không được biểu quyết của nhà tài trợ chịu trách nhiệm cho việc thiết kế và giám sát thử nghiệm và báo cáo kết quả. Đề cương nghiên cứu đã được chấp thuận bởi các hội đồng đạo đức ở địa phương hoặc trung tâm ở mỗi điểm nghiên cứu. Tất cả các bệnh nhân tham gia nghiên cứu đều được cung cấp bản cung cấp thông tin và đồng thuận được viết ra giấy trước khi bắt đầu bất kỳ một thử nghiệm cụ thể nào. Sự an toàn của các bệnh nhân tham gia nghiên cứu đã được giám sát bởi một hội đồng theo dõi dữ kiện độc lập.
DÂN SỐ NGHIÊN CỨU
Những người trưởng thành có hoặc không có đái tháo đường típ 2, có độ lọc cầu thận ước đoán (eGFR) từ 25 – 75 ml/phút/1.73m2 da và tỉ lệ albumin/creatinin niệu (mg/g) từ 200 – 5000 là phù hợp để trở thành đối tượng bệnh nhân tham gia nghiên cứu. Tất cả những bệnh nhân tham gia nghiên cứu được yêu cầu sử dụng liều ổn định của một ức chế men chuyển angiotensin hoặc chẹn thụ thể angiotensin trong ít nhất 4 tuần trước khi sàng lọc. Tuy nhiên, đối với những người bệnh được ghi nhận là không thể sử dụng ức chế men chuyển hoặc chẹn thụ thể angiotensin thì vẫn được chấp thuận vào nghiên cứu. Các tiêu chuẩn loại trừ chắc chắn là đã được chẩn đoán đái tháo đường típ 1, bệnh thận đa nang, viêm thận lupus, hoặc viêm mạch máu liên quan đến kháng thể kháng bào tương của bạch cầu trung tính. Những bệnh nhân đã được điều trị ức chế miễn dịch cho bệnh thận nguyên phát hoặc thứ phát trong vòng 6 tháng trước khi đăng ký cũng sẽ bị loại trừ. Tiêu chuẩn tiếp nhận và loại trừ đầy đủ được liệt kê ở phần phụ chú kèm theo, có sẵn ở NEJM.org.
ĐỀ CƯƠNG NGHIÊN CỨU
Những bệnh nhân tham gia nghiên cứu được phân ngẫu nhiên để sử dụng dapagliflozin (10mg, một lần/ngày) hoặc giả dược, phù hợp với kế hoạch phân ngẫu nhiên đã được ấn định, với việc sử dụng các phương án cân đối nhóm để đảm bảo một tỉ lệ xấp xỉ 1:1 của hai nhóm. Việc phân ngẫu nhiên đã được phân lớp dựa trên việc chẩn đoán đái tháo đường típ 2 (có hoặc không) và tỉ lệ albumin/creatinin niệu (£1000 hoặc >1000). Việc phân ngẫu nhiên đã được theo dõi để đảm bảo rằng tối thiểu 30% những bệnh nhân tham gia nghiên cứu là dân số có đái tháo đường típ 2 hoặc không. Việc thu tuyển bệnh nhân vào nghiên cứu với eGFR từ 60 – 75 ml/phút/1.73m2 đã được dừng lại vào ngày 27/11/2017, để đảm bảo không có hơn 10% các bệnh nhân tham gia thử nghiệm có bệnh thận mạn ở giai đoạn 2. Các bệnh nhân tham gia nghiên cứu và tất cả các nhân viên tiến hành nghiên cứu (ngoại trừ các thành viên của hội đồng giám sát dữ kiện độc lập) đều không được biết về sự phân nhóm trong thử nghiệm. Dapagliflozin và giả dược đã được đóng gói tương tự, với hình dạng viên thuốc cùng một kiểu, có nhãn dán và kế hoạch quản lý như nhau.
Sau khi được phân ngẫu nhiên, những buổi thăm khám trực tiếp của nghiên cứu sẽ được tiến hành tại thời điểm 2 tuần, 2, 4 và 8 tháng, và khoảng cách mỗi 4 tháng sau đó. Tại mỗi lần thăm khám, sinh hiệu được ghi nhận, mẫu máu và nước tiểu được gửi đến phòng xét nghiệm để phân tích và thông tin về các kết cục có khả năng xảy ra của thử nghiệm, những biến cố bất lợi, các trị liệu đi kèm, và sự tuân thủ chế độ điều trị được thu thập. Dapagliflozin hoặc giả dược sẽ được dừng sử dụng nếu có thai hoặc bị nhiễm toan ceton do đái tháo đường. Trước khi kết thúc thử nghiệm, mỗi bệnh nhân tham gia nghiên cứu sẽ trải qua một lần thăm khám cuối cùng trong nghiên cứu.
KẾT CỤC
Kết cục đa hợp chính đã được đánh giá trong một phân tích biến cố theo thời gian, là sự xuất hiện đầu tiên của bất kỳ các biến cố nào sau đây: một sự giảm eGFR ít nhất 50% (xác nhận bằng mẫu thử creatinin huyết thanh thứ hai sau ≥28 ngày), sự khởi phát của bệnh thận mạn giai đoạn cuối (được định nghĩa là phải lọc máu duy trì ≥28 ngày, hoặc phải ghép thận, hoặc có eGFR <15 ml/ph/1.73m2 được xác nhận bằng lần đo lường thứ 2 sau ≥28 ngày), hoặc tử vong do nguyên nhân bệnh lý thận hoặc tim mạch. Các kết cục phụ (cũng được đánh giá dựa trên phân tích biến cố theo thời gian) là, trong một trật tự có thứ bậc, kết cục thận đa hợp, của một sự giảm ổn định eGFR ít nhất 50%, bệnh thận mạn giai đoạn cuối, hoặc tử vong do nguyên nhân thận; một kết cục tim mạch đa hợp đã được định nghĩa là nhập viện do suy tim hoặc tử vong do nguyên nhân tim mạch; và tử vong do bất kỳ nguyên nhân nào.
Một ủy ban độc lập của các thành viên không biết về sự phân nhóm trong nghiên cứu sẽ đánh giá tất cả các kết cục chính và phụ, ngoại trừ kết cục sự giảm ổn định eGFR ít nhất 50% và eGFR ổn định dưới 15 ml/phút/1.73m2, điều này sẽ được xác định từ sự đo lường của phòng xét nghiệm trung tâm. Dữ kiện về các biến cố bất lợi chọn lọc đã được thu thập trong thử nghiệm. Những điều này bao gồm các biến cố bất lợi nghiêm trọng, các biến cố bất lợi dẫn đến phải ngừng dapagliflozin hoặc giả dược, và các biến cố bất lợi đáng quan tâm khác (các triệu chứng của sự mất nước, những biến cố về thận, hạ đường huyết nặng, gãy xương, sự đoạn chi, và nguy cơ nhiễm toan ceton do đái tháo đường). Các trường hợp có khả năng bị nhiễm toan ceton do đái tháo đường được đánh giá bởi một hội đồng đánh giá độc lập. Tất cả các dấu hiệu gợi ý đến hoại thư Fournier được đánh giá bởi một nhóm an toàn nội kiểm bao gồm các đại diện của nhà tài trợ – những người không được biết về sự phân nhóm trong thử nghiệm.
KẾT QUẢ
DÂN SỐ NGHIÊN CỨU VÀ THEO DÕI
Từ tháng 02 năm 2017 đến tháng 10 năm 2018, có 7517 bệnh nhân được sàng lọc, trong số đó có 4094 người bệnh trải qua giai đoạn phân ngẫu nhiên. Vì sự chậm trễ do các thủ tục, việc đăng ký ở Trung Quốc chưa được khởi đầu cho đến tháng 12 năm 2019, sau đó 210 bệnh nhân tham gia nghiên cứu từ Trung Quốc đã trải qua quá trình phân ngẫu nhiên, đến tháng 3 năm 2020.
Các đặc tính cơ bản, bao gồm các thuốc điều trị đái tháo đường típ 2 và bệnh thận, đã được cân đối giữa hai nhóm dapagliflozin và giả dược. Độ tuổi trung bình (±độ lệch chuẩn, ĐLC) là 61.8±12.1 tuổi, và 1425 bệnh nhân tham gia nghiên cứu là nữ (33.1%). EGFR trung bình là 43.1±12.4 ml/phút/1.73m2, tỉ lệ albumin/creatinin niệu trung bình là 949, và 2960 người tham gia nghiên cứu (67.5%) đã được chẩn đoán đái tháo đường típ 2.
Sau một cuộc họp xem xét chính thức diễn ra vào ngày 26 tháng 03 năm 2020, hội đồng giám sát dữ kiện độc lập đưa ra khuyến cáo rằng thử nghiệm nên được dừng lại do có hiệu quả rõ ràng, dựa trên cơ sở 408 kết cục chính. Nhóm lãnh đạo nghiên cứu chấp thuận khuyến cáo này, và chọn ngày 03 tháng 04 năm 2020 là ngày kết thúc của tất cả các phân tích hiệu quả.
Ở kết luận của thử nghiệm, thời gian theo dõi trung vị là 2.4 năm (với độ trải giữa từ 2.0 đến 2.7). Dapagliflozin đã bị dừng sử dụng bởi các lý do không phải là tử vong ở 274 bệnh nhân tham gia nghiên cứu, và nhóm giả dược bị ngưng ở 309 bệnh nhân (tương ứng 12.7% và 14.4%). Trong số tất cả 4289 bệnh nhân (99.7%) hoàn thành thử nghiệm, có tổng cộng là 11 bệnh nhân (0.3%) rút lui khỏi thử nghiệm, và tất cả đều được biết rõ tình trạng sống còn, ngoại trừ 05 trường hợp (0.1%).
KẾT CỤC VỀ HIỆU QUẢ
Các kết cục đa hợp chính bao gồm một sự giảm ổn định eGFR ít nhất 50%, bệnh thận mạn giai đoạn cuối, hoặc tử vong do nguyên nhân thận hoặc tim mạch xảy ra ở 197 bệnh nhân (9.2%) ở nhóm dapagliflozin và 312 bệnh nhân (14.5%) ở nhóm giả dược (tỉ số rủi ro 0.61; KTC 95%, 0.51 – 0.72; P<0.001) (bảng 2 và hình 1A). Tỉ lệ các biến cố cho tất cả các thành tố của kết cục đa hợp ủng hộ cho dapagliflozin (bảng 2). Số lượng các bệnh nhân cần điều trị trong suốt thời gian thử nghiệm để ngăn ngừa một biến cố kết cục chính là 19 (KTC 95%, 15 – 27).
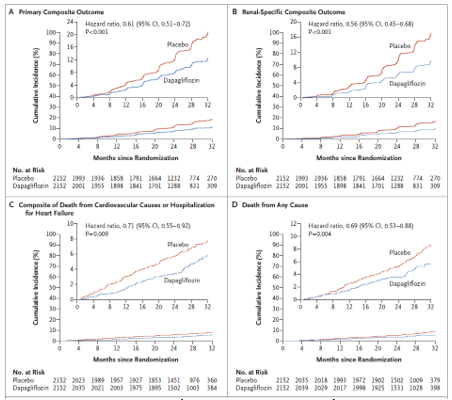
Hình 1. kết cục đa hợp chính và phụ. A. Kết cục đa hợp chính; B. Kết cục đa hợp ở thận; C. Kết cục đa hợp gồm tử vong do nguyên nhân tim mạch hoặc nhập viện vì suy tim; D. Tử vong do bất kỳ nguyên nhân nào. (Chụp từ tài liệu gốc)
Hiệu quả của dapagliflozin trên các kết cục chính nhìn chung là nhất quán trong các phân nhóm đã định trước (hình 2). Ở những bệnh nhân mắc đái tháo đường típ 2, tỉ số rủi ro trong sự so sánh giữa dapagliflozin và giả dược cho các kết cục chính là 0.64 (KTC 95%, 0.52 – 0.79) so với 0.5 (KCT 95%, 0.35 – 0.72) ở những bệnh nhân không mắc đái tháo đường típ 2.
Tỉ suất mới mắc của mỗi kết cục phụ ở nhóm dapagliflozin thì thấp hơn nhóm giả dược (bảng 2). Tỉ số rủi ro cho các kết cục đa hợp ở thận gồm một sự giảm ổn định eGFR ít nhất 50%, bệnh thận mạn giai đoạn cuối, hoặc tử vong do nguyên nhân thận là 0.56 (KTC 95%, 0.45 – 0.68; P<0.001) (bảng 2 và hình 1B). Tỉ số rủi ro cho các kết cục đa hợp gồm tử vong do nguyên nhân tim mạch hoặc nhập viện vì suy tim là 0.71 (KTC 95%, 0.55 – 0.92; P=0.009) (bảng 2 và hình 1C). Đã có 101 trường hợp tử vong (4.7%) do bất kỳ nguyên nhân nào ở nhóm dapagliflozin và 146 (6.8%) ở nhóm giả dược (tỉ số rủi ro = 0.69; KTC 95%, 0.53 – 0.88; P=0.004) (bảng 2 và hình 1D).
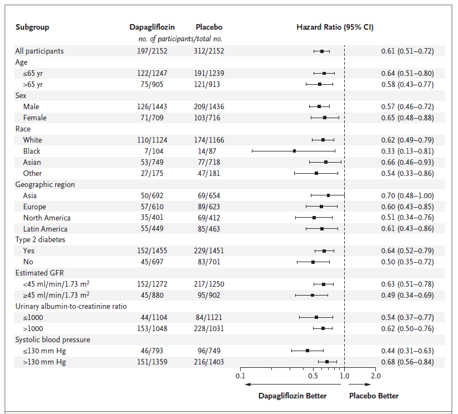
Hình 2. Kết cục đa hợp chính theo các phân nhóm đã định trước. (Chụp từ tài liệu gốc)
Trung bình của bình phương tối thiểu (±ĐLC) eGFR giảm từ đường cơ sở trong 30 tháng ở nhóm dapagliflozin và giả dược, tương ứng là -2.86 ± 0.11 và -3.79 ± 0.11 ml/ph/1.73m2/năm dẫn đến một sự khác biệt giữa hai nhóm là 0.93 ml/ph/1.73m2/năm (KTC 95%, 0.61 – 1.25) (hình 3). Trong hai tuần đầu tiên, có một sự giảm mạnh eGFR trong nhóm dapagliflozin hơn là nhóm giả dược (-3.97 ± 0.15 so với -0.82 ± 0.15 ml/ph/1.73m2). Sau đó, sự thay đổi hằng năm của eGFR ở nhóm dapagliflozin là ít hơn nhóm giả dược (tương ứng -1.67 ± 0.11 và -3.59 ± 0.11 ml/ph/1.73m2), sự khác biệt giữa hai nhóm là 1.92 ml/ph/1.73m2/năm (KTC 95%, 1.61 – 2.24).
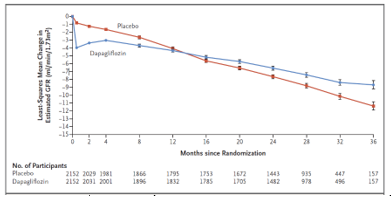
Hình 3. Thay đổi độ lọc cầu thận ước đoán. (Chụp từ tài liệu gốc)
KẾT CỤC VỀ TÍNH AN TOÀN VÀ CÁC BIẾN CỐ BẤT LỢI
Tỉ suất mới mắc của các biến cố bất lợi và các biến cố bất lợi nghiêm trọng là tương tự nhau ở nhóm dapagliflozin cũng như là nhóm giả dược (bảng 2). Nhiễm toan ceton do đái tháo đường đã không có báo cáo ở bất kỳ bệnh nhân nào ở nhóm dùng dapagliflozin, và có 02 bệnh nhân ở nhóm dùng giả dược được ghi nhận. Không có trường hợp nào bị nhiễm toan ceton do đái tháo đường hay bị hạ đường huyết nghiêm trọng được ghi nhận ở những người bệnh không mắc đái tháo đường. Có một trường hợp được xác định là bị hoại thư Fournier ở nhóm giả dược và không có trường hợp nào ghi nhận ở nhóm dapagliflozin
Bảng 2. Kết cục đa hợp chính và phụ và các biến cố bất lợi được quan tâm đặc biệt *
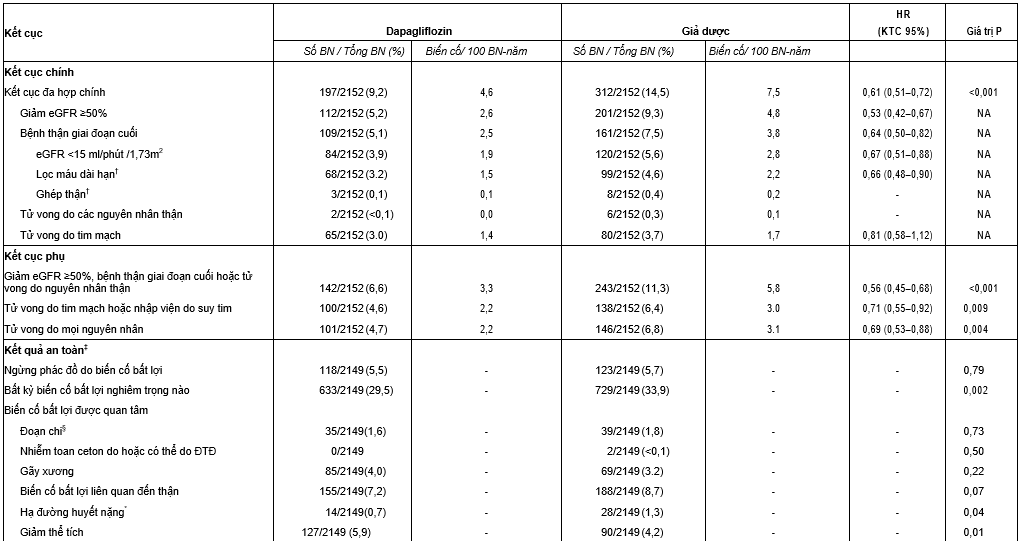
NA: Không áp dụng được vì giá trị P cho kết cục về hiệu quả chỉ được báo cáo cho các kết cục nằm trong sự phân tầng của kiểm định
† Đối với đa hợp lọc máu hoặc ghép thận, có 69 biến cố ở nhóm dapagliflozin và 100 biến cố ở nhóm giả dược (HR 0,66; KTC 95%:0,49 – 0,90)
‡ Các phân tích về tính an toàn bao gồm tất cả bệnh nhân đã trải qua phân ngẫu nhiên và được dùng ít nhất một liều dapagliflozin hoặc giả dược
- Là các trường hợp cắt cụt chi do phẫu thuật hoặc cắt cụt chi tự phát hoặc không phẫu thuật, không bao gồm cắt cụt chi do chấn thương
* Nghiên cứu viên xác nhận các tiêu chí sau: triệu chứng của suy giảm nghiêm trọng về ý thức hoặc hành vi, cần được hỗ trợ từ bên ngoài, can thiệp để điều trị hạ đường huyết và hồi phục nhanh chóng khỏi các triệu chứng cấp tính sau can thiệp
BÀN LUẬN
Chúng tôi nhận thấy rằng những bệnh nhân có bệnh thận mạn, có hoặc không mắc đái tháo đường típ 2, những bệnh nhân được phân nhóm ngẫu nhiên vào nhóm sử dụng dapagliflozin đã có một nguy cơ thấp hơn của việc xảy ra các kết cục đa hợp chính gồm một sự giảm ổn định eGFR ít nhất 50%, bệnh thận mạn giai đoạn cuối, hoặc tử vong do nguyên nhân thận hoặc tim mạch hơn là các bệnh nhân ở nhóm đối chứng giả dược. Mỗi một thành tố của kết cục đa hợp diễn ra với tuần suất ít hơn ở nhóm dapagliflozin, với các kết quả như vậy, điều này cũng tương tự cho các biến cố tử vong do nguyên nhân tim mạch, nhập viện vì suy tim và tử vong do mọi nguyên nhân. Thử nghiệm của chúng tôi ghi nhận thêm vào y văn việc xác định hiệu quả của chất ức chế SGLT2, đã thêm vào liệu pháp điều trị nền tảng bao gồm ức chế men chuyển hoặc chẹn thụ thể angiotensin, ở những bệnh nhân bệnh thận mạn, có hoặc không có đái tháo đường típ 2 đi kèm.
Hiệu quả bảo vệ thận của ức chế SGLT2 đã từng được thấy ra ở những bệnh nhân mắc đái tháo đường típ 2 và bệnh thận mạn trong thử nghiệm CREDENCE. Trong thử nghiệm đó, cũng như là hầu hết các thử nghiệm về ức chế SGLT2 trên kết cục tim mạch trước đây, ngưỡng cắt eGFR thấp nhất để thu nhận bệnh nhân vào nghiên cứu là 30 ml/ph/1.73m2. Đối lập với thử nghiệm CREDENCE, thử nghiệm hiện tại nghiên cứu hiệu quả của ức chế SGLT2 ở những bệnh nhân bệnh thận mạn, trong số đó có 32.5% không mắc đái tháo đường típ 2 và 14.5% người bệnh có eGFR dưới 30 ml/ph/1.73m2. Thử nghiệm của chúng tôi xác nhận rằng hiệu quả bảo vệ thận của ức chế SGLT2 mở rộng đến dân số rộng hơn của những người mắc bệnh thận mạn không bị đái tháo đường típ 2, những người mà ức chế men chuyển là liệu pháp dược lý duy nhất đã từng cho thấy ngăn ngừa suy thận.
Kỳ vọng sống giảm đáng kể khi chức năng thận giảm hoặc xuất hiện albumin niệu. Ước tính toàn cầu đã chỉ ra rằng 1.2 triệu cái chết gây ra do bệnh thận mạn trong năm 2017. Các phát hiện từ thử nghiệm này xác nhận tỉ lệ tử vong cao ở những bệnh nhân với chức năng thận bị suy giảm. Tỉ lệ tử vong giảm một cách đáng kể ở nhóm dapagliflozin hơn là nhóm giả dược đã ủng hộ cho việc sử dụng dapagliflozin như là một liệu pháp điều trị cho bệnh thận mạn.
Những bệnh nhân trong thử nghiệm của chúng tôi cũng có nguy cơ cao phải nhập viện vì suy tim hoặc tử vong do nguyên nhân tim mạch. Sự giảm nguy cơ nhập viện vì suy tim hoặc tử vong do nguyên nhân tim mạch ở nhóm dapagliflozin so với nhóm đối chứng giả dược là phù hợp với kết quả của hai thử nghiệm trước đây của dapagliflozin, thử nghiệm DECLARE-TIMI 58 và DAPA-HF. Các thử nghiệm lâm sàng của các ức chế SGLT2 khác cũng đã cho thấy các kết quả tương tự.
Dapagliflozin đã có một hồ sơ an toàn được chấp thuận ở dân số này, những bệnh nhân có eGFR thấp đến bằng 25 ml/ph/1.73m2. Về tổng thể, nghiên cứu hiện tại xác nhận hồ sơ an toàn có lợi của dapagliflozin. Đặc biệt là, không có trường hợp nào bị nhiễm toan ceton do đái tháo đường với dapagliflozin, và những đợt hạ đường huyết không hề xảy ra ở dân số không mắc đái tháo đường.
Thử nghiệm của chúng tôi cũng còn tồn tại một số hạn chế. Đầu tiên, thử nghiệm đã được dừng lại dựa trên khuyến nghị từ hội đồng giám sát dữ kiện độc lập. Điều này có thể giảm độ mạnh của một vài kết cục phụ. Tuy nhiên, tính hiệu lực mạnh mẽ ở cả trong ngoài của hiệu quả điều trị gợi ý rằng giới hạn này dường như không có một tác động mạnh nào trên các kết quả. Như là ở các thử nghiệm khác của ức chế SGLT2, đã có một bước sụt giảm ban đầu của eGFR, theo sau bởi một sự giảm ổn định chức năng thận. Sự sụt giảm ban đầu này của eGFR phản ánh những sự thay đổi huyết động có lợi ở cầu thận. Chúng tôi không tiếp tục thu thập giá trị eGFR sau khi hoàn thành thử nghiệm và không biết liệu rằng sự sụt giảm ban đầu của eGFR có hồi phục sau khi ngưng dapagliflozin, như đã được quan sát trong các nghiên cứu khác về dapagliflozin hay không.
Thử nghiệm hiện tại cho thấy rằng những người mắc bệnh thận mạn có sử dụng dapagliflozin có một nguy cơ thấp đáng kể của một kết cục đa hợp của một sự giảm độ lọc cầu thận ổn định ít nhất 50%, bệnh thận mạn giai đoạn cuối, hoặc tử vong do nguyên nhân thận hoặc tim mạch hơn là các bệnh nhân ở nhóm đối chứng giả dược, độc lập với sự có hoặc không hiện diện của đái tháo đường típ 2. Thêm nữa, các bệnh nhân sử dụng dapagliflozin có một nguy cơ thấp của tử vong do nguyên nhân tim mạch hoặc nhập viện vì suy tim và có thời gian sống còn lâu hơn.
Cảm ơn AstraZeneca đã hỗ trợ nhằm mục đích cập nhật và giáo dục y khoa.
TÀI LIỆU THAM KHẢO
Hiddo J.L. Heerspink, Ph.D., Bergur V. Stefánsson, M.D., et al (2020), “Dapagliflozin in Patients
with Chronic Kidney Disease”, the New England Journal of Medicine, 383:1436-1446.







