ĐẶT VẤN ĐỀ:
Tần suất bệnh đái tháo đường (ĐTĐ) ngày càng gia tăng trên toàn thế giới. Theo thống kê năm 2011, xấp xỉ 360 triệu người bị ĐTĐ trong đó 95% là ĐTĐ tip 2. Theo ước tính đến năm 2030, con số này sẽ tăng đến khoảng 552 triệu
BS. Nguyễn Thanh Hiền
BS. Dương Hiệp Hồ
BS. Thượng Thanh Phương
ĐẶT VẤN ĐỀ:
Tần suất bệnh đái tháo đường (ĐTĐ) ngày càng gia tăng trên toàn thế giới. Theo thống kê năm 2011, xấp xỉ 360 triệu người bị ĐTĐ trong đó 95% là ĐTĐ tip 2. Theo ước tính đến năm 2030, con số này sẽ tăng đến khoảng 552 triệu và phân nửa số đó không được chẩn đoán [8]. Bệnh tim mạch (BTM) là nguyên nhân tử vong chính và chiếm phần lớn chi phí trực tiếp cũng như gián tiếp ở bệnh nhân ĐTĐ. Cùng với ĐTĐ, những bệnh thường gặp đi kèm với ĐTĐ tip 2 như tăng huyết áp (THA), rối loạn lipid máu…là những yếu tố nguy cơ chính cho bệnh tim mạch [1]. Nhiều nghiên cứu đã chỉ ra tính hiệu quả của việc kiểm soát các YTNC này trong ngăn ngừa hoặc làm chậm tiến triển BTM. Tháng 1/2013, trong khuyến cáo về chăm sóc ĐTĐ đăng tải hằng năm của mình, hiệp hội đái tháo đường Mỹ (ADA) có cập nhật xử trí bệnh tim mạch ở bệnh nhân ĐTĐ. Gần đây hơn trong hội nghị thường niên vừa được tổ chức vào cuối tháng 8/2013, hội tim châu âu (ESC) cùng với hiệp hội nghiên cứu ĐTĐ châu âu (EASD) đã đăng tải khuyến cáo chuyên biệt riêng về bệnh tim mạch ở bệnh nhân ĐTĐ. Theo đó khuyến cáo ở 2 vùng Âu, Mỹ này còn một số quan điểm chưa thống nhất. Bài viết này xin điểm qua cơ chế, bằng chứng hiện có và sự khác biệt giữa các khuyến cáo về 4 vấn đề tim mạch thường gặp trên lâm sàng ở bệnh nhân ĐTĐ:
1.Đánh giá nguy cơ và tầm soát bệnh mạch vành
2.Tăng huyết áp
3.Rối loạn mỡ máu
4.Ức chế kết tập tiểu cầu
Các bệnh lý bệnh mạch vành cấp-mạn, bệnh động mạch ngoại vi, suy tim, loạn nhịp… ở bệnh nhân ĐTĐ xin tham khảo các bài tổng quan khác.
1. ĐÁNH GIÁ NGUY CƠ VÀ TẦM SOÁT BỆNH MẠCH VÀNH
ĐTĐ tip 2 được đặc trưng bởi tình trạng đề kháng insulin kéo dài, tăng insulin máu bù trừ, sự thay đổi rất nhiều của ĐH, và cùng với các yếu tố nguy cơ tim mạch khác sẽ gây biến chứng mạch máu lớn trước khi được chẩn đoán (hình 1).
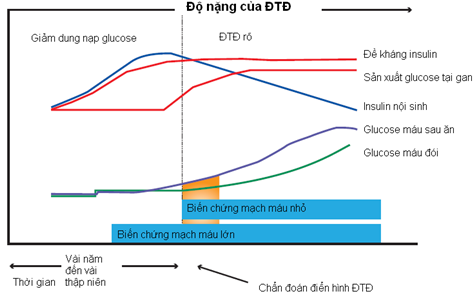
Hình 1: Các dạng về đường huyết và bệnh tim mạch [15]
Sự phát triển bệnh lý tim mạch ở bệnh nhân đề kháng insulin là 1 tiến trình tiếp diễn được đặc trưng bởi rối loạn chức năng nội mạc sớm và viêm mạch máu, dẫn đến tuyển mộ các BC đơn nhân, hình thành tế bào bọt và sau đó phát triển thành vệt mỡ. Qua nhiều năm, mảng xơ vữa hình thành, đặc biệt càng nhiều lõi lipid hơn ở bệnh nhân ĐTĐ, với sự hiện diện của nhiều tế bào viêm, mãng xơ vữa trở nên không ổn định và bị nứt vỡ ra, hình thành nên huyết khối tắc nghẽn mạch máu. Cơ chế bên dưới chính là tình trạng stress oxy hóa (Oxidative stress) với sự tích tụ các gốc tự do trong mạch máu để rồi hoạt hóa những con đường sinh hóa gây hại dẫn đến viêm mạch máu và sản sinh ROS (reactive oxygen species). Sự phóng thích acid béo tự do và cytokine từ mô mỡ làm suy giảm trực tiếp tính nhạy cảm insulin. Trong mô cơ và mô mỡ sản phẩm ROS liên quan acid béo tự do làm giảm hoạt hóa thụ thể IRS-1 và tín hiệu PI3K-Akt dẫn đến điều chỉnh xuống của GLUT-4 (glucose transporter 4) và giảm phosphorin hóa eNOS (endothelial nitric oxide synthase ) gây giảm sản xuất NO (nitric oxide), rối loạn chức năng nội mạc và tái cấu trúc mạch máu (tăng bề dày nội trung mạc) là những yếu tố tiên lượng quan trọng của bệnh tim mạch (hình 2). Những bằng chứng gần đây đề nghị rằng sản sinh ROS do tăng ĐH liên quan đến tình trạng rối loạn chức năng mạch máu tồn tại dai dẳng mặc dù mức ĐH đã về bình thường. Hiện tượng này còn được gọi là “trí nhớ chuyển hóa” và có thể giải thích tại sao biến chứng mạch máu nhỏ và mạch máu lớn vẫn tiếp diễn mặc dù đã kiểm soát ĐH tích cực .
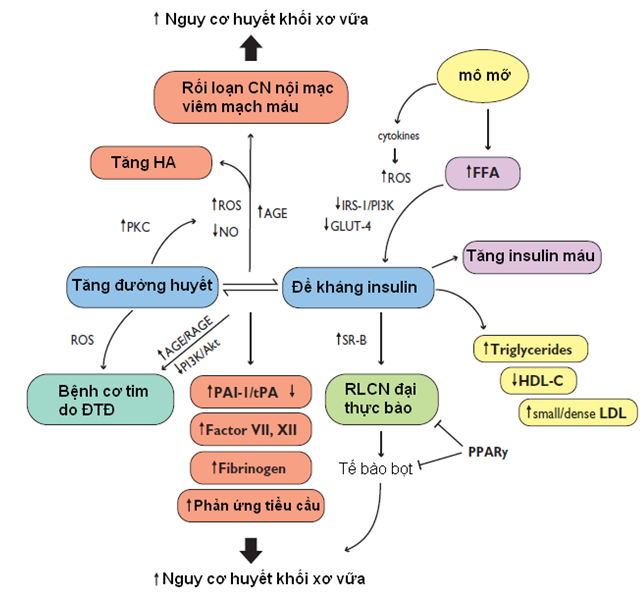
Hình 2: Tăng đường huyết, đề kháng insulin và bệnh tim mạch [15]
1.2.Về mặt chứng cứ:
Mục đích của đánh giá nguy cơ là phân loại bệnh nhân thành các nhóm nguy cơ để từ đó có tiếp cận dự phòng tích cực. Năm 2012 trong khuyến cáo dự phòng bệnh tim mạch, ESC đã đề nghị 1 đánh giá nguy cơ ở bệnh nhân ĐTĐ. Theo đó nguy cơ rất cao (very high risk) khi có bằng chứng bệnh tim mạch rõ, bệnh thận mạn nặng, hoặc ≥ 1 yếu tố nguy cơ tim mạch (YTNC) và/hoặc tổn thương cơ quan đích. Và nguy cơ cao (high risk) khi chỉ có ĐTĐ mà không có các yếu tố kể trên (không có bất kỳ YTNC tim mạch nào và không có tổn thương cơ quan đích) [19]. Việc áp dụng những thang điểm nguy cơ để phân nhóm bệnh nhân sẽ rất khó vì có sự khác nhau về văn hóa, sắc tộc, những dấu ấn viêm, chuyển hóa và quan trọng là thang điểm cho đột quị sẽ khác với thang điểm cho bệnh mạch vành. Hiện tại đã có nhiều thang điểm nguy cơ riêng cho bệnh nhân ĐTĐ: UKPDS cho đột quị, UKPDS cho bệnh mạch vành, Framingham cho đột quị, mô hình ADVANCE.. Một phân tích gộp gần đây từ 17 thang điểm nguy cơ (15 thang điểm trên dân số da trắng (Mỹ và Châu Âu) 2 thang điểm từ dân số Trung Quốc) đề nghị rằng hiện tại còn ít bằng chứng cho rằng việc dùng những thang điểm nguy cơ sẽ giúp lượng giá chính xác hơn nguy cơ tim mạch ở bệnh nhân ĐTĐ [6]. Các thang điểm nguy cơ chỉ cho kết quả tốt trên chính dân số được nghiên cứu phát triển mô hình đó mà ít đúng cho những dân số khác [15].
Thiếu máu cơ tim yên lặng (silent myocardial ischemia-SMI) chiếm tần suất khoảng 20-35% ở bệnh nhân ĐTĐ mà có những YTNC thêm vào, và 35-70% bệnh nhân SMI hẹp có ý nghĩa mạch vành/ chụp MV. Mặt khác SMI còn có thể do thay đổi chức năng nội mạc hoặc vi tuần hoàn mạch vành. SMI có thể được phát hiện bằng ECG gắng sức, siêu âm tim gắng sức, scintigraphy cơ tim [15]. Tuy nhiên, những nghiên cứu gần đây đã thất bại để chỉ ra bằng chứng thiếu máu cơ tim yên lặng trên test tầm soát ở những bệnh nhân ĐTĐ tip 2. Thử nghiệm lâm sàng quan sát ngẫu nhiên gần hơn cũng không chỉ ra lợi ích lâm sàng nào cho sàng lọc thường qui bệnh mạch vành ở những bệnh nhân ĐTĐ tip 2 không triệu chứng mà có ECG bình thường [1]. ESC 2013 đề nghị xem xét tầm soát SMI ở những bệnh nhân có nguy cơ đặc biệt cao như có bằng chứng của bệnh ĐM ngoại vi (PAD), hoặc điểm vôi hóa mạch vành cao hoặc có protein niệu hoặc ở những người chuẩn bị bắt đầu chương trình tập luyện nặng [15]. Tuy nhiên ADA 2013 khuyến cáo tất cả bệnh nhân ĐTĐ nên được đánh giá các YTNC tim mạch hằng năm và test sàng lọc bệnh mạch vành trên bệnh nhân ĐTĐ chỉ có ý nghĩa trên 2 nhóm đối tượng: có triệu chứng tim mạch điển hình hoặc không điển hình có bất thường trên ECG lúc nghỉ [1].
1.3.Khuyến cáo hiện tại:
ADA 2013[1]:
Trong những bệnh nhân không triệu chứng, tầm soát thường qui bệnh mạch vành không được khuyến cáo, khi điều này không làm cải thiện kết cục tim mạch cũng như các yếu tố nguy cơ đã được điều trị (A).
ESC 2013[15]:
Nên xem xét phân loại bệnh nhân ĐTĐ thành nhóm nguy cơ rất cao và nguy cơ cao tùy thuộc vào YTNC đi kèm và tổn thương cơ quan đích (IIa-C).
Không khuyến cáo đánh giá nguy cơ tim mạch ở bệnh nhân ĐTĐ dựa vào những thang điểm nguy cơ cho dân số chung (III-C).
Tầm soát SMI có thể được xem xét chọn lọc ở một số bệnh nhân ĐTĐ nguy cơ cao (có bằng chứng của bệnh ĐM ngoại vi (PAD), hoặc điểm vôi hóa mạch vành cao hoặc có protein niệu hoặc ở những người chuẩn bị bắt đầu chương trình tập luyện nặng) (IIb-C).
2.TĂNG HUYẾT ÁP:
2.1.Về mặt cơ chế [9],[15]: 3 yếu tố đã góp phần vào bệnh sinh THA ở bệnh nhân ĐTĐ:
· Tăng insulin trong máu do tình trạng đề kháng insulin hoặc do insulin ngoại sinh thêm vào sẽ làm tăng trương lực thần kinh giao cảm, tăng hoạt động hệ thống renin-angiotensin-aldosterol và tăng tái hấp thu Na ở thận.
· Quá tải thể tích dịch ngoại bào: tình trạng tăng insulin và tăng ĐH làm gia tăng lọc glucose tại thận từ đó tăng tái hấp thu glucose và cả muối Na tại ống lượn gần (qua cơ chế đồng vận chuyển Na-glucose) gây ứ muối và quá tải dịch góp dẫn đến tăng HA.
· Tăng độ cứng ĐM do tình trạng glycat hóa các protein và xơ vữa ĐM góp phần làm tăng HA tâm thu và tăng tử suất.
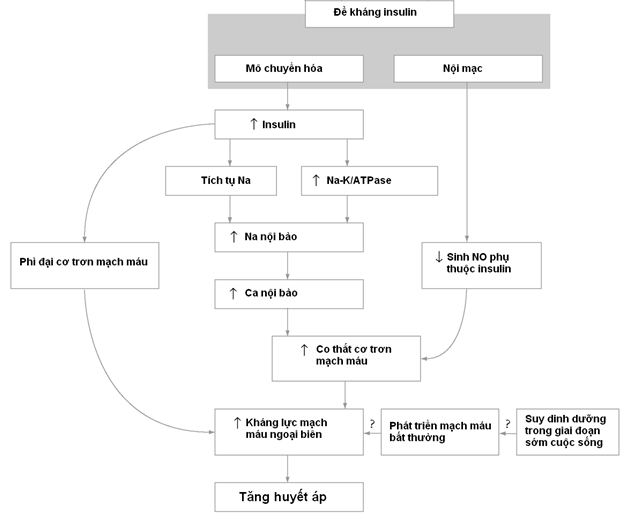
Hình 3: Cơ chế dẫn đến tăng huyết áp từ đề kháng insulin [20]
Ngoài ra béo phì, tuổi lớn và xuất hiện bệnh lý thận cũng góp phần làm tăng tần suất THA ở bệnh nhân ĐTĐ.
Như vậy bên cạnh kiểm soát tốt ĐH, việc ức chế hệ RAA, hệ giao cảm, giải quyết tình trạng ứ muối nước sẽ là những điều trị tác động trên các yếu tố sinh bệnh này.
2.2.Về mặt chứng cứ:
Lợi ích điều trị và mức đích cần đạt:
Điều trị THA ở bệnh nhân ĐTĐ đã được chứng minh là mang lại lợi ích lâm sàng trong 3 TNLS chính: UKPDS (kiểm soát HA chặt -HA trung bình 144/82- giảm 24% biến cố mạch máu lớn so với kiểm soát HA không chặt-HA trung bình 154/87 mmHg và quan sát sau đó ghi nhận tử vong sẽ giảm 15% cho mỗi 10mmHg giảm HATT tới 120 mmHG ), HOT (nhóm có HA trung bình 140/81 giảm biến cố tim mạch hơn so với nhóm có HA trung bình 144/85 mmHg – RR 0.49, 95% CI 0.29-0.81) [11]và ADVANCE (nhóm có HA trung bình 134.5/74 cải thiện tử vong so với nhóm có HA trung bình 140/76 mmHg) [18].
Gần đây TNLS ACCORD được thiết kế để đánh giá có hay không việc đưa HA tâm thu (HATT) < 120 mmHg sẽ bảo vệ tim mạch tốt hơn khi để mức HATT 130-140 mmHg ở bệnh nhân ĐTĐ tip 2 tại mức nguy cơ cao cho bệnh lý tim mạch? TNLS này đã thất bại trên tiêu chí chính (tử vong về tim mạch, NMCT không tử vong, đột quị không tử vong) với HR = 0.88 (95% CI 0.73-1.06, P = 0.20) trong nhóm điều trị tích cực (HATT < 120 mmHg). Tuy nhiên nhóm này lại cải thiện có ý nghĩa khi xét tiêu chí thứ phát như đột quị không tử vong HR = 0.63 (95% CI 0.41-0.96, P = 0.03) [7].
Mặt khác trong TNLS ADVANCE, mặc dù nhóm điều trị perindopril+indapamide cho thấy có giảm tử vong và không giảm trên tiêu chí gộp về kết cục mạch máu lớn, nhưng HA trung bình trong nhóm điều trị tích cực của nghiên cứu này lại là 135 mHg, cũng không thấp bằng ngay cả HA trung bình trong nhóm điều trị chuẩn của nghiên cứu ACCORD.
Phân tích gộp của tác giả Bangalore và cộng sự từ 13 TNLS với 37736 bệnh nhân với ĐTĐ, rối loạn ĐH đói và rối loạn dung nạp đường cho thấy nhóm điều trị tích cực (HATT ≤ 135 mmHg) giảm 10% tử vong do mọi nguyên nhân (95% CI 0.83-0.98) và 17% đột quị nhưng làm tăng 20% tác dụng phụ quan trọng khác so với nhóm điều trị chuẩn (HATT ≤ 140 mmHg). Phân tích này cũng cho thấy HATT ≤ 130 mmHg sẽ giảm tỷ lệ đột quị nhiều hơn nhưng không ảnh hưởng trên các biến cố tim mạch khác [4].
Như vậy các nghiên cứu và phân tích trên đã chỉ ra mức đích HA cần đạt nhằm mạng lại lợi ích lâm sàng (giảm biến cố tim mạch, đột quị, và bệnh thận) khi HATT ≤ 140 mmHg và HATTr ≤ 80-85 mmHg ở bệnh nhân ĐTĐ (các nhóm điều trị tích cực trong các TNLS trên với kế hoạch đưa HATTr ≤ 80 mmHg nhưng HATTr trung bình từ kết quả đạt được thường trên 80 mmHg).
Chọn lựa thuốc điều trị [1],[15]:
Chứng cứ hiện tại ủng hộ cho các thuốc ức chế hệ RAA hơn là ức chế Ca và b–trong ngăn ngừa tiến triển bệnh thận và nó cũng chính là nền tảng cho chọn lựa thuốc điều trị ban đầu THA ở bệnh nhân ĐTĐ. Tuy nhiên qua công trình nghiên cứu ONTARGET, ức chế kép hệ thống RAA lại thất bại trong việc chỉ ra lợi ích về kết cục lâm sàng. Mặt khác, lợi tiểu và ức chế bcó vai trò trên sinh bệnh THA ở bệnh nhân ĐTĐ nhưng lại có tác dụng phụ trên chuyển hóa là tăng nguy cơ mắc ĐTĐ2 và tăng axit uric (ngoại trừ carvedilol được ghi nhận là ít ảnh hưởng trên tỷ lệ ĐTĐ mới mắc hơn qua TNLS GEMINI [16]). Và theo dữ liệu từ TNLS ALLHAT, lợi tiểu thiazide liều thấp thường ít ảnh hưởng trên chuyển hóa. TNLS UKPDS cũng chỉ ra rằng kiểm soát chặt đường huyết ít ảnh hưởng trên kết cục tim mạch hơn là việc kiểm soát HA, nên tác dụng không tốt trên chuyển hóa của lợi tiểu và b–tuy làm cho các thuốc này không là chọn lựa đầu tiên ở bệnh nhân ĐTĐ nhưng có thể vẫn xem xét trong kết hợp thuốc khi cần những đặc tính hiệu quả của nó. Gần đây, kết quả từ TNLS ACCOMPLISH với 11506 bệnh nhân THA trong đó có 60% (6946 BN) là ĐTĐ cho thấy vai trò kết hợp thuốc LT + UCMC lại kém hơn sự kết hợp Ca + UCMC (benazepril +amlodipine) trong việc giảm biến cố tim mạch [13]
2.3. Khuyến cáo hiện tại [1],[15]:
Tầm soát và chẩn đoán
Huyết áp nên được đo tại mỗi lần tái khám, nếu HA cao, THA sẽ được khẳng định vào một ngày tái khám khác (B).
Đích của điều trị
Ở những bệnh nhân ĐTĐ, THA nên được điều trị đến mức đích HA tâm thu < 140 mmHg(B).
Mức đích HA tâm thu thấp hơn, như < 130 mmHg có thể thích hợp ở một vài cá nhân như ở bệnh thận với tiểu đạm rõ, bệnh nhân trẻ tuổi, nếu điều này có thể đạt được mà không gây gánh nặng cho điều trị (C).
Bệnh nhân ĐTĐ nên điều trị đưa HA tâm trương < 80 mmHg (theo ADA 2013) và < 85mmHg (theo ESC 2013) (B).
Điều trị
Bệnh nhân với HA > 120/80 mmHg nên được khuyên thay đổi lối sống để làm giảm HA(B).
Bệnh nhân có HA ≥ 140/80 mmHg nên bắt đầu điều trị bằng thuốc ngay và chỉnh liều sau đó bên cạnh thay đổi lối sống để đạt được mức đích HA (B).
Điều trị thay đổi lối sống bao gồm giảm cân nếu quá cân, chế độ ăn DASH bao gồm giảm muối Na, tăng K đưa vào, tiết chế rượu và tăng hoạt động thể lực (B).
Chế độ điều trị bằng thuốc nên bao gồm hoặc ức chế men chuyển (UCMC) hoặc ức chế thụ thể angiotensin (UCTT). Nếu 1 thuốc không dung nạp, thuốc khác nên được thay thế (C).
Chế độ điều trị nhiều thuốc (≥ 2 hoặc nhiều thuốc tại liều tối đa) nói chung được đòi hỏi để đạt mức đích HA (B).
Cho ≥ 1 thuốc điều trị THA vào buổi tối trước ngủ (A).
Khi UCMC, UCTT, lợi tiểu được sử dụng, creatinin huyết thanh, độ lọc cầu thận ước tính (eGFR) và K huyết thanh nên được theo dõi (E).
Ở bệnh nhân có thai với ĐTĐ và THA mạn, mức đích HA 110-129/65-79 mmHg được đề nghị trong mối quan tâm sức khỏe lâu dài của mẹ và làm giảm vấn đề thai chậm tăng trưởng. UCMC và UCTT bị chống chỉ định trong thai kỳ (E).
Vài lưu ý:
Sự thay đổi trong mặc định lại mức đích HATT không có nghĩa làm giảm tầm quan trọng của việc điều trị THA ở bệnh nhân ĐTĐ hoặc ngụ ý cho rằng các mức đích HA < 140 mmHg sẽ không hợp lý. Hiện tại đã có nhiều bằng chứng cho thấy HATT > 140 mmHg có hại, điều này đề nghị rằng nhà lâm sàng nên bắt đầu ngay và điều chỉnh điều trị để đạt được và duy trì HATT < 140 mmHg trong tất cả bệnh nhân. Những bệnh nhân với đời sống mong đợi dài sẽ có lợi ích trên thận từ nhóm kiểm soát HA tích cực lâu dài hoặc ở những người có nguy cơ bị đột quị thì cần mức đích HATT thấp hơn (<130 mmHg) là hợp lý. Điều này càng đặc biệt trong những trường hợp chỉ cần sử dụng vài thuốc đã đạt đích HA và không có tác dụng phụ nào.
Chúng ta luôn ghi nhớ rằng nhiều bệnh nhân ĐTĐ sẽ không đạt được đích HA khuyến cáo và không giống như trong trường hợp kiểm soát ĐH và statin, điều trị THA không có hiệu quả trí nhớ, nên việc theo dõi và điều chỉnh thuốc để kiểm soát HA lâu dài cần được thực hiện.
3.RỐI LOẠN MỠ MÁU
-Bất thường dung mạo lipid ở bệnh nhân ĐTĐ tip 1 và tip 2 là khác nhau. Ở bệnh nhân ĐTĐ tip1, Triglycerid (TG) bình thường và HDL-C ở giới hạn trên hoặc tăng nhẹ. Kết quả này là do điều trị insulin làm tăng hoạt động lipoprotein lipase ở mô mỡ, và tăng luân chuyển phân tử VLDL. Tuy nhiên thay đổi chất lượng trong phân tử LDL và HDL có thể sinh xơ vữa.
-Bệnh nhân ĐTĐ tip 2 với tình trạng đề kháng insulin, giảm sử dụng glucose phụ thuộc insulin để sinh năng lượng sẽ gây nên sự tăng huy động acid béo từ các mô mỡ để sinh năng lượng đáp ứng cho nhu cầu cơ thể, kết hợp với giảm thu nhận acid béo ở mô ngoại biên dẫn đến tăng acid béo trong máu và gan. Lúc này gan trở thành hồ chứa nhiều acid béo (gan nhiễm mỡ không do rượu) nên tăng sản xuất những phân tử VLDL giàu Triglyceride (TG) có kích thước lớn hơn bình thường và cùng kết hợp với việc giảm thanh lọc VLDL ra khỏi tuần hoàn dẫn đến tồn tại các Lipoprotein giàu TG lâu trong máu (tăng TG khi định lượng). Điều này đến lượt nó làm tăng hoạt động các men:
· Men CETP (Cholesteryl Ester Transfer Protein), làm tăng chuyển đổi cholesterol tự do từ HDL sang cho VLDL và những sản phẩm của nó để nhận ngược lại TG từ những phân tử này (giảm cholesterol trong HDL hay giảm HDL-C)
· Men LPL (lipoprotein lipase) & HL (hepatic lipase) giúp tăng ly giải 2 thành phần TG và phospholipid của VLDL & những sản phẩm của nó trong 1 khoảng thời gian dài (do tồn tại lâu) làm sản sinh ra phân tử LDL nhỏ đậm đặc (do mất nhiều TG & phospholipids nhưng nhận thêm cholesterol tự do) và chính LDL nhỏ đậm đặc này cũng tồn tại lâu trong tuần hoàn do có tình trạng giảm hoạt động tương đối thụ thể LDL (LDL-R).
· Riêng bản thân men HL tăng hoạt động trên những phân tử LP tồn tại lâu trong máu sẽ dẫn đến ly giải phospholipid nhiều hơn và hình thành nên những phân tử HDL nhỏ hơn bình thường & LDL càng đậm đặc hơn, càng nhỏ hơn. Chính những phân tử nhỏ mới hình thành này lại dễ đi vào thành động mạch hơn để gây XVĐM (mặc dù nồng độ cholesterol trong LDL (LDL-C) có thể bình thường) và sẽ gây nên những biến cố mạch máu sớm hơn và nhiều hơn.
-Vì vậybộ 3 bất thường lipoprotein đặc trưng của bệnh nhân ĐTĐ tip 2 là:
· Tăng TG
· Giảm HDL-C
· Tăng thành phần LDL nhỏ đậm đặc mà LDL-C có thể bình thường
Do đó bản chất rối loạn dung mạo lipid của bệnh nhân ĐTĐ tip 2 khó có thể nhận dạng hết nếu chỉ dựa vào xét nghiệm lipid thường quy. Tình trạng này sẽ được khảo sát tốt hơn bằng sử dụng chỉ số non-HDL-C hoặc định lượng nồng độ ApoB vì ApoB gián tiếp đếm được số phân tử sinh xơ vữa (VLDL, IDL, LDL, LDL nhỏ đậm đặc) do nó luôn gắn theo tỷ lệ 1:1 với các phân tử này.
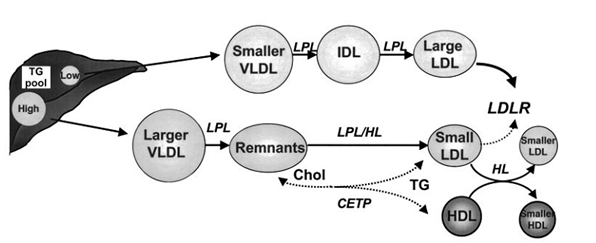
Hình 4: Chuyển hóa lipoprotein trong tình trạng đề kháng insulin [14]
3.2.Về mặt chứng cứ:
Nhiều TNLS đã chỉ ra lợi ích của statin trong phòng ngừa tiên phát và thứ phát bệnh tim mạch trên cả đối tượng ĐTĐ và không ĐTĐ. Một phân tích gộp 14 TNLS với hơn 18000 bệnh nhân cho thấy điều trị với statin làm giảm 1 mmol/l của LDL-C sẽ làm giảm 9 % tử vong do mọi nguyên nhân và 13% tử vong do mạch máu [12]. Lợi ích statin càng lớn khi nguy cơ tim mạch càng cao (BMV đã biết và/hoặc LDL-C rất cao), điều này đã thuyết phục cho điều trị statin ở bệnh nhân ĐTĐ tại mức nguy cơ tim mạch trung bình và cao.
Điều trị statin tích cực cải thiện 16% tử vong do bệnh mạch vành hoặc NMCT qua 1 phân tích gộp. Dữ liệu khác từ 10 TNLS, nghiên cứu trên 41778 bệnh nhân qua 2.5 năm theo dõi cho thấy điều trị statin tích cực giảm tiêu chí gộp về bệnh mạch vành khoảng 10% (95% CI 0.84-0.96, P < 0.0001) nhưng không làm giảm tử vong tim mạch. Điều trị tích cực giảm LDL-C bên cạnh dùng liều cao statin còn có thể cho ezetimide thêm cùng statin, tuy nhiên chưa có dữ liệu TNLS cho điều trị kết hợp này trên kết cục tim mạch, chúng ta chờ kết quả từ TNLS IMPROVE-IT, tuy nhiên trên đối tượng suy thận mạn nghiên cứu SHARH cho thấy giảm 17% biến cố do xơ vữa ĐM từ kết hợp này [3].
Tỉ suất ĐTĐ mới mắc tăng ở bệnh nhân sử dụng statin, tuy nhiên tác dụng có lợi trên biến cố tim mạch nhiều hơn khi xem xét tỉ lệ lợi ích-nguy cơ. Qua 5 năm theo dõi từ 1 nghiên cứu cho thấy tỉ suất mới mắc ĐTĐ 1.5% ở nhóm điều trị rosuvastatin so với 1.2% ở nhóm giả dược. Sau đó 1 phân tích gộp 27 TNLS dự phòng tiên phát, gồm 170000 bệnh nhân tại mức nguy cơ thấp, cho thấy lợi ích rất lớn trên biến cố mạch máu lớn và tử vong do nguyên nhân mạch máu từ điều trị statin mà không làm tăng tỉ suất mới mắc ung thư hoặc tử vong do nhiều nguyên nhân khác [12].
HDL-C thấp và Tryglyceride cao là dạng RLLP thường gặp ở bệnh nhân ĐTĐ típ 2. Nicotinic giảm biến cố tim mạch trên đoàn hệ không ĐTĐ từ kết quả của 1 nghiên cứu. Gemfibrozil giảm các biến cố này trên cả dân số ĐTĐ từ TNLS lớn và không ĐTĐ qua phân tích phân nhóm. Tuy nhiên, qua 1 TNLS lớn chuyên biệt trên bệnh nhân ĐTĐ, fenofibrat lại thất bại khi chỉ ra lợi ích làm giảm kết cục tim mạch toàn bộ [1].
Điều trị kết hợp statin + fibrat hoặc statin + niacin làm cải thiện cả 3 chỉ số trên dung mạo lipid, tuy nhiên kết quả từ 2 TNLS lớn ACCORD và AIM-HIGH không cho thấy lợi ích về biến cố tim mạch từ điều trị kết hợp này [5],[10]. Trong phân tích phân nhóm, kết hợp fenofibrat+simvastatin chỉ có lợi trên nam (nhưng có hại trên nữ) và trên những BN có cả 2 rối loạn TG ≥ 204 mg/dl và HDL-C ≤ 34 mg/dl
Các TNLS về điều trị statin so sánh với giả dược để cải thiện biến cố tim mạch đều cho thấy đạt mức giảm 30-40% so với giá trị LDL-C ban đầu. Vì thế khá hợp lý khi chọn mức giảm LDL-C 30-40% giá trị ban đầu trong điều trị statin khi chúng ta không đạt mức đích LDL-C < 100 mg/dl (hoặc < 70 mg/dl khi thuộc nhóm nguy cơ rất cao) ở bệnh nhân có LDL-C ban đầu quá cao hoặc không dung nạp ở liều statin cao. Trong những người có bệnh tim mạch (CVD) lâm sàng, hoặc những người > 40 tuổi có kèm YTNC khác, điều trị statin và thay đổi lối sống bất kể giá trị lipid ban đầu cho thấy có tác dụng bảo vệ tim mạch. Ở những người không thuộc 2 nhóm kể trên, điều trị statin nên xem xét khi LDL-C đáp ứng không thích hợp với thay đổi lối sống và điều chỉnh đường huyết thích hợp. Hiện tại còn rất ít bằng chứng từ TNLS về statin trên bệnh nhân ĐTĐ tip 2 dưới 40 tuổi.
3.3.Khuyến cáo hiện tại [1],[15]:
Tầm soát
Trong hầu hết bệnh nhân ĐTĐ, cần đo lường dung mạo lipid đói ít nhất mỗi năm (B).
Trong những bệnh nhân lipid ở mức nguy cơ thấp (LDL-C < 100 mg/dl, HDL-C > 50 mg/dl, và triglyceride < 150 mg/dl), đánh giá lipid có thể lặp lại mỗi 2 năm (E).
Khuyến cáo điều trị và mức đích
Thay đổi lối sống cần tập trung vào giảm chất béo bão hòa, chất béo trans và cholesterol, tăng acid béo n-3, chất xơ sợi và stanols/sterols thực vật, giảm cân (nếu được chỉ định) và tăng hoạt động thể lực nên được khuyến cáo để cải thiện dung mạo lipid ở bệnh nhân ĐTĐ (A).
Điều trị statin nên được cho cùng với thay đổi lối sống bất chấp mức lipid nền ban đầu ở bệnh nhân ĐTĐ có:
· Bệnh tim mạch rõ(A)
· Bệnh nhân không bị bệnh tim mạch nhưng ≥ 40 tuổi và có ≥ 1 yếu tố nguy cơ tim mạch (tiền sử gia đình bệnh tim mạch, THA, hút thuốc lá, rối loạn mỡ máu hoặc tiểu albumin) (A).
Những bệnh nhân ở mức nguy cơ thấp hơn so với trên (như không có bệnh tim mạch rõ và dưới 40 tuổi) điều trị statin nên được thêm vào cùng với thay đổi lối sống, nếu LDL-C vẫn > 100 mg/dl hoặc ở những người với nhiều yếu tố nguy cơ tim mạch (C).
Ở những người không có bệnh tim mạch rõ, mức đích LDL-C < 100 mg/dl (2.6 mmol/l) (B).
Ở những người có bệnh tim mạch rõ, sử dụng liều cao statin đạt mức đích LDL-C thấp hơn (< 70 mg/dl) là một chọn lựa (B).
ESC 2013 khuyến cáo điều trị statin cho phổ bệnh nhân tương đối rộng hơn là ở tất cả bệnh nhân ĐTĐ típ 1 & 2 thuộc nhóm nguy cơ rất cao và riêng nhóm nguy cơ cao thì chỉ cho ĐTĐ tip 2. Như vậy bệnh nhân ĐTĐ tip 2 là có chỉ định statin (vì chỉ có 2 nhóm nguy cơ là cao và rất cao) và chỉ khác nhau ở đích đến là < 70 mg/dl cho nhóm nguy cơ rất cao và < 100 mg/dl cho nhóm nguy cơ cao
Nếu bệnh nhân điều trị bằng thuốc với liều tối đa dung nạp được của statin vẫn không đạt mức đích như trên, mức đích điều trị thay thế là giảm LDL-C khoảng 30-40% giá trị ban đầu (B).
Điều trị statin tích cực nên được xem xét trước điều trị kết hợp statin với ezetimibe.
Triglyceride < 150 mg/dl (1.7 mmol/l) và HDL-C > 40 mg/dl (1 mmol/l) ở nam và > 50 mg/dl (> 1.3 mmol/l) ở nữ là điều mong muốn đạt được. Tuy nhiên, điều trị statin để đạt mức đích LDL-C vẫn là chiến lược được ưu tiên (A).
Điều trị kết hợp không cho thấy có lợi thêm về mặt tim mạch so với điều trị statin đơn thuần và nói chung không được khuyến cáo (A).
Statin bị chống chỉ định trong thai kỳ (B).
4.THUỐC ỨC CHẾ KẾT TẬP TIỂU CẦU
Trong bệnh nhân ĐTĐ tip 2, tình trạng đề kháng insulin và tăng ĐH tham gia vào bệnh sinh của tình trạng tiền huyết khối, do có sự tăng PAI-1, yếu tố VII, XII, fibrinogen và giảm tPA. Hoạt hóa tiểu cầu đóng vai trò then chốt trong khởi phát và tiến triển của huyết khối xơ vữa. Cả 2 vấn đề tăng ĐH sau ăn và tăng ĐH dai dẳng đã được xác định là yếu tố chính gây hoạt hóa tiểu cầu trong cả giai đoạn sớm và muộn của ĐTĐ tip 2. Tăng ĐH làm thay đổi nội môi Ca trong tiểu cầu, dẫn đến bất thường bộ xương tế bào và tăng tiết những yếu tố tiền kết tập tiểu cầu. Hơn nữa nó còn có sự điều hòa lên của glycoprotein (Ib và IIb/IIIa), P-selectin và tăng tín hiệu P2Y12 là những sự kiện chính của nguy cơ huyết khối xơ vữa bên dưới. Vì vậy, các thuốc ức chế kết tập tiểu cầu chính là tác động quan trọng trong bệnh sinh huyết khối ĐM ở bệnh nhân ĐTĐ.
4.2.Về mặt chứng cứ:
Aspirin cho thấy hiệu quả rất rõ trên dự phòng thứ phát, nhưng trong dự phòng tiên phát trên bệnh nhân có hay không có ĐTĐ vẫn còn bàn cãi. 2 TNLS gần đây trên bệnh nhân ĐTĐ, aspirin đã thất bại khi chỉ ra tác dụng làm giảm biến cố tim mạch trong phòng ngừa tiên phát. Trong phân tích gộp ATT (Antithrombotic Trialist) năm 2009 từ 6 TNLS trên 95000 bệnh nhân trong đó có 4000 bệnh nhân ĐTĐ cho thấy lợi ích lớn nhất trên nhồi máu cơ tim không tử vong và giảm tỉ lệ biến cố mạch máu có lợi rõ ở nam nhưng không có lợi ở nữ. Điều quan trọng là phân tích này lại thấy aspirin không có lợi trên tử vong tim mạch và đột quị toàn bộ (RR 0.95, 95%CI 0.78-1.15), hiệu quả này là tương tự cho bệnh nhân ĐTĐ (RR 0.88, 95%CI 0.67-1.15) và không ĐTĐ (RR 0.87, 95%CI 0.79-0.96) [2].
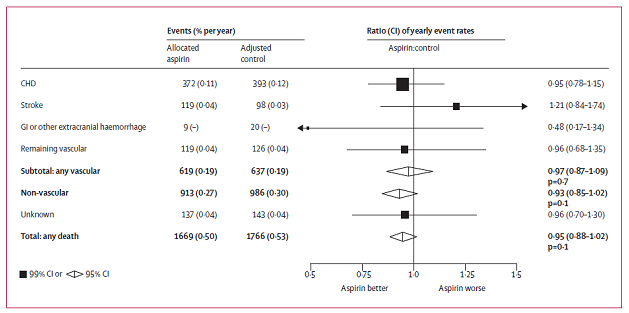
Hình 5: Tử vong theo nguyên nhân trong các TNLS về dự phòng tiên phát [2]
3 phân tích gộp đăng tải năm 2011 và 2012 từ 3 TNLS cũng cho kết quả tương tự như phân tích gộp ATT. Lợi ích của aspirin trong dự phòng tiên phát phụ thuộc trên nguy cơ tim mạch nền của bệnh nhân. Trong phân tích gộp 2012, lợi ích tim mạch đã vượt nguy cơ chảy máu ở bệnh nhân thuộc nhóm nguy cơ cao và nguy cơ sẽ vượt xa lợi ích khi nguy cơ biến cố tim mạch 10 năm < 5% [21]. Cần nhấn mạnh rằng bên cạnh nguy cơ biến cố tim mạch hằng năm, chúng ta cần đánh giá nguy cơ chảy máu tùy thuộc vào tuổi và tiền sử của loét dạ dày tá tràng. Sử dụng aspirin ở bệnh nhân < 21 tuổi là chống chỉ định vì nguy cơ bị hội chứng Reye.
4.3.Khuyến cáo hiện tại [1],[15]:
Xem xét điều trị aspirin (75-162 mg/ngày) như một chiến lược dự phòng tiên phát ở bệnh nhân ĐTĐ tip 1 và 2 tại mức nguy cơ tim mạch tăng (nguy cơ biến cố tim mạch 10 năm > 10%). Điều này bao gồm hầu hết những người nam > 50 tuổi hoặc nữ > 60 tuổi kèm ít nhất 1 yếu tố nguy cơ chính thêm vào như tiền sử gia đình mắc bệnh tim mạch, THA, hút thuốc lá, rối loạn mỡ máu hoặc tiểu albumin (C).
Aspirin không được khuyến cáo cho dự phòng bệnh tim mạch ở người ĐTĐ tại nguy cơ tim mạch thấp (nguy cơ biến cố tim mạch 10 năm < 5%, như là nam < 50 tuổi, nữ < 60 tuổi và không có thêm yếu tố nguy cơ tim mạch chính nào) vì tác dụng phụ gây xuất huyết che lấp lợi ích đạt đươc (C).
Những bệnh nhân trong độ tuổi này với nhiều yếu tố nguy cơ tim mạch (như nguy cơ biến cố tim mạch cho 10 năm 5-10%) dùng aspirin tùy thuộc vào quyết định của nhà lâm sàng (E).
Aspirin (75-162 mg/ngày) như dự phòng thứ phát được khuyến cáo ở những bệnh nhân ĐTĐ và đã có bệnh tim mạch (A).
Những bệnh nhân đã có bệnh tim mạch và có bằng chứng di ứng với aspirin, clopidogrel liều 75 mg/ngày nên được sử dụng (B).
Điều trị kết hợp aspirin (75-162 mg/ngày) và clopidogrel (75 mg/ngày) cho đến 1 năm sau hội chứng mạch vành cấp là hợp lý (B).
KẾT LUẬN:
Bệnh tim mạch ở bệnh nhân ĐTĐ là vấn đề thời sự và thách thức đối với các bác sĩ tim mạch-nội tiết nói riêng và cho toàn ngành y tế nói chung khi mà gánh nặng về bệnh tật cũng như tử vong của nó ngày càng gia tăng trên toàn thế giới. Cơ chế bệnh sinh phức tạp, biến chứng mạch máu nhỏ và mạch máu lớn vẫn tiếp diễn mặc dù đã kiểm soát tốt ĐH “trí nhớ chuyển hóa”. Các bằng chứng từ các nghiên cứu mới xuất hiện liên tục nhằm tìm ra những biện pháp hữu hiệu nhằm ngăn chặn hoặc làm chậm tiến trình nguy hiểm này. Khuyến cáo từ các hiệp hội uy tín trên thế giới còn có nhiều quan điểm chưa tương đồng, đặt biệt trong đánh giá nguy cơ, tầm soát BMV, các mức đích điều trị cũng như những đối tượng nào cần điều trị. Trong thực hành hằng ngày, người BS lâm sàng chúng ta cần tiếp cận cá thể hóa trên cơ sở cập nhật và so sánh các khuyến cáo hiện hành.
TÀI LIỆU THAM KHẢO:
1. American Diabetes Association (2013), “Standards of Medical care in Diabetes”, Diabetes Care, 36, supl 1, S11.
2. Antithrombotic Trialists’ (ATT) Collaboration, Baigent C, et al. (2009), ” Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials”, Lancet, 373, 1849.
3. Baigent C, Landray MJ, et al. (2011), “The effects of lowering LDL cholesterol with simvastatin plus ezetimibe in patients with chronic kidney disease (Study of Heart and Renal Protection): a randomised placebo-controlled trial.”, 377, 2118-2192.
4. Bangalore S, Kumar S, et al. (2011), “Blood pressure targets in subjects with type 2 diabetes mellitus/impaired fasting glucose: observations from traditional and bayesian random-effects meta-analyses of randomized trials”, Circulation, 123, 2799–2810.
5. Boden WE, Probstfield JL, et al. (2011), “AIM-HIGH Investigators. Niacin in patients with low HDL cholesterol levels receiving intensive statin therapy”, N Engl J Med, 365, 2255-2267.
6. Chamnan P, Simmons RK, et al. (2009), “Cardiovascular risk assessment scores for people with diabetes: a systematic review”, Diabetologia, 52, 2001-2014.
7. Cushman WC, Evans GW, et al. (2010), “Effects of intensive blood-pressure control in type 2 diabetes mellitus”, N Engl J Med, 362, 1575–1585.
8. Federation, I. D. (2011), “Global Burden: Prevalence and Projections, 2011 and 2030.
“,
9. George L Bakris (2013), “Treatment of hypertension in patients with diabetes mellitus”, www.uptodate.com,
10. Ginsberg HN, Elam MB, et al. (2010), “ACCORD Study Group. Effects of combination lipid therapy in type 2 diabetes mellitus”, N Engl J Med, 362, 1563-1574.
11. Hansson L, Zanchetti A, et al. (1998), “Hypertension Optimal Treatment (HOT) randomised trial. HOT Study Group”, Lancet, 351, 1755-1762.
12. Kearney PM, Blackwell L, et al. (2008), “Cholesterol Treatment Trialists (CTT) Collaborators. Efficacy of cholesterol- lowering therapy in 18,686 people with diabetes in 14 randomised trials of statins: a meta-analysis”, Lancet, 371, 117-125.
13. Kenneth Jamerson and Michael A. Weber (2008), “Benazepril plus Amlodipine or Hydrochlorothiazide for Hypertension in High-Risk Patients”, N Engl J Med, 359, 2417-2428.
14. Krauss RM (2004), “Lipids and Lipoproteins in Patients With Type 2 Diabetes”, Diabetes Care, 1496-1504.
15. Lars Ryden and Peter J. Grant (2013), “ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD”, European Heart Journal,
16. McGill JB, Bakris GL, et al. (2007), “beta-blocker use and diabetes symptom score: results from the GEMINI study”, Diabetes Obes Metab, 9, 408-17.
17. McGuire, D. K. (2012), “Diabetes and the Cardiovascular System”, Braunwaid’s Hear disease-textbook cardiovascular in medicine, 1392-1407.
18. Patel A, MacMahon S, et al. (2007), “Effects of a fixed combination of perindopril and indapamide on macrovascular and microvascular outcomes in patients with type 2 diabetes mellitus (the ADVANCE trial): a randomised controlled trial.”, Lancet, 370, 829-840.
19. Perk J, De Backer G, et al. (2012), “European Guidelines on cardiovascular disease prevention in clinical practice (version 2012”, Eur Heart J, 33, 1635-1701.
20. Reinhard G. Bretzel (2007), “Comorbidity of Diabetes Mellitus and Hypertension in the Clinical Setting: A Review of Prevalence, Pathophysiology, and Treatment Perspectives”, Clinical Therapeutics, 29, Supplement B,
21. Seshasai SR, Wijesuriya S, et al. (2012), “Effect of aspirin on vascular and nonvascular outcomes: meta-analysis of randomized controlled trials”, Arch Intern Med, 172, 209.







