Edoardo Bertero, Gerd Heusch, Thomas Münzel and Christoph Maack
Người dịch: THS.BS. NGUYỄN MINH KHA
Giảng viên Bộ môn Nội Tổng quát, Đại học Y Dược TP. Hồ Chí Minh
Hiệu đính: PGS. TS. BS.HOÀNG ANH TIẾN
PGĐ Trung tâm Tim mạch – BV trường ĐH Y Dược Huế
Phó trưởng Bộ môn Nội – Trường ĐH Y Dược Huế
Chuyển hoá của tế bào cơ tim trong giai đoạn bình thường và thiếu máu cục bộ
Tiêu thụ năng lượng của tế bào cơ tim được thực hiện chủ yếu ở ty thể thông qua quá trình oxy axít béo, những cũng có sự tham gia của glucose, lactate, ketone và mức độ ít hơn của axít amino93,94 (Hình 2). Năng lượng, dưới dạng ATP phụ thuộc chặt chẽ vào nguồn oxy. Hiệu quả của quá trình phosphoryl hoá được biểu hiện qua tỉ số phosphate trên oxy. Tỉ lệ P:O thay đổi phụ thuộc vào cơ chế được sử dụng để cung cấp để giảm hoá trị hoặc cao hơn đối với glucose (2,58) cao hơn đối với axít béo (2,33 cho axít palmitic).
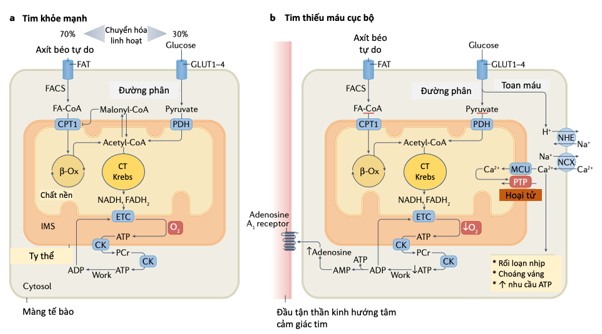
Hình 2. Sự kết hợp năng lượng-cơ học của tim ở tim bình thường và thiếu máu cục bộ
a | Trái tim khỏe mạnh chủ yếu tiêu thụ các axit béo và glucose để sản xuất ATP nhưng có thể thay đổi giữa các chất nền tùy thuộc vào sự sẵn có của chúng, điều kiện nội tiết tố và sự chuyển đổi trong hoạt động. Tế bào cơ tim chủ yếu hấp thụ các axit béo thông qua bộ chuyển hóa axit béo tại lưới nội cơ tương (FAT; còn được gọi là CD36), trong khi sự hấp thụ glucose được thực hiện qua trung gian của các chất vận chuyển glucose (GLUT1-GLUT4) và ở mức độ thấp hơn, kênh đồng vậnNatri-Glucose 1 (không thể hiện trong hình). Trong bào tương, tổng hợp axit béo-CoA (FACS) chuyển đổi axit béo thành acyl-CoA béo (FA-CoA), có thể được lưu trữ trong nhóm triacylglycerol của tế bào hoặc được vận chuyển vào chất nền ty thể thông qua con thoi creatine. Bước giới hạn tốc độ trong quá trình oxy hóa axit béo được xúc tác bởi carnitine palmitoyltransferase 1 (CPT1), hoạt động của nó phụ thuộc vào mức độ của chất ức chế nội sinh, malonyl-CoA. Bên trong ty thể, các axit béo được oxy hóa thành acetyl-CoA, được chuyển vào chu trình Krebs, nguồn cung cấp chất khử chính (NADH và FADH2) cho chuỗi vận chuyển điện tử (ETC). Đường phân là một nguồn chính khác của acetyl-CoA, được tạo ra từ pyruvate khi quá trình khử carbon oxy hóa bởi phức hợp pyruvate dehydrogenase (PDH). b | Trong tim thiếu máu cục bộ, quá trình chuyển hóa oxy hóa ở ty thể bị cản trở do cung cấp không đủ oxy, gây ra sự không phù hợp giữa tốc độ đường phân cao và quá trình oxy hóa pyruvate trong ty thể. Thủy phân ATP theo con đường đường phân tạo ra proton, do đó làm giảm pH của tế bào. Các proton được đưa ra khỏi tế bào thông qua kênh vận chuyển Na+ –H+ (NHE) với dẫn đến làm giảm gradient Na+ thúc đẩy quá trình đẩy Ca2+ra ngoài qua kênh Na+ –Ca2+ở lưới nội cơ tương (NCX). Nồng độ Na+ và Ca2+ trong tế bào tăng cao cản trở sự kết hợp kích thích – co bóp. Ngoài ra, sự gia tăng bệnh lý của nồng độ Ca2+ trong tế bào làm tăng quá tải Ca2+ của ty thể khi tái tưới máu, gây ra việc mở lỗ chuyển tiếp tính thấm (PTP). Mặc dù quá trình oxy hóa axit béo bị giảm trong giai đoạn thiếu máu cục bộ cấp tính, cơ tim sau thiếu máu cục bộ chủ yếu dựa vào quá trình oxy hóa axit béo để sản xuất ATP do tăng phân phối axit béo đến cơ tim và giảm mức độ malonyl-CoA, làm giảm ức chế CPT1. Trong quá trình thiếu máu cục bộ, sự phân hủy ATP làm tăng mức adenosine, có thể gây ra cơn đau thắt ngực tại các dây thần kinh giao cảm hướng tâm và hoạt động như một cơ chế kiểm soát chuyển hóa của trương lực vi mạch (không thể hiện trong hình). β-Oxi – β-oxi hóa; CK – creatine kinase; IMS –khoảng gian màng; MCU – đơn vị liên kết canxi ty thể; PCr – photphocreatine.
Thiếu máu cục bộ cơ tim làm suy giảm cung cấp oxy và năng lượng, cũng như loại bỏ các chất chuyển hóa. Chuyển hóa oxy hoá ở ty thể bị ức chế khi bị thiếu máu cục bộ và chuyển hóa yếm khí sẽ tăng lên, do đó làm thay đổi cân bằng giữa sử dụng glucose và axít béo95. Ngoài ra, sử dụng các thể keton cũng giảm khi bị thiếu máu cục bộ cấp tính96. Sự tích lũy các proton phóng thích bởi quá trình thuỷ phân gốc đường của ATP làm giảm pH nội bào97. Toan máu làm xấu đi tương tác co bóp và kích thích, tăng tiêu thụ ATP để duy trì cân bằng ion nội mô ở mức tiêu thụ tối ưu ATP cho các protein của sarcomere95. Đặc biệt, quá nhiều proton được đẩy ra để trao đổi với Na+ ở lưới nội cơ tương thông qua bơm Na+-H+ (NHE), làm tăng nồng độ Na+ nội bào một cách quá mức làm giảm quá trình đẩy Ca2+ ra ngoại bào thông qua kênh Na+-Ca2+ (Hình 2). Do đó, toan máu làm quá tải nồng độ Ca2+ nội bào và làm suy giảm sự kết hợp cơ học – năng lượng98. Đáp ứng chuyển hóa đối với tình trạng thiếu máu cục bộ cấp có sự khác biệt đáng kể từ đáp ứng dung nạp đến giảm dần lưu lượng máu mạch vành. Những thay đổi sau đó, tương hợp co bóp – tưới máu được bảo tồn, tiêu thụ ATP ở tế bào cơ tim giảm dần để tương xứng với mức độ giảm cung cấp oxy và sản phẩm lactate (một chất chỉ điểm cho chuyển hoá yếm khí) là thấp hoặc không có91,99.
Sự thay đổi trong chuyển hoá ở tim không bị giới hạn trong thiếu máu cục bộ cấp tính nhưng kéo dài ở tế bào cơ tim sau thiếu máu cục bộ, ở đó axít béo được hấp thu và quá trình oxy hoá diễn ra mạnh hơn so với với trong trạng thái bình thường100,01. Do đó, kích thích giao cảm sau giai đoạn thiếu máu cục bộ thúc đẩy quá trình phân huỷ mỡ102 và giảm bài biết insulin cũng như giảm nhạy cảm insulin ở ngoại biên. Ngoài ra, sự tích luỹ AMP sẽ kích hoạt protein kinase phụ thuộc AMP, chất này ức chế quá trình carboxy hoá acetyl CoA và giải phóng chất ức chế carnitine palmitoyltransferase 1 độc lập malonyl-CoA103. Ở tế bào cơ tim sau thiếu máu cục bộ, tăng tỷ lệ phân hủyoxy hoá axít béo không bắt cặp từ quá trình oxy hoá pyruvat (thông qua chu trình Randle) khi có sự hiện diện oxy, do đó làm chậm hồi phục pH sau tưới máu104. Tiếp theo đó, AMP phân huỷ tạo ra adenosine và nó tiếp tục giải phóng từ tế bào cơ tim, chúng được cho là liên quan đến đau thắt ngực bằng cách kích thích thụ thể adenosin (subtype 1A) tại đầu tận thần kinh hướng tâm cảm giác của tim105 (Hình 2).
Tóm lại, sự chuyển dịch các cơ chế chuyển hoá cơ tim hướng đến sử dụng tối đa axít béo để giảm hiệu suất sử dụng oxy (có nghĩa là năng lượng cơ học tạo ra ở tâm thất liên quan với tiêu thụ oxy) thông qua nhiều cơ chế khác nhau106. Những cơ chế này bao gồm giảm tỷ lệ P: O của axit béo so với quá trình oxy hóa glucose, sự không phù hợp do axit béo gây ra giữa quá trình đường phân và quá trình oxy hóa glucose trong ty thể, chu trình không hiệu quả của axit béo vào và ra khỏi nhóm triacylglycerol trong tế bào và sự không bắt cặp trong ty thể điều kiển bởi axít béo95.
Cơ chế hoạt động của các thuốc chống đau thắt ngực
Mục tiêu chung của các biện pháp điều trị đau thắt ngực là chuyển đổi sự cân bằng giữa cung cấp oxy cho vùng thiếu máu cục bộ và tiêu thụ oxy ở khu vực xa không thiếu máu cục bộ theo hướng cung cấp oxy nhiều hơn cho vùng thiếu máu cục bộ và tiêu thụ oxy ít hơn ở vùng không thiếu máu cục bộ72(Hình 3). Ba cơ chế chính có thể đạt được sự chuyển đổi cân bằng này là: cải thiện cung cấp oxy bằng cách gia tăng lưu lượng mạch vành hoặc bàng hệ (chẳng hạn như sử dụng nitrat hoặc chẹn kênh canxi); các can thiệp huyết động làm giảm tiêu thụ oxy ở vùng không thiếu máu cục bộ và làm giảm hiện tượng ăn cắp máu mạch vành thông qua giảm huyết áp và quan trọng hơn là tần số tim (nghĩa là, chẹn kênh canxi, thuốc chẹn beta hoặc ivabradine); và cải thiện hiệu quả sử dụng nhiên liệu trong tế bào cơ tim bằng cách thay đổi cơ chất ưa thích sang sử dụng glucose và tránh sử dụng axit béo, do trước đây có thể tạo ra nhiều ATP hơn cho bất kỳ lượng oxy tiêu thụ nào (chẳng hạn như khi sử dụng ranolazine hoặc trimetazidine) (Bảng 1). Ngoài ra, một số hợp chất có các đặc tính phụ trợ bằng cách kích hoạt các kênh ion ty thể ngăn chặn sự mở kênh chuyển tiếp tính thấm của ty thể và sự hoại tử hoặc chết theo chương trìnhtheo sau (gọi là điều hòa trước) bên cạnh các đặc tính giãn mạch của chúng (ví dụ đối với nicorandil).
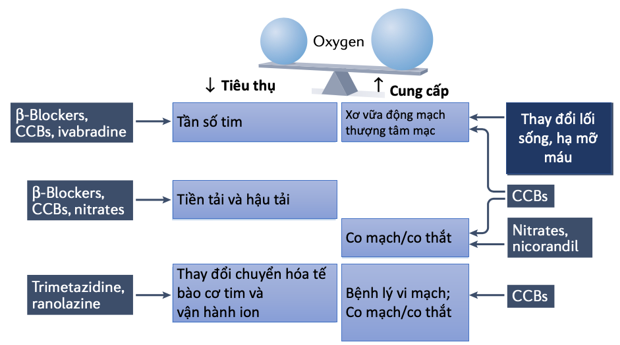
Hình 3. Các phương thức hoạt động của thuốc chống đau thắt ngực, ảnh hưởng đến việc tiêu thụ hoặc cung cấp oxy.
Thuốc chống đau thắt ngực giúp giảm triệu chứng bằng cách giảm tiêu thụ oxy của cơ tim hoặc tăng cung cấp O2. Các yếu tố quyết định chính đến mức tiêu thụ oxy của cơ tim là nhịp tim, sức co bóp của tim và sức căng của thành tâm thất. Thuốc chẹn β và thuốc chẹn kênh canxi (CCB) nhóm không DHP hoạt động ở nhiều cấp độ bằng cách giảm nhịp tim, sức co bóp và gánh sau thất. Ivabradine làm giảm nhịp tim một cách chọn lọc. Tác dụng dãn mạch của nitrat làm giảm tiền tải, một yếu tố quyết định sức căng thành của tâm thất. Một chiến lược khác để giảm tiêu thụ oxy của cơ tim là điều chỉnh sự ưa thích cơ chất bằng cách ức chế quá trình oxy hóa axit béo. Cung cấp oxy cho cơ tim được tăng lên nhờ các thuốc giãn mạch như CCB, nitrat và nicorandil, cũng có hiệu quả chống lại chứng đau thắt ngực do co thắt mạch.
Quá trình dãn mạch
Cơ chế tế bào của quá trình dãn mạch.
Nguyên tắc hoạt động của nitrat hữu cơ là giải phóng NO. Glyceryl trinitrate (GTN) và pentaerythritol tetranitrate (PETN) giải phóng NO sau khi kích hoạt sinh học bởi aldehyde dehydrogenase của ty thể, trong khi sự giải phóng NO từ isosorbide mononitrate (ISMN) và isosorbide dinitrate (ISDN) có nhiều khả năng phụ thuộc vào cytochrome P450. Trong tế bào cơ trơn mạch máu, NO kích hoạt enzym đích guanylyl cyclase hòa tan, làm tăng tính khả dụng sinh học của cGMP107 và kích hoạt các kinase protein phụ thuộc cGMP107, chẳng hạn như protein kinase 1 (cGK1) phụ thuộc cGMP (Hình 4). Quá trình thư giãn ở giai đoạn cuối của các quá trình này được thực hiện bởi các cơ chế phụ thuộc Ca2+ hoặc độc lập với Ca2+. cGK1 ức chế giải phóng Ca2+ phụ thuộc inositol 1,4,5-trisphosphat (IP3) thông qua quá trình phosphoryl hóa cGMP kinase liên kết với thụ thể IP3 và kích hoạt độ dẫn một lượng lớn Ca2+ được kích hoạt và kênh K+ hoạt hóa bằng điện thế (BKCa) thông qua quá trình phosphoryl hóa, dẫn đến tăng phân cực và giảm dòng Ca2+ đi vào và do đó làm giãn các tế bào cơ trơn mạch máu. Hơn nữa, cGK1 sẽ phosphoryl hoá và ức chế protein liên kết GTP nhỏ RhoA, làm giảm hoạt động của Rho kinase và duy trì hoạt động của myosin phosphatase chuỗi nhẹ, tất cả những đều nàyđưa đến giãn mạch (Hình 4).
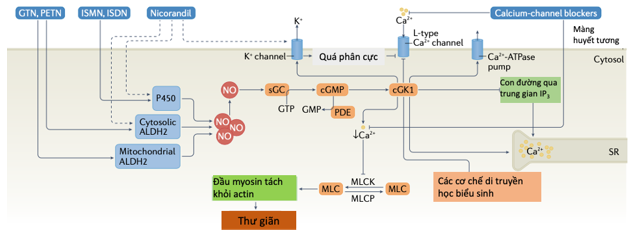
Hình 4. Cơ chế giãn mạch do nitrate.
Truyền tín hiệu nội bào qua trung gian nitric oxide (NO) –cGMP dẫn đến giãn tế bào cơ trơn liên quan đến việc kích hoạt kinase phụ thuộc cGMP (cGK1) và giảm nồng độ Ca2+ nội bào (thông qua ức chế kênh Ca2+ do thụ thể inositol 1,4,5-trisphosphate (IP3) điều chỉnh, kích hoạt các kênh K + với sự ức chế tiếp theo của các kênh Ca2+ phụ thuộc điện thế của tế bào thần kinh và kích hoạt bơm Ca2+), cũng như các cơ chế di truyền học biểu sinh, chẳng hạn như những thay đổi trong các biến đổi sau dịch mã của histone. Bằng chứng thực nghiệm cho thấy rằng sự chuyển dạng sinh học của glyceryl trinitrate (GTN) chỉ xảy ra trong ty thể khi đạt được nồng độ tại chỗ cao. ALDH2 – aldehyde dehydrogenase ty thể; ISDN – isosorbide dinitrate; ISMN – isosorbide mononitrate; MLCK – myosinlightchainkinase; MLCP – myosinlightchainphosphatase; PDE – phosphodiesterase; PETN – pentaerythritol tetranitrate; sGC – guanylyl cyclase hòa tan; SR – lưới chất dẻo113.
Nitrate hữu cơ.
Các nitrate hữu cơ, chẳng hạn như GTN, làm giãn sức chứa của các tĩnh mạch và những động mạch vành kích thước lớn và trung bình theo cách phụ thuộc NO108 (Hình 4), trong khi các tiểu động mạch vành và ngoại biên thường kháng nitrat109. Trong bệnh cảnh đau thắt ngực ổn định, giãn tĩnh mạch ưu tiên gây ra bởi liều nitrate chống thiếu máu cục bộ dẫn đến tăng sức chứa tĩnh mạch, do đó làm giảm tiền tải, giảm áp lực đổ đầy cuối tâm trương thất trái và giảm sức căng thành LV110. Hậu quả là làm giảm công cơ tim và giảm tiêu thụ oxy. Ngoài những tác dụng này, nitrate hữu cơ làm giãn các mạch vành hẹp lệch tâm và cải thiện lưu lượng máu bàng hệ110. Sự giãn mạch này cải thiện tái máu cơ tim, do đó tăng cường cung cấp oxy cho lớp dưới nội mạc, chủ yếu bằng cách giảm chèn ép ngoài mạch và tăng tổng độ dẫn mạch vành110,111.
Dung nạp nitrate và rối loạn chức năng nội mạc.
Hạn chế quan trọng của điều trị nitrate là xuất hiện dung nạp với nitrate và rối loạn chức năng nội mạc, điều này xảy ra trong vài ngày sau khi điều trị nitrate liên tục110,112. Stress oxi hoá được coi như là cơ chế chính của tình trạng dung nạp nitrate113. Ngược lại, nicorandil và hiệu ứng PETN không có hiện tượng dung nạp thuốc và rối loạn chức năng nội mạch do đặc tính quá phân cực của nicorandil114 và điều hoà do PETN của enzym chống oxy hoá haem-oxygenase trong cân bằng stress oxy hoá do nitrate115. Hơn thế, nitrite (NO2-) và nitrate là các dạng dự trữ của NO với tiềm năng điều trị quan trọng so với các hợp chất nitrate hữu cơ truyền thống116. Không những vậy, khi đánh giá các nghiên cứu trước đây về vấn đề an toàn của nhóm nitrate19-21, rất cần chứng minh hiệu quả của những nhóm thuốc này khi điều trị trên người, ví dụ qua các thử nghiệm lâm sàng lớn đánh giá trực tiếp kết cục.
Ở những bệnh nhân bị CCS và suy tim đồng thời, việc điều trị bằng nitrat giúp giảm quá tải cho thất trái đang bị suy bằng cách làm giảm sự đổ đầy tâm trương thông qua làm tăng sức chứa tĩnh mạch và làm giảm sự cản trở quá trình tống máu của thất trái chủ yếu do giãn các động mạch máu lớn110. Kế đến, tăng sự đàn hồi của hệ mạch động mạchlàm giảm cường độ, tần số và vận tốc của sóng phản xạ trong tuần hoàn động mạch. Do đó, những hiệu ứng huyết động này của nitrate làm tăng cung lượng tim, giảm áp lực đổ đầy thất trái và sức căng của thành tim, và làm giảm trào ngược van hai lá, do đó dịch chuyển áp lực cuối tâm trương thất trái và thể tích nhát bóp trở lại từ giá trị âm sang giá trị dương. Các nitrate hữu cơ cũng có hiệu quả trong điều trị đau thắt ngực do co thắt mạch (còn được gọi là đau thắt ngực biến thái)118. ISDN và một kết hợp liều cố định với hydralazine đã cải thiện kết cục và triệu chứng ở bệnh nhân Mỹ gốc Phi bị suy tim với phân suất tống máu giảm (HFrEF), trong đó khoảng 25% có nguyên nhân suy tim do thiếu máu cục bộ119. Ngược lại, điều trị ngắn hạn bệnh nhân suy tim với phân suất tống máu bảo tồn (HFpEF) bằng nitrat hít hoặc ISMN không cải thiện các triệu chứng hoặc khả năng gắng sức120,121.
Chẹn kênh canxi (CCBs – Calcium-channel blockers)
Cơ chế tác dụng chính của CCBs là ức chế dòng ion Ca2+ nhập bào qua kênh Ca2+ phụ thuộc điện thế type-L ở tế bào cơ trơn (Hình 4) và cơ tim. CCBs là tên gọi chung một nhóm nhiều hoạt chất khác nhau, được phân loại thành dihydropyridines (DHPs; ví dụ như amlodipine, felodipine, nicardipine, nifedipine và nisoldipine) và non-DHPs (diltiazem và verapamil), như đã giới thiệu ở trên122. Trong khi các thuốc nhóm non-DHPs ức chế nút xoang và nút nhĩ thất, làm chậm nhịp tim, thì DHPs có tác dụng chọn lọc mạch máu nhiều hơn, nên chúng có xu hướng làm tăng nhịp tim thông qua hoạt hóa phản xạ giao cảm. Vì vậy, các thuốc nhóm DHPs có thể lý tưởng để sử dụng chung với các thuốc chẹn beta122. Ngược lại, để tránh làm chậm nhịp tim và ức chế sức co bóp cơ tim quá mức, diltiazem và verapamil không nên được sử dụng chung với chẹn beta. CCBs là thuốc có tiềm năng dãn các động mạch vành lớn cũng như làm giảm kháng lực mạch vành và mạch máu ngoại biên. Khả năng chính chống đau thắt ngực có được nhờ cải thiện lưu lượng máu vành đến vùng cơ tim thiếu máu và làm giảm kháng lực ngoại biên, vì vậy giảm hậu tải và tiêu thụ oxy của cơ tim ở những bệnh nhân tăng huyết áp. CCBs (như amlodipine) là thuốc điều trị được chọn ở những bệnh nhân đau thắt ngực do co thắt mạch và ở những dạng đau thắt ngực mạch máu vi mạch118,123. Dù có hiệu quả điều trị đau thắt ngực, cả 2 nhóm DHP và non-DHPs đều không cải thiện kết cục ở những bệnh nhân CCS khi so sánh với giả dược10,11 hay chẹn beta7-9. Kết luận trên đã được xác nhận trong một phân tích gộp và một nghiên cứu đoàn hệ năm 201917. Do tác dụng ức chế sức co bóp cơ tim trực tiếp124, CCBs bị chống chỉ định ở những bệnh nhân suy tim có phân suất tống máu giảm (HFrEF), nhưng chúng an toàn để điều trị tăng huyết áp hay kiểm soát tần số trong rung nhĩ ở bệnh nhân suy tim có phân suất tống máu bảo tồn (HFpEF)125.
Giảm tiêu thụ oxy ở cơ tim
Chẹn β
Chẹn β là thuốc điều trị đau thắt ngực cổ điển. Tác dụng sơ khởi của ức chế β là làm chậm tần số tim, giúp tăng thời gian tâm trương, vì vậy kéo dài thời gian tưới máu vành. Đồng thời, chẹn β cũng làm giảm tiêu thụ oxy ở cơ tim khỏe mạnh, vì vậy hạn chế sự tái phân bố tưới máu không có lợi cho vùng cơ tim phía sau mạch vành bị hẹp. Cho dù chẹn β thực chất là một chất ức chế sức co bóp cơ tim, nhưng việc tăng lưu lượng máu cho vùng cơ tim cục bộ126– đặc biệt là tăng lưu lượng máu trên từng chu chuyển tim – giúp cho vùng cơ tim sau đoạn hẹp có khả năng tăng sức co bóp86,90. Quan sát rằng hoạt tính ức chế co bóp cơ tim làm tăng chức năng co bóp của vùng sau hẹp ủng hộ khái niệm tương hợp tưới máu–co bóp hơn là khái niệm mất cân bằng cung-cầu ở vùng cơ tim thiếu máu cục bộ. Điều đó cũng phù hợp với quan điểm rằng những lợi ích của chẹn β đạt được là nhờ làm giảm tần số tim và cải thiện lưu lượng máu cơ tim cục bộ90. Tuy nhiên, trong tình huống không có tác dụng giảm tần số tim (như khi sử dụng máy tạo pacing từ nhĩ), chẹn β làm giảm lưu lượng máu vì tác dụng co mạch vành thông qua các thụ thể α-adrenergic127 và làm giảm sức co bóp cơ tim cục bộ90. Ức chế các thụ thể β2-adrenergic cũng gây co mạch, vì vậy, các chất ức chế chọn lọc β1 hay ức chế β với hoạt tính dãn mạch (như carvedilol, nebivolol) được ưu tiên sử dụng hơn trong điều trị không chỉ đau thắt ngực mà còn trong tăng huyết áp hay suy tim.
Cho dù một vài nghiên cứu về tác động tiên lượng của chẹn β đã được tiến hành từ những năm 1990128, trước khi những tiến bộ đáng kể trong điều trị bệnh nhân CCS (như chiến lược tái tưới máu, sử dụng thuốc kháng kết tập tiểu cầu và statin) xuất hiện, nhưng nhiều phân tích hệ thống đã được thực hiện trong thập kỉ thứ nhất129 và thứ hai130,131 cũng những năm 2000, bao gồm những nghiên cứu trên bệnh nhân sử dụng các phương pháp điều trị chuẩn hiện nay. Theo những phân tích gộp đó, giá trị tiên lượng của ức chế β dường như giới hạn ở những bệnh nhân sau nhồi máu cơ tim (MI) có rối loạn chức năng thất trái hoặc được sử dụng sớm sau MI128,129, trong khi đó không có lợi ích nào được phát hiện ở nhóm bệnh nhân CCS không có tiền sử MI hay chức năng thất trái bảo tồn130,131. Cũng tương tự kết quả từ những nghiên cứu trên, carvedilol cải thiện tỉ lệ tử vong do mọi nguyên nhân và do tim mạch, giảm tần suất MI không tử vong khi so sánh với giả dược trong một thử nghiệm bệnh-chứng tiến cứu ở bệnh nhân sau nhồi máu cơ tim có phân suất tống máu ≤40%132.
Ivabradine
Ivabradine ức chế chọn lọc kênh điện thế “funny” (If) ở nút xoang, kênh này chịu trách nhiệm cho dòng Na+-K+ đi vào tế bào hoạt hóa bởi sự quá khử cực, hình thành khả năng tự khử cực ở các tế bào tạo nhịp ở nút xoang nhĩ133,134. Ức chế kênh này làm cho đường cong khử cực của điện thế động ở các tế bào xoang nhĩ đi xuống, vì vậy gây giảm tần số tim. Tương tự CCBs, ivabradine ức chế các kênh đặc hiệu khi ở trạng thái mở, vì vậy có đặc tính phụ thuộc vào tình trạng sử dụng kênh (cụ thể là, hiệu quả càng cao khi tần số tim càng cao)134. Ngược lại với chẹn β không chọn lọc, ivabradine không ảnh hưởng đến đường kính động mạch vành lúc nghỉ và không cản trở việc tăng lưu lượng mạch vành khi hoạt động135. Các tác nhân làm chậm nhịp tim chọn lọc, như ivabradine, cải thiện lưu lượng máu cơ tim và chức năng co bóp cục bộ trong mối quan hệ phù hợp giữa tưới máu-co bóp, mà không gây ảnh hưởng bất lợi khi vắng mặt khả năng giảm nhịp tim89,136,137.
Ivabradine không cải thiện kết cục ở bệnh nhân bệnh mạch vành ổn định và chức năng thất trái bảo tồn15 hoặc giảm13 lần lượt trong các thử nghiệm SIGNIFY và BEAUTIFUL. Tuy nhiên, ivabradine làm giảm tỉ lệ tử vong do nguyên nhân tim mạch và nhập viện do suy tim ở những bệnh nhân HfrEF138. Dựa trên những dữ liệu trên, người ta đề xuất rằng việc gia tăng tần số tim có thể chỉ được cân nhắc là một dấu hiệu nguy cơ thay vì một yếu tố hiệu chỉnh kết cục ở những bệnh nhân bệnh mạch vành ổn định không có suy tim trên lâm sàng139. Việc gia tăng nguy cơ tử vong do tim mạch và nhồi máu cơ tim không tử vong được quan sát ở những nhóm bệnh nhân đau thắt ngực ổn định mạn tính điều trị với ivabradine dẫn đến nhiều sự quan tâm về tính an toàn của ivabradine. Kết quả trên có thể được giải thích bằng việc sử dụng liều ivabradine cao hơn và mục tiêu tần số tim thấp hơn trong thử nghiệm đó (60 lần/phút)15 và việc sử dụng đồng thời CCB non-DHP, gây rối loạn chuyển hóa ivabradine do ức chế cytochrom P450 CYP3A4140. Những yếu tố này có thể góp phần gây nhịp chậm có tần suất phổ biến hơn (18%) trong thử nghiệm SIGNIFY khi so sánh với các thử nghiệm khác sử dụng ivabradine. Ngược lại, trong thử nghiệm BEAUTIFUL, ivabradine làm giảm nguy cơ các biến chứng tim mạch ở bệnh nhân có triệu chứng đau thắt ngực giới hạn141. Trong một phân tích gộp các nghiên cứu quan sát, ivabradine cho thấy hiệu quả và an toàn khi sử dụng chung với chẹn β. Nhìn chung, ivabradine dường như an toàn và cung cấp những lợi ích bổ sung khi sử dụng với các thuốc điều trị đau thắt ngực khác, tuy nhiên cần tránh kết hợp nó với verapamil hay diltiazem.
Xem tiếp kỳ sau







