1. ĐẠI CƯƠNG
Cân bằng giữa phòng ngừa huyết khối và nguy cơ xuất huyết là điều khó khăn trong việc xác định tiếp cận điều trị chống huyết khối tối ưu ở bệnh nhân rung nhĩ trải qua can thiệp mạch vành qua da [1-2].
ThS.BS TRẦN CÔNG DUY
Bộ môn Nội, Đại học Y Dược TP. Hồ Chí Minh
Thuốc kháng đông đường uống được chỉ định ở bệnh nhân rung nhĩ để phòng ngừa đột quỵ và thuyên tắc hệ thống, trong khi liệu pháp kháng tiểu cầu kép với ức chế P2Y12 và aspirin được chỉ định ở bệnh nhân trải qua can thiệp mạch vành qua da với đặt stent để phòng ngừa biến cố tim mạch bao gồm huyết khối trong stent [3-5]. Cho đến gần đây, hầu hết các hướng dẫn khuyến cáo điều trị cả kháng đông và kháng tiểu cầu kép (điều trị bộ ba) [3],[6-9]. Tuy nhiên, các nghiên cứu cho thấy các phác đồ điều trị này có liên quan với tỉ lệ xuất huyết cao, và những phát hiện này thúc đẩy nỗ lực tìm kiếm các chiến lược điều trị mới [10-15].
Hai tiếp cận mới đầy hứa hẹn đã được chỉ định để làm giảm nguy cơ xuất huyết ở những bệnh nhân được điều trị cả kháng đông và kháng tiểu cầu. Tiếp cận đầu tiên là sử dụng thuốc kháng đông đường uống không phải kháng vitamin K, trong đó thuốc đầu tiên của nhóm này là ức chế trực tiếp thrombin đường uống, dabigatran. Hai liều dabigatran cho thấy hiệu quả trong phòng ngừa đột quỵ ở bệnh nhân rung nhĩ bao gồm những người đang điều trị kháng tiểu cầu đơn hoặc kép [16-17]. Tiếp cận thứ hai là loại bỏ aspirin ra khỏi điều trị chuẩn và sử dụng ức chế P2Y12 phối hợp với thuốc kháng đông đường uống. Trong một thử nghiệm quy mô trung bình ở bệnh nhân trải qua can thiệp mạch vành qua da và có chỉ định kháng đông, nguy cơ xuất huyết (và biến cố mạch máu) thấp hơn ở nhóm tiếp cận điều trị kép so với nhóm điều trị bộ ba [18]. Dữ liệu từ một thử nghiệm khác ủng hộ sử dụng điều trị bộ ba trong khoảng thời gian ngắn hơn [19]. Một thử nghiệm gần đây, PIONEER AF-PCI, nhận thấy nguy cơ xuất huyết thấp hơn với chế độ rivaroxaban giảm liều và một thuốc ức chế P2Y12 so với điều trị bộ ba chuẩn [20-22]. Vào cuối tháng 8/2017 vừa qua, kết quả của thử nghiệm RE-DUAL PCI (Randomized Evaluation of Dual Antithrombotic Therapy with Dabigatran versus Triple Therapy with Warfarin in Patients with Nonvalvular Atrial Fibrillation Undergoing Percutaneous Coronary Intervention) đã được công bố góp phần mang lại dữ liệu chứng cứ cho tiếp cận điều trị bệnh nhân rung nhĩ sau can thiệp mạch vành qua da. Bài báo này sẽ cập nhật phương pháp nghiên cứu và kết quả của thử nghiệm này để các bác sĩ có cái nhìn rõ ràng hơn về vấn đề thực hành lâm sàng này.
2. THỬ NGHIỆM RE-DUAL PCI
2.1 PHƯƠNG PHÁP NGHIÊN CỨU
RE-DUAL PCI là một thử nghiệm lâm sàng đa trung tâm, tiến cứu, ngẫu nhiên, nhãn mỡ, kết cục mù, có đối chứng, giai đoạn 3b.
2.1.1 Đối tượng bệnh nhân
Nam hoặc nữ ít nhất 18 tuổi được nhận vào thử nghiệm nếu có rung nhĩ không do bệnh van tim và trải qua can thiệp mạch vành qua da với stent thường hoặc stent phủ thuốc trong vòng 120 giờ (Bảng 1) [23]. Rung nhĩ không do bệnh van tim có thể kịch phát, dai dẳng hoặc vĩnh viễn, nhưng không do rối loạn thứ phát có thể hồi phục được trừ khi dự đoán cần điều trị dài hạn kháng đông đường uống. Các bệnh nhân đã nhận điều trị kháng đông đường uống trước can thiệp mạch vành qua da và những người chưa nhận kháng đông đường uống đều có thể thích hợp nhận vào. Chỉ định can thiệp mạch vành qua da có thể là hội chứng mạch vành cấp hoặc bệnh động mạch vành ổn định. Tiêu chuẩn loại trừ chính là sự hiện diện của van cơ học hoặc van sinh học, suy thận nặng (độ thanh lọc creatinine < 30 mL/phút) hoặc các bệnh đồng mắc nặng khác.
Bảng 1. Tiêu chuẩn chọn bệnh và tiêu chuẩn loại trừ của thử nghiệm RE-DUAL PCI
|
Tiêu chuẩn chọn bệnh |
|
• Tuổi ≥18 • Rung nhĩ không do bệnh van tim: kịch phát, dai dẳng hoặc vĩnh viễn nhưng không do rối loạn thứ phát có thể hồi phục (như NMCT, thuyên tắc phổi, phẫu thuật gần đây, viêm màng ngoài tim, hoặc nhiễm độc giáp) trừ khi dự định kháng đông đường uống dài hạn • Đang điều trị kháng đông đường uống (warfarin, kháng vitamin K khác hoặc kháng đông đường uống không phải kháng vitamin K) hoặc chưa điều trị trước CTMVQD • Hội chứng mạch vành cấp (NMCT ST chênh lên/NMCT không ST chênh lên/Đau thắt ngực không ổn định) được điều trị thành công bằng CTMVQD và đặt stent (stent thường hoặc stent phủ thuốc) hoặc bệnh mạch vành ổn định với ≥1 sang thương phù hợp CTMVQD đã được điều trị thành công bằng CTMVQD và đặt stent (stent thường hoặc stent phủ thuốc) • Có khả năng cung cấp đồng thuận tham gia nghiên cứu |
|
Tiêu chuẩn loại trừ |
|
· Van tim nhân tạo cơ học hoặc sinh học • Choáng tim trong lúc nằm viện • Sử dụng thuốc tiêu sợi huyết trong vòng 24 giờ phân nhóm ngẫu nhiên có thể làm bệnh nhân có nguy cơ xuất huyết cao • Đột quỵ hoặc phẫu thuật lớn trong vòng 1 tháng trước lần khám tầm soát • Đã hoặc đang chờ ghép tạng • Tiền sử xuất huyết nội nhãn, tủy sống, sau phúc mạc hoặc trong khớp do chấn thương trừ khi đã loại bỏ hoặc sửa chữa vĩnh viễn yếu tố nguyên nhân. • Xuất huyết tiêu hóa trong vòng 1 tháng trước tầm soát trừ khi đã loại bỏ vĩnh viễn nguyên nhân • Xuất huyết nặng, bao gồm xuất huyết đe dọa tính mạng, trong vòng 1 tháng trước lần khám tầm soát • Rối loạn xuất huyết hoặc cơ địa xuất huyết (như bệnh von Willebrand, hemophilia A hoặc B hoặc rối loạn xuất huyết di truyền khác, tiền sử xuất huyết trong khớp tự phát hoặc xuất huyết kéo dài sau phẫu thuật/can thiệp) • Thiếu máu (Hb < 10 g/dL) hoặc giảm tiểu cầu (bao gồm do heparin; số lượng tiểu cầu < 100 × 109/L) lúc tầm soát • Suy thận nặng (độ thanh lọc creatinine ước đoán < 30 mL/ph, tính bằng phương trình Cockcroft-Gault) lúc tầm soát • Bệnh gan tiến triển (như ≥ 1 lần tiền sử và dai dẳng ALT, AST, hoặc AP > 3× ULN); viêm gan siêu vi A, B hoặc C đang hoạt động đã biết • Ung thư hoặc xạ trị gần đây (≤ 6 tháng) trừ khi tuổi thọ sống thêm dự đoán > 36 tháng • Cần điều trị ketoconazole, itraconazole, posaconazole, cyclosporine, tacrolimus, dronedarone, rifampicin, phenytoin, carbamazepine, St. John’s wort, hoặc bất kỳ thuốc độc tế bào/ức chế tủy đường toàn thân • Cần điều trị liên tục thuốc kháng viêm non-steroid • Đã biết dị ứng với dabigatran etexilate hoặc viên kháng vitamin K hoặc tá dược • Chống chỉ định điều trị kháng đông đường uống, clopidogrel, ticagrelor hoặc aspirin • Trước khi mãn kinh (chu kỳ kinh cuối cùng ≤ 1 năm trước tầm soát) và: đang mang thai hoặc cho con bú; không triệt sản ngoại khoa; có khả năng mang thai và không (có kế hoạch tiếp tục) thực hiện biện pháp ngừa thai chấp nhận được trong quá trình thử nghiệm |
2.1.2 Điều trị
Bệnh nhân đã nhận điều trị chống huyết khối chuẩn đối với thủ thuật can thiệp mạch vành qua da. Sau can thiệp mạch vành qua da, các bệnh nhân thích hợp nhận vào thử nghiệm được phân ngẫu nhiên để nhận một trong ba điều trị: điều trị kép với dabigatran etexilate (110 mg hai lần/ngày) cộng clopidogrel hoặc ticagrelor (nhóm điều trị kép 110 mg), điều trị kép với dabigatran etexilate (150 mg 2 lần/ngày) cộng clopidogrel hoặc ticagrelor (nhóm điều trị kép 150 mg), hoặc điều trị bộ ba với warfarin cộng aspirin (≤ 100 mg/ngày) và clopidogrel hoặc ticagrelor (nhóm điều trị bộ ba). Trong nhóm điều trị bộ ba, aspirin được ngưng sau 1 tháng ở bệnh nhân đặt stent thường và sau 3 tháng ở bệnh nhân đặt stent phủ thuốc.
Bệnh nhân được phân nhóm ngẫu nhiên theo nhóm tuổi (không cao tuổi hoặc cao tuổi [< 80 hoặc ≥ 80 tuổi; < 70 hoặc ≥ 70 tuổi ở Nhật) và vùng (Hoa Kỳ, Nhật hoặc các quốc gia khác). Tất cả bệnh nhân ở Hoa Kỳ và bệnh nhân không cao tuổi ở các nước khác được phân ngẫu nhiên vào nhóm điều trị kép 110 mg, nhóm điều trị kép 150 mg hoặc nhóm điều trị bộ ba theo tỉ số 1:1:1. Bệnh nhân cao tuổi ở ngoài Hoa Kỳ được phân ngẫu nhiên vào nhóm điều trị kép 110 mg hoặc nhóm điều trị bộ ba theo tỉ số 1:1; họ không thích hợp nhận vào nhóm điều trị kép 150 mg theo khuyến cáo của nhãn dabigatran ở các nước đó.
Tất cả bệnh nhân sử dụng clopidogrel (75 mg/ngày) hoặc ticagrelor (90 mg/ngày) ít nhất 12 tháng sau phân nhóm ngẫu nhiên; lựa chọn thuốc theo quyết định của người nghiên cứu. Liều warfarin được điều chỉnh để đảm bảo chỉ số INR (international normalized ratio) trong khoảng 2,0 đến 3,0. Bệnh nhân được theo dõi mỗi 3 tháng. Tất cả bệnh nhân có lần khám vào lúc kết thúc điều trị khi ngưng thuốc kháng đông thử nghiệm (dabigatran hoặc warfarin); một lần khám theo dõi 4 tuần sau đó. Thử nghiệm tiếp tục đến khi tất cả bệnh nhân có tối thiểu 6 tháng theo dõi và dự đoán đạt được số biến cố kết cục mục tiêu.
2.1.3 Kết cục
Kết cục chính là biến cố lần đầu xuất huyết nặng hoặc không nặng có ý nghĩa lâm sàng được định nghĩa bởi Hội Huyết Khối và Cầm Máu Quốc Tế (International Society on Thrombosis and Hemostatsis). Kết cục phụ chủ yếu là tổ hợp kết cục của biến cố thuyên tắc huyết khối (nhồi máu cơ tim, đột quỵ hoặc thuyên tắc hệ thống), tử vong hoặc tái thông mạch máu ngoài chương trình (can thiệp mạch vành qua da hoặc phẫu thuật bắc cầu mạch vành). Các kết cục phụ khác bao gồm tổ hợp kết cục của biến cố thuyên tắc huyết khối hoặc tử vong, cũng như biến cố thuyên tắc huyết khối riêng và huyết khối trong stent.
2.2 KẾT QUẢ
2.2.1 Đặc điểm dân số nghiên cứu
Từ 21/07/2014 đến 31/10/2016, 2.725 bệnh nhân được phân nhóm ngẫu nhiên ở 414 trung tâm của 41 quốc gia. Chỉ 6 bệnh nhân (0,2 %) bị mất theo dõi và không có dữ liệu về tình trạng sống còn. 2,0% bệnh nhân ở nhóm điều trị kép 110 mg, 0,5% bệnh nhân ở nhóm điều trị kép 150 mg và 3,9% ở nhóm điều trị bộ ba rút khỏi nghiên cứu và không có dữ liệu về tình trạng sống còn tại cuối thời điểm thử nghiệm. Ở những bệnh nhân hoàn thành thử nghiệm, 130 (13,3%) ở nhóm điều trị kép 110 mg, 99 (13,0%) ở nhóm điều trị kép 150 mg, và 163 (16,6%) ở nhóm điều trị bộ ba ngưng sớm thuốc kháng đông thử nghiệm. Thời gian điều trị trung vị với thuốc kháng đông thử nghiệm là 12,3 tháng, và thời gian theo dõi trung vị là 14,0 tháng.
Đặc điểm ban đầu của bệnh nhân được trình bày ở Bảng 2. Tuổi trung vị là 70,8 (16,8% bệnh nhân ở nhóm cao tuổi), và chỉ định chính can thiệp mạch vành qua da là hội chứng mạch vành cấp ở 50,5% bệnh nhân. Stent phủ thuốc được sử dụng ở 82,6% bệnh nhân. Hầu hết bệnh nhân sử dụng clopidogrel; chỉ 12,0% dùng ticagrelor. Trong nhóm điều trị bộ ba, tỉ lệ trung vị thời gian trong ngưỡng INR điều trị (tính theo phương pháp Rosendaal và cs [26]) là 64%.
|
Bảng 2. Đặc điểm ban đầu của dân số nghiên cứu |
||||
|
Đặc điểm |
Điều trị kép với Dabigatran,110 mg(N= 981) |
Điều trị bộ ba với Warfarin (N= 981) |
Điều trị kép với Dabigatran,150 mg(N= 763) |
Điều trị bộ ba với Warfarin(N= 764) |
|
Tuổi — năm |
71.5±8.9 |
71.7±8.9 |
68.6±7.7 |
68.8±7.7 |
|
Nhóm cao tuổi — số BN (%) |
225 (22.9) |
225 (22.9) |
8 (1.0) |
8 (1.0) |
|
Giới nam — số BN (%) |
728 (74.2) |
750 (76.5) |
592 (77.6) |
594 (77.7) |
|
Đái tháo đường — số BN/tổng số (%) |
362/981 (36.9) |
371/980 (37.9) |
260/763 (34.1) |
303/763 (39.7) |
|
Tiền sử đột quỵ — số BN/tổng số (%) |
74/981 (7.5) |
100/980 (10.2) |
52/763 (6.8) |
77/763 (10.1) |
|
Điểm số CHA2DS2-VASc |
3.7±1.6 |
3.8±1.5 |
3.3±1.5 |
3.6±1.5 |
|
Điểm số HAS-BLED |
2.7±0.7 |
2.8±0.8 |
2.6±0.7 |
2.7±0.8 |
|
Độ thanh lọc creatinine — ml/ph |
76.3±28.9 |
75.4±29.1 |
83.7±31.0 |
81.3±29.6 |
|
Tiền sử NMCT — số BN (%) |
237 (24.2) |
268 (27.3) |
194 (25.4) |
211 (27.6) |
|
Tiền sử CTMVQD — số BN/tổng số (%) |
326/981 (33.2) |
347/980 (35.4) |
239/763 (31.3) |
272/763 (35.6) |
|
Tiền sử PTBCMV — số BN/tổng số (%) |
97/981 (9.9) |
111/980 (11.3) |
79/763 (10.4) |
87/763 (11.4) |
|
Loại rung nhĩ— số BN/tổng số (%) |
||||
|
Dai dẳng |
174/981 (17.7) |
178/980 (18.2) |
132/763 (17.3) |
149/763 (19.5) |
|
Vĩnh viễn |
320/981 (32.6) |
318/980 (32.4) |
250/763 (32.8) |
238/763 (31.2) |
|
Kịch phát |
487/981 (49.6) |
484/980 (49.4) |
380/763 (49.8) |
376/763 (49.3) |
|
Chỉ định CTMVQD — số BN (%) |
||||
|
ĐTNOĐ hoặc NPGS dương tính |
433 (44.1) |
429 (43.7) |
320 (41.9) |
339 (44.4) |
|
Hội chứng mạch vành cấp |
509 (51.9) |
475 (48.4) |
391 (51.2) |
369 (48.3) |
|
Phẫu thuật chương trình |
156 (15.9) |
168 (17.1) |
138 (18.1) |
134 (17.5) |
|
Khác |
43 (4.4) |
62 (6.3) |
65 (8.5) |
50 (6.5) |
|
Loại stent — số BN/tổng số (%) |
||||
|
Stent phủ thuốc |
804/979 (82.1) |
826/976 (84.6) |
621/762 (81.5) |
638/759 (84.1) |
|
Stent thường |
148/979 (15.1) |
133/976 (13.6) |
123/762 (16.1) |
107/759 (14.1) |
|
Stent phủ thuốc và stent thường |
19/979 (1.9) |
12/976 (1.2) |
10/762 (1.3) |
9/759 (1.2) |
|
Khác |
8/979 (0.8) |
5/976 (0.5) |
8/762 (1.0) |
5/759 (0.7) |
BN: bệnh nhân; CTMVQD: can thiệp mạch vành qua da; PTBCMV: phẫu thuật bắc cầu mạch vành; ĐTNOĐ: đau thắt ngực ổn định; NPGS: nghiệm pháp gắng sức
2.2.2 Kết cục chính
Tỉ lệ mới mắc kết cục chính (biến cố lần đầu xuất huyết nặng hoặc không nặng có ý nghĩa lâm sàng) là 15,4% ở nhóm điều trị kép 110 mg so với 26,9% ở nhóm điều trị bộ ba (tỉ số nguy cơ [TSNC]: 0,52; khoảng tin cậy [KTC] 95%: 0,42 – 0,63; P < 0,001 đối với tính không thua kém; P < 0,001 đối với tính ưu thế) và 20,2% ở nhóm điều trị kép 150 mg so với 25,7% ở nhóm điều trị bộ ba (TSNC: 0,72; KTC 95%: 0,58 – 0,88; P < 0,001 đối với tính không thua kém) (Hình 1A và 1B). Các kết quả của phân tích theo ý định điều trị (intention-to-treat analysis) phù hợp với các kết quả của phân tích đang điều trị (on-treatment analysis) và ở các phân nhóm lớn. Tỉ lệ xuất huyết nặng và xuất huyết chung thấp hơn có ý nghĩa ở cả hai nhóm điều trị kép so với điều trị bộ ba. Ngoài ra, khi định nghĩa xuất huyết nặng theo tiêu chuẩn TIMI (Thrombolysis in Myocardial Infarction), tỉ lệ ở cả hai nhóm điều trị kép thấp hơn nhóm điều trị bộ ba: 1,4% ở nhóm điều trị kép 110 mg so với 3,8% ở nhóm điều trị bộ ba (TSNC: 0,37; KTC 95%: 0,20 – 0,68; P = 0,002) và 2,1% ở nhóm điều trị kép 150 mg so với 3,9% ở nhóm điều trị bộ ba (TSNC: 0,51; KTC 95%: 0,28 – 0,93; P = 0,03). Xuất huyết nội sọ thì hiếm nhưng cũng xảy ra với tỉ lệ thấp hơn ở nhóm điều trị kép 110 mg so với nhóm điều trị bộ ba (0,3% so với 1,0%; TSNC: 0,30; KTC 95%: 0,08 – 1,07; P = 0,06) và tỉ lệ thấp hơn ở nhóm điều trị kép 150 mg so với nhóm điều trị bộ ba (0,1% so với 1,0%; TSNC: 0,12; KTC 95%: 0,02 – 0,98; P = 0,047).
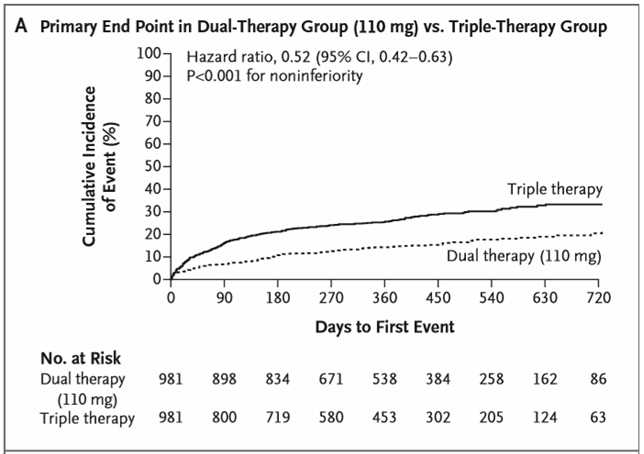
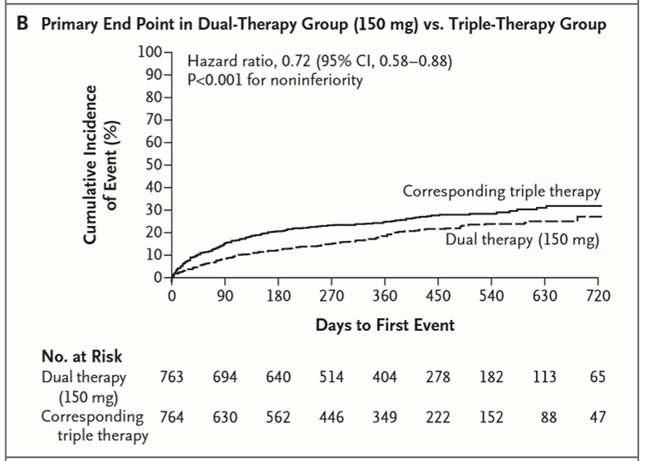
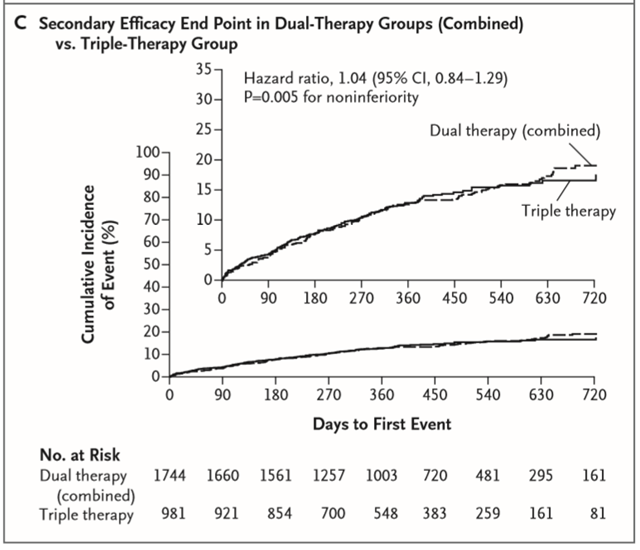
Hình 1. Kết cục chính và kết cục phụ. A: Kết cục chính ở nhóm điều trị kép 110 mg so với nhóm điều trị bộ ba. B: kết cục chính ở nhóm điều trị kép 150 mg so với nhóm điều trị bộ ba. C: kết cục phụ về hiệu quả ở nhóm điều trị kép (phối hợp) so với nhóm điều trị bộ ba. (Chụp từ tài liệu gốc)
2.2.3 Kết cục phụ
Tỉ lệ mới mắc tổ hợp kết cục hiệu quả của biến cố thuyên tắc huyết khối (nhồi máu cơ tim, đột quỵ hoặc thuyên tắc hệ thống), tử vong hoặc tái thông mạch máu ngoài chương trình là 13,7% ở hai nhóm điều trị kép so với 13,4% ở nhóm điều trị bộ ba (TSNC: 1,04; KTC 95%: 0,84 – 1,29; P = 0,005 đối với tính không thua kém). Tỉ lệ là 15,2% ở nhóm điều trị kép 110 mg so với 13,4% ở nhóm điều trị bộ ba (TSNC: 1,13; KTC 95%: 0,90 – 1,43; P = 0,30) và 11,8% ở nhóm điều trị kép 150 mg so với 12,8% ở nhóm điều trị bộ ba (TSNC: 0,89; KTC 95%: 0,67 – 1,19; P = 0,44). Các kết quả của phân tích theo ý định điều trị phù hợp với kết quả của phân tích đang điều trị và các phân tích dưới nhóm bao gồm bệnh nhân hội chứng mạch vành cấp và đặt stent phủ thuốc. Tỉ lệ tổ hợp kết cục biến cố thuyên tắc huyết khối hoặc tử vong là 9,6% ở hai nhóm điều trị kép so với 8,5% ở nhóm điều trị bộ ba (TSNC: 1,17; KTC 95%: 0,90 – 1,53; P = 0,11 đối với tính không thua kém).
Số bệnh nhân huyết khối trong stent thì thấp; các biến cố xảy ra ở 15 bệnh nhân (1,5%) ở nhóm điều trị kép 110 mg so với 8 (0,8%) ở nhóm điều trị bộ ba (P = 0,15) và ở 7 bệnh nhân (0,9%) ở nhóm điều trị kép 150 mg so với 7 (0,9%) ở nhóm điều trị bộ ba (P = 0,98).
2.2.4 Biến cố có hại nặng
Phân tích các biến cố có hại bao gồm các bệnh nhân đã nhận ít nhất một liều thuốc kháng đông thử nghiệm. Các biến cố có hại nặng xảy ra ở 42,7% bệnh nhân ở nhóm điều trị kép 110 mg; 39,6% ở nhóm điều trị kép 150 mg, và 41,8% ở nhóm điều trị bộ ba. Các biến cố có hại nặng gây tử vong xảy ra trong điều trị ở 38 bệnh nhân (3,9%) ở nhóm điều trị kép 110 mg, 24 (3,2%) ở nhóm điều trị kép 150 mg, và 41 (4,3%) ở nhóm điều trị bộ ba.
3. BÀN LUẬN
Thử nghiệm RE-DUAL PCI cho thấy rằng ở những bệnh nhân rung nhĩ trải qua can thiệp mạch vành qua da, hai chế độ điều trị kháng đông khác nhau với dabigatran (110 mg hoặc 150 mg 2 lần/ngày) cộng với ức chế P2Y12 (clopidogrel hoặc ticagrelor) dẫn đến nguy cơ xuất huyết nặng hoặc không nặng có ý nghĩa lâm sàng thấp hơn điều trị bộ ba với warfarin. Ngoài ra, điều trị kép với dabigatran không thua kém điều trị bộ ba với warfarin về tổ hợp kết cục hiệu quả của biến cố thuyên tắc huyết khối, tử vong hoặc tái thông mạch máu ngoài chương trình. Đối với kết cục chính về xuất huyết nặng hoặc không nặng có ý nghĩa lâm sàng, sự khác biệt nguy cơ giữa nhóm điều trị kép 110 mg và nhóm điều trị bộ ba là 48% và sự khác biệt nguy cơ giữa nhóm điều trị kép 150 mg và nhóm điều trị bộ ba là 28% trong khoảng 1 năm điều trị. Tỉ lệ xuất huyết nặng ISTH và TIMI ở cả hai nhóm điều trị kép thấp hơn nhóm điều trị bộ ba, các phát hiện này khẳng định lại tính an toàn của dabigatran ở các chế độ điều trị này thậm chí với liều 150 mg. Các phát hiện này cho thấy lợi ích lâm sàng ròng của chế độ điều trị kép và các nhà lâm sàng có thể chọn một trong hai chế độ này dựa vào nguy cơ xuất huyết của bệnh nhân và nguy cơ biến cố thuyên tắc huyết khối.
Các chiến lược điều trị kép với dabigatran kết hợp hai thay đổi so với điều trị chuẩn trước đây (điều trị bộ ba với warfarin). Thứ nhất, thử nghiệm đánh giá hai liều của dabigatran đã được chấp thuận rộng rãi trên thế giới và cho thấy hiệu quả và an toàn [16]. Lợi ích về tỉ lệ xuất huyết thấp hơn đã được ghi nhận trước đây trong thử nghiệm RE-LY (Randomized Evaluation of Long-Term Anticoagulation Therapy) nhưng có vẻ tăng trong dân số bệnh nhân này với những người có nguy cơ xuất huyết cao và ngưng aspirin sau can thiệp mạch vành qua da tại thời điểm phân nhóm ngẫu nhiên. RE-DUAL PCI là một thử nghiệm ngẫu nhiên lớn củng cố giá trị của quan niệm trong nghiên cứu WOEST (What is the Optimal Antiplatelet and Anticoagulant Therapy in Patients with Oral Anticoagulation and Coronary Stenting) [18] nhưng với độ mạnh thống kê lớn hơn.
Ở nhóm điều trị bộ ba với warfarin, thời gian điều trị aspirin là 1 đến 3 tháng; tiếp cận này phù hợp với thực hành và các hướng dẫn [27-28]. Thực ra, điều trị bộ ba thay đổi thành điều trị kép trong phần lớn thời gian thử nghiệm nhưng nguy cơ xuất huyết của nhóm điều trị kép 110 mg và 150 mg thấp hơn khoảng ½ và ¼ so với nhóm điều trị bộ ba. Kết quả của thử nghiệm PIONEER AF-PCI (Open-Label, Randomized, Controlled, MultiCenter Study Exploring Two Treatment Strategies of Rivaroxaban and a Dose-Adjusted Oral Vitamin K Antagonist Treatment Strategy in Subjects with Atrial Fibrillation who Undergo Percutaneous Coronary Intervention) phát hiện tỉ lệ xuất huyết có ý nghĩa lâm sàng khi điều trị kép với rivaroxaban cũng như tỉ lệ xuất huyết của điều trị bộ ba với rivaroxaban liều thấp ít hơn tỉ lệ xuất huyết của điều trị bộ ba với warfarin [20]. Liều của rivaroxaban được sử dụng trong nghiên cứu PIONEER AF-PCI thấp hơn liều phòng ngừa đột quỵ trong thử nghiệm ROCKET-AF (Rivaroxaban Once Daily Oral Direct Factor Xa Inhibition Compared with Vitamin K Antagonism for Prevention of Stroke and Embolism Trial in Atrial Fibrillation) [29].
Về tổ hợp kết cục hiệu quả, thử nghiệm đáp ứng được tiêu chuẩn đã xác định được. Thử nghiệm này với 2.725 bệnh nhân không đủ độ mạnh để cho phép so sánh từng thành phần riêng lẻ của kết cục này. RE-DUAL PCI nghiên cứu liều của dabigatran đã được chứng minh trước đây về phòng ngừa đột quỵ ở bệnh nhân rung nhĩ (trong thử nghiệm RE-LY gồm 18.000 bệnh nhân). Bất kỳ chế độ điều trị chống huyết khối nào cũng cần cân bằng giữa nguy cơ xuất huyết và phòng ngừa biến cố thuyên tắc huyết khối. Trong những năm gần đây, các hướng dẫn lâm sàng và các tuyên bố đồng thuận [1], [3] đã phát triển và đề nghị rằng điều trị chống huyết khối kép là một lựa chọn ở nhóm dân số bệnh nhân này (mức độ khuyến cáo IIb). Những phát hiện của RE-DUAL PCI trong đánh giá hai chế độ điều trị kép với dabigatran đã cung cấp thêm chứng cứ ủng hộ sự thay đổi khuyến cáo của các hướng dẫn lâm sàng.
Tuy nhiên, thử nghiệm này có một số hạn chế. Một là, nhóm nghiên cứu đã sửa đề cương và nhận vào số bệnh nhân ít hơn dự kiến ban đầu, điều này làm hạn chế độ mạnh của thử nghiệm để kiểm tra hiệu quả theo liều dabigatran. Để so sánh tổ hợp kết cục hiệu quả, nhóm nghiên cứu kết hợp hai nhóm điều trị kép để có độ mạnh phân tích hợp lý (83,6%). Hai là, mặc dù giới hạn không thua kém của thử nghiệm dựa vào các nghiên cứu rung nhĩ trước đây nhưng giới hạn này được sử dụng cho một kết cục khác. Cuối cùng, về kết quả của các kết cục xuất huyết và biến cố thuyên tắc huyết khối, RE-DUAL PCI chỉ có thể nghiên cứu sự đóng góp tương đối của việc loại bỏ aspirin và loại thuốc kháng đông đường uống ở các nhóm điều trị kép và nhóm điều trị bộ ba. Một thử nghiệm với kiểu thiết kế 2×2 sẽ có thể nhận rõ các đóng góp này và một thử nghiệm như thế đang tiến hành (ClinicalTrials.gov number, NCT02415400).
4. KẾT LUẬN
Tóm lại, thử nghiệm RE-DUAL PCI cho thấy ở những bệnh nhân rung nhĩ trải qua can thiệp mạch vành qua da, điều trị kép với dabigatran và một ức chế P2Y12 mang lại nguy cơ xuất huyết thấp hơn có ý nghĩa so với điều trị bộ ba với warfarin, ức chế P2Y12 và aspirin. Ngoài ra, điều trị kép với dabigatran không thua kém điều trị bộ ba với warfarin về tỉ lệ biến cố thuyên tắc huyết khối. Ở chế độ điều trị kép, mỗi liều dabigatran cân bằng giữa nguy cơ xuất huyết và phòng ngừa biến cố thuyên tắc huyết khối, mang lại cho các nhà lâm sàng hai chọn lựa mới trong điều trị bệnh nhân với các nguy cơ thuyên tắc huyết khối và xuất huyết khác nhau.
Tài liệu tham khảo
1. ACC/AHA guideline focused update on duration of dual antiplatelet therapy in patients with coronary artery disease. Circulation 2016; 134(10):e123-e155.
2. Steg PG, Bhatt DL. Viewpoint: a proposal for a simple algorithm for managing oral anticoagulation and antiplatelet therapy in patients with non-valvular atrial fibrillation and coronary stents. Eur Heart J Acute Cardiovasc Care 2017;6:93-7.
3. Lip GY, Windecker S, Huber K, et al. Management of antithrombotic therapy in atrial fibrillation patients presenting with acute coronary syndrome and/or undergoing percutaneous coronary or valve interventions. Eur Heart J 2014;35:3155-79.
4. January CT, Wann LS, Alpert JS, et al. 2014 AHA/ACC/HRS guideline for the management of patients with atrial fibrillation practice guidelines and the Heart Rhythm Society. Circulation 2014;130:2071-104.
5. Levine GN, Bates ER, Blankenship JC, et al. 2011 ACCF/AHA/SCAI guideline for percutaneous coronary intervention. Circulation 2011;124:2574-609.
6. Windecker S, Kolh P, Alfonso F, et al. 2014 ESC/EACTS guidelines on myocardial revascularization. Eur Heart J 2014; 35:2541-619.
7. De Caterina R, Husted S, Wallentin L, et al. Vitamin K antagonists in heart disease: current status and perspectives (Section III) — position paper of the ESC Working Group on Thrombosis–Task Force on Anticoagulants in Heart Disease. Thromb Haemost 2013;110:1087- 107.
8. Vardi M, Debidda M, Bhatt DL, Mauri L, Cannon CP. Evolving antithrombotic strategies in patients with atrial fibrillation undergoing percutaneous coronary intervention: results from a survey among US cardiologists. Clin Cardiol 2014;37: 103-7.
9. Kirchhof P, Benussi S, Kotecha D, et al. 2016 ESC guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J 2016;37:2893-962.
10. Andrade JG, Deyell MW, Khoo C, Lee M, Humphries K, Cairns JA. Risk of bleeding on triple antithrombotic therapy after percutaneous coronary intervention/ stenting: a systematic review and meta- analysis. Can J Cardiol 2013;29:204-12.
11. Lamberts M, Olesen JB, Ruwald MH, et al. Bleeding after initiation of multiple antithrombotic drugs, including triple therapy, in atrial fibrillation patients following myocardial infarction and coronary intervention: a nationwide cohort study. Circulation 2012;126:1185-93.
12. Lemesle G, Ducrocq G, Elbez Y, et al. Vitamin K antagonists with or without long-term antiplatelet therapy in outpatients with stable coronary artery disease and atrial fibrillation: association with ischemic and bleeding events. Clin Car- diol 2017 July 10 (Epub ahead of print).
13. Depta JP, Cannon CP, Fonarow GC, Zhao X, Peacock WF, Bhatt DL. Patient characteristics associated with the choice of triple antithrombotic therapy in acute coronary syndromes. Am J Cardiol 2009; 104:1171-8.
14. Dewilde WJ, Janssen PW, Verheugt FW, et al. Triple therapy for atrial fibrillation and percutaneous coronary interven tion: a contemporary review. J Am Coll Cardiol 2014;64:1270-80.
15. Lamberts M, Gislason GH, Olesen JB, et al. Oral anticoagulation and antiplatelets in atrial fibrillation patients after myocardial infarction and coronary intervention. J Am Coll Cardiol 2013;62:981-9.
16. Connolly SJ, Ezekowitz MD, Yusuf S, et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009;361:1139-51.
17. Dans AL, Connolly SJ, Wallentin L, et al. Concomitant use of antiplatelet therapy with dabigatran or warfarin in the Randomized Evaluation of Long-Term Anticoagulation Therapy (RE-LY) trial. Circulation 2013;127:634-40.
18. Dewilde WJ, Oirbans T, Verheugt FW, et al. Use of clopidogrel with or without aspirin in patients taking oral anticoagulant therapy and undergoing percutaneous coronary intervention: an open-label, randomised, controlled trial. Lancet 2013;381:1107-15.
19. Fiedler KA, Maeng M, Mehilli J, et al. Duration of triple therapy in patients requiring oral anticoagulation after drug-eluting stent implantation: the ISAR-TRIPLE Trial. J Am Coll Cardiol 2015;65: 1619-29.
20. Gibson CM, Mehran R, Bode C, et al. Prevention of bleeding in patients with atrial fibrillation undergoing PCI. N Engl J Med 2016;375:2423-34.
21. Gibson CM, Pinto DS, Chi G, et al. Recurrent hospitalization among patients with atrial fibrillation undergoing intracoronary stenting treated with 2 treatment strategies of rivaroxaban or a dose- adjusted oral vitamin K antagonist treatment strategy. Circulation 2017;135: 323-33.
22. Bhatt DL. O PIONEERs! The beginning of the end of full-dose triple therapy with warfarin? Circulation 2017;135:334-7.
23. Cannon CP, Gropper S, Bhatt DL, et al. Design and rationale of the RE-DUAL PCI trial: a prospective, randomized, phase 3b study comparing the safety and efficacy of dual antithrombotic therapy with dabigatran etexilate versus warfarin triple therapy in patients with nonvalvular atrial fibrillation who have undergone percutaneous coronary intervention with stenting. Clin Cardiol 2016;39:555-64.
24. Schulman S, Kearon C. Definition of major bleeding in clinical investigations of antihemostatic medicinal products in non-surgical patients. J Thromb Haemost 2005;3:692-4.
25. Jackson K, Gersh BJ, Stockbridge N, et al. Antithrombotic drug development for atrial fibrillation: proceedings, Washing- ton, DC, July 25-27, 2005. Am Heart J 2008;155:829-40.
26. Rosendaal FR, Cannegieter SC, van der Meer FJM, Briët E. A method to determine the optimal intensity of oral anticoagulant therapy. Thromb Haemost 1993; 3:236-9.
27. Faxon DP, Eikelboom JW, Berger PB, et al. Consensus document: antithrombotic therapy in patients with atrial fibrillation undergoing coronary stenting: a North-American perspective. Thromb Haemost 2011;106:572-84.
28. Angiolillo DJ, Goodman SG, Bhatt DL, et al. Antithrombotic therapy in patients with atrial fibrillation undergoing percutaneous coronary intervention: a North American perspective — 2016 up- date. Circ Cardiovasc Interv 2016;9(11): e004395 .
29. Patel MR, Mahaffey KW, Garg J, et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med 2011; 365:883-91.







