Trong năm nay ESC đã đưa ra 5 hướng đẫn trong chẩn đoán và điều trị các bệnh lý tim mạch. Hướng dẫn điều chỉnh bệnh nhân rối loạn nhịp thất và phòng ngừa đột tử tim của ESC 2015 là 1 trong 5 hướng dẫn mới này. Chúng tôi xin được trình bày những điểm cơ bản của khuyến cáo này.
TS Phạm Hữu Văn
Các nhóm đặc trách về điều chỉnh bệnh nhân rối loạn nhịp thất và ngăn ngừa đột tử tim của Hội tim mạch châu Âu (ESC) đã được Hội Tim bẩn sinh và nhi khoa châu Âu (AEPC). Các tác giả / thành viên ban đặc trách: Silvia G. Priori * (chủ tịch) (Italy), Carina Blomstrưm-Lundqvist * (đồng Chủ tịch) (Thụy Điển), Andrea Mazzanti † (Italy), Nico Bloma (Hà Lan), Martin Borggrefe (Đức), John Camm (Vương quốc Anh), Perry Mark Elliott (Vương quốc Anh), Donna Fitzsimons (Vương quốc Anh), Robert Hatala (Slovakia), Gerhard Hindricks (Đức), Paulus Kirchhof (Anh / Đức) , Keld Kjeldsen (Đan Mạch), Karl-Heinz Kuck (Đức), Antonio Hernandez-Madrid (Tây Ban Nha), Nikolaos Nikolaou (Hy Lạp), Tone M. Norekva˚l (Na Uy), Christian Spaulding (Pháp), và Dirk J. Van Veldhuisen (Hà Lan) xác nhận.
Lời nói đầu
Hướng dẫn tổng kết và đánh giá tất cả các bằng chứng sẵn có về một vấn đề cụ thể tại thời điểm quá trình soạn thảo, với mục đích hỗ trợ các chuyên gia y tế trong việc lựa chọn các chiến lược điều chỉnh tốt nhất cho từng bệnh nhân với một điều kiện nhất định, có tính đến tác động lên kết cục, cũng như tỷ lệ rủi ro-lợi ích của phương tiện chẩn đoán hoặc điều trị riêng biệt. Hướng dẫn và khuyến cáo sẻ giúp các chuyên gia y tế đưa ra quyết định trong thực tế hàng ngày của mình. Tuy nhiên, quyết định cuối cùng liên quan đến bệnh nhân phải do các chuyên viên sức khỏe phù hợp được thực hiện trong sự tham vấn với các bệnh nhân và người chăm sóc tương ứng.
Một số lượng lớn các hướng dẫn đã được ban hành trong những năm gần đây của Hội Tim mạch châu Âu (ESC) cũng như các hội và các tổ chức khác. Do tác động trên thực hành lâm sàng, tiêu chuẩn chất lượng cho sự phát triển của các hướng dẫn đã được thành lập để thực hiện tất cả các quyết định minh bạch cho người sử dụng. Các khuyến nghị cho việc xây dựng và ban hành Hướng dẫn của ESC có thể được tìm thấy trên trang web của ESC (http://www.escardio.org/Guidelines- &-Education/Clinical-Practice-Guidelines/Guidelines-development/ Writing-ESC-Guidelines).. Hướng dẫnESC thể hiện vị trí chính thức của ESC về một chủ đề nhất định và được cập nhật thường xuyên.
Các thành viên của Ban đặc nhiệm này đã được ESC lựa chọn để đại diện cho các chuyên gia tham gia vào việc chăm sóc y tế của bệnh nhân với bệnh lý. Chuyên gia được lựa chọn trong lĩnh vực này đã tiến hành một đánh giá toàn diện các chứng cứ được công bố cho điều chỉnh (bao gồm chẩn đoán, điều trị, phòng ngừa và phục hồi chức năng) của một điều kiện nhất định theo Ủy ban ESC cho chiến lược hướng dẫn thực hành (CPG). Một đánh giá quan trọng của quy trình chẩn đoán và điều trị được thực hiện, bao gồm cả đánh giá về tỷ lệ rủi ro và lợi ích. Ước tính kết quả y tế dự kiến cho các nhóm lớn hơn đã được bao gồm, nơi lưa trữ dữ liệu. Mức độ bằng chứng và sức mạnh của khuyến cáo các lựa chọn điều chỉnh riêng biệt được cân nhắc và phân loại theo cân nhắc được dự kiến, được nêu trong bảng 1 và 2.
Các chuyên gia của các nhóm nhận và soạn thảo xem xét cung cấp tờ khai các hình thức lợi ích cho tất cả các mối quan hệ có thể được coi như là nguồn thực sự hay tiềm năng xung đột lợi ích. Những hình thức này được biên soạn thành một tập tin và có thể được tìm thấy trên các trang web của ESC (http: // www.escardio.org/guidelines). Bất kỳ thay đổi trong tờ khai của lợi ích phát sinh trong khoảng thời gian soạn thảo phải được thông báo cho ESC và cập nhật. Ban đặc nhiệm đã nhận được toàn bộ hỗ trợ tài chính từ ESC mà không cần bất kỳ sự tham gia từ các ngành công nghiệp chăm sóc sức khỏe.
ESC CPG giám sát và điều phối việc chuẩn bị các hướng dẫn mới được Ban đặc nhiệm, các nhóm chuyên gia hoặc các nhóm đồng thuận thực hiện. Ủy ban cũng chịu trách nhiệm cho quá trình chứng thực của Hướng dẫn này. Hướng dẫn ESC trải qua xem xét mở rộng của CPG và các chuyên gia bên ngoài. Sau khi chỉnh cho phù hợp với hướng dẫn được sự chấp thuận của tất cả các chuyên gia tham gia trong Ủy Ban. Các tài liệu hoàn chỉnh được sự chấp thuận của CPG cho xuất bản trên tạp chí European Heart. Hướng dẫn này được phát triển sau khi xem xét cẩn thận các kiến thức khoa học và y học và các bằng chứng sẵn có tại thời điểm xem xét.
Bảng 1: Các cấp độ khuyến cáo
|
Cấp độ khuyến cáo |
Xác định |
Gợi ý sử dụng |
|
Class I |
Bằng chứng và / hoặc thỏa thuận chung là điều trị xác định hay thủ thuật là có lợi, hữu ích, hiệu quả. |
Được khuyến cáo / được chỉ định |
|
Class II |
Bằng chứng mâu thuẫn và / hoặc một ý kiến khác nhau về tính hữu ích / tính hiệu quả của việc điều trị cho hay thủ thuật. |
|
|
Class IIa |
Khối lượng bằng chứng / ý kiến có lợi cho tính hữu ích / hiệu quả. |
Cần được xem xét |
|
Class IIb |
Tính hữu dụng / hiệu quả tính toán bằng các bằng chứng/ý kiến là ít hơn |
Có thể được xem xét |
|
Class III |
Bằng chứng hoặc thoả thuận chung, việc điều trị xác định hay thủ thuật là không hữu ích / hiệu quả, và trong một số trường hợp có thể có hại. |
Không được khuyến cáo |
Các nhiệm vụ phát triển Hướng dẫn của ESC bao gồm không chỉ tích hợp các nghiên cứu gần đây nhất, mà còn tạo ra các công cụ giáo dục và các chương trình thực hiện cho các khuyến nghị. Để thực hiện chủ trương, sản xuất phiên bản các hướng dẫn rút ngắn bỏ túi, slide tóm tắt, sổ tay với những thông điệp cần thiết, thẻ tóm tắt cho người không chuyên môn và một phiên bản điện tử cho các ứng dụng kỹ thuật số (điện thoại thông minh, vv). Những phiên bản này được rút gọn và do đó, nếu cần, người ta luôn luôn tham khảo các phiên bản văn bản đầy đủ, có sẵn miễn phí trên trang web của ESC. Các hội quốc gia của ESC được khuyến khích để xác nhận, dịch và thực hiện tất cả các hướng dẫn của ESC. Chương trình thực hiện là cần thiết do nó đã được chứng minh kết quả của bệnh có thể được ảnh hưởng thuận lợi bằng áp dụng toàn bộ các khuyến cáo lâm sàng.
Các nghiên cứu quan sát và đăng ký là cần thiết để xác minh thực hành đời sống thực sự hàng ngày phù hợp với những gì được khuyến cáo trong hướng dẫn, do đó hoàn thành các vòng lặp giữa nghiên cứu lâm sàng, văn bản hướng dẫn, phổ biến và thực hiện chúng trong thực hành lâm sàng.
Nhân viên y tế được khuyến khích để có những hướng dẫn của ESC đầy đủ vào các văn bản khi thực hiện đánh giá lâm sàng của họ, cũng như trong việc xác định và thực hiện chiến lược y tế dự phòng, chẩn đoán hoặc điều trị. Tuy nhiên, Hướng dẫn của ESC không làm mất đi trong bất kỳ cách nào trách nhiệm cá nhân của các chuyên gia y tế để đưa ra quyết định phù hợp và chính xác trong việc xem xét tình trạng sức khỏe của từng bệnh nhân và tham khảo ý kiến với bệnh nhân và người chăm sóc của bệnh nhân ở đó thích hợp và / hoặc cần thiết. Đó cũng là trách nhiệm của các chuyên gia y tế để xác minh các quy tắc và quy định áp dụng đối với các loại thuốc và các thiết bị tại thời điểm kê đơn thuốc.
Bảng 2: Các mức độ của bằng chứng
|
Mức độ chứng cứu A |
Các tư liệu rút ra từ nhiều nghiên cứu lâm sàng ngẫu nhiên hoặc các phân tích gộp. |
|
Mức độ chứng cứu B |
Các tư liệu rút ra từ một nghiên cứu ngẫu nhiên đơn thuần hoặc các nghiên cứu lớn không ngẫu nhiên. |
|
Mức độ chứng cứ C |
Sự đồng thuận ý kiến của các chuyên gia và / hoặc các nghiên cứu nhỏ, nghiên cứu hồi cứu, các đăng ký. |
1. Giới thiệu
Các tài liệu này đã được hình thành như bản cập nhật của châu Âu đối với các hướng dẫn điều chỉnh các bệnh nhân rối loạn nhịp thất (VA) và phòng ngừa đột tử tim (SCD) của ACC / AHA năm 2006 [1]. Với sự sáng tỏ của tư liệu đồng thuận rất gần đây cho việc điều chỉnh các bệnh nhân VA do các hội nhịp tim quốc tế lớn, [2,3] Ban Hướng dẫn của ESC đã quyết định tập trung vào nội dung của tài liệu này về dự phòng SCD. Bản cập nhật kịp thời, xem xét các hiểu biết mới về bệnh sử tự nhiên của bệnh dẫn đến SCD và hoàn thiện các nghiên cứu lớn sẽ ảnh hưởng đến chiến lược điều chỉnh cho suy tim (HF) liên quan đến cả hai phương pháp điều trị thuốc và thiết bị.
2. Cấu trúc các hướng dẫn
Tài liệu được chia thành các phần gồm các chủ đề cụ thể. Các chương trình đánh giá rủi ro và điều chỉnh được cung cấp cần được thay đổi trong việc xem xét các đồng bệnh suất, giới hạn của tuổi thọ, ảnh hưởng đến chất lượng cuộc sống và các tình huống khác.
Trong khi chuẩn bị bản cập nhật này, các ủy ban xem xét các khuyến nghị mới nhất cho từng chủ đề và sửa đổi các cấp độ (class) và / hoặc cường độ của khuyến cáo, xem xét liệu các kết quả mới từ các thử nghiệm ngẫu nhiên, phân tích gộp hoặc bằng chứng lâm sàng sẽ hướng đến sự thay đổi. Chăm sóc đặc biệt đã được thực hiện để duy trì tính nhất quán trong việc sử dụng ngôn từ với hướng dẫn hiện hành. Tuy nhiên, đôi khi, những thay đổi từ ngữ được thực hiện để làm cho một số khuyến nghị ban đầu để nhiều người sử dụng thân thiện và chính xác.
Ủy ban gồm các bác sĩ và các nhà cung cấp chăm sóc sức khỏe liên quan đến các chuyên gia trong các lĩnh vực SCD và phòng ngừa, VA phức tạp, điện sinh học can thiệp, bệnh động mạch vành (CAD), suy tim và bệnh cơ tim, tim mạch nhi khoa và loạn nhịp tim, điều trị thiết bị, chăm sóc tim mạch, tim mạch di truyền và điều dưỡng. Các chuyên gia ở khoa phụ khác nhau trong tim mạch đã được xác định với sự giúp đỡ của các nhóm làm việc có liên quan của ESC.
Tất cả các thành viên của Ủy ban soạn thảo chấp thuận các đề nghị hướng dẫn. Bảy mươi bốn người nhận xét phản biện đã xem lại tài liệu. Một cuộc khảo sát tài liệu rộng lớn đã được tiến hành dẫn đến việc đưa vào các 810 tài liệu tham khảo. Các hướng dẫn đánh giá liên quan đến công tác phòng ngừa SCD được liệt kê trong bảng 1. [3-13]
3. Định nghĩa, dịch tễ học và triển vọng tương lai cho công tác phòng ngừa đột tử tim
Các định nghĩa sử dụng cho đột tử, ngừng tim được thoát, rung thất vô căn (VF) và cho công tác phòng ngừa đột tử được nêu chi tiết trong Bảng 3.
3.1. Dịch tễ học của đột tử tim
Trong 20 năm qua, tỷ lệ tử vong tim mạch đã giảm ở tất cả các nước có thu nhập cao [19] trong đáp ứng với việc áp dụng các biện pháp phòng ngừa để giảm gánh nặng của CAD và HF. Mặc dù có những kết quả đáng khích lệ, các bệnh tim mạch chịu trách nhiệm cho khoảng 17 triệu người tử vong mỗi năm trên thế giới, khoảng 25% trong số đó là SCD [20]. Nguy cơ SCD là ở nam giới cao hơn ở phụ nữ và tăng theo tuổi do sự phổ biến cao của CAD ở người lớn tuổi [21]. Theo đó, tần số SCD được ước tính khoảng từ 1,40 / 100 000 người / năm [CI 95% (CI) 0,95, 1,98] ở phụ nữ đến 6,68 / 100 000 người / năm (95% CI 6.24, 7.14) ở nam. [21] SCD ở những người trẻ tuổi có tỉ lệ mắc ước tính khoảng 0,46 – 3,7 biến cố / 100 000 người / năm, [22,23] tương ứng với một ước tính sơ bộ 1100-9000 trường hợp tử vong ở châu Âu và 800-6.200 ca tử vong ở Mỹ mỗi năm [24].
Bảng 3: Các định nghĩa các thuật ngữ thường được sử dụng
|
Thuật ngữ |
Định nghĩa |
Tài liệu tham khảo |
|
Đột tử (SD) |
Không do chấn thương, biến cố bất ngờ xảy ra gây tử vong trong vòng 1 giờ sau khi khởi phát các triệu chứng ở một người có vẻ khỏe mạnh. Nếu tử vong không được chứng kiến, định nghĩa được áp dụng khi các nạn nhân vẫn khỏe mạnh 24 giờ trước khi biến cố. |
1 |
|
SUDS và SUDI |
Tử vong đột ngột không có nguyên nhân rõ ràng và không được thực hiện khám nghiệm tử thi ở người lớn (SUDS) hoặc ở trẻ <1 tuổi (SUDI) |
14 |
|
Đột tử tim (SCD) |
Thuật ngữ được sử dụng khi: • Điều kiện tim bẩm sinh, hoặc mắc phải, gây tử vong tiềm tàng đã được biết hiện diện trong đời sống; HOẶC • Khám nghiệm tử thi xác định có dị tật tim hoặc mạch máu là nguyên nhân có thể xảy ra của biến cố; HOẶC • Không có nguyên nhân ngoài tim rõ ràng đã được xác định bằng cách khám nghiệm tử thi và do đó một biến cố loạn nhịp tim có thể là nguyên nhân gây tử vong. |
1, 14, 15 |
|
SADS và SIDS |
Cả hai khám nghiệm tử thi và độc chất là không thuyết phục, tim cấu trúc bình thường trong khám nghiệm toàn bộ và tổ chức học cũng như các căn nguyên ngoài tim đã được loại trừ ở người lớn (SADS) và ở trẻ sơ sinh (SIDS). |
16 |
|
Ngừng tim được thoát (Aborted cardiac arrest) |
Ngừng tuần hoàn bất ngờ, xảy ra trong vòng 1 giờ sau khi khởi phát các triệu chứng cấp tính, được hồi phục bằng các phương pháp hồi sức thành công (như khử rung) |
|
|
VF tự phát (Idiopathic VF) |
Các khám nghiệm lâm sàng rung thất tự phát âm tính ở bệnh nhân sống sót qua cơn rung thất |
17, 18 |
|
Phòng ngừa SCD tiên phát |
Các điều trị để giảm nguy cơ SCD ở những người có nguy cơ SCD nhưng chưa trải qua ngừng tim được thoát hoặc loạn nhịp nguy hiểm.
|
|
|
Phòng ngừa SCD thứ phát |
Các điều trị làm giảm nguy cơ SCD ở các bệnh nhân đã trải qua ngừng tim được thoát hoặc loạn nhịp nguy hiểm. |
1 |
SADS = Hội chứng đột tử do loạn nhịp (sudden arrhythmic death syndrome); SCD = Đột tử tim (sudden cardiac death); SIDS = Hội chứng đột tử ở trẻ em (sudden infant death syndrome); SUDI = Đột tử không giải thích được ở trẻ em (sudden unexplained death in infancy); SUDS = Hội chứng đột tử không giải thích được (sudden unexplained death syndrome).
3.1.1 Nguyên nhân đột tử tim ở các nhóm tuổi khác nhau
Các bệnh tim mạch liên quan với SCD khác nhau ở trẻ so với người lớn tuổi. Ở người trẻ có ưu thế của các bệnh kênh (channelopathies) và các bệnh cơ tim (cardiomyopathies) (Bảng 2), [21,25-48] viêm cơ tim và lạm dụng thuốc, [49] trong khi ở các quần thể lớn tuổi, bệnh thoái hóa mãn tính chiếm đa số (CAD, bệnh van tim và HF). Một số thách thức làm thay đổi xác định nguyên nhân của SCD ở cả hai nhóm tuổi: các nạn nhân lớn tuổi, ví dụ, có thể bị nhiều bệnh tim mạch mãn tính do đó nó trở nên khó khăn để xác định nguyên nhân nào góp phần nhiều nhất cho SCD. Ở những người trẻ tuổi, nguyên nhân của SCD có thể khó nhận biết bắt ngay cả sau khi khám nghiệm tử thi, vì điều kiện như các bệnh kênh di truyền hoặc loạn nhịp tim do thuốc đều không có bất thường cấu trúc là dịch tễ học có liên quan trong nhóm tuổi này.
3.2 khám nghiệm tử thi và khám nghiệm tử thi phân tử ở các nạn nhân đột tử
Chỉ định mổ tử thi khám nghiệm tử thi phân tử ở các nạn nhân đột tử
|
Các khuyến cáo |
Class a |
Level b |
Ref.c |
|
Khám nghiệm tử thi được khuyến cáo để điều tra nguyên nhân đột tử và để xác định liệu SCD là thứ phát do loạn nhịp tim hoặc các cơ chế không do loạn nhịp (ví dụ như vỡ phình động mạch chủ). |
I |
C |
17 |
|
Bất cứ khi nào khám nghiệm tử thi được thực hiện, kiểm tra tổ chức học tiêu chuẩn của tim được khuyến khích và nó phải bao gồm các khối cơ tim được ghi nhãn sắp xếp từ lát ngang đại diện của cả hai tâm thất. |
I |
C |
17 |
|
Việc phân tích máu và chất dịch khác của cơ thể được thu thập đầy đủ cho độc học và các bệnh lý phân tử được khuyến cáo trong tất cả các nạn nhân đột tử không rõ nguyên nhân. |
I |
C |
17 |
|
Phân tích di truyền sau tử vong đã đạt mục tiêu gene có thể gây bệnh cần được xem xét ở tất cả các nạn nhân đột tử ở người có bệnh kênh di truyền cụ thể hoặc nghi ngờ bệnh cơ tim. |
IIa |
C |
17.50.51 |
SCD = Đột tử tim (sudden cardiac death).
aClass của khuyến cáo.
b Mức độ bằng chứng.
c Tài liệu tham khảo ủng hộ cho khuyến cáo.
Xác định nguyên nhân gây ra đột tử cung cấp cho gia đình với sự hiểu biết một phần và giải thích hợp lý các bi kịch bất ngờ, tạo điều kiện cho quá trình dự phòng và cho phép hiểu biết có hay không có nguy cơ đột tử có thể mở rộng ra các thành viên trong gia đình. Theo đó, điều hợp lý cho tất cả các nạn nhân đột tử không giải thích được cần trải qua khám nghiệm của các chuyên gia sau khi tử vong để tìm hiểu có nguồn gốc tim cần được nghi ngờ hay không.
Mặc dù CAD chiếm một tỷ lệ lớn các trường hợp đột tử, đặc biệt là đối với người > 40 tuổi, nên chú ý đến các nguyên nhân khác, gồm rối loạn di truyền có ảnh hưởng đến cả sự toàn vẹn của cơ tim (xem phần 7) hoặc chức năng điện của tim (xem phần 8). Mỗi khi một bệnh di truyền được xác định ở một cá nhân đã tử vong, thân nhân của các nạn nhân có thể có nguycơ bị ảnh hưởng và tử vong đột ngột trừ khi được chẩn đoán kịp thời và các biện pháp phòng ngừa được thực.
Đáng tiếc, ngay cả khi khám nghiệm tử thi được thực hiện, tỷ lệ đột tử từ 2 đến 54% [48] vẫn không giải thích được (Bảng 2): phạm vi rộng của các giá trị này có thể do sự không đồng nhất của các protocol (giao thức) khám nghiệm tử thi. Để thúc đẩy một tiêu chuẩn chung cho khám nghiệm tử thi, hướng dẫn đạt được mục tiêu đã phát triển để xác định các giao thức kiểm tra tim và lấy mẫu tổ chức học, cũng như cho độc học và các khám nghiệm phân tử [17,50]. Nhìn chung, một khám nghiệm tử thi được tiến hành đúng cách nên cung cấp câu trả lời cho các vấn đề sau: (i) xem tử vong là do bệnh tim hay không, (ii) bản chất của các bệnh tim mạch (nếu có), (iii) liệu cơ chế của tử vong do loạn nhịp hay không, (iv) có bằng chứng của một bệnh tim do di truyền hay không và do đó đòi hỏi sàng lọc và tư vấn người thân và (v) khả năng sử dụng thuốc độc hoặc thuốc bất hợp pháp hoặc các nguyên nhân tủ vong không tự nhiên khác.
Kiểm tra tổ chức học của tim chuẩn nên bao gồm các khối cơ tim được phân bố sắp xếp từ các lát cắt đại diện cho hai thất. Người ta khuyến khích các nhà bệnh lý học liên hệ với các trung tâm chuyên ngành và gửi mẫu tim đến đây để kiểm tra. Các nhà nghiên cứu bệnh nên thực hiện một cuộc kiểm tra chuẩn chung về tim, bao gồm lát cắt nganh mỏm và lấy các tổ chức, máu và các chất dịch khác cho độc học và các bệnh lý phân tử trước khi cố định tim trong formalin. Tiếp theo, thu thập và lưu trữ các mẫu sinh học để tách chiết DNA để cho phép khám nghiệm tử thi “phân tử” được khuyến khích [17]. Khám nghiệm tử thi phân tử là một sự bổ sung quan trọng để khám nghiệm tử thi tiêu chuẩn, vì nó cho phép chẩn đoán các bệnh kênh sau tử vong, điều đó có thể giải thích 15-25% của các trường hợp hội chứng đột tử do loạn nhịp (SADS) [17]. Giá trị của chẩn đoán sau tử vong ở nạn nhân SCD nằm trong việc mở rộng sàng lọc di truyền cho các thành viên gia đình của họ hoặc SADS hoặc SIDS. Văn bản đồng thuận của chuyên gia gần đây cho việc chẩn đoán và điều chỉnh rối loạn nhịp tim do di truyền nói rõ việc sử dụng khám nghiệm tử thi phân tử được nhấn mạnh / test di truyền sau tử vong cần được xem xét cho các nạn nhân SCD khi nghi ngờ bệnh kênh. Người ta ủng hộ đề nghị này và tham khảo các độc giả quan tâm đến các văn bản đồng thuận gần đây nhất trên chủ đề này [14,52].
3.3. Dự đoán nguy cơ đột tử do tim
Dự đoán SCD hòn đá tảng mờ ảo của loạn nhịp học, các cố gắng để cung cấp các chỉ dấu đáng tin cậy của SCD đã châm ngòi cho một trong những khu vực khám phá năng động nhất trong loạn nhịp học suốt mấy thập niên gân đây [53]. Ngày nay vấn đề đã rõ ràng xu hướng đột tử bắt nguồn như một “trận bão hoàn hảo”- tương tác của một nền dễ bị tổn thương (thay đổi di truyền hoặc mắc phải trong các thuộc tính điện hoặc cơ học của tim) có nhiều yếu tố tạm thời tham gia vào việc kích hoạt các biến cố nguy hiểm. Trong phần tiếp theo, chúng tôi cung cấp nhãn quan tổng quan ngắn gọn về nhiều hạn chế trong các lưu đồ phân tầng nguy cơ SCD ở những người bình thường, ở các bệnh nhân có bệnh tim thiếu máu cục bộ và bệnh nhân bị các bệnh về kênh và bệnh cơ tim.
3.3.1 Các cá nhân không có bệnh tim đã rõ
Khoảng 50% các ngừng tim xảy ra ở những người không bị bệnh tim đã biết rõ, nhưng hầu hết do các bệnh tim thiếu máu cục bộ bị che dấu [54]. Như một hệ quả, phương pháp hiệu quả nhất để ngăn ngừa SCD trong quần thể dân số chung thuộc về định lượng nguy cơ riêng rẽ phát triển bệnh tim thiếu máu cục bộ trên cơ sở thang điểm nguy cơ, tiếp theo là kiểm soát các yếu tố nguy cơ như cholesterol toàn phần trong huyết thanh, đường, huyết áp, hút thuốc lá và chỉ số khối cơ thể (BMI) [55]. Giảm khoảng 40% SCD đã được quan sát là kết quả trực tiếp của việc giảm CAD và các điều kiện tim mạch khác [56].
Một số nghiên cứu [57-61] đã cung cấp bằng chứng một khuynh hướng di truyền gây ra tử vong đột ngột. Các nhóm nghiên cứu dẫn đầu do X. Jouven là một trong những người đầu tiên để điều tra các giá trị tiên đoán tái phát đột tử mang tính gia đình. Các tác giả đã chứng minh, trong nghiên cứu Paris xuất bản năm 1999, [57] có một bệnh sử cha mẹ đột tử có nguy cơ tương đối (RR) cho đột tử là 1.89, trong đó tăng lên đến 9,44 ở những người có hai bệnh sử cha mẹ đột tử (P = 0,01). Đồng thời, Friedlander và cộng sự [58] khẳng định, trong một nghiên cứu trên cơ sở trường hợp từ nghiên cứu Framingham, tăng gần 50% [RR 1.46 (95% CI 1.23, 1.72)] khả năng đột tử trong sự hiện diện của một bệnh sử gia đình SCD. Năm 2006, Dekker và cộng sự [59] cho thấy đột tử gia đình xảy ra thường xuyên hơn một cách có ý nghĩa ở những người được cấp cứu từ VF tiên phát so với nhóm chứng [tỉ số chênh (OR) 2.72 (95% CI 1.84, 4.03)]. Sự đồng nhất ấn tượng của những kết quả này cho thấy khuynh hướng chết đột ngột được ghi trong các gen, ngay cả trong sự vắng mặt của một bệnh Mendel, và khuyến khích điều tra phân tử để xác định các marker DNA để dự đoán SCD trong dân số nói chung.
Trong số các nghiên cứu đã tìm kiếm các đa hình nucleotide đơn dẫn đến các SCD, kết quả của hai nghiên cứu genome (GWAS) có liên quan: nghiên cứu loạn nhịp tim di truyền ở Ha Lan (Arrhythmia Genetics in the Netherlands: AGNES), [61] có liên quan đến bệnh nhân bị nhồi máu cơ tim lần đầu tiên và VF và so sánh chúng với một nhóm các bệnh nhân nhồi máu cơ tim đầu tiên không VF. Chỉ có một đa hình nucleotide đơn nằm trong locus 21q21 đạt được ý nghĩa toàn bộ gen, với OR 1,78 (95% CI 1.47, 2.13;P = 3,36 × 10 10). Đa hình nucleotide đơn này (47% tần số của allele) được đặt trong khu vực intergenic và gen gần nhất, CXADR (98 kb away), mã hóa một thụ thể của virus liên quan đến viêm cơ tim do virus. Nghiên cứu GWAS lần thừ hai [62] là một nghiên cứu rất lớn xác định được một tín hiệu mạnh mẽ tại 2q24.2 locus, trong đó có ba gen có chức năng chưa được biết tất cả đều biểu hiện trong tim. Locus này làm tăng nguy cơ của SCD bằng 1,92 (95% CI 1.57, 2.34). Tuy nhiên, nghiên cứu đã không nhân rộng các kết quả của nghiên cứu AGNES, tăng lên lo ngại một trong hai kích thước hay thiết kế của nghiên cứu AGES bị giới hạn. Những dữ liệu di truyền chưa được áp dụng tại các bệnh viện, nhưng chúng cho thấy di truyền học có thể phát triển thành một phương pháp tiếp cận đầy hứa hẹn để định lượng nguy cơ SCD khi còn trẻ. Khả năng của công nghệ mới cho phép xác định kiểu gene nhanh hơn và rẻ hơn có thể sớm cung cấp số liệu trên dân số rất lớn và cung cấp những khả năng thống kê cần thiết cho các điều tra này.
3.3.2 Bệnh nhân bệnh tim thiếu máu cục bộ
Trong hơn hai thập kỷ các nhà điều tra trên toàn thế giới đã hình dung ra một loạt các ‘chỉ tiêu’ cho SCD xảy ra trong tình trạng bệnh tim thiếu máu cục bộ. Một số chỉ dấu không xâm lấn cho nguy cơ SCD đã được đưa ra cho bệnh nhân thiếu máu cơ tim cục bộ, gồm, trong số đó, kích thích tâm thất theo chương trình (PVS), điện thế trẽ, biến thiên nhịp tim, độ nhạy phẩn xạ áp lực (baroreflex), phân tán khoảng QT, luân phiên vi điện thế sóng T và hỗn loạn nhịp tim. Tuy nhiên, bất chấp những kết quả đầy hứa hẹn của các nghiên cứu ban đầu, không chỉ số nào trong số các “dự báo” đã ảnh hưởng đến thực hành lâm sàng. Như một hệ quả, các chỉ số duy nhất đã luôn thể hiện kết hợp với tăng nguy cơ đột tử trong các trạng thái nhồi máu cơ tim và rối loạn chức năng tâm thất trái (LV) là phân suất tống máu thất trái (LVEF) [63,64]. Biến này đã được sử dụng trong hơn một thập kỷ để nhắm mục tiêu sử dụng cấy máy khử rung tim (ICD) dự phòng SCD tiên phát, thường kết hợp class của NYHA (độ suy tim). Mặc dù thực tế LVEF không phải là một tham số lâm sàng chính xác và có thể tạo ra, nó vẫn được sử dụng để lựa chọn bệnh nhân cho cấy ICD trong phòng ngừa SCD tiên phát.
Trong số các biến mới nổi và nhìn thấy đầy hứa hẹn cho việc dự đoán SCD là các chỉ số sinh hóa B-type natriuretic peptide và N-terminal pro-B-type natriuretic peptide, trong đó đã chỉ ra kết quả đáng khích lệ trong các nghiên cứu sơ bộ [65].
3.3.3 Bệnh nhân có bệnh rối loạn nhịp có thể di truyền
Sự sẵn có các phương án phân tầng nguy cơ không đồng nhất lớn giữa các bệnh kênh và các bệnh cơ tim khác nhau: ví dụ, trong khi khoảng thời gian QT có điều chỉnh (QTc) là một chỉ số đáng tin cậy cho biến cố tim trong hội chứng QT dài (LQTS), [67] và phì đại vách ngăn trong dự đoán hậu quả bệnh cơ tim phì đại (HCM), [68] ở các bệnh khác, chẳng hạn như hội chứng Brugada hoặc hội chứng QT ngắn (SQTS), số liệu phân tầng nguy cơ không mạnh mẽ, còn không chắc chắn về cách như thế nào nhắm mục tiêu sử dụng dự phòng của ICD. Cho đến nay, thông tin di truyền có thể được sử dụng để hướng dẫn phân tầng nguy cơ chỉ trong một vài bệnh như LQTS và lamin A / C bệnh cơ tim giãn [69-71].
3.4 Phòng ngừa đột tử do tim ở những khung cảnh đặc biệt
3.4.1 Tầm soát dân số nói chung đối với nguy cơ đột tử do tim
Cảnh giác với những dấu hiệu điện tâm đồ (ECG) và siêu âm tim của bệnh rối loạn nhịp có thể di truyền có vẻ là một phần quan trọng trong thực hành lâm sàng và có thể góp phần vào việc xác định sớm những bệnh nhân có nguy cơ SCD. Cho dù một cách tiếp cận thận trọng như vậy nên được mở rộng để sàng lọc hàng loạt trong quần thể có nguy cơ tử vong đột ngột hiện nay còn chưa rõ ràng. Italy và Nhật Bản đã triển khai hệ thống tầm số điện tâm đồ, trong đó có thể xác định bệnh nhân có các bệnh loạn nhịp có thể di truyền không có triệu chứng. [72- 74] Trong khi có sự nhất trí giữa các chuyên gia ở châu Âu và Hoa Kỳ (Mỹ) ủng hộ cho sự sàng lọc trước khi tham dự của các vận động viên (một phương pháp đã được xác nhận của Ủy ban Olympic quốc tế), [75-77] một nghiên cứu gần đây báo cáo không có sự thay đổi trong tần số tỷ lệ bị SCD ở các vận động viên thi đấu tiếp sau thực hiện chương trình sàng lọc tại Israel. [78]
Tương tự như vậy, không có số liệu rõ ràng hỗ trợ các lợi ích của chương trình sàng lọc rộng rãi trong dân số nói chung. Narain et al. [79] tầm soát 12 000 người khỏe mạnh không được chọn lọc có tuổi từ 14 đến 35. Sàng lọc được thực hiện với chi phí 35GBP mỗi cá nhân và bao gồm một bản hỏi sức khỏe, 12 chuyển đạo ECG và tham vấn với bác sĩ tim mạch. Các cá nhân có bất thường trải qua một siêu âm tim qua thành ngực vào cùng ngày hoặc được giới thiệu để đánh giá thêm.
Mặc dù sàng lọc xác định chỉ có một số ít bệnh nhân có bệnh kênh hoặc bệnh cơ tim di truyền (4/12.000), các tác giả kết luận chi phí để xác định cá nhân có nguy cơ SCD tăng lên vẫn có thể hỗ trợ một chương trình sàng lọc hàng loạt.
Rõ ràng việc đánh giá chi phí-lợi ích của tầm soát trong dân số bằng ECG bị ảnh hưởng nhiều do chi phí của việc xác định một cá nhân bị ảnh hưởng duy nhất. Chi phí như vậy chưa được xác định bằng các hệ thống y tế quốc gia Ý mặc dù thực tế là một chương trình kiểm tra phổ quát đã được diễn ra trong 35 năm qua và sẽ khác nhau tùy thuộc vào các tổ chức khu vực chăm sóc sức khoẻ. Ước tính chi phí cho sàng lọc vận động viên Mỹ khoảng từ 300 triệu USD đến 2 tỷ USD mỗi năm theo Kaltman et al. [80]
Nhìn chung, người ta không thể cung cấp các khuyến nghị sàng lọc dân số tại thời điểm này vì những hậu quả của chiến lược sàng lọc phát hiện một số vẫn còn chưa được định nghĩa “dương tính giả” và bỏ lỡ một tỷ lệ còn chưa rõ các trường hợp bị ảnh hưởng (“âm tính giả”) còn không được xác định. Không có khả năng này để đưa ra các khuyến cáo từ các bằng chứng thu được trong các chương trình sàng lọc hiện có minh họa sự cần thiết cho công việc tiếp theo để thu thập dữ liệu định lượng về các tư liệu chi phí – lợi ích của việc thực hiện ECG sàng lọc trong quần thể khác nhau và trong các hệ thống chăm sóc sức khỏe và các khung cảnh khác nhau. Ngược lại, trong việc xem xét các nguy cơ cao hơn về loạn nhịp và sự xấu đi của bệnh cấu trúc hoặc di truyền cá thể bị bộc lộ ra khi gắng sức cường độ cao, [81,82] người ta ủng hộ các khuyến nghị hiện hành cho sàng lọc các vận động viên trước khi tham dự. Ở châu Âu có sự đồng thuận đánh giá lâm sàng, cá nhân hoặc gia đình lĩnh và làm ECG 12 chuyển đạo cơ bản ở quần thể này (xem phần 12.7).
3.4.2 Tầm soát các thành viên gia đình nạn nhân đột tử
Việc chẩn đoán của rối loạn loạn nhịp tim di truyền được tính toàn lên đến trên 50% [83] các gia đình có nạn nhân SADS, đặc biệt bệnh kênh [ví dụ: LQTS, hội chứng Brugada và nhịp tim nhanh thất đa hình do tăng tiết catecholamine (CPVT)] và đôi khi ở các hình thái khó thấy của bệnh cơ tim [ bệnh cơ tim phì đại (HCM) và bệnh cơ tim loạn sản thất phải gây loạn nhịp (ARVC) nói riêng] hoặc tăng cholesterol máu gia đình. Như một hệ quả của những phát hiện này, khi khám nghiệm tử thi, hoặc là không thể đạt được cho các nạn nhân (tức là SUDS hoặc SUDI) và / hoặc khi khám nghiệm tử thi không phát hiện bất thường về cấu trúc và kết quả độc tính là bình thường (tức là SADS hoặc SIDS), các thân nhân thể hệ đầu tiên của nạn nhân nên được thông báo về những nguy cơ tiềm ẩn của biến cố tương tự đối với bản thân họ và nên trải qua đánh giá tim.
Một bệnh sử gia đình với SUDS sớm tái phát hoặc bệnh tim di truyền thể hiện một “lá cờ đỏ” khiến cho việc đánh giá gia đình được khuyến cáo mạnh mẽ. Sàng lọc gia đình của thân nhân thế hệ đầu tiên của các nạn nhân đột tử là một can thiệp quan trọng để xác định cá thể có nguy cơ, tư vấn về khả năng điều trị và ngăn ngừa đột tử. [14,84] Hiện nay chỉ có 40% các thành viên trong gia đình đều được tầm soát, [85] một phần do thiếu cơ sở hạ tầng sàng lọc phù hợp, nhưng cũng do sự lo lắng và căng thẳng liên quan đến trải nghiệm loạn nhịp nguy hiểm đến tính mạng mỗi cá nhân hoặc mất người thân trong gia đình mới đây do tình trạng tim di truyền. [86,87] Các nhu cầu tâm lý xã hội của các bệnh nhân và gia đình của họ phải được đánh giá và một cách tiếp cận đa ngành trong các trung tâm chuyên ngành cầnđược tiếp theo, như các khuyến cáo gần đây. [14,84,88] Giá trị của phương pháp này đã được chứng minh [89,90].
Các giao thức khác nhau đã được đề nghị để sàng lọc các thành viên gia đình của các nạn nhân dột tử. [14,91] Các giao thức này thường theo một cách tiếp cận từng bước, bắt đầu với các điều tra chi phí thấp hơn và năng suất cao hơn và chuyển sang các khám nghiệm tiếp theo trên cơ sở cả hai nhận định khởi đầu và bệnh sử gia đình. [91] Bất cứ khi nào một chẩn đoán nghi ngờ, trên cơ sở có các bất tường về cấu trúc và điện học, các dựa vào sự hiện diện của các cấu trúc bất thường hoặc điện, các quy trình chuẩn cho chẩn đoán các bệnh nghi ngờ cần được tiếp theo.
Thu lượm bệnh sử chính xác là bước đầu tiên để đạt chẩn đoán sau tử vong, mở đầu tích cực khảo sát các thành viên trong gia đình. Khi nạn nhân trẻ, nên tập trung vào các bệnh cơ tim và bệnh kênh. Việc đánh giá các triệu chứng tim mạch báo trước (bao gồm cả ngất hoặc ‘động kinh’), cùng với một thăm dò đầy đủ các tình huống tử vong và thu thấp các điều tra lâm sàng tim mạch trước khi chế đã được khuyến cáo. Khi nạn nhân là 0> 40 tuổi, sự có mặt của các yếu tố nguy cơ đối với CAD nên được đánh giá (ví dụ như hoạt động hoặc hút thuốc thụ động, rối loạn mỡ máu, tăng huyết áp hoặc tiểu đường). Ngoài ra, ba thế hệ đầy đủ cần được làm rõ, ghi lại tất cả đột tử và các bệnh tim mạch.[14] Các nỗi lực để tìm kiếm lại các hồ sở y tế cũ và / hoặc khám nghiệm sau tử vong cần được thực hiện. Các thành viên gia đình có triệu chứng gợi ý có mặt của một tình trạng tim mạch, chẳng hạn như ngất, đánh trống ngực hoặc đau ngực, cần được ưu tiên để đánh giá.
Việc đánh giá tập trung được đề nghị cho thân nhân thế hệ đầu tiên của nạn nhân đột tử được minh họa trong Bảng 4. Trong trường hợp không có một chẩn đoán trong gia đình, trẻ em rất trẻ nên được kiểm tra ít nhất bằng một ECG cơ bản và siêu âm tim.
Như nhiều bệnh rối loạn nhịp di truyền được đặc trưng bằng thể hiện liên quan đến tuổi và bộc lộ không hoàn tòa, các các thể trẻ hơn cần theo dõi thiếp trong những khoảng thời gian đều đặn.. Người lớn không có triệu chứng và phát triển đầy đủ có thể được loại ra từ các dịch vụ chăm sóc, trừ khi các triệu chứng xuất hiện hoặc thông tin mới từ các gia đình trở nên có giá trị.
Khi một bệnh rối loạn nhịp di truyền được nghi ngờ, các mẫu DNA từ các nạn nhân là nguồn thông tin tốt nhất khi thực hiện một khám nghiệm tử thi phân tử. Nếu có kết quả dương tính, các thành viên trong gia đình nên được cung cấp cơ hội để trải qua sàng lọc di truyền dự đoán, theo một mẫu bậc thang. ‘Quyền không biết ” (right not to know) và khả năng giảm tầm soát phân tử nên được bao gồm trong bất kỳ truyền thông thông tin trước với người thân.
Khi không có các mẫu sinh học từ những người đã chết, mục tiêu sàng lọc phân tử ở các thân nhân thể hệ đầu tiên có thể được xem xét khi có những nghi ngờ về sự có mặt của một căn bệnh di truyền trong gia đình. Ngược lại, sàng lọc di truyền của một nhóm lớn các gen không nên được thực hiện ở các thân nhân SUDS hoặc SADS mà không có manh mối lâm sàng cho một bệnh cụ thể sau khi đánh giá lâm sàng. Điều này đặc biệt đúng trong trường hợp SIDS, nơi khám nghiệm tử thi phân tử xác định phạm vi thấp hơn của các bệnh kênh so với SADS và bệnh di truyền thường xuyên như là một nguyên nhân gây ra đột tử và có thể thường xuyên hơn.
3.4.3 Sàng lọc bệnh nhân có rối loạn nhịp thất chứng minh bằng tư liệu hoặc nghi ngờ
3.4.3.1 Bệnh sử lâm sàng
Hồi hộp (hoặc cảm giác tim đập nhanh đột ngột), gần ngất và ngất là ba triệu chứng quan trọng nhất mà đòi hỏi phải thu lượm bệnh sử kỹ lưỡng và điều tra có thể tiếp tục để loại trừ mối quan hệ với VAs. Hồi hộp liên quan đến nhịp tim nhanh thất (VT) thường có khởi đầu đột ngột / mẫu bù và có thể được liên kết với gần ngất và / hoặc ngất. Các cơn suy sụp đột ngột với mất ý thức mà không có bất kỳ sự báo trước nào phải tăng sự nghi ngờ vể loạn nhịp chậm hoặc VA. Ngất xảy ra trong gắng sức nặng, trong khi ngồi hoặc trong tư thế nằm ngửa nên luôn luôn tăng những nghi ngờ về nguyên nhân tim mạch, trong khi trong các tình huống biến có khác có thể chỉ ra ngất do cường phế vị hoặc hạ huyết áp tư thế. [92] Các triệu chứng liên quan đến bệnh tim cấu trúc cơ bản, chẳng hạn như đau ngực , khó thở và mệt mỏi, cũng có thể có mặt và phải được hỏi kỹ lưỡng. Yêu cầu khai thác kỹ lưỡng bệnh sử gia đình của SCD và các loại thuốc, bao gồm cả liều lượng sử dụng, phải được bao gồm trong việc đánh giá các bệnh nhân nghi ngờ có VA. Một bệnh sử gia đình SCD dương tính là một yếu tố dự báo độc lập mạnh mẽ của tính nhạy cảm với VA và SCD. [57,58] Mặc dù khám lâm sàng hiếm khi được biết, nó có thể đôi khi cung cấp đầu mối quan trọng.
Bảng 4. Phương pháp chẩn đoán cho các thành viên gia đình của hội chứng đột tử không rõ nguyên nhân hoặc nạn nhân hội chứng đột tử do loạn nhịp
|
Phương pháp |
Việc làma |
|
Thu lượm bệnh sử và khám thực thể |
• Bệnh sử lâm sàng cá nhân • Bệnh sử gia định tập chung và bệnh tim hoặc ECG người đột tử |
|
ECG |
• ECG 12 chuyển đạo cơ bản có các chuyển đạo chuẩn và trước tim cao • ECG lưu động 24-h • Test gắng sức • ECG tín hiệu trung bình • Test thúc đẩy loạn nhịp bằng Ajmalin/flecainide (khi nghi ngờ Brugada syndrome) |
|
Hình ảnh tim |
• Siêu âm 2 bình diện và /hoặc CMR (có hay không có tương phản |
|
Test di truyền
|
Test di truyền • Test phân tử được đặt mục tiêu và tư vấn di truyền nếu có nghi ngời lâm sàng của các bệnh đặc biệt • Giới thiệu đến một trung tâm đại học chuyên đánh giá các yếu tố di truyền của chứng loạn nhịp tim |
CMR = cộng hưởng từ tim; ECG = điện tâm đồ.
aCác khuyến cáo trong bảng này được dựa trên sự đồng thuận của nhóm chuyên gia và không phải trên dữ liệu dựa trên bằng chứng.
3.4.3.2 Đánh giá không xâm lấn và đánh giá xâm lấn
Đánh giá không xâm lấn các bệnh nhân loạn nhịp thất nghi ngờ hoặc đã rõ
|
Các khuyến cáo |
Classa |
Levelb |
Ref.c |
|
ECG 12 chuyển đạo lúc nghỉ |
|||
|
ECG 12 chuyển đạo lúc nghỉ được khuyến cáo ở tất cả các bệnh nhân được đánh giá cho VA |
I |
A |
1 |
|
Theo dõi ECG |
|||
|
Theo dõi ECG lưu động được khuyến cáo để phát hiện và chẩn đoán rối loạn nhịp, ECG 12 chuyển đạo theo dõi được khuyến cáo đánh giá các thay đổi khoảng QT hoặc ST |
I |
A |
93 |
|
Ghi ECG sự kiện được khuyến cáo khi các triệu chứng không thường xuyên để xác định các rối loạn nhịp tim thoáng qua có gây ra không. |
I |
B |
94 |
|
Vi mạch cấy vào cơ thể (ILR) được khuyến cáo khi các triệu chứng, ví dụ: ngất thất thường và bị nghi có liên quan đến rối loạn nhịp và mối tương quan triệu chứng – nhịp không thể xác định bằng các kỹ thuật chẩn đoán thông thường. |
I |
B |
95 |
|
SA-ECG được đề nghị để cải thiện chẩn đoán ARVC ở bệnh nhân VAs hoặc ở những người có nguy cơ phát triển VAs đe dọa tính mạng. |
I |
B |
96,97 |
|
Test gắng sức |
|||
|
Test gắng sức được khuyến cáo ở bệnh nhân VA lớn tuổi có xác suất CAD trung bình hay cao hơn theo tuổi và triệu chứng được thúc đẩy các thay đổi thiếu máu cục bộ hay VA. |
I |
B |
98 |
|
Nghiệm pháp gắng sức được khuyến cáo ở những bệnh nhân đã biết hoặc nghi ngờ VA do gắng sức thúc đẩy, bao gồm CPVT, để đạt được chẩn đoán xác định và tiên lượng. |
I |
B |
99 |
|
Test gắng sức nên được xem xét trong việc đánh giá đáp ứng với điều trị nội khoa hoặc triệt phá (ablation) ở bệnh nhân được biết VA thúc đẩy do gắng sức. |
IIa |
C
|
1 |
|
Hình ảnh học |
|||
|
Siêu âm tim để đánh giá chức năng LV và phát hiện các bệnh tim cấu trúc được khuyến cáo trong tất cả các bệnh nhân nghi ngờ hoặc biết VA. |
I |
B |
100, 101 |
|
Siêu âm tim để đánh giá chức năng LV, RV và phát hiện các bệnh tim cấu trúc được khuyến khích cho những bệnh nhân có nguy cơ cao phát triển VAs nghiêm trọng hoặc SCD, chẳng hạn như những bệnh nhân bị bệnh cơ tim giãn, phì đại hoặc bệnh cơ tim thất phát, người sống sót sau nhồi máu cơ tim cấp hoặc người thân của bệnh nhân có rối loại di truyền có SCD. |
I |
B |
100 |
|
Test gắng sức kết hợp với hình ảnh học (test siêu âm tim gắng sức hoặc kiểm tra bài tập căng thẳng siêu âm tim hoặc truyền dịch hạt nhân, SPECT) được khuyến cáo để phát hiện thiếu máu im lặng ở những bệnh nhân Vas có khả năng trung bình cho CAD theo độ tuổi hoặc có triệu chứng và người ECG ít tin cậy (sử dụng digoxin, phì đại LV, 0,1-mm đoạn ST chênh xuống 1 mm lúc nghỉ, hội chứng WPW hoặc LBBB). |
I |
B |
102 |
|
Test gắng sức bằng thuốc kết hợp với thẻ thức hình ành học được khuyến khích để phát hiện thiếu máu im lặng ở bệnh nhân VAs người có xác suất trung bình về CAD theo độ tuổi hoặc có triệu chứng và có thể chất không thể thực hiện test gắng sức do hạn chế triệu chứng. |
I |
B |
103 |
|
CMR hoặc CT cần được xem xét ở những bệnh nhân VAs khi siêu âm tim không cung cấp đánh giá chính xác chức năng LV, RV và / hoặc đánh giá những thay đổi về cơ cấu.. |
IIa |
B |
1 |
ARVC = Bệnh cơ tim thất phải gây loạn nhịp; Bệnh động mạch vành = CAD; CMR = Cộng hưởng từ tim; CPVT = nhịp nhanh thất đa hình do tăng tiết cathecholamine; CT = Chụp cắt lớp điện toán; ECG = điện tâm đồ; LBBB = blốc nhánh trái; LV = thất trái; RV = thất phải; SA-ECG = ECG tín hiệu trung bình; SCD = đột tử do tim; SPECT = chụp cắt điện toán phát xạ photon đơn; VA = loạn nhịp thất; WPW = Wolff-Parkinson-White. a class khuyến cáo b Mức độ bằng chứng. c Tài liệu tham khảo ủng hộ.
Đánh giá xâm lấn các bệnh nhân loạn nhịp thất nghi ngờ hoặc đã rõ
|
Khuyến cáo |
Classa |
Levelb |
Refc |
|
Chụp động mạch vành |
|||
|
Chụp động mạch vành nên được xem xét để xác định hoặc loại trừ CAD tắc nghẽn có ý nghĩa ở những bệnh nhân VAs đe dọa tính mạng hoặc những người sống sót sau SCD, những người có khả năng trung bình hay cáo hơn cho CAD theo tuổi và triệu chứng. |
IIa |
C |
104 |
|
Nghiên cứu điện sinh lý |
|||
|
Nghiên cứu điện sinh lý ở những bệnh nhân CAD được khuyến cáo đánh giá chẩn đoán bệnh nhân bị nhồi máu cơ tim đã lâu với triệu chứng gợi ý nhịp nhanh thất, bao gồm đánh trống ngực, gần ngất và ngất. |
I |
B |
105 |
|
Nghiên cứu điện sinh lý bệnh nhân ngất được khuyến cáo khi nghi ngờ loạn nhịp chậm hoặc nhịp tim nhanh, dựa trên các triệu chứng (ví dụ như đánh trống ngực) hoặc các kết quả đánh giá không xâm lấn, đặc biệt là ở những bệnh nhân có bệnh tim cấu trúc. |
I |
I |
106 |
|
Nghiên cứu điện sinh lý có thể được xem xét để chẩn đoán phân biệt ARVC và nhịp tim nhanh RVOT lành tính hay sarcoidosis. |
IIb |
B |
107 |
ARVC = Bệnh cơ tim thất phải gây loạn nhịp; Bệnh động mạch vành = CAD; RVOT = Nhịp nhanh đường ra thất phải; SCD = Đột tử do tim; VA = loạn nhịp thất.
aclass khuyến cáo b Mức độ bằng chứng. c Tài liệu tham khảo ủng hộ.
ECG 12 chuyển đạo chuẩn có thể cho thấy dấu hiệu rối loạn di truyền liên kết với VAs và SCD như bệnh lý kênh (LQTS, SQTS, hội chứng Brugada, CPVT) và các bệnh cơ tim (ARVC và HCM). Các thông số khác của ECG cho thấy bệnh cấu trúc cơ bản gồm blốc nhánh bó, blốc nhĩ thất (AV), phì đại tâm thất và sóng Q phù hợp với bệnh tim thiếu máu cục bộ hoặc thâm nhiễm. Rối loạn điện giải và ảnh hưởng của các loại thuốc khác nhau có thể dẫn đến những bất thường tái cực và / hoặc kéo dài thời gian QRS.
Điện tâm đồ thường được áp dụng để phát hiện thiếu máu cục bộ im lặng ở bệnh nhân người lớn với VAs. VT tạm thời được tạo ra do gắng sức đã được thông báo ở khoảng 4% ở người lớn tuổi trung niên không triệu chứng và không có liên quan với tăng nguy cơ tử suất toàn bộ.[108] Test gắng sức trong rối loạn nhịp phụ thuộc adrenergic, gồm VT đơn hình và VT đa hình như CPVT là rất hữu ích cho mục đích chẩn đoán và đánh giá đáp ứng điều trị. Test gắng sức ở các bệnh nhân có VAs nguy hiểm đến tính mạng có thể liên quan với rối loạn nhịp cần chuyển nhịp, các thuốc tĩnh mạch (iv) hoặc hồi sức, nhưng vẫn có thể được bảo đảm vì nó là tốt hơn để các loạn nhịp bộc phát và đánh giá rủi ro trong điều kiện được kiểm soát. Người ta cần thực hiện các test này trong điều kiện các thiết bị hồi sức và các nhân viên được huấn luyện luôn luôn có ngay lập tức.
Kỹ thuật ghi lưu động liên tục hoặc tường lúc có thể hỗ trợ trong việc liên quan đến sự hiện diện các triệu chứng của rối loạn nhịp tim. Các cơn thiếu máu cục bộ im lặng cũng có thể được phát hiện. Nghi Holter liên tục 24- 48-h là thích hợp bất cứ khi nào các rối loạn nhịp tim được biết hoặc nghi ngờ xảy ra ít nhất một lần một ngày. Đối với các cơn lẻ tẻ, ghi ECG sự kiện thông thường hữu ích hơn, vì chúng có thể ghi lại qua thời gian dài. Các thiết bị cấy ghép dưới da liên tục theo dõi các biến cố nhịp tim và kỷ lục trong một khoảng thời gian tính bằng năm có thể ghi được kích hoạt tự động cho bệnh nhân hoặc các tiêu chí định sẵn. Chúng có thể rất hữu ích trong việc chẩn đoán loạn nhịp nhanh và nhịp chậm nghiêm trọng ở những bệnh nhân có các triệu chứng đe dọa tính mạng như ngất. Các ‘’ghi vi mạch có thể tiêm’’ (‘injectable’ loop recorders) không cần phải đòi hỏi chuẩn bị ngoại khoa truyền thống.
ECG tín hiệu trung bình (SA-ECG) cải thiện tín hiệu: tỷ lệ tiếng ồn của một ECG bề mặt đến mức độ tín hiệu biên độ thấp (mức độ microvolt), được cho là ‘’điện thế trế’’, có thể được nhận biết ở cuối của phức hợp QRS. Điện thế trễ chỉ ra khu vực cơ tim bất thường với dẫn truyền chậm, bất thường của nền có thể cho phép nhịp nhanh thất vào lại. SA-ECG được khuyến cáo cho chẩn đoán phân biệt bệnh tim cấu trúc, như ARVC, ở những bệnh nhân VAs.
Siêu âm tim là kỹ thuật hình ảnh phổ biến nhất được sử dụng do, so với sự cộng hưởng từ tim (CMR) và chụp cắt lớp điện toán (CT) là rẻ tiền, sẵn có và cung cấp chẩn đoán chính xác cho cơ tim, van tim và các rối loạn tim bẩm sinh kết hợp với VA và SCD. [109] Ngoài ra, chức năng tâm thu LV và vận động thành khu vực có thể được đánh giá trong phần lớn các bệnh nhân. Vì vậy siêu âm tim được chỉ định ở những bệnh nhân VA nghi ngờ mắc bệnh tim cấu trúc và trong nhóm bệnh nhân có nguy cơ cao đối với sự phát triển VA nghiêm trọng hoặc SCD, chẳng hạn như những người bị bệnh cơ tim giãn, phì đại hoặc bệnh cơ tim thất phải (RV), những người sống sót sau nhồi máu cơ tim cấp hoặc người thân của bệnh nhân có rối loạn di truyền liên kết với SCD. Sự kết hợp của siêu âm tim với test gắng sức hoặc bằng thuốc (thường được gọi là ‘echo tress’) được áp dụng cho một nhóm được lựa chọn các bệnh nhân nghi ngờ VA kích hoạt bằng thiếu máu cục bộ và những người không thể thực hiện gắng sức hoặc bất thường ECG lúc nghỉ do giới hạn về độ chính xác của ECG để phát hiện thiếu máu cục bộ.
Những tiến bộ trong CMR đã làm cho kỹ thuật này có thể để đánh giá cả về cấu trúc và chức năng của tim đang đập. Độ phân giải hình ảnh xuất sắc thu được với các kỹ thuật hiện hành cho phép định lượng chính xác thể tích các buồng tim, khối lượng và chức năng LV. Đây là giá trị đặc biệt cho bệnh nhân nghi ngờ ARVC, trong đó CMR cung cấp đánh giá tuyệt vời của kích thước RV, chức năng và vận động thành trong khu vực.
CT cho phép định lượng chính xác của khối lượng LV, phân suất tống máu và khối lượng, với kết quả tương đương với CMR, nhưng ngoài ra cung cấp hình ảnh phân đoạn của động mạch vành từ đó mức độ vôi hóa có thể định lượng được. CT tim có thể được sử dụng ở những bệnh nhân được chọn trong đó đánh giá cấu trúc của tim là không khả thi với siêu âm tim và không có sẵn CMR. Nguồn gốc bất thường của động mạch vành có thể được phát hiện bằng CT hoặc kỹ thuật hình ảnh khác.
Chụp cắt lớp điện toán phát dòng photon đơn tưới máu cơ tim (myocardial perfusion single-photon emission CT:SPECT) sử dụng gắng sức hoặc thuốc có thể áp dụng cho một nhóm được lựa chọn của bệnh nhân bị nghi ngờ mắc VA kích hoạt do thiếu máu cục bộ và những người không thể gắng sức hoặc có bất thường ECG lúc nghỉ giới hạn về độ chính xác của ECG để phát hiện thiếu máu cục bộ. Định lượng chính xác LVEF có thể với chụp mạch phóng xạ hạt nhân được cửa chặn (quét sóng thu nhận đa cửa) và có thể hữu ích ở những bệnh nhân không có khả năng thực hiện siêu âm tim.
Chụp động mạch vành đóng một vai trò quan trọng trong việc xác định chẩn đoán hoặc loại trừ sự có mặt của CAD tắc nghẽn đáng kể ở bệnh nhân VA đe dọa tính mạng hay ở những người sống sót sau SCD.
Một nghiên cứu về điện sinh lý (EPS) với PVS đã được sử dụng để chứng minh bằng tư liệu khả năng tạo ra VT, hướng dẫn triệt phá (ablation), đánh giá nguy cơ VT tái phát hoặc SCD, đánh mất ý thức ở những bệnh nhân được lựa chọn với loạn nhịp tim bị nghi ngờ là nguyên nhân và đánh giá các chỉ định điều trị ICD. Phạm vi của EPS thay đổi về cơ bản với các loại và mức độ nghiêm trọng của bệnh tim, sự hiện diện hay vắng mặt của VT tự phát, điều trị bằng thuốc đồng thời, giao thức kích thích và vị trí kích thích. Các mức đáp ứng cao nhất và khả năng tái lập quan sát thấy ở những bệnh nhân sau nhồi máu cơ tim và khuyến cáo sử dụng trong các trường hợp được lựa chọn sẽ được đưa ra trong tài liệu này.
Để đánh giá bệnh nhân VAs, hầu hết các trung tâm sử dụng 8 kích thích tâm thất ở chiều dài chu kỳ dẫn nhịp giữa 600 ms và 400 ms ở mỏm RV, ở ngưỡng hai lần tâm trương và thời gian xung từ 0.5- 2 ms, phát ra 1 đến 3 kích thích thất ở mức cơ bản . Xét nghiệm này có thể được lặp đi lặp lại trong suốt quá trình truyền isoproterenol. [110] Tính đến sớm của các kích thích ngoài được tăng lên đến tận thời kỳ trơ hoặc tạo ra nhịp nhanh thất dai dẳng đạt được. Do sự kích thích tâm thất sớm với một khoảng thời gian ghép (coupling) rất ngắn có nhiều khả năng gây ra VF đối lại với VT đơn hình, nó có thể là hợp lý để hạn chế tính đến sớm của các kích thích ngoài đến tối thiểu là 180 ms khi nghiên cứu những bệnh nhân chỉ có thể tạo ra VT đơn hình dai dẳng sẽ được xem xét là tiêu chí dương tính. EPS có thể được lặp đi lặp ngoài mỏm RV – đường ra thất phải (RVOT) hoặc LV.
EPS có thể được dùng để chứng minh nguyên nhân ngất do loạn nhịp tim và nên được sử dụng để bổ sung cho thu lượm đánh giá ngất đầy đủ. Nó rất hữu ích nhất ở bệnh nhân có rối loạn chức năng LV và CAD. EPS có thể được sử dụng để chứng minh bằng tư liệu hoặc thúc đẩy loạn nhịp chậm hoặc blốc AV khi các kiểm tra khác có thể thất bại trong việc cung cấp thông tin kết luận. Phạm vi chẩn đoán thay đổi rất lớn với các quần thể bệnh nhân lựa chọn [111] và ở mức thấp nếu không có bệnh tim cấu trúc hoặc ECG bất thường. Ở bệnh nhân ngất, blốc nhánh mạn tính và giảm phân suất tống máu (< 45%), VT có thể được tạo ra trong quá trình EPS đạt đến 42% các trường hợp. Ở bệnh nhân ngất và blốc nhánh, EPS âm tính giả thường gặp.[112] EPs có thể thúc đẩy đáp ứng nhịp nhanh không đặc hiệu ở các bệnh nhân có chức năng LV bảo tồn LV không có bệnh tim thực thể.
Các tiện ích của EPS để xác định chẩn đoán và hướng dẫn điều trị ở những bệnh nhân bệnh cơ tim và hội chứng loạn nhịp tiên phát di truyền được thảo luận trong phần 7 và 8. Tóm lại, EPS có thể đóng một vai trò trong ARVC [113,114] hoặc bệnh nhân DCM, [115] trong khi nó không góp phần vào xác định bệnh nhân có nguy cơ cao trong HCM (loại III) [116]. . Trong số các các bệnh kênh, EPS được không được ghi trong LQTS, [117] CPVT [14] và SQTS, [118.119] trong khi tiện ích của nó được tranh luận trong hội chứng Brugada [120].
Ngất ở bệnh nhân có bệnh tim cấu trúc và nói riêng trong rối loạn chức năng thất trái đáng kể là điểm xâus. VT tạm thời trong theo dõi Holter, ngất và bệnh tim cấu trúc là nhạy cảm cao cho dự báo sự hiện diện của VT có thể tạo ra. Ngất liên quan đến bệnh tim và phân suất tống máu giảm có tần số tái phát và tử vong cao, [121] ngay cả khi kết quả EPS âm tính. EPS là hữu ích ở những bệnh nhân có rối loạn chức LV do nhồi máu cơ tim trước đó (phân suất tống máu < 40%) nhưng không nhạy cảm ở những bệnh nhân có bệnh cơ tim không do thiếu máu cục bộ. Tạo ra VT đa hình hoặc VF, đặc biệt là với các kỹ thuật kích thích bùng nổ là không đặc hiệu. Trong CAD, lợi ích chẩn đoán có thể đạt 50%.
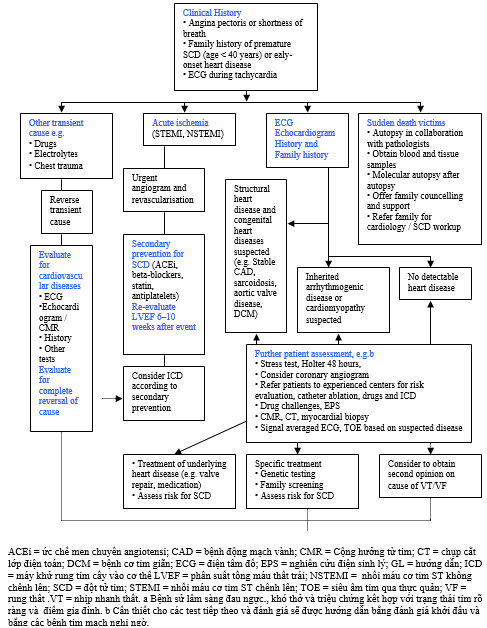
Hình 1 mô tả các thứ tự công việc chẩn đoán được đề nghị cho những bệnh nhân sống sót sau ngừng tim, trong khi điều chỉnh ngừng tim trong tình huống các điều kiện cụ thể được mô tả trong phần 5-12. Bảng 3 trình bày các danh pháp được thông qua khi đề cập đến VAs qua tư liệu này[122]. Các điều tra có thể hé mở những phát hiện bệnh cụ thể được nêu chi tiết trong Bảng 4.
Hình 1 Chẩn đoán được thiết lập ở các bệnh nhân có biểu hiện nhịp nhanh thất dai dẳng hoặc rung thất
(còn nữa)
Tài liệu tham khảo
1. Zipes DP, Camm AJ, Borggrefe M, Buxton AE, Chaitman B, Fromer M, Gregoratos G, Klein G, Moss AJ, Myerburg RJ, Priori SG, Quinones MA, Roden DM, Silka MJ, Tracy C, Blanc JJ, Budaj A, Dean V, Deckers JW, Despres C, Dickstein K, Lekakis J, McGregor K, Metra M, Morais J, Osterspey A, Tamargo JL, Zamorano JL, Smith SC Jr, Jacobs AK, Adams CD, Antman EM, Anderson JL, Hunt SA, Halperin JL, Nishimura R, Ornato JP, Page RL, Riegel B. ACC/AHA/ESC 2006 guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death – executive summary: a report of the American College of Cardiology/American Heart Association Task Force and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Develop Guidelines for Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death) Developed in collaboration with the European Heart Rhythm Association and the Heart Rhythm Society. Eur Heart J 2006;27: 2099–2140.
2. Aliot EM, Stevenson WG, Almendral-Garrote JM, Bogun F, Calkins CH, Delacretaz E, Bella PD, Hindricks G, Jais P, Josephson ME, Kautzner J, Kay GN, Kuck KH, Lerman BB, Marchlinski F, Reddy V, Schalij MJ, Schilling R, Soejima K, Wilber D, European Heart Rhythm Association, European Society of Cardiology, Heart Rhythm Society. EHRA/HRS Expert Consensus on Catheter Ablation of Ventricular Arrhythmias: developed in a partnership with the European Heart Rhythm Association (EHRA), a Registered Branch of the European Society of Cardiology (ESC), and the Heart Rhythm Society (HRS); in collaboration with the American College of Cardiology (ACC) and the American Heart Association (AHA). Europace 2009;11: 771–817.
3. Pedersen CT, Kay GN, Kalman J, Borggrefe M, Della-Bella P, Dickfeld T, Dorian P, Huikuri H, Kim YH, Knight B, Marchlinski F, Ross D, Sacher F, Sapp J, Shivkumar K, Soejima K, Tada H, Alexander ME, Triedman JK, Yamada T, Kirchhof P, Document R, Lip GY, Kuck KH, Mont L, Haines D, Indik J, Dimarco J, Exner D, Iesaka Y, Savelieva I. EHRA/HRS/APHRS expert consensus on ventricular arrhythmias. Europace 2014;16:1257–1283.
4. Vardas PE, Auricchio A, Blanc JJ, Daubert JC, Drexler H, Ector H, Gasparini M, Linde C, Morgado FB, Oto A, Sutton R, Trusz-Gluza M, European Society of Cardiology, European Heart Rhythm Association. Guidelines for cardiac pacing and cardiac resynchronization therapy. The Task Force for Cardiac Pacing and Cardiac Resynchronization Therapy of the European Society of Cardiology. Developed in collaboration with the European Heart Rhythm Association. Europace 2007;9: 959–998.
5. Epstein AE, DiMarco JP, Ellenbogen KA, Estes NA 3rd, Freedman RA, Gettes LS, Gillinov AM, Gregoratos G, Hammill SC, Hayes DL, Hlatky MA, Newby LK, Page RL, Schoenfeld MH, Silka MJ, Stevenson LW, Sweeney MO, Smith SC Jr, Jacobs AK, Adams CD, Anderson JL, Buller CE, Creager MA, Ettinger SM, Faxon DP, Halperin JL, Hiratzka LF, Hunt SA, Krumholz HM, Kushner FG, Lytle BW, Nishimura RA, Ornato JP, Page RL, Riegel B, Tarkington LG, Yancy CW. ACC/AHA/HRS 2008 Guidelines for Device-Based Therapy of Cardiac Rhythm Abnormalities: a report of the American College of Cardiology/ American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the ACC/AHA/NASPE 2002 Guideline Update for Implantation of Cardiac Pacemakers and Antiarrhythmia Devices) developed in collaboration with the American Association for Thoracic Surgery and Society of Thoracic Surgeons. J Am Coll Cardiol 2008;51:e1–62.
6. Goldberger JJ, Cain ME, Hohnloser SH, Kadish AH, Knight BP, Lauer MS, Maron BJ, Page RL, Passman RS, Siscovick D, Stevenson WG, Zipes DP. American Heart Association/American College of Cardiology Foundation/Heart Rhythm Society scientific statement on noninvasive risk stratification techniques for identifying patients at risk for sudden cardiac death: a scientific statement from the American Heart Association Council on Clinical Cardiology Committee on Electrocardiography and Arrhythmias and Council on Epidemiology and Prevention. Circulation 2008;118:1497–1518
7. Dickstein K, Vardas PE, Auricchio A, Daubert JC, Linde C, McMurray J, Ponikowski P, Priori SG, Sutton R, van Veldhuisen DJ. 2010 focused update of ESC Guidelines on device therapy in heart failure: an update of the 2008 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure and the 2007 ESC Guidelines for cardiac and resynchronization therapy. Developed with the special contribution of the Heart Failure Association and the European Heart Rhythm Association. Eur J Heart Fail 2010;12:1143–1153.
8. McMurray JJ, Adamopoulos S, Anker SD, Auricchio A, Bohm M, Dickstein K, Falk V, Filippatos G, Fonseca C, Gomez-Sanchez MA, Jaarsma T, Kober L, Lip GY, Maggioni AP, Parkhomenko A, Pieske BM, Popescu BA, Ronnevik PK, Rutten FH, Schwitter J, Seferovic P, Stepinska J, Trindade PT, Voors AA, Zannad F, Zeiher A. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. Eur Heart J 2012;33:1787–1847.
9. Yancy CW, Jessup M, Bozkurt B, Butler J, Casey DE Jr, Drazner MH, Fonarow GC, Geraci SA, Horwich T, Januzzi JL, Johnson MR, Kasper EK, Levy WC, Masoudi FA, McBride PE, McMurray JJ, Mitchell JE, Peterson PN, Riegel B, Sam F, Stevenson LW, Tang WH, Tsai EJ, Wilkoff BL. 2013 ACCF/AHA guideline for the management of heart failure: executive summary: a report of the American College of Cardiology Foundation/American Heart Association Task Force on practice guidelines. Circulation 2013;128:1810–1852.
10. Brignole M, Auricchio A, Baron-Esquivias G, Bordachar P, Boriani G, Breithardt OA, Cleland J, Deharo JC, Delgado V, Elliott PM, Gorenek B, Israel CW, Leclercq C, Linde C, Mont L, Padeletti L, Sutton R, Vardas PE, Zamorano JL, Achenbach S, Baumgartner H, Bax JJ, Bueno H, Dean V, Deaton C, Erol C, Fagard R, Ferrari R, Hasdai D, Hoes AW, Kirchhof P, Knuuti J, Kolh P, Lancellotti P, Linhart A, Nihoyannopoulos P, Piepoli MF, Ponikowski P, Sirnes PA, Tamargo JL, Tendera M, Torbicki A, Wijns W, Windecker S, Document R, Kirchhof P, Blomstrom-Lundqvist C, Badano LP, Aliyev F, Bansch D, Baumgartner H, Bsata W, Buser P, Charron P, Daubert JC, Dobreanu D, Faerestrand S, Hasdai D, Hoes AW, Le Heuzey JY, Mavrakis H, McDonagh T, Merino JL, Nawar MM, Nielsen JC, Pieske B, Poposka L, Ruschitzka F, Tendera M, Van Gelder IC, Wilson CM. 2013 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy: the Task Force on cardiac pacing and resynchronization therapy of the European Society of Cardiology (ESC). Developed in collaboration with the European Heart Rhythm Association (EHRA). Eur Heart J 2013;34:2281–2329.
11. Epstein AE, DiMarco JP, Ellenbogen KA, Estes NA 3rd, Freedman RA, Gettes LS, Gillinov AM, Gregoratos G, Hammill SC, Hayes DL, Hlatky MA, Newby LK, Page RL, Schoenfeld MH, Silka MJ, Stevenson LW, Sweeney MO, American College of Cardiology Foundation, American Heart Association Task Force on Practice Guidelines, Heart Rhythm Society. 2012 ACCF/AHA/HRS focused update incorporated into the ACCF/AHA/HRS 2008 guidelines for device-based therapy of cardiac rhythm abnormalities: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines and the Heart Rhythm Society. Circulation 2013;127:e283–352.
12. Kusumoto FM, Calkins H, Boehmer J, Buxton AE, Chung MK, Gold MR, Hohnloser SH, Indik J, Lee R, Mehra MR, Menon V, Page RL, Shen WK, Slotwiner DJ, Stevenson LW, Varosy PD, Welikovitch L. HRS/ACC/AHA expert consensus statement on the use of implantable cardioverter-defibrillator therapy in patients who are not included or not well represented in clinical trials. J Am Coll Cardiol 2014;64:1143–1177.
13. Windecker S, Kolh P, Alfonso F, Collet JP, Cremer J, Falk V, Filippatos G, Hamm C, Head SJ, Juni P, Kappetein AP, Kastrati A, Knuuti J, Landmesser U, Laufer G, Neumann FJ, Richter DJ, Schauerte P, Sousa Uva M, Stefanini GG, Taggart DP, Torracca L, Valgimigli M, Wijns W, Witkowski A. 2014 ESC/EACTS Guidelines on myocardial revascularization: the Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS) developed with the special contribution of the European Association of Percutaneous Cardiovascular Interventions (EAPCI). Eur Heart J 2014;35:2541–2619.
14. Priori SG, Wilde AA, Horie M, Cho Y, Behr ER, Berul C, Blom N, Brugada J, Chiang CE, Huikuri H, Kannankeril P, Krahn A, Leenhardt A, Moss A, Schwartz PJ, Shimizu W, Tomaselli G, Tracy C. Executive summary: HRS/ EHRA/APHRS expert consensus statement on the diagnosis and management of patients with inherited primary arrhythmia syndromes. Europace 2013;15: 1389–1406.
15. Fishman GI, Chugh SS, Dimarco JP, Albert CM, Anderson ME, Bonow RO, Buxton AE, Chen PS, Estes M, Jouven X, Kwong R, Lathrop DA, Mascette AM, Nerbonne JM, ORourke B, Page RL, Roden DM, Rosenbaum DS, Sotoodehnia N, Trayanova NA, Zheng ZJ. Sudden cardiac death prediction and prevention: report from a National Heart, Lung, and Blood Institute and Heart Rhythm Society Workshop. Circulation 2010;122:2335–2348.
16. Byard RW, Ranson D, Krous HF, Workshop P. National Australian workshop consensus on the definition of SIDS and initiation of a uniform autopsy approach to unexpected infant and early childhood death. Forensic Sci Med Pathol 2005;1: 289–292.
17. Basso C, Burke M, Fornes P, Gallagher PJ, de Gouveia RH, Sheppard M, Thiene G, van der Wal A, Association for European Cardiovascular P. Guidelines for autopsy investigation of sudden cardiac death. Virchows Arch 2008;452:11–18.
18. Priori S, Schwartz P, Bardy G, Bigger JJ, Borggrefe M, Camm A, Cobb L, Ewy G, Hauer R, Kuck K, Lane R, Lazzara R, Marcus F, Muller J, Myerburg R, Touboul P, Verrier R, Wellens H, Zipes D. Survivors of out-of-hospital cardiac arrest with apparently normal heart. Need for definition and standardized clinical evaluation. Consensus Statement of the Joint Steering Committees of the Unexplained Cardiac Arrest Registry of Europe and of the Idiopathic Ventricular Fibrillation Registry of the United States. Circulation 1997;95:265–272.
19. Niemeijer MN, van den Berg ME, Leening MJ, Hofman A, Franco OH, Deckers JW, Heeringa J, Rijnbeek PR, Stricker BH, Eijgelsheim M. Declining incidence of sudden cardiac death from 1990–2010 in a general middle-aged and elderly population: the Rotterdam Study. Heart Rhythm 2015;12:123–129.
20. Mendis SPP, Norrving B. Global Atlas on Cardiovascular Disease Prevention and Control. Geneva: World Health Organization, 2011. 21. Eckart RE, Shry EA, Burke AP, McNear JA, Appel DA, Castillo-Rojas LM, Avedissian L, Pearse LA, Potter RN, Tremaine L, Gentlesk PJ, Huffer L, Reich SS, Stevenson WG, Department of Defense Cardiovascular Death Registry G. Sudden death in young adults: an autopsy-based series of a population undergoing active surveillance. J Am Coll Cardiol 2011;58:1254–1261.
22. Maron BJ, Gohman TE, Aeppli D. Prevalence of sudden cardiac death during competitive sports activities in Minnesota high school athletes. J Am Coll Cardiol 1998; 32:1881–1884.
23. van der Werf C, Hendrix A, Birnie E, Bots ML, Vink A, Bardai A, Blom MT, Bosch J, Bruins W, Das CK, Koster RW, Naujocks T, Schaap B, Tan HL, de Vos R, de Vries P, Woonink F, Doevendans PA, van Weert HC, Wilde AA, Mosterd A, van Langen IM. Improving usual care after sudden death in the young with focus on inherited cardiac diseases (the CAREFUL study): a community-based intervention study. Europace 2015 Apr 1. pii: euv 059 [Epub ahead of print].
24. United Nations Economic Commission for Europe. UNECE statistical database. Available at http://w3.unece.org/pxweb.
25. Van Camp SP, Bloor CM, Mueller FO, Cantu RC, Olson HG. Nontraumatic sports death in high school and college athletes. Med Sci Sports Exerc 1995;27:641–647.
26. Corrado D, Basso C, Rizzoli G, Schiavon M, Thiene G. Does sports activity enhance the risk of sudden death in adolescents and young adults? J Am Coll Cardiol 2003;42:1959–1963.
27. Maron BJ, Doerer JJ, Haas TS, Tierney DM, Mueller FO. Sudden deaths in young competitive athletes: analysis of 1866 deaths in the United States, 1980–2006. Circulation 2009;119:1085–1092.
28. Choi K, Pan YP, Pock M, Chang RK. Active surveillance of sudden cardiac death in young athletes by periodic Internet searches. Pediatr Cardiol 2013;34:1816–1822.
29. Suarez-Mier MP, Aguilera B, Mosquera RM, Sanchez-de-Leon MS. Pathology of sudden death during recreational sports in Spain. Forensic Sci Int 2013;226: 188–196.
30. Maron BJ, Haas TS, Murphy CJ, Ahluwalia A, Rutten-Ramos S. Incidence and causes of sudden death in U.S. college athletes. J Am Coll Cardiol 2014;63: 1636–1643.
31. Topaz O, Edwards JE. Pathologic features of sudden death in children, adolescents, and young adults. Chest 1985;87:476–482. 32. Drory Y, Turetz Y, Hiss Y, Lev B, Fisman EZ, Pines A, Kramer MR. Sudden unexpected death in persons less than 40 years of age. Am J Cardiol 1991;68: 1388–1392.
33. Wisten A, Forsberg H, Krantz P, Messner T. Sudden cardiac death in 15–35-year olds in Sweden during 1992–99. J Intern Med 2002;252:529–536.
34. Eckart RE, Scoville SL, Campbell CL, Shry EA, Stajduhar KC, Potter RN, Pearse LA, Virmani R. Sudden death in young adults: a 25-year review of autopsies in military recruits. Ann Intern Med 2004;141:829–834.
35. Puranik R, Chow CK, Duflou JA, Kilborn MJ, McGuire MA. Sudden death in the young. Heart Rhythm 2005;2:1277–1282. 36. di Gioia CR, Autore C, Romeo DM, Ciallella C, Aromatario MR, Lopez A, Pagannone E, Giordano C, Gallo P, dAmati G. Sudden cardiac death in younger adults: autopsy diagnosis as a tool for preventive medicine. Hum Pathol 2006;37: 794–801.
37. Papadakis M, Sharma S, Cox S, Sheppard MN, Panoulas VF, Behr ER. The magnitude of sudden cardiac death in the young: a death certificate-based review in England and Wales. Europace 2009;11:1353–1358.
38. Morris VB, Keelan T, Leen E, Keating J, Magee H, ONeill JO, Galvin J. Sudden cardiac death in the young: a 1-year post-mortem analysis in the Republic of Ireland. Ir J Med Sci 2009;178:257–261.
39. Lim Z, Gibbs K, Potts JE, Sanatani S. A review of sudden unexpected death in the young in British Columbia. Can J Cardiol 2010;26:22–26.
40. Winkel BG, Holst AG, Theilade J, Kristensen IB, Thomsen JL, Ottesen GL, Bundgaard H, Svendsen JH, Haunso S, Tfelt-Hansen J. Nationwide study of sudden cardiac death in persons aged 1–35 years. Eur Heart J 2011;32:983–990.
41. Margey R, Roy A, Tobin S, OKeane CJ, McGorrian C, Morris V, Jennings S, Galvin J. Sudden cardiac death in 14- to 35-year olds in Ireland from 2005 to 2007: a retrospective registry. Europace 2011;13:1411–1418.
42. Pilmer CM, Porter B, Kirsh JA, Hicks AL, Gledhill N, Jamnik V, Faught BE, Hildebrandt D, McCartney N, Gow RM, Goodman J, Krahn AD. Scope and nature of sudden cardiac death before age 40 in Ontario: a report from the cardiac death advisory committee of the office of the chief coroner. Heart Rhythm 2013;10: 517–523.
43. de Noronha SV, Behr ER, Papadakis M, Ohta-Ogo K, Banya W, Wells J, Cox S, Cox A, Sharma S, Sheppard MN. The importance of specialist cardiac histopathological examination in the investigation of young sudden cardiac deaths. Europace 2014;16:899–907.
44. Risgaard B, Winkel BG, Jabbari R, Behr ER, Ingemann-Hansen O, Thomsen JL, Ottesen GL, Gislason GH, Bundgaard H, Haunso S, Holst AG, Tfelt-Hansen J. Burden of sudden cardiac death in persons aged 1 to 49 years: nationwide study in Denmark. Circ Arrhythm Electrophysiol 2014;7:205–211.
45. Winkel BG, Risgaard B, Sadjadieh G, Bundgaard H, Haunso S, Tfelt-Hansen J. Sudden cardiac death in children (1–18 years): symptoms and causes of death in a nationwide setting. Eur Heart J 2014;35:868–875.
46. Pilmer CM, Kirsh JA, Hildebrandt D, Krahn AD, Gow RM. Sudden cardiac death in children and adolescents between 1 and 19 years of age. Heart Rhythm 2014;11: 239–245.
47. Vassalini M, Verzeletti A, Restori M, De Ferrari F. An autopsy study of sudden cardiac death in persons aged 1-40 years in Brescia (Italy). J Cardiovasc Med 2015;16: [Epub ahead of print].
48. Mazzanti A, ORourke S, Ng K, Miceli C, Borio G, Curcio A, Esposito F, Napolitano C, Priori SG. The usual suspects in sudden cardiac death of the young: a focus on inherited arrhythmogenic diseases. Expert Rev Cardiovasc Ther 2014;12: 499–519.
49. Maron BJ. Sudden death in young athletes. N Engl J Med 2003;349:1064–1075. 50. Basso C, Carturan E, Pilichou K, Rizzo S, Corrado D, Thiene G. Sudden cardiac death with normal heart: molecular autopsy. Cardiovasc Pathol 2010;19:321–325.
51. Tester DJ, Medeiros-Domingo A, Will ML, Haglund CM, Ackerman MJ. Cardiac channel molecular autopsy: insights from 173 consecutive cases of autopsynegative sudden unexplained death referred for postmortem genetic testing. Mayo Clin Proc 2012;87:524–539.
52. Ackerman MJ, Priori SG, Willems S, Berul C, Brugada R, Calkins H, Camm AJ, Ellinor PT, Gollob M, Hamilton R, Hershberger RE, Judge DP, Le Marec H, McKenna WJ, Schulze-Bahr E, Semsarian C, Towbin JA, Watkins H, Wilde A, Wolpert C, Zipes DP. HRS/EHRA expert consensus statement on the state of genetic testing for the channelopathies and cardiomyopathies. Europace 2011; 13:1077–1109.
53. Wellens HJ, Schwartz PJ, Lindemans FW, Buxton AE, Goldberger JJ, Hohnloser SH, Huikuri HV, Kaab S, La Rovere MT, Malik M, Myerburg RJ, Simoons ML, Swedberg K, Tijssen J, Voors AA, Wilde AA. Risk stratification for sudden cardiac death: current status and challenges for the future. Eur Heart J 2014;35:1642–1651.
54. Myerburg RJ, Kessler KM, Castellanos A. Sudden cardiac death. Structure, function, and time-dependence of risk. Circulation 1992;85:I2–10. 55. Lloyd-Jones DM, Wilson PW, Larson MG, Beiser A, Leip EP, DAgostino RB, Levy D. Framingham risk score and prediction of lifetime risk for coronary heart disease. Am J Cardiol 2004;94:20–24.
56. Perk J, De Backer G, Gohlke H, Graham I, Reiner Z, Verschuren M, Albus C, Benlian P, Boysen G, Cifkova R, Deaton C, Ebrahim S, Fisher M, Germano G, Hobbs R, Hoes A, Karadeniz S, Mezzani A, Prescott E, Ryden L, Scherer M, Syvanne M, Scholte op Reimer WJ, Vrints C, Wood D, Zamorano JL, Zannad F. European Guidelines on cardiovascular disease prevention in clinical practice (version 2012). The Fifth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of nine societies and by invited experts). Eur Heart J 2012;33:1635–1701.
57. Jouven X, Desnos M, Guerot C, Ducimetiere P. Predicting sudden death in the population: the Paris Prospective Study I. Circulation 1999;99:1978–1983.
58. Friedlander Y, Siscovick DS, Weinmann S, Austin MA, Psaty BM, Lemaitre RN, Arbogast P, Raghunathan TE, Cobb LA. Family history as a risk factor for primary cardiac arrest. Circulation 1998;97:155–160.
59. Dekker LR, Bezzina CR, Henriques JP, Tanck MW, Koch KT, Alings MW, Arnold AE, de Boer MJ, Gorgels AP, Michels HR, Verkerk A, Verheugt FW, Zijlstra F, Wilde AA. Familial sudden death is an important risk factor for primary ventricular fibrillation: a case-control study in acute myocardial infarction patients. Circulation 2006;114:1140–1145.
60. Kaikkonen KS, Kortelainen ML, Linna E, Huikuri HV. Family history and the risk of sudden cardiac death as a manifestation of an acute coronary event. Circulation 2006;114:1462–1467.
61. Bezzina CR, Pazoki R, Bardai A, Marsman RF, de Jong JS, Blom MT, Scicluna BP, Jukema JW, Bindraban NR, Lichtner P, Pfeufer A, Bishopric NH, Roden DM, Meitinger T, Chugh SS, Myerburg RJ, Jouven X, Kaab S, Dekker LR, Tan HL, Tanck MW, Wilde AA. Genome-wide association study identifies a susceptibility locus at 21q21 for ventricular fibrillation in acute myocardial infarction. Nat Genet 2010;42:688–691.
62. Arking DE, Junttila MJ, Goyette P, Huertas-Vazquez A, Eijgelsheim M, Blom MT, Newton-Cheh C, Reinier K, Teodorescu C, Uy-Evanado A, Carter-Monroe N, Kaikkonen KS, Kortelainen ML, Boucher G, Lagace C, Moes A, Zhao X, Kolodgie F, Rivadeneira F, Hofman A, Witteman JC, Uitterlinden AG, Marsman RF, Pazoki R, Bardai A, Koster RW, Dehghan A, Hwang SJ, Bhatnagar P, Post W, Hilton G, Prineas RJ, Li M, Kottgen A, Ehret G, Boerwinkle E, Coresh J, Kao WH, Psaty BM, Tomaselli GF, Sotoodehnia N, Siscovick DS, Burke GL, Marban E, Spooner PM, Cupples LA, Jui J, Gunson K, Kesaniemi YA, Wilde AA, Tardif JC, ODonnell CJ, Bezzina CR, Virmani R, Stricker BH, Tan HL, Albert CM, Chakravarti A, Rioux JD, Huikuri HV, Chugh SS. Identification of a sudden cardiac death susceptibility locus at 2q24.2 through genome-wide association in European ancestry individuals. PLoS Genet 2011;7:e1002158.
63. Moss AJ, Zareba W, Hall WJ, Klein H, Wilber DJ, Cannom DS, Daubert JP, Higgins SL, Brown MW, Andrews ML. Prophylactic implantation of a defibrillator in patients with myocardial infarction and reduced ejection fraction. N Engl J Med 2002;346:877–883.
64. Bardy GH, Lee KL, Mark DB, Poole JE, Packer DL, Boineau R, Domanski M, Troutman C, Anderson J, Johnson G, McNulty SE, Clapp-Channing N, Davidson-Ray LD, Fraulo ES, Fishbein DP, Luceri RM, Ip JH, Sudden Cardiac Death in Heart Failure Trial (SCD-HeFT) Investigators. Amiodarone or an implantable cardioverter-defibrillator for congestive heart failure. N Engl J Med 2005;352: 225–237.
65. Scott PA, Barry J, Roberts PR, Morgan JM. Brain natriuretic peptide for the prediction of sudden cardiac death and ventricular arrhythmias: a meta-analysis. Eur J Heart Fail 2009;11:958–966.
66. Levine YC, Rosenberg MA, Mittleman M, Samuel M, Methachittiphan N, Link M, Josephson ME, Buxton AE. B-type natriuretic peptide is a major predictor of ventricular tachyarrhythmias. Heart Rhythm 2014;11:1109–1116.
67. Priori SG, Schwartz PJ, Napolitano C, Bloise R, Ronchetti E, Grillo M, Vicentini A, Spazzolini C, Nastoli J, Bottelli G, Folli R, Cappelletti D. Risk stratification in the long-QT syndrome. N Engl J Med 2003;348:1866–1874.
68. Spirito P, Bellone P, Harris KM, Bernabo P, Bruzzi P, Maron BJ. Magnitude of left ventricular hypertrophy and risk of sudden death in hypertrophic cardiomyopathy. N Engl J Med 2000;342:1778–1785.
69. Barsheshet A, Goldenberg I, O-Uchi J, Moss AJ, Jons C, Shimizu W, Wilde AA, McNitt S, Peterson DR, Zareba W, Robinson JL, Ackerman MJ, Cypress M, Gray DA, Hofman N, Kanters JK, Kaufman ES, Platonov PG, Qi M, Towbin JA, Vincent GM, Lopes CM. Mutations in cytoplasmic loops of the KCNQ1 channel and the risk of life-threatening events: implications for mutation-specific response to beta-blocker therapy in type 1 long-QT syndrome. Circulation 2012;125: 1988–1996.
70. Moss AJ, Zareba W, Kaufman ES, Gartman E, Peterson DR, Benhorin J, Towbin JA, Keating MT, Priori SG, Schwartz PJ, Vincent GM, Robinson JL, Andrews ML, Feng C, Hall WJ, Medina A, Zhang L, Wang Z. Increased risk of arrhythmic events in long-QT syndrome with mutations in the pore region of the human ether-a-go-go-related gene potassium channel. Circulation 2002;105:794–799.
71. van Rijsingen IA, Arbustini E, Elliott PM, Mogensen J, Hermans-van Ast JF, van der Kooi AJ, van Tintelen JP, van den Berg MP, Pilotto A, Pasotti M, Jenkins S, Rowland C, Aslam U, Wilde AA, Perrot A, Pankuweit S, Zwinderman AH, Charron P, Pinto YM. Risk factors for malignant ventricular arrhythmias in lamin a/c mutation carriers a European cohort study. J Am Coll Cardiol 2012;59:493–500.
72. Yoshinaga M, Ushinohama H, Sato S, Tauchi N, Horigome H, Takahashi H, Sumitomo N, Kucho Y, Shiraishi H, Nomura Y, Shimizu W, Nagashima M. Electrocardiographic screening of 1-month-old infants for identifying prolonged QT intervals. Circ Arrhythm Electrophysiol 2013;6:932–938.
73. Yoshinaga M, Kucho Y, Sarantuya J, Ninomiya Y, Horigome H, Ushinohama H, Shimizu W, Horie M. Genetic characteristics of children and adolescents with long-QT syndrome diagnosed by school-based electrocardiographic screening programs. Circ Arrhythm Electrophysiol 2014;7:107–112.
74. Schwartz PJ, Stramba-Badiale M, Crotti L, Pedrazzini M, Besana A, Bosi G, Gabbarini F, Goulene K, Insolia R, Mannarino S, Mosca F, Nespoli L, Rimini A, Rosati E, Salice P, Spazzolini C. Prevalence of the congenital long-QT syndrome. Circulation 2009;120:1761–1767.
75. Corrado D, Pelliccia A, Bjornstad HH, Vanhees L, Biffi A, Borjesson M, Panhuyzen-Goedkoop N, Deligiannis A, Solberg E, Dugmore D, Mellwig KP, Assanelli D, Delise P, van-Buuren F, Anastasakis A, Heidbuchel H, Hoffmann E, Fagard R, Priori SG, Basso C, Arbustini E, Blomstrom-Lundqvist C, McKenna WJ, Thiene G. Cardiovascular pre-participation screening of young competitive athletes for prevention of sudden death: proposal for a common European protocol. Consensus Statement of the Study Group of Sport Cardiology of the Working Group of Cardiac Rehabilitation and Exercise Physiology and the Working Group of Myocardial and Pericardial Diseases of the European Society of Cardiology. Eur Heart J 2005;26:516–524.
76. Maron BJ, Thompson PD, Ackerman MJ, Balady G, Berger S, Cohen D, Dimeff R, Douglas PS, Glover DW, Hutter AM Jr, Krauss MD, Maron MS, Mitten MJ, Roberts WO, Puffer JC. Recommendations and considerations related to preparticipation screening for cardiovascular abnormalities in competitive athletes: 2007 update: a scientific statement from the American Heart Association Council on Nutrition, Physical Activity, and Metabolism: endorsed by the American College of Cardiology Foundation. Circulation 2007;115:1643–1455.
77. Ljungqvist A, Jenoure P, Engebretsen L, Alonso JM, Bahr R, Clough A, De Bondt G, Dvorak J, Maloley R, Matheson G, Meeuwisse W, Meijboom E, Mountjoy M, Pelliccia A, Schwellnus M, Sprumont D, Schamasch P, Gauthier JB, Dubi C, Stupp H, Thill C. The International Olympic Committee (IOC) consensus statement on periodic health evaluation of elite athletes, March 2009. Br J Sports Med 2009;43:631–643.
78. Steinvil A, Chundadze T, Zeltser D, Rogowski O, Halkin A, Galily Y, Perluk H, Viskin S. Mandatory electrocardiographic screening of athletes to reduce their risk for sudden death proven fact or wishful thinking? J Am Coll Cardiol 2011;57: 1291–1296.
79. Narain R, Dhutia H, Merghani A, Myers J, Malhotra A, Millar L, Sheikh N, Sharma S, Papadakis M. Preventing sudden cardiac death in the young: results from a population-based screening program in the UK. European Journal of Preventive Cardiology 2014;21:suppl S1–S6.
80. Kaltman JR, Thompson PD, Lantos J, Berul CI, Botkin J, Cohen JT, Cook NR, Corrado D, Drezner J, Frick KD, Goldman S, Hlatky M, Kannankeril PJ, Leslie L, Priori S, Saul JP, Shapiro-Mendoza CK, Siscovick D, Vetter VL, Boineau R, Burns KM, Friedman RA. Screening for sudden cardiac death in the young: report from a national heart, lung, and blood institute working group. Circulation 2011; 123:1911–1918.
81. James CA, Bhonsale A, Tichnell C, Murray B, Russell SD, Tandri H, Tedford RJ, Judge DP, Calkins H. Exercise increases age-related penetrance and arrhythmic risk in arrhythmogenic right ventricular dysplasia/cardiomyopathy-associated desmosomal mutation carriers. J Am Coll Cardiol 2013;62:1290–1297.
82. Sawant AC, Bhonsale A, te Riele ASJM, Tichnell C, Murray B, Russell SD, Tandri H, Tedford RJ, Judge DP, Calkins H, James CA. Exercise has a disproportionate role in the pathogenesis of arrhythmogenic right ventricular dysplasia/cardiomyopathy in patients without desmosomal mutations. J Am Heart Assoc 2014;3:e001471.
83. Behr ER, Dalageorgou C, Christiansen M, Syrris P, Hughes S, Tome Esteban MT, Rowland E, Jeffery S, McKenna WJ. Sudden arrhythmic death syndrome: familial evaluation identifies inheritable heart disease in the majority of families. Eur Heart J 2008;29:1670–1680.
84. Charron P, Arad M, Arbustini E, Basso C, Bilinska Z, Elliott P, Helio T, Keren A, McKenna WJ, Monserrat L, Pankuweit S, Perrot A, Rapezzi C, Ristic A, Seggewiss H, van Langen I, Tavazzi L, European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Genetic counselling and testing in cardiomyopathies: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J 2010;31: 2715–2726.
85. Christiaans I, Birnie E, Bonsel GJ, Wilde AA, van Langen IM. Uptake of genetic counselling and predictive DNA testing in hypertrophic cardiomyopathy. Eur J Hum Genet 2008;16:1201–1207. 86. Ormondroyd E, Oates S, Parker M, Blair E, Watkins H. Pre-symptomatic genetic testing for inherited cardiac conditions: a qualitative exploration of psychosocial and ethical implications. Eur J Hum Genet 2014;22:88–93.
87. Ingles J, Yeates L, Hunt L, McGaughran J, Scuffham PA, Atherton J, Semsarian C. Health status of cardiac genetic disease patients and their at-risk relatives. Int J Cardiol 2013;165:448–453.
88. Battista RN, Blancquaert I, Laberge AM, van Schendel N, Leduc N. Genetics in health care: an overview of current and emerging models. Public Health Genomics 2012;15:34–45.
89. Ingles J, Lind JM, Phongsavan P, Semsarian C. Psychosocial impact of specialized cardiac genetic clinics for hypertrophic cardiomyopathy. Genet Med 2008;10: 117–120.
90. Christiaans I, van Langen IM, Birnie E, Bonsel GJ, Wilde AA, Smets EM. Quality of life and psychological distress in hypertrophic cardiomyopathy mutation carriers: a cross-sectional cohort study. Am J Med Genet A 2009;149A:602–612.
91. McGorrian C, Constant O, Harper N, ODonnell C, Codd M, Keelan E, Green A, ONeill J, Galvin J, Mahon NG. Family-based cardiac screening in relatives of victims of sudden arrhythmic death syndrome. Europace 2013;15:1050–1058.
92. Moya A, Sutton R, Ammirati F, Blanc JJ, Brignole M, Dahm JB, Deharo JC, Gajek J, Gjesdal K, Krahn A, Massin M, Pepi M, Pezawas T, Ruiz Granell R, Sarasin F, Ungar A, van Dijk JG, Walma EP, Wieling W. Guidelines for the diagnosis and management of syncope. Eur Heart J 2009;30:2631–2671.
93. George S, Rodriguez I, Ipe D, Sager PT, Gussak I, Vajdic B. Computerized extraction of electrocardiograms from continuous 12-lead Holter recordings reduces measurement variability in a thorough QT study. J Clin Pharmacol 2012;52: 1891–1900.
94. de Asmundis C, Conte G, Sieira J, Chierchia GB, Rodriguez-Manero M, Di Giovanni G, Ciconte G, Levinstein M, Baltogiannis G, Saitoh Y, Casado-Arroyo R, Brugada P. Comparison of the patient-activated event recording system vs. traditional 24 h Holter electrocardiography in individuals with paroxysmal palpitations or dizziness. Europace 2014;16:1231–1235.
95. Volosin K, Stadler RW, Wyszynski R, Kirchhof P. Tachycardia detection performance of implantable loop recorders: results from a large real-life patient cohort and patients with induced ventricular arrhythmias. Europace 2013;15:1215–1222.
96. Kamath GS, Zareba W, Delaney J, Koneru JN, McKenna W, Gear K, Polonsky S, Sherrill D, Bluemke D, Marcus F, Steinberg JS. Value of the signal-averaged electrocardiogram in arrhythmogenic right ventricular cardiomyopathy/dysplasia. Heart Rhythm 2011;8:256–262.
97. Nava A, Folino AF, Bauce B, Turrini P, Buja GF, Daliento L, Thiene G. Signal-averaged electrocardiogram in patients with arrhythmogenic right ventricular cardiomyopathy and ventricular arrhythmias. Eur Heart J 2000;21:58–65.
98. Gibbons RJ, Balady GJ, Bricker JT, Chaitman BR, Fletcher GF, Froelicher VF, Mark DB, McCallister BD, Mooss AN, OReilly MG, Winters WL, Gibbons RJ, Antman EM, Alpert JS, Faxon DP, Fuster V, Gregoratos G, Hiratzka LF, Jacobs AK, Russell RO, Smith SC. ACC/AHA 2002 guideline update for exercise testing: summary article. A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee to Update the 1997 Exercise Testing Guidelines). J Am Coll Cardiol 2002;40:1531–1540.
99. Podrid PJ, Graboys TB. Exercise stress testing in the management of cardiac rhythm disorders. Med Clin North Am 1984;68:1139–1152.
100. Prastaro M, DAmore C, Paolillo S, Losi M, Marciano C, Perrino C, Ruggiero D, Gargiulo P, Savarese G, Trimarco B, Perrone Filardi P. Prognostic role of transthoracic echocardiography in patients affected by heart failure and reduced ejection fraction. Heart Fail Rev 2015;20:305–316.
101. Chiu DT, Shapiro NI, Sun BC, Mottley JL, Grossman SA. Are echocardiography, telemetry, ambulatory electrocardiography monitoring, and cardiac enzymes in emergency department patients presenting with syncope useful tests? A preliminary investigation. J Emerg Med 2014;47:113–118.
102. Zellweger MJ, Hachamovitch R, Kang X, Hayes SW, Friedman JD, Germano G, Berman DS. Threshold, incidence, and predictors of prognostically high-risk silent ischemia in asymptomatic patients without prior diagnosis of coronary artery disease. J Nucl Cardiol 2009;16:193–200.
103. Kang X, Berman DS, Lewin H, Miranda R, Erel J, Friedman JD, Amanullah AM. Comparative ability of myocardial perfusion single-photon emission computed tomography to detect coronary artery disease in patients with and without diabetes mellitus. Am Heart J 1999;137:949–957.
104. Zelias A, Stepinska J, Andres J, Trabka-Zawicki A, Sadowski J, Zmudka K. Ten-year experience of an invasive cardiology centre with out-of-hospital cardiac arrest patients admitted for urgent coronary angiography. Kardiol Pol 2014;72:687–699.
105. Zaman S, Narayan A, Thiagalingam A, Sivagangabalan G, Thomas S, Ross DL, Kovoor P. Significance of repeat programmed ventricular stimulation at electrophysiology study for arrhythmia prediction after acute myocardial infarction. Pacing Clin Electrophysiol 2014;37:795–802.
106. Brembilla-Perrot B, Suty-Selton C, Houriez P, Claudon O, Beurrier D, de la Chaise AT. Value of non-invasive and invasive studies in patients with bundle branch block, syncope and history of myocardial infarction. Europace 2001;3: 187–194.
107. Dechering DG, Kochhauser S, Wasmer K, Zellerhoff S, Pott C, Kobe J, Spieker T, Piers SR, Bittner A, Monnig G, Breithardt G, Wichter T, Zeppenfeld K, Eckardt L. Electrophysiological characteristics of ventricular tachyarrhythmias in cardiac sarcoidosis versus arrhythmogenic right ventricular cardiomyopathy. Heart Rhythm 2013;10:158–164.
108. Marine JE, Shetty V, Chow GV, Wright JG, Gerstenblith G, Najjar SS, Lakatta EG, Fleg JL. Prevalence and prognostic significance of exercise-induced nonsustained ventricular tachycardia in asymptomatic volunteers: BLSA (Baltimore Longitudinal Study of Aging). J Am Coll Cardiol 2013;62:595–600.
109. Cheitlin MD, Armstrong WF, Aurigemma GP, Beller GA, Bierman FZ, Davis JL, Douglas PS, Faxon DP, Gillam LD, Kimball TR, Kussmaul WG, Pearlman AS, Philbrick JT, Rakowski H, Thys DM. ACC/AHA/ASE 2003 guideline update for the clinical application of echocardiography-summary article: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (ACC/AHA/ASE Committee to Update the 1997 Guidelines for the Clinical Application of Echocardiography). J Am Coll Cardiol 2003;42: 954–970.
110. Summitt J, Rosenheck S, Kou WH, Schmaltz S, Kadish AH, Morady F. Effect of basic drive cycle length on the yield of ventricular tachycardia during programmed ventricular stimulation. Am J Cardiol 1990;65:49–52.
111. Denes P, Uretz E, Ezri MD, Borbola J. Clinical predictors of electrophysiologic findings in patients with syncope of unknown origin. Arch Intern Med 1988;148: 1922–1928.
112. Brignole M, Menozzi C, Moya A, Garcia-Civera R, Mont L, Alvarez M, Errazquin F, Beiras J, Bottoni N, Donateo P, International Study on Syncope of Uncertain Etiology (ISSUE) Investigators. Mechanism of syncope in patients with bundle branch block and negative electrophysiological test. Circulation 2001;104:2045–2050.
113. Roguin A, Bomma CS, Nasir K, Tandri H, Tichnell C, James C, Rutberg J, Crosson J, Spevak PJ, Berger RD, Halperin HR, Calkins H. Implantable cardioverterdefibrillators in patients with arrhythmogenic right ventricular dysplasia/cardiomyopathy. J Am Coll Cardiol 2004;43:1843–1852.
114. Bhonsale A, James CA, Tichnell C, Murray B, Gagarin D, Philips B, Dalal D, Tedford R, Russell SD, Abraham T, Tandri H, Judge DP, Calkins H. Incidence and predictors of implantable cardioverter-defibrillator therapy in patients with arrhythmogenic right ventricular dysplasia/cardiomyopathy undergoing implantable cardioverter-defibrillator implantation for primary prevention. J Am Coll Cardiol 2011;58:1485–1496.
115. Goldberger JJ, Subacius H, Patel T, Cunnane R, Kadish AH. Sudden cardiac death risk stratification in patients with nonischemic dilated cardiomyopathy. J Am Coll Cardiol 2014;63:1879–1889.
116. Elliott PM, Anastasakis A, Borger MA, Borggrefe M, Cecchi F, Charron P, Hagege AA, Lafont A, Limongelli G, Mahrholdt H, McKenna WJ, Mogensen J, Nihoyannopoulos P, Nistri S, Pieper PG, Pieske B, Rapezzi C, Rutten FH, Tillmanns C, Watkins H. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy: The Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardiology (ESC). Eur Heart J 2014;35:2733–2779.
117. Bhandari AK, Shapiro WA, Morady F, Shen EN, Mason J, Scheinman MM. Electrophysiologic testing in patients with the long QT syndrome. Circulation 1985;71: 63–71.
118. Giustetto C, Schimpf R, Mazzanti A, Scrocco C, Maury P, Anttonen O, Probst V, Blanc JJ, Sbragia P, Dalmasso P, Borggrefe M, Gaita F. Long-term follow-up of patients with short QT syndrome. J Am Coll Cardiol 2011;58:587–595.
119. Mazzanti A, Kanthan A, Monteforte N, Memmi M, Bloise R, Novelli V, Miceli C, ORourke S, Borio G, Zienciuk-Krajka A, Curcio A, Surducan AE, Colombo M, Napolitano C, Priori SG. Novel insight into the natural history of short QT syndrome. J Am Coll Cardiol 2014;63:1300–1308.
120. Brugada J, Brugada R, Brugada P. Determinants of sudden cardiac death in individuals with the electrocardiographic pattern of Brugada syndrome and no previous cardiac arrest. Circulation 2003;108:3092–3096.
121. Middlekauff HR, Stevenson WG, Stevenson LW, Saxon LA. Syncope in advanced heart failure: high risk of sudden death regardless of origin of syncope. J Am Coll Cardiol 1993;21:110–116.
122. Surawicz B, Knilas T. Chous Electrocardiography in Clinical Practice. Philadelphia, PA: Saunders Elsevier, 2008. 123. Amiodarone Trials Meta Analysis Investigators. Effect of prophylactic amiodarone on mortality after acute myocardial infarction and in congestive heart failure: meta-analysis of individual data from 6500 patients in randomised trials. Lancet 1997;350:1417–1424.
124. Boutitie F, Boissel JP, Connolly SJ, Camm AJ, Cairns JA, Julian DG, Gent M, Janse MJ, Dorian P, Frangin G. Amiodarone interaction with beta-blockers: analysis of the merged EMIAT (European Myocardial Infarct Amiodarone Trial) and CAMIAT (Canadian Amiodarone Myocardial Infarction Trial) databases. The EMIAT and CAMIAT Investigators. Circulation 1999;99:2268–2275.
125. Ray WA, Murray KT, Meredith S, Narasimhulu SS, Hall K, Stein CM. Oral erythromycin and the risk of sudden death from cardiac causes. N Engl J Med 2004;351: 1089–1096.
126. Mosholder AD, Mathew J, Alexander JJ, Smith H, Nambiar S. Cardiovascular risks with azithromycin and other antibacterial drugs. N Engl J Med 2013;368: 1665–1668.
127. Belardinelli L, Giles WR, Rajamani S, Karagueuzian HS, Shryock JC. Cardiac late Na(+) current: proarrhythmic effects, roles in long QT syndromes, and pathological relationship to CaMKII and oxidative stress. Heart Rhythm 2015;12: 440–448.
128. Sarganas G, Garbe E, Klimpel A, Hering RC, Bronder E, Haverkamp W. Epidemiology of symptomatic drug-induced long QT syndrome and torsade de pointes in Germany. Europace 2014;16:101–108.
129. Cardiac Arrhythmia Suppression Trial (CAST) Investigators. Preliminary report: effect of encainide and flecainide on mortality in a randomized trial of arrhythmia suppression after myocardial infarction. N Engl J Med 1989;321:406–412.
130. Kontos MC, Diercks DB, Ho PM, Wang TY, Chen AY, Roe MT. Treatment and outcomes in patients with myocardial infarction treated with acute beta-blocker therapy: results from the American College of Cardiologys NCDRw. Am Heart J 2011;161:864–870.
131. Echt DS, Liebson PR, Mitchell LB, Peters RW, Obias-Manno D, Barker AH, Arensberg D, Baker A, Friedman L, Greene HL, Huther ML, Richardson DW, CAST Investigators. Mortality and morbidity in patients receiving encainide, flecainide, or placebo. The Cardiac Arrhythmia Suppression Trial. N Engl J Med 1991;324:781–788.
132. Singh SN, Fletcher RD, Fisher SG, Singh BN, Lewis HD, Deedwania PC, Massie BM, Colling C, Lazzeri D. Amiodarone in patients with congestive heart failure and asymptomatic ventricular arrhythmia. Survival Trial of Antiarrhythmic Therapy in Congestive Heart Failure. N Engl J Med 1995;333:77–82.
133. Piccini JP, Berger JS, OConnor CM. Amiodarone for the prevention of sudden cardiac death: a meta-analysis of randomized controlled trials. Eur Heart J 2009; 30:1245–1253.
134. Singh BN, Singh SN, Reda DJ, Tang XC, Lopez B, Harris CL, Fletcher RD, Sharma SC, Atwood JE, Jacobson AK, Lewis HD Jr, Raisch DW, Ezekowitz MD, Sotalol Amiodarone Atrial Fibrillation Efficacy Trial (SAFE-T) Investigators. Amiodarone versus sotalol for atrial fibrillation. N Engl J Med 2005;352:1861–1872.
135. Lafuente-Lafuente C, Longas-Tejero MA, Bergmann JF, Belmin J. Antiarrhythmics for maintaining sinus rhythm after cardioversion of atrial fibrillation. Cochrane Database Syst Rev 2012;5:CD005049.
136. Kuhlkamp V, Mewis C, Mermi J, Bosch RF, Seipel L. Suppression of sustained ventricular tachyarrhythmias: a comparison of d,l-sotalol with no antiarrhythmic drug treatment. J Am Coll Cardiol 1999;33:46–52.
137. Waldo AL, Camm AJ, deRuyter H, Friedman PL, MacNeil DJ, Pauls JF, Pitt B, Pratt CM, Schwartz PJ, Veltri EP. Effect of d-sotalol on mortality in patients with left ventricular dysfunction after recent and remote myocardial infarction. The SWORD Investigators. Survival With Oral d-Sotalol. Lancet 1996;348:7–12.
138. Hohnloser SH, Dorian P, Roberts R, Gent M, Israel CW, Fain E, Champagne J, Connolly SJ. Effect of amiodarone and sotalol on ventricular defibrillation threshold: the optimal pharmacological therapy in cardioverter defibrillator patients (OPTIC) trial. Circulation 2006;114:104–109.
139. Bunch TJ, Mahapatra S, Murdock D, Molden J, Weiss JP, May HT, Bair TL, Mader KM, Crandall BG, Day JD, Osborn JS, Muhlestein JB, Lappe DL, Anderson JL. Ranolazine reduces ventricular tachycardia burden and ICD shocks in patients with drug-refractory ICD shocks. Pacing Clin Electrophysiol 2011;34: 1600–1606.
140. Pacifico A, Hohnloser SH, Williams JH, Tao B, Saksena S, Henry PD, Prystowsky EN. Prevention of implantable-defibrillator shocks by treatment with sotalol. N Engl J Med 1999;340:1855–1862. 141. Goyal A, Spertus JA, Gosch K, Venkitachalam L, Jones PG, Van den Berghe G, Kosiborod M. Serum potassium levels and mortality in acute myocardial infarction. JAMA 2012;307:157–164.
142. Alberte C, Zipes DP. Use of nonantiarrhythmic drugs for prevention of sudden cardiac death. J Cardiovasc Electrophysiol 2003;14:S87–S95. 143. Pitt B, Remme W, Zannad F, Neaton J, Martinez F, Roniker B, Bittman R, Hurley S, Kleiman J, Gatlin M, Eplerenone Post-Acute Myocardial Infarction Heart Failure Efficacy and Survival Study Investigators. Eplerenone, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction. N Engl J Med 2003;348:1309–1321.
144. Dries DL, Domanski MJ, Waclawiw MA, Gersh BJ. Effect of antithrombotic therapy on risk of sudden coronary death in patients with congestive heart failure. Am J Cardiol 1997;79:909–913.
145. Mitchell LB, Powell JL, Gillis AM, Kehl V, Hallstrom AP. Are lipid-lowering drugs also antiarrhythmic drugs? An analysis of the Antiarrhythmics versus Implantable Defibrillators (AVID) trial. J Am Coll Cardiol 2003;42:81–87.
146. Smith T, Jordaens L, Theuns DA, van Dessel PF, Wilde AA, Hunink MG. The costeffectiveness of primary prophylactic implantable defibrillator therapy in patients with ischaemic or non-ischaemic heart disease: a European analysis. Eur Heart J 2013;34:211–219.
147. Goldenberg I, Gillespie J, Moss AJ, Hall WJ, Klein H, McNitt S, Brown MW, Cygankiewicz I, Zareba W, Executive Committee of the Multicenter Automatic Defibrillator Implantation Trial II. Long-term benefit of primary prevention with an implantable cardioverter-defibrillator: an extended 8-year follow-up study of the Multicenter Automatic Defibrillator Implantation Trial II. Circulation 2010;122: 1265–1271.
148. Goldenberg I, Kutyifa V, Klein HU, Cannom DS, Brown MW, Dan A, Daubert JP, Estes NA 3rd, Foster E, Greenberg H, Kautzner J, Klempfner R, Kuniss M, Merkely B, Pfeffer MA, Quesada A, Viskin S, McNitt S, Polonsky B, Ghanem A, Solomon SD, Wilber D, Zareba W, Moss AJ. Survival with cardiac-resynchronization therapy in mild heart failure. N Engl J Med 2014;370: 1694–1701.
149. Garnreiter JM, Pilcher TA, Etheridge SP, Saarel EV. Inappropriate ICD shocks in pediatrics and congenital heart disease patients: Risk factors and programming strategies. Heart Rhythm 2015;12:937–942. 150. van der Heijden AC, Borleffs CJ, Buiten MS, Thijssen J, van Rees JB, Cannegieter SC, Schalij MJ, van Erven L. The clinical course of patients with implantable defibrillators: Extended experience on clinical outcome, device replacements, and device-related complications. Heart Rhythm 2015;12:1169–1176.
151. Connolly SJ, Gent M, Roberts RS, Dorian P, Roy D, Sheldon RS, Mitchell LB, Green MS, Klein GJ, OBrien B. Canadian implantable defibrillator study (CIDS): a randomized trial of the implantable cardioverter defibrillator against amiodarone. Circulation 2000;101:1297–1302.
152. Kuck KH, Cappato R, Siebels J, Ruppel R. Randomized comparison of antiarrhythmic drug therapy with implantable defibrillators in patients resuscitated from cardiac arrest: the Cardiac Arrest Study Hamburg (CASH). Circulation 2000;102: 748–754.
153. The Antiarrhythmics versus Implantable Defibrillators (AVID) Investigators. A comparison of antiarrhythmic-drug therapy with implantable defibrillators in patients resuscitated from near-fatal ventricular arrhythmias. N Engl J Med 1997;337: 1576–1583.
154. Connolly SJ, Hallstrom AP, Cappato R, Schron EB, Kuck KH, Zipes DP, Greene HL, Boczor S, Domanski M, Follmann D, Gent M, Roberts RS. Meta-analysis of the implantable cardioverter defibrillator secondary prevention trials. AVID, CASH and CIDS studies. Antiarrhythmics vs Implantable Defibrillator study. Cardiac Arrest Study Hamburg. Canadian Implantable Defibrillator Study. Eur Heart J 2000;21:2071–2078.
155. CASCADE Investigators. Randomized antiarrhythmic drug therapy in survivors of cardiac arrest (the CASCADE Study). Am J Cardiol 1993;72:280–287.
156. Connolly SJ, Dorian P, Roberts RS, Gent M, Bailin S, Fain ES, Thorpe K, Champagne J, Talajic M, Coutu B, Gronefeld GC, Hohnloser SH, Optimal Pharmacological Therapy in Cardioverter Defibrillator Patients (OPTIC) Investigators. Comparison of beta-blockers, amiodarone plus beta-blockers, or sotalol for prevention of shocks from implantable cardioverter defibrillators: the OPTIC Study: a randomized trial. JAMA 2006;295:165–171.
157. Weiss R, Knight BP, Gold MR, Leon AR, Herre JM, Hood M, Rashtian M, Kremers M, Crozier I, Lee KL, Smith W, Burke MC. Safety and efficacy of a totally subcutaneous implantable-cardioverter defibrillator. Circulation 2013;128: 944–953.
158. Lambiase PD, Barr C, Theuns DA, Knops R, Neuzil P, Johansen JB, Hood M, Pedersen S, Kaab S, Murgatroyd F, Reeve HL, Carter N, Boersma L. Worldwide experience with a totally subcutaneous implantable defibrillator: early results from the EFFORTLESS S-ICD Registry. Eur Heart J 2014;35:1657–1665.
159. Bardy GH, Smith WM, Hood MA, Crozier IG, Melton IC, Jordaens L, Theuns D, Park RE, Wright DJ, Connelly DT, Fynn SP, Murgatroyd FD, Sperzel J, Neuzner J, Spitzer SG, Ardashev AV, Oduro A, Boersma L, Maass AH, Van Gelder IC, Wilde AA, van Dessel PF, Knops RE, Barr CS, Lupo P, Cappato R, Grace AA. An entirely subcutaneous implantable cardioverter-defibrillator. N Engl J Med 2010;363:36–44.
160. Jarman JW, Lascelles K, Wong T, Markides V, Clague JR, Till J. Clinical experience of entirely subcutaneous implantable cardioverter-defibrillators in children and adults: cause for caution. Eur Heart J 2012;33:1351–1359.
161. Dabiri Abkenari L, Theuns DA, Valk SD, Van Belle Y, de Groot NM, Haitsma D, Muskens-Heemskerk A, Szili-Torok T, Jordaens L. Clinical experience with a novel subcutaneous implantable defibrillator system in a single center. Clin Res Cardiol 2011;100:737–744.
162. Olde Nordkamp LR, Dabiri Abkenari L, Boersma LV, Maass AH, de Groot JR, van Oostrom AJ, Theuns DA, Jordaens LJ, Wilde AA, Knops RE. The entirely subcutaneous implantable cardioverter-defibrillator: initial clinical experience in a large Dutch cohort. J Am Coll Cardiol 2012;60:1933–1939.
163. Aydin A, Hartel F, Schluter M, Butter C, Kobe J, Seifert M, Gosau N, Hoffmann B, Hoffmann M, Vettorazzi E, Wilke I, Wegscheider K, Reichenspurner H, Eckardt L, Steven D, Willems S. Shock efficacy of subcutaneous implantable cardioverterdefibrillator for prevention of sudden cardiac death: initial multicenter experience. Circ Arrhythm Electrophysiol 2012;5:913–919.
164. Jarman JW, Todd DM. United Kingdom national experience of entirely subcutaneous implantable cardioverter-defibrillator technology: important lessons to learn. Europace 2013;15:1158–1165.
165. Kobe J, Reinke F, Meyer C, Shin DI, Martens E, Kaab S, Loher A, Amler S, Lichtenberg A, Winter J, Eckardt L. Implantation and follow-up of totally subcutaneous versus conventional implantable cardioverter-defibrillators: a multicenter case-control study. Heart Rhythm 2013;10:29–36.
166. Burke MC, Gold MR, Knight BP, Barr CS, Theuns DA, Boersma LV, Knops RE, Weiss R, Leon AR, Herre JM, Husby M, Stein KM, Lambiase PD. Safety and efficacy of the totally subcutaneous implantable defibrillator: 2-year results from a pooled analysis of the IDE Study and EFFORTLESS Registry. J Am Coll Cardiol 2015;65: 1605–1615.
167. Adler A, Halkin A, Viskin S. Wearable cardioverter-defibrillators. Circulation 2013; 127:854–860.
168. Auricchio A, Klein H, Geller CJ, Reek S, Heilman MS, Szymkiewicz SJ. Clinical ef- ficacy of the wearable cardioverter-defibrillator in acutely terminating episodes of ventricular fibrillation. Am J Cardiol 1998;81:1253–1256.
169. Chung MK, Szymkiewicz SJ, Shao M, Zishiri E, Niebauer MJ, Lindsay BD, Tchou PJ. Aggregate national experience with the wearable cardioverter-defibrillator: event rates, compliance, and survival. J Am Coll Cardiol 2010;56:194–203.
170. Epstein AE, Abraham WT, Bianco NR, Kern KB, Mirro M, Rao SV, Rhee EK, Solomon SD, Szymkiewicz SJ. Wearable cardioverter-defibrillator use in patients perceived to be at high risk early post-myocardial infarction. J Am Coll Cardiol 2013; 62:2000–2007.
171. Klein HU, Goldenberg I, Moss AJ. Risk stratification for implantable cardioverter defibrillator therapy: the role of the wearable cardioverter-defibrillator. Eur Heart J 2013;34:2230–2242.
172. Kao AC, Krause SW, Handa R, Karia D, Reyes G, Bianco NR, Szymkiewicz SJ, Wearable defibrillator use In heart Failure (WIF) Investigators. Wearable defibrillator use in heart failure (WIF): results of a prospective registry. BMC Cardiovasc Disord 2012;12:123.
173. Hallstrom AP, Ornato JP, Weisfeldt M, Travers A, Christenson J, McBurnie MA, Zalenski R, Becker LB, Schron EB, Proschan M. Public-access defibrillation and survival after out-of-hospital cardiac arrest. N Engl J Med 2004;351:637–646.
174. Capucci A, Aschieri D, Piepoli MF, Bardy GH, Iconomu E, Arvedi M. Tripling survival from sudden cardiac arrest via early defibrillation without traditional education in cardiopulmonary resuscitation. Circulation 2002;106:1065–1070.
175. de Vreede-Swagemakers JJ, Gorgels AP, Dubois-Arbouw WI, van Ree JW, Daemen MJ, Houben LG, Wellens HJ. Out-of-hospital cardiac arrest in the 1990s: a population-based study in the Maastricht area on incidence, characteristics and survival. J Am Coll Cardiol 1997;30:1500–1505.
176. Moriwaki Y, Tahara Y, Iwashita M, Kosuge T, Suzuki N. Risky locations for out-of-hospital cardiopulmonary arrest in a typical urban city. J Emerg Trauma Shock 2014;7:285–294.
177. Bardy GH, Lee KL, Mark DB, Poole JE, Toff WD, Tonkin AM, Smith W, Dorian P, Yallop JJ, Packer DL, White RD, Longstreth W, Anderson J, Johnson G, Bischoff E, Munkers CD, Brown A, McNulty S, Ray LD, Clapp-Channing NE, Rosenberg Y, Salive M, Schron EB. Rationale and design of the Home Automatic External De- fibrillator Trial (HAT). Am Heart J 2008;155:445–454.
178. Weisfeldt ML, Sitlani CM, Ornato JP, Rea T, Aufderheide TP, Davis D, Dreyer J, Hess EP, Jui J, Maloney J, Sopko G, Powell J, Nichol G, Morrison LJ. Survival after application of automatic external defibrillators before arrival of the emergency medical system: evaluation in the resuscitation outcomes consortium population of 21 million. J Am Coll Cardiol 2010;55:1713–1720.
179. Nolan JP, Soar J, Zideman DA, Biarent D, Bossaert LL, Deakin C, Koster RW, Wyllie J, Bottiger B, Group ERCGW. European Resuscitation Council Guidelines for Resuscitation 2010 Section 1. Executive summary. Resuscitation 2010;81: 1219–1276.
180. Zafari AM, Zarter SK, Heggen V, Wilson P, Taylor RA, Reddy K, Backscheider AG, Dudley SC Jr. A program encouraging early defibrillation results in improved inhospital resuscitation efficacy. J Am Coll Cardiol 2004;44:846–852.
181. Nolan JP, Hazinski MF, Billi JE, Boettiger BW, Bossaert L, de Caen AR, Deakin CD, Drajer S, Eigel B, Hickey RW, Jacobs I, Kleinman ME, Kloeck W, Koster RW, Lim SH, Mancini ME, Montgomery WH, Morley PT, Morrison LJ, Nadkarni VM, OConnor RE, Okada K, Perlman JM, Sayre MR, Shuster M, Soar J, Sunde K, Travers AH, Wyllie J, Zideman D. Part 1: Executive summary: 2010 International Consensus on Cardiopulmonary Resuscitation and Emergency Cardiovascular Care Science With Treatment Recommendations. Resuscitation 2010;81(Suppl 1): e1–25.
182. Griffith MJ, Garratt CJ, Rowland E, Ward DE, Camm AJ. Effects of intravenous adenosine on verapamil-sensitive “idiopathic” ventricular tachycardia. Am J Cardiol 1994;73:759–764.
183. Carbucicchio C, Santamaria M, Trevisi N, Maccabelli G, Giraldi F, Fassini G, Riva S, Moltrasio M, Cireddu M, Veglia F, Della Bella P. Catheter ablation for the treatment of electrical storm in patients with implantable cardioverter-defibrillators: short- and long-term outcomes in a prospective single-center study. Circulation 2008;117:462–469.
184. Calkins H, Epstein A, Packer D, Arria AM, Hummel J, Gilligan DM, Trusso J, Carlson M, Luceri R, Kopelman H, Wilber D, Wharton JM, Stevenson W. Catheter ablation of ventricular tachycardia in patients with structural heart disease using cooled radiofrequency energy: results of a prospective multicenter study. Cooled RF Multi Center Investigators Group. J Am Coll Cardiol 2000;35: 1905–1914.
185. Stevenson WG, Wilber DJ, Natale A, Jackman WM, Marchlinski FE, Talbert T, Gonzalez MD, Worley SJ, Daoud EG, Hwang C, Schuger C, Bump TE, Jazayeri M, Tomassoni GF, Kopelman HA, Soejima K, Nakagawa H. Irrigated radiofrequency catheter ablation guided by electroanatomic mapping for recurrent ventricular tachycardia after myocardial infarction: the multicenter thermocool ventricular tachycardia ablation trial. Circulation 2008;118:2773–2782.
186. Tanner H, Hindricks G, Volkmer M, Furniss S, Kuhlkamp V, Lacroix D, C DEC, Almendral J, Caponi D, Kuck KH, Kottkamp H. Catheter ablation of recurrent scar-related ventricular tachycardia using electroanatomical mapping and irrigated ablation technology: results of the prospective multicenter Euro-VT-study. J Cardiovasc Electrophysiol 2010;21:47–53.
187. Reddy VY, Reynolds MR, Neuzil P, Richardson AW, Taborsky M, Jongnarangsin K, Kralovec S, Sediva L, Ruskin JN, Josephson ME. Prophylactic catheter ablation for the prevention of defibrillator therapy. N Engl J Med 2007;357:2657–2665.
188. Kuck KH, Schaumann A, Eckardt L, Willems S, Ventura R, Delacretaz E, Pitschner HF, Kautzner J, Schumacher B, Hansen PS. Catheter ablation of stable ventricular tachycardia before defibrillator implantation in patients with coronary heart disease (VTACH): a multicentre randomised controlled trial. Lancet 2010; 375:31–40.
189. Poole JE, Johnson GW, Hellkamp AS, Anderson J, Callans DJ, Raitt MH, Reddy RK, Marchlinski FE, Yee R, Guarnieri T, Talajic M, Wilber DJ, Fishbein DP, Packer DL, Mark DB, Lee KL, Bardy GH. Prognostic importance of defibrillator shocks in patients with heart failure. N Engl J Med 2008;359:1009–1017.
190. Kamphuis HC, de Leeuw JR, Derksen R, Hauer RN, Winnubst JA. Implantable cardioverter defibrillator recipients: quality of life in recipients with and without ICD shock delivery: a prospective study. Europace 2003;5:381–389.
191. de Bakker JM, van Capelle FJ, Janse MJ, Tasseron S, Vermeulen JT, de Jonge N, Lahpor JR. Slow conduction in the infarcted human heart. Zigzag course of activation. Circulation 1993;88:915–926.
192. de Chillou C, Lacroix D, Klug D, Magnin-Poull I, Marquie C, Messier M, Andronache M, Kouakam C, Sadoul N, Chen J, Aliot E, Kacet S. Isthmus characteristics of reentrant ventricular tachycardia after myocardial infarction. Circulation 2002;105:726–731.
193. Littmann L, Svenson RH, Gallagher JJ, Selle JG, Zimmern SH, Fedor JM, Colavita PG. Functional role of the epicardium in postinfarction ventricular tachycardia. Observations derived from computerized epicardial activation mapping, entrainment, and epicardial laser photoablation. Circulation 1991;83:1577–1591.
194. Berruezo A, Mont L, Nava S, Chueca E, Bartholomay E, Brugada J. Electrocardiographic recognition of the epicardial origin of ventricular tachycardias. Circulation 2004;109:1842–1847.
195. Daniels DV, Lu YY, Morton JB, Santucci PA, Akar JG, Green A, Wilber DJ. Idiopathic epicardial left ventricular tachycardia originating remote from the sinus of Valsalva: electrophysiological characteristics, catheter ablation, and identification from the 12-lead electrocardiogram. Circulation 2006;113:1659–1666.
196. Bazan V, Gerstenfeld EP, Garcia FC, Bala R, Rivas N, Dixit S, Zado E, Callans DJ, Marchlinski FE. Site-specific twelve-lead ECG features to identify an epicardial origin for left ventricular tachycardia in the absence of myocardial infarction. Heart Rhythm 2007;4:1403–1410.
197. Valles E, Bazan V, Marchlinski FE. ECG criteria to identify epicardial ventricular tachycardia in nonischemic cardiomyopathy. Circ Arrhythm Electrophysiol 2010;3: 63–71.
198. Arenal A, Perez-David E, Avila P, Fernandez-Portales J, Crisostomo V, Baez C, Jimenez-Candil J, Rubio-Guivernau JL, Ledesma-Carbayo MJ, Loughlin G, Bermejo J, Sanchez-Margallo FM, Fernandez-Aviles F. Noninvasive identification of epicardial ventricular tachycardia substrate by magnetic resonance-based signal intensity mapping. Heart Rhythm 2014;11:1456–1464.
199. Perez-David E, Arenal A, Rubio-Guivernau JL, del Castillo R, Atea L, Arbelo E, Caballero E, Celorrio V, Datino T, Gonzalez-Torrecilla E, Atienza F, Ledesma-Carbayo MJ, Bermejo J, Medina A, Fernandez-Aviles F. Noninvasive identification of ventricular tachycardia-related conducting channels using contrast-enhanced magnetic resonance imaging in patients with chronic myocardial infarction: comparison of signal intensity scar mapping and endocardial voltage mapping. J Am Coll Cardiol 2011;57:184–194.
200. Bansch D, Bocker D, Brunn J, Weber M, Breithardt G, Block M. Clusters of ventricular tachycardias signify impaired survival in patients with idiopathic dilated cardiomyopathy and implantable cardioverter defibrillators. J Am Coll Cardiol 2000;36:566–573.
201. Haissaguerre M, Extramiana F, Hocini M, Cauchemez B, Jais P, Cabrera JA, Farre J, Leenhardt A, Sanders P, Scavee C, Hsu LF, Weerasooriya R, Shah DC, Frank R, Maury P, Delay M, Garrigue S, Clementy J. Mapping and ablation of ventricular fibrillation associated with long-QT and Brugada syndromes. Circulation 2003;108: 925–928.
202. Berruezo A, Fernandez-Armenta J, Mont L, Zeljko H, Andreu D, Herczku C, Boussy T, Tolosana JM, Arbelo E, Brugada J. Combined endocardial and epicardial catheter ablation in arrhythmogenic right ventricular dysplasia incorporating scar dechanneling technique. Circ Arrhythm Electrophysiol 2012;5:111–121.
203. Marchlinski FE, Callans DJ, Gottlieb CD, Zado E. Linear ablation lesions for control of unmappable ventricular tachycardia in patients with ischemic and nonischemic cardiomyopathy. Circulation 2000;101:1288–1296.
204. Jais P, Maury P, Khairy P, Sacher F, Nault I, Komatsu Y, Hocini M, Forclaz A, Jadidi AS, Weerasooryia R, Shah A, Derval N, Cochet H, Knecht S, Miyazaki S, Linton N, Rivard L, Wright M, Wilton SB, Scherr D, Pascale P, Roten L, Pederson M, Bordachar P, Laurent F, Kim SJ, Ritter P, Clementy J, Haissaguerre M. Elimination of local abnormal ventricular activities: a new end point for substrate modification in patients with scar-related ventricular tachycardia. Circulation 2012;125:2184–2196.
205. Di Biase L, Santangeli P, Burkhardt DJ, Bai R, Mohanty P, Carbucicchio C, Dello Russo A, Casella M, Mohanty S, Pump A, Hongo R, Beheiry S, Pelargonio G, Santarelli P, Zucchetti M, Horton R, Sanchez JE, Elayi CS, Lakkireddy D, Tondo C, Natale A. Endo-epicardial homogenization of the scar versus limited substrate ablation for the treatment of electrical storms in patients with ischemic cardiomyopathy. J Am Coll Cardiol 2012;60:132–141.
206. Cano O, Hutchinson M, Lin D, Garcia F, Zado E, Bala R, Riley M, Cooper J, Dixit S, Gerstenfeld E, Callans D, Marchlinski FE. Electroanatomic substrate and ablation outcome for suspected epicardial ventricular tachycardia in left ventricular nonischemic cardiomyopathy. J Am Coll Cardiol 2009;54:799–808.
207. Bai R, Di Biase L, Shivkumar K, Mohanty P, Tung R, Santangeli P, Saenz LC, Vacca M, Verma A, Khaykin Y, Mohanty S, Burkhardt JD, Hongo R, Beheiry S, Dello Russo A, Casella M, Pelargonio G, Santarelli P, Sanchez J, Tondo C, Natale A. Ablation of ventricular arrhythmias in arrhythmogenic right ventricular dysplasia/ cardiomyopathy: arrhythmia-free survival after endo-epicardial substrate based mapping and ablation. Circ Arrhythm Electrophysiol 2011;4:478–485.
208. Dinov B, Fiedler L, Schonbauer R, Bollmann A, Rolf S, Piorkowski C, Hindricks G, Arya A. Outcomes in catheter ablation of ventricular tachycardia in dilated nonischemic cardiomyopathy compared with ischemic cardiomyopathy: results from the Prospective Heart Centre of Leipzig VT (HELP-VT) Study. Circulation 2014; 129:728–736.
209. Kojodjojo P, Tokuda M, Bohnen M, Michaud GF, Koplan BA, Epstein LM, Albert CM, John RM, Stevenson WG, Tedrow UB. Electrocardiographic left ventricular scar burden predicts clinical outcomes following infarct-related ventricular tachycardia ablation. Heart Rhythm 2013;10:1119–1124.
210. Della Bella P, Baratto F, Tsiachris D, Trevisi N, Vergara P, Bisceglia C, Petracca F, Carbucicchio C, Benussi S, Maisano F, Alfieri O, Pappalardo F, Zangrillo A, Maccabelli G. Management of ventricular tachycardia in the setting of a dedicated unit for the treatment of complex ventricular arrhythmias: long-term outcome after ablation. Circulation 2013;127:1359–1368.
211. Peichl P, Wichterle D, Pavlu L, Cihak R, Aldhoon B, Kautzner J. Complications of catheter ablation of ventricular tachycardia: a single-center experience. Circ Arrhythm Electrophysiol 2014;7:684–690.
212. Mukaddirov M, Demaria RG, Perrault LP, Frapier JM, Albat B. Reconstructive surgery of postinfarction left ventricular aneurysms: techniques and unsolved problems. Eur J Cardiothorac Surg 2008;34:256–261.
213. Sartipy U, Albage A, Insulander P, Lindblom D. Surgery for ventricular tachycardia in patients undergoing surgical ventricular restoration: the Karolinska approach. J Interv Card Electrophysiol 2007;19:171–178.
214. Moran JM, Kehoe RF, Loeb JM, Lichtenthal PR, Sanders JH Jr, Michaelis LL. Extended endocardial resection for the treatment of ventricular tachycardia and ventricular fibrillation. Ann Thorac Surg 1982;34:538–552.
215. ONeill JO, Starling RC, Khaykin Y, McCarthy PM, Young JB, Hail M, Albert NM, Smedira N, Chung MK. Residual high incidence of ventricular arrhythmias after left ventricular reconstructive surgery. J Thorac Cardiovasc Surg 2005;130:1250–1256.
216. Rastegar H, Link MS, Foote CB, Wang PJ, Manolis AS, Estes NA 3rd. Perioperative and long-term results with mapping-guided subendocardial resection and left ventricular endoaneurysmorrhaphy. Circulation 1996;94:1041–1048.
217. Page PL, Cardinal R, Shenasa M, Kaltenbrunner W, Cossette R, Nadeau R. Surgical treatment of ventricular tachycardia. Regional cryoablation guided by computerized epicardial and endocardial mapping. Circulation 1989;80:I124–134.
218. Josephson ME, Harken AH, Horowitz LN. Endocardial excision: a new surgical technique for the treatment of recurrent ventricular tachycardia. Circulation 1979;60:1430–1439.
219. Krishnan SC, Josephson ME. Surgery for postinfarction ventricular tachycardia: is it obsolete? Pacing Clin Electrophysiol 2000;23:1295–1301. 220. Iwa T, Misaki T, Kawasuji M, Matsunaga Y, Tsubota M, Matsumoto Y. Long-term results of surgery for non-ischemic ventricular tachycardia. Eur J Cardiothorac Surg 1991;5:191–197.
221. Karamlou T, Silber I, Lao R, McCrindle BW, Harris L, Downar E, Webb GD, Colman JM, Van Arsdell GS, Williams WG. Outcomes after late reoperation in patients with repaired tetralogy of Fallot: the impact of arrhythmia and arrhythmia surgery. Ann Thorac Surg 2006;81:1786–1793.
222. Tilz RR, Makimoto H, Lin T, Rillig A, Deiss S, Wissner E, Mathew S, Metzner A, Rausch P, Kuck KH, Ouyang F. Electrical isolation of a substrate after myocardial infarction: a novel ablation strategy for unmappable ventricular tachycardiasfeasibility and clinical outcome. Europace 2014;16:1040–1052.
223. Schron EB, Exner DV, Yao Q, Jenkins LS, Steinberg JS, Cook JR, Kutalek SP, Friedman PL, Bubien RS, Page RL, Powell J. Quality of life in the antiarrhythmics versus implantable defibrillators trial: impact of therapy and influence of adverse symptoms and defibrillator shocks. Circulation 2002;105:589–594.
224. Irvine J, Dorian P, Baker B, OBrien BJ, Roberts R, Gent M, Newman D, Connolly SJ. Quality of life in the Canadian Implantable Defibrillator Study (CIDS). Am Heart J 2002;144:282–289.
225. Koopman HM, Vrijmoet-Wiersma CM, Langius JN, van den Heuvel F, Clur SA, Blank CA, Blom NA, ten Harkel AD. Psychological functioning and disease-related quality of life in pediatric patients with an implantable cardioverter defibrillator. Pediatr Cardiol 2012;33:569–575.
226. Berg SK, Higgins M, Reilly CM, Langberg JJ, Dunbar SB. Sleep quality and sleepiness in persons with implantable cardioverter defibrillators: outcome from a clinical randomized longitudinal trial. Pacing Clin Electrophysiol 2012;35:431–443.
227. Vazquez LD, Kuhl EA, Shea JB, Kirkness A, Lemon J, Whalley D, Conti JB, Sears SF. Age-specific differences in women with implantable cardioverter defibrillators: an international multi center study. Pacing Clin Electrophysiol 2008;31:1528–1534.
228. Magyar-Russell G, Thombs BD, Cai JX, Baveja T, Kuhl EA, Singh PP, Montenegro Braga Barroso M, Arthurs E, Roseman M, Amin N, Marine JE, Ziegelstein RC. The prevalence of anxiety and depression in adults with implantable cardioverter defi- brillators: a systematic review. J Psychosom Res 2011;71:223–231.
229. Braunschweig F, Boriani G, Bauer A, Hatala R, Herrmann-Lingen C, Kautzner J, Pedersen SS, Pehrson S, Ricci R, Schalij MJ. Management of patients receiving implantable cardiac defibrillator shocks: recommendations for acute and long-term patient management. Europace 2010;12:1673–1690.
230. Hoogwegt MT, Kupper N, Theuns DA, Zijlstra WP, Jordaens L, Pedersen SS. Undertreatment of anxiety and depression in patients with an implantable cardioverter-defibrillator: impact on health status. Health Psychol 2012;31: 745–753.
231. Lang S, Becker R, Wilke S, Hartmann M, Herzog W, Lowe B. Anxiety disorders in patients with implantable cardioverter defibrillators: frequency, course, predictors, and patients requests for treatment. Pacing Clin Electrophysiol 2014;37: 35–47.
232. Kapa S, Rotondi-Trevisan D, Mariano Z, Aves T, Irvine J, Dorian P, Hayes DL. Psychopathology in patients with ICDs over time: results of a prospective study. Pacing Clin Electrophysiol 2010;33:198–208.
233. Morken IM, Bru E, Norekval TM, Larsen AI, Idsoe T, Karlsen B. Perceived support from healthcare professionals, shock anxiety and post-traumatic stress in implantable cardioverter defibrillator recipients. J Clin Nurs 2014;23:450–460.
234. Versteeg H, Theuns DA, Erdman RA, Jordaens L, Pedersen SS. Posttraumatic stress in implantable cardioverter defibrillator patients: the role of preimplantation distress and shocks. Int J Cardiol 2011;146:438–439.
235. Morken IM, Isaksen K, Karlsen B, Norekval TM, Bru E, Larsen AI. Shock anxiety among implantable cardioverter defibrillator recipients with recent tachyarrhythmia. Pacing Clin Electrophysiol 2012;35:1369–1376.
236. Pedersen SS, van den Broek KC, Erdman RA, Jordaens L, Theuns DA. Preimplantation implantable cardioverter defibrillator concerns and type D personality increase the risk of mortality in patients with an implantable cardioverter de- fibrillator. Europace 2010;12:1446–1452.
237. Mastenbroek MH, Versteeg H, Jordaens L, Theuns DA, Pedersen SS. Ventricular tachyarrhythmias and mortality in patients with an implantable cardioverter defibrillator: impact of depression in the MIDAS cohort. Psychosom Med 2014;76: 58–65.
238. Dunbar SB, Dougherty CM, Sears SF, Carroll DL, Goldstein NE, Mark DB, McDaniel G, Pressler SJ, Schron E, Wang P, Zeigler VL. Educational and psychological interventions to improve outcomes for recipients of implantable cardioverter defibrillators and their families: a scientific statement from the American Heart Association. Circulation 2012;126:2146–2172.
239. Vijgen J, Botto G, Camm J, Hoijer CJ, Jung W, Le Heuzey JY, Lubinski A, Norekval TM, Santomauro M, Schalij M, Schmid JP, Vardas P. Consensus statement of the European Heart Rhythm Association: updated recommendations for driving by patients with implantable cardioverter defibrillators. Europace 2009;11:1097–1107.
240. Johansson I, Stromberg A. Experiences of driving and driving restrictions in recipients with an implantable cardioverter defibrillator-the patient perspective. J Cardiovasc Nurs 2010;25:E1–E10.
241. Steinke EE, Gill-Hopple K, Valdez D, Wooster M. Sexual concerns and educational needs after an implantable cardioverter defibrillator. Heart Lung 2005;34: 299–308.
242. Steinke EE, Jaarsma T, Barnason SA, Byrne M, Doherty S, Dougherty CM, Fridlund B, Kautz DD, Martensson J, Mosack V, Moser DK. Sexual counselling for individuals with cardiovascular disease and their partners: a consensus document from the American Heart Association and the ESC Council on Cardiovascular Nursing and Allied Professions (CCNAP). Eur Heart J 2013;34:3217–3235.
243. Zeigler VL, Nelms T. Almost normal: experiences of adolescents with implantable cardioverter defibrillators. J Spec Pediatr Nurs 2009;14:142–151.
244. Steg PG, Cambou JP, Goldstein P, Durand E, Sauval P, Kadri Z, Blanchard D, Lablanche JM, Gueret P, Cottin Y, Juliard JM, Hanania G, Vaur L, Danchin N. Bypassing the emergency room reduces delays and mortality in ST elevation myocardial infarction: the USIC 2000 registry. Heart 2006;92:1378–1383.
245. Soholm H, Wachtell K, Nielsen SL, Bro-Jeppesen J, Pedersen F, Wanscher M, Boesgaard S, Moller JE, Hassager C, Kjaergaard J. Tertiary centres have improved survival compared to other hospitals in the Copenhagen area after out-of-hospital cardiac arrest. Resuscitation 2013;84:162–167.
246. Xiao G, Guo Q, Shu M, Xie X, Deng J, Zhu Y, Wan C. Safety profile and outcome of mild therapeutic hypothermia in patients following cardiac arrest: systematic review and meta-analysis. Emerg Med J 2013;30:91–100.
247. Boersma E, Maas AC, Deckers JW, Simoons ML. Early thrombolytic treatment in acute myocardial infarction: reappraisal of the golden hour. Lancet 1996;348: 771–775.
248. Boersma E, Primary Coronary Angioplasty vs. Thrombolysis Group. Does time matter? A pooled analysis of randomized clinical trials comparing primary percutaneous coronary intervention and in-hospital fibrinolysis in acute myocardial infarction patients. Eur Heart J 2006;27:779–788.
249. Keeley EC, Boura JA, Grines CL. Comparison of primary and facilitated percutaneous coronary interventions for ST-elevation myocardial infarction: quantitative review of randomised trials. Lancet 2006;367:579–588.
250. Roffi M, Patrono C, Collet JP, Mueller C, Valgimigli M, Andreotti F, Bax JJ, Borger MA, Brotons C, Chew DP, Gencer B, Hasenfuss G, Kjeldsen K, Lancellotti P, Landmesser U, Mehilli J, Mukherjee D, Storey RF, Windecker S. 2015 ESC Guidelines for the Management of Acute Coronary Syndromes in Patients Presenting Without Persistent ST-Segment Elevation. Eur Heart J 2015. doi:10.1093/eurheartj/ehv320.
251. Spaulding CM, Joly LM, Rosenberg A, Monchi M, Weber SN, Dhainaut JF, Carli P. Immediate coronary angiography in survivors of out-of-hospital cardiac arrest. N Engl J Med 1997;336:1629–1633.
252. Dumas F, Cariou A, Manzo-Silberman S, Grimaldi D, Vivien B, Rosencher J, Empana JP, Carli P, Mira JP, Jouven X, Spaulding C. Immediate percutaneous coronary intervention is associated with better survival after out-of-hospital cardiac arrest: insights from the PROCAT (Parisian Region Out of hospital Cardiac ArresT) registry. Circ Cardiovasc Interv 2010;3:200–207.
253. Bowers TR, ONeill WW, Grines C, Pica MC, Safian RD, Goldstein JA. Effect of reperfusion on biventricular function and survival after right ventricular infarction. N Engl J Med 1998;338:933–940.
254. Reddy YM, Chinitz L, Mansour M, Bunch TJ, Mahapatra S, Swarup V, Di Biase L, Bommana S, Atkins D, Tung R, Shivkumar K, Burkhardt JD, Ruskin J, Natale A, Lakkireddy D. Percutaneous left ventricular assist devices in ventricular tachycardia ablation: multicenter experience. Circ Arrhythm Electrophysiol 2014;7:244–250.
255. Lamhaut L, Jouffroy R, Soldan M, Phillipe P, Deluze T, Jaffry M, Dagron C, Vivien B, Spaulding C, An K, Carli P. Safety and feasibility of prehospital extra corporeal life support implementation by non-surgeons for out-of-hospital refractory cardiac arrest. Resuscitation 2013;84:1525–1529.
256. Wang CH, Chou NK, Becker LB, Lin JW, Yu HY, Chi NH, Hunag SC, Ko WJ, Wang SS, Tseng LJ, Lin MH, Wu IH, Ma MH, Chen YS. Improved outcome of extracorporeal cardiopulmonary resuscitation for out-of-hospital cardiac arrest-a comparison with that for extracorporeal rescue for in-hospital cardiac arrest. Resuscitation 2014;85:1219–1224.
257. Piccini JP, Hranitzky PM, Kilaru R, Rouleau JL, White HD, Aylward PE, Van de Werf F, Solomon SD, Califf RM, Velazquez EJ. Relation of mortality to failure to prescribe beta blockers acutely in patients with sustained ventricular tachycardia and ventricular fibrillation following acute myocardial infarction (from the VALsartan In Acute myocardial iNfarcTion trial [VALIANT] Registry). Am J Cardiol 2008;102:1427–1432.
258. Wolfe CL, Nibley C, Bhandari A, Chatterjee K, Scheinman M. Polymorphous ventricular tachycardia associated with acute myocardial infarction. Circulation 1991; 84:1543–1551.
259. Chatterjee S, Chaudhuri D, Vedanthan R, Fuster V, Ibanez B, Bangalore S, Mukherjee D. Early intravenous beta-blockers in patients with acute coronary syndrome—a meta-analysis of randomized trials. Int J Cardiol 2013; 168:915–921.
260. Bangalore S, Makani H, Radford M, Thakur K, Toklu B, Katz SD, DiNicolantonio JJ, Devereaux PJ, Alexander KP, Wetterslev J, Messerli FH. Clinical outcomes with beta-blockers for myocardial infarction: a meta-analysis of randomized trials. Am J Med 2014;127:939–953.
261. Enjoji Y, Mizobuchi M, Muranishi H, Miyamoto C, Utsunomiya M, Funatsu A, Kobayashi T, Nakamura S. Catheter ablation of fatal ventricular tachyarrhythmias storm in acute coronary syndrome—role of Purkinje fiber network. J Interv Card Electrophysiol 2009;26:207–215.
262. Frankel DS, Mountantonakis SE, Robinson MR, Zado ES, Callans DJ, Marchlinski FE. Ventricular tachycardia ablation remains treatment of last resort in structural heart disease: argument for earlier intervention. J Cardiovasc Electrophysiol 2011;22:1123–1128.
263. Peichl P, Cihak R, Kozeluhova M, Wichterle D, Vancura V, Kautzner J. Catheter ablation of arrhythmic storm triggered by monomorphic ectopic beats in patients with coronary artery disease. J Interv Card Electrophysiol 2010;27:51–59.
264. Deneke T, Lemke B, Mugge A, Shin DI, Grewe PH, Horlitz M, Balta O, Bosche L, Lawo T. Catheter ablation of electrical storm. Expert Rev Cardiovasc Ther 2011;9: 1051–1058.
265. Deneke T, Shin DI, Lawo T, Bosche L, Balta O, Anders H, Bunz K, Horlitz M, Grewe PH, Lemke B, Mugge A. Catheter ablation of electrical storm in a collaborative hospital network. Am J Cardiol 2011;108:233–239.
266. Gorenek B, Blomstrom Lundqvist C, Brugada Terradellas J, Camm AJ, Hindricks G, Huber K, Kirchhof P, Kuck KH, Kudaiberdieva G, Lin T, Raviele A, Santini M, Tilz RR, Valgimigli M, Vos MA, Vrints C, Zeymer U, Lip GY, Potpara T, Fauchier L, Sticherling C, Roffi M, Widimsky P, Mehilli J, Lettino M, Schiele F, Sinnaeve P, Boriani G, Lane D, Savelieva I. Cardiac arrhythmias in acute coronary syndromes: position paper from the joint EHRA, ACCA, and EAPCI task force. Europace 2014;16:1655–1673.
267. Shaw DJ, Davidson JE, Smilde RI, Sondoozi T, Agan D. Multidisciplinary team training to enhance family communication in the ICU. Crit Care Med 2014;42:265–271.
268. Piccini JP, Schulte PJ, Pieper KS, Mehta RH, White HD, Van de Werf F, Ardissino D, Califf RM, Granger CB, Ohman EM, Alexander JH. Antiarrhythmic drug therapy for sustained ventricular arrhythmias complicating acute myocardial infarction. Crit Care Med 2011;39:78–83.
269. Huikuri HV, Castellanos A, Myerburg RJ. Sudden death due to cardiac arrhythmias. N Engl J Med 2001;345:1473–1482.
270. Hine LK, Laird N, Hewitt P, Chalmers TC. Meta-analytic evidence against prophylactic use of lidocaine in acute myocardial infarction. Arch Intern Med 1989;149: 2694–2698.
271. Steg PG, James SK, Atar D, Badano LP, Blomstrom-Lundqvist C, Borger MA, Di Mario C, Dickstein K, Ducrocq G, Fernandez-Aviles F, Gershlick AH, Giannuzzi P, Halvorsen S, Huber K, Juni P, Kastrati A, Knuuti J, Lenzen MJ, Mahaffey KW, Valgimigli M, vant Hof A, Widimsky P, Zahger D. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J 2012;33:2569–2619.
272. Borne RT, Varosy PD, Masoudi FA. Implantable cardioverter-defibrillator shocks: epidemiology, outcomes, and therapeutic approaches. JAMA Intern Med 2013;173: 859–865.
273. Liang JJ, Hodge DO, Mehta RA, Russo AM, Prasad A, Cha YM. Outcomes in patients with sustained ventricular tachyarrhythmias occurring within 48 h of acute myocardial infarction: when is ICD appropriate? Europace 2014;16:1759–1766.
274. Hohnloser SH, Kuck KH, Dorian P, Roberts RS, Hampton JR, Hatala R, Fain E, Gent M, Connolly SJ, Investigators D. Prophylactic use of an implantable cardioverter-defibrillator after acute myocardial infarction. N Engl J Med 2004; 351:2481–2488.
275. Steinbeck G, Andresen D, Seidl K, Brachmann J, Hoffmann E, Wojciechowski D, Kornacewicz-Jach Z, Sredniawa B, Lupkovics G, Hofgartner F, Lubinski A, Rosenqvist M, Habets A, Wegscheider K, Senges J, IRIS Investigators. Defibrillator implantation early after myocardial infarction. N Engl J Med 2009;361:1427–1436.
276. Noc M, Fajadet J, Lassen JF, Kala P, MacCarthy P, Olivecrona GK, Windecker S, Spaulding C. Invasive coronary treatment strategies for out-of-hospital cardiac arrest: a consensus statement from the European Association for Percutaneous Cardiovascular Interventions (EAPCI)/Stent for Life (SFL) groups. EuroIntervention 2014;10:31–37.
277. Bougouin W, Marijon E, Puymirat E, Defaye P, Celermajer DS, Le Heuzey JY, Boveda S, Kacet S, Mabo P, Barnay C, Da Costa A, Deharo JC, Daubert JC, Ferrieres J, Simon T, Danchin N. Incidence of sudden cardiac death after ventricular fibrillation complicating acute myocardial infarction: a 5-year cause-of-death analysis of the FAST-MI 2005 registry. Eur Heart J 2014;35:116–122.
278. Avezum A, Piegas LS, Goldberg RJ, Brieger D, Stiles MK, Paolini R, Huang W, Gore JM. Magnitude and prognosis associated with ventricular arrhythmias in patients hospitalized with acute coronary syndromes (from the GRACE Registry). Am J Cardiol 2008;102:1577–1582.
279. Piccini JP, White JA, Mehta RH, Lokhnygina Y, Al-Khatib SM, Tricoci P, Pollack CV Jr, Montalescot G, Van de Werf F, Gibson CM, Giugliano RP, Califf RM, Harrington RA, Newby LK. Sustained ventricular tachycardia and ventricular fibrillation complicating non-ST-segment-elevation acute coronary syndromes. Circulation 2012;126:41–49.
280. Buxton AE, Lee KL, DiCarlo L, Gold MR, Greer GS, Prystowsky EN, OToole MF, Tang A, Fisher JD, Coromilas J, Talajic M, Hafley G. Electrophysiologic testing to identify patients with coronary artery disease who are at risk for sudden death. Multicenter Unsustained Tachycardia Trial Investigators. N Engl J Med 2000;342: 1937–1945.
281. Buxton AE, Lee KL, Hafley GE, Pires LA, Fisher JD, Gold MR, Josephson ME, Lehmann MH, Prystowsky EN. Limitations of ejection fraction for prediction of sudden death risk in patients with coronary artery disease: lessons from the MUSTT study. J Am Coll Cardiol 2007;50:1150–1157.
282. Gatzoulis KA, Tsiachris D, Arsenos P, Archontakis S, Dilaveris P, Vouliotis A, Sideris S, Skiadas I, Kallikazaros I, Stefanadis C. Prognostic value of programmed ventricular stimulation for sudden death in selected high risk patients with structural heart disease and preserved systolic function. Int J Cardiol 2014;176: 1449–1451.
283. Exner DV, Kavanagh KM, Slawnych MP, Mitchell LB, Ramadan D, Aggarwal SG, Noullett C, Van Schaik A, Mitchell RT, Shibata MA, Gulamhussein S, McMeekin J, Tymchak W, Schnell G, Gillis AM, Sheldon RS, Fick GH, Duff HJ. Noninvasive risk assessment early after a myocardial infarction the REFINE study. J Am Coll Cardiol 2007;50:2275–2284.
284. Malik M, Camm AJ, Janse MJ, Julian DG, Frangin GA, Schwartz PJ. Depressed heart rate variability identifies postinfarction patients who might benefit from prophylactic treatment with amiodarone: a substudy of EMIAT (the European Myocardial Infarct Amiodarone Trial). J Am Coll Cardiol 2000;35:1263–1275.
285. Zaman S, Narayan A, Thiagalingam A, Sivagangabalan G, Thomas S, Ross DL, Kovoor P. Long-term arrhythmia-free survival in patients with severe left ventricular dysfunction and no inducible ventricular tachycardia after myocardial infarction. Circulation 2014;129:848–854.
286. Soholm H, Lonborg J, Andersen MJ, Vejlstrup N, Engstrom T, Moller JE, Hassager C. Repeated echocardiography after first ever ST-segment elevation myocardial infarction treated with primary percutaneous coronary intervention—is it necessary? Eur Heart J Acute Cardiovasc Care 2014 Oct 15. pii: 2048872614556000 [Epub ahead of print].
287. Allman KC, Shaw LJ, Hachamovitch R, Udelson JE. Myocardial viability testing and impact of revascularization on prognosis in patients with coronary artery disease and left ventricular dysfunction: a meta-analysis. J Am Coll Cardiol 2002;39: 1151–1158.
288. St John Sutton M, Pfeffer MA, Plappert T, Rouleau JL, Moye LA, Dagenais GR, Lamas GA, Klein M, Sussex B, Goldman S. Quantitative two-dimensional echocardiographic measurements are major predictors of adverse cardiovascular events after acute myocardial infarction. The protective effects of captopril. Circulation 1994; 89:68–75.
289. Kelly P, Ruskin JN, Vlahakes GJ, Buckley MJ Jr, Freeman CS, Garan H. Surgical coronary revascularization in survivors of prehospital cardiac arrest: its effect on inducible ventricular arrhythmias and long-term survival. J Am Coll Cardiol 1990;15: 267–273.
290. van der Burg AE, Bax JJ, Boersma E, Pauwels EK, van der Wall EE, Schalij MJ. Impact of viability, ischemia, scar tissue, and revascularization on outcome after aborted sudden death. Circulation 2003;108:1954–1959.
291. Bax JJ, Visser FC, Poldermans D, Elhendy A, Cornel JH, Boersma E, van Lingen A, Fioretti PM, Visser CA. Time course of functional recovery of stunned and hibernating segments after surgical revascularization. Circulation 2001;104:I314–I318.
292. Funaro S, La Torre G, Madonna M, Galiuto L, Scara A, Labbadia A, Canali E, Mattatelli A, Fedele F, Alessandrini F, Crea F, Agati L. Incidence, determinants, and prognostic value of reverse left ventricular remodelling after primary percutaneous coronary intervention: results of the Acute Myocardial Infarction Contrast Imaging (AMICI) multicenter study. Eur Heart J 2009;30:566–575.
293. Cairns JA, Connolly SJ, Roberts R, Gent M. Randomised trial of outcome after myocardial infarction in patients with frequent or repetitive ventricular premature depolarisations: CAMIAT. Canadian Amiodarone Myocardial Infarction Arrhythmia Trial Investigators. Lancet 1997;349:675–682.
294. Julian DG, Camm AJ, Frangin G, Janse MJ, Munoz A, Schwartz PJ, Simon P. Randomised trial of effect of amiodarone on mortality in patients with left-ventricular dysfunction after recent myocardial infarction: EMIAT. European Myocardial Infarct Amiodarone Trial Investigators. Lancet 1997;349:667–674.
295. Solomon SD, Wang D, Finn P, Skali H, Zornoff L, McMurray JJ, Swedberg K, Yusuf S, Granger CB, Michelson EL, Pocock S, Pfeffer MA. Effect of candesartan on cause-specific mortality in heart failure patients: the Candesartan in Heart failure Assessment of Reduction in Mortality and morbidity (CHARM) program. Circulation 2004;110:2180–2183.
296. Cleland JG, Massie BM, Packer M. Sudden death in heart failure: vascular or electrical? Eur J Heart Fail 1999;1:41–45.
297. Gradman A, Deedwania P, Cody R, Massie B, Packer M, Pitt B, Goldstein S. Predictors of total mortality and sudden death in mild to moderate heart failure. Captopril-Digoxin Study Group. J Am Coll Cardiol 1989;14:564–570.
298. Szabo BM, van Veldhuisen DJ, Crijns HJ, Wiesfeld AC, Hillege HL, Lie KI. Value of ambulatory electrocardiographic monitoring to identify increased risk of sudden death in patients with left ventricular dysfunction and heart failure. Eur Heart J 1994;15:928–933.
299. Doval HC, Nul DR, Grancelli HO, Varini SD, Soifer S, Corrado G, Dubner S, Scapin O, Perrone SV. Nonsustained ventricular tachycardia in severe heart failure. Independent marker of increased mortality due to sudden death. GESICAGEMA Investigators. Circulation 1996;94:3198–3203.
300. Teerlink JR, Jalaluddin M, Anderson S, Kukin ML, Eichhorn EJ, Francis G, Packer M, Massie BM. Ambulatory ventricular arrhythmias in patients with heart failure do not specifically predict an increased risk of sudden death. PROMISE (Prospective Randomized Milrinone Survival Evaluation) Investigators. Circulation 2000;101: 40–46.
301. AlJaroudi WA, Refaat MM, Habib RH, Al-Shaar L, Singh M, Gutmann R, Bloom HL, Dudley SC, Ellinor PT, Saba SF, Shalaby AA, Weiss R, McNamara DM, Halder I, London B, Genetic Risk Assessment of Defibrillator Events Investigators. Effect of angiotensin-converting enzyme inhibitors and receptor blockers on appropriate implantable cardiac defibrillator shock in patients with severe systolic heart failure (from the GRADE Multicenter Study). Am J Cardiol 2015;115:924–931.
302. Pitt B, White H, Nicolau J, Martinez F, Gheorghiade M, Aschermann M, van Veldhuisen DJ, Zannad F, Krum H, Mukherjee R, Vincent J, EPHESUS Investigators. Eplerenone reduces mortality 30 days after randomization following acute myocardial infarction in patients with left ventricular systolic dysfunction and heart failure. J Am Coll Cardiol 2005;46:425–431.
303. Peck KY, Lim YZ, Hopper I, Krum H. Medical therapy versus implantable cardioverter-defibrillator in preventing sudden cardiac death in patients with left ventricular systolic dysfunction and heart failure: a meta-analysis of .35,000 patients. Int J Cardiol 2014;173:197–203.
304. Chatterjee S, Udell JA, Sardar P, Lichstein E, Ryan JJ. Comparable benefit of betablocker therapy in heart failure across regions of the world: meta-analysis of randomized clinical trials. Can J Cardiol 2014;30:898–903.
305. Garg R, Yusuf S. Overview of randomized trials of angiotensin-converting enzyme inhibitors on mortality and morbidity in patients with heart failure. Collaborative Group on ACE Inhibitor Trials. JAMA 1995;273:1450–1456.
306. Kotecha D, Holmes J, Krum H, Altman DG, Manzano L, Cleland JG, Lip GY, Coats AJ, Andersson B, Kirchhof P, von Lueder TG, Wedel H, Rosano G, Shibata MC, Rigby A, Flather MD, Beta-Blockers in Heart Failure Collaborative Group. Efficacy of beta blockers in patients with heart failure plus atrial fibrillation: an individual-patient data meta-analysis. Lancet 2014;384:2235–2243.
307. Kotecha D, Altman DG, Manzano L, Flather MD, Beta-Blockers in Heart Failure Collaborative Group. beta blockers in patients with heart failure and atrial fibrillation—authors reply. Lancet 2015;385:1618–1619.
308. Pitt B, Zannad F, Remme WJ, Cody R, Castaigne A, Perez A, Palensky J, Wittes J. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. Randomized Aldactone Evaluation Study Investigators. N Engl J Med 1999;341:709–717.
309. Zannad F, McMurray JJ, Krum H, van Veldhuisen DJ, Swedberg K, Shi H, Vincent J, Pocock SJ, Pitt B. Eplerenone in patients with systolic heart failure and mild symptoms. N Engl J Med 2011;364:11–21.
310. Bapoje SR, Bahia A, Hokanson JE, Peterson PN, Heidenreich PA, Lindenfeld J, Allen LA, Masoudi FA. Effects of mineralocorticoid receptor antagonists on the risk of sudden cardiac death in patients with left ventricular systolic dysfunction: a meta-analysis of randomized controlled trials. Circ Heart Fail 2013;6:166–173.
311. Borlaug BA, Paulus WJ. Heart failure with preserved ejection fraction: pathophysiology, diagnosis, and treatment. Eur Heart J 2011;32:670–679.
312. Chan MM, Lam CS. How do patients with heart failure with preserved ejection fraction die? Eur J Heart Fail 2013;15:604–613.
313. Bristow MR, Saxon LA, Boehmer J, Krueger S, Kass DA, De Marco T, Carson P, DiCarlo L, DeMets D, White BG, DeVries DW, Feldman AM, Comparison of Medical Therapy, Pacing, and Defibrillation in Heart Failure (COMPANION) Investigators. Cardiac-resynchronization therapy with or without an implantable defibrillator in advanced chronic heart failure. N Engl J Med 2004;350:2140–2150.
314. Cleland JG, Daubert JC, Erdmann E, Freemantle N, Gras D, Kappenberger L, Tavazzi L. The effect of cardiac resynchronization on morbidity and mortality in heart failure. N Engl J Med 2005;352:1539–1549.
315. van Veldhuisen DJ, Maass AH, Priori SG, Stolt P, van Gelder IC, Dickstein K, Swedberg K. Implementation of device therapy (cardiac resynchronization therapy and implantable cardioverter defibrillator) for patients with heart failure in Europe: changes from 2004 to 2008. Eur J Heart Fail 2009;11:1143–1151.
316. Kadish A, Dyer A, Daubert JP, Quigg R, Estes NA, Anderson KP, Calkins H, Hoch D, Goldberger J, Shalaby A, Sanders WE, Schaechter A, Levine JH, Defibrillators in Non-Ischemic Cardiomyopathy Treatment Evaluation Investigators. Prophylactic defibrillator implantation in patients with nonischemic dilated cardiomyopathy. N Engl J Med 2004;350:2151–2158.
317. Desai AS, Fang JC, Maisel WH, Baughman KL. Implantable defibrillators for the prevention of mortality in patients with nonischemic cardiomyopathy: a meta-analysis of randomized controlled trials. JAMA 2004;292:2874–2879.
318. Goldenberg I, Moss AJ, McNitt S, Zareba W, Hall WJ, Andrews ML, Wilber DJ, Klein HU. Time dependence of defibrillator benefit after coronary revascularization in the Multicenter Automatic Defibrillator Implantation Trial (MADIT)-II. J Am Coll Cardiol 2006;47:1811–1817.
319. Packer DL, Prutkin JM, Hellkamp AS, Mitchell LB, Bernstein RC, Wood F, Boehmer JP, Carlson MD, Frantz RP, McNulty SE, Rogers JG, Anderson J, Johnson GW, Walsh MN, Poole JE, Mark DB, Lee KL, Bardy GH. Impact of implantable cardioverter-defibrillator, amiodarone, and placebo on the mode of death in stable patients with heart failure: analysis from the sudden cardiac death in heart failure trial. Circulation 2009;120:2170–2176.
320. Frohlich GM, Holzmeister J, Hubler M, Hubler S, Wolfrum M, Enseleit F, Seifert B, Hurlimann D, Lehmkuhl HB, Noll G, Steffel J, Falk V, Luscher TF, Hetzer R, Ruschitzka F. Prophylactic implantable cardioverter defibrillator treatment in patients with end-stage heart failure awaiting heart transplantation. Heart 2013;99: 1158–1165.
321. Sandner SE, Wieselthaler G, Zuckermann A, Taghavi S, Schmidinger H, Pacher R, Ploner M, Laufer G, Wolner E, Grimm M. Survival benefit of the implantable cardioverter-defibrillator in patients on the waiting list for cardiac transplantation. Circulation 2001;104:I171–I176.
322. Zareba W, Klein H, Cygankiewicz I, Hall WJ, McNitt S, Brown M, Cannom D, Daubert JP, Eldar M, Gold MR, Goldberger JJ, Goldenberg I, Lichstein E, Pitschner H, Rashtian M, Solomon S, Viskin S, Wang P, Moss AJ, Investigators M-C. Effectiveness of Cardiac Resynchronization Therapy by QRS Morphology in the Multicenter Automatic Defibrillator Implantation Trial–Cardiac Resynchronization Therapy (MADIT-CRT). Circulation 2011;123:1061–1072.
323. Birnie DH, Ha A, Higginson L, Sidhu K, Green M, Philippon F, Thibault B, Wells G, Tang A. Impact of QRS morphology and duration on outcomes after cardiac resynchronization therapy: results from the Resynchronization-Defibrillation for Ambulatory Heart Failure Trial (RAFT). Circ Heart Fail 2013;6:1190–1198.
324. Nery PB, Ha AC, Keren A, Birnie DH. Cardiac resynchronization therapy in patients with left ventricular systolic dysfunction and right bundle branch block: a systematic review. Heart Rhythm 2011;8:1083–1087.
325. Sipahi I, Chou JC, Hyden M, Rowland DY, Simon DI, Fang JC. Effect of QRS morphology on clinical event reduction with cardiac resynchronization therapy: meta-analysis of randomized controlled trials. Am Heart J 2012;163:260–267.
326. Bilchick KC, Kamath S, DiMarco JP, Stukenborg GJ. Bundle-branch block morphology and other predictors of outcome after cardiac resynchronization therapy in Medicare patients. Circulation 2010;122:2022–2030.
327. Tang AS, Wells GA, Talajic M, Arnold MO, Sheldon R, Connolly S, Hohnloser SH, Nichol G, Birnie DH, Sapp JL, Yee R, Healey JS, Rouleau JL, ResynchronizationDefibrillation for Ambulatory Heart Failure Trial (RAFT) Investigators. Cardiac-resynchronization therapy for mild-to-moderate heart failure. N Engl J Med 2010;363:2385–2395.
328. Sipahi I, Carrigan TP, Rowland DY, Stambler BS, Fang JC. Impact of QRS duration on clinical event reduction with cardiac resynchronization therapy: meta-analysis of randomized controlled trials. Arch Intern Med 2011;171:1454–1462.
329. Moss AJ, Hall WJ, Cannom DS, Klein H, Brown MW, Daubert JP, Estes NA 3rd, Foster E, Greenberg H, Higgins SL, Pfeffer MA, Solomon SD, Wilber D, Zareba W, MADIT-CRT Trial Investigators. Cardiac-resynchronization therapy for the prevention of heart-failure events. N Engl J Med 2009;361:1329–1338.
330. Linde C, Leclercq C, Rex S, Garrigue S, Lavergne T, Cazeau S, McKenna W, Fitzgerald M, Deharo JC, Alonso C, Walker S, Braunschweig F, Bailleul C, Daubert JC. Long-term benefits of biventricular pacing in congestive heart failure: results from the MUltisite STimulation in cardiomyopathy (MUSTIC) study. J Am Coll Cardiol 2002;40:111–118.
331. Doshi RN, Daoud EG, Fellows C, Turk K, Duran A, Hamdan MH, Pires LA, PAVE Study Group. Left ventricular-based cardiac stimulation post AV nodal ablation evaluation (the PAVE study). J Cardiovasc Electrophysiol 2005;16:1160–1165.
332. Ganesan AN, Brooks AG, Roberts-Thomson KC, Lau DH, Kalman JM, Sanders P. Role of AV nodal ablation in cardiac resynchronization in patients with coexistent atrial fibrillation and heart failure a systematic review. J Am Coll Cardiol 2012;59: 719–726.
333. Gasparini M, Leclercq C, Lunati M, Landolina M, Auricchio A, Santini M, Boriani G, Lamp B, Proclemer A, Curnis A, Klersy C, Leyva F. Cardiac resynchronization therapy in patients with atrial fibrillation: the CERTIFY study (Cardiac Resynchronization Therapy in Atrial Fibrillation Patients Multinational Registry). JACC Heart Fail 2013;1:500–507.
334. Cleland JG, Abraham WT, Linde C, Gold MR, Young JB, Claude Daubert J, Sherfesee L, Wells GA, Tang AS. An individual patient meta-analysis of five randomized trials assessing the effects of cardiac resynchronization therapy on morbidity and mortality in patients with symptomatic heart failure. Eur Heart J 2013; 34:3547–3556.
335. Cleland JG, Daubert JC, Erdmann E, Freemantle N, Gras D, Kappenberger L, Tavazzi L. Longer-term effects of cardiac resynchronization therapy on mortality in heart failure [the CArdiac REsynchronization-Heart Failure (CARE-HF) trial extension phase]. Eur Heart J 2006;27:1928–1932.
336. Gold MR, Thebault C, Linde C, Abraham WT, Gerritse B, Ghio S, St John Sutton M, Daubert JC. Effect of QRS duration and morphology on cardiac resynchronization therapy outcomes in mild heart failure: results from the Resynchronization Reverses Remodeling in Systolic Left Ventricular Dysfunction (REVERSE) study. Circulation 2012;126:822–829.
337. Cunnington C, Kwok CS, Satchithananda DK, Patwala A, Khan MA, Zaidi A, Ahmed FZ, Mamas MA. Cardiac resynchronisation therapy is not associated with a reduction in mortality or heart failure hospitalisation in patients with nonleft bundle branch block QRS morphology: meta-analysis of randomised controlled trials. Heart 2015 Feb 12. doi:10.1136/heartjnl-2014-306811 [Epub ahead of print].
338. Magee CD, Byars LA, DeZee KJ. Limitations of subgroup analyses in meta-analysis of cardiac resynchronization therapy by QRS duration. Arch Intern Med 2012;172: 375.
339. Ruschitzka F, Abraham WT, Singh JP, Bax JJ, Borer JS, Brugada J, Dickstein K, Ford I, Gorcsan J 3rd, Gras D, Krum H, Sogaard P, Holzmeister J, Echo CRTSG. Cardiac-resynchronization therapy in heart failure with a narrow QRS complex. N Engl J Med 2013;369:1395–1405.
340. Camm AJ, Kirchhof P, Lip GY, Schotten U, Savelieva I, Ernst S, Van Gelder IC, Al-Attar N, Hindricks G, Prendergast B, Heidbuchel H, Alfieri O, Angelini A, Atar D, Colonna P, De Caterina R, De Sutter J, Goette A, Gorenek B, Heldal M, Hohloser SH, Kolh P, Le Heuzey JY, Ponikowski P, Rutten FH. Guidelines for the management of atrial fibrillation: the Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC). Eur Heart J 2010;31:2369–2429.
341. Deyell MW, Park KM, Han Y, Frankel DS, Dixit S, Cooper JM, Hutchinson MD, Lin D, Garcia F, Bala R, Riley MP, Gerstenfeld E, Callans DJ, Marchlinski FE. Predictors of recovery of left ventricular dysfunction after ablation of frequent ventricular premature depolarizations. Heart Rhythm 2012;9:1465–1472.
342. Baman TS, Lange DC, Ilg KJ, Gupta SK, Liu TY, Alguire C, Armstrong W, Good E, Chugh A, Jongnarangsin K, Pelosi F Jr., Crawford T, Ebinger M, Oral H, Morady F, Bogun F. Relationship between burden of premature ventricular complexes and left ventricular function. Heart Rhythm 2010;7:865–869.
343. Ban JE, Park HC, Park JS, Nagamoto Y, Choi JI, Lim HE, Park SW, Kim YH. Electrocardiographic and electrophysiological characteristics of premature ventricular complexes associated with left ventricular dysfunction in patients without structural heart disease. Europace 2013;15:735–741.
344. Maggioni AP, Zuanetti G, Franzosi MG, Rovelli F, Santoro E, Staszewsky L, Tavazzi L, Tognoni G. Prevalence and prognostic significance of ventricular arrhythmias after acute myocardial infarction in the fibrinolytic era. GISSI-2 results. Circulation 1993;87:312–322.
345. Blanck Z, Dhala A, Deshpande S, Sra J, Jazayeri M, Akhtar M. Bundle branch reentrant ventricular tachycardia: cumulative experience in 48 patients. J Cardiovasc Electrophysiol 1993;4:253–262. 346. Caceres J, Jazayeri M, McKinnie J, Avitall B, Denker ST, Tchou P, Akhtar M. Sustained bundle branch reentry as a mechanism of clinical tachycardia. Circulation 1989;79:256–270.
347. Tchou P, Jazayeri M, Denker S, Dongas J, Caceres J, Akhtar M. Transcatheter electrical ablation of right bundle branch. A method of treating macroreentrant ventricular tachycardia attributed to bundle branch reentry. Circulation 1988;78: 246–257.
348. Elliott P, Andersson B, Arbustini E, Bilinska Z, Cecchi F, Charron P, Dubourg O, Kuhl U, Maisch B, McKenna WJ, Monserrat L, Pankuweit S, Rapezzi C, Seferovic P, Tavazzi L, Keren A. Classification of the cardiomyopathies: a position statement from the European Society Of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J 2008;29:270–276.
349. Taylor MR, Carniel E, Mestroni L. Familial dilated cardiomyopathy. Orphanet J Rare Dis 2006;1:27.
350. Towbin JA, Lowe AM, Colan SD, Sleeper LA, Orav EJ, Clunie S, Messere J, Cox GF, Lurie PR, Hsu D, Canter C, Wilkinson JD, Lipshultz SE. Incidence, causes, and outcomes of dilated cardiomyopathy in children. JAMA 2006;296:1867–1876.
351. Petretta M, Pirozzi F, Sasso L, Paglia A, Bonaduce D. Review and metaanalysis of the frequency of familial dilated cardiomyopathy. Am J Cardiol 2011;108: 1171–1176.
352. Haas J, Frese KS, Peil B, Kloos W, Keller A, Nietsch R, Feng Z, Muller S, Kayvanpour E, Vogel B, Sedaghat-Hamedani F, Lim WK, Zhao X, Fradkin D, Kohler D, Fischer S, Franke J, Marquart S, Barb I, Li DT, Amr A, Ehlermann P, Mereles D, Weis T, Hassel S, Kremer A, King V, Wirsz E, Isnard R, Komajda M, Serio A, Grasso M, Syrris P, Wicks E, Plagnol V, Lopes L, Gadgaard T, Eiskjaer H, Jorgensen M, Garcia-Giustiniani D, Ortiz-Genga M, Crespo-Leiro MG, Deprez RH, Christiaans I, van Rijsingen IA, Wilde AA, Waldenstrom A, Bolognesi M, Bellazzi R, Morner S, Bermejo JL, Monserrat L, Villard E, Mogensen J, Pinto YM, Charron P, Elliott P, Arbustini E, Katus HA, Meder B. Atlas of the clinical genetics of human dilated cardiomyopathy. Eur Heart J 2015;36:1123–1135.
353. Hershberger RE, Lindenfeld J, Mestroni L, Seidman CE, Taylor MR, Towbin JA. Genetic evaluation of cardiomyopathy—a Heart Failure Society of America practice guideline. J Card Fail 2009;15:83–97.
354. Strickberger SA, Hummel JD, Bartlett TG, Frumin HI, Schuger CD, Beau SL, Bitar C, Morady F, Investigators A. Amiodarone versus implantable cardioverterdefibrillator:randomized trial in patients with nonischemic dilated cardiomyopathy and asymptomatic nonsustained ventricular tachycardia— AMIOVIRT. J Am Coll Cardiol 2003;41:1707–1712.
355. Proietti R, Essebag V, Beardsall J, Hache P, Pantano A, Wulffhart Z, Juta R, Tsang B, Joza J, Nascimento T, Pegoraro V, Khaykin Y, Verma A. Substrate-guided ablation of haemodynamically tolerated and untolerated ventricular tachycardia in patients with structural heart disease: effect of cardiomyopathy type and acute success on long-term outcome. Europace. 2015;17:461–467.
356. Kober L, Torp-Pedersen C, McMurray JJ, Gotzsche O, Levy S, Crijns H, Amlie J, Carlsen J, Dronedarone Study G. Increased mortality after dronedarone therapy for severe heart failure. N Engl J Med 2008;358:2678–2687.
357. Connolly SJ, Camm AJ, Halperin JL, Joyner C, Alings M, Amerena J, Atar D, Avezum A, Blomstrom P, Borggrefe M, Budaj A, Chen SA, Ching CK, Commerford P, Dans A, Davy JM, Delacretaz E, Di Pasquale G, Diaz R, Dorian P, Flaker G, Golitsyn S, Gonzalez-Hermosillo A, Granger CB, Heidbuchel H, Kautzner J, Kim JS, Lanas F, Lewis BS, Merino JL, Morillo C, Murin J, Narasimhan C, Paolasso E, Parkhomenko A, Peters NS, Sim KH, Stiles MK, Tanomsup S, Toivonen L, Tomcsanyi J, Torp-Pedersen C, Tse HF, Vardas P, Vinereanu D, Xavier D, Zhu J, Zhu JR, Baret-Cormel L, Weinling E, Staiger C, Yusuf S, Chrolavicius S, Afzal R, Hohnloser SH. Dronedarone in highrisk permanent atrial fibrillation. N Engl J Med 2011;365:2268–2276.
358. Castelli G, Fornaro A, Ciaccheri M, Dolara A, Troiani V, Tomberli B, Olivotto I, Gensini GF. Improving survival rates of patients with idiopathic dilated cardiomyopathy in Tuscany over 3 decades: impact of evidence-based management. Circ Heart Fail 2013;6:913–921.
359. Alexander PM, Daubeney PE, Nugent AW, Lee KJ, Turner C, Colan SD, Robertson T, Davis AM, Ramsay J, Justo R, Sholler GF, King I, Weintraub RG. Long-term outcomes of dilated cardiomyopathy diagnosed during childhood: results from a national population-based study of childhood cardiomyopathy. Circulation 2013;128:2039–2046.
360. Kuruvilla S, Adenaw N, Katwal AB, Lipinski MJ, Kramer CM, Salerno M. Late gadolinium enhancement on cardiac magnetic resonance predicts adverse cardiovascular outcomes in nonischemic cardiomyopathy: a systematic review and meta-analysis. Circ Cardiovasc Imaging 2014;7:250–258.
361. Bansch D, Antz M, Boczor S, Volkmer M, Tebbenjohanns J, Seidl K, Block M, Gietzen F, Berger J, Kuck KH. Primary prevention of sudden cardiac death in idiopathic dilated cardiomyopathy: the Cardiomyopathy Trial (CAT). Circulation 2002; 105:1453–1458.
362. Roden DM. Drug-induced prolongation of the QT interval. N Engl J Med 2004; 350:1013–1022.
363. Chamberlain DA, Jewitt DE, Julian DG, Campbell RW, Boyle DM, Shanks RG. Oral mexiletine in high-risk patients after myocardial infarction. Lancet 1980;2: 1324–1327.
364. Elliott PM, Gimeno JR, Thaman R, Shah J, Ward D, Dickie S, Tome Esteban MT, McKenna WJ. Historical trends in reported survival rates in patients with hypertrophic cardiomyopathy. Heart 2006;92:785–791.
365. OMahony C, Jichi F, Pavlou M, Monserrat L, Anastasakis A, Rapezzi C, Biagini E, Gimeno JR, Limongelli G, McKenna WJ, Omar RZ, Elliott PM. A novel clinical risk prediction model for sudden cardiac death in hypertrophic cardiomyopathy (HCM risk-SCD). Eur Heart J 2014;35:2010–2020.
366. Pelliccia A, Fagard R, Bjornstad HH, Anastassakis A, Arbustini E, Assanelli D, Biffi A, Borjesson M, Carre F, Corrado D, Delise P, Dorwarth U, Hirth A, Heidbuchel H, Hoffmann E, Mellwig KP, Panhuyzen-Goedkoop N, Pisani A, Solberg EE, van-Buuren F, Vanhees L, Blomstrom-Lundqvist C, Deligiannis A, Dugmore D, Glikson M, Hoff PI, Hoffmann A, Horstkotte D, Nordrehaug JE, Oudhof J, McKenna WJ, Penco M, Priori S, Reybrouck T, Senden J, Spataro A, Thiene G. Recommendations for competitive sports participation in athletes with cardiovascular disease: a consensus document from the Study Group of Sports Cardiology of the Working Group of Cardiac Rehabilitation and Exercise Physiology and the Working Group of Myocardial and Pericardial Diseases of the European Society of Cardiology. Eur Heart J 2005;26:1422–1445.
367. OMahony C, Tome-Esteban M, Lambiase PD, Pantazis A, Dickie S, McKenna WJ, Elliott PM. A validation study of the 2003 American College of Cardiology/European Society of Cardiology and 2011 American College of Cardiology Foundation/American Heart Association risk stratification and treatment algorithms for sudden cardiac death in patients with hypertrophic cardiomyopathy. Heart 2013;99:534–541.
368. OMahony C, Lambiase PD, Quarta G, Cardona M, Calcagnino M, Tsovolas K, Al-Shaikh S, Rahman SM, Arnous S, Jones S, McKenna W, Elliott P. The long-term survival and the risks and benefits of implantable cardioverter defibrillators in patients with hypertrophic cardiomyopathy. Heart 2012;98:116–125.
369. Elliott PM, Sharma S, Varnava A, Poloniecki J, Rowland E, McKenna WJ. Survival after cardiac arrest or sustained ventricular tachycardia in patients with hypertrophic cardiomyopathy. J Am Coll Cardiol 1999;33:1596–1601.
370. Cecchi F, Maron BJ, Epstein SE. Long-term outcome of patients with hypertrophic cardiomyopathy successfully resuscitated after cardiac arrest. J Am Coll Cardiol 1989;13:1283–1288.
371. Maron BJ, Spirito P, Shen WK, Haas TS, Formisano F, Link MS, Epstein AE, Almquist AK, Daubert JP, Lawrenz T, Boriani G, Estes NA 3rd, Favale S, Piccininno M, Winters SL, Santini M, Betocchi S, Arribas F, Sherrid MV, Buja G, Semsarian C, Bruzzi P. Implantable cardioverter-defibrillators and prevention of sudden cardiac death in hypertrophic cardiomyopathy. JAMA 2007;298:405–412.
372. Syska P, Przybylski A, Chojnowska L, Lewandowski M, Sterlinski M, Maciag A, Gepner K, Pytkowski M, Kowalik I, Maczynska-Mazuruk R, Ruzyllo W, Szwed H. Implantable cardioverter-defibrillator in patients with hypertrophic cardiomyopathy: efficacy and complications of the therapy in long-term follow-up. J Cardiovasc Electrophysiol 2010;21:883–889.
373. Monserrat L, Elliott PM, Gimeno JR, Sharma S, Penas-Lado M, McKenna WJ. Nonsustained ventricular tachycardia in hypertrophic cardiomyopathy: an independent marker of sudden death risk in young patients. J Am Coll Cardiol 2003;42: 873–879.
374. Adabag AS, Casey SA, Kuskowski MA, Zenovich AG, Maron BJ. Spectrum and prognostic significance of arrhythmias on ambulatory Holter electrocardiogram in hypertrophic cardiomyopathy. J Am Coll Cardiol 2005;45:697–704.
375. OHanlon R, Grasso A, Roughton M, Moon JC, Clark S, Wage R, Webb J, Kulkarni M, Dawson D, Sulaibeekh L, Chandrasekaran B, Bucciarelli-Ducci C, Pasquale F, Cowie MR, McKenna WJ, Sheppard MN, Elliott PM, Pennell DJ, Prasad SK. Prognostic significance of myocardial fibrosis in hypertrophic cardiomyopathy. J Am Coll Cardiol 2010;56:867–874.
376. Gimeno JR, Tome-Esteban M, Lofiego C, Hurtado J, Pantazis A, Mist B, Lambiase P, McKenna WJ, Elliott PM. Exercise-induced ventricular arrhythmias and risk of sudden cardiac death in patients with hypertrophic cardiomyopathy. Eur Heart J 2009; 30:2599–2605.
377. Inada K, Seiler J, Roberts-Thomson KC, Steven D, Rosman J, John RM, Sobieszczyk P, Stevenson WG, Tedrow UB. Substrate characterization and catheter ablation for monomorphic ventricular tachycardia in patients with apical hypertrophic cardiomyopathy. J Cardiovasc Electrophysiol 2011;22:41–48.
378. Maron BJ, McKenna WJ, Danielson GK, Kappenberger LJ, Kuhn HJ, Seidman CE, Shah PM, Spencer WH 3rd, Spirito P, Ten Cate FJ, Wigle ED. American College of Cardiology/European Society of Cardiology Clinical Expert Consensus Document on Hypertrophic Cardiomyopathy. A report of the American College of Cardiology Foundation Task Force on Clinical Expert Consensus Documents and the European Society of Cardiology Committee for Practice Guidelines. Eur Heart J 2003;24:1965–1991.
379. Gersh BJ, Maron BJ, Bonow RO, Dearani JA, Fifer MA, Link MS, Naidu SS, Nishimura RA, Ommen SR, Rakowski H, Seidman CE, Towbin JA, Udelson JE, Yancy CW, American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines, American Association for Thoracic Surgery, American Society of Echocardiography, American Society of Nuclear Cardiology, Heart Failure Society of America, Heart Rhythm Society, Society for Cardiovascular Angiography and Interventions, Society of Thoracic Surgeons. 2011 ACCF/AHA guideline for the diagnosis and treatment of hypertrophic cardiomyopathy: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation 2011;124: e783–e831.
380. McKenna WJ, Oakley CM, Krikler DM, Goodwin JF. Improved survival with amiodarone in patients with hypertrophic cardiomyopathy and ventricular tachycardia. Br Heart J 1985;53:412–416.
381. Melacini P, Maron BJ, Bobbo F, Basso C, Tokajuk B, Zucchetto M, Thiene G, Iliceto S. Evidence that pharmacological strategies lack efficacy for the prevention of sudden death in hypertrophic cardiomyopathy. Heart 2007;93:708–710.
382. Marcus FI, McKenna WJ, Sherrill D, Basso C, Bauce B, Bluemke DA, Calkins H, Corrado D, Cox MG, Daubert JP, Fontaine G, Gear K, Hauer R, Nava A, Picard MH, Protonotarios N, Saffitz JE, Sanborn DM, Steinberg JS, Tandri H, Thiene G, Towbin JA, Tsatsopoulou A, Wichter T, Zareba W. Diagnosis of arrhythmogenic right ventricular cardiomyopathy/dysplasia: proposed modification of the task force criteria. Eur Heart J 2010;31:806–814.
383. Basso C, Corrado D, Marcus FI, Nava A, Thiene G. Arrhythmogenic right ventricular cardiomyopathy. Lancet 2009;373:1289–1300.
384. Sen-Chowdhry S, Syrris P, Prasad SK, Hughes SE, Merrifield R, Ward D, Pennell DJ, McKenna WJ. Left-dominant arrhythmogenic cardiomyopathy: an under-recognized clinical entity. J Am Coll Cardiol 2008;52:2175–2187.
385. Basso C, Corrado D, Thiene G. Cardiovascular causes of sudden death in young individuals including athletes. Cardiol Rev 1999;7:127–135.
386. Tabib A, Loire R, Chalabreysse L, Meyronnet D, Miras A, Malicier D, Thivolet F, Chevalier P, Bouvagnet P. Circumstances of death and gross and microscopic observations in a series of 200 cases of sudden death associated with arrhythmogenic right ventricular cardiomyopathy and/or dysplasia. Circulation 2003;108: 3000–3005.
387. Schinkel AF. Implantable cardioverter defibrillators in arrhythmogenic right ventricular dysplasia/cardiomyopathy: patient outcomes, incidence of appropriate and inappropriate interventions, and complications. Circ Arrhythm Electrophysiol 2013;6:562–568.
388. Ruwald AC, Marcus F, Estes NA 3rd, Link M, McNitt S, Polonsky B, Calkins H, Towbin JA, Moss AJ, Zareba W. Association of competitive and recreational sport participation with cardiac events in patients with arrhythmogenic right ventricular cardiomyopathy: results from the North American multidisciplinary study of arrhythmogenic right ventricular cardiomyopathy. Eur Heart J 2015;36:1735–43.
389. Corrado D, Leoni L, Link MS, Della Bella P, Gaita F, Curnis A, Salerno JU, Igidbashian D, Raviele A, Disertori M, Zanotto G, Verlato R, Vergara G, Delise P, Turrini P, Basso C, Naccarella F, Maddalena F, Estes NA 3rd, Buja G, Thiene G. Implantable cardioverter-defibrillator therapy for prevention of sudden death in patients with arrhythmogenic right ventricular cardiomyopathy/dysplasia. Circulation 2003;108:3084–3091.
390. Marcus GM, Glidden DV, Polonsky B, Zareba W, Smith LM, Cannom DS, Estes NA 3rd, Marcus F, Scheinman MM, Multidisciplinary Study of Right Ventricular Dysplasia Investigators. Efficacy of antiarrhythmic drugs in arrhythmogenic right ventricular cardiomyopathy: a report from the North American ARVC Registry. J Am Coll Cardiol 2009;54:609–615.
391. Wichter T, Borggrefe M, Haverkamp W, Chen X, Breithardt G. Efficacy of antiarrhythmic drugs in patients with arrhythmogenic right ventricular disease. Results in patients with inducible and noninducible ventricular tachycardia. Circulation 1992;86:29–37.
392. Philips B, Madhavan S, James C, Tichnell C, Murray B, Dalal D, Bhonsale A, Nazarian S, Judge DP, Russell SD, Abraham T, Calkins H, Tandri H. Outcomes of catheter ablation of ventricular tachycardia in arrhythmogenic right ventricular dysplasia/cardiomyopathy. Circ Arrhythm Electrophysiol 2012;5:499–505.
393. Dalal D, Jain R, Tandri H, Dong J, Eid SM, Prakasa K, Tichnell C, James C, Abraham T, Russell SD, Sinha S, Judge DP, Bluemke DA, Marine JE, Calkins H. Long-term efficacy of catheter ablation of ventricular tachycardia in patients with arrhythmogenic right ventricular dysplasia/cardiomyopathy. J Am Coll Cardiol 2007;50:432–440.
394. Dalal D, Molin LH, Piccini J, Tichnell C, James C, Bomma C, Prakasa K, Towbin JA, Marcus FI, Spevak PJ, Bluemke DA, Abraham T, Russell SD, Calkins H, Judge DP. Clinical features of arrhythmogenic right ventricular dysplasia/cardiomyopathy associated with mutations in plakophilin-2. Circulation 2006;113:1641–1649.
395. Wichter T, Paul M, Wollmann C, Acil T, Gerdes P, Ashraf O, Tjan TD, Soeparwata R, Block M, Borggrefe M, Scheld HH, Breithardt G, Bocker D. Implantable cardioverter/defibrillator therapy in arrhythmogenic right ventricular cardiomyopathy: single-center experience of long-term follow-up and complications in 60 patients. Circulation 2004;109:1503–1508.
396. Nava A, Bauce B, Basso C, Muriago M, Rampazzo A, Villanova C, Daliento L, Buja G, Corrado D, Danieli GA, Thiene G. Clinical profile and long-term followup of 37 families with arrhythmogenic right ventricular cardiomyopathy. J Am Coll Cardiol 2000;36:2226–2233.
397. Nasir K, Bomma C, Tandri H, Roguin A, Dalal D, Prakasa K, Tichnell C, James C, Spevak PJ, Marcus F, Calkins H. Electrocardiographic features of arrhythmogenic right ventricular dysplasia/cardiomyopathy according to disease severity: a need to broaden diagnostic criteria. Circulation 2004;110:1527–1534.
398. Hamid MS, Norman M, Quraishi A, Firoozi S, Thaman R, Gimeno JR, Sachdev B, Rowland E, Elliott PM, McKenna WJ. Prospective evaluation of relatives for familial arrhythmogenic right ventricular cardiomyopathy/dysplasia reveals a need to broaden diagnostic criteria. J Am Coll Cardiol 2002;40:1445–1450.
399. Sen-Chowdhry S, Syrris P, Ward D, Asimaki A, Sevdalis E, McKenna WJ. Clinical and genetic characterization of families with arrhythmogenic right ventricular dysplasia/cardiomyopathy provides novel insights into patterns of disease expression. Circulation 2007;115:1710–1720.
400. Hoffmayer KS, Machado ON, Marcus GM, Yang Y, Johnson CJ, Ermakov S, Vittinghoff E, Pandurangi U, Calkins H, Cannom D, Gear KC, Tichnell C, Park Y, Zareba W, Marcus FI, Scheinman MM. Electrocardiographic comparison of ventricular arrhythmias in patients with arrhythmogenic right ventricular cardiomyopathy and right ventricular outflow tract tachycardia. J Am Coll Cardiol 2011;58:831–838.
401. Link MS, Laidlaw D, Polonsky B, Zareba W, McNitt S, Gear K, Marcus F, Estes NA 3rd. Ventricular arrhythmias in the North American multidisciplinary study of ARVC: predictors, characteristics, and treatment. J Am Coll Cardiol 2014;64: 119–125.
402. Ouyang F, Fotuhi P, Goya M, Volkmer M, Ernst S, Cappato R, Kuck K. Ventricular tachycardia around the tricuspid annulus in right ventricular dysplasia. Circulation 2001;103:913–914.
403. Heidbuchel H, Hoogsteen J, Fagard R, Vanhees L, Ector H, Willems R, Van Lierde J. High prevalence of right ventricular involvement in endurance athletes with ventricular arrhythmias. Role of an electrophysiologic study in risk stratification. Eur Heart J 2003;24:1473–1480.
404. Corrado D, Calkins H, Link MS, Leoni L, Favale S, Bevilacqua M, Basso C, Ward D, Boriani G, Ricci R, Piccini JP, Dalal D, Santini M, Buja G, Iliceto S, Estes NA 3rd, Wichter T, McKenna WJ, Thiene G, Marcus FI. Prophylactic implantable defibrillator in patients with arrhythmogenic right ventricular cardiomyopathy/dysplasia and no prior ventricular fibrillation or sustained ventricular tachycardia. Circulation 2010;122:1144–1152.
405. Peters S. Long-term follow-up and risk assessment of arrhythmogenic right ventricular dysplasia/cardiomyopathy: personal experience from different primary and tertiary centres. J Cardiovasc Med (Hagerstown) 2007;8:521–526.
406. Lemola K, Brunckhorst C, Helfenstein U, Oechslin E, Jenni R, Duru F. Predictors of adverse outcome in patients with arrhythmogenic right ventricular dysplasia/cardiomyopathy: long term experience of a tertiary care centre. Heart 2005;91: 1167–1172.
407. Rigato I, Bauce B, Rampazzo A, Zorzi A, Pilichou K, Mazzotti E, Migliore F, Marra MP, Lorenzon A, De Bortoli M, Calore M, Nava A, Daliento L, Gregori D, Iliceto S, Thiene G, Basso C, Corrado D. Compound and digenic heterozygosity predicts lifetime arrhythmic outcome and sudden cardiac death in desmosomal gene-related arrhythmogenic right ventricular cardiomyopathy. Circ Cardiovasc Genet 2013;6:533–542.
408. Kristen AV, Dengler TJ, Hegenbart U, Schonland SO, Goldschmidt H, Sack FU, Voss F, Becker R, Katus HA, Bauer A. Prophylactic implantation of cardioverterdefibrillator in patients with severe cardiac amyloidosis and high risk for sudden cardiac death. Heart Rhythm 2008;5:235–240.
409. Palladini G, Malamani G, Co F, Pistorio A, Recusani F, Anesi E, Garini P, Merlini G. Holter monitoring in AL amyloidosis: prognostic implications. Pacing Clin Electrophysiol 2001;24:1228–1233.
410. Dubrey SW, Bilazarian S, LaValley M, Reisinger J, Skinner M, Falk RH. Signal-averaged electrocardiography in patients with AL (primary) amyloidosis. Am Heart J 1997;134:994–1001.
411. Reisinger J, Dubrey SW, Lavalley M, Skinner M, Falk RH. Electrophysiologic abnormalities in AL (primary) amyloidosis with cardiac involvement. J Am Coll Cardiol 1997;30:1046–1051.
412. Ammash NM, Seward JB, Bailey KR, Edwards WD, Tajik AJ. Clinical profile and outcome of idiopathic restrictive cardiomyopathy. Circulation 2000;101: 2490–2496.
413. Dubrey SW. Amyloid heart disease: a brief review of treatment options. Postgrad Med J 2012;88:700–705. 414. Ruberg FL, Berk JL. Transthyretin (TTR) cardiac amyloidosis. Circulation 2012;126: 1286–1300.
415. Jaccard A, Comenzo RL, Hari P, Hawkins PN, Roussel M, Morel P, Macro M, Pellegrin JL, Lazaro E, Mohty D, Mercie P, Decaux O, Gillmore J, Lavergne D, Bridoux F, Wechalekar AD, Venner CP. Efficacy of bortezomib, cyclophosphamide and dexamethasone in treatment-naive patients with high-risk cardiac AL amyloidosis (Mayo Clinic stage III). Haematologica 2014;99:1479–1485.
416. Falk RH, Rubinow A, Cohen AS. Cardiac arrhythmias in systemic amyloidosis: correlation with echocardiographic abnormalities. J Am Coll Cardiol 1984;3:107–113.
417. Maskatia SA, Decker JA, Spinner JA, Kim JJ, Price JF, Jefferies JL, Dreyer WJ, Smith EO, Rossano JW, Denfield SW. Restrictive physiology is associated with poor outcomes in children with hypertrophic cardiomyopathy. Pediatr Cardiol 2012;33:141–149.
418. Rivenes SM, Kearney DL, Smith EO, Towbin JA, Denfield SW. Sudden death and cardiovascular collapse in children with restrictive cardiomyopathy. Circulation 2000;102:876–882.
419. Lipshultz SE, Orav EJ, Wilkinson JD, Towbin JA, Messere JE, Lowe AM, Sleeper LA, Cox GF, Hsu DT, Canter CE, Hunter JA, Colan SD. Risk stratification at diagnosis for children with hypertrophic cardiomyopathy: an analysis of data from the Pediatric Cardiomyopathy Registry. Lancet 2013;382:1889–1897.
420. Webber SA, Lipshultz SE, Sleeper LA, Lu M, Wilkinson JD, Addonizio LJ, Canter CE, Colan SD, Everitt MD, Jefferies JL, Kantor PF, Lamour JM, Margossian R, Pahl E, Rusconi PG, Towbin JA. Outcomes of restrictive cardiomyopathy in childhood and the influence of phenotype: a report from the Pediatric Cardiomyopathy Registry. Circulation 2012;126:1237–1244.
421. Kaski JP, Syrris P, Burch M, Tome-Esteban MT, Fenton M, Christiansen M, Andersen PS, Sebire N, Ashworth M, Deanfield JE, McKenna WJ, Elliott PM. Idiopathic restrictive cardiomyopathy in children is caused by mutations in cardiac sarcomere protein genes. Heart 2008;94:1478–1484.
422. Bhatia NL, Tajik AJ, Wilansky S, Steidley DE, Mookadam F. Isolated noncompaction of the left ventricular myocardium in adults: a systematic overview. J Card Fail 2011;17:771–778.
423. Oechslin E, Jenni R. Left ventricular non-compaction revisited: a distinct phenotype with genetic heterogeneity? Eur Heart J 2011;32:1446–1456.
424. Lofiego C, Biagini E, Pasquale F, Ferlito M, Rocchi G, Perugini E, Bacchi-Reggiani L, Boriani G, Leone O, Caliskan K, ten Cate FJ, Picchio FM, Branzi A, Rapezzi C. Wide spectrum of presentation and variable outcomes of isolated left ventricular noncompaction. Heart 2007;93:65–71.
425. Murphy RT, Thaman R, Blanes JG, Ward D, Sevdalis E, Papra E, Kiotsekoglou A, Tome MT, Pellerin D, McKenna WJ, Elliott PM. Natural history and familial characteristics of isolated left ventricular non-compaction. Eur Heart J 2005;26: 187–192.
426. Muratore CA, Batista Sa LA, Chiale PA, Eloy R, Tentori MC, Escudero J, Lima AM, Medina LE, Garillo R, Maloney J. Implantable cardioverter defibrillators and Chagas disease: results of the ICD Registry Latin America. Europace 2009;11: 164–168.
427. Martinelli M, de Siqueira SF, Sternick EB, Rassi A Jr, Costa R, Ramires JA, Kalil Filho R. Long-term follow-up of implantable cardioverter-defibrillator for secondary prevention in Chagas heart disease. Am J Cardiol 2012;110:1040–1045.
428. Cardinalli-Neto A, Bestetti RB, Cordeiro JA, Rodrigues VC. Predictors of all-cause mortality for patients with chronic Chagas heart disease receiving implantable cardioverter defibrillator therapy. J Cardiovasc Electrophysiol 2007;18:1236–1240.
429. Barbosa MP, da Costa Rocha MO, de Oliveira AB, Lombardi F, Ribeiro AL. Efficacy and safety of implantable cardioverter-defibrillators in patients with Chagas disease. Europace 2013;15:957–962.
430. Gali WL, Sarabanda AV, Baggio JM, Ferreira LG, Gomes GG, Marin-Neto JA, Junqueira LF. Implantable cardioverter-defibrillators for treatment of sustained ventricular arrhythmias in patients with Chagas heart disease: comparison with a control group treated with amiodarone alone. Europace 2014;16:674–680.
431. Schwartz PJ, Moss AJ, Vincent GM, Crampton RS. Diagnostic criteria for the long QT syndrome. An update. Circulation 1993;88:782–784.
432. Moss AJ, Schwartz PJ, Crampton RS, Tzivoni D, Locati EH, MacCluer J, Hall WJ, Weitkamp L, Vincent GM, Garson A Jr. The long QT syndrome. Prospective longitudinal study of 328 families. Circulation 1991;84:1136–1144.
433. Nguyen HL, Pieper GH, Wilders R. Andersen–Tawil syndrome: clinical and molecular aspects. Int J Cardiol 2013;170:1–16.
434. Schwartz PJ, Priori SG, Spazzolini C, Moss AJ, Vincent GM, Napolitano C, Denjoy I, Guicheney P, Breithardt G, Keating MT, Towbin JA, Beggs AH, Brink P, Wilde AA, Toivonen L, Zareba W, Robinson JL, Timothy KW, Corfield V, Wattanasirichaigoon D, Corbett C, Haverkamp W, Schulze-Bahr E, Lehmann MH, Schwartz K, Coumel P, Bloise R. Genotype-phenotype correlation in the long-QT syndrome: gene-specific triggers for life-threatening arrhythmias. Circulation 2001;103:89–95.
435. Priori SG, Napolitano C, Schwartz PJ, Grillo M, Bloise R, Ronchetti E, Moncalvo C, Tulipani C, Veia A, Bottelli G, Nastoli J. Association of long QT syndrome loci and cardiac events among patients treated with beta-blockers. JAMA 2004;292: 1341–1344.
436. Moss AJ, Zareba W, Hall WJ, Schwartz PJ, Crampton RS, Benhorin J, Vincent GM, Locati EH, Priori SG, Napolitano C, Medina A, Zhang L, Robinson JL, Timothy K, Towbin JA, Andrews ML. Effectiveness and limitations of beta-blocker therapy in congenital long-QT syndrome. Circulation 2000;101:616–623.
437. Zareba W, Moss AJ, Daubert JP, Hall WJ, Robinson JL, Andrews M. Implantable cardioverter defibrillator in high-risk long QT syndrome patients. J Cardiovasc Electrophysiol 2003;14:337–341.
438. Schwartz PJ, Spazzolini C, Priori SG, Crotti L, Vicentini A, Landolina M, Gasparini M, Wilde AA, Knops RE, Denjoy I, Toivonen L, Monnig G, Al-Fayyadh M, Jordaens L, Borggrefe M, Holmgren C, Brugada P, De Roy L, Hohnloser SH, Brink PA. Who are the long-QT syndrome patients who receive an implantable cardioverter-defibrillator and what happens to them?: data from the European Long-QT Syndrome Implantable Cardioverter-Defibrillator (LQTS ICD) Registry. Circulation 2010;122:1272–1282.
439. Jons C, Moss AJ, Goldenberg I, Liu J, McNitt S, Zareba W, Qi M, Robinson JL. Risk of fatal arrhythmic events in long QT syndrome patients after syncope. J Am Coll Cardiol 2010;55:783–788.
440. Schwartz PJ, Priori SG, Cerrone M, Spazzolini C, Odero A, Napolitano C, Bloise R, De Ferrari GM, Klersy C, Moss AJ, Zareba W, Robinson JL, Hall WJ, Brink PA, Toivonen L, Epstein AE, Li C, Hu D. Left cardiac sympathetic denervation in the management of high-risk patients affected by the long-QT syndrome. Circulation 2004;109:1826–1833.
441. Schwartz PJ, Priori SG, Locati EH, Napolitano C, Cantu F, Towbin JA, Keating MT, Hammoude H, Brown AM, Chen LS. Long QT syndrome patients with mutations of the SCN5A and HERG genes have differential responses to Na+ channel blockade and to increases in heart rate. Implications for gene-specific therapy. Circulation 1995;92:3381–3386.
442. Moss AJ, Windle JR, Hall WJ, Zareba W, Robinson JL, McNitt S, Severski P, Rosero S, Daubert JP, Qi M, Cieciorka M, Manalan AS. Safety and efficacy of flecainide in subjects with Long QT-3 syndrome (DeltaKPQ mutation): a randomized, double-blind, placebo-controlled clinical trial. Ann Noninvasive Electrocardiol 2005;10:59–66.
443. Moss AJ, Zareba W, Schwarz KQ, Rosero S, McNitt S, Robinson JL. Ranolazine shortens repolarization in patients with sustained inward sodium current due to type-3 long-QT syndrome. J Cardiovasc Electrophysiol 2008;19:1289–1293.
444. Liu JF, Jons C, Moss AJ, McNitt S, Peterson DR, Qi M, Zareba W, Robinson JL, Barsheshet A, Ackerman MJ, Benhorin J, Kaufman ES, Locati EH, Napolitano C, Priori SG, Schwartz PJ, Towbin J, Vincent M, Zhang L, Goldenberg I. Risk factors for recurrent syncope and subsequent fatal or near-fatal events in children and adolescents with long QT syndrome. J Am Coll Cardiol 2011;57:941–950.
445. Seth R, Moss AJ, McNitt S, Zareba W, Andrews ML, Qi M, Robinson JL, Goldenberg I, Ackerman MJ, Benhorin J, Kaufman ES, Locati EH, Napolitano C, Priori SG, Schwartz PJ, Towbin JA, Vincent GM, Zhang L. Long QT syndrome and pregnancy. J Am Coll Cardiol 2007;49:1092–1098.
446. Goldenberg I, Horr S, Moss AJ, Lopes CM, Barsheshet A, McNitt S, Zareba W, Andrews ML, Robinson JL, Locati EH, Ackerman MJ, Benhorin J, Kaufman ES, Napolitano C, Platonov PG, Priori SG, Qi M, Schwartz PJ, Shimizu W, Towbin JA, Vincent GM, Wilde AA, Zhang L. Risk for life-threatening cardiac events in patients with genotype-confirmed long-QT syndrome and normal-range corrected QT intervals. J Am Coll Cardiol 2011;57:51–59.
447. Gaita F, Giustetto C, Bianchi F, Wolpert C, Schimpf R, Riccardi R, Grossi S, Richiardi E, Borggrefe M. Short QT syndrome: a familial cause of sudden death. Circulation 2003;108:965–970.
448. Gaita F, Giustetto C, Bianchi F, Schimpf R, Haissaguerre M, Calo L, Brugada R, Antzelevitch C, Borggrefe M, Wolpert C. Short QT syndrome: pharmacological treatment. J Am Coll Cardiol 2004;43:1494–1499.
449. Fowler SJ, Priori SG. Clinical spectrum of patients with a Brugada ECG. Curr Opin Cardiol 2009;24:74–81.
450. Gehi AK, Duong TD, Metz LD, Gomes JA, Mehta D. Risk stratification of individuals with the Brugada electrocardiogram: a meta-analysis. J Cardiovasc Electrophysiol 2006;17:577–583.
451. Priori SG, Napolitano C, Gasparini M, Pappone C, Della Bella P, Giordano U, Bloise R, Giustetto C, De Nardis R, Grillo M, Ronchetti E, Faggiano G, Nastoli J. Natural history of Brugada syndrome: insights for risk stratification and management. Circulation 2002;105:1342–1347.
452. Fauchier L, Isorni MA, Clementy N, Pierre B, Simeon E, Babuty D. Prognostic value of programmed ventricular stimulation in Brugada syndrome according to clinical presentation: an updated meta-analysis of worldwide published data. Int J Cardiol 2013;168:3027–3029.
453. Maury P, Hocini M, Haissaguerre M. Electrical storms in Brugada syndrome: review of pharmacologic and ablative therapeutic options. Indian Pacing Electrophysiol J 2005;5:25–34.
454. Marquez MF, Bonny A, Hernandez-Castillo E, De Sisti A, Gomez-Flores J, Nava S, Hidden-Lucet F, Iturralde P, Cardenas M, Tonet J. Long-term efficacy of low doses of quinidine on malignant arrhythmias in Brugada syndrome with an implantable cardioverter-defibrillator: a case series and literature review. Heart Rhythm 2012; 9:1995–2000.
455. Nademanee K, Veerakul G, Chandanamattha P, Chaothawee L, Ariyachaipanich A, Jirasirirojanakorn K, Likittanasombat K, Bhuripanyo K, Ngarmukos T. Prevention of ventricular fibrillation episodes in Brugada syndrome by catheter ablation over the anterior right ventricular outflow tract epicardium. Circulation 2011;123:1270–1279.
456. Priori SG, Gasparini M, Napolitano C, Della Bella P, Ottonelli AG, Sassone B, Giordano U, Pappone C, Mascioli G, Rossetti G, De Nardis R, Colombo M. Risk stratification in Brugada syndrome: results of the PRELUDE (PRogrammed ELectrical stimUlation preDictive valuE) registry. J Am Coll Cardiol 2012;59:37–45.
457. Coumel P. Catecholamine-induced severe ventricular arrhythmias with AdamsStokes syndrome in children: a report of four cases. Br Heart J 1978;40:28–37.
458. Priori SG, Napolitano C, Memmi M, Colombi B, Drago F, Gasparini M, DeSimone L, Coltorti F, Bloise R, Keegan R, Cruz Filho FE, Vignati G, Benatar A, DeLogu A. Clinical and molecular characterization of patients with catecholaminergic polymorphic ventricular tachycardia. Circulation 2002;106: 69–74.
459. Marjamaa A, Hiippala A, Arrhenius B, Lahtinen AM, Kontula K, Toivonen L, Happonen JM, Swan H. Intravenous epinephrine infusion test in diagnosis of catecholaminergic polymorphic ventricular tachycardia. J Cardiovasc Electrophysiol 2012;23:194–199.
460. Leenhardt A, Lucet V, Denjoy I, Grau F, Ngoc DD, Coumel P. Catecholaminergic polymorphic ventricular tachycardia in children. A 7-year follow-up of 21 patients. Circulation 1995;91:1512–1519.
461. Hayashi M, Denjoy I, Extramiana F, Maltret A, Buisson NR, Lupoglazoff JM, Klug D, Takatsuki S, Villain E, Kamblock J, Messali A, Guicheney P, Lunardi J, Leenhardt A. Incidence and risk factors of arrhythmic events in catecholaminergic polymorphic ventricular tachycardia. Circulation 2009;119:2426–2434.
462. van der Werf C, Nederend I, Hofman N, van Geloven N, Ebink C, Frohn-Mulder IM, Alings AM, Bosker HA, Bracke FA, van den Heuvel F, Waalewijn RA, Bikker H, van Tintelen JP, Bhuiyan ZA, van den Berg MP, Wilde AA. Familial evaluation in catecholaminergic polymorphic ventricular tachycardia: disease penetrance and expression in cardiac ryanodine receptor mutation-carrying relatives. Circ Arrhythm Electrophysiol 2012;5:748–756.
463. Watanabe H, Chopra N, Laver D, Hwang HS, Davies SS, Roach DE, Duff HJ, Roden DM, Wilde AA, Knollmann BC. Flecainide prevents catecholaminergic polymorphic ventricular tachycardia in mice and humans. Nat Med 2009;15: 380–383. 464. Olde Nordkamp LR, Driessen AH, Odero A, Blom NA, Koolbergen DR, Schwartz PJ, Wilde AA. Left cardiac sympathetic denervation in the Netherlands for the treatment of inherited arrhythmia syndromes. Neth Heart J 2014;22: 160–166.
465. Hofferberth SC, Cecchin F, Loberman D, Fynn-Thompson F. Left thoracoscopic sympathectomy for cardiac denervation in patients with life-threatening ventricular arrhythmias. J Thorac Cardiovasc Surg 2014;147:404–409. 466. Roses-Noguer F, Jarman JW, Clague JR, Till J. Outcomes of defibrillator therapy in catecholaminergic polymorphic ventricular tachycardia. Heart Rhythm 2014;11: 58–66.
467. Haissaguerre M, Derval N, Sacher F, Jesel L, Deisenhofer I, de Roy L, Pasquie JL, Nogami A, Babuty D, Yli-Mayry S, De Chillou C, Scanu P, Mabo P, Matsuo S, Probst V, Le Scouarnec S, Defaye P, Schlaepfer J, Rostock T, Lacroix D, Lamaison D, Lavergne T, Aizawa Y, Englund A, Anselme F, ONeill M, Hocini M, Lim KT, Knecht S, Veenhuyzen GD, Bordachar P, Chauvin M, Jais P, Coureau G, Chene G, Klein GJ, Clementy J. Sudden cardiac arrest associated with early repolarization. N Engl J Med 2008;358:2016–2023.
468. Rosso R, Kogan E, Belhassen B, Rozovski U, Scheinman MM, Zeltser D, Halkin A, Steinvil A, Heller K, Glikson M, Katz A, Viskin S. J-point elevation in survivors of primary ventricular fibrillation and matched control subjects: incidence and clinical significance. J Am Coll Cardiol 2008;52:1231–1238.
469. Paul T, Marchal C, Garson A Jr. Ventricular couplets in the young: prognosis related to underlying substrate. Am Heart J 1990;119:577–582.
470. Beaufort-Krol GC, Dijkstra SS, Bink-Boelkens MT. Natural history of ventricular premature contractions in children with a structurally normal heart: does origin matter? Europace 2008;10:998–1003.
471. Pfammatter JP, Paul T. Idiopathic ventricular tachycardia in infancy and childhood: a multicenter study on clinical profile and outcome. Working Group on Dysrhythmias and Electrophysiology of the Association for European Pediatric Cardiology. J Am Coll Cardiol 1999;33:2067–2072.
472. Wang S, Zhu W, Hamilton RM, Kirsh JA, Stephenson EA, Gross GJ. Diagnosisspecific characteristics of ventricular tachycardia in children with structurally normal hearts. Heart Rhythm 2010;7:1725–1731.
473. Collins KK, Schaffer MS, Liberman L, Saarel E, Knecht M, Tanel RE, Bradley D, Dubin AM, Paul T, Salerno J, Bar-Cohen Y, Sreeram N, Sanatani S, Law IH, Blaufox A, Batra A, Moltedo JM, van Hare GF, Reed J, Ro PS, Kugler J, Anderson C, Triedman JK. Fascicular and nonfascicular left ventricular tachycardias in the young: an international multicenter study. J Cardiovasc Electrophysiol 2013;24:640–648.
474. Schneider HE, Kriebel T, Jung K, Gravenhorst VD, Paul T. Catheter ablation of idiopathic left and right ventricular tachycardias in the pediatric population using noncontact mapping. Heart Rhythm 2010;7:731–739.
475. Blaufox AD, Felix GL, Saul JP. Radiofrequency catheter ablation in infants ≤18 months old: when is it done and how do they fare?: short-term data from the pediatric ablation registry. Circulation 2001;104:2803–2808.
476. Lapage MJ, Bradley DJ, Dick M 2nd. Verapamil in infants: an exaggerated fear? Pediatr Cardiol 2013;34:1532–1534.
477. Nagashima M, Matsushima M, Ogawa A, Ohsuga A, Kaneko T, Yazaki T, Okajima M. Cardiac arrhythmias in healthy children revealed by 24-hour ambulatory ECG monitoring. Pediatr Cardiol 1987;8:103–108.
478. Southall DP, Richards J, Mitchell P, Brown DJ, Johnston PG, Shinebourne EA. Study of cardiac rhythm in healthy newborn infants. Br Heart J 1980;43:14–20.
479. Jacobsen JR, Garson A Jr, Gillette PC, McNamara DG. Premature ventricular contractions in normal children. J Pediatr 1978;92:36–38. 480. Tsuji A, Nagashima M, Hasegawa S, Nagai N, Nishibata K, Goto M, Matsushima M. Long-term follow-up of idiopathic ventricular arrhythmias in otherwise normal children. Jpn Circ J 1995;59:654–662.
481. Van Hare GF, Stanger P. Ventricular tachycardia and accelerated ventricular rhythm presenting in the first month of life. Am J Cardiol 1991;67:42–45.
482. Iwamoto M, Niimura I, Shibata T, Yasui K, Takigiku K, Nishizawa T, Akaike T, Yokota S. Long-term course and clinical characteristics of ventricular tachycardia detected in children by school-based heart disease screening. Circ J 2005;69: 273–276.
483. Roggen A, Pavlovic M, Pfammatter JP. Frequency of spontaneous ventricular tachycardia in a pediatric population. Am J Cardiol 2008;101:852–854.
484. Garson A Jr, Smith RT Jr, Moak JP, Kearney DL, Hawkins EP, Titus JL, Cooley DA, Ott DA. Incessant ventricular tachycardia in infants: myocardial hamartomas and surgical cure. J Am Coll Cardiol 1987;10:619–626.
485. Paul T, Bokenkamp R, Mahnert B, Trappe HJ. Coronary artery involvement early and late after radiofrequency current application in young pigs. Am Heart J 1997; 133:436–440.
486. Khairy P, Guerra PG, Rivard L, Tanguay JF, Landry E, Guertin MC, Macle L, Thibault B, Tardif JC, Talajic M, Roy D, Dubuc M. Enlargement of catheter ablation lesions in infant hearts with cryothermal versus radiofrequency energy: an animal study. Circ Arrhythm Electrophysiol 2011;4:211–217.
487. Saul JP, Hulse JE, Papagiannis J, Van Praagh R, Walsh EP. Late enlargement of radiofrequency lesions in infant lambs. Implications for ablation procedures in small children. Circulation 1994;90:492–499.
488. Khairy P, Harris L, Landzberg MJ, Viswanathan S, Barlow A, Gatzoulis MA, Fernandes SM, Beauchesne L, Therrien J, Chetaille P, Gordon E, Vonder Muhll I, Cecchin F. Implantable cardioverter-defibrillators in tetralogy of Fallot. Circulation 2008;117:363–370.
489. Khairy P, Harris L, Landzberg MJ, Fernandes SM, Barlow A, Mercier LA, Viswanathan S, Chetaille P, Gordon E, Dore A, Cecchin F. Sudden death and defi- brillators in transposition of the great arteries with intra-atrial baffles: a multicenter study. Circ Arrhythm Electrophysiol 2008;1:250–257.
490. Berul CI, Van Hare GF, Kertesz NJ, Dubin AM, Cecchin F, Collins KK, Cannon BC, Alexander ME, Triedman JK, Walsh EP, Friedman RA. Results of a multicenter retrospective implantable cardioverter-defibrillator registry of pediatric and congenital heart disease patients. J Am Coll Cardiol 2008;51:1685–1691.
491. Koyak Z, de Groot JR, Van Gelder IC, Bouma BJ, van Dessel PF, Budts W, van Erven L, van Dijk AP, Wilde AA, Pieper PG, Sieswerda GT, Mulder BJ. Implantable cardioverter defibrillator therapy in adults with congenital heart disease: who is at risk of shocks? Circ Arrhythm Electrophysiol 2012;5:101–110.
492. Zeppenfeld K, Schalij MJ, Bartelings MM, Tedrow UB, Koplan BA, Soejima K, Stevenson WG. Catheter ablation of ventricular tachycardia after repair of congenital heart disease: electroanatomic identification of the critical right ventricular isthmus. Circulation 2007;116:2241–2252.
493. Gallego P, Gonzalez AE, Sanchez-Recalde A, Peinado R, Polo L, Gomez-Rubin C, Lopez-Sendon JL, Oliver JM. Incidence and predictors of sudden cardiac arrest in adults with congenital heart defects repaired before adult life. Am J Cardiol 2012; 110:109–117.
494. Ghai A, Silversides C, Harris L, Webb GD, Siu SC, Therrien J. Left ventricular dysfunction is a risk factor for sudden cardiac death in adults late after repair of tetralogy of Fallot. J Am Coll Cardiol 2002;40:1675–1680.
495. Gatzoulis MA, Balaji S, Webber SA, Siu SC, Hokanson JS, Poile C, Rosenthal M, Nakazawa M, Moller JH, Gillette PC, Webb GD, Redington AN. Risk factors for arrhythmia and sudden cardiac death late after repair of tetralogy of Fallot: a multicentre study. Lancet 2000;356:975–981.
496. Khairy P, Landzberg MJ, Gatzoulis MA, Lucron H, Lambert J, Marcon F, Alexander ME, Walsh EP. Value of programmed ventricular stimulation after tetralogy of fallot repair: a multicenter study. Circulation 2004;109:1994–2000.
497. Koyak Z, Harris L, de Groot JR, Silversides CK, Oechslin EN, Bouma BJ, Budts W, Zwinderman AH, Van Gelder IC, Mulder BJ. Sudden cardiac death in adult congenital heart disease. Circulation 2012;126:1944–1954.
498. Kammeraad JA, van Deurzen CH, Sreeram N, Bink-Boelkens MT, Ottenkamp J, Helbing WA, Lam J, Sobotka-Plojhar MA, Daniels O, Balaji S. Predictors of sudden cardiac death after Mustard or Senning repair for transposition of the great arteries. J Am Coll Cardiol 2004;44:1095–1102.
499. van der Linde D, Konings EE, Slager MA, Witsenburg M, Helbing WA, Takkenberg JJ, Roos-Hesselink JW. Birth prevalence of congenital heart disease worldwide: a systematic review and meta-analysis. J Am Coll Cardiol 2011;58: 2241–2247.
500. Marelli AJ, Mackie AS, Ionescu-Ittu R, Rahme E, Pilote L. Congenital heart disease in the general population: changing prevalence and age distribution. Circulation 2007;115:163–172.
501. Silka MJ, Hardy BG, Menashe VD, Morris CD. A population-based prospective evaluation of risk of sudden cardiac death after operation for common congenital heart defects. J Am Coll Cardiol 1998;32:245–251.
502. Oechslin EN, Harrison DA, Connelly MS, Webb GD, Siu SC. Mode of death in adults with congenital heart disease. Am J Cardiol 2000;86:1111–1116. 503. Nieminen HP, Jokinen EV, Sairanen HI. Causes of late deaths after pediatric cardiac surgery: a population-based study. J Am Coll Cardiol 2007;50:1263–1271.
504. Murphy JG, Gersh BJ, Mair DD, Fuster V, McGoon MD, Ilstrup DM, McGoon DC, Kirklin JW, Danielson GK. Long-term outcome in patients undergoing surgical repair of tetralogy of Fallot. N Engl J Med 1993;329:593–599.
505. Moons P, Gewillig M, Sluysmans T, Verhaaren H, Viart P, Massin M, Suys B, Budts W, Pasquet A, De Wolf D, Vliers A. Long term outcome up to 30 years after the Mustard or Senning operation: a nationwide multicentre study in Belgium. Heart 2004;90:307–313.
506. Brown DW, Dipilato AE, Chong EC, Gauvreau K, McElhinney DB, Colan SD, Lock JE. Sudden unexpected death after balloon valvuloplasty for congenital aortic stenosis. J Am Coll Cardiol 2010;56:1939–1946.
507. Khairy P, Fernandes SM, Mayer JE Jr, Triedman JK, Walsh EP, Lock JE, Landzberg MJ. Long-term survival, modes of death, and predictors of mortality in patients with Fontan surgery. Circulation 2008;117:85–92.
508. Heersche JH, Blom NA, van de Heuvel F, Blank C, Reimer AG, Clur SA, Witsenburg M, ten Harkel AD. Implantable cardioverter defibrillator therapy for prevention of sudden cardiac death in children in the Netherlands. Pacing Clin Electrophysiol 2010;33:179–185.
509. Silka MJ, Kron J, Dunnigan A, Dick M 2nd. Sudden cardiac death and the use of implantable cardioverter-defibrillators in pediatric patients. The Pediatric Electrophysiology Society. Circulation 1993;87:800–807.
510. Etheridge SP, Sanatani S, Cohen MI, Albaro CA, Saarel EV, Bradley DJ. Long QT syndrome in children in the era of implantable defibrillators. J Am Coll Cardiol 2007; 50:1335–1340.
511. Maron BJ, Spirito P, Ackerman MJ, Casey SA, Semsarian C, Estes NA 3rd, Shannon KM, Ashley EA, Day SM, Pacileo G, Formisano F, Devoto E, Anastasakis A, Bos JM, Woo A, Autore C, Pass RH, Boriani G, Garberich RF, Almquist AK, Russell MW, Boni L, Berger S, Maron MS, Link MS. Prevention of sudden cardiac death with implantable cardioverter-defibrillators in children and adolescents with hypertrophic cardiomyopathy. J Am Coll Cardiol 2013;61: 1527–1535.
512. Radbill AE, Triedman JK, Berul CI, Fynn-Thompson F, Atallah J, Alexander ME, Walsh EP, Cecchin F. System survival of nontransvenous implantable cardioverter-defibrillators compared to transvenous implantable cardioverterdefibrillators in pediatric and congenital heart disease patients. Heart Rhythm 2010;7:193–198. 513. Burns KM, Evans F, Kaltman JR. Pediatric ICD utilization in the United States from 1997 to 2006. Heart Rhythm 2011;8:23–28.
514. Pahl E, Sleeper LA, Canter CE, Hsu DT, Lu M, Webber SA, Colan SD, Kantor PF, Everitt MD, Towbin JA, Jefferies JL, Kaufman BD, Wilkinson JD, Lipshultz SE, Pediatric Cardiomyopathy Registry I. Incidence of and risk factors for sudden cardiac death in children with dilated cardiomyopathy: a report from the Pediatric Cardiomyopathy Registry. J Am Coll Cardiol 2012;59:607–615.
515. Dimas VV, Denfield SW, Friedman RA, Cannon BC, Kim JJ, Smith EO, Clunie SK, Price JF, Towbin JA, Dreyer WJ, Kertesz NJ. Frequency of cardiac death in children with idiopathic dilated cardiomyopathy. Am J Cardiol 2009;104:1574–1577.
516. Hamilton RM, Dorian P, Gow RM, Williams WG. Five-year experience with implantable defibrillators in children. Am J Cardiol 1996;77:524–526.
517. Chatrath R, Porter CB, Ackerman MJ. Role of transvenous implantable cardioverter-defibrillators in preventing sudden cardiac death in children, adolescents, and young adults. Mayo Clin Proc 2002;77:226–231.
518. Lawrence D, Von Bergen N, Law IH, Bradley DJ, Dick M 2nd, Frias PA, Streiper MJ, Fischbach PS. Inappropriate ICD discharges in single-chamber versus dualchamber devices in the pediatric and young adult population. J Cardiovasc Electrophysiol 2009;20:287–290.
519. Celiker A, Olgun H, Karagoz T, Ozer S, Ozkutlu S, Alehan D. Midterm experience with implantable cardioverter-defibrillators in children and young adults. Europace 2010;12:1732–1738.
520. Shah MJ. Implantable cardioverter defibrillator-related complications in the pediatric population. Pacing Clin Electrophysiol 2009;32(Suppl 2):S71–S74.
521. Janson CM, Patel AR, Bonney WJ, Smoots K, Shah MJ. Implantable cardioverterdefibrillator lead failure in children and young adults: a matter of lead diameter or lead design? J Am Coll Cardiol 2014;63:133–140.
522. Atallah J, Erickson CC, Cecchin F, Dubin AM, Law IH, Cohen MI, Lapage MJ, Cannon BC, Chun TU, Freedenberg V, Gierdalski M, Berul CI, Pediatric and Congenital Electrophysiology Society (PACES). Multi-institutional study of implantable defibrillator lead performance in children and young adults: results of the Pediatric Lead Extractability and Survival Evaluation (PLEASE) study. Circulation 2013;127:2393–2402.
523. Janousek J, Gebauer RA, Abdul-Khaliq H, Turner M, Kornyei L, Grollmuss O, Rosenthal E, Villain E, Fruh A, Paul T, Blom NA, Happonen JM, Bauersfeld U, Jacobsen JR, van den Heuvel F, Delhaas T, Papagiannis J, Trigo C, Working Group for Cardiac Dysrhythmias and Electrophysiology of the Association for European Paediatric Cardiology. Cardiac resynchronisation therapy in paediatric and congenital heart disease: differential effects in various anatomical and functional substrates. Heart 2009;95:1165–1171.
524. van der Hulst AE, Delgado V, Blom NA, van de Veire NR, Schalij MJ, Bax JJ, Roest AA, Holman ER. Cardiac resynchronization therapy in paediatric and congenital heart disease patients. Eur Heart J 2011;32:2236–2246.
525. Morady F, Kadish AH, DiCarlo L, Kou WH, Winston S, deBuitlier M, Calkins H, Rosenheck S, Sousa J. Long-term results of catheter ablation of idiopathic right ventricular tachycardia. Circulation 1990;82:2093–2099.
526. Yamashina Y, Yagi T, Namekawa A, Ishida A, Sato H, Nakagawa T, Sakuramoto M, Sato E, Yambe T. Distribution of successful ablation sites of idiopathic right ventricular outflow tract tachycardia. Pacing Clin Electrophysiol 2009;32:727–733.
527. Ventura R, Steven D, Klemm HU, Lutomsky B, Mullerleile K, Rostock T, Servatius H, Risius T, Meinertz T, Kuck KH, Willems S. Decennial follow-up in patients with recurrent tachycardia originating from the right ventricular outflow tract: electrophysiologic characteristics and response to treatment. Eur Heart J 2007;28:2338–2345.
528. Krittayaphong R, Sriratanasathavorn C, Dumavibhat C, Pumprueg S, Boonyapisit W, Pooranawattanakul S, Phrudprisan S, Kangkagate C. Electrocardiographic predictors of long-term outcomes after radiofrequency ablation in patients with right-ventricular outflow tract tachycardia. Europace 2006;8:601–606.
529. Steven D, Roberts-Thomson KC, Seiler J, Inada K, Tedrow UB, Mitchell RN, Sobieszczyk PS, Eisenhauer AC, Couper GS, Stevenson WG. Ventricular tachycardia arising from the aortomitral continuity in structural heart disease: characteristics and therapeutic considerations for an anatomically challenging area of origin. Circ Arrhythm Electrophysiol 2009;2:660–666.
530. Hachiya H, Hirao K, Sasaki T, Higuchi K, Hayashi T, Tanaka Y, Kawabata M, Isobe M. Novel ECG predictor of difficult cases of outflow tract ventricular tachycardia: peak deflection index on an inferior lead. Circ J 2010;74:256–261.
531. Sacher F, Roberts-Thomson K, Maury P, Tedrow U, Nault I, Steven D, Hocini M, Koplan B, Leroux L, Derval N, Seiler J, Wright MJ, Epstein L, Haissaguerre M, Jais P, Stevenson WG. Epicardial ventricular tachycardia ablation a multicenter safety study. J Am Coll Cardiol 2010;55:2366–2372.
532. Ouyang F, Mathew S, Wu S, Kamioka M, Metzner A, Xue Y, Ju W, Yang B, Zhan X, Rillig A, Lin T, Rausch P, Deiss S, Lemes C, Tonnis T, Wissner E, Tilz RR, Kuck KH, Chen M. Ventricular arrhythmias arising from the left ventricular outflow tract below the aortic sinus cusps: mapping and catheter ablation via transseptal approach and electrocardiographic characteristics. Circ Arrhythm Electrophysiol 2014;7: 445–455.
533. Kamakura S, Shimizu W, Matsuo K, Taguchi A, Suyama K, Kurita T, Aihara N, Ohe T, Shimomura K. Localization of optimal ablation site of idiopathic ventricular tachycardia from right and left ventricular outflow tract by body surface ECG. Circulation 1998;98:1525–1533.
534. Callans DJ, Menz V, Schwartzman D, Gottlieb CD, Marchlinski FE. Repetitive monomorphic tachycardia from the left ventricular outflow tract: electrocardiographic patterns consistent with a left ventricular site of origin. J Am Coll Cardiol 1997;29:1023–1027.
535. Tada H, Hiratsuji T, Naito S, Kurosaki K, Ueda M, Ito S, Shinbo G, Hoshizaki H, Oshima S, Nogami A, Taniguchi K. Prevalence and characteristics of idiopathic outflow tract tachycardia with QRS alteration following catheter ablation requiring additional radiofrequency ablation at a different point in the outflow tract. Pacing Clin Electrophysiol 2004;27:1240–1249.
536. Yamada T, McElderry HT, Doppalapudi H, Murakami Y, Yoshida Y, Yoshida N, Okada T, Tsuboi N, Inden Y, Murohara T, Epstein AE, Plumb VJ, Singh SP, Kay GN. Idiopathic ventricular arrhythmias originating from the aortic root prevalence, electrocardiographic and electrophysiologic characteristics, and results of radiofrequency catheter ablation. J Am Coll Cardiol 2008;52:139–147.
537. Kanagaratnam L, Tomassoni G, Schweikert R, Pavia S, Bash D, Beheiry S, Neibauer M, Saliba W, Chung M, Tchou P, Natale A. Ventricular tachycardias arising from the aortic sinus of valsalva: an under-recognized variant of left outflow tract ventricular tachycardia. J Am Coll Cardiol 2001;37:1408–1414.
538. Ouyang F, Fotuhi P, Ho SY, Hebe J, Volkmer M, Goya M, Burns M, Antz M, Ernst S, Cappato R, Kuck KH. Repetitive monomorphic ventricular tachycardia originating from the aortic sinus cusp: electrocardiographic characterization for guiding catheter ablation. J Am Coll Cardiol 2002;39:500–508.
539. Tada H, Nogami A, Naito S, Fukazawa H, Horie Y, Kubota S, Okamoto Y, Hoshizaki H, Oshima S, Taniguchi K. Left ventricular epicardial outflow tract tachycardia: a new distinct subgroup of outflow tract tachycardia. Jpn Circ J 2001;65:723–730.
540. Yamada T, Litovsky SH, Kay GN. The left ventricular ostium: an anatomic concept relevant to idiopathic ventricular arrhythmias. Circ Arrhythm Electrophysiol 2008;1: 396–404.
541. Yamada T, McElderry HT, Doppalapudi H, Okada T, Murakami Y, Yoshida Y, Yoshida N, Inden Y, Murohara T, Plumb VJ, Kay GN. Idiopathic ventricular arrhythmias originating from the left ventricular summit: anatomic concepts relevant to ablation. Circ Arrhythm Electrophysiol 2010;3:616–623.
542. Ouyang F, Bansch D, Schaumann A, Ernst S, Linder C, Falk P, Hachiya H, Kuck KH, Antz M. Catheter ablation of subepicardial ventricular tachycardia using electroanatomic mapping. Herz 2003;28:591–597.
543. Kumagai K, Yamauchi Y, Takahashi A, Yokoyama Y, Sekiguchi Y, Watanabe J, Iesaka Y, Shirato K, Aonuma K. Idiopathic left ventricular tachycardia originating from the mitral annulus. J Cardiovasc Electrophysiol 2005;16:1029–1036.
544. Tada H, Tadokoro K, Miyaji K, Ito S, Kurosaki K, Kaseno K, Naito S, Nogami A, Oshima S, Taniguchi K. Idiopathic ventricular arrhythmias arising from the pulmonary artery: prevalence, characteristics, and topography of the arrhythmia origin. Heart Rhythm 2008;5:419–426.
545. Sekiguchi Y, Aonuma K, Takahashi A, Yamauchi Y, Hachiya H, Yokoyama Y, Iesaka Y, Isobe M. Electrocardiographic and electrophysiologic characteristics of ventricular tachycardia originating within the pulmonary artery. J Am Coll Cardiol 2005;45:887–895.
546. Timmermans C, Rodriguez LM, Crijns HJ, Moorman AF, Wellens HJ. Idiopathic left bundle-branch block-shaped ventricular tachycardia may originate above the pulmonary valve. Circulation 2003;108:1960–1967.
547. Krittayaphong R, Saiviroonporn P, Boonyasirinant T, Nakyen S, Thanapiboonpol P, Watanaprakarnchai W, Ruksakul K, Kangkagate C. Magnetic resonance imaging abnormalities in right ventricular outflow tract tachycardia and the prediction of radiofrequency ablation outcome. Pacing Clin Electrophysiol 2006;29:837–845.
548. Proclemer A, Basadonna PT, Slavich GA, Miani D, Fresco C, Fioretti PM. Cardiac magnetic resonance imaging findings in patients with right ventricular outflow tract premature contractions. Eur Heart J 1997;18:2002–2010.
549. Lerman BB, Belardinelli L, West GA, Berne RM, DiMarco JP. Adenosine-sensitive ventricular tachycardia: evidence suggesting cyclic AMP-mediated triggered activity. Circulation 1986;74:270–280.
550. Lerman BB. Response of nonreentrant catecholamine-mediated ventricular tachycardia to endogenous adenosine and acetylcholine. Evidence for myocardial receptor-mediated effects. Circulation 1993;87:382–390.
551. Sung RJ, Keung EC, Nguyen NX, Huycke EC. Effects of beta-adrenergic blockade on verapamil-responsive and verapamil-irresponsive sustained ventricular tachycardias. J Clin Invest 1988;81:688–699.
552. Wilber DJ, Baerman J, Olshansky B, Kall J, Kopp D. Adenosine-sensitive ventricular tachycardia. Clinical characteristics and response to catheter ablation. Circulation 1993;87:126–134.
553. Marchlinski FE, Deely MP, Zado ES. Sex-specific triggers for right ventricular out- flow tract tachycardia. Am Heart J 2000;139:1009–1013.
554. ODonnell D, Cox D, Bourke J, Mitchell L, Furniss S. Clinical and electrophysiological differences between patients with arrhythmogenic right ventricular dysplasia and right ventricular outflow tract tachycardia. Eur Heart J 2003;24:801–810.
555. Khasnis A, Jongnarangsin K, Abela G, Veerareddy S, Reddy V, Thakur R. Tachycardia-induced cardiomyopathy: a review of literature. Pacing Clin Electrophysiol 2005;28:710–721.
556. Ho YS. Overview of cardiac anatomy relevant to catheter ablation. In: Wilber D, Packer D, Stevenson W, eds. Catheter Ablation of Cardiac Arrhythmias, 3rd edn. Cambridge, MA: Blackwell Scientific; 2008:3–17.
557. McAlpine WA. Heart and Coronary Arteries. New York: Springer-Verlag; 1975.
558. Ito S, Tada H, Naito S, Kurosaki K, Ueda M, Hoshizaki H, Miyamori I, Oshima S, Taniguchi K, Nogami A. Development and validation of an ECG algorithm for identifying the optimal ablation site for idiopathic ventricular outflow tract tachycardia. J Cardiovasc Electrophysiol 2003;14:1280–1286.
559. Pons M, Beck L, Leclercq F, Ferriere M, Albat B, Davy JM. Chronic left main coronary artery occlusion: a complication of radiofrequency ablation of idiopathic left ventricular tachycardia. Pacing Clin Electrophysiol 1997;20:1874–1876.
560. Koruth JS, Aryana A, Dukkipati SR, Pak HN, Kim YH, Sosa EA, Scanavacca M, Mahapatra S, Ailawadi G, Reddy VY, dAvila A. Unusual complications of percutaneous epicardial access and epicardial mapping and ablation of cardiac arrhythmias. Circ Arrhythm Electrophysiol 2011;4:882–888.
561. Roberts-Thomson KC, Steven D, Seiler J, Inada K, Koplan BA, Tedrow UB, Epstein LM, Stevenson WG. Coronary artery injury due to catheter ablation in adults: presentations and outcomes. Circulation 2009;120:1465–1473.
562. Makimoto H, Zhang Q, Tilz RR, Wissner E, Cuneo A, Kuck KH, Ouyang F. Aborted sudden cardiac death due to radiofrequency ablation within the coronary sinus and subsequent total occlusion of the circumflex artery. J Cardiovasc Electrophysiol 2013;24:929–932.
563. Klein LS, Shih HT, Hackett FK, Zipes DP, Miles WM. Radiofrequency catheter ablation of ventricular tachycardia in patients without structural heart disease. Circulation 1992;85:1666–1674.
564. Lin D, Hsia HH, Gerstenfeld EP, Dixit S, Callans DJ, Nayak H, Russo A, Marchlinski FE. Idiopathic fascicular left ventricular tachycardia: linear ablation lesion strategy for noninducible or nonsustained tachycardia. Heart Rhythm 2005;2: 934–939.
565. Crijns HJ, Smeets JL, Rodriguez LM, Meijer A, Wellens HJ. Cure of interfascicular reentrant ventricular tachycardia by ablation of the anterior fascicle of the left bundle branch. J Cardiovasc Electrophysiol 1995;6:486–492.
566. Ohe T, Shimomura K, Aihara N, Kamakura S, Matsuhisa M, Sato I, Nakagawa H, Shimizu A. Idiopathic sustained left ventricular tachycardia: clinical and electrophysiologic characteristics. Circulation 1988;77:560–568.
567. Ouyang F, Cappato R, Ernst S, Goya M, Volkmer M, Hebe J, Antz M, Vogtmann T, Schaumann A, Fotuhi P, Hoffmann-Riem M, Kuck KH. Electroanatomic substrate of idiopathic left ventricular tachycardia: unidirectional block and macroreentry within the Purkinje network. Circulation 2002;105:462–469.
568. Nogami A, Naito S, Tada H, Taniguchi K, Okamoto Y, Nishimura S, Yamauchi Y, Aonuma K, Goya M, Iesaka Y, Hiroe M. Demonstration of diastolic and presystolic Purkinje potentials as critical potentials in a macroreentry circuit of verapamilsensitive idiopathic left ventricular tachycardia. J Am Coll Cardiol 2000;36:811–823.
569. Ma FS, Ma J, Tang K, Han H, Jia YH, Fang PH, Chu JM, Pu JL, Zhang S. Left posterior fascicular block: a new endpoint of ablation for verapamil-sensitive idiopathic ventricular tachycardia. Chin Med J (Engl) 2006;119:367–372.
570. Kottkamp H, Chen X, Hindricks G, Willems S, Haverkamp W, Wichter T, Breithardt G, Borggrefe M. Idiopathic left ventricular tachycardia: new insights into electrophysiological characteristics and radiofrequency catheter ablation. Pacing Clin Electrophysiol 1995;18:1285–1297.
571. Nogami A, Naito S, Tada H, Oshima S, Taniguchi K, Aonuma K, Iesaka Y. Verapamil-sensitive left anterior fascicular ventricular tachycardia: results of radiofrequency ablation in six patients. J Cardiovasc Electrophysiol 1998;9: 1269–1278.
572. Reithmann C, Hahnefeld A, Ulbrich M, Matis T, Steinbeck G. Different forms of ventricular tachycardia involving the left anterior fascicle in nonischemic cardiomyopathy: critical sites of the reentrant circuit in low-voltage areas. J Cardiovasc Electrophysiol 2009;20:841–849.
573. Bogun F, El-Atassi R, Daoud E, Man KC, Strickberger SA, Morady F. Radiofrequency ablation of idiopathic left anterior fascicular tachycardia. J Cardiovasc Electrophysiol 1995;6:1113–1116.
574. Mizusawa Y, Sakurada H, Nishizaki M, Ueda-Tatsumoto A, Fukamizu S, Hiraoka M. Characteristics of bundle branch reentrant ventricular tachycardia with a right bundle branch block configuration: feasibility of atrial pacing. Europace 2009;11: 1208–1213.
575. Nogami A. Purkinje-related arrhythmias part I: monomorphic ventricular tachycardias. Pacing Clin Electrophysiol 2011;34:624–650.
576. Doppalapudi H, Yamada T, McElderry HT, Plumb VJ, Epstein AE, Kay GN. Ventricular tachycardia originating from the posterior papillary muscle in the left ventricle: a distinct clinical syndrome. Circ Arrhythm Electrophysiol 2008;1:23–29.
577. Crawford T, Mueller G, Good E, Jongnarangsin K, Chugh A, Pelosi F Jr, Ebinger M, Oral H, Morady F, Bogun F. Ventricular arrhythmias originating from papillary muscles in the right ventricle. Heart Rhythm 2010;7:725–730.
578. Bogun F, Desjardins B, Crawford T, Good E, Jongnarangsin K, Oral H, Chugh A, Pelosi F, Morady F. Post-infarction ventricular arrhythmias originating in papillary muscles. J Am Coll Cardiol 2008;51:1794–1802.
579. Yeh SJ, Wen MS, Wang CC, Lin FC, Wu D. Adenosine-sensitive ventricular tachycardia from the anterobasal left ventricle. J Am Coll Cardiol 1997;30:1339–1345.
580. Kondo K, Watanabe I, Kojima T, Nakai T, Yanagawa S, Sugimura H, Shindo A, Oshikawa N, Masaki R, Saito S, Ozawa Y, Kanmatsuse K. Radiofrequency catheter ablation of ventricular tachycardia from the anterobasal left ventricle. Jpn Heart J 2000;41:215–225.
581. Tada H, Ito S, Naito S, Kurosaki K, Kubota S, Sugiyasu A, Tsuchiya T, Miyaji K, Yamada M, Kutsumi Y, Oshima S, Nogami A, Taniguchi K. Idiopathic ventricular arrhythmia arising from the mitral annulus: a distinct subgroup of idiopathic ventricular arrhythmias. J Am Coll Cardiol 2005;45:877–886.
582. Prystowsky EN, Padanilam BJ, Joshi S, Fogel RI. Ventricular arrhythmias in the absence of structural heart disease. J Am Coll Cardiol 2012;59:1733–1744.
583. Meissner MD, Lehmann MH, Steinman RT, Mosteller RD, Akhtar M, Calkins H, Cannom DS, Epstein AE, Fogoros RN, Liem LB, Marchlinski FE, Myerburg RJ, Veltri EP. Ventricular fibrillation in patients without significant structural heart disease: a multicenter experience with implantable cardioverter-defibrillator therapy. J Am Coll Cardiol 1993;21:1406–1412.
584. Haissaguerre M, Shah DC, Jais P, Shoda M, Kautzner J, Arentz T, Kalushe D, Kadish A, Griffith M, Gaita F, Yamane T, Garrigue S, Hocini M, Clementy J. Role of Purkinje conducting system in triggering of idiopathic ventricular fibrillation. Lancet 2002;359:677–678.
585. Bogun F, Good E, Reich S, Elmouchi D, Igic P, Tschopp D, Dey S, Wimmer A, Jongnarangsin K, Oral H, Chugh A, Pelosi F, Morady F. Role of Purkinje fibers in post-infarction ventricular tachycardia. J Am Coll Cardiol 2006;48:2500–2507.
586. Knecht S, Sacher F, Wright M, Hocini M, Nogami A, Arentz T, Petit B, Franck R, De Chillou C, Lamaison D, Farre J, Lavergne T, Verbeet T, Nault I, Matsuo S, Leroux L, Weerasooriya R, Cauchemez B, Lellouche N, Derval N, Narayan SM, Jais P, Clementy J, Haissaguerre M. Long-term follow-up of idiopathic ventricular fibrillation ablation: a multicenter study. J Am Coll Cardiol 2009;54:522–528.
587. Nogami A, Sugiyasu A, Kubota S, Kato K. Mapping and ablation of idiopathic ventricular fibrillation from the Purkinje system. Heart Rhythm 2005;2:646–649.
588. Haissaguerre M, Shoda M, Jais P, Nogami A, Shah DC, Kautzner J, Arentz T, Kalushe D, Lamaison D, Griffith M, Cruz F, de Paola A, Gaita F, Hocini M, Garrigue S, Macle L, Weerasooriya R, Clementy J. Mapping and ablation of idiopathic ventricular fibrillation. Circulation 2002;106:962–967.
589. Wever EF, Robles de Medina EO. Sudden death in patients without structural heart disease. J Am Coll Cardiol 2004;43:1137–1144.
590. Leenhardt A, Glaser E, Burguera M, Nurnberg M, Maison-Blanche P, Coumel P. Short-coupled variant of torsade de pointes. A new electrocardiographic entity in the spectrum of idiopathic ventricular tachyarrhythmias. Circulation 1994;89: 206–215.
591. Eisenberg SJ, Scheinman MM, Dullet NK, Finkbeiner WE, Griffin JC, Eldar M, Franz MR, Gonzalez R, Kadish AH, Lesh MD. Sudden cardiac death and polymorphous ventricular tachycardia in patients with normal QT intervals and normal systolic cardiac function. Am J Cardiol 1995;75:687–692.
592. Van den Branden B, Wever E, Boersma L. Torsade de pointes with short coupling interval. Acta Cardiol 2010;65:345–346.
593. Caforio AL, Pankuweit S, Arbustini E, Basso C, Gimeno-Blanes J, Felix SB, Fu M, Helio T, Heymans S, Jahns R, Klingel K, Linhart A, Maisch B, McKenna W, Mogensen J, Pinto YM, Ristic A, Schultheiss HP, Seggewiss H, Tavazzi L, Thiene G, Yilmaz A, Charron P, Elliott PM. Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J 2013;34:2636–2648.
594. JCS Joint Working Group. Guidelines for diagnosis and treatment of myocarditis (JCS 2009): digest version. Circ J 2011;75:734–743.
595. Aoyama N, Izumi T, Hiramori K, Isobe M, Kawana M, Hiroe M, Hishida H, Kitaura Y, Imaizumi T. National survey of fulminant myocarditis in Japan: therapeutic guidelines and long-term prognosis of using percutaneous cardiopulmonary support for fulminant myocarditis (special report from a scientific committee). Circ J 2002;66:133–144.
596. Liberman L, Anderson B, Silver ES, Singh R, Richmond ME. Incidence and characteristics of arrhythmias in pediatric patients with myocarditis: a multicenter study. J Am Coll Cardiol 2014;63:A483.
597. Kindermann I, Kindermann M, Kandolf R, Klingel K, Bultmann B, Muller T, Lindinger A, Bohm M. Predictors of outcome in patients with suspected myocarditis. Circulation 2008;118:639–648.
598. Prochnau D, Surber R, Kuehnert H, Heinke M, Klein HU, Figulla HR. Successful use of a wearable cardioverter-defibrillator in myocarditis with normal ejection fraction. Clin Res Cardiol 2010;99:129–131.
599. Chung MK. The role of the wearable cardioverter defibrillator in clinical practice. Cardiol Clin 2014;32:253–270.
600. Kandolin R, Lehtonen J, Salmenkivi K, Raisanen-Sokolowski A, Lommi J, Kupari M. Diagnosis, treatment, and outcome of giant-cell myocarditis in the era of combined immunosuppression. Circ Heart Fail 2013;6:15–22.
601. Schumm J, Greulich S, Wagner A, Grun S, Ong P, Bentz K, Klingel K, Kandolf R, Bruder O, Schneider S, Sechtem U, Mahrholdt H. Cardiovascular magnetic resonance risk stratification in patients with clinically suspected myocarditis. J Cardiovasc Magn Reson 2014;16:14.
602. Rosenheck S, Weiss A, Sharon Z. Therapy success and survival in patients with valvular heart disease and implantable cardioverter defibrillator. Int J Cardiol 2010;144:103–104.
603. Yang F, Shah B, Iwai S, Markowitz SM, Lerman BB, Stein KM. ICD implantation and arrhythmia-free survival in patients with depressed LV function following surgery for valvular heart disease. Pacing Clin Electrophysiol 2008;31:1419–1424.
604. Valles AG, Khawaja FJ, Gersh BJ, Enriquez-Sarano M, Friedman PA, Park SJ, Hodge DO, Cha YM. Implantable cardioverter defibrillators in patients with valvular cardiomyopathy. J Cardiovasc Electrophysiol 2012;23:1326–1332.
605. Aranki SF, Santini F, Adams DH, Rizzo RJ, Couper GS, Kinchla NM, Gildea JS, Collins JJ Jr, Cohn LH. Aortic valve endocarditis. Determinants of early survival and late morbidity. Circulation 1994;90:II175–II182.
606. Johnson LL, Sciacca RR, Ellis K, Weiss MB, Cannon PJ. Reduced left ventricular myocardial blood flow per unit mass in aortic stenosis. Circulation 1978;57: 582–590.
607. Martinez-Rubio A, Schwammenthal Y, Schwammenthal E, Block M, Reinhardt L, Garcia-Alberola A, Sierra G, Shenasa M, Haverkamp W, Scheld HH, Breithardt G, Borggrefe M. Patients with valvular heart disease presenting with sustained ventricular tachyarrhythmias or syncope: results of programmed ventricular stimulation and long-term follow-up. Circulation 1997;96:500–508.
608. Narasimhan C, Jazayeri MR, Sra J, Dhala A, Deshpande S, Biehl M, Akhtar M, Blanck Z. Ventricular tachycardia in valvular heart disease: facilitation of sustained bundle-branch reentry by valve surgery. Circulation 1997;96:4307–4313.
609. Sagar S, Liu PP, Cooper LT Jr. Myocarditis. Lancet 2012;379:738–747.
610. Liu QN, Reddy S, Sayre JW, Pop V, Graves MC, Fiala M. Essential role of HIV type 1-infected and cyclooxygenase 2-activated macrophages and T cells in HIV type 1 myocarditis. AIDS Res Hum Retroviruses 2001;17:1423–1433.
611. Richardson P, McKenna W, Bristow M, Maisch B, Mautner B, OConnell J, Olsen E, Thiene G, Goodwin J, Gyarfas I, Martin I, Nordet P. Report of the 1995 World Health Organization/International Society and Federation of Cardiology Task Force on the Definition and Classification of Cardiomyopathies. Circulation 1996;93:841–842.
612. Ukena C, Mahfoud F, Kindermann I, Kandolf R, Kindermann M, Bohm M. Prognostic electrocardiographic parameters in patients with suspected myocarditis. Eur J Heart Fail 2011;13:398–405.
613. Kohno K, Aoyama N, Shimohama T, Yoshida M, Machida Y, Fukuda N, Aizaki T, Suzuki K, Kurosawa T, Izumi T. Resuscitation from fulminant myocarditis associated with refractory ventricular fibrillation. Jpn Circ J 2000;64:139–143.
614. McCarthy RE 3rd, Boehmer JP, Hruban RH, Hutchins GM, Kasper EK, Hare JM, Baughman KL. Long-term outcome of fulminant myocarditis as compared with acute (nonfulminant) myocarditis. N Engl J Med 2000;342:690–695.
615. Phillips M, Robinowitz M, Higgins JR, Boran KJ, Reed T, Virmani R. Sudden cardiac death in Air Force recruits. A 20-year review. JAMA 1986;256:2696–2699.
616. Basso C, Calabrese F, Corrado D, Thiene G. Myocarditis: an underestimated cause of sudden cardiac death. In: Aliot E, Clementy J, Prystowsky EN, eds. Fighting Sudden Cardiac Death: A Worldwide Challenge. Armonk, NY: Futura; 2000:447–458.
617. Basso C, Calabrese F, Corrado D, Thiene G. Postmortem diagnosis in sudden cardiac death victims: macroscopic, microscopic and molecular findings. Cardiovasc Res 2001;50:290–300.
618. Fabre A, Sheppard MN. Sudden adult death syndrome and other non-ischaemic causes of sudden cardiac death. Heart 2006;92:316–320.
619. Wesslen L, Pahlson C, Lindquist O, Hjelm E, Gnarpe J, Larsson E, Baandrup U, Eriksson L, Fohlman J, Engstrand L, Linglof T, Nystrom-Rosander C, Gnarpe H, Magnius L, Rolf C, Friman G. An increase in sudden unexpected cardiac deaths among young Swedish orienteers during 1979–1992. Eur Heart J 1996;17: 902–910.
620. DAmbrosio A, Patti G, Manzoli A, Sinagra G, Di Lenarda A, Silvestri F, Di Sciascio G. The fate of acute myocarditis between spontaneous improvement and evolution to dilated cardiomyopathy: a review. Heart 2001;85:499–504.
621. Kuhl U, Pauschinger M, Seeberg B, Lassner D, Noutsias M, Poller W, Schultheiss HP. Viral persistence in the myocardium is associated with progressive cardiac dysfunction. Circulation 2005;112:1965–1970.
622. Mazzone P, Tsiachris D, Della Bella P. Epicardial management of myocarditisrelated ventricular tachycardia. Eur Heart J 2013;34:244.
623. Wallace SM, Walton BI, Kharbanda RK, Hardy R, Wilson AP, Swanton RH. Mortality from infective endocarditis: clinical predictors of outcome. Heart 2002;88: 53–60.
624. Kumar S, Barbhaiya C, Nagashima K, Choi EK, Epstein LM, John RM, Maytin M, Albert CM, Miller AL, Koplan BA, Michaud GF, Tedrow UB, Stevenson WG. Ventricular tachycardia in cardiac sarcoidosis: characterization of ventricular substrate and outcomes of catheter ablation. Circ Arrhythm Electrophysiol 2015;8: 87–93.
625. Birnie DH, Sauer WH, Bogun F, Cooper JM, Culver DA, Duvernoy CS, Judson MA, Kron J, Mehta D, Cosedis Nielsen J, Patel AR, Ohe T, Raatikainen P, Soejima K. HRS expert consensus statement on the diagnosis and management of arrhythmias associated with cardiac sarcoidosis. Heart Rhythm 2014;11:1305–1323.
626. von Olshausen K, Schwarz F, Apfelbach J, Rohrig N, Kramer B, Kubler W. Determinants of the incidence and severity of ventricular arrhythmias in aortic valve disease. Am J Cardiol 1983;51:1103–1109.
627. Hochreiter C, Niles N, Devereux RB, Kligfield P, Borer JS. Mitral regurgitation: relationship of noninvasive descriptors of right and left ventricular performance to clinical and hemodynamic findings and to prognosis in medically and surgically treated patients. Circulation 1986;73:900–912.
628. Chizner MA, Pearle DL, deLeon AC Jr. The natural history of aortic stenosis in adults. Am Heart J 1980;99:419–424.
629. Sorgato A, Faggiano P, Aurigemma GP, Rusconi C, Gaasch WH. Ventricular arrhythmias in adult aortic stenosis: prevalence, mechanisms, and clinical relevance. Chest 1998;113:482–491.
630. Delahaye JP, Gare JP, Viguier E, Delahaye F, De Gevigney G, Milon H. Natural history of severe mitral regurgitation. Eur Heart J 1991;12(Suppl B):5–9.
631. Grigioni F, Enriquez-Sarano M, Ling LH, Bailey KR, Seward JB, Tajik AJ, Frye RL. Sudden death in mitral regurgitation due to flail leaflet. J Am Coll Cardiol 1999; 34:2078–2085.
632. Olafiranye O, Hochreiter CA, Borer JS, Supino PG, Herrold EM, Budzikowski AS, Hai OY, Bouraad D, Kligfield PD, Girardi LN, Krieger KH, Isom OW. Nonischemic mitral regurgitation: prognostic value of nonsustained ventricular tachycardia after mitral valve surgery. Cardiology 2013;124:108–115.
633. Groves P. Valve disease: Surgery of valve disease: late results and late complications. Heart 2001;86:715–721.
634. Blackstone EH, Kirklin JW. Death and other time-related events after valve replacement. Circulation 1985;72:753–767.
635. Hwang MH, Burchfiel CM, Sethi GK, Oprian C, Grover FL, Henderson WG, Hammermeister K. Comparison of the causes of late death following aortic and mitral valve replacement. VA Co-operative Study on Valvular Heart Disease. J Heart Valve Dis 1994;3:17–24.
636. Burke AP, Farb A, Sessums L, Virmani R. Causes of sudden cardiac death in patients with replacement valves: an autopsy study. J Heart Valve Dis 1994;3:10–16.
637. Food and Drug Administration. International Conference on Harmonisation; guidance on E14 Clinical Evaluation of QT/QTc Interval Prolongation and Proarrhythmic Potential for Non-Antiarrhythmic Drugs; availability. Notice. Fed Reg 2005;70:61134–61135.
638. Watanabe J, Suzuki Y, Fukui N, Ono S, Sugai T, Tsuneyama N, Someya T. Increased risk of antipsychotic-related QT prolongation during nighttime: a 24-hour Holter electrocardiogram recording study. J Clin Psychopharmacol 2012;32:18–22.
639. Wu CS, Tsai YT, Tsai HJ. Antipsychotic drugs and the risk of ventricular arrhythmia and/or sudden cardiac death: a nation-wide case-crossover study. J Am Heart Assoc 2015;4:e001568.
640. Sala M, Vicentini A, Brambilla P, Montomoli C, Jogia JR, Caverzasi E, Bonzano A, Piccinelli M, Barale F, De Ferrari GM. QT interval prolongation related to psychoactive drug treatment: a comparison of monotherapy versus polytherapy. Ann Gen Psychiatry 2005;4:1.
641. Fanoe S, Kristensen D, Fink-Jensen A, Jensen HK, Toft E, Nielsen J, Videbech P, Pehrson S, Bundgaard H. Risk of arrhythmia induced by psychotropic medications: a proposal for clinical management. Eur Heart J 2014;35:1306–1315.
642. Girardin FR, Gex-Fabry M, Berney P, Shah D, Gaspoz JM, Dayer P. Drug-induced long QT in adult psychiatric inpatients: the 5-year cross-sectional ECG Screening Outcome in Psychiatry study. Am J Psychiatry 2013;170:1468–1476.
643. Murray-Thomas T, Jones ME, Patel D, Brunner E, Shatapathy CC, Motsko S, Van Staa TP. Risk of mortality (including sudden cardiac death) and major cardiovascular events in atypical and typical antipsychotic users: a study with the general practice research database. Cardiovasc Psychiatry Neurol 2013;2013:247486.
644. Appleby L, Thomas S, Ferrier N, Lewis G, Shaw J, Amos T. Sudden unexplained death in psychiatric in-patients. Br J Psychiatry 2000;176:405–406.
645. Roden DM, Lazzara R, Rosen M, Schwartz PJ, Towbin J, Vincent GM. Multiple mechanisms in the long-QT syndrome. Current knowledge, gaps, and future directions. The SADS Foundation Task Force on LQTS. Circulation 1996;94: 1996–2012.
646. Ray WA, Meredith S, Thapa PB, Meador KG, Hall K, Murray KT. Antipsychotics and the risk of sudden cardiac death. Arch Gen Psychiatry 2001;58:1161–1167.
647. Ray WA, Chung CP, Murray KT, Hall K, Stein CM. Atypical antipsychotic drugs and the risk of sudden cardiac death. N Engl J Med 2009;360:225–235.
648. Haddad PM, Anderson IM. Antipsychotic-related QTc prolongation, torsade de pointes and sudden death. Drugs 2002;62:1649–1671.
649. Taylor DM. Antipsychotics and QT prolongation. Acta Psychiatr Scand 2003;107: 85–95.
650. Devinsky O. Sudden, unexpected death in epilepsy. N Engl J Med 2011;365: 1801–1811.
651. Annegers JF. United States perspective on definitions and classifications. Epilepsia 1997;38(Suppl):S9–S12.
652. Dasheiff RM. Sudden unexpected death in epilepsy: a series from an epilepsy surgery program and speculation on the relationship to sudden cardiac death. J Clin Neurophysiol 1991;8:216–222.
653. Donner EJ, Smith CR, Snead OC 3rd. Sudden unexplained death in children with epilepsy. Neurology 2001;57:430–434.
654. Ficker DM, So EL, Shen WK, Annegers JF, OBrien PC, Cascino GD, Belau PG. Population-based study of the incidence of sudden unexplained death in epilepsy. Neurology 1998;51:1270–1274.
655. Nashef L, Fish DR, Garner S, Sander JW, Shorvon SD. Sudden death in epilepsy: a study of incidence in a young cohort with epilepsy and learning difficulty. Epilepsia 1995;36:1187–1194.
656. Nilsson L, Ahlbom A, Farahmand BY, Tomson T. Mortality in a population-based cohort of epilepsy surgery patients. Epilepsia 2003;44:575–581.
657. Sperling MR, Feldman H, Kinman J, Liporace JD, OConnor MJ. Seizure control and mortality in epilepsy. Ann Neurol 1999;46:45–50.
658. Tomson T, Nashef L, Ryvlin P. Sudden unexpected death in epilepsy: current knowledge and future directions. Lancet Neurol 2008;7:1021–1031.
659. Tomson T, Walczak T, Sillanpaa M, Sander JW. Sudden unexpected death in epilepsy: a review of incidence and risk factors. Epilepsia 2005;46(Suppl 11):54–61.
660. Walczak TS, Leppik IE, DAmelio M, Rarick J, So E, Ahman P, Ruggles K, Cascino GD, Annegers JF, Hauser WA. Incidence and risk factors in sudden unexpected death in epilepsy: a prospective cohort study. Neurology 2001;56: 519–525.
661. Sandorfi G, Clemens B, Csanadi Z. Electrical storm in the brain and in the heart: epilepsy and Brugada syndrome. Mayo Clin Proc 2013;88:1167–1173.
662. Johnson JN, Hofman N, Haglund CM, Cascino GD, Wilde AA, Ackerman MJ. Identification of a possible pathogenic link between congenital long QT syndrome and epilepsy. Neurology 2009;72:224–231.
663. Rugg-Gunn FJ, Simister RJ, Squirrell M, Holdright DR, Duncan JS. Cardiac arrhythmias in focal epilepsy: a prospective long-term study. Lancet 2004;364: 2212–2219.
664. Ryvlin P, Nashef L, Lhatoo SD, Bateman LM, Bird J, Bleasel A, Boon P, Crespel A, Dworetzky BA, Hogenhaven H, Lerche H, Maillard L, Malter MP, Marchal C, Murthy JM, Nitsche M, Pataraia E, Rabben T, Rheims S, Sadzot B, Schulze-Bonhage A, Seyal M, So EL, Spitz M, Szucs A, Tan M, Tao JX, Tomson T. Incidence and mechanisms of cardiorespiratory arrests in epilepsy monitoring units (MORTEMUS): a retrospective study. Lancet Neurol 2013;12: 966–977.
665. Lund M, Diaz LJ, Ranthe MF, Petri H, Duno M, Juncker I, Eiberg H, Vissing J, Bundgaard H, Wohlfahrt J, Melbye M. Cardiac involvement in myotonic dystrophy: a nationwide cohort study. Eur Heart J 2014;35:2158–2164.
666. Groh WJ. Arrhythmias in the muscular dystrophies. Heart Rhythm 2012;9: 1890–1895.
667. Petri H, Vissing J, Witting N, Bundgaard H, Kober L. Cardiac manifestations of myotonic dystrophy type 1. Int J Cardiol 2012;160:82–88.
668. Lallemand B, Clementy N, Bernard-Brunet A, Pierre B, Corcia P, Fauchier L, Raynaud M, Pellieux S, Babuty D. The evolution of infrahissian conduction time in myotonic dystrophy patients: clinical implications. Heart 2012;98:291–296.
669. Groh WJ, Groh MR, Saha C, Kincaid JC, Simmons Z, Ciafaloni E, Pourmand R, Otten RF, Bhakta D, Nair GV, Marashdeh MM, Zipes DP, Pascuzzi RM. Electrocardiographic abnormalities and sudden death in myotonic dystrophy type 1. N Engl J Med 2008;358:2688–2697.
670. Roberts NK, Perloff JK, Kark RA. Cardiac conduction in the Kearns-Sayre syndrome (a neuromuscular disorder associated with progressive external ophthalmoplegia and pigmentary retinopathy). Report of 2 cases and review of 17 published cases. Am J Cardiol 1979;44:1396–1400.
671. Boriani G, Gallina M, Merlini L, Bonne G, Toniolo D, Amati S, Biffi M, Martignani C, Frabetti L, Bonvicini M, Rapezzi C, Branzi A. Clinical relevance of atrial fibrillation/ flutter, stroke, pacemaker implant, and heart failure in Emery-Dreifuss muscular dystrophy: a long-term longitudinal study. Stroke 2003;34:901–908.
672. Wahbi K, Meune C, Porcher R, Becane HM, Lazarus A, Laforet P, Stojkovic T, Behin A, Radvanyi-Hoffmann H, Eymard B, Duboc D. Electrophysiological study with prophylactic pacing and survival in adults with myotonic dystrophy and conduction system disease. JAMA 2012;307:1292–1301.
673. Laurent V, Pellieux S, Corcia P, Magro P, Pierre B, Fauchier L, Raynaud M, Babuty D. Mortality in myotonic dystrophy patients in the area of prophylactic pacing devices. Int J Cardiol 2011;150:54–58.
674. Meune C, Van Berlo JH, Anselme F, Bonne G, Pinto YM, Duboc D. Primary prevention of sudden death in patients with lamin A/C gene mutations. N Engl J Med 2006;354:209–210.
675. European Society of Gynecology (ESG), Association for European Paediatric Cardiology (AEPC), German Society for Gender Medicine (DGesGM), Regitz-Zagrosek V, Blomstrom Lundqvist C, Borghi C, Cifkova R, Ferreira R, Foidart JM, Gibbs JS, Gohlke-Baerwolf C, Gorenek B, Iung B, Kirby M, Maas AH, Morais J, Nihoyannopoulos P, Pieper PG, Presbitero P, Roos-Hesselink JW, Schaufelberger M, Seeland U, Torracca L, ESC Committee for Practice Guidelines. ESC Guidelines on the management of cardiovascular diseases during pregnancy: the Task Force on the Management of Cardiovascular Diseases during Pregnancy of the European Society of Cardiology (ESC). Eur Heart J 2011;32:3147–3197.
676. Rashba EJ, Zareba W, Moss AJ, Hall WJ, Robinson J, Locati EH, Schwartz PJ, Andrews M. Influence of pregnancy on the risk for cardiac events in patients with hereditary long QT syndrome. LQTS Investigators. Circulation 1998;97: 451–456.
677. Task Force on the Management of Cardiovascular Diseases During Pregnancy of the European Society of Cardiology. Expert consensus document on management of cardiovascular diseases during pregnancy. Eur Heart J 2003;24:761–781.
678. Dorian P, Cass D, Schwartz B, Cooper R, Gelaznikas R, Barr A. Amiodarone as compared with lidocaine for shock-resistant ventricular fibrillation. N Engl J Med 2002;346:884–890.
679. Siu SC, Sermer M, Colman JM, Alvarez AN, Mercier LA, Morton BC, Kells CM, Bergin ML, Kiess MC, Marcotte F, Taylor DA, Gordon EP, Spears JC, Tam JW, Amankwah KS, Smallhorn JF, Farine D, Sorensen S. Prospective multicenter study of pregnancy outcomes in women with heart disease. Circulation 2001;104: 515–521.
680. Drenthen W, Pieper PG, Roos-Hesselink JW, van Lottum WA, Voors AA, Mulder BJ, van Dijk AP, Vliegen HW, Yap SC, Moons P, Ebels T, van Veldhuisen DJ. Outcome of pregnancy in women with congenital heart disease: a literature review. J Am Coll Cardiol 2007;49:2303–2311.
681. Roos-Hesselink JW, Ruys TP, Stein JI, Thilen U, Webb GD, Niwa K, Kaemmerer H, Baumgartner H, Budts W, Maggioni AP, Tavazzi L, Taha N, Johnson MR, Hall R. Outcome of pregnancy in patients with structural or ischaemic heart disease: results of a registry of the European Society of Cardiology. Eur Heart J 2013;34: 657–665.
682. Wolbrette D, Naccarelli G, Curtis A, Lehmann M, Kadish A. Gender differences in arrhythmias. Clin Cardiol 2002;25:49–56.
683. Rodriguez-Manero M, Casado-Arroyo R, Sarkozy A, Leysen E, Sieira JA, Namdar M, Conte G, Levinstein M, Chierchia GB, de Asmundis C, Brugada P. The clinical significance of pregnancy in Brugada syndrome. Rev Esp Cardiol (Engl Ed) 2014;67:176–180.
684. Benito B, Berruezo A. Brugada syndrome and pregnancy: delving into the role of sex hormones in ion channelopathies. Rev Esp Cardiol (Engl Ed) 2014;67:165–167.
685. Shotan A, Ostrzega E, Mehra A, Johnson JV, Elkayam U. Incidence of arrhythmias in normal pregnancy and relation to palpitations, dizziness, and syncope. Am J Cardiol 1997;79:1061–1064.
686. Widerhorn J, Widerhorn AL, Rahimtoola SH, Elkayam U. WPW syndrome during pregnancy: increased incidence of supraventricular arrhythmias. Am Heart J 1992; 123:796–798.
687. Tawam M, Levine J, Mendelson M, Goldberger J, Dyer A, Kadish A. Effect of pregnancy on paroxysmal supraventricular tachycardia. Am J Cardiol 1993;72:838–840.
688. Lee SH, Chen SA, Wu TJ, Chiang CE, Cheng CC, Tai CT, Chiou CW, Ueng KC, Chang MS. Effects of pregnancy on first onset and symptoms of paroxysmal supraventricular tachycardia. Am J Cardiol 1995;76:675–678.
689. Brodsky M, Doria R, Allen B, Sato D, Thomas G, Sada M. New-onset ventricular tachycardia during pregnancy. Am Heart J 1992;123:933–941.
690. Silversides CK, Harris L, Haberer K, Sermer M, Colman JM, Siu SC. Recurrence rates of arrhythmias during pregnancy in women with previous tachyarrhythmia and impact on fetal and neonatal outcomes. Am J Cardiol 2006;97:1206–1212.
691. Sharif-Kazemi MB, Emkanjoo Z, Tavoosi A, Kafi M, Kheirkhah J, Alizadeh A, Sadr-Ameli MA. Electrical storm in Brugada syndrome during pregnancy. Pacing Clin Electrophysiol 2011;34:e18–e21.
692. Joglar JA, Page RL. Treatment of cardiac arrhythmias during pregnancy: safety considerations. Drug Saf 1999;20:85–94.
693. Cox JL, Gardner MJ. Treatment of cardiac arrhythmias during pregnancy. Prog Cardiovasc Dis 1993;36:137–178.
694. Tan HL, Lie KI. Treatment of tachyarrhythmias during pregnancy and lactation. Eur Heart J 2001;22:458–464.
695. Abello M, Peinado R, Merino JL, Gnoatto M, Mateos M, Silvestre J, Dominguez JL. Cardioverter defibrillator implantation in a pregnant woman guided with transesophageal echocardiography. Pacing Clin Electrophysiol 2003;26:1913–1914.
696. Natale A, Davidson T, Geiger MJ, Newby K. Implantable cardioverterdefibrillators and pregnancy: a safe combination? Circulation 1997;96:2808–2812.
697. Piper JM, Berkus M, Ridgway LE 3rd. Pregnancy complicated by chronic cardiomyopathy and an automatic implantable cardioverter defibrillator. Am J Obstet Gynecol 1992;167:506–507.
698. Sliwa K, Hilfiker-Kleiner D, Petrie MC, Mebazaa A, Pieske B, Buchmann E, Regitz-Zagrosek V, Schaufelberger M, Tavazzi L, van Veldhuisen DJ, Watkins H, Shah AJ, Seferovic PM, Elkayam U, Pankuweit S, Papp Z, Mouquet F, McMurray JJ. Current state of knowledge on aetiology, diagnosis, management, and therapy of peripartum cardiomyopathy: a position statement from the Heart Failure Association of the European Society of Cardiology Working Group on peripartum cardiomyopathy. Eur J Heart Fail 2010;12:767–778.
699. Cooper WO, Hernandez-Diaz S, Arbogast PG, Dudley JA, Dyer S, Gideon PS, Hall K, Ray WA. Major congenital malformations after first-trimester exposure to ACE inhibitors. N Engl J Med 2006;354:2443–2451.
700. Regitz-Zagrosek V, Blomstrom Lundqvist C, Borghi C, Cifkova R, Ferreira R, Foidart JM, Gibbs JS, Gohlke-Baerwolf C, Gorenek B, Iung B, Kirby M, Maas AH, Morais J, Nihoyannopoulos P, Pieper PG, Presbitero P, Roos-Hesselink JW, Schaufelberger M, Seeland U, Torracca L. ESC Guidelines on the management of cardiovascular diseases during pregnancy: the Task Force on the Management of Cardiovascular Diseases during Pregnancy of the European Society of Cardiology (ESC). Eur Heart J 2011;32:3147–3197.
701. Sliwa K, Fett J, Elkayam U. Peripartum cardiomyopathy. Lancet 2006;368:687–693. 702. Gunderson EP, Croen LA, Chiang V, Yoshida CK, Walton D, Go AS. Epidemiology of peripartum cardiomyopathy: incidence, predictors, and outcomes. Obstet Gynecol 2011;118:583–591.
703. Felker GM, Jaeger CJ, Klodas E, Thiemann DR, Hare JM, Hruban RH, Kasper EK, Baughman KL. Myocarditis and long-term survival in peripartum cardiomyopathy. Am Heart J 2000;140:785–791.
704. van Spaendonck-Zwarts KY, Posafalvi A, van den Berg MP, Hilfiker-Kleiner D, Bollen IA, Sliwa K, Alders M, Almomani R, van Langen IM, van der Meer P, Sinke RJ, van der Velden J, Van Veldhuisen DJ, van Tintelen JP, Jongbloed JD. Titin gene mutations are common in families with both peripartum cardiomyopathy and dilated cardiomyopathy. Eur Heart J 2014;35:2165–2173.
705. Sliwa K, Hilfiker-Kleiner D, Mebazaa A, Petrie MC, Maggioni AP, Regitz-Zagrosek V, Schaufelberger M, Tavazzi L, van Veldhuisen DJ, Roos-Hesslink JW, Shah AJ, Seferovic PM, Elkayam U, van Spaendonck-Zwarts K, Bachelier-Walenta K, Mouquet F, Kraigher-Krainer E, Hall R, Ponikowski P, McMurray JJ, Pieske B. EURObservational Research Programme: a worldwide registry on peripartum cardiomyopathy (PPCM) in conjunction with the Heart Failure Association of the European Society of Cardiology Working Group on PPCM. Eur J Heart Fail 2014;16:583–591.
706. Gowda RM, Khan IA, Mehta NJ, Vasavada BC, Sacchi TJ. Cardiac arrhythmias in pregnancy: clinical and therapeutic considerations. Int J Cardiol 2003;88:129–133.
707. Schaefer C. Angiotensin II-receptor-antagonists: further evidence of fetotoxicity but not teratogenicity. Birth Defects Res A Clin Mol Teratol 2003;67:591–594. 708. Trappe HJ, Pfitzner P. [Cardiac arrhythmias in pregnancy]. Z Kardiol 2001; 90(Suppl 4):36–44.
709. Mirshahi M, Ayani E, Nicolas C, Golestaneh N, Ferrari P, Valamanesh F, Agarwal MK. The blockade of mineralocorticoid hormone signaling provokes dramatic teratogenesis in cultured rat embryos. Int J Toxicol 2002;21:191–199.
710. Habli M, OBrien T, Nowack E, Khoury S, Barton JR, Sibai B. Peripartum cardiomyopathy: prognostic factors for long-term maternal outcome. Am J Obstet Gynecol 2008;199:415.e1–415.e5.
711. Simantirakis EN, Schiza SI, Marketou ME, Chrysostomakis SI, Chlouverakis GI, Klapsinos NC, Siafakas NS, Vardas PE. Severe bradyarrhythmias in patients with sleep apnoea: the effect of continuous positive airway pressure treatment: a longterm evaluation using an insertable loop recorder. Eur Heart J 2004;25: 1070–1076.
712. Gami AS, Olson EJ, Shen WK, Wright RS, Ballman KV, Hodge DO, Herges RM, Howard DE, Somers VK. Obstructive sleep apnea and the risk of sudden cardiac death: a longitudinal study of 10,701 adults. J Am Coll Cardiol 2013;62:610–616.
713. Young T, Palta M, Dempsey J, Skatrud J, Weber S, Badr S. The occurrence of sleepdisordered breathing among middle-aged adults. N Engl J Med 1993;328: 1230–1235.
714. Marshall NS, Wong KK, Liu PY, Cullen SR, Knuiman MW, Grunstein RR. Sleep apnea as an independent risk factor for all-cause mortality: the Busselton Health Study. Sleep 2008;31:1079–1085.
715. Young T, Finn L, Peppard PE, Szklo-Coxe M, Austin D, Nieto FJ, Stubbs R, Hla KM. Sleep disordered breathing and mortality: eighteen-year follow-up of the Wisconsin sleep cohort. Sleep 2008;31:1071–1078.
716. Kreuz J, Skowasch D, Horlbeck F, Atzinger C, Schrickel JW, Lorenzen H, Nickenig G, Schwab JO. Usefulness of sleep-disordered breathing to predict occurrence of appropriate and inappropriate implantable-cardioverter defibrillator therapy in patients with implantable cardioverter-defibrillator for primary prevention of sudden cardiac death. Am J Cardiol 2013;111:1319–1323.
717. Bitter T, Westerheide N, Prinz C, Hossain MS, Vogt J, Langer C, Horstkotte D, Oldenburg O. Cheyne-Stokes respiration and obstructive sleep apnoea are independent risk factors for malignant ventricular arrhythmias requiring appropriate cardioverter-defibrillator therapies in patients with congestive heart failure. Eur Heart J 2011;32:61–74.
718. Roche F, Xuong AN, Court-Fortune I, Costes F, Pichot V, Duverney D, Vergnon JM, Gaspoz JM, Barthelemy JC. Relationship among the severity of sleep apnea syndrome, cardiac arrhythmias, and autonomic imbalance. Pacing Clin Electrophysiol 2003;26:669–677.
719. Guilleminault C, Connolly SJ, Winkle RA. Cardiac arrhythmia and conduction disturbances during sleep in 400 patients with sleep apnea syndrome. Am J Cardiol 1983;52:490–494.
720. Becker HF, Koehler U, Stammnitz A, Peter JH. Heart block in patients with sleep apnoea. Thorax 1998;53(Suppl 3):S29–S32.
721. Grimm W, Hoffmann J, Menz V, Kohler U, Heitmann J, Peter JH, Maisch B. Electrophysiologic evaluation of sinus node function and atrioventricular conduction in patients with prolonged ventricular asystole during obstructive sleep apnea. Am J Cardiol 1996;77:1310–1314.
722. Mehra R, Benjamin EJ, Shahar E, Gottlieb DJ, Nawabit R, Kirchner HL, Sahadevan J, Redline S. Association of nocturnal arrhythmias with sleep-disordered breathing: the Sleep Heart Health Study. Am J Respir Crit Care Med 2006;173:910–916.
723. Hoffstein V, Mateika S. Cardiac arrhythmias, snoring, and sleep apnea. Chest 1994; 106:466–471.
724. Tilkian AG, Guilleminault C, Schroeder JS, Lehrman KL, Simmons FB, Dement WC. Sleep-induced apnea syndrome. Prevalence of cardiac arrhythmias and their reversal after tracheostomy. Am J Med 1977;63:348–358.
725. Ryan CM, Usui K, Floras JS, Bradley TD. Effect of continuous positive airway pressure on ventricular ectopy in heart failure patients with obstructive sleep apnoea. Thorax 2005;60:781–785.
726. Gami AS, Howard DE, Olson EJ, Somers VK. Day-night pattern of sudden death in obstructive sleep apnea. N Engl J Med 2005;352:1206–1214.
727. Gonzalez-Rothi RJ, Foresman GE, Block AJ. Do patients with sleep apnea die in their sleep? Chest 1988;94:531–538.
728. Seppala T, Partinen M, Penttila A, Aspholm R, Tiainen E, Kaukianen A. Sudden death and sleeping history among Finnish men. J Intern Med 1991;229:23–28.
729. Zeidan-Shwiri T, Aronson D, Atalla K, Blich M, Suleiman M, Marai I, Gepstein L, Lavie L, Lavie P, Boulos M. Circadian pattern of life-threatening ventricular arrhythmia in patients with sleep-disordered breathing and implantable cardioverter-defibrillators. Heart Rhythm 2011;8:657–662.
730. Harbison J, OReilly P, McNicholas WT. Cardiac rhythm disturbances in the obstructive sleep apnea syndrome: effects of nasal continuous positive airway pressure therapy. Chest 2000;118:591–595.
731. Grimm W, Koehler U, Fus E, Hoffmann J, Menz V, Funck R, Peter JH, Maisch B. Outcome of patients with sleep apnea-associated severe bradyarrhythmias after continuous positive airway pressure therapy. Am J Cardiol 2000;86:688–692.
732. Koehler U, Fus E, Grimm W, Pankow W, Schafer H, Stammnitz A, Peter JH. Heart block in patients with obstructive sleep apnoea: pathogenetic factors and effects of treatment. Eur Respir J 1998;11:434–439.
733. Stegman SS, Burroughs JM, Henthorn RW. Asymptomatic bradyarrhythmias as a marker for sleep apnea: appropriate recognition and treatment may reduce the need for pacemaker therapy. Pacing Clin Electrophysiol 1996;19:899–904.
734. Garrigue S, Pepin JL, Defaye P, Murgatroyd F, Poezevara Y, Clementy J, Levy P. High prevalence of sleep apnea syndrome in patients with long-term pacing: the European Multicenter Polysomnographic Study. Circulation 2007;115: 1703–1709.
735. Doherty LS, Kiely JL, Swan V, McNicholas WT. Long-term effects of nasal continuous positive airway pressure therapy on cardiovascular outcomes in sleep apnea syndrome. Chest 2005;127:2076–2084.
736. Garrigue S, Bordier P, Jais P, Shah DC, Hocini M, Raherison C, Tunon De Lara M, Haissaguerre M, Clementy J. Benefit of atrial pacing in sleep apnea syndrome. N Engl J Med 2002;346:404–412.
737. Simantirakis EN, Vardas PE. Cardiac pacing in sleep apnoea: diagnostic and therapeutic implications. Europace 2006;8:984–987.
738. Marin JM, Carrizo SJ, Vicente E, Agusti AG. Long-term cardiovascular outcomes in men with obstructive sleep apnoea-hypopnoea with or without treatment with continuous positive airway pressure: an observational study. Lancet 2005;365: 1046–1053.
739. Defaye P, de la Cruz I, Marti-Almor J, Villuendas R, Bru P, Senechal J, Tamisier R, Pepin JL. A pacemaker transthoracic impedance sensor with an advanced algorithm to identify severe sleep apnea: the DREAM European study. Heart Rhythm 2014;11:842–848.
740. Strollo PJ Jr, Soose RJ, Maurer JT, de Vries N, Cornelius J, Froymovich O, Hanson RD, Padhya TA, Steward DL, Gillespie MB, Woodson BT, Van de Heyning PH, Goetting MG, Vanderveken OM, Feldman N, Knaack L, Strohl KP. Upper-airway stimulation for obstructive sleep apnea. N Engl J Med 2014;370: 139–149.
741. Wyse DG, Friedman PL, Brodsky MA, Beckman KJ, Carlson MD, Curtis AB, Hallstrom AP, Raitt MH, Wilkoff BL, Greene HL. Life-threatening ventricular arrhythmias due to transient or correctable causes: high risk for death in follow-up. J Am Coll Cardiol 2001;38:1718–1724.
742. Monnig G, Kobe J, Loher A, Wasmer K, Milberg P, Zellerhoff S, Pott C, Zumhagen S, Radu R, Scheld HH, Haverkamp W, Schulze-Bahr E, Eckardt L. Role of implantable cardioverter defibrillator therapy in patients with acquired long QT syndrome: a long-term follow-up. Europace 2012;14:396–401.
743. Wolbrette DL. Risk of proarrhythmia with class III antiarrhythmic agents: sexbased differences and other issues. Am J Cardiol 2003;91:39D–44D.
744. Haverkamp W, Breithardt G, Camm AJ, Janse MJ, Rosen MR, Antzelevitch C, Escande D, Franz M, Malik M, Moss A, Shah R. The potential for QT prolongation and proarrhythmia by non-antiarrhythmic drugs: clinical and regulatory implications. Report on a policy conference of the European Society of Cardiology. Eur Heart J 2000;21:1216–1231.
745. Rao GA, Mann JR, Shoaibi A, Bennett CL, Nahhas G, Sutton SS, Jacob S, Strayer SM. Azithromycin and levofloxacin use and increased risk of cardiac arrhythmia and death. Ann Fam Med 2014;12:121–127.
746. Ray WA, Murray KT, Hall K, Arbogast PG, Stein CM. Azithromycin and the risk of cardiovascular death. N Engl J Med 2012;366:1881–1890.
747. Lapi F, Wilchesky M, Kezouh A, Benisty JI, Ernst P, Suissa S. Fluoroquinolones and the risk of serious arrhythmia: a population-based study. Clin Infect Dis 2012;55: 1457–1465.
748. Svanstrom H, Pasternak B, Hviid A. Use of clarithromycin and roxithromycin and risk of cardiac death: cohort study. BMJ 2014;349:g4930.
749. Fralick M, Macdonald EM, Gomes T, Antoniou T, Hollands S, Mamdani MM, Juurlink DN, Canadian Drug Safety and Effectiveness Research Network (CDSERN). Co-trimoxazole and sudden death in patients receiving inhibitors of renin-angiotensin system: population based study. BMJ 2014;349:g6196.
750. Tada H, Sticherling C, Oral H, Morady F. Brugada syndrome mimicked by tricyclic antidepressant overdose. J Cardiovasc Electrophysiol 2001;12:275.
751. Lipshultz SE, Lipsitz SR, Mone SM, Goorin AM, Sallan SE, Sanders SP, Orav EJ, Gelber RD, Colan SD. Female sex and drug dose as risk factors for late cardiotoxic effects of doxorubicin therapy for childhood cancer. N Engl J Med 1995; 332:1738–1743.
752. Steinherz LJ, Steinherz PG, Tan C. Cardiac failure and dysrhythmias 6-19 years after anthracycline therapy: a series of 15 patients. Med Pediatr Oncol 1995;24: 352–361.
753. Anand AJ. Fluorouracil cardiotoxicity. Ann Pharmacother 1994;28:374–378.
754. Gorgulu S, Celik S, Tezel T. A case of coronary spasm induced by 5-fluorouracil. Acta Cardiol 2002;57:381–383. 755. Pinter A, Dorian P, Newman D. Cesium-induced torsades de pointes. N Engl J Med 2002;346:383–384.
756. Gowda RM, Cohen RA, Khan IA. Toad venom poisoning: resemblance to digoxin toxicity and therapeutic implications. Heart 2003;89:e14.
757. Bain RJ. Accidental digitalis poisoning due to drinking herbal tea. Br Med J (Clin Res Ed) 1985;290:1624.
758. Eddleston M, Ariaratnam CA, Sjostrom L, Jayalath S, Rajakanthan K, Rajapakse S, Colbert D, Meyer WP, Perera G, Attapattu S, Kularatne SA, Sheriff MR, Warrell DA. Acute yellow oleander (Thevetia peruviana) poisoning: cardiac arrhythmias, electrolyte disturbances, and serum cardiac glycoside concentrations on presentation to hospital. Heart 2000;83:301–306.
759. Schnetzler B, Popova N, Collao Lamb C, Sappino AP. Coronary spasm induced by capecitabine. Ann Oncol 2001;12:723–724.
760. Welch KM, Saiers J, Salonen R. Triptans and coronary spasm. Clin Pharmacol Ther 2000;68:337–338.
761. Qasim A, Townend J, Davies MK. Ecstasy induced acute myocardial infarction. Heart 2001;85:E10. 762. Tzivoni D, Banai S, Schuger C, Benhorin J, Keren A, Gottlieb S, Stern S. Treatment of torsade de pointes with magnesium sulfate. Circulation 1988;77:392–397.
763. Hondeghem LM. Antiarrhythmic agents: modulated receptor applications. Circulation 1987;75:514–520.
764. Siebels J, Kuck KH. Implantable cardioverter defibrillator compared with antiarrhythmic drug treatment in cardiac arrest survivors (the Cardiac Arrest Study Hamburg). Am Heart J 1994;127:1139–1144.
765. Hellestrand KJ, Burnett PJ, Milne JR, Bexton RS, Nathan AW, Camm AJ. Effect of the antiarrhythmic agent flecainide acetate on acute and chronic pacing thresholds. Pacing Clin Electrophysiol 1983;6:892–899. 766. Echt DS, Black JN, Barbey JT, Coxe DR, Cato E. Evaluation of antiarrhythmic drugs on defibrillation energy requirements in dogs. Sodium channel block and action potential prolongation. Circulation 1989;79:1106–1117.
767. Torp-Pedersen C, Moller M, Bloch-Thomsen PE, Kober L, Sandoe E, Egstrup K, Agner E, Carlsen J, Videbaek J, Marchant B, Camm AJ. Dofetilide in patients with congestive heart failure and left ventricular dysfunction. Danish Investigations of Arrhythmia and Mortality on Dofetilide Study Group. N Engl J Med 1999;341: 857–865.
768. Lazzara R. Antiarrhythmic drugs and torsade de pointes. Eur Heart J 1993; 14(Suppl H):88–92. 769. Khan IA, Gowda RM. Novel therapeutics for treatment of long-QT syndrome and torsade de pointes. Int J Cardiol 2004;95:1–6.
770. Barra S, Agarwal S, Begley D, Providencia R. Post-acute management of the acquired long QT syndrome. Postgrad Med J 2014;90:348–358. 771. Borron SW, Bismuth C, Muszynski J. Advances in the management of digoxin toxicity in the older patient. Drugs Aging 1997;10:18–33.
772. Solomon RJ. Ventricular arrhythmias in patients with myocardial infarction and ischaemia. Relationship to serum potassium and magnesium. Drugs 1984;28(Suppl 1): 66–76.
773. Sjogren A, Edvinsson L, Fallgren B. Magnesium deficiency in coronary artery disease and cardiac arrhythmias. J Intern Med 1989;226:213–222.
774. Rasmussen HS, McNair P, Norregard P, Backer V, Lindeneg O, Balslev S. Intravenous magnesium in acute myocardial infarction. Lancet 1986;1:234–236.
775. Abraham AS, Rosenmann D, Kramer M, Balkin J, Zion MM, Farbstien H, Eylath U. Magnesium in the prevention of lethal arrhythmias in acute myocardial infarction. Arch Intern Med 1987;147:753–755.
776. Rajs J, Rajs E, Lundman T. Unexpected death in patients suffering from eating disorders. A medico-legal study. Acta Psychiatr Scand 1986;74:587–596. 777. Iseri LT, Freed J, Bures AR. Magnesium deficiency and cardiac disorders. Am J Med 1975;58:837–846.
778. Zwerling HK. Does exogenous magnesium suppress myocardial irritability and tachyarrhythmias in the nondigitalized patient? Am Heart J 1987;113:1046–1053.
779. Rosenqvist M, Beyer T, Block M, den Dulk K, Minten J, Lindemans F. Adverse events with transvenous implantable cardioverter-defibrillators: a prospective multicenter study. European 7219 Jewel ICD investigators. Circulation 1998;98: 663–670.
780. Martinez Sanchez J, Garcia Alberol A, Almendral Garrote J, Castellanos E, Perez Castellanos N, Ortiz Paton M, Sanchez Munoz JJ, Llamas Lazaro C, Ruiperez Abizanda JA, Valdes Chavarri M. [Ventricular arrhythmias induced by appropriate antibradycardia pacing in patients with implantable defibrillators]. Rev Esp Cardiol 2001;54:845–850.
781. Callans DJ, Hook BG, Kleiman RB, Mitra RL, Flores BT, Marchlinski FE. Unique sensing errors in third-generation implantable cardioverter-defibrillators. J Am Coll Cardiol 1993;22:1135–1140.
782. Chantranuwat C, Blakey JD, Kobashigawa JA, Moriguchi JD, Laks H, Vassilakis ME, Fishbein MC. Sudden, unexpected death in cardiac transplant recipients: an autopsy study. J Heart Lung Transplant 2004;23:683–689.
783. Vakil K, Taimeh Z, Sharma A, Abidi KS, Colvin M, Luepker R, Levy WC, Adabag S. Incidence, predictors, and temporal trends of sudden cardiac death after heart transplantation. Heart Rhythm 2014;11:1684–1690. 784. Tsai VW, Cooper J, Garan H, Natale A, Ptaszek LM, Ellinor PT, Hickey K, Downey R, Zei P, Hsia H, Wang P, Hunt S, Haddad F, Al-Ahmad A. The efficacy of implantable cardioverter-defibrillators in heart transplant recipients: results from a multicenter registry. Circ Heart Fail 2009;2:197–201.
785. Menafoglio A, Di Valentino M, Porretta AP, Foglia P, Segatto JM, Siragusa P, Pezzoli R, Maggi M, Romano GA, Moschovitis G, Gallino A. Cardiovascular evaluation of middle-aged individuals engaged in high-intensity sport activities: implications for workload, yield and economic costs. Br J Sports Med 2014 Nov 13. doi:10.1136/bjsports-2014-093857 [Epub ahead of print].
786. Borjesson M, Serratosa L, Carre F, Corrado D, Drezner J, Dugmore DL, Heidbuchel HH, Mellwig KP, Panhuyzen-Goedkoop NM, Papadakis M, Rasmusen H, Sharma S, Solberg EE, van Buuren F, Pelliccia A, writing group on behalf of the EACPR Section of Sports Cardiology. Consensus document regarding cardiovascular safety at sports arenas: position stand from the European Association of Cardiovascular Prevention and Rehabilitation (EACPR), section of Sports Cardiology. Eur Heart J 2011;32:2119–2124.
787. Conroy RM, Pyorala K, Fitzgerald AP, Sans S, Menotti A, De Backer G, De Bacquer D, Ducimetiere P, Jousilahti P, Keil U, Njolstad I, Oganov RG, Thomsen T, Tunstall-Pedoe H, Tverdal A, Wedel H, Whincup P, Wilhelmsen L, Graham IM, SCORE project group. Estimation of ten-year risk of fatal cardiovascular disease in Europe: the SCORE project. Eur Heart J 2003;24:987–1003.
788. Harmon KG, Drezner JA, Wilson MG, Sharma S. Incidence of sudden cardiac death in athletes: a state-of-the-art review. Heart 2014;100:1227–1234. 789. Schmied C, Borjesson M. Sudden cardiac death in athletes. J Intern Med 2014;275: 93–103.
790. Corrado D, Basso C, Pavei A, Michieli P, Schiavon M, Thiene G. Trends in sudden cardiovascular death in young competitive athletes after implementation of a preparticipation screening program. JAMA 2006;296:1593–1601.
791. Maron BJ, Araujo CG, Thompson PD, Fletcher GF, de Luna AB, Fleg JL, Pelliccia A, Balady GJ, Furlanello F, Van Camp SP, Elosua R, Chaitman BR, Bazzarre TL. Recommendations for preparticipation screening and the assessment of cardiovascular disease in masters athletes: an advisory for healthcare professionals from the working groups of the World Heart Federation, the International Federation of Sports Medicine, and the American Heart Association Committee on Exercise, Cardiac Rehabilitation, and Prevention. Circulation 2001;103:327–334.
792. Borjesson M, Urhausen A, Kouidi E, Dugmore D, Sharma S, Halle M, Heidbuchel H, Bjornstad HH, Gielen S, Mezzani A, Corrado D, Pelliccia A, Vanhees L. Cardiovascular evaluation of middle-aged/senior individuals engaged in leisure-time sport activities: position stand from the sections of exercise physiology and sports cardiology of the European Association of Cardiovascular Prevention and Rehabilitation. Eur J Cardiovasc Prev Rehabil 2011;18:446–458.
793. Pappone C, Vicedomini G, Manguso F, Saviano M, Baldi M, Pappone A, Ciaccio C, Giannelli L, Ionescu B, Petretta A, Vitale R, Cuko A, Calovic Z, Fundaliotis A, Moscatiello M, Tavazzi L, Santinelli V. Wolff–Parkinson–White syndrome in the era of catheter ablation: insights from a registry study of 2169 patients. Circulation 2014;130:811–819.
794. Obeyesekere MN, Leong-Sit P, Massel D, Manlucu J, Modi S, Krahn AD, Skanes AC, Yee R, Gula LJ, Klein GJ. Risk of arrhythmia and sudden death in patients with asymptomatic preexcitation: a meta-analysis. Circulation 2012;125: 2308–2315.
795. Munger TM, Packer DL, Hammill SC, Feldman BJ, Bailey KR, Ballard DJ, Holmes DR Jr, Gersh BJ. A population study of the natural history of Wolff–Parkinson–White syndrome in Olmsted County, Minnesota, 1953–1989. Circulation 1993;87:866–873.
796. Cohen MI, Triedman JK, Cannon BC, Davis AM, Drago F, Janousek J, Klein GJ, Law IH, Morady FJ, Paul T, Perry JC, Sanatani S, Tanel RE. PACES/HRS expert consensus statement on the management of the asymptomatic young patient with a Wolff–Parkinson–White (WPW, ventricular preexcitation) electrocardiographic pattern: developed in partnership between the Pediatric and Congenital Electrophysiology Society (PACES) and the Heart Rhythm Society (HRS). Endorsed by the governing bodies of PACES, HRS, the American College of Cardiology Foundation (ACCF), the American Heart Association (AHA), the American Academy of Pediatrics (AAP), and the Canadian Heart Rhythm Society (CHRS). Heart Rhythm 2012;9:1006–1024.
797. Soumerai SB, McLaughlin TJ, Spiegelman D, Hertzmark E, Thibault G, Goldman L. Adverse outcomes of underuse of beta-blockers in elderly survivors of acute myocardial infarction. JAMA 1997;277:115–121.
798. Kong MH, Al-Khatib SM, Sanders GD, Hasselblad V, Peterson ED. Use of implantable cardioverter-defibrillators for primary prevention in older patients: a systematic literature review and meta-analysis. Cardiol J 2011;18:503–514.
799. Santangeli P, Di Biase L, Dello Russo A, Casella M, Bartoletti S, Santarelli P, Pelargonio G, Natale A. Meta-analysis: age and effectiveness of prophylactic implantable cardioverter-defibrillators. Ann Intern Med 2010;153:592–599.
800. Healey JS, Hallstrom AP, Kuck KH, Nair G, Schron EP, Roberts RS, Morillo CA, Connolly SJ. Role of the implantable defibrillator among elderly patients with a history of life-threatening ventricular arrhythmias. Eur Heart J 2007;28: 1746–1749.
801. Chan PS, Nallamothu BK, Spertus JA, Masoudi FA, Bartone C, Kereiakes DJ, Chow T. Impact of age and medical comorbidity on the effectiveness of implantable cardioverter-defibrillators for primary prevention. Circ Cardiovasc Qual Outcomes 2009;2:16–24.
802. Brullmann S, Dichtl W, Paoli U, Haegeli L, Schmied C, Steffel J, Brunckhorst C, Hintringer F, Seifert B, Duru F, Wolber T. Comparison of benefit and mortality of implantable cardioverter-defibrillator therapy in patients aged ≥75 years versus those ,75 years. Am J Cardiol 2012;109:712–717.
803. Noyes K, Corona E, Zwanziger J, Hall WJ, Zhao H, Wang H, Moss AJ, Dick AW. Health-related quality of life consequences of implantable cardioverter defibrillators: results from MADIT II. Med Care 2007;45:377–385. 804. Lunney JR, Lynn J, Foley DJ, Lipson S, Guralnik JM. Patterns of functional decline at the end of life. JAMA 2003;289:2387–2392.
805. Padeletti L, Arnar DO, Boncinelli L, Brachman J, Camm JA, Daubert JC, Hassam SK, Deliens L, Glikson M, Hayes D, Israel C, Lampert R, Lobban T, Raatikainen P, Siegal G, Vardas P, Reviewers, Kirchhof P, Becker R, Cosio F, Loh P, Cobbe S, Grace A, Morgan J. EHRA Expert Consensus Statement on the management of cardiovascular implantable electronic devices in patients nearing end of life or requesting withdrawal of therapy. Europace 2010;12: 1480–1489.
806. Jaarsma T, Beattie JM, Ryder M, Rutten FH, McDonagh T, Mohacsi P, Murray SA, Grodzicki T, Bergh I, Metra M, Ekman I, Angermann C, Leventhal M, Pitsis A, Anker SD, Gavazzi A, Ponikowski P, Dickstein K, Delacretaz E, Blue L, Strasser F, McMurray J. Palliative care in heart failure: a position statement from the palliative care workshop of the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail 2009;11:433–443.
807. Goldstein NE, Lampert R, Bradley E, Lynn J, Krumholz HM. Management of implantable cardioverter defibrillators in end-of-life care. Ann Intern Med 2004; 141:835–838.
808. Wright GA, Klein GJ, Gula LJ. Ethical and legal perspective of implantable cardioverter defibrillator deactivation or implantable cardioverter defibrillator generator replacement in the elderly. Curr Opin Cardiol 2013;28:43–49.
809. Lampert R, Hayes DL, Annas GJ, Farley MA, Goldstein NE, Hamilton RM, Kay GN, Kramer DB, Mueller PS, Padeletti L, Pozuelo L, Schoenfeld MH, Vardas PE, Wiegand DL, Zellner R. HRS Expert Consensus Statement on the Management of Cardiovascular Implantable Electronic Devices (CIEDs) in patients nearing end of life or requesting withdrawal of therapy. Heart Rhythm 2010;7:1008–1026.







