TS PHẠM HỮU VĂN
7. Rối loạn dẫn truyền (với dẫn truyền nhĩ thất 1:1)
Phần này tập trung vào các bất thường QRS gây ra do block bó và block nhánh bó do đẫn truyền bị chậm trễ hoặc block trong phạm vị ≥1 các nhanh của hệ thống His – Purkinje, bao gồm sự phân chia của bó His vào nhánh bó trái và phải, tiếp theo bằng sự phân chia của bó trái thành bó trước và sau. Sự phối hợp của dẫn truyền bị chậm trễ hoặc bị block của bó nhánh phải và 1 bó của nhánh trái được biểu thị block hai bó (bifascicular block) (cũng gồm LBBB). Mặc dù block nhĩ thất độ I là rối loạn dẫn truyền chính xác hơn được thảo luận đầy đủ và các khuyến cáo về trạng thái này đã được cung cấp ở phần block nhĩ thất.
7.1. Sinh lý bệnh
Trục dẫn truyền bình thường gồm nút xoang, cơ nhĩ, nút nhĩ thất, bó His, các nhánh bó, bó, sợi Purkinje, và cơ thất. Sinh lý bệnh liên quan đến bệnh dẫn truyền có thể là sự phát triển, di truyền / gene, chuyển hóa, nhiễm trùng, viêm, thâm nhiễm, chấn thương, thiếu máu cục bộ, ác tính hoặc thoái hóa. Nói chung, có thể hữu ích để mô tả môt quá trình như là sự không tiến triển hoặc tiến triển.
7.2. Bệnh căn / phân loại
Có một số các bệnh căn có thể cho các rối loạn dẫn truyền với dẫn truyền nhĩ thất 1:1 các thày thuốc nên xem xét (Bảng S3 trong phần hỗ trợ của Web).
7.3. Biểu hiện lâm sàng
Các block bó đơn độc và block nhánh bó hiếm khi kết hợp với các triệu chứng riêng biệt của chúng mặc dù biểu hiện của chúng có thể là một chỉ dấu cho bệnh tim cấu trúc cơ bản và sự rối loạn đồng bộ tim do LBBB có thể gây ra các triệu chứng đặc biệt là trong việc trạng thái chức năng thất trái giảm. Sự hiện diện hoặc vắng mặt của các triệu chứng có khả năng liên quan đến nhịp tim chậm không liên tục thường sẽ hướng dẫn đánh giá bệnh nhân với block bó hoặc block nhánh bó.
7.4. Đánh giá các rối loạn dẫn truyền
|
Các khuyến cáo cho đánh giá các rối loạn dẫn truyền (Với dẫn truyền nhĩ thất 1:1 và khoảng PR bình thường) Các nghiên cứu tham khảo hỗ trợ các khuyến cáo được tóm tắt trong dữ liệu hỗ trợ trực tuyến 41 và 42. |
||
|
COR |
LOE |
Các khuyến cáo |
|
I |
B-NR |
1. Ở các bệnh nhân bị LBBB mới được phát hiện, nên siêu âm tim qua thành ngực để loại trừ bệnh tim cấu trúc (S7.4-1, S7 S7-3-3). |
|
I |
C-LD |
2. Ở các bệnh nhân có triệu chứng bị bệnh hệ thống dẫn truyền, trong đó nghi ngờ block nhĩ thất, theo dõi điện tâm đồ lưu động là hữu ích (S7.4-4, S7.4-11). |
|
IIa |
B-NR |
3. Ở các bệnh nhân được lựa chọn có rối loạn dẫn truyền trong thất ngoài LBBB, siêu âm tim siêu âm là hợp lý nếu nghi ngờ bệnh tim cấu trúc (S7.4-3, S7.4-12, S7.4-13). |
|
IIa |
B-NR |
4. Ở các bệnh nhân có triệu chứng gợi ý nhịp tim chậm từng lúc (ví dụ, chóng váng, ngất), với bệnh hệ thống dẫn truyền được xác định bằng ECG và không được chứng minh có block nhĩ thất, EPS là hợp lý (S7.4-14). |
|
IIa |
C-LD |
5. Ở các bệnh nhân được lựa chọn có LBBB trong đó nghi ngờ bệnh tim cấu trúc và siêu âm tim là không thuyết phục, hình ảnh bổ xung (ví dụ, MRI tim, chụp cắt lớp điện toán hoặc nghiên cứu hạt nhân) là hợp lý (S7.4-15). |
|
IIb |
C-LD |
6. Ở các bệnh nhân không có triệu chứng được lựa chọn với bệnh hệ thống dẫn truyền lan rộng (block hai bó hoặc ba bó), ghi điện tâm đồ lưu động có thể được xem xét để ghi nhận mức độ nghi ngờ của block nhĩ thất mức độ cao hơn (S7.4-4, S7.4-6). |
|
IIb |
C-LD |
7. Ở các bệnh nhân không có triệu chứng với LBBB được lựa chọn trong đó nghi ngờ mắc bệnh thiếu máu cơ tim cục bộ test gắng sức bằng hình ảnh có thể được xem xét (S7.4-2). |
Tóm tắt
Theo dõi điện tâm đồ lưu động có thể giúp thiết lập mối tương quan giữa triệu chứng – nhịp hoặc tư liệu về block nhĩ thất bệnh lý chưa được biết trước đó. Các nghiên cứu đoàn hệ nói chung đã chứng minh mối liên quan giữa LBBB, nhưng không phải RBBB, sự hiện diện và sự phát triển của bệnh mạch vành và suy tim (S7.4-1 – S7.4-3, S7.4-16). Chậm dẫn truyền trong thất không đặc hiệu là một dấu hiệu cho tiên lượng xấu hơn trong 1 nghiên cứu nhưng trong một nghiên cứu khác không được cho thấy là một yếu tố dự đoán độc lập về tỷ lệ tử vong khi không có bệnh động mạch vành (S7.4-17, S7.4-18). Do đó, ngưỡng cho hình ảnh hoặc nghiên cứu chức năng tiếp theo thấp hơn ở những bệnh nhân bị LBBB và siêu âm tim, MRI tim và test gắng sức có thể có khả năng hữu ích. Một EPS có độ đặc hiệu và độ nhạy thấp nói chung nhưng có thể hữu ích ở những bệnh nhân được chọn với những bất thường dẫn truyền đã được chứng minh trong đó xét nghiệm khác không được biểu hiện. Một thuật toán đề xuất để đánh giá bệnh nhân bị rối loạn dẫn truyền được thể hiện trong Hình 8.
Văn bản hỗ trợ khuyến cáo riêng biệt
1. Ở các bệnh nhân nghi ngờ mắc bệnh tim cấu trúc, siêu âm tim có thể phát hiện ra bệnh có thể điều trị hoặc ảnh hưởng đến tác động điều trị như đặt dụng cụ tái đồng bộ tim. Sự có mặt của LBBB trên ECG làm tăng đáng kể khả năng rối loạn chức năng tâm thu thất trái sẽ được chẩn đoán bằng siêu âm tim (S7.4-3).
2. Điện tâm đồ là phương pháp chính để chẩn đoán các rối loạn dẫn truyền tiềm tàng. Thời lượng ghi có thể thay đổi từ ECG 10 giây thông qua các bản ghi lưu động liên tục trong các khoảng thời gian khác nhau (24-, 48-, 72 giờ) để theo dõi sự kiện hoặc cấy máy ghi vòng lặp, nhằm mục đích phát hiện ra mối tương quan giữa các triệu chứng đối với bệnh nhân mệt mỏi, chóng mặt hoặc ngất nghi ngờ có block nhĩ thất hoặc SND thêm vào bệnh hệ thống dẫn truyền có biểu hiện của chúng (S7.4-19). Các thiết bị như vậy cũng thường có khả năng phát hiện và lưu trữ tự động các sự kiện nhịp chậm hoặc nhịp tim nhanh, mặc dù các phát hiện này bị ảnh hưởng bởi chất lượng ghi (các tác động bên ngoài). Ngoài các thiết bị y tế đã được quy định, các thiết bị hướng đến người tiêu dùng ngày càng có sẵn, đặc biệt là liên kết với thiết bị điện tử cá nhân.
3. Bệnh nhân mắc RBBB hoặc chậm dẫn truyền trong thất trên ECG cũng tăng nguy cơ rối loạn chức năng tâm thu thất trái so với những bệnh nhân có ECG hoàn toàn bình thường, nhưng ảnh hưởng thấp hơn so với những bệnh nhân LBBB (S7.4-12). Siêu âm tim có thể xác định các bất thường về cấu trúc tim khác nhau làm rối loạn dẫn truyền, gồm bệnh cơ tim, bệnh van tim, dị tật bẩm sinh, khối u, nhiễm trùng, quá trình thâm nhiễm, các trạng thái qua trung gian miễn dịch và bệnh mạch máu lớn (S7.4-13).
4. EPS có thể cung cấp thông tin chẩn đoán cấp thời, tránh các nguy cơ tiềm ẩn của chẩn đoán trễ với các chiến lược theo dõi bệnh nhân ngoại trú, nhưng có độ nhạy thay đổi tùy theo cách biểu hiện và ảnh hưởng đến nguy cơ thủ thuật nhỏ. Ở những bệnh nhân có block nhánh bó hoặc bó, khoảng thời gian HV kéo dài trong EPS dự đoán nguy cơ cao hơn đối với block tim hoàn toàn (S7.4-14). Trong một nghiên cứu khác, block nhĩ thất độ I hoặc block nhánh bó là những dấu hiệu cho phát hiện EPS bất thường ở bệnh nhân bị ngất (S7.4-20).
5. MRI tim có thể được xem xét ở những bệnh nhân được lựa chọn có LBBB và chức năng tâm thất trái bình thường bằng siêu âm tim trong đó sarcoidosis, bệnh mô liên kết, viêm cơ tim hoặc bệnh cơ tim giãn khác được nghi ngờ trên cơ sở lâm sàng. Trong 1 nghiên cứu, MRI tim đã phát hiện bệnh cơ tim dưới lâm sàng ở một phần ba số bệnh nhân LBBB không triệu chứng và siêu âm tim bình thường (S7.4-15). Trong một nghiên cứu khác về bệnh nhân mắc bệnh mô liên kết, LBBB khởi phát mới và siêu âm tim bình thường, MRI tim đã xác định những bất thường đáng kể ở 42% bệnh nhân (S7.4-21).
6. Theo dõi điện tâm đồ lưu động có thể được sử dụng để ghi nhận rối loạn nhịp tim có ý nghĩa lâm sàng ở bệnh nhân không có triệu chứng. Hầu hết các hệ thống theo dõi hiện tại sẽ tự động lưu trữ các nhịp bất thường trên lâm sàng bên cạnh các bản ghi kích hoạt cho bệnh nhân. Những bệnh nhân được lựa chọn mắc bệnh hệ thống dẫn truyền có thể được hưởng lợi từ việc sàng lọc như vậy, ngay cả khi không có các triệu chứng quan trọng như ngất (S7.4-4, S7.4-6). Tuy nhiên, sự tiến triển của LBBB và block hai bó đến block nhĩ thất và nhịp chậm là thấp, khoảng 1% mỗi năm, với khoảng một nửa số bệnh nhân xuất hiện ngất và nửa còn lại có một triệu chứng gồm mệt mỏi, đau ngực hoặc khó thở (S7 .4-14). Hầu hết các nghiên cứu đã báo cáo LBBB có liên quan đến tỷ lệ tử vong cao hơn các dạng rối loạn dẫn truyền khác (S7.4-2, S7.4-22).
7. Ngưỡng để xem xét test gắng sức thấp hơn ở những bệnh nhân LBBB và lo ngại về thiếu máu cục bộ, do xác suất mắc bệnh tim liên quan cao hơn (S7.4-23 S7 S7.4-27). Nếu có LBBB, các thay đổi điện tim thiếu máu cục bộ sẽ khó giải thích hơn và cấu thành hình ảnh là cần thiết (S7.4-2). Tỷ lệ LBBB liên quan cũng đã được báo cáo là nguyên nhân có thể gây đau ngực không do thiếu máu (S7.4-28). Gắng sức gây ra LBBB, nhưng RBBB được tạo ra không do gắng sức, có liên quan đến tăng nguy cơ tử vong và các biến cố tim (S7.4-29, S7.4-30).
7.5. Điều chỉnh các rối loạn dẫn truyền (với dẫn truyền nhĩ thất 1:1)
|
Các khuyến cáo điều chỉnh các rối loạn dẫn truyền (với dẫn truyền nhĩ thất 1:1 và các khoảng PR bình thường) Các nghiên cứu tham khảo hỗ trợ các khuyến cáo được tóm tắt trong tư liệu hỗ trợ trực tuyến 41, 42, và 43. |
||
|
COR |
LOE |
Các khuyến cáo |
|
I |
C-LD |
1. Ở các bệnh nhân bị ngất và block nhánh bó được phát hiện có khoảng cách HV 70 ms trở lên hoặc bằng chứng về block dưới nút khi EPS, tạo nhịp vĩnh viễn được khuyến cáo (S7.5-1, S7.5-2) |
|
I |
C-LD |
2. Ở những bệnh nhân có block nhánh bó xen kẽ, tạo nhịp vĩnh viễn được khuyến cáo (S7.5-3). |
|
IIa |
C-LD |
3. Ở các bệnh nhân mắc hội chứng Kearns-Sayre và rối loạn dẫn truyền, tạo nhịp vĩnh viễn là hợp lý, với khả năng khử rung tim bổ sung nếu dự kiến sống sót phù hợp và có ý nghĩa hơn 1 năm (S7.5-4, S7.5-5). |
|
IIb |
C-LD |
4. Ở các bệnh nhân mắc bệnh Anderson-Fabry và kéo dài QRS lớn hơn 110 ms, tạo nhịp vĩnh viễn, với khả năng khử rung tim bổ sung nếu cần và có thể sống sót hơn 1 năm được dự kiến, có thể được xem xét (S7.5-6, S7.5 -7). |
|
IIb |
C-LD |
5. Ở các bệnh nhân bị suy tim, LVEF giảm nhẹ đến vừa phải (36% -50%) và LBBB (QRS ≥150 ms), CRT có thể được xem xét (S7.5-8, S7.5-9). |
|
III: Harm |
B-NR |
6. Ở những bệnh nhân không có triệu chứng với bệnh dẫn truyền đơn độc và dẫn truyền nhĩ thất 1: 1, tạo nhịp tim vĩnh viễn không được chỉ định (trong trường hợp không có chỉ định khác về nhịp) (S7.5-10, S7.5-15). |
Tóm tắt
Xử trí các rối loạn dẫn truyền với dẫn truyền nhĩ thất 1: 1 với khoảng PR bình thường đòi hỏi một cách tiếp cận tập trung vào bệnh nhân với đánh giá của bất kỳ bệnh tim tiềm ẩn nào, triệu chứng và ECG cơ bản (block nhánh bó, chậm trễ trong thất không đặc hiệu) (Hình 9). Điều trị tạo nhịp có thể được xem xét khi có hoặc không có triệu chứng nếu có rối loạn tiềm ẩn liên quan đến bệnh tiến triển như loạn dưỡng cơ Emery-Dreifuss hoặc hội chứng Kearns-Sayre. Block nhánh bó xen kẽ thực sự (phức bộ QRS với hình thái LBBB và RBBB xen kẽ) là bằng chứng cho bệnh dưới nút có ý nghĩa và khả năng cao cho phát triển khởi phát đột ngột block tim hoàn toàn với tần số thoát thất chậm hoặc không có.
Văn bản hỗ trợ khuyến cáo riêng biệt
1. Ở bệnh nhân ngất, sự hiện diện của block nhánh bó trên ECG là một yếu tố dự báo cho các đặc tính dẫn truyền bất thường được xác định tại EPS (S7.5-16). Tuy nhiên, đối với những bệnh nhân bị block nhánh bó, nguyên nhân cơ bản của ngất có thể liên quan đến cơ chế gây giãn mạch hơn là nhịp tim chậm qua trung gian block tim. EPS có thể được sử dụng để đánh giá dẫn truyền nhĩ thất và xác định sự hiện diện và mức độ của bệnh dưới nút. Tạo nhịp vĩnh viễn đã được khuyến cáo cho những bệnh nhân bị ngất và khoảng HV ≥70 ms hoặc block dưới nút thật sự (S7.5-17).
2. Block nhánh bó xen kẽ (phức hợp QRS với hình thái LBBB và RBBB xen kẽ) ám chỉ bệnh dẫn truyền không ổn định ở cả hai bó dẫn truyền, bệnh nhân có mẫu điện tim này cần nhận được máy tạo nhịp tim vì nguy cơ cao phát triển block nhĩ thất hoàn toàn (S7.5-3 ).
3. Trong hội chứng Kearns-Sayre, rối loạn di truyền ty thể với liệt mắt ngoài tiến triển và bệnh cơ, có một tỷ lệ cao của block nhĩ thất và đột tử do tim (S7.5-4, S7.5-5). Trong một loạt 35 bệnh nhân mắc hội chứng Kearns Sayre, 66% bị chậm dẫn truyền và 4 bệnh nhân bị đột tử do tim (S7.5-4).
4. Bệnh Anderson Fabry là một rối loạn lưu trữ lysosomal liên kết X. Trong 1 nghiên cứu đoàn hệ với 189 bệnh nhân, 6,3% bệnh nhân có nhịp tim chậm vĩnh viễn do block nhĩ thất hoặc SND và thêm 2,6% bệnh nhân được cấy ICD (S7.5-6, S7.5-7). Thời gian QRS > 110 ms là một yếu tố dự đoán độc lập để yêu cầu điều trị tạo nhịp (HR: 1.05; 95% CI: 1.02 sừng1.09; p = 0,001; c = 0,726). Sẹo cơ tim và đột tử đã được báo cáo ở những bệnh nhân mắc bệnh Anderson Fabry (S7.5-18, S7.5-19).
5. Trong 1 nghiên cứu hồi cứu trên 1.436 bệnh nhân và LVEF từ 36% đến 50% và LBBB phù hợp với một nhóm bệnh nhân không mắc bệnh dẫn truyền, LBBB có liên quan đến tỷ lệ tử vong nặng hơn đáng kể (HR: 1.17; 95% CI: 1.00 1,36) và giảm LVEF xuống ≤ 35% (HR: 1,34; 95% CI:1.09-1.63) (S7.5-8). PROSPECT (Predictors of Response to CRT Tria) ghi nhận bệnh nhân có LVEF 35%, khoảng QRS > 130 ms và suy tim class III / IV. Trong một phân tích hậu kiểm , bệnh nhân có LVEF> 35% (khi được đánh giá bằng labo cơ bản) có đáp ứng lâm sàng và siêu âm tim tương tự với CRT so với bệnh nhân có LVEF ≤ 35% (S7.5-9). Trong thử nghiệm REVERSE (Resynchronization Reverses Remodeling in Systolic Left Ventricular Dysfunction), bệnh nhân có thể được ghi danh nếu họ có các triệu chứng suy tim I / II theo Hiệp hội Tim mạch New York và LVEF < 40% (mặc dù LVEF trung bình đã là 27%). Bệnh nhân có QRS giãn rộng và hình thái LBBB là các dấu hiệu cho lợi ích lâm sàng với CRT (S7.5-20).
6. Một số nghiên cứu từ những năm 1970 đã chứng minh không có lợi ích gì từ việc điều trị dự phòng ở những bệnh nhân không có triệu chứng bị rối loạn dẫn truyền (kết hợp RBBB và block bó trước trái, hoặc block nhánh bó) ngay cả khi có bệnh dưới nút (S7.5-10, S7.5- 11). Mặc dù cấy PPM là một thủ thuật tim có nguy cơ tương đối thấp, các biến chứng gồm tử vong nằm trong khoảng từ 3% đến 7% và có các biến chứng lâu dài có ý nghĩa đối với các hệ thống tạo nhịp sử dụng điện cực quan đường tĩnh mạch (S7.5-12 12 S7.5-15) .
Hình 9. Điều chỉnh Thuật toán Các rối loạn dẫn truyền
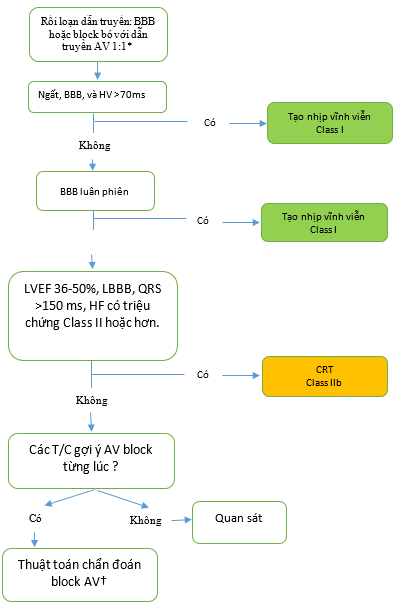
Màu sắc tương ứng với class khuyến cáo trong Bảng 2.
* Đối với block nhĩ thất độ I nặng hoặc block nhĩ thất độ I với bệnh thần kinh cơ đi kèm, cũng tham khảo Mục 6.4., Hình 7, thuật toán block nhĩ thất.
† Xem Mục 4.3.2., Hình 3.
AV: nhĩ thất; BBB: block nhánh bó; HF, suy tim; LBBB: block nhánh bó trái; và LVEF: phân suất tống máu thất trái. T/C: triệu chứng.
8. Các quần thể đặc biệt
8.1. Điều chỉnh quanh phẫu thuật
Điều chỉnh nhịp tim chậm sau phẫu thuật tim chủ yếu dựa trên thực hành bệnh sử phẫu thuật. Thông thường, tất cả các bệnh nhân nhận được dây tạo nhịp tim thượng tâm mạc tạm thời tại thời điểm phẫu thuật tim. Đây là những dây có kích cỡ chỉ được đặt trên tâm nhĩ và / hoặc tâm thất với đầu tận cùng được đưa ra ngoài qua da. Các dây tạm thời được sử dụng nếu cần thiết để hỗ tần số hoặc để duy trì đồng bộ nhĩ thất và sau đó được lấy bỏ bằng cách kéo chúng ra khỏi lối ra của chúng ở da. Chảy máu do loại bỏ các dây tạm thời đôi khi có thể là nguyên nhân gây ra ép tim do tràn dịch màng ngoài tim (tamponade), gây ra phẫu thuật trễ và thậm chí tử vong (S8.1-1). Nhu cầu tạo nhịp tạm thời sau phẫu thuật tim rất khác nhau (từ 0,8% đến 24%) và chủ yếu phụ thuộc vào loại phẫu thuật tim, cũng như một số yếu tố nguy cơ như: tuổi già, AF, phẫu thuật trước đó, suy thận quanh phẫu thuật và viêm nội tâm mạc hoạt động (S8.1-2, S8.1-4).
8.1.1. Các bệnh nhân có nguy cơ nhịp tim chậm trong quá trình phẫn thuật hoặc thủ thuật không phải tim
|
Khuyến cáo cho bệnh nhân có nguy cơ bị nhịp tim chậm trong quá trình phẫu thuật hoặc thủ thuật không do tim Các nghiên cứu được tham khảo hỗ trợ các khuyến cáo được tóm tắt trong tư liệu hỗ trợ trực tuyến 42, 44 và 45. |
||
|
COR |
LOE |
Các khuyến cáo |
|
IIa |
B-NR
|
1. Ở những bệnh nhân được cho là có nguy cơ cao phát triển nhịp tim chậm trong hoặc quanh phẫu thuật do đặc điểm của bệnh nhân hoặc loại thủ thuật, việc đặt miếng tạo nhịp qua da là hợp lý (S8.1.1-1. S8.1.1-3). |
|
III: Harm |
B-NR |
2. Ở những bệnh nhân LBBB cần đặt catheter động mạch phổi để theo dõi trong phẫu thuật, tạo nhịp qua đường tĩnh mạch tạm thời dự phòng thường quy không nên được thực hiện (S8.1.1-4, S8.1.1-5). |
Tóm tắt
Sự phát triển của nhịp tim chậm có ý nghĩa trong phẫu thuật có thể do các yếu tố liên quan đến bệnh nhân và liên quan đến thủ thuật. Một số nghiên cứu hồi cứu đã xác định tuổi (> 60-65 tuổi), bệnh đi kèm (Class III hoặc IV của Hội Gây mê Hoa ký), tần số tim chậm (<60 bpm) hoặc huyết áp (<110/60 mm Hg) ở mức cơ sở, và sử dụng các thuốc đồng thời như thuốc chẹn beta hoặc thuốc chẹn hệ thống renin angiotensin là yếu tố nguy cơ cho sự phát triển của nhịp tim chậm trong phẫu thuật và hạ huyết áp ở bệnh nhân trải qua phẫu thuật không do tim (S8.1.1-6, S8.1.1-8). Do block nhánh bó phải nằm gần bề mặt nội tâm của RV, RBBB thoáng qua có thể xảy ra trong quá trình đặt catheter động mạch phổi để sử dụng trong quá trình theo dõi phẫu thuật (S8.1.1-1, S8.1.1-4, S8.1.1-5).
Một số báo cáo trường hợp và loạt nhỏ đã xác định một số thủ thuật không phải tim có nhiều khả năng liên quan đến nhịp tim chậm. Cụ thể, các thủ thuật có khả năng kích hoạt phản xạ tim thần kinh sinh ba hoặc dây thần kinh phế vị, ví dụ, phẫu thuật hàm mặt (maxillofacial) hoặc phẫu thuật nội soi động mạch cảnh hoặc đặt stent, hoặc các thủ thuật phẫu thuật thần kinh khác liên quan đến thao tác điều trị cột sống hoặc màng cứng (dura mater) đã được thông báo gây ra nhịp tim chậm (S8.1.1-9 S8.1.1-12). Những người khác đã xác định bơm màng bụng là giai đoạn quan trọng có thể xảy ra trong phẫu thuật bụng liên quan đến nhịp tim chậm đáng kể (S8.1.1-13, S8.1.1-14).
Các văn bản hỗ trợ khuyến cáo riêng biệt
1. Bệnh nhân lớn tuổi bị nhiều bệnh kết hợp (Class III và IV của Hiệp hội Gây mê hồi sức) và nhịp tim thấp ở mức cơ bản có nguy cơ cao phát triển nhịp tim chậm trong phẫu thuật (S8.1.1-6, S8.1.1-8). Trong môi trường phẫu thuật không do tim, nhịp tim chậm trong phẫu thuật thường được quy cho SND và hiếm khi được quy cho do làm xấu đi dẫn truyền nhĩ thất (S8.1.1-1, S8.1.1-8, S8.1.1-15). Một số thủ thuật phẫu thuật như phẫu thuật nội soi động mạch cảnh hoặc đặt stent có liên quan đến các giai đoạn nhịp tim chậm (S8.1.1-3, S8.1.1-9, S8.1.1-12). Ngoài ra, các giai đoạn quan trọng trong phẫu thuật như bơm hơi bụng trong phẫu thuật nội soi hoặc thao tác các vùng được do dây thần kinh sinh ba chi phối đã được báo cáo có liên quan đến nhịp tim chậm (S8.1.1-13, S8.1.1-14). Trong một nghiên cứu trên 30 bệnh nhân trải qua phẫu thuật tạo hình động mạch cảnh và đặt stent đã trải qua tạo nhịp qua da dự phòng do có nguy cơ cao đến nhịp tim chậm liên quan đến tạo hình mạch, tạo nhịp qua da tạm thời được sử dụng ở 23 bệnh nhân và có hiệu quả trong việc loại bỏ nhịp tim chậm). Tuy nhiên, việc đặt miếng tạo nhịp qua da thường quy ở bệnh nhân chỉ vì sự hiện diện của rối loạn dẫn truyền không cung cấp thêm lợi ích (S8.1.1-15).
2. Mặc dù block tim hoàn toàn có thể xảy ra trong trạng thái đặt catheter động mạch phổi ở bệnh nhân có LBBB sẵn có, tỷ lệ thấp (S8.1.1-4, S8.1.1-5). Một số nghiên cứu đã báo cáo tăng nguy cơ rối loạn nhịp thất với tạo nhịp tạm thời (S8.1.1-16, S8.1.1-17). Tạo nhịp tim dự phòng không được khuyến cáo, nhưng bác sĩ lâm sàng nên xem xét khả năng block tim hoàn toàn nếu catheter động mạch phổi được đòi hỏi cho việc theo dõi trong phẫu thuật và được chuẩn bị để điều chỉnh biến chứng này để khởi đầu nhanh chóng tạo nhịp quan đường tĩnh mạch hoặc tạo nhịp qua da ngay lập tức nếu tần số hỗ trợ duy trì được đòi hỏi.
8.1.2. Nhịp tim chậm sau phẫu thuật và rối loạn dẫn truyền sau ngoại khoa tim
Nguy cơ nhịp tim chậm sau phẫu thuật tim phần lớn liên quan đến loại phẫu thuật tim và mối quan hệ giải phẫu với hệ thống dẫn truyền. Do điều này, phần này đã được chia nhỏ bằng các phẫu thuật tim và các trạng thái cụ thể: bắc cầu động mạch vành, phẫu thuật van hở, gồm van động mạch chủ, van ba lá và van hai lá, đặt van động mạch chủ qua catheter; phẫu thuật tim bẩm sinh; ghép tim, phẫu thuật lấy bỏ cơ tim, triệt phá vách bằng alchohol và cắt bỏ vách ngăn rượu và di chứng (sequelae) sau phẫu thuật điều trị AF. Phục hồi dẫn truyền nhĩ thất sau phẫu thuật xảy ra ở khoảng 12% đến 13% bệnh nhân trong vòng 6 tháng và phụ thuộc vào phẫu thuật, bất thường dẫn truyền trước phẫu thuật, sự hiện diện của viêm nội tâm mạc và dẫn truyền nhĩ thất sau phẫu thuật tạm thời có được quan sát hay không (S8.1.2-1, S8. 1.2-2) (Bổ sung tư liệu trực tuyến 46).
8.1.2.1. Bắc cầu động mạch vành
|
Các khuyến cáo cho tạo nhịp sau phẫu thuật bắc cầu động mạch vành đơn độc Các nghiên cứu ủng hộ các khuyến cáo được tóm tắt trong tư liệu hỗ trợ trực tuyến 47. |
||
|
COR |
LOE |
Các khuyến cáo |
|
I |
B-NR |
1. Ở các bệnh nhân có SND mới sau phẫu thuật hoặc block nhĩ thất liên quan đến các triệu chứng dai dẳng hoặc mất ổn định huyết động không giải quyết sau phẫu thuật bắc cầu động mạch vành đơn độc, tạo nhịp vĩnh viễn được khuyến cáo trước khi xuất viện (S8.1.2.1-1. -9). |
|
IIa |
B-NR |
2. Ở các bệnh nhân trải qua phẫu thuật bắc cầu động mạch vành đơn độc, việc đặt dây tạo nhịp tim tạm thời là hợp lý (S8.1.2.1-5, S8.1.2.1-10, S8.1.2.1-11) |
|
IIb |
C-EO |
3. Ở những bệnh nhân trải qua phẫu thuật bắc cầu động mạch vành, những người có thể sẽ yêu cầu CRT hoặc tạo nhịp trong tương lai, đặt dây thượng tâm mạc trong khi phẫu thuật có thể được xem xét. |
Tóm tắt
Tỷ lệ khiếm khuyết dẫn truyền sau bắc cầu động mạch vành tự thân đơn độc dao động từ 2% đến 58% và có liên quan đến các yếu tố như bệnh thoái hóa mãn tính của tim, tổn thương phẫu thuật trực tiếp đối với hệ thống dẫn truyền, thiếu máu cơ tim cục bộ hoặc bảo vệ cơ tim không phù hợp. Những tiến bộ trong thực hành phẫu thuật có thể làm giảm tỷ lệ khiếm khuyết dẫn truyền nhưng không thể loại bỏ trong bất kỳ loạt nào (S8.1.2.1-1, S8.1.2.1-4, S8.1.2.1-6, S8.1.2. .1-9, S8.1.2.1-12).
Văn bản hỗ trợ khuyến cáo riêng biệt
1. Tần suất bệnh nhân phát triển các bất thường dẫn truyền cần tạo nhịp vĩnh viễn sau phẫu thuật bắc cầu động mạch vành đơn độc đã thay đổi và có thể giảm dần theo thời gian (S8.1.2.1-1, S8.1.2.1-7, S8.1.2.1- 9, S8.1.2.1-12). Nếu bất thường dẫn truyền gây ra nhịp chậm có triệu chứng đã có trước phẫu thuật, chúng thường sẽ không giải quyết bằng bắc cầu động mạch vành (S8.1.2.1-8). Một phần để giúp tạo điều kiện phục hồi sau phẫu thuật (ví dụ, chuyển ra khỏi môi trường chăm sóc đặc biệt, vận động và bắt đầu chống đông máu khi cần thiết), những bệnh nhân mới khởi phát SND hoặc block nhĩ thất lần đầu tiên tiến triển và không cải thiện nên trải qua đặt tạo nhịp vĩnh viễn sau phẫu thuật bắc cầu động mạch vành đơn độc. Thời gian cụ thể của máy tạo nhịp tim chưa được nghiên cứu chính thức và sẽ luôn phụ thuộc vào tình trạng lâm sàng của từng cá nhân nhưng 5 đến 7 ngày sau phẫu thuật là hợp lý (S8.1.2.1-1).
2. Việc đặt thường xuyên các dây tạo nhịp tạm thời tại thời điểm bắc cầu động mạch vành đơn độc đã được thực hành phẫu thuật tiêu chuẩn. Có nguy cơ chảy máu đáng kể dẫn đến tỷ lệ mắc bệnh và thậm chí tử vong sau khi loại bỏ, nhưng nguy cơ này được bù đắp bằng nhu cầu thường xuyên và không thể đoán trước được khi sử dụng tạo nhịp độ tạm thời (S8.1.2.1-5, S8.1.2.1 -10, S8.1.2.1-11). Một số bệnh nhân có nguy cơ rất thấp cần phải tạo nhịp tạm thời sau khi bắc cầu động mạch vành đơn độc. Trong 1 phân tích hồi cứu, bệnh nhân không bị đái tháo đường, rối loạn nhịp trước phẫu thuật hoặc yêu cầu tạo nhịp trong khi thoát khỏi bắc cầu tim phổi chỉ 2,6% cần tạo nhịp tạm thời sau phẫu thuật so với 8,6% bệnh nhân trong toàn bộ đoàn hệ (S8.1.1.1- 10). Bệnh nhân trải qua phẫu thuật bắc cầu động mạch vành ngoài bơm cũng có thể đảm bảo xem xét đặc biệt cho một chiến lược không sử dụng dây tạo nhịp tạm thời (S8.1.2.1-13). Tuy nhiên, không có nghiên cứu lớn nào xác định rõ ràng lợi ích của phương pháp này. Tái đồng bộ tim tạm thời bằng cách sử dụng dây nhĩ phải, tâm thất phải và tạo nhịp tim thất trái đã được đề xuất để cải thiện các thông số huyết động học tim trong giai đoạn hậu phẫu ngay lập tức ở những bệnh nhân bị rối loạn chức năng thất trái nặng với kết quả hỗn hợp mặc dù có thể mang lại lợi ích cho bệnh nhân đi kèm với LBBB (S8. 1.2.1-14 S S.1.1.1.1-16).
3. Đặt dây thất trái khi phẫu thuật được thực hiện như thủ thuật chuẩn đơn thuần khi đặt qua xoang vành là không thành công (S8.1.2.1-17). Nếu một bệnh nhân có chỉ định tái đồng bộ tim trước khi phẫu thuật tim, đặt dây bên thất trái thượng tâm mạc không phải mỏm tim trong thời gian phẫu thuật tim có thể mang lại lợi ích trong tương lai không có nguy cơ có hại có ý nghĩa. Mặc dù theo truyền thống được coi là chống chỉ định, có thể thực hiện MRI một cách an toàn ở những bệnh nhân được lựa chọn với các đầu dẫn để sẵn (chưa được nối với máy tạo nhịp, hay còn gọi là bị bỏ rơi) (abandoned) (S8.1.2.1-18, S8.1.2.1-20). Tại thời điểm tiến hành CRT trong tương lai, người thực hiện có thể cấy dây xoang vành hoặc sử dụng dây thượng tâm mạc nếu cần thiết.
8.1.2.2. Ngoại khoa cho rung nhĩ
|
Các khuyến cáo cho tạo nhịp sau phẫu thuật rung nhĩ Các nghiên cứu tham khảo ủng hộ các khuyến cáo được tóm tắt trong tư liệu hỗ trợ trực tuyến 48. |
||
|
COR |
LOE |
Các khuyến cáo |
|
I |
B-NR |
1. Ở các bệnh nhân được phẫu thuật cho rung nhĩ, nên đặt thường xuyên các dây tạo nhịp tạm thời thượng tâm mạc (S8.1.2.2-1, S8.1.2.2-4). |
|
I |
B-NR |
2. Ở các bệnh nhân có SND mới sau phẫu thuật hoặc block nhĩ thất liên quan đến các triệu chứng hoặc mất ổn định huyết động không giải quyết được sau phẫu thuật cho rung nhĩ, nên tạo nhịp vĩnh viễn trước khi xuất viện (S8.1.2.2-1, S8.1.2.2-4) . |
|
IIb |
C-EO |
3. Ở các bệnh nhân được phẫu thuật AF, những người có thể sẽ yêu cầu CRT hoặc tạo nhịp thất trong tương lai, có thể cân nhắc đặt dây thất trái thượng tâm mạc vĩnh viễn. |
Tóm tắt
AF hiện diện ở 30% đến 50% bệnh nhân trải qua phẫu thuật van tim và có liên quan đến giảm tỷ lệ sống sót và tăng nguy cơ đột quỵ (S8.1.2.2-2). Phẫu thuật điều trị AF thành công có liên quan đến khả năng sống sót của bệnh nhân được cải thiện so với những bệnh nhân bị AF tái phát (S8.1.2.2-5). Có tới 65% bệnh nhân trải qua phẫu thuật van hai lá có AF do phẫu thuật hướng tới việc điều chỉnh AF (S8.1.2.2-6). Một nghiên cứu trung tâm duy nhất gần đây cho thấy 11% bệnh nhân trải qua thủ thuật Cox Maze IV ngoài phẫu thuật van hai lá cần cấy PPM sau phẫu thuật (S8.1.2.2-4). Dữ liệu về việc phẫu thuật cho AF có liên quan đến tăng nguy cơ nhịp tim chậm sau phẫu thuật và cấy PPM hay không, một phần do sự tiến triển đáng kể trong tập hợp tổn thương và kỹ thuật phẫu thuật (S8.1.2.2-1-1 S8.1.2.2. -4). Một phân tích đăng ký STS và RCT cho thấy việc triệt phá bổ xung cho AF có liên quan đến khả năng cấy PPM tăng lên (S8.1.2.2-1, S8.1.2.2-2). Tuy nhiên, phân tích tổng hợp 16 RCT cho thấy không có sự khác biệt về nhu cầu sử dụng máy tạo nhịp vĩnh viễn ở bệnh nhân được chọn ngẫu nhiên để phẫu thuật bổ sung cho AF (OR: 0.88; 95% CI: 0.51 Lỗi1.51; p = 0.64) (S8.1.2.2-3 ).
Văn bản hỗ trợ khuyến cáo riêng biệt
1. Đặt dây tạo nhịp tạm thời tại thời điểm phẫu thuật cho AF là thực hành thường quy. Nguy cơ nhịp tim chậm sau phẫu thuật là tương đối thường xuyên, không có nghiên cứu nào ủng hộ cách tiếp cận có chọn lọc đối với việc đặt dây nhịp tạm thời (S8.1.2.2-1, S8.1.2.2-4).
2. Sự cần thiết cho cấy PPM là phổ biến sau phẫu thuật cho AF thường là SND vì block nhĩ thất không phổ biến (S8.1.2.2-1-1 S8.1.2.2-4). Một phần để tạo điều kiện phục hồi sau phẫu thuật (ví dụ, chuyển ra khỏi môi trường chăm sóc đặc biệt, vận động và bắt đầu chống đông máu), những bệnh nhân khởi phát SND mới (và trong trường hợp hiếm gặp là block nhĩ thất) phát triển và không cải thiện nên trải qua cấy máy tạo nhịp vĩnh viễn trước khi xuất viện. Thời gian cụ thể của cấy máy tạo nhịp tim chưa được nghiên cứu chính thức và sẽ luôn phụ thuộc vào tình trạng lâm sàng của từng cá nhân nhưng 5 đến 7 ngày sau phẫu thuật có lẽ là hợp lý.
3. Đặt dây thất trái khi phẫu thuật được thực hiện như một thủ thuật độc lập khi đặt qua xoang vành không hiệu quả (S8.1.2.2-7). Nếu một bệnh nhân có chỉ định tái đồng bộ tim trước khi phẫu thuật tim, đặt dây thất trái thượng tâm mạc ở thời điểm ngoại khoa cho AF có thể cung cấp lợi ích trong tương lai mà không có nguy cơ gây hại có ý nghĩa. Ngoài ra, việc đặt một dây thượng tâm mạc thành bên, không phải mỏm tim sẽ cho phép lựa chọn tạo nhịp nhiều hơn nếu bệnh nhân trải qua triệt phá nút nhĩ thất trong tương lai. Mặc dù theo truyền thống được coi là chống chỉ định, MRI có thể được thực hiện một cách an toàn ở những bệnh nhân được lựa chọn với các dây chưa lắp vào các thiết bị (dây còn để đơn thuần) (abandoned) dưới các giao thức chuyên biệt (S8.1.2.2-8 Thẻ S8.1.2.2-10). Tại thời điểm tiến hành CRT trong tương lai, người thực hiện có thể cấy dây xoang vành hoặc sử dụng dây thượng tâm mạc đã đính sẵn (capped) nến cần thiết.
8.1.2.3. Phẫu thuật van tim
8.1.2.3.1. Phẫu thuật thay van hoặc sửa chữa van động mạch chủ
|
Các khuyến cáo cho tạo nhịp sau ngoại khoa van động mạch chủ Các nghiên cứu tham khảo ủng hộ các khuyến cáo được tóm tắt trong tư liệu hỗ trợ trực tuyến 48. |
||
|
COR |
LOE |
Các khuyến cáo |
|
I |
C-LD |
1. Ở các bệnh nhân trải qua phẫu thuật thay hoặc sửa chữa van động mạch chủ, nên thường xuyên đặt các dây tạo nhịp tạm thời (S8.1.2.3.1-1-1 S8.1.2.3.1-3). |
|
I |
B-NR |
2. Ở các bệnh nhân có SND mới sau phẫu thuật hoặc block nhĩ thất liên quan đến các triệu chứng dai dẳng hoặc mất ổn định huyết động không giải quyết sau khi thay van động mạch chủ, nên tạo nhịp vĩnh viễn trước khi xuất viện (S8.1.2.3.1-1, S8.1.2.3.1-5 ). |
|
IIb |
C-EO |
3. Ở các bệnh nhân trải qua phẫu thuật van động mạch chủ, những người có thể sẽ yêu cầu CRT hoặc tạo nhịp thất trong tương lai, có thể cân nhắc đặt dây thất trái thượng tâm mạc trong khi phẫu thuật. |
Tóm tắt
Chấn thương phổ biến nhất đối với hệ thống dẫn truyền sau khi thay van động mạch chủ phẫu thuật là chấn thương bó chung do phù, loại bỏ canxi hoặc chỉ khâu sâu. Yêu cầu đối với máy tạo nhịp tim sau khi thay van động mạch chủ là phổ biến, dao động từ 3% đến 8,5%: nguy cơ cao nhất có thể xảy ra ở những bệnh nhân bị rối loạn dẫn truyền trước phẫu thuật (S8.1.2.3.1-1, S8.1.2.3.1-3). Dữ liệu có sẵn cho thấy hầu hết bệnh nhân không phục hồi dẫn truyền nhĩ thất (S8.1.2.3.1-4, S8.1.2.3.1-6). Một nghiên cứu cho thấy những bệnh nhân sử dụng máy tạo nhịp tim trong vòng 30 ngày sau khi thay van động mạch chủ có nguy cơ lâu dài tử vong cao hơn (S8.1.2.3.1-5).
Văn bản hỗ trợ khuyến cáo riêng biệt
1. Đặt dây dẫn tạo nhịp tim tạm thời tại thời điểm phẫu thuật van động mạch chủ là thực hành thường xuyên. Nguy cơ nhịp tim chậm sau phẫu thuật rất cao, không có nghiên cứu nào ủng hộ cách tiếp cận có chọn lọc đối với việc đặt dây nhịp tạm thời (S8.1.2.3.1-1, S8.1.2.3.1-3). Tái đồng bộ tim tạm thời bằng cách sử dụng dây nhĩ phải, tâm thất phải và các dây tạo nhịp tim thất trái đã được đề xuất để cải thiện các thông số huyết động học tim trong giai đoạn hậu phẫu ngay lập tức ở những bệnh nhân bị rối loạn chức năng thất trái nặng với kết quả hỗn hợp mặc dù có thể mang lại lợi ích cho bệnh nhân đi kèm với LBBB (S8. 1.2.3.1-4. S8.1.2.3.1-9).
2. Nhu cầu đặt PPM là thường xuyên sau khi thay van động mạch chủ (S8.1.2.3.1-1, S8.1.2.3.1-3). Do van động mạch chủ nằm ở vị trí giải phẫu gần bó His, trong khi van hai lá gần với nút nhĩ thất, block nhĩ thất sau phẫu thuật van động mạch chủ có ngưỡng thấp hơn để đề xuất tạo nhịp so với van hai lá, và dẫn truyền ít có khả năng nối lại (S8.1.2.3.1-4, S8.1.2.3.1-6). Điều này cho thấy những bệnh nhân có block nhĩ thất mới không được giải quyết được hoặc SND nên được cấy PPM trước khi xuất viện để điều trị nhịp tim chậm có triệu chứng hoặc huyết động có ý nghĩa. Thời gian cụ thể của máy tạo nhịp tim chưa được nghiên cứu chính thức và sẽ luôn phụ thuộc vào tình trạng lâm sàng của từng cá nhân nhưng 3 đến 5 ngày sau phẫu thuật có lẽ là hợp lý.
3. Đặt dây thất trái lúc phẫu thuật được thực hiện như một thủ thuật độc lập khi đặt qua xoang vành không thành công (S8.1.2.3.1-10). Nếu một bệnh nhân có chỉ định tái đồng bộ tim trước khi phẫu thuật tim, việc đặt dây ở bên thất trái thượng tâm mạc không phải mỏm trong thời gian phẫu thuật tim có thể mang lại lới ích trong tương lai không có nguy cơ có hại có ý nghĩa. Mặc dù theo truyền thống được coi là chống chỉ định, MRI có thể được thực hiện một cách an toàn ở những bệnh nhân được lựa chọn với các đầu dẫn chưa được nối với thiết bị dưới sự bảo trợ của các giao thức chuyên biệt (S8.1.2.3.1-11 11 S8.1.2.3.1-13). Tại thời điểm tiến hành CRT trong tương lai, người thực hiện có thể cấy dây xoang vành hoặc sử dụng dây dẫn đã được đính nếu cần thiết.
8.1.2.3.2. Phẫu thuật van hai lá
|
Các khuyến cáo cho tạo nhịp sau phẫu thuật van hai lá Các nghiên cứu tham khảo ủng hộ khuyến cáo được tóm tắt trong tư liệu hỗ trợ trực tuyến 48. |
||
|
COR |
LOE |
Các khuyến cáo |
|
I |
B-NR |
1. Ở các bệnh nhân có SND mới sau phẫu thuật hoặc block nhĩ thất liên quan đến các triệu chứng dai dẳng hoặc mất ổn định huyết động không giải quyết sau khi sửa van hai lá hoặc phẫu thuật thay thế, tạo nhịp vĩnh viễn được khuyến cáo trước khi xuất viện (S8.1.2.3.2-1, S8.1.2. 3.2-2). |
|
IIa |
C-LD |
2. Ở các bệnh nhân trải qua phẫu thuật van hai lá, việc đặt thường xuyên các dây tạo nhịp tạm thời là hợp lý (S8.1.2.3.2-1, S8.1.2.3.2-3). |
|
IIb |
C-EO |
3. Ở các bệnh nhân được phẫu thuật sửa chữa hoặc thay van hai lá có khả năng sẽ yêu cầu CRT hoặc tạo nhịp thất trong tương lai, có thể xem xét đặt dây thượng tâm mạc thất trái trong khi phẫu thuật. |
Tóm tắt
Tỷ lệ block nhĩ thất mới đã được báo cáo ở mức cao 23,5% bệnh nhân trải qua thay van hai lá hoặc sửa chữa vòng (S8.1.2.3.2-1). Trong 1 nghiên cứu bệnh lý, 55 trái tim từ những bệnh nhân chưa trải qua phẫu thuật đã được kiểm tra để đánh giá mối quan hệ giữa nút nhĩ thất, động mạch nút nhĩ thất và vòng van hai lá (S8.1.2.3.2-1). Ở những trái tim bị mổ, 23% có động mạch nút nhĩ thất chạy gần van hai lá, cho thấy tổn thương động mạch có thể đóng vai trò trong sự phát triển của block nhĩ thất sau phẫu thuật van hai lá. Sự cần thiết cho PPM sau phẫu thuật hai lá dao động từ 1% đến 9% (S8.1.2.3.2-1, S8.1.2.3.2-2, S8.1.2.3.2-4). Nguyên nhân có thể bị ảnh hưởng do loại phẫu thuật và có thể thấp hơn trong dân số sửa chữa ở người dải tạo hình vòng van không hoàn toàn có thể tránh tổn thương đến động mạch nút nhĩ thất (S8.1.2.3.2-2, S8.1.2.3.2-4).
Văn bản hỗ trợ khuyến cáo riêng biệt
1. Sự cần thiết đặt PPM là phổ biến sau phẫu thuật van hai lá (S8.1.2.3.2-1, S8.1.2.3.2-2, S8.1.2.3.2-5). Một phần để tạo điều kiện phục hồi sau phẫu thuật (như ra khỏi môi trường chăm sóc đặc biệt, vận động và bắt đầu chống đông máu), những bệnh nhân mới khởi phát block nhĩ thất hoặc SND phát triển và không cải thiện nên thực hiện đặt máy tạo nhịp vĩnh viễn trước khi xuất viện đối với nhịp chậm dai dẳng hoặc rối loạn huyết động có ý nghĩa. Do phẫu thuật van hai lá liên quan đến chấn thương của khu vực nút nhĩ thất chứ không phải chấn thương bó His liên quan đến phẫu thuật van động mạch chủ, ngưỡng cho cấy máy tạo nhịp tim cao hơn. Thời gian cụ thể của cấy máy tạo nhịp tim chưa được nghiên cứu chính thức và sẽ luôn phụ thuộc vào tình trạng lâm sàng cá nhân nhưng 5 đến 7 ngày sau phẫu thuật van hai lá có lẽ là hợp lý.
2. Đặt dây dẫn tạo nhịp thượng tâm mạc tạm thời tại thời điểm phẫu thuật van hai lá là thực hành thường xuyên. Nguy cơ nhịp tim chậm sau phẫu thuật là tương đối thường xuyên, không có nghiên cứu nào ủng hộ cách tiếp cận có chọn lọc đối với việc đặt dây nhịp tạm thời (S8.1.2.3.2-1, S8.1.2.3.2-2). Tuy nhiên, các chiến lược tạo nhịp thay thế sử dụng tạo nhịp catheter động mạch phổi đã được mô tả cho bệnh nhân trải qua phẫu thuật van hai lá xâm lấn tối thiểu (S8.1.2.3.2-3). Tái đồng bộ tim tạm thời bằng cách sử dụng dây nhĩ phải, tâm thất phải và tạo nhịp tim thất trái đã được đề xuất để cải thiện các thông số huyết động học tim trong giai đoạn hậu phẫu ngay lập tức ở những bệnh nhân bị rối loạn chức năng thất trái nặng với kết quả hỗn hợp mặc dù có thể mang lại lợi ích cho bệnh nhân đi kèm với LBBB (S8. 1.2.3.2-6. S8.1.2.3.2-8).
3. Đặt dây thất trái khi phẫu thuật được thực hiện đặt tâm thất trái phẫu thuật được thực hiện như một thủ thuật đơn độc chuẩn khi đặt qua xoang vành là không thành công (S8.1.2.3.2-9). Nếu một bệnh nhân có chỉ định tái đồng bộ tim trước khi phẫu thuật tim, việc đặt một nội tâm mạc thành bên thất trái không phải mỏm trong thời gian phẫu thuật có thể mang lại lợi ích không có nguy hại có ý nghĩa. Mặc dù theo truyền thống được coi là chống chỉ định, MRI có thể được thực hiện một cách an toàn ở những bệnh nhân được chọn với các đầu dẫn chưa được nối với thiết bị dưới sự bảo trợ của các giao thức chuyên biệt (S8.1.2.3.2-10, S8.1.2.3.2-12). Tại thời điểm tiến hành CRT trong tương lai, người thực hiện có thể cấy dây xoang vành hoặc sử dụng dây thượng tâm mạc đã được đính trước nếu cần thiết.
8.1.2.3.3. Phẫu thuật van ba lá
|
Các khuyến cáo cho tạo nhịp sau phẫu thuật van ba lá Các nghiên cứu ủng hộ các khuyến cáo được tóm tắt trong tư liệu hỗ trợ trực tuyến 48. |
||
|
COR |
LOE |
Các khuyến cáo |
|
I |
C-LD |
1. Ở các bệnh nhân trải qua phẫu thuật van ba lá, nên thường xuyên đặt các dây tạo nhịp tạm thời (S8.1.2.3.3-1-1 S8.1.2.3.3-4). |
|
I |
B-NR |
2. Ở các bệnh nhân có SND mới sau phẫu thuật hoặc block nhĩ thất liên quan đến các triệu chứng hoặc mất ổn định huyết động không giải quyết sau phẫu thuật van ba lá, nên tạo nhịp vĩnh viễn trước khi xuất viện (S8.1.2.3.3-1-1 S8.1.2.3.3-4). |
|
IIa |
C-LD |
3. Ở các bệnh nhân đang trải qua thay van ba lá hoặc sửa chữa ba lá có nguy cơ cao bị block nhĩ thất sau phẫu thuật, đặt các dây thượng tâm mạc trong lúc phẫu thuật tim là phù hợp (S8.1.2.3.3-1 S8.1.2.3.3- 5). |
Tóm tắt
Nút nhĩ thất có liên quan mật thiết đến van ba lá, nằm giữa các lá trước và lá vách; điều này làm cho nút nhĩ thất đặc biệt dễ bị tổn thương với bất kỳ can thiệp van ba lá. Các bác sĩ phẫu thuật đã phát triển nhiều kỹ thuật sửa chữa để tránh tổn thương nút, gồm thiết kế một số vòng van ba lá không khép kín (vòng không hoàn chỉnh) có khoảng cách giữa các lá trước và lá vách. Những kỹ thuật này tránh đặt chỉ khâu trong khu vực của nút nhĩ thất, có thể tổn thương nó. Sự cần thiết cho máy tạo nhịp sau sửa chữa đã được báo cáo thấp tới 2,3% (S8.1.2.3.3-1). Tuy nhiên, vì phẫu thuật ba lá đơn độc rất hiếm trong dân số trưởng thành, nên tỷ lệ chính xác của rối loạn dẫn truyền do can thiệp ba lá đơn độc rất khó xác định. Một số loạt báo cáo tỷ lệ bị cao hơn nhiều, lên tới 22% (S8.1.2.3.3-2, S8.1.2.3.3-4). Việc kiểm soát các bất thường dẫn truyền trong dân số này cũng rất phức tạp do không thể sử dụng các dây tạo nhịp qua tĩnh mạch trong van nhân tạo và sự can thiệp của chúng trong việc đóng van sinh học nhân tạo hoặc van tự nhiên đã được sửa chữa. Ngay cả trong các van tự nhiên, gần một phần tư số bệnh nhân bị hở van ba lá đáng kể được kết hợp với dây thất phải nội mạch (S8.1.2.3.3-5). Ở những bệnh nhân cần sử dụng máy tạo nhịp tim sau khi sửa chữa, tỷ lệ mắc bệnh ba lá từ trung bình đến nặng hoặc nặng là 42% (S8.1.2.3.3-3).
Văn bản hỗ trợ khuyến cáo riêng biệt
1. Đặt dây tạo nhịp tạm thời thượng tâm mạc tại thời điểm phẫu thuật van ba lá là thực hành thường xuyên. Nguy cơ nhịp tim chậm sau phẫu thuật là tương đối phổ biến, và không có nghiên cứu nào ủng hộ cách tiếp cận có chọn lọc đối với việc đặt dây nhịp tạm thời (S8.1.2.3.3-1, S8.1.2.3.3-4).
2. Sự cần thiết đặt PPM là thường xuyên sau phẫu thuật van ba lá (S8.1.2.3.3-1, S8.1.2.3.3-4). Một phần để tạo điều kiện phục hồi sau phẫu thuật (như ra khỏi môi trường chăm sóc đặc biệt, vận động và bắt đầu chống đông máu), những bệnh nhân mới khởi phát block nhĩ thất tiến triển hoặc SND phát triển và không cải thiện nên đặt máy tạo nhịp vĩnh viễn sau khi phẫu thuật mở van ba lá. Thời gian cụ thể của máy tạo nhịp tim chưa được nghiên cứu chính thức và sẽ luôn phụ thuộc vào tình trạng lâm sàng của từng cá nhân nhưng 3 đến 5 ngày sau phẫu thuật có lẽ là hợp lý. Để giảm thiểu việc đụng chạm đến van trong trạng thái van ba lá được sửa chữa, dây thất thượng tâm mạch qua van được đặt định vị một cách lý tưởng giữa các lá trước và lá vách của van ba lá.
3. Sự cần thiết đặt PPM là thường xuyên sau phẫu thuật van ba lá (S8.1.2.3.3-1, S8.1.2.3.3-4). Sau khi sửa chữa hoặc thay thế, có thể đặt thành công dẫn thất nội tâm mạc qua van sau khi sửa chữa van ba lá hoặc thay van sinh học nhưng có thể gây hở van ba lá nặng (S8.1.2.3.3-3, S8.1.2.3.3-5, S8.1.2.3.3-6). Các dây thất nội tâm mạc qua van không thể được đặt qua van cơ học ở vị trí van ba lá. Bệnh nhân đang trải qua thay van ba lá hoặc sửa chữa ba lá có nguy cơ cao bị block nhĩ thất sau phẫu thuật nên được xem xét mạnh mẽ cho các dây tạo nhịp thượng tâm mạc vĩnh viễn trong thời gian phẫu thuật tim (S8.1.2.3.3-7). Do các dây thượng tâm mạc có thể thất bại và đặt sau đó dây nội tâm mạc thất phải có thể là một vấn đề ở các bệnh nhân sau thay van ba lá, tại thời điểm phẫu thuật khởi đầu van ba lá, nếu có thể, cấy một vài dây lúc phẫu thuật (các dây nhĩ, thất phải, thất trái thành bên, không phải mỏm) nên được xem xét. Mặc dù theo truyền thống được coi là chống chỉ định, nhưng MRI có thể được thực hiện một cách an toàn ở những bệnh nhân được lựa chọn với các đầu dẫn chưa được gắn vào thiết bị (bỏ rơi) dưới sự bảo trợ của các giao thức chuyên biệt (S8.1.2.3.3-8, S8.1.2.3.3-10). Nếu một PPM được yêu cầu trong tương lai, người thực hiện có thể cấy dây xoang vành hoặc sử dụng dây dẫn đã đính sẵn ở thượng tâm mạc nếu cần thiết.
8.1.2.4. Thay van động mạch chủ qua catheter (Transcatheter Aortic Valve Replacement: TAVR)
|
Các khuyến cáo cho các rối loạn dẫn truyền sau thay van động mạch chủ qua catheter Các nghiên cứu tham khảo ủng hộ các khuyến cáo được tóm tắt trong tư liệu hỗ trợ trực tuyến 49. |
||
|
COR |
LOE |
Các khuyến cáo |
|
I |
B-NR |
1. Ở những bệnh nhân có block nhĩ thất mới sau khi thay van động mạch chủ qua catheter liên quan đến các triệu chứng hoặc mất ổn định huyết động không giải quyết được, nên tạo nhịp vĩnh viễn trước khi xuất viện (S8.1.2.4-1. |
|
IIa |
B-NR |
2. Ở các bệnh nhân có block nhánh bó mới kéo dài sau khi thay van động mạch chủ qua catheter, việc theo dõi cẩn thận nhịp tim chậm là hợp lý (S8.1.2.4-5, S8.1.2.4-6). |
|
IIb |
B-NR |
3. Ở các bệnh nhân LBBB mới kéo dài sau khi thay van động mạch chủ qua catheter, việc cấy PPM có thể được xem xét (S8.1.2.4-4, S8.1.2.4-7, S8.1.2.4-10). |
Tóm tắt
Tại thời điểm viết, tài liệu về rối loạn dẫn truyền sau khi thay van động mạch chủ qua catheter (TAVR) được hoàn thiện với hàng ngàn trường hợp, nhiều báo cáo từ các cơ quan đăng ký lớn hơn, một vài phân tích tổng hợp và không có RCT tiền cứu của cấy PPM. Trước các yếu tố dự đoán TAVR cho cấy PPM gồm RBBB có từ trước, khả năng giả cho tỷ lệ đường thất trái tăng lên và tăng đường kính cuối tâm trương thất trái (S8.1.2.4-8). Sau TAVR, LBBB mới xảy ra ở 19% đến 55% bệnh nhân (S8.1.2.4-1, S8.1.2.4-3, S8.1.2.4-11) và block nhĩ thất mức độ cao mới trong khoảng 10% của bệnh nhân (S8.1.2.4-12). Lên đến một nửa block nhánh nhánh mới (S8.1.2.4-1) và block tim hoàn toàn (S8.1.2.4-7) có thể được dự kiến sẽ mất đi khi xuất viện. Hơn nữa, chỉ một nửa số bệnh nhân có PPM mới sau TAVR sẽ phụ thuộc và máy tạo nhịp trong quá trình theo dõi mặc dù điều đó không nhất thiết ngụ nói lên việc tạo nhịp là không cần thiết, vì có thể xuất hiện block nhĩ thất không liên tục (S8.1.2.4-13). Khả năng rối loạn dẫn truyền mới phụ thuộc vào các yếu tố bệnh nhân và thủ thuật (S8.1.2.4-7, S8.1.2.4-8). Sau TAVR, RBBB mới có liên quan đến tăng nguy cơ cấy PPM và tăng tỷ lệ tử vong do mọi nguyên nhân muộn và tử vong do tim độc lập với việc cấy PPM mới (S8.1.2.4-5, S8.1.2.4-8, S8. 1.2.4-14, S8.1.2.4-15). Mặc dù hầu hết các nghiên cứu cho thấy LBBB mới sau TAVR (S8.1.2.4-4, S8.1.2.4-9, S8.1.2.4-10) có liên quan đến nguy cơ PPM mới cao hơn, các nghiên cứu được trộn lẫn về việc liệu LBBB mới là một yếu tố dự báo tỷ lệ tử vong muộn. Điều rõ ràng PPM sớm cho LBBB mới không bảo vệ chống lại tỷ lệ tử vong gia tăng (S8.1.2.4-4, S8.1.2.4-16, S8.1.2.4-17). Mặc dù có thể được xem xét, tại thời điểm viết bài này, không rõ liệu bệnh nhân có block nhánh bó mới vẫn tồn tại khi bệnh nhân sẵn sàng xuất viện hay không, sẽ được hưởng lợi từ việc cấy ghép máy tạo nhịp trong quá trình chỉ số nhập viện (S8.1.2.4-4 , S8.1.2.4-7 – S8.1.2.4-10).
Văn bản hỗ trợ khuyến cáo riêng biệt
1. Block nhĩ thất mức độ cao thường được quan sát thấy nhiều nhất trong ngay giai đoạn quanh thủ thuật nhưng sẽ tồn tại sau 48 giờ ở 2% đến 20% bệnh nhân (S8.1.2.4-1, S8.1.2.4-7, S8.1.2 .4-8). Trong các nghiên cứu cũ, tỷ lệ cấy PPM sau TAVR dao động từ 2% 51%, nhưng với công nghệ phát triển nhanh chóng và các chiến lược cấy mới hơn, đã có sự giảm chung về các yêu cầu cho cấy máy tạo nhịp sau TAVR (S8.1.2.4-2-2 S8.1.2.4-4, S8.1.2.4-7). Trong 1 nghiên cứu, theo dõi, 52% bệnh nhân được điều trị liên tục, nhưng 22% bệnh nhân đã hồi phục dẫn truyền nhĩ thất và không còn yêu cầu tạo nhịp để hỗ trợ tần số (S8.1.2.4-3). Thời gian cụ thể của máy tạo nhịp tim chưa được nghiên cứu chính thức và sẽ luôn phụ thuộc vào tình huống lâm sàng của từng cá nhân. Trong các báo cáo được công bố, phạm vi cấy máy tạo nhịp sau TAVR đã thay đổi từ 2 ngày đến vài tuần với thời gian trung bình khoảng 3 ngày (S8.1.2.4-2, S8.1.2.4-4, S8.1.2.4-7 ).
2. Bệnh nhân có block nhánh bó mới sau TAVR có thể có nguy cơ ngất và phát triển block nhĩ thất. Ở 29% bệnh nhân bị LBBB mới, cơn đầu tiên block nhĩ thất cao độ xảy ra sau khi xuất viện với nguy cơ tiềm ẩn liên quan đến ngất (S8.1.2.4-6). Giám sát cẩn thận cho nhịp tim chậm là thích hợp. Mặc dù các phương thức giám sát khác nhau, thời lượng và khoảng thời gian có sẵn, cho đến nay không có phương pháp hoặc giao thức cụ thể nào được chứng minh là vượt trội. Cần nghiên cứu thêm trong lĩnh vực này. Các tổ chức nên chọn phương thức giám sát và giao thức theo tính khả dụng và chuyên môn tại từng tổ chức.
3. LBBB mới xảy ra ở khoảng 10% bệnh nhân sau TAVR và mất đi trong khoảng 50% sau 6 đến 12 tháng (S8.1.2.4-8). Bệnh nhân LBBB mới kéo dài sau TAVR có nguy cơ cao cần cấy PPM quanh phẫu thuật và sau khi xuất viện (S8.1.2.4-4, S8.1.2.4-10). Các nghiên cứu đã không nhất quán về ý nghĩa của LBBB mới sau TAVR với một số nghiên cứu cho thấy tỷ lệ sống thấp hơn và các nghiên cứu khác cho thấy không có nguy cơ tử vong hoặc nhập viện lặp lại (S8.1.2.4-4, S8.1.2.4-18). Bất thường dẫn truyền tiền sản, đặc biệt RBBB có liên quan đến tăng nguy cơ PPM sau TAVR (S8.1.2.4-19, S8.1.2.4-20). Trong 1 nghiên cứu, khoảng HV 65 ms sau TAVR được dự đoán một cách khiêm tốn cho sự phát triển của block nhĩ thất cao độ trong tính huống nhánh bó bên trái mới sau TAVR (độ nhạy, 80%; độ đặc hiệu, 79%) (S8.1.2. 4-21).
8.1.2.5. Nghép tim, lấy bỏ cơ tim bằng ngoại khoa, triết phá vách bằng Alcohol
8.1.2.5.1. Sau ghép tim
Với phương pháp nối mạc máu trong ghép tim hai tĩnh mạch chủ hơn ghép mạch máu hai nhĩ tần số tạo nhịp đã giảm đi từ 10% đến 14% xuống 2% đến 4% (S8.1.2.5.1-1–S8.1.2.5.1-4). SND có là nguyên nhân phổ biến đối với nhịp chậm được tính toám khoảng 80% các trường hợp (S8.1.2.5.1-1–S8.1.2.5.1-4). Nghiên cứu bệnh lý đã được xác định các bệnh nhân riêng biệt ở họ hệ thống dẫn truyền bị ảnh hưởng tốt hơn trong quá trình thải ghép cùng loại, nhưng mối liên quan giữa nhịp chậm và thải ghép cùng loại không được xác định thường hơn trong các phân tích các dữ liệu lớn (S8.1.2.5.1-1–S8.1.2.5.1-5). Các hướng dẫn cho sử dụng các tạo nhịp vĩnh viễn tương tự cho những người áp dụng phổ biến cho SND và block nhĩ thất, đánh giá đặc biệt cần thận khi hiện diện SND có triệu chứng (Tư liệu hỗ trợ 50).
8.1.2.5.2. Các bỏ cơ tim ngoại khoa và triệu phát vách bằng alcohol cho bệnh cơ tim phì đại
|
Các khuyến cáo cho các bệnh nhân đang trải qua cắt bỏ cơ tim ngoại khoa hoặc triệt phá vách bằng alcohol cho bệnh cơ tim phì đại Các nghiên cứu ủng hộ khuyến cáo được tóm tắt trong tư liệu hỗ trợ trực tuyến 51 và 52. |
||
|
COR |
LOE |
Các khuyến cáo |
|
I |
B-NR |
1. Ở các bệnh nhân có block nhĩ thất độ 2 Mobitz type II, block nhĩ thất cao độ, hoặc block nhĩ thất hoàn toàn dai dẳng sau khi triệt phá vách bằng alcohol hoặc phẫu thuật cắt bỏ cơ, nên tiến hành tạo nhịp tim vĩnh viễn trước khi xuất viện (S8.1.2.5.2-1. 1.2.5.2-4). |
|
IIa |
B-NR |
2. Ở các bệnh nhân bệnh cơ tim phì đại được lựa chọn cần tạo nhịp tim vĩnh viễn để hỗ trợ tần số sau phẫu thuật triệt phá bằng alcohol hoặc phẫu thuật cắt bỏ cơ vách có nguy cơ cao cho đột tử tim và phạm vi sống còn lớn > 1 năm được dự kiến, lựa chọn thiết bị với khả năng khử rung là phù hợp (S8.1.2.5.2-5, S8.1.2.5.2-7). |
|
IIb |
C-LD |
3. Ở các bệnh nhân bị bệnh cơ tim phì đại, người bị triệt phá vách bằng alcohol và có nguy cơ phát triển block nhĩ thất muộn, có thể xem xét theo dõi điện tâm đồ kéo dài (S8.1.2.5.2-1, S8.1.2.2.2, S8.1.2.2.2 .5.2-4, S8.1.2.5.2-7, S8.1.2.5.2-8). |
|
IIb |
C-LD |
4. Ở các bệnh nhân bị bệnh cơ tim phì đại, đánh giá dẫn truyền thất nhĩ bằng EPS tại thời điểm triệt phá vách bằng alcohol có thể được xem xét để xác định nguy cơ block nhĩ thất trong tương lai (S8.1.2.5.2-9). |
Tóm tắt
Ở các bệnh nhân bị bệnh cơ tim phì đại và các triệu chứng do tắc nghẽn đường ra thất trái, phẫu thuật cắt bỏ cơ hoặc hoặc triệt phá bằng alcohol vách thể được sử dụng để giảm độ dày của vách và cải thiện triệu chứng (S8.1.2.5.2-10). Nguy cơ dẫn truyền nhĩ thất bất thường rất khác nhau giữa các nghiên cứu quan sát với ước tính từ 10% đến 33% cho triệt phá vách bằng alcohol và 3% đến 4% cho phẫu thuật cắt bỏ (S8.1.2.5.2-10, S8.1.2.5.2-15). Phạm vi báo cáo rộng một phần là do sự khác biệt về tính chất dẫn truyền đường cơ sở. Ví dụ, ở những bệnh nhân trải qua phẫu thuật cắt bỏ đòi hỏi tạo nhịp vĩnh viễn là 2% nhưng tăng lên 10% nếu có bất thường dẫn truyền đường cơ sở (S8.1.2.5.2-13). Một phân tích tổng hợp các nghiên cứu quan sát cho thấy nguy cơ dẫn truyền nhĩ thất bất thường đòi hỏi phải tạo nhịp vĩnh viễn cao hơn với triệt phá vách bằng alcohol so với phẫu thuật cắt bỏ (10% so với 4,4%) (S8.1.2.5.2-11). Tuy nhiên, một phân tích gần đây của Cơ sở dữ liệu Mẫu Bệnh nhân nội trú Quốc gia (National Inpatient Sample Database) đã tìm thấy các yêu cầu tương tự 9% đến 14% đối với PPM đối với cả triệt phá vách bằng alcohol và phẫu thuật cắt bỏ (S8.1.2.5.2-16). Sự phát triển của RBBB được quan sát thấy ở khoảng 60% bệnh nhân sau khi triệt phá vách bằng alcohol và tới 90% bệnh nhân phát triển LBBB sau phẫu thuật cắt bỏ (S8.1.2.5.2-13, S8.1.2.5.2-15).
Văn bản hỗ trợ khuyến cáo riêng biệt
1. Block nhĩ thất thoáng qua sau khi triệt phá vách bằng alcohol được quan sát thấy ở khoảng 15% đến 50% bệnh nhân và thường hết trong vòng 24 giờ (S8.1.2.5.2-1, S8.1.2.5.2-4, S8.1.2.5.2-11. S8.1.2.5.2- 15). Sự phát triển của block nhĩ thất trong lục thủ thuật có nhiều khả năng ở những bệnh nhân LBBB từ trước, bệnh nhân lớn tuổi, phụ nữ và sử dụng ethanol với liều lượng lớn hơn (S8.1.2.5.2-17). Các giao thức để cấy PPM thay đổi từ nghiên cứu này sang nghiên cứu khác, nhưng hầu hết cấy PPM nếu block nhĩ thất hoàn toàn có mặt > 24 giờ sau khi triệt phá vách bằng alcohol mặc dù thời gian cấy thực tế thay đổi trong khoảng từ 2 đến 7 ngày. Trong một số nghiên cứu, bệnh nhân có block nhĩ thất hoàn toàn kéo dài > 24 giờ thường cần tạo nhịp vĩnh viễn để hỗ trợ tần số trong 2 tuần, trong khi đó, trong các nghiên cứu khác, sự phục hồi dẫn truyền nhĩ thất đã được quan sát thấy ở hầu hết các bệnh nhân (S8.1.2.5.2-2. .5.2-4, S8.1.2.5.2-13). PPM được cấy vào 2% đến 10% bệnh nhân sau phẫu thuật cắt bỏ thường cho block tim hoàn toàn dai dẳng (S8.1.2.5.2-15, S8.1.2.5.2-18).
2. Bệnh nhân được lựa chọn bị bệnh cơ tim phì đại có nguy cơ đột tử tim. Hướng dẫn ACCF / AHA năm 2011 về chẩn đoán và điều trị bệnh cơ tim phì đại và Hướng đẫn của AHA / ACC / HRS năm 2017 cho loạn nhịp thất và đột tử tim đã xác định một số yếu tố nguy cơ gây đột tử tim gồm tiền sử rối loạn nhịp thất, tiền sử gia định có đột tử tim, ngất không giải thích được và độ dày thành tâm thất trái tối đa ≥ 30 mm (S8.1.2.5.2-5, S8.1.2.5.2-7, S8.1.2.5.2-10, S8.1.2.5.2-19). Phẫu thuật cắt bỏ cơ có liên quan đến việc giảm nguy cơ đột tử trong 1 đoàn hệ lớn (S8.1.2.5.2-20).
3. Block tim muộn với nhận biết khở đầu > 48 giờ đã được quan sát thấy ở một số nhưng không phải tất cả các nghiên cứu sau khi triệt phá vách bằng alcohol. Các yếu tố nguy cơ tiềm ẩn đối với block nhĩ thất kéo dài không nhất quán từ nghiên cứu này đến nghiên cứu khác và gồm block nhĩ thất độ I trước thủ thuật (S8.1.2.5.2-1) hoặc LBBB (S8.1.2.5.2-2), block nhĩ thất tạm thời và RBBB mới sau thủ thuật (S8.1.2.5.2-4). Trong 1 nghiên cứu, biểu hiện đầu tiên của block nhĩ thất xảy ra trong khoảng từ 2 ngày đến 3 năm ở 9% bệnh nhân sau khi triệt phá vách bằng alcohol (S8.1.2.5.2-21). Trong một nghiên cứu khác, việc theo dõi nhịp ngoại trú bằng cấy máy ghi vòng lặp được bắt đầu sau khi triệt phá vách bằng alcohol (S8.1.2.5.2-8). Mặc dù đã có các đợt rung thất liên quan đến block tim hoàn toàn trong giai đoạn ngay quanh thủ thuật, không có đợt nào của block tim được xác định sau khi xuất viện (S8.1.2.5.2-8). Sự phát triển muộn của block nhĩ thất sau phẫu thuật cắt bỏ cơ đã không được báo cáo do theo dõi hạn chế (S8.1.2.5.2-7, S8.1.2.5.2-15).
4. Trong 1 nghiên cứu trên 172 bệnh nhân trải qua quá trình triệt phá vách bằng alcohol và EPS đồng thời, những bệnh nhân này dẫn truyền tâm thất ngược nguyên vẹn không phát triển block tim hoàn toàn trễ bất kể những thay đổi về đặc tính dẫn truyền nhĩ thất xuôi liên quan đến triệt phá vách bằng alcohol (S8.1.2. 5.2-9).
8.1.2.6. Điều chỉnh các đợt nhịp tim chậm liên quan với AF sau phẫu thuật
AF xảy ra phổ biến sau phẫu thuật tim ở người lớn, với tỷ lệ bị cao nhất sau 2 đến 4 ngày sau phẫu thuật và tỷ lệ chung từ 10% đến 65% (S8.1.2.6-1). AF sau phẫu thuật xảy ra thường xuyên hơn ở những bệnh nhân trải qua phẫu thuật van so với những người trải qua phẫu thuật bắc cầu động mạch vành đơn độc (S8.1.2.6-2). Rối loạn nhịp tim có thể có một số hình thức ở những bệnh nhân này, gồm đáp ứng tâm thất chậm trong AF và các khoảng ngưng xoang kéo dài sau khi nhịp xoang được phục hồi. Đáp ứng tâm thất chậm và đều đặn trong khi AF thường biểu thị block tim hoàn toàn và có thể cần phải tạo nhịp nếu sự thoai lui không xảy ra (S8.1.2.6-3). Việc đánh giá nhịp tim chậm trong bối cảnh này thường phức tạp do sự cùng tồn tại của nhịp nhanh nhĩ; ảnh hưởng sau phẫu thuật thoáng qua và phụ thuộc vào thời gian đối với chức năng nút xoang và nút nhĩ thất, và sự hiện diện tiềm tàng của thuốc chống loạn nhịp tim (S8.1.2.6-4). Nói chung, nhịp tim chậm trong trạng thái AF sau phẫu thuật nên được điều trị tương tự như xảy ra ở tình huống không phẫu thuật và thường phải sử dụng thời gian chờ đợi thận trọng hơn là cấy PPM sớm. Ở những bệnh nhân thỉnh thoảng bị AF trơ với đáp ứng thất nhanh liên quan đến SND có ý nghĩa làm hạn chế các thuốc kiểm soát tần số, PPM có thể được yêu cầu để điều chỉnh AF đầy đủ.
8.2. Điều chỉnh nhịp tim chậm đối với bệnh tim bẩm sinh ở người lớn
|
Khuyến cáo cho điều chỉnh nhịp tim chậm ở người lớn bị tim bẩm sinh ở người lớn tuổi Các nghiên cứu tham khảo ủng hộ khuyến cáo được tóm tắt trong tư liệu hỗ trợ trực tuyến 53. |
||
|
COR |
LOE |
Các khuyến cáo |
|
I |
B-NR |
1. Ở người lớn mắc bệnh tim bẩm sinh trưởng thành (ACHD) và SND có triệu chứng hoặc mất khả năng điều biến tần số, tạo nhịp nhĩ được khuyến cáo (S8.2-1, S8.2-6). |
|
I |
B-NR |
2. Ở người lớn mắc ACHD và nhịp tim chậm có triệu chứng liên quan đến block nhĩ thất, nên tạo nhịp tim vĩnh viễn (S8.2-7, S8.2-9). |
|
I |
B-NR |
3. Ở người lớn bị block nhĩ thất hoàn toàn bẩm sinh với bất kỳ nhịp tim chậm có triệu chứng nào, nhịp thoát QRS rộng, nhịp tim trung bình ban ngày dưới 50 bpm, phẫu thuật tâm thất phức tạp hoặc rối loạn chức năng tâm thất, tạo nhịp tim vĩnh viễn được khuyến cáo (S8.2-10, S8.2 -11). |
|
I |
B-NR |
4. Ở người lớn mắc ACHD và block nhĩ thất độ 2 Mobitz type II sau phẫu thuật, block nhĩ thất cao độ hoặc block nhĩ thất độ 3 không được dự kiến được thoái lui, tạo nhịp vĩnh viễn được khuyến cáo (S8.2-12, S8.2 -13). |
|
IIa |
B-NR |
5. Ở người lớn không có triệu chứng với block nhĩ thất hoàn toàn bẩm sinh, tạo nhịp vĩnh viễn là hợp lý (S8.2-7, S8.2-11). |
|
IIa |
B-NR |
6. Ở những người trưởng thành bị ACHD đã được sửa chữa, yêu cầu tạo nhịp vĩnh viễn cho các chỉ định nhịp tim chậm, một thiết bị nhịp tim chậm có khả năng tạo nhịp chống nhịp nhanh nhĩ là hợp lý (S8.2-14, S8.2-15). |
|
IIa |
C-EO |
7. Ở người lớn mắc ACHD với bệnh nút xoang và / hoặc bệnh dẫn truyền nhĩ thất có từ trước đang trải qua phẫu thuật tim, đặt dây tạo nhip thượng tâm mạc trong lúc phẫu thuật là phù hợp. |
|
IIb |
B-NR |
8. Ở người lớn mắc ACHD và máy tạo nhịp tim, tạo nhịp tim vĩnh viễn dựa vào tâm nhĩ để ngăn ngừa rối loạn nhịp nhĩ có thể được xem xét (S8.2-3, S8.2-5, S8.2-16). |
|
III: Harm |
B-NR |
9. Ở những người trưởng thành được lựa chọn mắc ACHD và tĩnh mạch đến các shunt hệ thống trong tim, đặt dây tạo nhịp nội tâm mạc có khả năng gây hại (S8.2-17, S8.2-18). |
Tóm tắt
Người lớn mắc bệnh tim bẩm sinh là một nhóm bệnh nhân đa dạng với các giải phẫu khác nhau của hệ thống dẫn truyền, hồi lưu tĩnh mạch về tim, sửa chữa tim và cũng tiến triển bệnh hệ thống dẫn truyền. Nhóm khuyến nghị này được tập trung cụ thể vào người lớn (chứ không phải bệnh nhân nhi) với ACHD, chỉ sử dụng tài liệu tham khảo dành riêng cho người lớn hoặc chỉ có sự đồng thuận của chuyên gia. Nhiều hội chứng bệnh tim bẩm sinh có những cân nhắc cụ thể của chúng, chẳng hạn như hình ảnh học của bệnh nhân trước mổ với chuyển đổi nhĩ để chắc chắn không có hẹp có ý nghĩa về lâm sàng hoặc sự đường chẩy cản trở trước khi đặt dây nội tâm mạc. Chi tiết này nằm ngoài phạm vi của các tuyên bố hướng dẫn rộng rãi này và đối với dịch vụ chăm sóc chuyên khoa như vậy, những bệnh nhân này nên được chuyển đến các trung tâm dành riêng có kinh nghiệm đa phương thức trong việc quản lý loại bệnh nhân.
Văn bản hỗ trợ khuyến cáo riêng biệt
1. Tạo nhịp vĩnh viễn có thể làm giảm bớt các triệu chứng do SND ở người lớn mắc ACHD. Ở người trưởng thành mắc ACHD, SND có liên quan đến tỷ lệ tử vong và tỷ lệ rung nhĩ cao hơn mặc dù không có thử nghiệm ngẫu nhiên nào đánh giá liệu tạo nhịp tim vĩnh viễn có ngăn ngừa các di chứng này hay không (S8.2-1, S8.2-6). Với độ tuổi trung bình trẻ hơn biểu hiện bệnh nút xoang ở nhóm bệnh nhân này, họ vẫn có nguy cơ cao mắc nhiều bệnh dẫn truyền trong đời sống suốt cuộc đời. Tạo nhịp nhĩ đơn cực là một chiến lược đã được thiết lập cho loại bệnh nhân và sinh lý bệnh này và được khuyên dùng cho những bệnh nhân bị bệnh nút xoang đơn độc và dẫn truyền nhĩ thất bảo tồn. Tạo nhịp tâm nhĩ đơn giản làm hạn chế số các dây dẫn và bảo tồn một cách tiềm tàng tính bền vững của mạch máu (S8.2-19 Cuộc S8.2-23).
2. Block nhĩ thất ở mọi cấp độ có liên quan đến tỷ lệ tử vong cao hơn ở bệnh nhân ACHD, tuy nhiên không có nghiên cứu ngẫu nhiên nào hiện hữu để so sánh các chiến lược điều trị cho bệnh nhân không có triệu chứng. Mức độ của block nhĩ thất từ độ 1 đến block nhĩ thất hoàn toàn có liên quan đến sự chắc chắn của nhịp thoát hoặc ngất không giải thích được là một nỗi lo ngại, nhưng bệnh nhân có thể phát triển các triệu chứng, bất kể mức block. Một ví dụ, những bệnh nhân bị kéo dài đáng kể dẫn truyền nhĩ thất (không có block) có thể phát triển rối loạn chức năng nhĩ thất đến mức độ mà hội chứng nhịp tim có thể phát triển. Một số dị thường bẩm sinh (ví dụ, ccTGA và khiếm khuyết đệm nội tâm mạc) vốn có liên quan đến một hệ thống dẫn truyền nhĩ thất mong manh hơn, cần phải xem xét kỹ lưỡng hơn các nhóm bệnh nhân này (S8.2-7 S8.2-9).
3. Một số đặc điểm lâm sàng đã được xác định như các dấu hiệu nguy cơ cao cho các kết quả bất lợi gồm tử vong ở bệnh nhân block tim hoàn toàn bẩm sinh (S8.2-10, S8.2-11, S8.2-24). Những điều này phản ánh sự suy giảm hoặc không đáng tin cậy của tần số thoát; và tăng xu hướng phát triển rối loạn nhịp thất liên quan đến nhịp tim chậm gồm cả xoắn đỉnh (S8.2-10, S8.2-11, S8.2-24).
4. Tỷ lệ mắc và bệnh sử tự nhiên của block tim sau phẫu thuật ở người lớn mắc ACHD thay đổi theo giải phẫu cơ bản, thực hiện phẫu thuật và ảnh hưởng di truyền (S8.2-25). Khoảng thời gian tối ưu bác sĩ lâm sàng nên chờ đợi trước khi tạo nhịp vĩnh viễn không được xác định rõ do có nhiều cơ chế gồm chấn thương trực tiếp, thiếu máu cục bộ, nhồi máu, trương lực tự trị, cơ tim choáng váng và sự khác biệt trong tái tưới máu. Các cuộc điều tra gần đây cho thấy việc chờ đợi 7 đến 9 ngày có thể là không cần thiết, nhưng bác sĩ lâm sàng được khuyến cáo cân nhắc cẩn thận và thường tránh cấy ghép sớm <72 giờ, để tránh cấy máy tạo nhịp không cần thiết (S8.2-12, S8.2-13 ). Một nghiên cứu đã chỉ ra bệnh nhân có nguy cơ cao mắc block tim vĩnh viễn nếu dẫn truyền không được phục hồi trong vòng 72 giờ sau phẫu thuật (S8.2-13).
5. Bệnh nhân bị block tim hoàn toàn bẩm sinh có tỷ lệ đột tử muộn cao ở mọi lứa tuổi, và mặc dù tài liệu hỗ trợ có phần mâu thuẫn, vẫn có đủ mối lo ngại về sự tiến triển bệnh không thể đoán trước, bác sĩ lâm sàng có thể xem xét tạo nhịp tim vĩnh viễn ở người không có triệu chứng ( S8.2-7 Cẩu S8.2-11).
6. Bản chất vào lại của rối loạn nhịp nhĩ phổ biến nhất ở người lớn mắc ACHD sẽ có khả năng cho phép cắt cơn bằng tạo nhịp hiệu quả và tin cậy. Điều này khác biệt rõ rệt với việc điều trị rối loạn nhịp nhĩ phổ biến nhất ở tim bình thường và những người bệnh mắc phải, trong đó AF chiếm ưu thế và không thể cắt cơn bằng tạo nhịp (S8.2-14, S8.2-15).
7. Các nghiên cứu quan sát dài hạn đã chứng minh một cách nhất quán các dây nội tâm mạc duy trì thời gian hoạt động tốt hơn và ít có khả năng thất bại. Điều này có khả năng liên quan đến xơ hóa vùng thượng tâm mạc ở những bệnh nhân đã trải qua phẫu thuật cắt màng ngoài tim trước đó (S8.2-26, S8.2-27). Tuy nhiên, do có nguy cơ thấp trong việc đặt dây thượng tâm mạc tại thời điểm phẫu thuật tim, người ta khuyến cáo cơ hội này được sử dụng cho đặt dây – trước khi phát triển xơ hóa thượng tâm mạc nhiều / kết dính nhiều hơn.
8.3. Điều chỉnh nhịp tim chậm ở các bệnh nhân bị nhồi máu cơ tim cấp
|
Các khuyến cáo cho điều chỉnh nhịp tim chậm trong bối cảnh MI cấp Các nghiên cứu tham khảo ủng hộ các khuyến cáo được tóm tắt trong tư liệu hỗ trợ trực tuyến 54. |
||
|
COR |
LOE |
Các khuyến cáo |
|
I |
B-NR |
1. Ở các bệnh nhân bị nhồi máu cơ tim cấp tính, tạo nhịp tạm thời được chỉ định cho nhịp tim chậm có triệu chứng hoặc nhịp tim có ý nghĩa về mặt huyết học liên quan đến SND hoặc block nhĩ thất (S8.3-1–S8.3-4). |
|
I |
B-NR |
2. Bệnh nhân có SND hoặc block nhĩ thất trong trong trạng thái MI cấp tính phải trải qua thời gian chờ đợi trước khi xác định nhu cầu tạo nhịp vĩnh viễn (S8.3-1, S8.3-4, S8.3-7). |
|
I |
B-NR |
3. Ở các bệnh nhân bị nhồi máu cơ tim cấp tính với block nhĩ thất độ 2 Mobitz type II, block nhĩ thất cao độ, block bó nhánh xen kẽ, hoặc block nhĩ thất độ 3 (dai dẳng hoặc dưới nút), tạo nhịp vĩnh viễn được chỉ định sau giai đoạn chờ đợi (S8.3-7, S8.3-8). |
|
IIa |
B-NR |
4. Ở các bệnh nhân bị MI cấp tính có nhịp xoang chậm có triệu chứng hoặc huyết động có ý nghĩa hoặc block nhĩ thất ở mức nút nhĩ thất, việc sử dụng atropine là hợp lý (S8.3-9–S8.3-11). |
|
III: Harm |
B-NR |
5. Ở các bệnh nhân bị nhồi máu cơ tim cấp tính và block nhĩ thoáng qua đã giải quyết, không nên thực hiện tạo nhịp vĩnh viễn (S8.3-1, S8.3-4, S8.3-7, S8.3-12, S8.3- 16). |
|
III: Harm |
B-NR |
6. Ở các bệnh nhân bị MI cấp tính và block bó nhánh mới hoặc block bó độc lập không có block nhĩ thất độ 2 hoặc độ 3, tạo nhịp vĩnh viễn không nên được thực hiện (S8.3-17, S8.3- 19). |
Tóm tắt
Mặc dù SND thoáng qua có thể xảy ra trong bối cảnh MI cấp tính, chấn thương không hồi phục đối với hệ thống dẫn truyền nhĩ thất chiếm phần lớn chỉ định tạo nhịp. Bản chất nhất thời của các vấn đề ảnh hưởng đến dẫn truyền trong tình trạng này cần được xem xét. Ví dụ, SND và block nhĩ thất trong tình trạng MI thành dưới có thể là do sự tăng thoáng qua trong trương lực phế vị hoặc giảm cung cấp máu cho nút nhĩ thất hoặc ít phổ biến hơn là nút xoang. Tạo nhịp tạm thời không tự nó tạo thành một chỉ định cho nhịp độ vĩnh viễn. Tiên lượng dài hạn cho những người sống sót sau MI đã bị block nhĩ thất có liên quan chủ yếu đến mức độ tổn thương cơ tim và đặc điểm của rối loạn dẫn truyền trong thất chứ không phải block nhĩ thất (S8.3-20, S8.3-21). Một cảnh báo lớn trong hướng dẫn trị liệu hiện tại khi không có RCT nào so sánh các phương pháp tạo nhịp trong block nhĩ thất do biến chứng MI. Bất kể nhồi máu thành trước hay dưới, sự phát triển của chậm dẫn truyền trong thất phản ánh tổn thương cơ tim lan rộng hơn là một vấn đề về điện học đơn thuần (S8.3-22).
Văn bản hỗ trợ khuyến cáo riêng biệt
1. Tất cả các loại rối loạn dẫn truyền có thể xảy ra trong trạng thái MI cấp tính, chúng bị ảnh hưởng do nhiều cơ chế (thường là đồng thời) gồm thiếu máu cục bộ, mức độ và vị trí của MI, tái tưới máu và tác động tự trị ảnh hưởng đến dẫn truyền điện hoặc xoang hoặc nút nhĩ (S8.3-1 – S8.3-4). Sự tổn thương huyết động thứ phát do nhịp tim chậm đáng kể có thể có tác động xấu đến tưới máu cơ quan, có thể làm phức tạp sự phục hồi và tác động tiêu cực đến sự sống (thông qua thiếu máu cục bộ thận, gan hoặc não). Do khó khăn trong việc đánh giá sự bắt được cơ tim đáng tin cậy với tạo nhịp tim qua da, phương pháp này chỉ nên được sử dụng nếu các phương pháp tạm thời khác bị trì hoãn hoặc không có sẵn.
2. Có khuynh hướng các vùng của cơ tim có thể không bị nhồi máu không thể đảo ngược và tái tưới máu đầy đủ sẽ cải thiện sự dẫn truyền điện, block nhĩ thất tạm thời là phổ biến. Do đó, kết quả được xác định chủ yếu bằng biểu hiện lâm sàng, vị trí nhồi máu và tổn thương cơ tim liên quan (S8.3-6, S8.3-7, S8.3-9, S8.3-11, S8.3-23). MI trước có kết hợp với suy giảm dẫn truyền nhĩ thất thường có tiên lượng xấu với tử suất cao hơn MI thành dưới với biểu hiện khởi đầu tương tự (S8.3-1, S8.3-4, S8.3-6, S8.3-12, S8.3-24). Do đó, chỉ định cho cấy PPM trong tình trạng MI cấp tính dựa vào tình huống lâm sàng và quan sát đầy đủ để cho phép phục hồi dẫn truyền nhĩ thất, và để tránh cấy máy tạo nhịp không cần thiết. Một lần nữa, bác sĩ lâm sàng nên cân nhắc cẩn thận và thường tránh tạo nhịp vĩnh viễn sớm (<72 giờ), để có khả năng tránh việc cấy máy tạo nhịp không cần thiết (S8.3-10, S8.3-23). Có thể hợp lý khi xem xét CIED với khả năng khử rung tim ở bệnh nhân có yêu cầu tạo nhịp và LVEF thấp như đã nêu trong các tuyên bố các hội khoa học khác (S8.3-25, S8.3-26).
3. Bằng chứng dai dẳng về suy giảm dẫn truyền dưới nút có liên quan đến tổn thương cơ tim nặng hơn và tiên lượng xấu hơn. Trong bối cảnh duy trì block dẫn truyền dưới nút của tâm thu thất phụ thuộc vào sự hiện diện của nhịp thoát tâm thất ít đáng tin cậy. Có thể hợp lý khi xem xét CIED với khả năng khử rung tim ở bệnh nhân có yêu cầu tạo nhịp và LVEF thấp như đã nêu trong các tuyên bố của các hội khoa học khác (S8.3-25, S8.3-26).
4. Rối loạn tự động trong một MI cấp tính là phổ biến, một loạt trường hợp nhỏ cho thấy atropine có thể được sử dụng để tăng nhịp tim (S8.3-27). Atropine dường như an toàn ở những bệnh nhân như vậy với block nút nhĩ thất trong trường hợp không có bệnh hệ thống dẫn truyền dưới nút (S8.3-9, S8.3-28, S8.3-29). Ngược lại, điều quan trọng là phải nhận ra việc sử dụng atropine ở những bệnh nhân mắc bệnh hoặc block dẫn truyền dưới nút hoặc block có thể liên quan đến làm trầm trọng block và có khả năng gây hại. Aminophylline / theophylline cũng đã được kiểm tra trong tình huống này và trong bối cảnh dữ liệu rất hạn chế có vẻ an toàn nếu atropine không hiệu quả (S8.3-10, S8.3-11, S8.3-30, S8.3 -31).
5. Có khuynh hướng tiến trình tự nhiên của MI có bất thường hệ thống dẫn truyền thường liên quan đến phục hồi dẫn truyền – nên tránh tạo nhịp độ sớm và không cần thiết (S8.3-1, S8.3-4, S8.3-7, S8. 3-12). Mặc dù cấy PPM là một thủ thuật tim có nguy cơ tương đối thấp, các biến chứng gồm tử vong nằm trong khoảng từ 3% đến 7% và có biến chứng lâu dài có ý nghĩa đối với các hệ thống tạo nhịp sử dụng dây qua đường tĩnh mạch (S8.3-13, S8.3-16).
6. Mặc dù chấn thương hệ thống bó (fascicular) trong bối cảnh MI cấp tính cho thấy tổn thương cơ tim đáng kể (thường là do nhồi máu thành trước), bệnh nhân bị tổn thương nhánh bó (bundle braches) hoặc bó (fascucular) đơn giản không được biểu hiện.
8.4. Các rối loạn thần kinh
Một số rối loạn thần kinh có thể liên quan đến nhịp tim chậm, ví dụ tăng áp lực nội sọ (thường được gọi là phản xạ Cushing) (S8.4-1). Trong tình huống này, nhịp tim chậm có thể được điều trị như được mô tả trong các phần điều chỉnh cấp tính (Phần 5.4. Và 6.3.) Nếu cần hỗ trợ tạo nhịp tim. Trong quá trình điều trị mãn tính các rối loạn thần kinh, nhịp tim chậm có thể được quan sát trong một số tình huống. Các khuyến cáo chung cho việc điều chỉnh liên quan đến tim ở bệnh nhân rối loạn thần kinh cơ gồm các khuyến cáo về giám sát và điều chỉnh y tế đã được cung cấp trong một tuyên bố khoa học của AHA gần đây (S8.4-2). Các khuyến cáo cụ thể về tạo nhịp độ vĩnh viễn trong bối cảnh rối loạn thần kinh tiến triển ảnh hưởng đến dẫn truyền nhĩ thất và trong thất đã được thảo luận trong Phần 6.4.4. và 7.5. trong tài liệu này và những cân nhắc đặc biệt về tạo nhịp vĩnh viễn ở các bệnh nhân mắc bệnh thần kinh cơ được tóm tắt trong Bảng S4 trong trang web Bổ sung. Tổn thương tủy sống do chấn thương trên tủy sống ngực thứ sáu có thể gây ra rối loạn phản xạ tự động được đặc trưng bằng suy giảm giao cảm và đáp ứng phó giao cảm được bảo tồn qua thần kinh phế vị. Nhịp tim chậm nhiều có thể được kích hoạt bằng các kích thích có hại như đặt catheter bàng quang (S8.4-3). Trong một nghiên cứu tiền cứu đa trung tâm với 315 bệnh nhân bị chấn thương tủy sống, nhịp tim chậm chiếm khoảng 50% các biến chứng tim mạch quan sát được (S8.4-4). Vì nhịp tim chậm được thoái lui sau một vài tuần hoặc loại bỏ các kích thích có hại, điều trị bảo tồn thường thành công trong việc kiểm soát nhịp tim chậm. Tuy nhiên, trong một số trường hợp có thể tránh được nhịp tim chậm có triệu chứng bằng các biện pháp bảo tồn, tạo nhịp vĩnh viễn có thể được xem xét bằng cách sử dụng các khuyến cáo tiêu chuẩn cho việc cấy được nêu trong phần 5.5.4 và 6.4.4.
8.4.1. Động kinh (Epilepsy)
|
Các khuyến cáo cho các bệnh nhân động kinh và nhịp tim chậm có triệu chứng Các nghiên cứu tham khảo ủng hộ khuyến cáo được tóm tắt trong tư liệu hỗ trợ trực tuyến 55. |
||
|
COR |
LOE |
Khuyến cáo |
|
IIa |
C-LD |
1. Ở các bệnh nhân động kinh được kết hợp với nhịp tim chậm có triệu chứng nặng (nhịp tim chậm liên quan đến co giật) ở đó các thuốc chống động kinh không có hiệu quả, tạo nhịp vĩnh viễn là phù hợp cho giảm độ nặng của các triệu chứng (S8.4.1-1–S8.4.1-4). |
Tóm tắt
Trong khoảng 0,15% đến 0,3% bệnh nhân bị động kinh, nhịp tim chậm nhiều có thể được quan sát và thường được gọi là vô tâm thu do co giất (ictal asystole) (S8.4.1-1, S8.4.1-3). Rối loạn nhịp tim có thể là do hoặc ngưng nút xoang hoặc block tim hoàn toàn và thường liên quan nhất đến nguồn động kinh thùy thái dương (S8.4.1-1, S8.4.1-4). Hỗ trợ tần số ở những bệnh nhân bị nhịp tim chậm nhiều trong cơn động kinh về mặt lý thuyết có thể làm giảm mức độ nghiêm trọng của ngất có liên quan.
Văn bản hỗ trợ khuyến cáo riêng biệt
1. Tạo nhịp vĩnh viễn đã được đánh giá ở một số lượng nhỏ bệnh nhân bị nhịp tim chậm đáng kể liên quan đến động kinh được xác định từ cơ sở dữ liệu lớn (S8.4.1-1, S8.4.1-3). Mặc dù nhịp tim chậm được định nghĩa phổ biến nhất là khoảng ngưng > 3 giây và tăng gấp 2 lần trong khoảng RR trước đó, nhưng trong thực tế, khoảng ngưng dài hơn nhiều, thông thường với thời gian > 10 giây và 1 nghiên cứu cho thấy ngất chỉ xảy ra với vô tâm thu > 6 giây. Trong các nghiên cứu này với tạo nhịp độ theo dõi bị hạn chế dường như có lợi cho việc giảm các triệu chứng ngất liên quan đến động kinh (S8.4.1-1, S8.4.1-4). Điều trị hiệu quả các cơn động kinh bằng thuốc chống động kinh hoặc phẫu thuật cũng đưa đến làm giảm khả năng ngất do nhịp tim chậm và nên được xem xét trước khi cấy PPM (S8.4.1-4, S8.4.1-5). Hỗ trợ tần số với PPM sẽ không ảnh hưởng đến bất kỳ tác dụng giãn mạch đi kèm nào liên quan đến động kinh.
9. Đánh giá các nguy cơ cho loạn nhịp thất ở các bệnh nhân đòi hỏi tạo nhịp vĩnh viễn
|
Các khuyến cáo cho điều chỉnh nhịp tim chậm và bệnh tổ chức dẫn truyền ở các bệnh nhân đòi hỏi điều trị tạo nhịp và có thể cũng là nguy cơ cho rối loạn nhịp thất Các nghiên cứu tham khảo hỗ trợ được tóm tắt trong tư liệu hỗ trợ trực tuyến 56. |
||
|
COR |
LOE |
Khuyến cáo |
|
I |
B-NR |
1. Ở các bệnh nhân đòi hởi điều trị tạo nhịp vĩnh viễn, trước khi cấy, đánh giá nguy cơ rối loạn nhịp thất trong tương lại và cần thiết cho ICD nên được thực hiện (S9-1–S9-7). |
Tóm tắt
Một số bệnh nhân cần hoặc có thể được hưởng lợi từ điều trị tạo nhịp cũng có thể có nguy cơ bị rối loạn nhịp thất và nên được xem xét sử dụng một thiết bị điều trị nhịp tim chậm và / hoặc bệnh tổ chức dẫn truyền và cả liệu pháp ICD (S9-8, S9-9). Ví dụ, bệnh nhân bị nhịp tim chậm có triệu chứng gây ra do block nhĩ thất cũng có triệu chứng suy tim và LVEF ≤ 35%, loạn trương lực cơ tim, bệnh cơ tim lamin A / C, sarcoidosis tim hoặc bệnh cơ tim phì đại có nguy cơ rối loạn nhịp thất và đột tử tim và có thể có lợi ích từ thiết bị có khả năng tạo nhịp chống nhịp nhanh và khử rung tim (S9-1, S9-5, S9-9). Mặc dù ICD được thiết kế để điều trị rối loạn nhịp thất dai dẳng, các ICD có liên quan đến tăng nguy cơ biến chứng so với PPM và trong một số trường hợp, tiên lượng bị chi phối bởi các di chứng không liên quan đến chứng loạn nhịp tim của bệnh tiềm ẩn (S9-2, S9-4, S9 -6).
Văn bản hỗ trợ khuyến cáo riêng biệt
1. Một số bệnh nhân cần hoặc có thể được hưởng lợi từ điều trị tạo nhịp cũng có thể có nguy cơ bị rối loạn nhịp thất và ICD nên xem xét (S9-1, S9-7). Trước khi cấy ghép thiết bị tim để điều trị các triệu chứng liên quan đến nhịp tim chậm hoặc bệnh tổ chức dẫn truyền, nên đánh giá riêng về nguy cơ đột tử tim do rối loạn nhịp thất. Lựa chọn thiết bị cuối cùng nên được đưa ra sau khi thảo luận toàn diện về lợi ích và rủi ro tương đối và lựa chọn cá nhân dựa trên các nguyên tắc chia sẻ ra quyết định (S9-9).
10. Cân nhắc chi phí và giá trị
Chi phí máy tạo nhịp có thể là một thách thức để biểu thị đặc biệt, bởi vì sự thay đổi trong cả chi phí, bồi hoàn và loại thiết bị (một buồng so với hai buồng, sự hiện diện của các khả năng của ICD hoặc CRT); Trung tâm Dịch vụ Chăm sóc y tế & Cấp cứu y khoa báo cáo ở mức tiểu bang các khoản phí thay đổi từ $ 20,753 đến $ 78,140 và khoản bồi hoàn thay đổi từ $ 11,411 đến $ 19,577 ở Hoa Kỳ và các hệ thống có > 1 dây đắt hơn hệ thống đơn buồng (S10-1) . Tính toán hiệu quả chi phí gia tăng của các hệ thống tạo nhịp kép trên các hệ thống buồng đơn thay đổi theo cả ước tính cụ thể về lợi ích về chi phí và tuổi thọ được điều chỉnh theo chất lượng (S10-2 miếng S10-6). Tại Hoa Kỳ, dựa trên dữ liệu từ thử nghiệm MOST, tỷ lệ hiệu quả chi phí gia tăng ngắn hạn (chênh lệch chi phí giữa 2 liệu pháp chia cho chênh lệch hiệu quả hoặc tỷ lệ hiệu quả chi phí gia tăng đối với máy tạo nhịp hai buồng so với thiết bị một buồng là 53.000 đô la, nhưng được xem xét trong suốt cuộc đời, tỷ lệ hiệu quả chi phí gia tăng là 6.800 đô la mỗi năm sống được điều chỉnh chất lượng (S10-6). Phần lớn được điều khiển bởi dữ liệu từ DANPACE (Nghiên cứu ngẫu nhiên đa trung tâm của Đan Mạch về tạo nhịp AAI đối lại với DDD trong hội chứng nút xoang bệnh) (S10-7), các thiết bị hai buồng trong một nghiên cứu khác được cho là có hiệu quả chi phí nhiều hơn so với các thiết bị một buồng qua phạm vị của ngưỡng “sẵn sàng để trả” (willingness to pay) và trong hầu hết các tình huống, đặc biệt là ở người già bệnh nhân có gánh nặng cao hơn đồng bệnh suất (S10-8), chủ yếu là do nguy cơ mổ lại > 20% đối với hội chứng máy tạo nhịp tim ở những bệnh nhân có thiết bị một buồng.
11. Ra quyết định được chia sẻ
|
Các khuyến cáo cho ra quyết định được chia sẻ cho cấy máy tạo nhịp trong tình huống các chỉ định được dựa trên các hướng dẫn cho tạo nhịp nhịp tim chậm |
||
|
COR |
LOE |
Các khuyến cáo |
|
I |
C-LD |
1. Ở các bệnh nhân bị nhịp tim chậm có triệu chứng hoặc rối loạn dẫn truyền, bác sĩ lâm sàng và bệnh nhân nên tham gia vào cách tiếp cận chia sẻ ra quyết định chung, trong đó quyết định điều trị không chỉ dựa trên bằng chứng tốt nhất, mà còn dựa trên mục tiêu chăm sóc, sở thích và giá trị của bệnh nhân (S11-1, S11-6). |
|
I |
C-LD |
2. Bệnh nhân đang cân nhắc cấy máy tạo nhịp tim hoặc với máy tạo nhịp cần được chỉnh sửa dây hoặc thay máy phải được thông báo về các lợi ích và nguy cơ về thủ thuật, gồm các biến chứng ngắn hạn và dài hạn và liệu pháp thay thế có thể, nếu có, theo mục tiêu chăm sóc, ưa thích và các giá trị của họ (S11-1, S11-6). |
|
III: No Benefit |
C-LD |
3. Ở những bệnh nhân có chỉ định điều trị tạo nhịp tim vĩnh viễn nhưng cũng có những bệnh đi kèm đáng kể điều trị tạo nhịp không có khả năng mang lại lợi ích lâm sàng có ý nghĩa, hoặc nếu các mục tiêu chăm sóc điều trị máy tạo nhịp để phòng ngừa mạnh mẽ, việc cấy hoặc thay máy tạo nhịp không nên được thực hiện (S11-1 – S11-6). |
Tóm tắt
Quyết định cấy máy tạo nhịp tim nên được chia sẻ giữa bệnh nhân và bác sĩ lâm sàng, sử dụng các nguyên tắc của việc ra quyết định chung, và dựa trên các chỉ định lâm sàng, xem xét các nguy cơ và lợi ích cá nhân dựa trên tình trạng đồng bệnh suất và tiên lượng chung, và các sự ưu thích và các mục tiêu chăm sóc của bệnh nhân. Hậu quả tiềm tàng và các vấn đề điều chỉnh dây tiềm tàng trong tương lai (nếu có thể) nên được thảo luận với bệnh nhân và gia đình cùng với những cân nhắc tiềm tàng lúc cuối đời (S11-7, S11-8).
Văn bản hỗ trợ khuyến cáo riêng biệt
1. Cân nhắc sở thích của bệnh nhân là điều cần thiết cho các quyết định điều chỉnh. Sở thích của bệnh nhân cả đối với và chấp nhận nguy cơ thủ thuật và nguy cơ dài hạn và lợi ích của các điều trị xâm lấn khác nhau và có thể tiến triển trong suốt quá trình điều trị bệnh. Ủy ban soạn thảo hướng dẫn nhịp tim chậm tán thành việc ra quyết định chung như là một phần của việc chăm sóc chung cho bệnh nhân nhịp tim chậm có triệu chứng. Một định nghĩa thường được chấp nhận về việc ra quyết định chung (S11-9) gồm 4 thành phần: 1) ít nhất 2 người tham gia, bác sĩ lâm sàng và bệnh nhân; 2) cả hai người tham gia chia sẻ thông tin với nhau; 3) cả hai bên xây dựng sự đồng thuận về việc điều trị ưu tiên; và 4) đạt được thỏa thuận về việc điều trị để thực hiện. Chia sẻ quyết định không có nghĩa là cung cấp cho bệnh nhân một danh sách các rủi ro và lợi ích và bảo họ đưa ra quyết định. Một thực tế mà một số tác giả đã gọi là “sự ủy phó” (abandonment) (S11-10). Nếu thời gian cho phép, bệnh nhân nên được chuyển đến tài liệu đáng tin cậy hỗ trợ và đưa ra những cân nhắc phù hợp cần được đưa vào quá trình ra quyết định. Đáng chú ý, một khuyến cáo chỉ dựa trên bằng chứng hoặc hướng dẫn không được chia sẻ quyết định. Thay vào đó, một khuyến cáo dựa trên cả bằng chứng cũng như sự hiểu biết về bệnh nhân Mục tiêu, sở thích và giá trị sức khỏe của bệnh nhân là điều cần thiết để đạt được quyết định chia sẻ thực sự.
2. Cấy máy tạo nhịp hoặc chỉnh sửa là các thủ thuật tim thường được thực hiện và thường không liên quan đến nguy cơ thủ thuật cao ở hầu hết bệnh nhân. Tuy nhiên, do cấy hoặc điều chỉnh máy tạo nhịp thường được thực hiện ở những bệnh nhân cao tuổi mắc nhiều bệnh kèm theo, yếu sức và có nguy cơ tử vong, các tác dụng phụ như tràn khí màng phổi và chèn ép tim có thể làm phức tạp thủ thuật. Một cuộc thảo luận kỹ lưỡng nên diễn ra với bệnh nhân trước khi tiến hành phác thảo các lợi ích và nguy cơ cụ thể của từng bệnh nhân, gồm cả ý nghĩa của việc sống với cấy một thiết bị điện sinh lý gồm thảo luận về các mục tiêu, sở thích và giá trị sức khỏe của bệnh nhân. Đối với một số bệnh nhân, điều trị tạo nhịp có thể ảnh hưởng đến khả năng sử dụng.
3. Bệnh nhân có tình trạng đồng bệnh suất đáng kể có thể không nhận được lợi ích được dự kiến của hỗ trợ tạo nhịp hoặc cải thiện QOL. Tương tự, ở những bệnh nhân được dự kiến sẽ rút ngắn tuổi thọ vì bệnh tiến triển giai đoạn cuối (bao gồm chứng mất trí tiến triển, ung thư di căn với tử vong dự đoán trước mắt hoặc các tình huống tương tự với tiên lượng xấu), lợi ích của việc hỗ trợ tạo nhịp có thể không được nhận ra và không có khả năng tác động tích cực đến kết quả chung. Mặc dù nguy cơ của cấy máy tạo nhịp tim tương đối thấp, tỷ lệ nguy cơ lợi ích không thuận lợi nếu lợi ích có thể xảy ra cũng khá thấp (S11-11). Những ưu và nhược điểm này có thể được thảo luận với bệnh nhân, với sự cho phép của bệnh nhân một cuộc thảo luận về quá trình và quyết định của bệnh nhân cần được tạo điều kiện với gia đình, hoặc gia đình bệnh nhân hay thay thế nếu bệnh nhân không có năng lực.
12. Chất lượng cuộc sống
Trong số các bệnh nhân với chỉ định cấy PPM để hoặc ra quyết định được chia sẻ hoặc block nhĩ thất, QOL cải thiện đáng kể sau khi cấy máy tạo nhịp tim (S12-1, S12-5), nhưng lợi ích của các chế độ tạo nhịp khác nhau (như tạo nhịp hai buồng so với tạo nhịp hai buồng ) không nhất quán. Trong thử nghiệm CTOPP, chẳng hạn, không có sự khác biệt đáng kể về cải thiện QOL giữa bệnh nhân có nhịp hai buồng và nhịp đơn buồng (S12-4). Tuy nhiên, trong thử nghiệm PASE, mặc dù không có lợi ích chung của hai buồng so với tạo nhịp một buồng theo QOL, nhưng nhịp hai buồng dường như dẫn đến QOL tốt hơn trong nhóm phụ với việc ra quyết định chung (S12-3). Trong thử nghiệm MOST, ngoài lợi ích của ít AF và suy tim, tạo nhịp tim hai buồng có liên quan đến những cải thiện khiêm tốn ở một số chỉ số QOL, đặc biệt là ở những bệnh nhân trẻ tuổi (S12-1, S12-2). Trong các nghiên cứu chéo nhỏ, cải thiện các biện pháp QOL đã được tìm thấy với tạo nhịp hai buồng ở một số (S12-6 bồi S12-9), nhưng không phải tất cả các nghiên cứu (S12-10). Trong nghiên cứu quan sát FOLLOWPACE không ngẫu nhiên, qua thời gian theo dõi trung bình 7,5 năm, tạo nhịp có liên quan đến sự cải thiện QOL dài hạn, nhưng không có sự khác biệt rõ ràng dựa trên chế độ tạo nhịp (S12-5).
13. Ngừng điều trị tạo nhịp
|
Các khuyến cáo cho việc ngừng điều trị tạo nhịp |
||
|
COR |
LOE |
Các khuyến cáo |
|
IIa |
C-LD |
1. Ở các bệnh nhân biểu hiện thay máy tạo nhịp, hoặc điều chỉnh các biến chứng liên quan đến máy, ở người có chỉ định tạo nhịp ban đầu đã được giải quyết hoặc nghi ngờ, ngừng điều trị tạo nhịp là phù hợp sau khi đánh giá triệu chứng trong quá trình giai đoạn theo dõi trong khi tạo nhịp được tắt |
Tóm tắt
Các khuyến cáo trước đây đã được cung cấp để cấy PPM (S13-3). Tuy nhiên, quyết định không thay máy tạo nhịp tim là khó khăn hơn. Không có hướng dẫn nào trước đây để loại bỏ PPM và chấm dứt tạo nhịp tim dài hạn. Nói chung, hầu hết các bệnh nhân có máy tạo nhịp tim khi hết tuổi thọ pin hoặc bị trục trặc thiết bị hoặc dây đều trải qua thay thế hoặc sửa đổi mà không đặt câu hỏi về sự cần thiết phải tiếp tục tạo nhịp. Tuy nhiên, các bác sĩ thỉnh thoảng gặp phải bệnh nhân được phẫu thuật tạo nhịp tim hoặc với các biến chứng liên quan đến máy tạo nhịp tim dường như không có nhu cầu tạo nhịp liên tục vì chỉ định ban đầu không rõ ràng, nghi vấn hoặc dường như đã được giải quyết (S13-4, S13-5). Hơn nữa, một số nghiên cứu đã ước tính khoảng 30% máy tạo nhịp tim đã được cấy ngoài các chỉ định class I và IIa (S13-4, S13-6). Trong nhóm bệnh nhân này, trong đó nhu cầu về tạo nhịp liên tục được đặt câu hỏi, quá trình cần thiết để ngừng điều trị tạo nhịp là không rõ ràng. Mặc dù quyết định không thay máy tạo nhịp tim là một điều khó khăn, đặc biệt do lịch sử tự nhiên của nhịp tim chậm có thể không dự đoán được, nó phải được cân bằng trước nguy cơ biến chứng liên quan đến máy tạo nhịp tim trong suốt cuộc đời. Ở những bệnh nhân như vậy, các lựa chọn ngừng điều trị tạo nhịp tim có thể gồm lập trình cho máy tạo nhịp tim, tắt chức năng không thay thế của một thiết bị sắp hết tuổi thọ pin, lấy bỏ máy phát xung đơn thuần và trong một số trường hợp, lấy bỏ máy phát xung và tháo bỏ dây.
Văn bản hỗ trợ khuyến cáo riêng biệt
1. Trong một nghiên cứu, 5 bệnh nhân được chỉ định thay máy tạo nhịp tim hoặc biến chứng liên quan đến máy điều hòa nhịp tim trong đó chỉ định ban đầu về tạo nhịp tim dường như đã được giải quyết, nhịp nội tại đã được ghi nhận và 2 được thực hiện EPS (S13-1). Các máy tạo nhịp đã được lấy bỏ ở tất cả 5 bệnh nhân và không ai bị nhịp tim chậm có triệu chứng sau 18 đến 48 tháng theo dõi (S13-1). Một nhóm các nhà điều tra đã phát triển một giao thức được sử dụng để ngừng điều trị tạo nhịp ở 70 bệnh nhân mà không có chỉ định rõ ràng ban đầu hoặc liên tục. Giao thức bao gồm đánh giá lâm sàng, siêu âm tim, kiểm tra test gắng sức và kiểm tra bàn nghiêng. Nếu các xét nghiệm này âm tính, năng lượng của bộ tạo xung đã bị tắt, với việc theo dõi điện tâm đồ trong vòng 24 giờ định kỳ trong vòng 1 năm, sau đó tiến hành EPS. Trong số 70 bệnh nhân, 35 người đã được lấy bỏ máy tạo nhịp tim; sau 30,3 tháng theo dõi trung bình, tất cả các bệnh nhân vẫn không có triệu chứng, ngoại trừ 1 bệnh nhân tử vong do nguyên nhân không do tim (S13-2). Trong một nghiên cứu hồi cứu những bệnh nhân trải qua quá trình lấy bỏ điện cực mà không thay thế thiết bị, tỷ lệ tử vong dường như phụ thuộc vào tình trạng bệnh đi kèm và tử vong liên quan đến rối loạn nhịp tim là rất hiếm (S13-7)
14. Các xem xét kết thúc cuộc sống
Các chuyên gia chăm sóc sức khỏe thường xuyên phải đối mặt với các câu hỏi về việc ngừng hoạt động của máy tạo nhịp tim ở những bệnh nhân gần cuối đời. Mặc dù bệnh nhân và gia đình thường lo sợ máy tạo nhịp tim sẽ kéo dài quá trình tử vong, nhưng các nghiên cứu cho thấy nhiều bác sĩ báo cáo sự không thoải mái với các cuộc trò chuyện liên quan đến quản lý thiết bị vào cuối đời, với nhiều bác sĩ cảm thấy khó chịu hơn khi tắt máy tạo nhịp tim so với máy khử rung tim (S14-1). Do đó, hiểu được các vấn đề pháp lý, đạo đức và thực tế liên quan đến việc ngừng hoạt động của máy tạo nhịp tim là bắt buộc. Chủ đề này đã được đề cập rộng rãi trong một tuyên bố đồng thuận HRS; do đó, chỉ có một bản tóm tắt các vấn đề quan trọng nhất được cung cấp ở đây (S14-2).
Từ quan điểm pháp lý và đạo đức, một bệnh nhân có khả năng ra quyết định hoặc người thay thế được xác định hợp pháp, có quyền từ chối hoặc yêu cầu rút bất kỳ điều trị hoặc can thiệp y tế nào, kể cả máy tạo nhịp tim, bất kể việc điều trị có kéo dài cuộc sống và việc ngừng máy có thể gây tử vong. Việc rút lại một can thiệp y tế duy trì sự sống với sự đồng ý của bệnh nhân hoặc người thay thế hợp pháp không nên được coi là tự tử có sự trợ giúp của bác sĩ và việc tôn trọng các yêu cầu này nên được coi là một khía cạnh không thể thiếu trong chăm sóc bệnh nhân làm trung tâm (S14-3). Cũng như các quyết định xung quanh việc cấy máy tạo nhịp tim, các quyết định này nên được bệnh nhân hoặc người thay thế được xác định hợp pháp và bác sĩ cùng sử dụng các nguyên tắc ra quyết định chung thực hiện.
Các bác sĩ nên làm rõ cho bệnh nhân hoặc người thay thế được xác định hợp pháp và gia đình của họ về hậu quả mong đợi của việc ngừng hoạt động của máy tạo nhịp tim. Bệnh nhân và gia đình của họ có thể sai lầm khi nghĩ máy tạo nhịp tim có thể kéo dài quá trình chết và do đó kéo dài sự đau khổ. Tuy nhiên, nói chung, máy tạo nhịp tim không giữ bệnh nhân đang chết, vì các sự kiện ở giai đoạn cuối thường do nhiều tình trạng lâm sàng khác gây ra, như ung thư và tại thời điểm tử vong, máy tạo nhịp tim cuối cùng sẽ không bắt được cơ tim khiến nó không liên quan. Do đó các nhịp của máy điều hòa nhịp tim không gây đau đớn, trong hầu hết các trường hợp, việc ngừng tạo nhịp tim là không cần thiết và việc trấn an bệnh nhân và gia đình ngoài việc tắt monitoring theo dõi tim có thể là tất cả những gì cần thiết. Nếu quyết định được đưa ra để hủy kích hoạt máy tạo nhịp tim, bệnh nhân tử vong có thể theo dõi ngay sau khi ngừng điều trị tạo nhịp tim nếu bệnh nhân phụ thuộc hoàn toàn vào máy điều hòa nhịp tim. Tuy nhiên, ở những người không phụ thuộc vào máy tạo nhịp tim, quá trình tử vong có thể không thể đoán trước. Tắt máy tạo nhịp tim có thể dẫn đến sự khó chịu thêm; do đó, bệnh nhân phải được theo dõi chặt chẽ các triệu chứng tiềm ẩn, chẳng hạn như suy hô hấp, có thể cần tăng cường các biện pháp chăm sóc thoải mái.
Khử hoạt động của máy tạo nhịp tim đòi hỏi phải có lệnh bằng văn bản từ bác sĩ có trách nhiệm, kèm theo đó là lệnh không hồi sức. Tài liệu bổ sung trong hồ sơ bệnh án phải bao gồm xác nhận bệnh nhân (hoặc người thay thế hợp pháp) đã yêu cầu hủy kích hoạt thiết bị, khả năng của bệnh nhân để đưa ra quyết định hoặc xác định người thay thế phù hợp và tài liệu về các liệu pháp thay thế cũng như tài liệu về hậu quả của việc ngừng hoạt động đã được thảo luận (S14-2). Chăm sóc giảm nhẹ và hỗ trợ y tế nên được cung cấp cho bệnh nhân và gia đình để mang lại sự thoải mái khi xem xét các triệu chứng tiềm ẩn có thể phát sinh. Tiếp cận giáo sĩ (hoặc giáo sĩ đoàn) nên được cung cấp và cung cấp theo niềm tin tôn giáo cá nhân của bệnh nhân. Nếu bác sĩ yêu cầu hủy kích hoạt một thiết bị có niềm tin tôn giáo hoặc đạo đức cấm anh ta hoặc cô ta thực hiện việc hủy kích hoạt thiết bị, anh ta hoặc cô ta không nên bị buộc phải làm như vậy, và thay vào đó, bệnh nhân nên được giới thiệu đến một bác sĩ khác có khả năng và sẵn lòng.
Lý tưởng nhất là các nhà cung cấp và hệ thống chăm sóc sức khỏe cho bệnh nhân tạo nhịp tim nên có các quy trình thay thế cho việc tắt thiết bị khi đến lúc. Cuộc trò chuyện liên quan đến các vấn đề cuối đời nên một cách lý tưởng bắt đầu vào thời điểm cấy thiết bị, hoặc sớm trong giai đoạn đầu của bệnh nan y. Các bác sĩ lâm sàng nên khuyến khích bệnh nhân cấy thiết bị để hoàn thành các chỉ thị nâng cao và đặc biệt giải quyết vấn đề quản lý và hủy kích hoạt thiết bị nếu bệnh nhân bị bệnh nan y.
15. Các khoảng trống kiến thức và nghiên cứu tương lai
Những lỗ hổng trong cách hiểu về điều chỉnh nhịp tim chậm vẫn còn, đặc biệt là trong vai trò phát triển và công nghệ phát triển để tạo nhịp. Tạo nhịp tim bó His là một lĩnh vực đang được quan tâm và đặc biệt có liên quan ở những bệnh nhân cần tạo nhịp thất nhiều, nhưng kết quả lâu dài cho phương pháp này ở các quần thể bệnh nhân lớn vẫn còn chưa chắc chắn (S15-1, S15-2). Vai trò của tạo nhịp giữa các bệnh nhân bị nhịp tim chậm thoáng qua với ngất qua trung gian phản xạ ngoài những bệnh nhân có vô tâm thu tạm thời được chứng minh bằng tư liệu cũng không chắc chắn (S15-3, S15-4). Mặc dù tạo nhịp tim đồng bộ có liên quan đến sự cải thiện kết quả ở những bệnh nhân bị block nhĩ thất và suy tim nói chung (S15-5, S15-6), vai trò của tái đồng bộ tim ở nhóm phụ của bệnh nhân có LVEF> 35% vẫn chưa được hiểu rõ. Các giá trị tương đối của tạo nhịp bó His, tái đồng bộ tim hoặc các chiến lược tạo nhịp khác để duy trì hoặc cải thiện chức năng tâm thất trái ở bệnh nhân có khối nhĩ thất là không rõ. Ngoài ra, tạo nhịp với các thiết bị hoàn toàn không dây cũng là một lĩnh vực đang được quan tâm (S15-7, S15-8), nhưng vai trò của các thiết bị mới này trong thực tế trong thế giới thực và tương tác tiềm năng của chúng với các thiết bị tim khác vẫn chưa rõ ràng. Bất kể công nghệ là gì, trong tương lai gần, liệu pháp tạo nhịp đòi hỏi phải cấy thiết bị y tế và các nghiên cứu trong tương lai sẽ được yêu cầu tập trung vào các tác động lâu dài liên quan đến trị liệu suốt đời.
Tài liệu tham khảo
7. Rối loạn dẫn truyền (với dẫn truyền nhĩ thất 1:1)
7.4. Đánh giá rối loạn dẫn truyền
S7.4-1. Fahy GJ, Pinski SL, Miller DP, et al. Natural history of isolated bundle branch block. Am J Cardiol. 1996;77:1185-90.
S7.4-2. Schneider JF, Thomas HE Jr, Kreger BE, et al. Newly acquired left bundle-branch block: the Framingham study. Ann Intern Med. 1979;90:303-10.
S7.4-3. Talreja D, Gruver C, Sklenar J, et al. Efficient utilization of echocardiography for the assessment of left ventricular systolic function. Am Heart J. 2000;139:394-8.
S7.4-4. Barrett PM, Komatireddy R, Haaser S, et al. Comparison of 24-hour Holter monitoring with 14-day novel adhesive patch electrocardiographic monitoring. Am J Med. 2014;127:95.e11-7.
S7.4-5. Brown AP, Dawkins KD, Davies JG. Detection of arrhythmias: use of a patient-activated ambulatory electrocardiogram device with a solid-state memory loop. Br Heart J. 1987;58:251-3.
S7.4-6. Joshi AK, Kowey PR, Prystowsky EN, et al. First experience with a mobile cardiac outpatient telemetry (MCOT) system for the diagnosis and management of cardiac arrhythmia. Am J Cardiol. 2005;95:878-81.
S7.4-7. Locati ET, Moya A, Oliveira M, et al. External prolonged electrocardiogram monitoring in unexplained syncope and palpitations: results of the SYNARR-Flash study. Europace. 2016;18:1265-72.
S7.4-8. Reiffel JA, Schwarzberg R, Murry M. Comparison of autotriggered memory loop recorders versus standard loop recorders versus 24-hour Holter monitors for arrhythmia detection. Am J Cardiol. 2005;95:1055-9.
S7.4-9. Rothman SA, Laughlin JC, Seltzer J, et al. The diagnosis of cardiac arrhythmias: a prospective multi-center randomized study comparing mobile cardiac outpatient telemetry versus standard loop event monitoring. J Cardiovasc Electrophysiol. 2007;18:241-7.
S7.4-10. Sivakumaran S, Krahn AD, Klein GJ, et al. A prospective randomized comparison of loop recorders versus Holter monitors in patients with syncope or presyncope. Am J Med. 2003;115:1-5.
S7.4-11. Turakhia MP, Hoang DD, Zimetbaum P, et al. Diagnostic utility of a novel leadless arrhythmia monitoring device. Am J Cardiol. 2013;112:520-4.
S7.4-12. Chiu DT, Shapiro NI, Sun BC, et al. Are echocardiography, telemetry, ambulatory electrocardiography monitoring, and cardiac enzymes in emergency department patients presenting with syncope useful tests? A preliminary investigation. J Emerg Med. 2014;47:113-8.
S7.4-13. Douglas PS, Garcia MJ, Haines DE, et al. ACCF/ASE/AHA/ASNC/HFSA/HRS/SCAI/SCCM/SCCT/SCMR 2011 appropriate use criteria for echocardiography: a report of the American College of Cardiology Foundation Appropriate Use Criteria Task Force, American Society of Echocardiography, American Heart Association, American Society of Nuclear Cardiology, Heart Failure Society of America, Heart Rhythm Society, Society for Cardiovascular Angiography and Interventions, Society of Critical Care Medicine, Society of Cardiovascular Computed Tomography, Society for Cardiovascular Magnetic Resonance American College of Chest Physicians. J Am Soc Echocardiogr. 2011;24:229-67.
S7.4-14. McAnulty JH, Rahimtoola SH, Murphy E, et al. Natural history of “high-risk” bundle-branch block: final report of a prospective study. N Engl J Med. 1982;307:137-43.
S7.4-15. Mahmod M, Karamitsos TD, Suttie JJ, et al. Prevalence of cardiomyopathy in asymptomatic patients with left bundle branch block referred for cardiovascular magnetic resonance imaging. Int J Cardiovasc Imaging. 2012;28:1133-40.
S7.4-16. Eriksson P, Hansson PO, Eriksson H, et al. Bundle-branch block in a general male population: the study of men born 1913. Circulation. 1998;98:2494-500.
S7.4-17. Aro AL, Anttonen O, Tikkanen JT, et al. Intraventricular conduction delay in a standard 12-lead electrocardiogram as a predictor of mortality in the general population. Circ Arrhythm Electrophysiol. 2011;4:704-10.
S7.4-18. Tiosano S, Hod H, Oberman B, et al. A three-decade survival analysis of intraventricular conduction delay in adults without ischemic heart disease. Am J Med. 2016;129:1219.e11-6.
S7.4-19. Steinberg JS, Varma N, Cygankiewicz I, et al. 2017 ISHNE-HRS expert consensus statement on ambulatory ECG and external cardiac monitoring/telemetry. Heart Rhythm. 2017;14:e55-96.
S7.4-20. Linzer M, Prystowsky EN, Divine GW, et al. Predicting the outcomes of electrophysiologic studies of patients with unexplained syncope: preliminary validation of a derived model. J Gen Intern Med. 1991;6:113-20.
S7.4-21. Mavrogeni S, Sfikakis PP, Karabela G, et al. Cardiovascular magnetic resonance imaging in asymptomatic patients with connective tissue disease and recent onset left bundle branch block. Int J Cardiol. 2014;171:82-7.
S7.4-22. Haataja P, Anttila I, Nikus K, et al. Prognostic implications of intraventricular conduction delays in a general population: the Health 2000 Survey. Ann Med. 2015;47:74-80.
S7.4-23. Bharati S, Dhingra RC, Lev M, et al. Conduction system in a patient with Prinzmetal’s angina and transient atrioventricular block. Am J Cardiol. 1977;39:120-5.
S7.4-24. Bobba P, Salerno JA, Casari A. Transient left posterior hemiblock. Report of four cases induced by exercise test. Circulation. 1972;46:931-8.
S7.4-25. Boran KJ, Oliveros RA, Boucher CA, et al. Ischemia-associated intraventricular conduction disturbances during exercise testing as a predictor of proximal left anterior descending coronary artery disease. Am J Cardiol. 1983;51:1098-102.
S7.4-26. Coplan NL, Morales MC, Romanello P, et al. Exercise-related atrioventricular block. Influence of myocardial ischemia. Chest. 1991;100:1728-30.
S7.4-27. Oliveros RA, Seaworth J, Weiland FL, et al. Intermittent left anterior hemiblock during treadmill exercise test. Correlation with coronary arteriogram. Chest. 1977;72:492-4.
S7.4-28. Virtanen KS, Heikkila J, Kala R, et al. Chest pain and rate-dependent left bundle branch block in patients with normal coronary arteriograms. Chest. 1982;81:326-31.
S7.4-29. Grady TA, Chiu AC, Snader CE, et al. Prognostic significance of exercise-induced left bundle-branch block. JAMA. 1998;279:153-6.
S7.4-30. Stein R, Nguyen P, Abella J, et al. Prevalence and prognostic significance of exercise-induced right bundle branch block. Am J Cardiol. 2010;105:677-80.
7.5. Điều chỉnh rối loạn dẫn truyền (với dẫn truyền nhĩ thất 1:1)
S7.5-1. Scheinman MM, Peters RW, Suave MJ, et al. Value of the H-Q interval in patients with bundle branch block and the role of prophylactic permanent pacing. Am J Cardiol. 1982;50:1316-22.
S7.5-2. Morady F, Higgins J, Peters RW, et al. Electrophysiologic testing in bundle branch block and unexplained syncope. Am J Cardiol. 1984;54:587-91.
S7.5-3. Kubis M, Svejda J. Indication of permanent pacing after acute myocardial infarction complicated by combined intraventricular block. Cor Vasa. 1982;24:295-301.
S7.5-4. Khambatta S, Nguyen DL, Beckman TJ, et al. Kearns-Sayre syndrome: a case series of 35 adults and children. Int J Gen Med. 2014;7:325-32.
S7.5-5. Polak PE, Zijlstra F, Roelandt JR. Indications for pacemaker implantation in the Kearns-Sayre syndrome. Eur Heart J. 1989;10:281-2.
S7.5-6. O’Mahony C, Coats C, Cardona M, et al. Incidence and predictors of anti-bradycardia pacing in patients with Anderson-Fabry disease. Europace. 2011;13:1781-8.
S7.5-7. Sene T, Lidove O, Sebbah J, et al. Cardiac device implantation in Fabry disease: a retrospective monocentric study. Medicine (Baltimore). 2016;95:e4996.
S7.5-8. Witt CM, Wu G, Yang D, et al. Outcomes with left bundle branch block and mildly to moderately reduced left ventricular function. JACC Heart Fail. 2016;4:897-903.
S7.5-9. Chung ES, Katra RP, Ghio S, et al. Cardiac resynchronization therapy may benefit patients with left ventricular ejection fraction >35%: a PROSPECT trial substudy. Eur J Heart Fail. 2010;12:581-7.
S7.5-10. Peters RW, Scheinman MM, Modin C, et al. Prophylactic permanent pacemakers for patients with chronic bundle branch block. Am J Med. 1979;66:978-85.
S7.5-11. DePasquale NP, Bruno MS. Natural history of combined right bundle branch block and left anterior hemiblock (bilateral bundle branch block). Am J Med. 1973;54:297-303.
S7.5-12. Gadler F, Valzania C, Linde C. Current use of implantable electrical devices in Sweden: data from the Swedish pacemaker and implantable cardioverter-defibrillator registry. Europace. 2015;17:69-77.
S7.5-13. Armaganijan LV, Toff WD, Nielsen JC, et al. Are elderly patients at increased risk of complications following pacemaker implantation? A meta-analysis of randomized trials. Pacing Clin Electrophysiol. 2012;35:131-4.
S7.5-14. Kusumoto FM, Schoenfeld MH, Wilkoff BL, et al. 2017 HRS expert consensus statement on cardiovascular implantable electronic device lead management and extraction. Heart Rhythm. 2017;14:e503-51.
S7.5-15. Lee JZ, Ling J, Diehl NN, et al. Mortality and cerebrovascular events after heart rhythm disorder management procedures. Circulation. 2018;137:24-33.
S7.5-16. Linzer M, Prystowsky EN, Divine GW, et al. Predicting the outcomes of electrophysiologic studies of patients with unexplained syncope: preliminary validation of a derived model. J Gen Intern Med. 1991;6:113-20.
S7.5-17. Epstein AE, DiMarco JP, Ellenbogen KA, et al. ACC/AHA/HRS 2008 guidelines for device-based therapy of cardiac rhythm abnormalities: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the ACC/AHA/NASPE 2002 Guideline Update for Implantation of Cardiac Pacemakers and Antiarrhythmia Devices). Developed in collaboration with the American Association for Thoracic Surgery and Society of Thoracic Surgeons. Circulation. 2008;117:e350–408.
S7.5-18. Moon JC, Sheppard M, Reed E, et al. The histological basis of late gadolinium enhancement cardiovascular magnetic resonance in a patient with Anderson-Fabry disease. J Cardiovasc Magn Reson. 2006;8:479-82.
S7.5-19. Shah JS, Hughes DA, Sachdev B, et al. Prevalence and clinical significance of cardiac arrhythmia in Anderson-Fabry disease. Am J Cardiol. 2005;96:842-6.
S7.5-20. Gold MR, Thebault C, Linde C, et al. Effect of QRS duration and morphology on cardiac resynchronization therapy outcomes in mild heart failure: results from the Resynchronization Reverses Remodeling in Systolic Left Ventricular Dysfunction (REVERSE) study. Circulation. 2012;126:822-9.
8. Các quần thể đặc biệt
8.1. Điều chỉnh quanh phẫu thuật
S8.1-1. Bougioukas I, Jebran AF, Grossmann M, et al. Is there a correlation between late re-exploration after cardiac surgery and removal of epicardial pacemaker wires? J Cardiothorac Surg. 2017;12:3.
S8.1-2. Gordon RS, Ivanov J, Cohen G, et al. Permanent cardiac pacing after a cardiac operation: predicting the use of permanent pacemakers. Ann Thorac Surg. 1998;66:1698-704.
S8.1-3. Peretto G, Durante A, Limite LR, et al. Postoperative arrhythmias after cardiac surgery: incidence, risk factors, and therapeutic management. Cardiol Res Pract. 2014;2014:615987.
S8.1-4. Wiggins NB, Chong DT, Houghtaling PL, et al. Incidence, indications, risk factors, and survival of patients undergoing cardiac implantable electronic device implantation after open heart surgery. Europace. 2017;19:1335-42.
8.1.1. Các bệnh nhân nguy cơ nhịp tim chậm trong quá trình phẫu thuật hoặc thủ thuật không phải tim
S8.1.1-1. Gauss A, Hubner C, Meierhenrich R, et al. Perioperative transcutaneous pacemaker in patients with chronic bifascicular block or left bundle branch block and additional first-degree atrioventricular block. Acta Anaesthesiol Scand. 1999;43:731-6.
S8.1.1-2. Im SH, Han MH, Kim SH, et al. Transcutaneous temporary cardiac pacing in carotid stenting: noninvasive prevention of angioplasty-induced bradycardia and hypotension. J Endovasc Ther. 2008;15:110-6.
S8.1.1-3. Marrocco-Trischitta MM, Mazzone P, Vitale R, et al. Temporary transvenous pacemaker implantation during carotid endarterectomy in patients with trifascicular block. Ann Vasc Surg. 2016;34:206-11.
S8.1.1-4. Morris D, Mulvihill D, Lew WY. Risk of developing complete heart block during bedside pulmonary artery catheterization in patients with left bundle-branch block. Arch Intern Med. 1987;147:2005-10.
S8.1.1-5. Unnikrishnan D, Idris N, Varshneya N. Complete heart block during central venous catheter placement in a patient with pre-existing left bundle branch block. Br J Anaesth. 2003;91:747-9.
S8.1.1-6. Cheung CC, Martyn A, Campbell N, et al. Predictors of intraoperative hypotension and bradycardia. Am J Med. 2015;128:532-8.
S8.1.1-7. Fritsch G, Flamm M, Hepner DL, et al. Abnormal pre-operative tests, pathologic findings of medical history, and their predictive value for perioperative complications. Acta Anaesthesiol Scand. 2012;56:339-50.
S8.1.1-8. Pereira ID, Grando MM, Vianna PT, et al. Retrospective analysis of risk factors and predictors of intraoperative complications in neuraxial blocks at Faculdade de Medicina de Botucatu-UNESP. Rev Bras Anestesiol. 2011;61:568-81, 311-8.
S8.1.1-9. Bauer AM, Smith RB, Thorell WE. Implications of carotid sinus hypersensitivity following preoperative embolization of a carotid body tumor. An indication for prophylactic intraoperative cardiac pacing. JAMA Otolaryngol Head Neck Surg. 2014;140:459-63.
S8.1.1-10. Chowdhury T, Ahuja N, Schaller B. Severe bradycardia during neurosurgical procedure: depth of anesthesia matters and leads to a new surrogate model of the trigeminocardiac reflex: a case report. Medicine (Baltimore). 2015;94:e2118.
S8.1.1-11. Lin JA, Borel CO, Wang WB, et al. Anesthetic management of an AAI pacemaker patient with paroxysmal atrial fibrillation during colorectal surgery. J Clin Anesth. 2006;18:372-5.
S8.1.1-12. Vimala S, Arulvelan A. Sudden bradycardia and hypotension in neurosurgery: trigeminocardiac reflex (TCR) and more. J Neurosurg Anesthesiol. 2016;28:175-6.
S8.1.1-13. Christensen RE, Reynolds PI, Bukowski BK, et al. Anaesthetic management and outcomes in patients with surgically corrected D-transposition of the great arteries undergoing non-cardiac surgery. Br J Anaesth. 2010;104:12-5.
S8.1.1-14. Yong J, Hibbert P, Runciman WB, et al. Bradycardia as an early warning sign for cardiac arrest during routine laparoscopic surgery. Int J Qual Health Care. 2015;27:473-8.
S8.1.1-15. Okamoto A, Inoue S, Tanaka Y, et al. Application of prophylactic gel-pads for transcutaneous pacing in patients with complete right bundle-branch block with axis deviation when surgical procedures are performed: 10-year experience from a single Japanese university hospital. J Anesth. 2009;23:616-9.
S8.1.1-16. Lehmann MH, Cameron A, Kemp HG Jr. Increased risk of ventricular fibrillation associated with temporary pacemaker use during coronary arteriography. Pacing Clin Electrophysiol. 1983;6:923-9.
S8.1.1-17. Gilchrist IC, Cameron A. Temporary pacemaker use during coronary arteriography. Am J Cardiol. 1987;60:1051-4.
8.1.2. Nhịp tim chậm sau phẫu thuật và rối loạn dẫn truyền sau ngoại khoa tim
S8.1.2-1. Socie P, Nicot F, Baudinaud P, et al. Frequency of recovery from complete atrioventricular block after cardiac surgery. Am J Cardiol. 2017;120:1841-6.
S8.1.2-2. Kiehl EL, Makki T, Matar RM, et al. Incidence and predictors of late atrioventricular conduction recovery among patients requiring permanent pacemaker for complete heart block after cardiac surgery. Heart Rhythm. 2017;14:1786-92.
8.1.2.1. Bắc cầu động mạch vành
S8.1.2.1-1. Caspi Y, Safadi T, Ammar R, et al. The significance of bundle branch block in the immediate postoperative electrocardiograms of patients undergoing coronary artery bypass. J Thorac Cardiovasc Surg. 1987;93:442-6.
S8.1.2.1-2. Cook DJ, Bailon JM, Douglas TT, et al. Changing incidence, type, and natural history of conduction defects after coronary artery bypass grafting. Ann Thorac Surg. 2005;80:1732-7.
S8.1.2.1-3. Mackstaller LL, Alpert JS. Atrial fibrillation: a review of mechanism, etiology, and therapy. Clin Cardiol. 1997;20:640-50.
S8.1.2.1-4. Ngaage DL, Schaff HV, Mullany CJ, et al. Does preoperative atrial fibrillation influence early and late outcomes of coronary artery bypass grafting? J Thorac Cardiovasc Surg. 2007;133:182-9.
S8.1.2.1-5. Puskas JD, Sharoni E, Williams WH, et al. Is routine use of temporary epicardial pacing wires necessary after either OPCAB or conventional CABG/CPB? Heart Surg Forum. 2003;6:E103-6.
S8.1.2.1-6. Satinsky JD, Collins JJ Jr, Dalen JE. Conduction defects after cardiac surgery. Circulation. 1974;50:Ii170-4.
S8.1.2.1-7. Tuzcu EM, Emre A, Goormastic M, et al. Incidence and prognostic significance of intraventricular conduction abnormalities after coronary bypass surgery. J Am Coll Cardiol. 1990;16:607-10.
S8.1.2.1-8. Yesil M, Bayata S, Arikan E, et al. Should we revascularize before implanting a pacemaker? Clin Cardiol. 2008;31:498-501.
S8.1.2.1-9. Zeldis SM, Morganroth J, Horowitz LN, et al. Fascicular conduction distrubances after coronary bypass surgery. Am J Cardiol. 1978;41:860-4.
S8.1.2.1-10. Bethea BT, Salazar JD, Grega MA, et al. Determining the utility of temporary pacing wires after coronary artery bypass surgery. Ann Thorac Surg. 2005;79:104-7.
S8.1.2.1-11. Bougioukas I, Jebran AF, Grossmann M, et al. Is there a correlation between late re-exploration after cardiac surgery and removal of epicardial pacemaker wires? J Cardiothorac Surg. 2017;12:3.
S8.1.2.1-12. Slogoff S, Keats AS, Ott E. Preoperative propranolol therapy and aortocoronary bypass operation. JAMA. 1978;240:1487-90.
S8.1.2.1-13. Imren Y, Benson AA, Oktar GL, et al. Is use of temporary pacing wires following coronary bypass surgery really necessary? J Cardiovasc Surg (Torino). 2008;49:261-7.
S8.1.2.1-14. Garcia-Bengochea JB, Fernandez AL, Calvelo DS, et al. Temporary epicardial left ventricular and biventricular pacing improves cardiac output after cardiopulmonary bypass. J Cardiothorac Surg. 2012;7:113.
S8.1.2.1-15. Russell SJ, Tan C, O’Keefe P, et al. Optimized temporary bi-ventricular pacing improves haemodynamic function after on-pump cardiac surgery in patients with severe left ventricular systolic dysfunction: a two-centre randomized control trial. Eur J Cardiothorac Surg. 2012;42:e146-51.
S8.1.2.1-16. Evonich RF, Stephens JC, Merhi W, et al. The role of temporary biventricular pacing in the cardiac surgical patient with severely reduced left ventricular systolic function. J Thorac Cardiovasc Surg. 2008;136:915-21.
S8.1.2.1-17. Navia JL, Atik FA, Grimm RA, et al. Minimally invasive left ventricular epicardial lead placement: surgical techniques for heart failure resynchronization therapy. Ann Thorac Surg. 2005;79:1536-44; discussion -44.
S8.1.2.1-18. Kusumoto FM, Schoenfeld MH, Wilkoff BL, et al. 2017 HRS expert consensus statement on cardiovascular implantable electronic device lead management and extraction. Heart Rhythm. 2017;14:e503-51.
S8.1.2.1-19. Indik JH, Gimbel JR, Abe H, et al. 2017 HRS expert consensus statement on magnetic resonance imaging and radiation exposure in patients with cardiovascular implantable electronic devices. Heart Rhythm. 2017;14:e97-153.
S8.1.2.1-20. Padmanabhan D, Kella DK, Mehta R, et al. Safety of magnetic resonance imaging in patients with legacy pacemakers and defibrillators and abandoned leads. Heart Rhythm. 2018;15:228-33.
8.1.2.2. Ngoại khoa cho rung nhĩ
S8.1.2.2-1. Gammie JS, Haddad M, Milford-Beland S, et al. Atrial fibrillation correction surgery: lessons from the Society of Thoracic Surgeons National Cardiac Database. Ann Thorac Surg. 2008;85:909-14.
S8.1.2.2-2. Gillinov AM, Gelijns AC, Parides MK, et al. Surgical ablation of atrial fibrillation during mitral-valve surgery. N Engl J Med. 2015;372:1399-409.
S8.1.2.2-3. Phan K, Xie A, La Meir M, et al. Surgical ablation for treatment of atrial fibrillation in cardiac surgery: a cumulative meta-analysis of randomised controlled trials. Heart. 2014;100:722-30.
S8.1.2.2-4. Saint LL, Damiano RJ Jr, Cuculich PS, et al. Incremental risk of the Cox-maze IV procedure for patients with atrial fibrillation undergoing mitral valve surgery. J Thorac Cardiovasc Surg. 2013;146:1072-7.
S8.1.2.2-5. Lee R, McCarthy PM, Wang EC, et al. Midterm survival in patients treated for atrial fibrillation: a propensity-matched comparison to patients without a history of atrial fibrillation. J Thorac Cardiovasc Surg. 2012;143:1341-51; discussion 50-1.
S8.1.2.2-6. Ad N, Suri RM, Gammie JS, et al. Surgical ablation of atrial fibrillation trends and outcomes in North America. J Thorac Cardiovasc Surg. 2012;144:1051-60.
S8.1.2.2-7. Navia JL, Atik FA, Grimm RA, et al. Minimally invasive left ventricular epicardial lead placement: surgical techniques for heart failure resynchronization therapy. Ann Thorac Surg. 2005;79:1536-44; discussion-44.
S8.1.2.2-8. Kusumoto FM, Schoenfeld MH, Wilkoff BL, et al. 2017 HRS expert consensus statement on cardiovascular implantable electronic device lead management and extraction. Heart Rhythm. 2017;14:e503-51.
S8.1.2.2-9. Indik JH, Gimbel JR, Abe H, et al. 2017 HRS expert consensus statement on magnetic resonance imaging and radiation exposure in patients with cardiovascular implantable electronic devices. Heart Rhythm. 2017;14:e97-153.
S8.1.2.2-10. Padmanabhan D, Kella DK, Mehta R, et al. Safety of magnetic resonance imaging in patients with legacy pacemakers and defibrillators and abandoned leads. Heart Rhythm. 2018;15:228-33.
8.1.2.3. Ngoại khoa van tim
S8.1.2.3-1. Goldman BS, Hill TJ, Weisel RD, et al. Permanent cardiac pacing after open-heart surgery: acquired heart disease. Pacing Clin Electrophysiol. 1984;7:367-71.
S8.1.2.3-2. Elahi MM, Lee D, Dhannapuneni RR. Predictors of permanent pacemaker implantation during the early postoperative period after valve surgery. Tex Heart Inst J. 2006;33:455-7.
S8.1.2.3-3. Koplan BA, Stevenson WG, Epstein LM, et al. Development and validation of a simple risk score to predict the need for permanent pacing after cardiac valve surgery. J Am Coll Cardiol. 2003;41:795-801.
S8.1.2.3-4. Leyva F, Qiu T, McNulty D, et al. Long-term requirement for pacemaker implantation after cardiac valve replacement surgery. Heart Rhythm. 2017;14:529-34.
8.1.2.3.1. Surgical Aortic Valve Replacement or Repair
S8.1.2.3.1-1. Bagur R, Manazzoni JM, Dumont É, et al. Permanent pacemaker implantation following isolated aortic valve replacement in a large cohort of elderly patients with severe aortic stenosis. Heart. 2011;97:1687-94.
S8.1.2.3.1-2. Dawkins S, Hobson AR, Kalra PR, et al. Permanent pacemaker implantation after isolated aortic valve replacement: incidence, indications, and predictors. Ann Thorac Surg. 2008;85:108-12.
S8.1.2.3.1-3. Limongelli G, Ducceschi V, D’Andrea A, et al. Risk factors for pacemaker implantation following aortic valve replacement: a single centre experience. Heart. 2003;89:901-4.
S8.1.2.3.1-4. Baraki H, Al Ahmad A, Jeng-Singh S, et al. Pacemaker dependency after isolated aortic valve replacement: do conductance disorders recover over time? Interact Cardiovasc Thorac Surg. 2013;16:476-81.
S8.1.2.3.1-5. Greason KL, Lahr BD, Stulak JM, et al. Long-Term Mortality Effect of Early Pacemaker Implantation After Surgical Aortic Valve Replacement. Ann Thorac Surg. 2017;104:1259-64.
S8.1.2.3.1-6. Schurr UP, Berli J, Berdajs D, et al. Incidence and risk factors for pacemaker implantation following aortic valve replacement. Interact Cardiovasc Thorac Surg. 2010;11:556-60.
S8.1.2.3.1-7. Garcia-Bengochea JB, Fernandez AL, Calvelo DS, et al. Temporary epicardial left ventricular and biventricular pacing improves cardiac output after cardiopulmonary bypass. J Cardiothorac Surg. 2012;7:113.
S8.1.2.3.1-8. Russell SJ, Tan C, O’Keefe P, et al. Optimized temporary bi-ventricular pacing improves haemodynamic function after on-pump cardiac surgery in patients with severe left ventricular systolic dysfunction: a two-centre randomized control trial. Eur J Cardiothorac Surg. 2012;42:e146-51.
S8.1.2.3.1-9. Evonich RF, Stephens JC, Merhi W, et al. The role of temporary biventricular pacing in the cardiac surgical patient with severely reduced left ventricular systolic function. J Thorac Cardiovasc Surg. 2008;136:915-21.
S8.1.2.3.1-10. Navia JL, Atik FA, Grimm RA, et al. Minimally invasive left ventricular epicardial lead placement: surgical techniques for heart failure resynchronization therapy. Ann Thorac Surg. 2005;79:1536-44; discussion -44.
S8.1.2.3.1-11. Kusumoto FM, Schoenfeld MH, Wilkoff BL, et al. 2017 HRS expert consensus statement on cardiovascular implantable electronic device lead management and extraction. Heart Rhythm. 2017;14:e503-51.
S8.1.2.3.1-12. Indik JH, Gimbel JR, Abe H, et al. 2017 HRS expert consensus statement on magnetic resonance imaging and radiation exposure in patients with cardiovascular implantable electronic devices. Heart Rhythm. 2017;14:e97-153.
S8.1.2.3.1-13. Padmanabhan D, Kella DK, Mehta R, et al. Safety of magnetic resonance imaging in patients with legacy pacemakers and defibrillators and abandoned leads. Heart Rhythm. 2018;15:228-33.
8.1.2.3.2. Mitral Valve Surgery
S8.1.2.3.2-1. Berdajs D, Schurr UP, Wagner A, et al. Incidence and pathophysiology of atrioventricular block following mitral valve replacement and ring annuloplasty. Eur J Cardiothorac Surg. 2008;34:55-61.
S8.1.2.3.2-2. Goldstein D, Moskowitz AJ, Gelijns AC, et al. Two-year outcomes of surgical treatment of severe ischemic mitral regurgitation. N Engl J Med. 2016;374:344-53.
S8.1.2.3.2-3. Levin R, Leacche M, Petracek MR, et al. Extending the use of the pacing pulmonary artery catheter for safe minimally invasive cardiac surgery. J Cardiothor Vasc Anesthes. 2010;24:568-73.
S8.1.2.3.2-4. Chikwe J, Itagaki S, Anyanwu A, et al. Impact of concomitant tricuspid annuloplasty on tricuspid regurgitation, right ventricular function, and pulmonary artery hypertension after repair of mitral valve prolapse. J Am Coll Cardiol. 2015;65:1931-8.
S8.1.2.3.2-5. Gillinov AM, Gelijns AC, Parides MK, et al. Surgical ablation of atrial fibrillation during mitral-valve surgery. N Engl J Med. 2015;372:1399-409.
S8.1.2.3.2-6. Garcia-Bengochea JB, Fernandez AL, Calvelo DS, et al. Temporary epicardial left ventricular and biventricular pacing improves cardiac output after cardiopulmonary bypass. J Cardiothorac Surg. 2012;7:113.
S8.1.2.3.2-7. Russell SJ, Tan C, O’Keefe P, et al. Optimized temporary bi-ventricular pacing improves haemodynamic function after on-pump cardiac surgery in patients with severe left ventricular systolic dysfunction: a two-centre randomized control trial. Eur J Cardiothorac Surg. 2012;42:e146-51.
S8.1.2.3.2-8. Evonich RF, Stephens JC, Merhi W, et al. The role of temporary biventricular pacing in the cardiac surgical patient with severely reduced left ventricular systolic function. J Thorac Cardiovasc Surg. 2008;136:915-21.
S8.1.2.3.2-9. Navia JL, Atik FA, Grimm RA, et al. Minimally invasive left ventricular epicardial lead placement: surgical techniques for heart failure resynchronization therapy. Ann Thorac Surg. 2005;79:1536-44; discussion-44.
S8.1.2.3.2-10. Kusumoto FM, Schoenfeld MH, Wilkoff BL, et al. 2017 HRS expert consensus statement on cardiovascular implantable electronic device lead management and extraction. Heart Rhythm. 2017;14:e503-51.
S8.1.2.3.2-11. Indik JH, Gimbel JR, Abe H, et al. 2017 HRS expert consensus statement on magnetic resonance imaging and radiation exposure in patients with cardiovascular implantable electronic devices. Heart Rhythm. 2017;14:e97-153.
S8.1.2.3.2-12. Padmanabhan D, Kella DK, Mehta R, et al. Safety of magnetic resonance imaging in patients with legacy pacemakers and defibrillators and abandoned leads. Heart Rhythm. 2018;15:228-33.
8.1.2.3.3. Tricuspid Valve Surgery
S8.1.2.3.3-1. Chikwe J, Itagaki S, Anyanwu A, et al. Impact of concomitant tricuspid annuloplasty on tricuspid regurgitation, right ventricular function, and pulmonary artery hypertension after repair of mitral valve prolapse. J Am Coll Cardiol. 2015;65:1931-8.
S8.1.2.3.3-2. Jokinen JJ, Turpeinen AK, Pitkanen O, et al. Pacemaker therapy after tricuspid valve operations: implications on mortality, morbidity, and quality of life. Ann Thorac Surg. 2009;87:1806-14.
S8.1.2.3.3-3. McCarthy PM, Bhudia SK, Rajeswaran J, et al. Tricuspid valve repair: durability and risk factors for failure. J Thorac Cardiovasc Surg. 2004;127:674-85.
S8.1.2.3.3-4. Scully HE, Armstrong CS. Tricuspid valve replacement. Fifteen years of experience with mechanical prostheses and bioprostheses. J Thorac Cardiovasc Surg. 1995;109:1035-41.
S8.1.2.3.3-5. de Cock CC, Vinkers M, Van Campe LC, et al. Long-term outcome of patients with multiple (> or = 3) noninfected transvenous leads: a clinical and echocardiographic study. Pacing Clin Electrophysiol. 2000;23:423-6.
S8.1.2.3.3-6. Eleid MF, Blauwet LA, Cha YM, et al. Bioprosthetic tricuspid valve regurgitation associated with pacemaker or defibrillator lead implantation. J Am Coll Cardiol. 2012;59:813-8.
S8.1.2.3.3-7. Navia JL, Atik FA, Grimm RA, et al. Minimally invasive left ventricular epicardial lead placement: surgical techniques for heart failure resynchronization therapy. Ann Thorac Surg. 2005;79:1536-44; discussion-44.
S8.1.2.3.3-8. Kusumoto FM, Schoenfeld MH, Wilkoff BL, et al. 2017 HRS expert consensus statement on cardiovascular implantable electronic device lead management and extraction. Heart Rhythm. 2017;14:e503-51.
S8.1.2.3.3-9. Indik JH, Gimbel JR, Abe H, et al. 2017 HRS expert consensus statement on magnetic resonance imaging and radiation exposure in patients with cardiovascular implantable electronic devices. Heart Rhythm. 2017;14:e97-153.
S8.1.2.3.3-10. Padmanabhan D, Kella DK, Mehta R, et al. Safety of magnetic resonance imaging in patients with legacy pacemakers and defibrillators and abandoned leads. Heart Rhythm. 2018;15:228-33.
8.1.2.4. Thay van động mạch chủ qua catheter
S8.1.2.4-1. Piazza N, Onuma Y, Jesserun E, et al. Early and persistent intraventricular conduction abnormalities and requirements for pacemaking after percutaneous replacement of the aortic valve. JACC Cardiovasc Interv. 2008;1:310-6.
S8.1.2.4-2. Siontis GC, Juni P, Pilgrim T, et al. Predictors of permanent pacemaker implantation in patients with severe aortic stenosis undergoing TAVR: a meta-analysis. J Am Coll Cardiol. 2014;64:129-40.
S8.1.2.4-3. Boerlage-Van Dijk K, Kooiman KM, Yong ZY, et al. Predictors and permanency of cardiac conduction disorders and necessity of pacing after transcatheter aortic valve implantation. Pacing Clin Electrophysiol. 2014;37:1520-9.
S8.1.2.4-4. Regueiro A, Abdul-Jawad Altisent O, Del Trigo M, et al. Impact of new-onset left bundle branch block and periprocedural permanent pacemaker implantation on clinical outcomes in patients undergoing transcatheter aortic valve replacement: a systematic review and meta-analysis. Circ Cardiovasc Interv. 2016;9:e003635.
S8.1.2.4-5. Watanabe Y, Kozuma K, Hioki H, et al. Pre-existing right bundle branch block increases risk for death after transcatheter aortic valve replacement with a balloon-expandable valve. JACC Cardiovasc Interv. 2016;9:2210-6.
S8.1.2.4-6. Egger F, Nurnberg M, Rohla M, et al. High-degree atrioventricular block in patients with preexisting bundle branch block or bundle branch block occurring during transcatheter aortic valve implantation. Heart Rhythm. 2014;11:2176-82.
S8.1.2.4-7. Roten L, Wenaweser P, Delacretaz E, et al. Incidence and predictors of atrioventricular conduction impairment after transcatheter aortic valve implantation. Am J Cardiol. 2010;106:1473-80.
S8.1.2.4-8. Nazif TM, Dizon JM, Hahn RT, et al. Predictors and clinical outcomes of permanent pacemaker implantation after transcatheter aortic valve replacement: the PARTNER (Placement of AoRtic TraNscathetER Valves) trial and registry. JACC Cardiovasc Interv. 2015;8:60-9.
S8.1.2.4-9. Urena M, Mok M, Serra V, et al. Predictive factors and long-term clinical consequences of persistent left bundle branch block following transcatheter aortic valve implantation with a balloon-expandable valve. J Am Coll Cardiol. 2012;60:1743-52.
S8.1.2.4-10. Testa L, Latib A, De Marco F, et al. Clinical impact of persistent left bundle-branch block after transcatheter aortic valve implantation with CoreValve Revalving System. Circulation. 2013;127:1300-7.
S8.1.2.4-11. Franzoni I, Latib A, Maisano F, et al. Comparison of incidence and predictors of left bundle branch block after transcatheter aortic valve implantation using the CoreValve versus the Edwards valve. Am J Cardiol. 2013;112:554-9.
S8.1.2.4-12. Toggweiler S, Stortecky S, Holy E, et al. The electrocardiogram after transcatheter aortic valve replacement determines the risk for post-procedural high-degree AV block and the need for telemetry monitoring. JACC Cardiovasc Interv. 2016;9:1269-76.
S8.1.2.4-13. van der Boon RM, Van Mieghem NM, Theuns DA, et al. Pacemaker dependency after transcatheter aortic valve implantation with the self-expanding Medtronic CoreValve System. Int J Cardiol. 2013;168:1269-73.
S8.1.2.4-14. Dizon JM, Nazif TM, Hess PL, et al. Chronic pacing and adverse outcomes after transcatheter aortic valve implantation. Heart. 2015;101:1665-71.
S8.1.2.4-15. Mauri V, Reimann A, Stern D, et al. Predictors of permanent pacemaker implantation after transcatheter aortic valve replacement with the SAPIEN 3. JACC Cardiovasc Interv. 2016;9:2200-9.
S8.1.2.4-16. Schymik G, Tzamalis P, Bramlage P, et al. Clinical impact of a new left bundle branch block following TAVI implantation: 1-year results of the TAVIK cohort. Clin Res Cardiol. 2015;104:351-62.
S8.1.2.4-17. Urena M, Webb JG, Eltchaninoff H, et al. Late cardiac death in patients undergoing transcatheter aortic valve replacement: incidence and predictors of advanced heart failure and sudden cardiac death. J Am Coll Cardiol. 2015;65:437-48.
S8.1.2.4-18. Nazif TM, Williams MR, Hahn RT, et al. Clinical implications of new-onset left bundle branch block after transcatheter aortic valve replacement: analysis of the PARTNER experience. Eur Heart J. 2014;35:1599-607.
S8.1.2.4-19. Auffret V, Webb JG, Eltchaninoff H, et al. Clinical impact of baseline right bundle branch block in patients undergoing transcatheter aortic valve replacement. JACC Cardiovasc Interv. 2017;10:1564-74.
S8.1.2.4-20. Rampat R, Khawaja MZ, Hilling-Smith R, et al. Conduction abnormalities and permanent pacemaker implantation after transcatheter aortic valve replacement using the repositionable LOTUS device: the United Kingdom experience. JACC Cardiovasc Interv. 2017;10:1247-53.
S8.1.2.4-21. Rivard L, Schram G, Asgar A, et al. Electrocardiographic and electrophysiological predictors of atrioventricular block after transcatheter aortic valve replacement. Heart Rhythm. 2015;12:321-9.
8.1.2.5. Ghép tim, lấy bỏ cơ tim ngoại khoa và triệt phá vách bằng Alcohol
8.1.2.5.1. Sau ghép tim
S8.1.2.5.1-1. Cantillon DJ, Tarakji KG, Hu T, et al. Long-term outcomes and clinical predictors for pacemaker-requiring bradyarrhythmias after cardiac transplantation: analysis of the UNOS/OPTN cardiac transplant database. Heart Rhythm. 2010;7:1567-71.
S8.1.2.5.1-2. Jones DG, Mortsell DH, Rajaruthnam D, et al. Permanent pacemaker implantation early and late after heart transplantation: clinical indication, risk factors and prognostic implications. J Heart Lung Transplant. 2011;30:1257-65.
S8.1.2.5.1-3. Mallidi HR, Bates M. Pacemaker use following heart transplantation. Ochsner J. 2017;17:20-4.
S8.1.2.5.1-4. Wellmann P, Herrmann FE, Hagl C, et al. A single center study of 1,179 heart transplant patients—factors affecting pacemaker implantation. Pacing Clin Electrophysiol. 2017;40:247-54.
S8.1.2.5.1-5. Knight CS, Tallaj JA, Rayburn BK, et al. Bradycardia and syncope as a presentation of cardiac allograft rejection involving the conducting system. Cardiovasc Pathol. 2010;19:117-20.
8.1.2.5.2. Lấy bỏ cơ tim bằng ngoại khoa và triệt phá vách bằng alcohol cho bệnh cơ tim phì đại
S8.1.2.5.2-1. Axelsson A, Weibring K, Havndrup O, et al. Atrioventricular conduction after alcohol septal ablation for obstructive hypertrophic cardiomyopathy. J Cardiovasc Med (Hagerstown). 2014;15:214-21.
S8.1.2.5.2-2. El-Jack SS, Nasif M, Blake JW, et al. Predictors of complete heart block after alcohol septal ablation for hypertrophic cardiomyopathy and the timing of pacemaker implantation. J Interv Cardiol. 2007;20:73-6.
S8.1.2.5.2-3. Liebregts M, Faber L, Jensen MK, et al. Outcomes of alcohol septal ablation in younger patients with obstructive hypertrophic cardiomyopathy. JACC Cardiovasc Interv. 2017;10:1134-43.
S8.1.2.5.2-4. Veselka J, Lawrenz T, Stellbrink C, et al. Low incidence of procedure-related major adverse cardiac events after alcohol septal ablation for symptomatic hypertrophic obstructive cardiomyopathy. Can J Cardiol. 2013;29:1415-21.
S8.1.2.5.2-5. Maron BJ, Spirito P, Shen WK, et al. Implantable cardioverter-defibrillators and prevention of sudden cardiac death in hypertrophic cardiomyopathy. JAMA. 2007;298:405-12.
S8.1.2.5.2-6. Thavikulwat AC, Tomson TT, Knight BP, et al. Appropriate implantable defibrillator therapy in adults with hypertrophic cardiomyopathy. J Cardiovasc Electrophysiol. 2016;27:953-60.
S8.1.2.5.2-7. Wang W, Lian Z, Rowin EJ, et al. Prognostic implications of nonsustained ventricular tachycardia in high-risk patients with hypertrophic cardiomyopathy. Circ Arrhythm Electrophysiol. 2017;10:e004604.
S8.1.2.5.2-8. Balt JC, Wijffels MC, Boersma LV, et al. Continuous rhythm monitoring for ventricular arrhythmias after alcohol septal ablation for hypertrophic cardiomyopathy. Heart. 2014;100:1865-70.
S8.1.2.5.2-9. Lawrenz T, Lieder F, Bartelsmeier M, et al. Predictors of complete heart block after transcoronary ablation of septal hypertrophy: results of a prospective electrophysiological investigation in 172 patients with hypertrophic obstructive cardiomyopathy. J Am Coll Cardiol. 2007;49:2356-63.
S8.1.2.5.2-10. Gersh BJ, Maron BJ, Bonow RO, et al. 2011 ACCF/AHA guideline for the diagnosis and treatment of hypertrophic cardiomyopathy: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Developed in collaboration with the American Association for Thoracic Surgery, American Society of Echocardiography, American Society of Nuclear Cardiology, Heart Failure Society of America, Heart Rhythm Society, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons. Circulation. 2011;124:e783–831.
S8.1.2.5.2-11. Liebregts M, Vriesendorp PA, Mahmoodi BK, et al. A systematic review and meta-analysis of long-term outcomes after septal reduction therapy in patients with hypertrophic cardiomyopathy. JACC Heart Fail. 2015;3:896-905.
S8.1.2.5.2-12. Poon SS, Field M, Gupta D, et al. Surgical septal myectomy or alcohol septal ablation: which approach offers better outcomes for patients with hypertrophic obstructive cardiomyopathy? Interact Cardiovasc Thorac Surg. 2017;24:951-61.
S8.1.2.5.2-13. Qin JX, Shiota T, Lever HM, et al. Conduction system abnormalities in patients with obstructive hypertrophic cardiomyopathy following septal reduction interventions. Am J Cardiol. 2004;93:171-5.
S8.1.2.5.2-14. Ralph-Edwards A, Woo A, McCrindle BW, et al. Hypertrophic obstructive cardiomyopathy: comparison of outcomes after myectomy or alcohol ablation adjusted by propensity score. J Thorac Cardiovasc Surg. 2005;129:351-8.
S8.1.2.5.2-15. Talreja DR, Nishimura RA, Edwards WD, et al. Alcohol septal ablation versus surgical septal myectomy: comparison of effects on atrioventricular conduction tissue. J Am Coll Cardiol. 2004;44:2329-32.
S8.1.2.5.2-16. Kim LK, Swaminathan RV, Looser P, et al. Hospital volume outcomes after septal myectomy and alcohol septal ablation for treatment of obstructive hypertrophic cardiomyopathy: US nationwide inpatient database, 2003-2011. JAMA Cardiol. 2016;1:324-32.
S8.1.2.5.2-17. Chang SM, Nagueh SF, Spencer WH 3rd, et al. Complete heart block: determinants and clinical impact in patients with hypertrophic obstructive cardiomyopathy undergoing nonsurgical septal reduction therapy. J Am Coll Cardiol. 2003;42:296-300.
S8.1.2.5.2-18. Fitzgerald P, Kusumoto F. The effects of septal myectomy and alcohol septal ablation for hypertrophic cardiomyopathy on the cardiac conduction system. J Interv Card Electrophysiol. 2018;52:403-8.
S8.1.2.5.2-19. Al-Khatib SM, Stevenson WG, Ackerman MJ, et al. 2017 AHA/ACC/HRS guideline for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society. Circulation. 2018;138:e272–391.
S8.1.2.5.2-20. Ommen SR, Maron BJ, Olivotto I, et al. Long-term effects of surgical septal myectomy on survival in patients with obstructive hypertrophic cardiomyopathy. J Am Coll Cardiol. 2005;46:470-6.
S8.1.2.5.2-21. Schuller JL, Zipse MM, Krantz MJ, et al. Incidence and predictors of late complete heart block after alcohol septal ablation treatment of hypertrophic obstructive cardiomyopathy. J Interv Cardiol. 2015;28:90-7.
8.1.2.6. Điều chỉnh các cơn nhịp tim chậm kết hợp với AF sau phẫu thuật
S8.1.2.6-1. Maisel WH, Rawn JD, Stevenson WG. Atrial fibrillation after cardiac surgery. Ann Intern Med. 2001;135:1061-73.
S8.1.2.6-2. Gillinov AM, Bagiella E, Moskowitz AJ, et al. Rate control versus rhythm control for atrial fibrillation after cardiac surgery. N Engl J Med. 2016;374:1911-21.
S8.1.2.6-3. Levine SA, Miller H, Penton GB. Some clinical features of complete heart block. Circulation. 1956;13:801-24.
S8.1.2.6-4. Echahidi N, Pibarot P, O’Hara G, et al. Mechanisms, prevention, and treatment of atrial fibrillation after cardiac surgery. J Am Coll Cardiol. 2008;51:793-801.
8.2. Điều chỉnh nhịp chậm cho bệnh tim bẩm sinh người trưởng thành
S8.2-1. Albin G, Hayes DL, Holmes DR Jr. Sinus node dysfunction in pediatric and young adult patients: treatment by implantation of a permanent pacemaker in 39 cases. Mayo Clin Proc. 1985;60:667-72.
S8.2-2. Diller GP, Dimopoulos K, Okonko D, et al. Heart rate response during exercise predicts survival in adults with congenital heart disease. J Am Coll Cardiol. 2006;48:1250-6.
S8.2-3. Fishberger SB, Wernovsky G, Gentles TL, et al. Factors that influence the development of atrial flutter after the Fontan operation. J Thorac Cardiovasc Surg. 1997;113:80-6.
S8.2-4. Gelatt M, Hamilton RM, McCrindle BW, et al. Arrhythmia and mortality after the Mustard procedure: a 30-year single-center experience. J Am Coll Cardiol. 1997;29:194-201.
S8.2-5. Helbing WA, Hansen B, Ottenkamp J, et al. Long-term results of atrial correction for transposition of the great arteries. Comparison of Mustard and Senning operations. J Thorac Cardiovasc Surg. 1994;108:363-72.
S8.2-6. Sanders P, Morton JB, Kistler PM, et al. Electrophysiological and electroanatomic characterization of the atria in sinus node disease: evidence of diffuse atrial remodeling. Circulation. 2004;109:1514-22.
S8.2-7. Connelly MS, Liu PP, Williams WG, et al. Congenitally corrected transposition of the great arteries in the adult: functional status and complications. J Am Coll Cardiol. 1996;27:1238-43.
S8.2-8. Graham TP Jr, Bernard YD, Mellen BG, et al. Long-term outcome in congenitally corrected transposition of the great arteries: a multi-institutional study. J Am Coll Cardiol. 2000;36:255-61.
S8.2-9. Lundstrom U, Bull C, Wyse RK, et al. The natural and “unnatural” history of congenitally corrected transposition. Am J Cardiol. 1990;65:1222-9.
S8.2-10. Dewey RC, Capeless MA, Levy AM. Use of ambulatory electrocardiographic monitoring to identify high-risk patients with congenital complete heart block. N Engl J Med. 1987;316:835-9.
S8.2-11. Michaelsson M, Jonzon A, Riesenfeld T. Isolated congenital complete atrioventricular block in adult life. A prospective study. Circulation. 1995;92:442-9.
S8.2-12. Glikson M, Dearani JA, Hyberger LK, et al. Indications, effectiveness, and long-term dependency in permanent pacing after cardiac surgery. Am J Cardiol. 1997;80:1309-13.
S8.2-13. Kim MH, Deeb GM, Eagle KA, et al. Complete atrioventricular block after valvular heart surgery and the timing of pacemaker implantation. Am J Cardiol. 2001;87:649-51, a10.
S8.2-14. Rhodes LA, Walsh EP, Gamble WJ, et al. Benefits and potential risks of atrial antitachycardia pacing after repair of congenital heart disease. Pacing Clin Electrophysiol. 1995;18:1005-S8.2-16.
S8.2-15. Stephenson EA, Casavant D, Tuzi J, et al. Efficacy of atrial antitachycardia pacing using the Medtronic AT500 pacemaker in patients with congenital heart disease. Am J Cardiol. 2003;92:871-6.
S8.2-16. Janousek J, Paul T, Luhmer I, et al. Atrial baffle procedures for complete transposition of the great arteries: natural course of sinus node dysfunction and risk factors for dysrhythmias and sudden death. Z Kardiol. 1994;83:933-8.







