ThS.BS. LÊ THỊ LAN HƯƠNG
PGS.TS.BS. PHẠM NGUYỄN VINH
Bệnh viện đa khoa Tâm Anh TP. Hồ Chí Minh
DANH MỤC CÁC TỪ VIẾT TẮT
| AFD | Bệnh Anderson – Fabry |
| CMR | Cộng hưởng từ tim |
| GAGs | glycosaminoglycans |
| HHD | Bệnh tim tăng huyết áp |
| LGE | Kiểu hình ngậm gadolinium thì muộn |
| LVH | Phì đại thất trái |
| MPS | Mucopolysaccharidoses |
1. Đặt vấn đề
Trong thực hành lâm sàng hàng ngày, các bác sĩ tim mạch thường xuyên gặp những bệnh nhân có phì đại thất trái (LVH) ban đầu nhưng không rõ nguyên nhân. Chẩn đoán xác định và chẩn đoán phân biệt các nguyên nhân phì đại thất trái như: bệnh tim tăng huyết áp (HHD), bệnh cơ tim phì đại (HCM), bệnh cơ tim thâm nhiễm, bệnh cơ tim dự trữ đến các bệnh hệ thống như bệnh lý cơ ty thể, hoặc các trường hợp phì đại “sinh lý” như tim vận động viên giúp điều trị và tiên lượng bệnh. Phì đại thất trái thường được xác định khi độ dày thành thất trái cuối thời kỳ tâm trương ít nhất là 13mm trở lên. Tuy nhiên, việc xác định nguyên nhân tiềm ẩn của LVH vẫn khá thách thức đối với các bác sĩ lâm sàng. Do đó, bài trình bày này sẽ tập trung vào những chẩn đoán thường gặp và kể cả hiếm gặp của những bệnh lý gây ra phì đại thất trái (không bao gồm bệnh lý van tim).
2. Phương pháp tiếp cận chẩn đoán phì đại thất trái
Các phương tiện giúp chẩn đoán LVH đã gia tăng trong nhiều năm gần đây. Ngày nay, các phương tiện chẩn đoán hình ảnh không xâm lấn như cộng hưởng từ tim (CMR) cho phép đánh giá chi tiết và toàn diện kiểu hình phì đại thất trái, đây cũng là phương tiện chẩn đoán hình ảnh không xâm lấn và an toàn trong đánh giá đăc tính mô cơ tim nhằm giúp phân biệt nguyên nhân kiểu hình phì đại thất trái trong chuỗi bệnh lý cơ tim [1]. Hiện nay kỹ thuật sinh thiết nội mạc cơ tim xâm lấn (EMB) ngày càng phát triển và cho phép lấy mẫu sinh thiết an toàn và lấy mẫu từ cả cơ tim thất trái lẫn cơ thất phải (RV), kèm với các kỹ thuật hậu xử lý mô bệnh phẩm tiến bộ, cho phép xét nghiệm mẫu mô bệnh học với mức độ chính xác cao
[2-3]. Tuy nhiên, không có nhiều trung tâm thực hiện kỹ thuật này, cũng như chi phí cao dẫn đến bác sĩ lâm sàng khá cân nhắc khi chỉ định EMB. Do đó để chẩn đoán LVH, cần có phương pháp tiếp cận toàn diện và hệ thống với lựa chọn mục tiêu từng bước và các kỹ thuật chẩn đoán thích hợp.
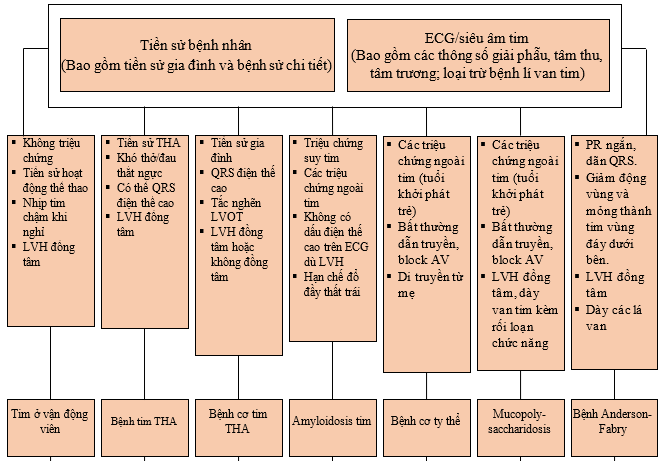
Chìa khóa quan trọng nhất và đơn giản nhất giúp chẩn đoán vẫn là tiền sử của bệnh nhân với trọng tâm chính là tiền sử gia đình. Ví dụ, kiểu hình tim vận động viên ở một bệnh nhân không hoạt động thể lực cường độ cao thì kiểu hình LVH khó xảy ra. Tuổi khởi phát các triệu chứng lâm sàng và/hoặc bệnh tim có thể cung cấp dữ kiện giúp chẩn đoán: ví dụ bệnh amyloidosis tim ‘tuổi già’ chủ yếu xảy ra ở nam giới cao tuổi. Hơn nữa, không chỉ các triệu chứng tim mà cả các triệu chứng ngoài tim cũng cần được đánh giá cẩn thận vì biểu hiện ở tim có thể chỉ là một cơ quan của bệnh lý toàn thân (di truyền/chuyển hóa). Đặc biệt, nếu một bệnh nhân có biểu hiện với các bệnh liên quan đến nhiều cơ quan, thoạt nhìn dường như không liên quan với nhau, nên xem xét hướng chẩn đoán đến các bệnh hệ thống như bệnh cơ ty thể (mitochondrial myopathy). Sau đó, tiền sử gia đình nên hỏi chi tiết để đánh giá khả năng mắc các bệnh di truyền nếu có. Nếu nghi ngờ về bệnh lý mang tính di truyền, các phương pháp khảo sát về di truyền sẽ hữu ích.
Sau khi khám lâm sàng kĩ lưỡng, đặc biệt tập trung vào các bệnh ngoài tim tiềm ẩn, thông tin thu được từ ECG lúc nghỉ có thể giúp thu hẹp các chẩn đoán khác nhau có thể có ở kiểu hình phì đại thất trái (LVH). Ví dụ blốc nhĩ thất (block AV) ở bệnh nhân LVH có thể gợi ý các bệnh lý di truyền như: bệnh cơ ty thể hoặc các bệnh cơ tim thâm nhiễm như amyloidosis tim, hoặc sarcoidosis. Bước tiếp theo, siêu âm tim qua thành ngực (TTE) là phương tiện hình ảnh đầu tay để đánh giá mức độ và sự phân bố của LVH bên cạnh các thông số giải phẫu và chức năng khác như đường kính tâm thất và chức năng tâm thu, tâm trương thất trái.
Sau khi thu thập cẩn thận các dữ liệu nói trên, các công cụ hình ảnh khác được thực hiện theo từng bước giúp định hướng chẩn đoán kiểu hình LVH. Dưới đây là sơ đồ tiếp cận có thể tham khảo:
Sơ đồ 1. Tiếp cận chẩn đoán phì đại thất trái [23]
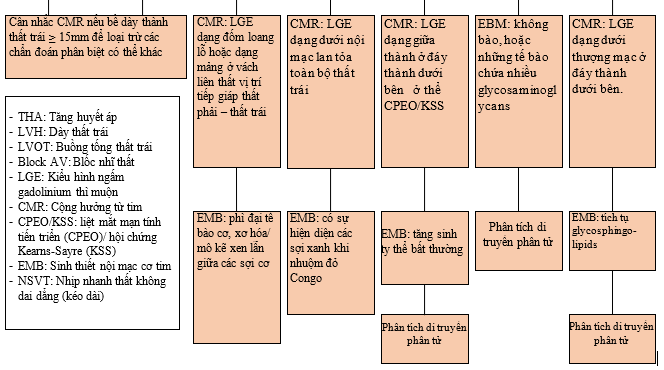
Bảng 1. Đặc điểm của kiểu hình phì đại thất trái trong các bệnh lý thường gặp [23]
| Tim vận động viên | THA | BCT phì đại (HCM) | Amyloidosis | Bệnh cơ tim ty thể | Bệnh Mucopolysaccharidosis | Bệnh Anderson – Fabry | |
| Tuổi khởi phát | Tuổi vị thành niên/trưởng thành | Tuổi trưởng thành | Tuổi vị thành niên/trưởng thành | Tuổi trưởng thành | Thời thơ ấu/ tuổi vị thành niên | Thời thơ ấu/ tuổi vị thành niên | Tuổi trưởng thành |
| Đặc điểm lâm sàng | Không có triệu chứng điển hình | Triệu chứng suy tim;
đau thắt ngực điển hình; đánh trống ngực |
Không có triệu chứng điển hình; khó thở/đau thắt ngực khi gắng sức trong trường hợp tắc nghẽn LVOT; ngất | Triệu chứng suy tim là chủ yếu (mặc dù chức năng thất trái bình thường) | Bệnh lý hệ thống (không có triệu chứng tim điển hình) | Bệnh lý hệ thống (không có triệu chứng tim điển hình) | Không có triệu chứng điển hình |
| ECG | Có thể tăng biên độ phức bộ QRS; Nhịp chậm khi nghỉ; bất thường đoạn ST | Có thể tăng biên độ phức bộ QRS; bất thường đoạn ST | Tăng biên độ phức bộ QRS; bất thường ST | Không gia tăng biên độ phức bộ QRS mặc dù phì đại thất trái; bất thường hệ dẫn truyền | Tùy thuộc từng phân nhóm: bất thường dẫn truyền hoặc blốc nhĩ thất | Bất thường dẫn truyền hoặc blốc nhĩ thất | Khoảng PR ngắn, phức bộ QRS kéo dài;
Nhịp nhanh thất không dai dẳng (NSVT) |
| Siêu âm tim | Dày đồng tâm thất trái | Dày đồng tâm thất trái | Dày đồng tâm/ lệch tâm; có thể tắc nghẽn LVOT; rối loạn chức năng tâm trương thất trái | Dày đồng tâm; dấu hiệu “lấp lánh/kính vỡ”; kiểu hình hạn chế; lớn hai nhĩ; dày các van và cơ trụ | Tùy thuộc từng phân nhóm sẽ có kiểu hình phì đại, dãn nỡ hoặc hạn chế | Dày đồng tâm thất trái; van dày và mất chức năng
(thường gặp ở van ĐMC hoặc van hai lá) |
Dày đồng tâm thất trái; giảm động và mỏng cơ tim vùng đáy thành dưới bên; dày van ĐMC và van 2 lá |
| Cộng hưởng từ tim | Kiểu hình LGE thiếu máu cục bộ hoặc không thiếu máu cục bộ | Không có kiểu hình LGE đặc hiệu; thường gặp LGE dạng patchy (loang lổ) | LGE dạng patchy hoặc dạng đám (confluent) tại vị trí giáp ranh thất phải – thất trái (RV insertion) và ở vách liên thất | LGE lan tỏa toàn bộ nội mạc cơ tim | Tổn thương LGE xuyên thành tại vùng đáy thành dưới bên ở thể CPEO/KSS; kiểu hình LGE giống HCM ở thể MELAS | Không có dữ liệu | Tổn thương LGE dạng dưới thượng mạc (sub-epi) ở vùng đáy thành dưới – bên |
| Sinh thiết nội mạc cơ tim | Phì đại tế bào cơ; mở rộng khoảng kẽ; xơ hóa quanh mạch máu do tích tụ collagen tiến triển | Phì đại tế bào cơ; mở rộng khoảng kẽ; xơ hóa quanh mạch máu do tích tụ collagen tiến triển | Phì đại tế bào cơ kèm nhân tế bào lớn; sợi cơ sắp xếp lộn xộn (myofibre disarray) kèm xơ hóa khoảng kẽ; giảm mật độ mạch máu | Xuất hiện các sợi xanh khi nhuộm đỏ Congo soi dưới kính hiển vi lưỡng cực hoặc dạng hình que (rod-line) khi soi dưới kính hiển vi điện tử | Phì đại tế bào cơ với
Hình thành khoảng không bào trong các tế bào cơ tim; sự gia tăng bất thường ty thể; xuất hiện thể khảm (mosaic) của khiếm khuyết COX |
Hình thành khoảng không bào kèm mở rộng tế bào chất dưới kính hiển vi quang học; tế bào chứa glycosaminoglycans (còn gọi là clear- cell) | Tích tụ glycosphingolipids trong tế bào; trống tế bào khi soi dưới kính hiển vi quang học; dạng lamellar hoặc thể đặc khi soi dưới kính hiển vi điện tử. |
| Phát hiện ngoài tim | – | Có thể có biến chứng mạch máu | – | Hội chứng thận hư và suy thận; suy gan ứ mật; hội chứng kém hấp thu và
xuất huyết tiêu hóa; ngoại vi hoặc tự trị bệnh thần kinh; phì đại lưỡi hoặc ban xuất huyết quanh hốc mắt |
Tùy thuộc vào phân nhóm: sụp mi, bệnh cơ gốc chi, mệt mỏi, mất khả năng gắng sức; bệnh não gan và thất điều | Chậm phát triển; dị tật xương; bao gồm tổn thương hệ thần kinh TW, khiếm thính và khiếm thị; hô hấp khó khăn; rối loạn tiêu hóa | Suy thận; lắng đọng ở giác mạc; Biểu hiện trên hệ thần kinh; đường tiêu hóa, và ngoài da
|
| Di truyền | – | – | Di truyền trội; hiếm các trường hợp di truyền lặn, di truyền NST X hoặc di truyền từ mẹ | ATTR: di truyền lặn | Chủ yếu di truyền từ mẹ | Chủ yếu di truyền lặn; thể MPS II di truyền NST X | Di truyền trên NST X: nam giới bị bệnh, nữ mang gen bệnh |
| Điều trị đặc hiệu | – | Sử dụng thuốc hạ áp | – | Hóa trị ở thể AL | – | Cấy tế bào gốc và điều trị enzyme thay thế | Điều trị enzyme thay thế |
3. Tim vận động viên
Ở vận động viên, kiểu hình phì đại thất trái “sinh lý” thường gặp do luyện tập cường độ cao liên tục. Ngoài ra còn kèm những thay đổi hình thái học bao gồm giãn LV và RV cùng với những thay đổi ECG như: nhịp tim chậm khi nghỉ, bất thường đoạn ST và tăng biên độ ở thành trước bên và dưới bên gợi ý phì đại thất trái. Nghiên cứu gần đây ở Châu Âu cho thấy rằng đột tử do tim ở các vận động viên trẻ phần lớn là do bệnh cơ tim “im lặng” về mặt lâm sàng hoặc các hội chứng rối loạn dẫn truyền tiên phát (với hình thái tim bình thường) và không phải do phì đại thất trái sinh lý [4]. Hơn nữa, dữ liệu từ nghiên cứu sổ bộ của Hoa Kỳ từ năm 1980 đến năm 2006 bao gồm các biến cố liên quan đến 38 môn thể thao khác nhau, cho thấy 1049 ca tử vong do tim mạch, trong đó nguyên nhân tim mạch phổ biến nhất là HCM (36%) và bất thường xuất phát động mạch vành bẩm sinh (17%) [5]. Do đó, phân biệt giữa kiểu hình phì đại thất trái “sinh lý” và “bệnh lý” rất quan trọng để dự đoán các nguy cơ trong tương lai và đưa ra điều trị thích hợp.
Vẫn chưa rõ liệu kiểu hình phì đại thất trái “sinh lý” ở vận động viên có thể dẫn đến xơ hóa cơ tim hay không, và có gây ra những biến đổi chất nền tiềm tàng dẫn đến rối loạn nhịp thất đe dọa tính mạng [6]. Một giả thuyết cho rằng xơ hóa cơ tim có thể xảy ra để đáp ứng với tình trạng phì đại thất trái, vì bệnh nhân không có phì đại thất trái hiếm khi biểu hiện xơ hóa cơ tim [7]. Trong một nghiên cứu nhỏ ghi nhận tỷ lệ xơ hóa cơ tim cao chiếm 50% ở các vận động viên nam hoạt động thể lực kéo dài gần suốt đời [8]. Ngược lại, một giả thuyết khác lập luận rằng xơ hóa cơ tim xảy ra do tăng nồng độ catecholamine và gây co thắt mạch vành dẫn đến tổn thương thiếu máu, hoại tử và xơ hóa cơ tim ngay cả khi không có biểu hiện phì đại thất trái hoặc bệnh lý xơ vữa mạch vành.
Rõ ràng, ngoài những biến đổi ECG khi nghỉ gợi ý phì đại, siêu âm tim qua thành ngực là phương tiện hình ảnh sàng lọc đầu tay để phát hiện sự hiện diện của phì đại thất trái. Tuy nhiên, trong những trường hợp phì đại thất trái không do van tim, kỹ thuật siêu âm tim thông thường chỉ giới hạn trong các phân tích giải phẫu và chức năng và không đánh giá chính xác những thay đổi cấu trúc của mô cơ tim. Theo tác giả Waterhouse và cộng sự cho thấy hình thái phì đại thất trái ở các vận động viên trùng lặp với những bệnh nhân HCM thể nhẹ [4]. Do đó, sự phân biệt bệnh lý hay sinh lý chỉ dựa trên siêu âm tim thường khó khăn, ngay cả khi xem xét các tiêu chí siêu âm khác nhau để tạo ra sự khác biệt này đã được mô tả trước đây, chẳng hạn như: mức độ và mô hình phì đại thất trái, cũng như kích thước buồng thất trái [5]. Hơn nữa do cửa sổ siêu âm tim hạn chế, đôi khi khó quan sát thành trước bên và vùng mỏm thất trái, tuy nhiên đối với cộng hưởng từ tim lại không hạn chế cửa sổ thu hình và có thể khảo sát đa mặt phẳng. Do đó hiện nay, cộng hưởng từ tim là một công cụ được chấp nhận rộng rãi và đầy hứa hẹn để phân biệt phì đại thất trái “sinh lý” do luyện tập thể thao cường độ cao với các trường hợp “bệnh lý” xảy ra với các bệnh cơ tim khác nhau [4].
Nghiên cứu của tác giả Puntmann, sử dụng các thông số trên cộng hưởng từ có thể phân biệt tim vận động viên có thể phân biệt với các dạng phì đại thất trái “bệnh lý” khác bằng cách sử dụng thể tích thất trái và các chỉ số hình học: bằng cách sử dụng tỉ số bề dày thành thất trái tối đa ở thì cuối tâm trương/thể tích thất trái với điểm cắt < 0,15 mm × m2/ml có thể phân biệt được kiểu hình tim vận động viên với các dạng phì đại tim bệnh lý khác với độ đặc hiệu 99% [10]. Lượng giá sự phân bố của tình trạng xơ hóa cơ tim, không có nghiên cứu nào ghi nhận kiểu hình ngấm thuốc thì muộn (LGE) có thể gợi ý chẩn đoán phì đại thất trái “sinh lý” vì nguyên nhân gây xơ hóa vẫn chưa rõ ràng. Kiểu hình LGE do thiếu máu cục bộ cũng như không do thiếu máu cục bộ đều được mô tả ở tim vận động viên [10]. Như trường hợp xơ hóa lan tỏa đặc biệt là ở thành bên và thành sau thất trái, cũng như xơ hóa khoảng kẽ ở giữa thành cơ tim (mid-wall) trong trường hợp không có sự xáo trộn tế bào cơ tim, được mô tả ở tim vận động viên marathon và gợi ý kiểu hình phì đại thất trái “sinh lý” [10]. Tuy nhiên, vì có các kiểu hình LGE đặc trưng đối với tình trạng phì đại thất trái gây ra bởi các bệnh cơ tim khác nhau, cho nên nhìn chung chẩn đoán phì đại thất trái “sinh lý” ở vận động viên sẽ khẳng định chắc chắn khi không có bất thường lâm sàng và không có tổn thương LGE trên cộng hưởng từ tim.
4. Bệnh tim tăng huyết áp (HHD)
Trong báo cáo gần đây bởi tác giả Raman và cộng sự, tăng huyết áp không những là một yếu tố nguy cơ tim mạch thường gặp và lâu dài dẫn tới các biến chứng như: suy tim, rung nhĩ, rối loạn nhịp thất, mà còn đưa đến bệnh tim thiếu máu cục bộ và nhồi máu cơ tim [7]. Những biến đổi cấu trúc ở bệnh nhân HHD bao gồm phì đại tế bào cơ tim, gia tăng mức độ xơ hóa khoảng kẽ và xơ hóa khoảng quanh mạch máu do tích lũy collagen tiến triển và tăng độ cứng thành động mạch (Hình 1A). Hơn nữa, những thay đổi này không chỉ liên quan đến kiểu hình phì đại và tăng khối lượng cơ thất trái, mà còn làm giảm mật độ mao mạch trong cơ tim và dày thành động mạch (Hình 1: B +C) [8,11]. Mặc dù nhiều quá trình tổn thương tế bào và phi tế bào trong HHD có liên quan đến sự xuất hiện của xơ hóa cơ tim, nhưng mối quan hệ nhân quả giữa tăng huyết áp và xơ hóa cơ tim vẫn chưa rõ ràng. Phải chăng sự hiện diện trước đó của tăng huyết áp (không phải do nguyên nhân tim mạch) dẫn đến sự xuất hiện của những thay đổi cấu trúc nói trên, hay những thay đổi cấu trúc này dẫn đến sự xuất hiện của tăng huyết áp do đó gây ra một vòng xoắn bệnh lý.
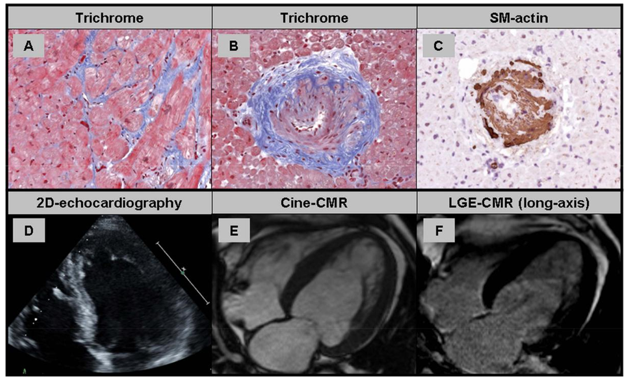
Hình 1. Kết quả sinh thiết nội mạc cơ tim ở bệnh nhân bị bệnh tim tăng huyết áp (HHD);
(A) Phì đại tế bào cơ tim và xơ hóa khoảng kẽ do tích tụ collagen tiến triển là dấu hiệu của HHD. (B + C) Các tiểu động mạch trong cơ tim có biểu hiện xơ hóa khoảng quanh mạch máu và tăng sinh lớp trung mạc gợi ý bệnh vi mạch mạn tính. (D) Cửa sổ siêu âm tim bốn buồng hạn chế quan sát thành bên. (E + F) Hình ảnh cine trục dài và hình LGE của bệnh nhân bị HHD cho thấy phì đại thất trái đồng tâm mà không có tổn thương LGE.
Theo đó, không có mô hình cụ thể của xơ hóa cơ tim nào dựa trên các kỹ thuật không xâm lấn có thể được sử dụng để chẩn đoán thích hợp HHD. Gần đây, Rudolph và cộng sự đã đánh giá tỷ lệ mắc và mô hình LGE ở các kiểu hình phì đại thất trái khác nhau bao gồm bệnh nhân hẹp van động mạch chủ (AS), HHD và HCM [9]. Tổn thương LGE được phát hiện ở tất cả các kiểu hình phì đại thất trái (AS 62%, HHD 50%, HCM 72%) và có mối tương quan với khối lượng cơ thất trái. Kiểu hình LGE điển hình thường thấy ở bệnh nhân HCM nhưng không ghi nhận ở AS và HHD. Bệnh nhân HHD ghi nhận kiểu hình LGE dạng patchy (loang lỗ), và phần nào có thể phân biệt hoặc loại trừ những tổn thương LGE dưới nội mạc của bệnh tim thiếu máu cục bộ (Hình 1 D + E). Trong một nghiên cứu tương tự khác, sử dụng mô hình đa tham số để phân biệt nguyên nhân của kiểu hình phì đại; cho thấy bệnh nhân HHD gia tăng sức căng thành, trong khi đó bệnh nhân HCM giảm độ biến dạng cơ tim theo trục dọc tương quan với mức độ xơ hóa [10]. Hơn nữa, điều trị tăng huyết áp thành công sẽ dẫn đến giảm khối lượng LV và cải thiện chức năng co bóp và tăng tưới máu cơ tim có thể đo được chính xác bằng cộng hưởng từ tim đa tham số, và điều này không xảy ra trong các trường hợp HCM. Ngoài ra, các phương pháp thiết lập bản đồ (mapping) cộng hưởng từ tim hứa hẹn định lượng chính xác xơ hóa khoảng kẽ từ những xơ hóa tinh tế đến xơ hóa lan tỏa – đây là dạng xơ hóa chiếm ưu thế trong HHS. Và khi sử dụng kỹ thuật lập bản đồ (mapping) thì có thể không cần dùng thuốc tương phản từ.
5. Bệnh cơ tim phì đại
HCM được xác định bởi sự hiện diện của phì đại thất trái trong trường hợp không có nguyên nhân làm tăng hậu tải thất trái như tăng huyết áp động mạch hoặc hẹp van động mạch chủ. Tỷ lệ hiện mắc HCM trong dân số nói chung được ước tính là 1:500 – 1:200 tùy vào nghiên cứu. HCM là bệnh lý di truyền trội và chủ yếu là do đột biến gen mã hóa cho protein sarcomeric. Chẩn đoán HCM dựa trên bằng chứng mô bệnh học gồm phì đại tế bào cơ tim, xáo trộn sắp xếp sợi cơ tim (myofibre disarray) và xơ hóa khoảng kẽ (Hình 2A). Những biến đổi về mặt hình thái dẫn đến làm tăng độ cứng của cơ tim gây ra rối loạn chức năng tâm trương. Hơn nữa, những tổn thương xơ hóa gây ra những biến đổi về chất nền, do đó có thể dẫn đến rối loạn nhịp đe dọa tính mạng [3,6].
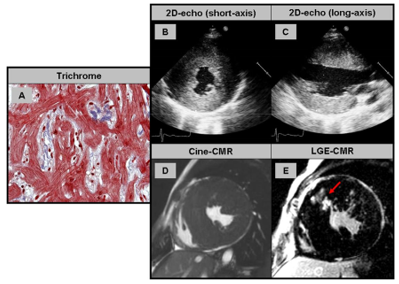
Hình 2: (A) Sinh thiết nội mạc cơ tim ở bệnh nhân bệnh cơ tim phì đại: phì đại tế bào cơ tim, xáo trộn sắp xếp sợi cơ (disarray) và xơ hóa là dấu hiệu của bệnh cơ tim phì đại. (B, C) Siêu âm tim 2D trục ngắn và trục dài cho thấy phì đại vách liên thất và thành bên. (D, E). Hình ảnh cine trục ngắn và hình LGE cho thấy tổn thương dạng patchy (loang lổ) (mũi tên đỏ (nguồn Yilmaz et al.)
Hình ảnh LGE của cộng hưởng từ tim là một kỹ thuật không xâm lấn hữu ích giúp phát hiện xơ hóa cơ tim, dựa vào đó nhiều nghiên cứu đã phân tích kiểu phân bố của LGE và tỉ lệ xơ hóa ở bệnh nhân HCM để đưa ra các mô hình tiên đoán nguy cơ đột tử. Đối với phân bố xơ hóa, tổn thương LGE hiện diện chủ yếu tại vách liên thất vị trí giáp ranh thất phải – thất trái với kiểu hình dạng patchy (loang lổ) hoặc dạng đám (confluent) (Hình 2 B-E) [13,14]. Theo các nghiên cứu, LGE hiện diện ở 60-80% bệnh nhân HCM và đây là một yếu tố tiên lượng xấu [11]. Trong một phân tích gộp gồm 4 nghiên cứu về giá trị dự đoán của LGE-CMR đối với các biến cố tim mạch trong tương lai và tỉ lệ tử vong ở bệnh nhân HCM với 1063 bệnh nhân và theo dõi trung bình 3,1 năm, ghi nhận tổn thương LGE bất kỳ tương quan với tử vong do nguyên nhân tim mạch (OR = 2,92; p = 0,047), tử vong do suy tim (OR 5,68; p = 0,045) và tử vong chung (OR = 4,46; p = 0,006). Nghiên cứu đưa ra xu hướng liên quan mật thiết giữa tỉ lệ LGE và dự đoán đột tử hoặc đột tử cứu sống (OR = 2,39; p = 0,091) [15].
Năm 2018, nghiên cứu của tác giả Mentias và cộng sự thực hiện trên 1423 bệnh nhân HCM nguy cơ thấp và trung bình, có phân suất tống máu bảo tồn, được thực hiện cộng hưởng từ tim để đánh giá mức độ xơ hóa cơ tim (% xơ hóa/ tổng khối lượng cơ tim) từ năm 2008 đến 2015. Tiêu chí chính là đánh giá nguy cơ đột tử trong 5 năm và chỉ định cấy ICD theo AHA/ACC và ESC. Kết quả nghiên cứu cho thấy, nguy cơ đột tử trong 5 năm là 2.3 +/- 2.0. Nghiên cứu định lượng mức độ xơ hóa cơ tim trên cộng hưởng từ với ngưỡng + 6SD và phân tích dữ liệu bằng phần mềm Circle Cardiovascular Imaging. Kết quả cho thấy, định lượng mức độ xơ hóa LGE ≥ 15% làm gia tăng biến cố cộng gộp. Phân tích dưới nhóm riêng ở nhóm HCM có tắc nghẽn tỉ lệ LGE ≥ 15% làm gia tăng biến cố chính (HR = 3.04, 95% CI: 1.48 – 6.10), gia tăng tần suất phẫu thuật cắt vách (HR = 0.44, 95% CI: 0.2 –0.76).
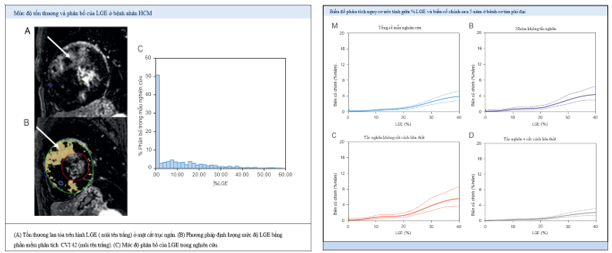
Hình 3. Phân bố LGE và biến cố tim mạch [22]
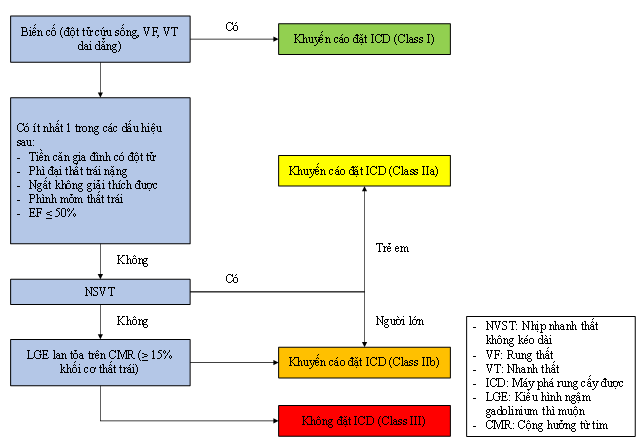
Khác với mô hình tiên đoán dự báo nguy cơ đột tử của ESC năm 2014, năm 2022 hướng dẫn của AHA/ACC về bệnh cơ tim phì đại đưa ra nhiều tiêu chuẩn hơn về chỉ định cấy máy phá rung (ICD) ở bệnh nhân bệnh cơ tim phì đại) như ở sơ đồ 1, trong đó tổn thương LGE lan tỏa được xem như một trong những tiêu chuẩn để quyết định cấy máy phá rung với mức độ chỉ định IIb.
Sơ đồ 2. Chỉ định cấy máy phá rung theo AHA/ACC 2022 [25]
(Còn nữa…)
TÀI LIỆU THAM KHẢO
- Maron MS. Clinical utility of cardiovascular magnetic resonance in hypertrophic cardiomyopathy. J Cardiovasc Magn Reson 2012;14:13.
- Yilmaz A, Kindermann I, Kindermann M, et al. Comparative evaluation of left and right ventricular endomyocardial biopsy:differences in complication rate and diagnostic performance. Circulation 2010;122:900–9.
- Adabag AS, Maron BJ, Appelbaum E, et al. Occurrence and frequency of arrhythmias in hypertrophic cardiomyopathy in relation to delayed enhancement on cardiovascular magnetic resonance. J Am Coll Cardiol 2008;51:1369–74.
- Waterhouse DF, Ismail TF, Prasad SK, et al. Imaging focal and interstitial fibrosis with cardiovascular magnetic resonance in athletes with left ventricular hypertrophy: implications for sporting participation. Br J Sports Med 2012;46(Suppl 1):i69–77.
- Maron BJ, Pelliccia A, Spirito P. Cardiac disease in young trained athletes. Insights into methods for distinguishing athlete’s heart from structural heart disease, with particular emphasis on hypertrophic cardiomyopathy. Circulation 1995;91:1596–601.
- Petersen SE, Selvanayagam JB, Francis JM, et al. Differentiation of athlete’s heart from pathological forms of cardiac hypertrophy by means of geometric indices derived from cardiovascular magnetic resonance. J Cardiovasc Magn Reson 2005;7:551–8.
- Raman SV. The hypertensive heart. An integrated understanding informed by imaging. J Am Coll Cardiol 2010;55:91–6.
- Yilmaz A, Sechtem U. Angina pectoris in patients with normal coronary angiograms: current pathophysiological concepts and therapeutic options. Heart 2012;98:1020–9.
- Rudolph AA, Abdel-Aty H, Bohl S, et al. Noninvasive detection of fibrosis applying contrast-enhanced cardiac magnetic resonance in different forms of left ventricular hypertrophy relation to remodeling. J Am Coll Cardiol 2009;53:284–91.
- Puntmann VO, Jahnke C, Gebker R, et al. Usefulness of magnetic resonance imaging to distinguish hypertensive and hypertrophic cardiomyopathy. Am J Cardiol 2010;106:1016–22.
- Noureldin RA, Liu S, Nacif MS, et al. The diagnosis of hypertrophic cardiomyopathy by cardiovascular magnetic resonance. J Cardiovasc Magn Reson 2012;14:17.
- Gersh BJ, Maron BJ, Bonow RO, et al. 2011 ACCF/AHA guideline for the diagnosis and treatment of hypertrophic cardiomyopathy: a report of the American College of Cardiology Foundation/ American Heart Association Task Force on Practice Guidelines. Developed in collaboration with the American Association for Thoracic Surgery, American Society of Echocardiography, American Society of Nuclear Cardiology, Heart Failure Society of America, Heart Rhythm Society, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons. J Am Coll Cardiol 2011;58:e212–60.
- Rapezzi C, Merlini G, Quarta CC, et al. Systemic cardiac amyloidoses: disease profiles and clinical courses of the 3 main types. Circulation 2009;120:1203–12.
- Srinivasan G, Joseph M, Selvanayagam JB. Recent advances in the imaging assessment of infiltrative cardiomyopathies. Heart 2013;99:204–13.
- Vogelsberg H, Mahrholdt H, Deluigi CC, et al. Cardiovascular magnetic resonance in clinically suspected cardiac amyloidosis: noninvasive imaging compared to endomyocardial biopsy. J Am Coll Cardiol 2008;51:1022–30
- Syed IS, Glockner JF, Feng D, et al. Role of cardiac magnetic resonance imaging in the detection of cardiac amyloidosis. JACC Cardiovasc Imaging 2010;3:155–64.
- Holmgren D, Wahlander H, Eriksson BO, et al. Cardiomyopathy in children with mitochondrial disease; clinical course and cardiological findings. Eur Heart J 2003;24:280–8.
- Bates MG, Bourke JP, Giordano C, et al. Cardiac involvement in mitochondrial DNA disease: clinical spectrum, diagnosis, and management. Eur Heart J 2012;33:3023–33.
- Yilmaz A, Gdynia HJ, Ponfick M, et al. Cardiovascular magnetic resonance imaging (CMR) reveals characteristic pattern of myocardial damage in patients with mitochondrial myopathy. Clin Res Cardiol 2012;101:255–61.
- Braunlin EA, Harmatz PR, Scarpa M, et al. Cardiac disease in patients with mucopolysaccharidosis: presentation, diagnosis and management. J Inherit Metab Dis 2011;34:1183–97.
- 21 Moon JC, Sheppard M, Reed E, et al. The histological basis of late gadolinium enhancement cardiovascular magnetic resonance in a patient with Anderson-Fabry disease. J Cardiovasc Magn Reson 2006;8:479–82.
- Mentias, A, Raeisi-Giglou, P, Smedira, N. et al. Late Gadolinium Enhancement in Patients With Hypertrophic Cardiomyopathy and Preserved Systolic Function. J Am Coll Cardiol. 2018 Aug, 72 (8) 857–870.
- Yilmaz A, Sechtem U. Diagnostic approach and differential diagnosis in patients with hypertrophied left ventriclesHeart 2014;100:662-671.
- Jason N. Dungu et al; CMR-Based Differentiation of AL and ATTR Cardiac Amyloidosis, JACC: Cardiovascular Imaging, Volume 7, Issue 2-2014, Pages 133-142,ISSN 1936-878X
- 2020 AHA/ACC Guideline for the Diagnosis and Treatment of Patients With Hypertrophic Cardiomyopathy: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol 2020;Nov 20
- Dungu JN, Valencia O, Pinney JH, Gibbs SD, Rowczenio D, Gilbertson JA, et al. CMRbased differentiation of AL and ATTR cardiac amyloidosis. JACC Cardiovasc Imaging. 2014;7(2):133–42
- Pablo Garcia-Pavia, Claudio Rapezzi, et al, Diagnosis and treatment of cardiac amyloidosis: a position statement of the ESC Working Group on Myocardial and Pericardial Diseases, European Heart Journal, Volume 42, Issue 16, 21 April 2021, Pages 1554–1568.