Bộ Môn LÃO KHOA – ĐHYD TP. Hồ Chí Minh
1. MỞ ĐẦU
Nhồi máu cơ tim (NMCT) cấp là nguyên nhân gây tử vong thường gặp nhất ở các nước đã phát triển, chỉ riêng ở Hoa Kì có khoảng 500.000-700.000 trường hợp tử vong mỗi năm. Gần phân nửa số trường hợp tử vong xảy ra trước khi nhập viện. Một số nghiên cứu đã cho thấy trong 40-60% các trường hợp, biểu hiện lâm sàng đầu tiên của bệnh động mạch vành là NMCT cấp hoặc đột tử. Với một số ít trường hợp ngoại lệ (như viêm mạch máu, bóc tách, thuyên tắc, co thắt), NMCT cấp là do tắc nghẽn đột ngột động mạch vành thượng tâm mạc, sự tắc nghẽn này do hình thành huyết khối trên nền mảng xơ vữa bị vỡ trong lòng động mạch vành. Huyết khối trong động mạch vành thượng tâm mạc xuôi dòng gây thuyên tắc hệ thống vi tuần hoàn có thể cũng góp phần gây ra hoại tử cơ tim, đặc biệt ở những bệnh nhân có tình trạng bán tắc lòng động mạch vành. [59]
Sự vỡ của mảng xơ vữa giàu lipid gây ra hình thành huyết khối cấp tính trong lòng mạch vành đã được chứng minh qua các nghiên cứu mô bệnh học [19]. Có 3 loại huyết khối trong hội chứng mạch vành cấp đã được phân biệt: huyết khối gây tắc nghẽn hoàn toàn, tắc nghẽn không hoàn toàn và tắc nghẽn rãi rác. Huyết khối gây tắc nghẽn hoàn toàn thường gây ra NMCT có đoạn ST chênh lên với sự hình thành sóng Q bệnh lý. Huyết khối gây tắc nghẽn không hoàn toàn thì hầu hết gặp trong hội chứng mạch vành cấp không có đoạn ST chênh lên, không có hình thành sóng Q và có thể có hoặc không gây ra hoại tử cơ tim: loại đầu (hội chứng mạch vành cấp không có đoạn ST chênh lên, có hoại tử cơ tim) là NMCT không có đoạn ST chênh lên, loại sau (hội chứng mạch vành cấp không có đoạn ST chênh lên, không có hoại tử cơ tim) là cơn đau thắt ngực không ổn định. Huyết khối gây thuyên tắc rãi rác được thấy ở những trường hợp vỡ mảng xơ vữa gây thuyên tắc xuôi dòng ở bệnh nhân đột tử do tim. Người ta nghĩ là do sự không ổn định về mặt điện học ở vùng cơ tim bị thiếu máu gây ra vòng vào lại và sau đó là rối loạn nhịp thất gây tử vong.
Chiến lược tái tưới máu được chọn lựa cho hội chứng mạch vành cấp có đoạn ST chênh lên là điều trị tiêu sợi huyết (TSH) hay can thiệp mạch vành qua da tiên phát. Nhưng hạn chế của TSH là tái tưới máu không hoàn toàn và tái tắc nghẽn. Để khắc phục những hạn chế đó, điều trị chống thành lập huyết khối trở thành nền tảng trong điều trị hội chứng mạch vành cấp. Đại hội thường niên của châu Âu tại Barcelona năm 2009 đã đặc biệt bàn về vấn đề này khi có đến 3 thử nghiệm lâm sàng lớn được công bố là PLATO [64], CURRENT-OASIS 7 [63], SEPIA-ACS1 TIMI 42 [46]. Vai trò của điều trị chống thành lập huyết khối đã trở nên quan trọng hơn khi mà tái tưới máu bằng can thiệp qua da được thực hiện, đặc biệt sau khi đặt stent mạch vành. Trong bối cảnh đó, điều trị thuốc kháng kết tập tiểu cầu kép là bắt buộc, kết hợp aspirin với thienopiridine, thường dùng nhất là clopidogrel. Cũng như chống kết tập tiểu cầu, thuốc chống đông cũng rất cần thiết ở bệnh nhân bị NMCT cấp cho tới khi được can thiệp qua da và đặt stent [51]. Theo sau sự thành công to lớn của của clopidogrel và enoxaparin trong thập niên qua, những thuốc chống thành lập huyết khối mới cũng đã được công bố, trong đó fondaparinux và prasugrel được đưa vào thực hành lâm sàng, và đã được chứng minh qua 3 thử nghiệm lớn đã nêu trên. Đặc biệt, trong thử nghiệm SEPIA-ACS1 TIMI 42, đã chứng minh hiệu quả của thuốc kháng đông otamixaban, thuốc ức chế yếu tố Xa, trong hội chứng mạch vành cấp không có đoạn ST chênh lên (NSTE ACS). Xu hướng mới về thuốc kháng đông trong điều trị NSTE ACS hiện nay như thế nào? Qua chuyên đề này chúng tôi cố gắng sẽ trình bày những vấn đề quan trọng liên quan tới thuốc điều trị kháng đông cho bệnh nhân bị NSTE ACS trong tình hình hiện nay.
2. SINH LÝ BỆNH CỦA HỘI CHỨNG MẠCH VÀNH CẤP: VỠ MẢNG XƠ VỮA VÀ HUYẾT KHỐI XƠ VỮA.
2.1. Hình thành mảng xơ vữa và vỡ mảng xơ vữa:
Sang thương xơ vữa là tình trạng dày khu trú không đối xứng của lớp áo trong cùng nhất của động mạch, lớp áo nội mạc (hình 2.1). Sang thương này bao gồm các tế bào, thành phần mô liên kết, lipid và mảnh vỡ [60]. Các tế bào viêm và tế bào miễn dịch là những thành phần quan trọng của mảng xơ vữa, phần còn lại được tạo thành từ các tế bào nội mô mạch máu và các tế bào cơ trơn. Mảng xơ vữa được báo trước bằng những vệt mỡ, sự tích tụ của các tế bào giàu lipid nằm dưới lớp nội mô. Hầu hết các tế bào trong vệt mỡ là đại thực bào cùng với một vài tế bào T. Những vệt mỡ thường thấy ở người trẻ, không bao giờ gây ra triệu chứng và có thể tiến triển thành xơ vữa hoặc thậm chí biến mất. Trong trung tâm của mảng xơ vữa, các tế bào bọt và dạng những giọt nhỏ lipid bên ngoài vùng nhân, được bao quanh bởi những tế bào cơ trơn và chất gian bào giàu collagen. Tế bào T, đại thực bào và các dưỡng bào xâm nhập vào sang thương và đặc biệt nhiều ở vùng biên, nơi mà mảng xơ vữa phát triển. [40], [42]
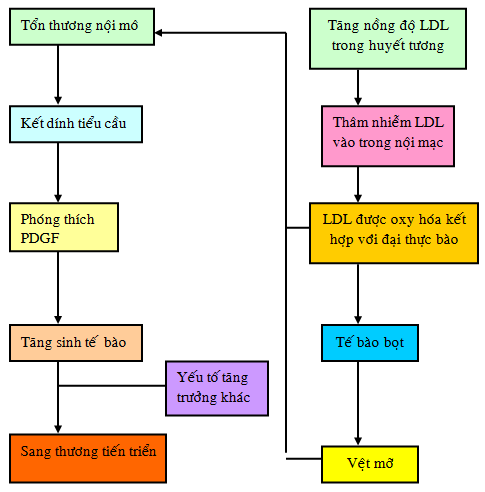
Theo thời gian những vệt mỡ tiến triển thành những mảnh xơ vữa trưởng thành (hình 2.2). Các đại thực bào xâm nhập vào vùng này có thể phóng thích ra những độc chất làm tổn thương hơn nữa dẫn tới sự ăn mòn lớp nội mô và tổn thương nội mạc. Dạng tổn thương sâu hơn có thể dẫn tới kết dính tiểu cầu. Kết dính tiểu cầu, cùng với sự xâm nhập của đại thực bào và tổn thương lớp nội mô làm phóng thích ra các yếu tố tăng trưởng như yếu tố tăng trưởng có nguồn gốc tiểu cầu (PDGF), yếu tố tăng trưởng biểu bì- â và somatomedin C. Các yếu tố tăng trưởng này có thể làm di chuyển và tăng sinh các tế bào cơ trơn mạch máu và kích thích sản xuất ra collagen, elastin và glycoprotein. Các protein này cung cấp mô liên kết gian bào và các cấu trúc cho việc hình thành mảng xơ vữa mới. Cholesterol, có nguồn gốc từ sự phân lập của các lipid trong máu hoặc được phóng thích từ những bọt bào đã chết, bị giữ lại trong chất gian bào này. Lipid và mô liên kết gian bào được bao phủ bởi bao sợi cơ bao gồm các tế bào cơ trơn, collagen (loại I và III) và lớp đơn của tế bào nội mô (hình 2.3). Các tế bào cơ trơn mạch máu tổng hợp và thu thập các sợi collagen, và cung cấp những thành phần không phải collagen cho chất gian bào ngoài tế bào của bao sợi. Bao sợi cơ là một cấu trúc động, trải qua tái cấu trúc hằng định thông qua việc tổng hợp và phá hủy các thành phần cần thiết. [34]
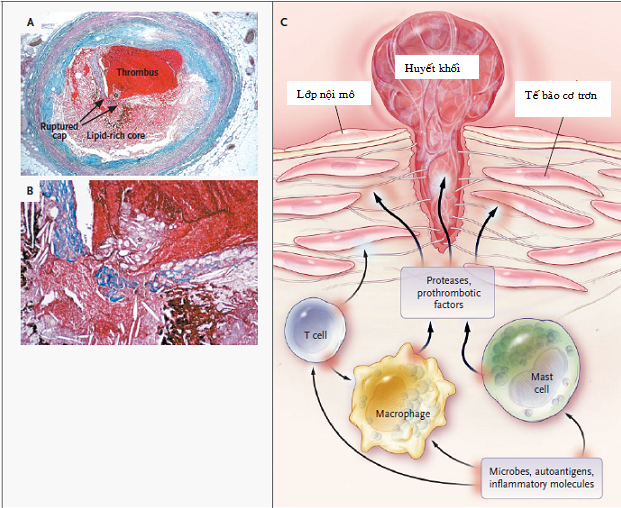
Hình 2.1. Sang thương xơ vữa ở động mạch của người. [34]
Hình A: Mô tả hình ảnh cắt ngang của động mạch vành từ một bệnh nhân đã tử vong do NMCT cấp. Nó chứa huyết khối gây tắc nghẽn trên nền mảng xơ vữa giàu lipid. Bao mô sợi bao quanh nhân giàu lipid đã bị vỡ (vùng giữa các mũi tên) làm cho nhân hình thành huyết khối khi tiếp xúc với máu. Hình B được quan sát dưới kính hiển vi cho thấy mảng xơ vữa đã thấm qua khoảng trống của bao sợi vào trong lòng mạch máu, điều này nói lên vỡ mảng xơ vữa xảy ra trước khi hình thành huyết khối. Hình C minh họa hậu quả của hoạt hóa các tế bào miễn dịch trong mảnh xơ vữa. Vi khuẩn, tự kháng nguyên và những phân tử viêm khác có thể hoạt hóa tế bào T, đại thực bào và các dưỡng bào dẫn đến bài tiết các cytokine viêm (như interferon và các yếu tố hoại tử u) làm giảm tính ổn định của mảng xơ vữa. Sự hoạt hóa của đại thực bào và dưỡng bào cũng có thể gây ra phóng thích metalloproteinase và cystein protenase, các chất này tấn công trực tiếp lên collagen và các thành phần khác của mô gian bào. Các tế bào này có thể cũng tạo ra prothrombotic và các yếu tố tiền đông làm thúc đẩy trực tiếp hình thành huyết khối tại vị trí của mảng xơ vữa vỡ.
Chú thích: LDL, low-density lipoprotein, PDGF: platelet-derived growth factor
Hình 2.2. Mối liên hệ giữa giả thuyết thâm nhiễm lipid và tổn thương nội mô. [61]
Thành phần của mảng xơ vữa không bị vỡ có tính biến đổi cao và các yếu tố kiểm soát quá trình này chưa được hiểu rõ. Mảng xơ vữa trưởng thành bao gồm hai thành phần: chất xơ vữa giàu lipid, mềm và mô xơ hóa giàu collagen, cứng. Số lượng tương đối của mỗi thành phần có thể khác nhau tùy từng sang thương xơ vữa, nhưng nhìn chung hai thành phần này là nổi bật ở các sang thương (hình 2.3B).
Sự khác biệt trong thành phần của mảng xơ vữa có ứng dụng lâm sàng quan trọng. Mảng xơ vữa gây nên hẹp nặng xu hướng có mô sợi cao hơn và thành phần lipid thấp hơn so với sang thương hẹp nhẹ hơn [45]. Tuy nhiên, một vài nghiên cứu đã cho thấy những mảng xơ vữa giàu lipid, ít gây hẹp là những mảng xơ vữa nguy hiểm về mặt lâm sàng hơn. [25]
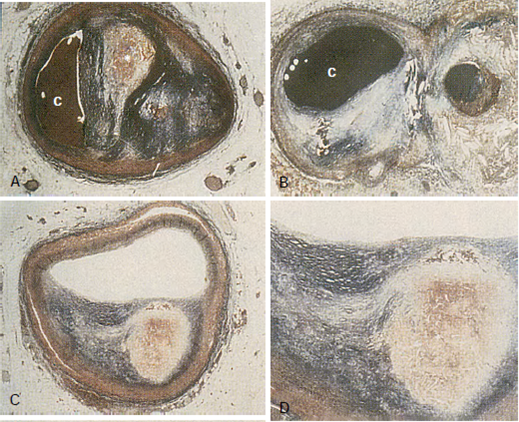
Hình 2.3. Mối liên hệ giữa thành phần mảng xơ vữa và tính chất dễ bị tổn thương.
Mảng xơ vữa trưởng thành bao gồm hai thành phần chính: chất giàu lipid mềm và mô xơ cứng giàu collagen (hình A). Hai mảng xơ vữa kề nhau, một nằm ở nhánh động mạch vành mũ (trái) và một nằm ở đoạn gần của nhánh bên (phải). Mặc dù cả hai mảng xơ vữa đều được tiếp xúc với những yếu tố nguy cơ tương tự, nhưng mảng ở bên trái được collagen hóa và ổn định, còn mảng ở bên phải là mảng xơ vữa bị tổn thương với huyết khối gây tắc nghẽn không hoàn toàn trên nền bề mặt bị phá vỡ (hình B). Mảng xơ vữa bị tổn thương chứa nhân xơ vữa mềm được cách ly với lòng mạch máu bởi bao mô sợi mỏng bị thâm nhiễm tế bào bọt (hình C-D).
Sự hình thành mảng xơ vữa trong lòng mạch vành có thể ngăn cản từ từ lưu lượng máu bởi sự tắc nghẽn tiến triển của lòng mạch. Lúc đầu, các sang thương này thường không gây ra triệu chứng ngoại trừ trong giai đoạn gia tăng nhu cầu oxy của cơ tim. Khi lưu lượng máu trong mạch vành không thể gia tăng để đáp ứng cho nhu cầu của cơ tim, sẽ dẫn đến thiếu máu cục bộ cơ tim và gây ra cơn đau thắt ngực khi gắng sức điển hình. Trong thời gian này, mảng xơ vữa có thể lớn ra thêm một cách chậm hơn, tạo ra tắc nghẽn thêm lòng mạch và gây ra triệu chứng với mức độ gắng sức ít hơn. Sinh lý bệnh của hội chứng mạch vành cấp, bao gồm cơn đau thắt ngực không ổn định, NMCT và đột tử do tim, thì khác nhau một cách rõ ràng. Nhưng toàn bộ bệnh cảnh lâm sàng này được biểu hiện bởi sự giảm đột ngột lưu lượng máu trong lòng mạch vành. Các quan điểm hiện nay cho rằng sự giảm đột ngột này được gây ra do nứt hoặc vỡ mảng xơ vữa dẫn đến hình thành huyết khối, trên nền sang thương đã tồn tại từ trước, làm hạn chế nghiêm trọng lưu lượng máu (hình 2.3) [18], [19], [20]. Nguy cơ nứt hoặc vỡ mảng xơ vữa có liên quan với đặc tính nội tại của từng mảng xơ vữa (tính dễ bị tổn thương) và các yếu tố ngoại sinh tác động vào chính mảng xơ vữa (các yếu tố khởi kích gây ra vỡ).
2.1. Huyết khối xơ vữa.
Sự tạo thành huyết khối là trung tâm để hình thành hội chứng mạch vành cấp. Các yếu tố nội sinh và ngoại sinh có thể kết hợp gây ra vỡ mảng xơ vữa làm tiếp xúc các thành phần trung tâm của mảng xơ vữa với máu và huyết khối hình thành sau đó.
2.2.1. Sinh học tiểu cầu.
Sự kết tập và hoạt hóa tiểu cầu đóng vai trò quan trọng thiết yếu trong cầm máu bình thường và trong hội chứng mạch vành cấp. Sau khi thành mạch máu bị tổn thương, như trong vỡ mảng xơ vữa, tiểu cầu được huy động để đáp ứng bước đầu (cầm máu ban đầu). Hiệu quả cầm máu ban đầu đòi hỏi có 3 sự kiện quan trọng xảy ra: 1) kết dính tiểu cầu, 2) hoạt hóa tiểu cầu với phóng thích các hạt nhỏ, 3) ngưng kết tiểu cầu.
2.2.1.1. Kết dính tiểu cầu.
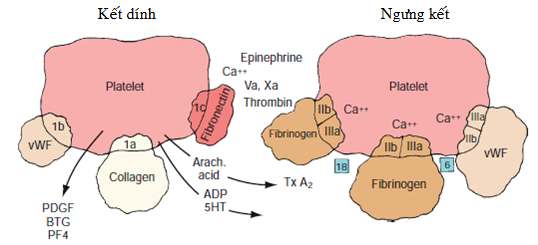
Tổn thương thành mạch máu làm tiếp xúc các chất sinh huyết khối dưới nội mô và nhân xơ vữa (đặc biệt collagen và yếu tố mô) với máu tuần hoàn. Kết dính tiểu cầu với collagen dưới nội mô xảy ra hầu như ngay lập tức thông qua sự tương tác với glycoprotein VI tiểu cầu. Kết dính tiểu cầu tùy thuộc vào nhiều thụ thể của tiểu cầu và màng kết dính glycoprotein (hình 2.4) [36]. Glycoprotein Ib trong màng tiểu cầu là thành phần quan trọng của tiểu cầu tiếp xúc đầu tiên với yếu tố von Willebrand ở lớp dưới nội mô. Yếu tố von Willebrand hình thành một mối liên kết giữa giữa thụ thể trên tiểu cầu và sợi collagen dưới nội mô cho phép tiểu cầu gắn chặt vào thành mạch máu dù lực kéo của máu rất cao. Phức hợp thụ thể màng, glycoprotein IIb/IIIa, gắn kết nhiều protein phù hợp, bao gồm yếu tố von Willebrand, fibrinogen và fibronectin [28]. Phức hợp này đóng vai trò quan trọng trong kết dính và ngưng kết tiểu cầu ban đầu. Qua hàng loạt sự tương tác giữa các chất- thụ thể phức hợp, tiểu cầu đã tạo ra được đơn lớp kết dính để hình thành nền móng cho tạo thành cục máu đông. Con đường bước đầu qua collagen cho hoạt hóa tiểu cầu thì độc lập với thrombin.
Chú thích: 1a, 1b, 1c, and IIb/IIIa, glycoprotein receptor sites; 5HT, serotonin; ADP, adenosine diphosphate; Arach acid, arachidonic acid; BTG, â-thromboglobulin; PDGF, platelet-derived growth factor; PF4, platelet factor 4; TxA2, thromboxane A2; Va, activated factor V; vWF, von Willebrand factor; Xa, activated factor X.
Hình 2.4. Lược đồ hoạt hóa tiểu cầu và vị trí các thụ thể
2.2.1.2. Hoạt hóa và ngưng kết tiểu cầu.
Kết dính tiểu cầu dẫn tới phóng thích một vài chất trong tế bào làm cho hoạt hóa tiểu cầu hơn nữa. Hoạt hóa tiểu cầu và bài tiết được điều hòa bởi một vài yếu tố, bao gồm thay đổi nồng độ nucleotide, dòng can-xi đi vào, thủy phân màng phospholipids và phosphoryl hóa những protein quan trọng trong tế bào. Sự gắn kết của các chất đồng vận như epinephrine, collagen và thrombin với các thụ thể tiểu cầu làm hoạt hóa phospholipase C và phospholipase A2, enzyme màng, chất xúc tác phóng thích của acid arachidonic. Qua một loạt phản ứng phức tạp, cuối cùng acid arachidonic được phóng thích chuyển thành thromboxane A2 và prostacyclin. Hai sản phẩm này có hiệu quả trái ngược nhau trên hoạt hóa tiểu cầu và trương lực thành mạch máu. Thromboxane A2 là một chất kích thích hoạt hóa, ngưng kết và co thắt mạch mạnh, ngược lại thì prostacyclin tác dụng ức chế hoạt hóa tiểu cầu và gây ra dãn mạch. Bằng cách chọn lọc hoặc ức chế hai chất này, các thay đổi về mức độ hoạt hóa tiểu cầu và trương lực thành mạch máu có thể đạt được [53]. Những sản phẩm có hoạt tính khác được bài tiết bởi tiểu cầu bao gồm endoglycosidase, can-xi, serotonin, adenosine diphosphate (ADP) từ các hạt có đậm độ nhỏ, yếu tố von Willebrand, fibronectin, thrombospondin và PDGF từ hạt á. Các sản phẩm này có nhiều vai trò quan trọng bao gồm điều chỉnh trương lực mạch vành, tăng sinh và di chuyển của tế bào, và tương tác với hệ thống đông máu. Người ta thấy rằng PDGF là chất quan trọng trong tăng sinh và di chuyển của tế bào cơ trơn sau khi mạch máu bị tổn thương [58]. ADP được phóng thích gắn kết với các thụ thể chuyên biệt, làm thay đổi hình thể của phức hợp glycoprotein IIb/IIIa để nó gắn kết với yếu tố von Willebrand, fibrinogen và fibronectin, các tiểu cầu kề bên hình thành cục máu đông (hình 2.5).
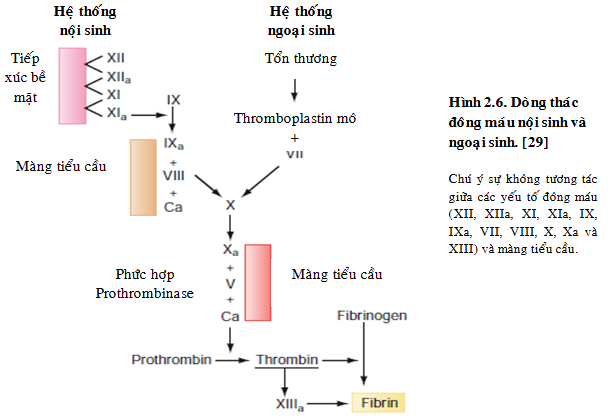
2.2.2. Dòng thác đông máu.
Hệ thống đông máu cũng đóng vai trò quan trọng trong cầm máu thông thường (cầm máu thứ phát) và hội chứng mạch vành cấp. Hệ thống đông máu bao gồm một số protein huyết tương tham gia vào các phản ứng và cuối cùng tạo ra thrombin, thrombin sẽ chuyển fibrinogen thành fibrin. Fibrin được tạo ra qua hệ thống này rất quan trọng trong duy trì nút chặn cầm máu ban đầu được hình thành bởi tiểu cầu. Dòng thác đông máu có thể được chia thành hai con đường: nội sinh và ngoại sinh (hìinh 2.6). Cả hai con đường này tham gia vào các phản ứng cần thiết để hình thành các phức hợp bao quanh bề mặt và chuyển những tiền chất protein không hoạt hóa thành các protease hoạt hóa. Đường nội sinh (các yếu tố XII, XIIa, XI và XIa) được hoạt hóa bởi tiếp xúc các thành phần của máu với các chất tích điện âm, lớp dưới nội mô bị tổn thương và bề mặt lớp áo giữa của mạch máu. Đường ngoại sinh được hoạt hóa bởi sự tương tác của yếu tố được phóng thích từ thành mạch máu bị tổn thương và yếu tố VII.
Cuối cùng, hai con đường này tạo thành phức hợp hoạt hóa yếu tố X. Yếu tố X được hoạt hóa tương tác với yếu tố V, can-xi và phospholipids để hình thành nên phức hợp xúc tác sự chuyển prothrombin thành thrombin. Phản ứng này được gia tăng 1.000 lần trên bề mặt tiểu cầu được hoạt hóa. Thrombin có nhiều chức năng trong cầm máu, trong đó chức năng chính là chuyển fibrinogen trong huyết tương thành fibrin. Sau khi chuyển thành fibrin, phân tử được biến đổi này trùng hợp thành chất không thể hòa tan được. Chất trùng hợp fibrin có tính rất ổn định do liên kết chéo với các fibrin khác qua tác dụng của yếu tố XII a, điều này làm kết dính cục máu đông. Ngoài ra, thrombin còn hoạt hóa yếu tố V, VIII, XIII và kích thích bài tiết và ngưng kết tiểu cầu.
3. HEPARIN KHÔNG PHÂN ĐOẠN VÀ HEPARIN TRỌNG LƯỢNG PHÂN TỬ THẤP.
3.1. Cơ chế tác dụng:
Heparin không phân đoạn (unfractionated heparin-UFH) là một hỗn hợp heparin, được sulfat cao, gồm các glycosaminoglycan tích điện âm. Các phân tử trong hỗn hợp này không đồng nhất về trọng lượng phân tử, thay đổi từ 3.000-30.000 Da. Heparin tác dụng bằng cách ức chế gián tiếp các yếu tố đông máu, do antithrombin, một yếu tố điều hòa tự nhiên của dòng thác đông máu, thì cần thiết như là đồng yếu tố cho tác dụng kháng đông. Antithrombin và heparin hình thành một phức hợp để ức chế thrombin (yếu tố IIa), yếu tố Xa, IXa, XIa và XIIa. Bằng cách ức chế các yếu tố này, UFH ngăn cản thrombin thủy phân chuyển fibrinogen thành fibrin. Ngoài ra, UFH còn dự phòng những hoạt tính liên quan tới thrombin của tiểu cầu và yếu tố V, VIII. Trong các yếu tố trên thì thrombin và yếu tố Xa là nhạy nhất với sự ức chế của antithrombin/heparin. UFH có tác dụng mạnh trên thrombin hơn so với yếu tố Xa, với tỉ lệ anti-IIa/anti-Xa khoảng 10. [37]
Heparin trọng lượng phân tử thấp (LMWH) có nguồn gốc từ sự khử trùng hợp (polymer) của UFH tạo ra một phân tử có trọng lượng trung bình khoảng 1/3 của UFH (2.000-9.000 Da). Các LMWH hiện có trên thị trường hiện nay khác nhau ở phương pháp để đạt được sự khử trùng hợp. Enoxaparin được hình thành từ sự khử trùng hợp alkaline của heparin benzyl ester. Enoxaparin có trọng lượng phân tử trung bình khoảng 4.500 Da [26]. Cũng tương tự như UFH, LMWH có tác dụng kháng đông gián tiếp qua antithrombin. Do kích thước nhỏ hơn, LMWH ít có khả năng ức chế thrombin và do đó ức chế chuyên biệt hơn trên yếu tố Xa [37]. Ức chế chọn lọc yếu tố Xa được xem như là ưu điểm hơn hẳn về mặt dược lý học của LMWH so với UFH. Tuy nhiên, không có chứng cứ nào về lâm sàng xác nhận rằng hoạt tính anti-Xa tốt hơn hoạt tính anti-IIa hoặc chọn lọc anti-Xa có ưu điểm hơn. [56]
3.2. Các thử nghiệm lâm sàng có liên quan:
Hai thử nghiệm lâm sàng lớn đầu tiên so sánh enoxaparin và UFH trong điều trị bệnh nhân bị NSTE ACS là ESSENCE [14] và TIMI 11B [7]. Trong thử nghiệm ESSENCE phân ngẫu nhiên 3.171 bệnh nhân bị NSTE ACS nhận hoặc là enoxaparin tiêm dưới da (1 mg/kg hai lần mỗi ngày) hoặc UFH tĩnh mạch, trong thời gian tối thiểu là 48 giờ tới tối đa là 8 ngày. Tiêu chí chính bao gồm tử vong, NMCT hoặc đau thắt ngực tái phát trong vòng 14 ngày. Những bệnh nhân ở nhóm enoxaparin giảm ý nghĩa các tỉ lệ của tiêu chí chính (16,6% so với 19,8%; odds ratio [OR] 0,80; 95% CI 0,67-0,96). Tại thời điểm 30 ngày, tỉ lệ của các tiêu chí chính trên cũng thấp hơn một cách có ý nghĩa ở nhóm enoxaparin (19,8% so với 23,3%; OR 0,81; 95% CI 0,68-0,96). Biến chứng chảy máu thì cao hơn một cách ý nghĩa ở nhóm enoxaparin (18,4% so với 14,2%; p=0,001), mặc dù chảy máu nặng thì không có sự khác biệt ý nghĩa (6,5% so với 7.0%; p=0,57). Sau 1 năm theo dõi của thử nghiệm ESSENCE, kết quả cũng cho thấy lợi ích của enoxaparin được duy trì ở 3 tiêu chí chính trên (32,0% so với 35,7%; p=0,022). [32]
Thử nghiệm TIMI 11B bao gồm 3.910 bệnh nhân bị NSTE ACS được nhận hoặc là enoxaparin (khởi đầu 30 mg tĩnh mạch, sau đó tiêm dưới da 1 mg/kg mỗi 12 giờ) hoặc 3-8 ngày truyền tĩnh mạch UFH (khởi đầu 70 đơn vị/kg bolus và sau đó truyền tĩnh mạch 15 đơn vị/kg/giờ; mục tiêu là aPTT 1.5-2.5 lần so với chứng) [7]. Thử nghiệm cũng có một giai đoạn điều trị ngoại trú, với những bệnh nhân trong nhóm enoxaparin vẫn tiếp tục được điều trị (40 mg tiêm dưới da mỗi 12 giờ cho những người có cân nặng <65 kg và 60 mg cho những người có cân nặng ≥65 kg) cho thêm 35 ngày sau xuất viện và bệnh nhân trong nhóm UFH chỉ nhận tiêm dưới da giả dược. Các tiêu chí chính bao gồm tử vong, NMCT hoặc tái tưới máu khẩn cấp. Tại thời điểm 8 ngày, tiêu chí chính xảy ra 12,4% ở nhóm bệnh nhân dùng enoxaparin và 14,5% ở nhóm bệnh nhân UFH (OR 0,83; CI 95% 0,69-1.00). Lợi ích này cũng được duy trì ở giai đoạn ngoại viện của nghiên cứu (17,3% so với 19,7%; OR 0,85; 95% CI 0,72-1,00) nhưng không có thêm lợi ích nào khác nữa của enoxaparin. Tỉ lệ chảy máu nặng trong thời gian nội viện không có khác biệt ý nghĩa giữa hai nhóm (1,5% ở nhóm enoxaparin so với 1% ở nhóm UFH, p=0,143), nhưng ngược lại thì tỉ lệ chảy máu nhẹ cao hơn ở nhóm enoxaparin, hầu hết là vết bầm máu được ghi nhận tại vị trí tiêm (9,5% so với 2,5%; p<0,001). Ở giai đoạn điều trị ngoại viện, bệnh nhân điều trị với enoxaparin có tỉ lệ chảy máu nặng (2,9% so với 1,5%; p=0,021) và nhẹ (19,3% so với 5,2%; p<0,001) cao hơn một cách có ý nghĩa so với giả dược.
Kết quả của thử nghiệm ESSENCE và TIMI 11B cũng đã được đưa vào phân tích gộp và kết quả cho thấy rằng enoxaparin có lợi ích 20% hơn UFH trong giảm tử vong và các biến cố tim nặng khác [6]. Hơn nữa, dữ liệu cũng cho thấy giảm 18-23% nguy cơ tương đối của tiêu chí tử vong hoặc NMCT, trong khi hai thử nghiệm riêng biệt thì không cho thấy giảm ý nghĩa trong tiêu chí kết hợp này [7], [14]. Sự giảm các biến cố chỉ xảy ra trong những ngày đầu của điều trị, mặc dù nó được kéo dài qua 43 ngày. Điều hạn chế là gia tăng tỉ lệ chảy máu nhẹ liên quan với điều trị enoxaparin (OR 2,38; CI 95% 1,98-2,85).
Kết quả của các thử nghiệm với LMWH khác (dalteparin và nadroparin) đã không nhất quán với các thử nghiệm ESSENCE và TIMI 11B trong việc cho thấy tính vượt trội hơn so với UFH, vì vậy phủ nhận “tác dụng tuyệt vời” của LMWH. Thử nghiệm FRIC đã thất bại trong việc chứng minh lợi ích rõ ràng của dalteparin so với UFH về giảm nguy cơ tử vong, NMCT và đau thắt ngực tái phát trong giai đoạn nội viện (9,3% dalteparin so với 7,6% UFH; RR 1,18; 95% CI 0,84-1,66), và cũng thấy lợi ích của dalteparin so với giả dược trong nhóm điều trị lâu dài (tới 45 ngày) [41]. Thử nghiệm FRAXIS cho thấy điều trị với nadroparin trong 6 ngày cũng không tốt hơn so với UFH và chế độ điều trị dài hơn (14 ngày) của nadroparin không cho thấy bất kì lợi ích nào thêm nữa [17]. Lý do cho sự không đồng nhất của các kết quả giữa các thử nghiệm enoxaparin, dalteparin và nadroparin thì không rõ. Sự khác biệt về chế phẩm LMWH, tỉ lệ yếu tố anti- Xa/anti- IIa, liều lượng dùng, dân số nghiên cứu và thiết kế thử nghiệm được xem như là những nguyên nhân để giải thích.
Sau thử nghiệm pilot ACUTE, thử nghiệm ACUTE II, đánh giá độ an toàn khi thêm enoxaparin với tirofiban cho bệnh nhân NSTE ACS [15], [16]. Tổng số có 525 bệnh nhân được điều trị với tirofiban (ức chế thụ thể glycoprotein IIb/IIIa) được phân ngẫu nhiên nhận enoxaparin (1 mg/kg mỗi 12 giờ) hoặc UFH (5.000 đơn vị bolus tĩnh mạch, sau đó 1.000 đơn vị truyền tĩnh mạch mỗi giờ) trong 24-96 giờ [15]. Tỉ lệ chảy máu nặng và nhẹ không khác biệt giữa hai nhóm (theo thứ tự là 3,5% so với 4,8% cho enoxaparin và UFH; OR 1,4; CI 95% 0,6-3,4). Mặc dù thử nghiệm không thuyết phục về việc đánh giá hiệu quả nhưng không có sự khác biệt trong tỉ lệ tử vong hoặc NMCT được thấy, tuy vậy, biến cố thiếu máu cơ tim cục bộ tái phát ít hơn ở nhóm enoxaparin. Thử nghiệm INTERACT ngẫu nhiên phân 746 bệnh nhân bị NSTE ACS được điều trị với eptifibatide (ức chế thụ thể glycoprotein IIb/IIIa) nhận enoxaparin (1 mg/kg mỗi 12 giờ) hoặc UFH (70 đơn vị/kg bolus tĩnh mạch, sau đó 15 đơn vị/kg/giờ truyền tĩnh mạch mỗi giờ) trong 48 giờ [33]. Kết quả chính (chảy máu không liên quan tới CABG tại 96 giờ) là thấp hơn ý nghĩa ở nhóm enoxaparin so với nhóm UFH (1,8% so với 4,6%, p=0,03), nhưng tỉ lệ chảy máu nhẹ thì cao hơn ở nhóm enoxaparin (30,3% so với 20,8%, p=0,003). Thử nghiệm cũng cho thấy tỉ lệ thấp hơn về thiếu máu cục bộ được theo dõi trên điện tâm đồ liên tục và tử vong 30 ngày hoặc NMCT ở nhóm enoxaparin. Thử nghiệm lớn nhất so sánh enoxaparin và UFH trên nền điều trị với ức chế thụ thể GP IIb/IIIa là thử nghiệm A-Z (ngẫu nhiên, tiền cứu, đa quốc gia) [11]. Mục tiêu của nghiên cứu là đánh giá tính vượt trội của enoxaparin (1 mg/kg mỗi 12 giờ) so với UFH điều chỉnh theo cân nặng ở bệnh nhân NSTE ACS được điều trị với tirofiban. Chiến lược điều trị (can thiệp sớm hay bảo tồn) tùy thuộc vào bác sĩ điều trị. Tiêu chí chính bao gồm tử vong, NMCT hoặc thiếu máu cục bộ cơ tim không đáp ứng với điều trị tại thời điểm 7 ngày. Trong số 3.978 bệnh nhân trong nghiên cứu, 8,4% trong nhóm enoxaparin bị một biến cố trong tiêu chí chính và tỉ lệ này là 9,4% trong nhóm UFH ([HR] 0,88; CI 95% 0,71-1,08).
Thử nghiệm SYNERGY được thiết kế để so sánh enoxaparin và UFH ở bệnh nhân dự định trải qua can thiệp mạch vành sớm [27]. Có một vài lý do để giải thích tại sao cần có thử nghiệm như vậy. Thứ nhất, những bệnh nhân trải qua chiến lược can thiệp mạch vành sớm thường khác với nhóm điều trị bảo tồn về đặc điểm nhân chủng học và yếu tố nguy cơ. Thứ hai, dùng chiến lược can thiệp sớm cho thấy giảm biến cố thiếu máu ở NSTE ACS, và do đó không rõ có hay không điều trị với enoxaparin sẽ có lợi trong trường hợp điều trị bảo tồn. Thứ ba, những bệnh nhân trải qua can thiệp mạch vành qua da thường nhận 3 thuốc điều trị kháng kết tập tiểu cầu bao gồm aspirin, clopidogrel và ức chế thụ thể GP IIb/IIIa. Thứ tư, các bác sĩ tim mạch can thiệp thường miễn cưỡng dùng enoxaparin trong lúc can thiệp do thiếu sự theo dõi kháng đông liên tục và cũng như do lo ngại về nguy cơ hình thành huyết khối trong sheath. Cuối cùng, thử nghiệm SYNERGY đánh giá enoxaparin và UFH ở nhóm bệnh nhân nguy cơ cao, trong khi đó những thử nghiệm trước đây thì bao gồm phổ rộng dân số NSTE ACS, hầu hết có nguy cơ thấp tới trung bình.
Thử nghiệm SYNERGY là thử nghiệm ngẫu nhiên bao gồm 10.027 bệnh nhân NSTE ACS nguy cơ cao [27]. Bệnh nhân được nhận hoặc là enoxaparin tiêm dưới da hoặc UFH tĩnh mạch điều chỉnh dựa theo cân nặng. Những thuốc dùng đồng thời trong thử nghiệm bao gồm aspirin (95%), clopidogrel hoặc ticlopidine (66%) và ức thế thụ thể GP IIb/IIIa (57%). Chụp động mạch vành được thực hiện ở 92% bệnh nhân; 47% trải qua can thiệp qua da và 19% trải qua CABG. Tiêu chí hiệu quả chính là tử vong toàn bộ hoặc NMCT không tử vong trong 30 ngày đầu sau khi ngẫu nhiên hóa. Kết quả của nghiên cứu cho thấy không có sự giảm ý nghĩa trong tiêu chí chính về tử vong hoặc NMCT không tử vong tại thời điểm 30 ngày hoặc 6 tháng ở nhóm enoxaparin (14% so với 14,5% và 17,6% so với 17,8%, theo thứ tự, với UFH). Cũng không có sự khác biệt về tử vong hoặc NMCT không tử vong hoặc tử vong do tất cả các nguyên nhân tại thời điểm 1 năm (7,4% so với 7,8%). Tuy nhiên, có sự gia tăng ý nghĩa chảy máu nặng trong bệnh viện theo tiêu chuẩn TIMI (giảm ít nhất 5 g/dL hemoglobin, giảm ít nhất 15% hematocrit hoặc chảy máu nội sọ) với enoxaparin (9,1% so với 7,6% của UFH). Không có sự khác biệt ý nghĩa về nhu cầu cần truyền máu (17% so với 16%).
Một phân tích gộp dữ liệu trong năm 2004 của 21.946 bệnh nhân từ 6 thử nghiệm ngẫu nhiên bao gồm ESSENCE, TIMI 11B, phase A của thử nghiệm A-Z, ACUTE II, INTERACT và SYNERGY [54]. Enoxaparin có liên quan tới giảm ý nghĩa tỉ lệ tử vong hoặc NMCT không tử vong tại thời điểm 30 ngày (10,1% so với 11% của UFH, OR 0,91, CI 95% 0,83-0,99). Một sự giảm ý nghĩa tương tự tỉ lệ tử vong hoặc NMCT không tử vong tại thời điểm 30 ngày cũng đã được ghi nhận trong phân tích gộp năm 2007 (9,8% so với 11,4% của UFH, OR 0,84) [52]. Sử dụng phân tích gộp bị hạn chế bởi sự không đồng nhất về dân số nghiên cứu. Ức chế thụ thể GP IIb/IIIa không được dùng trong thử nghiệm ESSENCE và TIMI 11B, được cho ở tất cả bệnh nhân trong phase A của thử nghiệm A-Z, và khoảng một nửa bệnh nhân trong thử nghiệm SYNERGY. Thêm vào đó, thông tim chẩn đoán được thực hiện ở 92% bệnh nhân trong thử nghiệm SYNERGY nhưng chỉ có 45-65% bệnh nhân trong các thử nghiệm khác. Vì vậy, vai trò rõ ràng của enoxaparin ở bệnh nhân được điều trị với ức chế GP IIb/IIIa và ở bệnh nhân trải qua điều trị xâm lấn không thể được xác định từ phân tích gộp.
3.3. Các khuyến cáo hiện nay về sử dụng heparin trong hội chứng mạch vành cấp.
Để tổng kết các quan sát ở trên, enoxaparin và UFH hình như có hiệu quả tương đương trong điều trị bệnh nhân đau thắt nghực không ổn định và NMCT cấp không có đoạn ST chênh lên được đánh giá gộp chung. Tuy nhiên, những bệnh nhân được điều trị bằng chiến lược bảo tồn cho thấy có ít biến cố tim mạch nặng hơn khi điều trị với enoxaparin so với UFH. Hơn nữa, đối với những bệnh nhân trải qua chiến lược can thiệp sớm, UFH có thể phù hợp hơn do gia tăng nguy cơ chảy máu với enoxaparin được thấy trong thử nghiệm SYNERGY.
Trong năm 2007, Hội Tim mạch và Trường Môn Tim mạch Hoa Kì (ACC/AHA) đã đưa ra khuyến cáo về vai trò của của enoxaparin và UFH cho bệnh nhân NSTE ACS như sau: [4]
– Trong số những bệnh nhân mà chiến lược điều trị bảo tồn được chọn lựa, hoặc là enoxaparin hoặc là UFH được đề nghị, nhưng có vẻ hợp lý (khuyến cáo yếu hơn) khi chọn enoxaparin. Thời gian điều trị được đề nghị cho enoxaparin trong thời gian nằm viện tối đa 8 ngày hoặc UFH trong 48 giờ.
– Những bệnh nhân mà dự định thực hiện CABG trong vòng 24 giờ tới, UFH thích hợp hơn do hiệu quả kháng đông của nó có thể được phục hồi nhanh chóng hơn so với enoxaparin. Ở những bệnh nhân đã được điều trị với enoxaparin, enoxaparin nên được ngưng và bệnh nhân nên được chuyển sang UFH với liều phù hợp.
– Những bệnh nhân trải qua can thiệp mạch vành qua da, điều trị kháng đông nên được ngưng sau thủ thuật trong trường hợp không có biến chứng.
– Những bệnh nhân mà điều trị nội khoa được chọn lựa sau khi có kết quả chụp động mạch vành và heparin đã được cho trước khi chụp mạch vành, enoxaparin nên được tiếp tục trong thời gian nằm viện (tối đa 8 ngày) hoặc UFH nên được tiếp tục cho ít nhất 48 giờ hoặc tới khi xuất viện.
Những LMWH khác-dalteparin, nadroparin và tinaparin- không được khuyến cáo ở bệnh nhân NSTE ACS. Mặc dù những thuốc này có hiệu quả hơn so với giả dược, nhưng lại ít hiệu quả hơn so với enoxaparin, không hiệu quả hơn UFH và có thể liên quan tới gia tăng nguy cơ chảy máu.
4. ỨC CHẾ THROMBIN TRỰC TIẾP.
4.1. Cơ chế tác dụng:
Ức chế thrombin trực tiếp (DTIs) tác dụng bằng cách gắn kết với thrombin và ức chế sự tương tác của nó với chất nền (substrate). DTIs không chỉ ức chế trực tiếp sự hình thành fibrin từ fibrinogen bởi tác dụng của thrombin, mà còn có thể ức chế hoạt tính phản hồi của các yếu tố đông máu bởi thrombin và ức chế sự ngưng kết tiểu cầu gây ra do thrombin [9], [66]. DTIs gắn kết với vị trí men thủy phân serine-protease của thrombin và ngăn cản không cho thrombin chuyển fibrinogen thành fibrin (hình 4.1 và 4.2). DTIs được phân loại hoặc là thuốc đơn hóa trị (chỉ gắn kết duy nhất tại vị trí men thủy phân) hoặc hai hóa trị (gắn kết cùng lúc tại vị trí men thủy phân và vị trí ghi nhận chất nền exosite 1. Trong điều trị hội chứng mạch vành cấp, thuốc hai hóa trị cho thấy có những lợi ích lâm sàng tốt hơn [22]. Hiện nay có 3 thuốc DTIs được dùng phổ biến là argatroban, lepirudin và bivalirudin (bảng 4.1). [39]
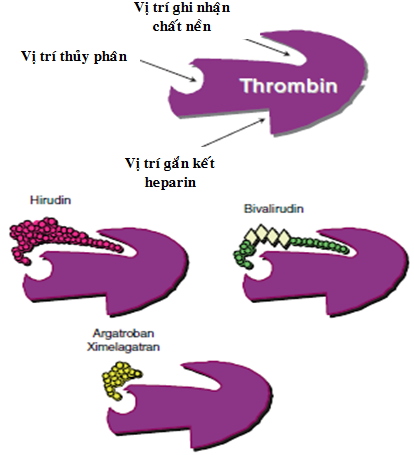
Hình 4.1. Lược đồ mô tả thrombin với các vị trí ghi nhận chất nền (exosite 1 và 2) và vị trí hoạt động của men thủy phân. Các dạng kết hợp của hai hóa trị (hirudin và bivalirudin) và đơn hóa trị (argatroban và ximelagatran).
Bảng 4.1: Các thuốc ức chế thrombin trực tiếp. [39]
|
|
Argatroban |
Lepirudin |
Bivalirudin |
|
Ức chế thrombin |
Thoáng qua |
Ức chế không cạnh tranh (phục hồi chậm) |
Thoáng qua |
|
Thuốc |
Đơn hóa trị |
Hai hóa trị |
Hai hóa trị |
|
Đào thải |
Gan |
Thận |
Men (80%), thận (20%) |
|
Thời gian bán hủy |
39-51 phút |
1-3 giờ |
25 phút |
|
Dùng cho ACS |
Không |
Có |
Có |
|
Dùng điều trị HIT |
Có |
Có |
Không |
|
Dùng trong PCI |
Không |
Không |
Có |
Chú thích: HIT, heparin-induced thrombocytopenia (xuất huyết giảm tiểu cầu do heparin) ; PCI, percutaneous coronary intervention (can thiệp mạch vành qua da); ACS, acute coronary syndrome (hội chứng mạch vành cấp).
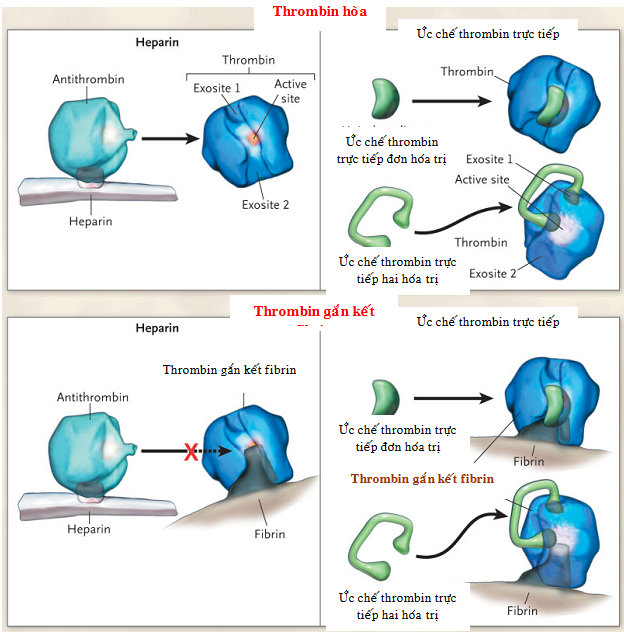
Trong trường hợp không có heparin, tỉ lệ thrombin bị bất hoạt bởi antithrombin tương đối thấp, nhưng sau khi heparin làm thay đổi hình dạng, antithrombin gắn kết và ức chế không phục hồi vị trí tác dụng của thrombin. Vì vậy, hoạt tính kháng đông của heparin bắt nguồn từ khả năng tạo ra phức hợp tam thể heparin-thrombin-antithrombin. Hoạt tính của DTIs thì độc lập với sự hiện diện của antithrombin và có liên quan tới sự tương tác trực tiếp của thuốc này với phân tử thrombin. DTIs hai hóa trị kết hợp cùng lúc tại exosite 1 và vị trí hoạt động, trong khi đó DTIs đơn hóa trị chỉ tác dụng tại vị trí hoạt động của enzyme. Ở hình bên dưới, phức hợp heparin-antithrombin không thể gắn kết được với phức hợp thrombin-fibrin (thrombin đã gắn vào phân tử fibrin), trong khi đó DTIs không chỉ có thể gắn và bất hoạt hoạt động của thrombin hòa tan mà còn tác dụng trên thrombin đã gắn kết với fibrin, như trong trường hợp cục máu đông.
Hình 4.2. Cơ chế tác dụng của ức chế thrombin trực tiếp so với heparin. [47]
Xem PHẦN II (Đang cập nhật)