CHUYỂN HÓA TY THỂ TRONG ĐIỀU KIỆN BÌNH THƯỜNG
Hoạt động co bóp của cơ tim tiêu thụ adenosine triphosphate (ATP) một cách liên tục với vận tốc rất cao, điều được đảm bảo trong điều kiện bình thường bởi lưu lượng tưới máu mạch vành đầy đủ nhằm phục vụ cho sự oxy hóa nhiên liệu carbon và tái tổng hợp ATP qua đường hiếu khí trong các ty thể.
TS Hồ Huỳnh Quang Trí
Viện Tim TP HCM
Bình thường, khoảng 97% ATP được tổng hợp trong tim từ sự oxy hóa acid béo và pyruvate trong ty thể.1 60% phân giải ATP được dùng cho hoạt động co sợi cơ tim và 40% còn lại được dùng cho hoạt động của các bơm ion (chủ yếu là bơm Ca2+-ATPase cần cho sự thư giãn tâm trương và cả bơm trao đổi Na+-K+).1,2
Cơ chất chính của quá trình tổng hợp năng lượng cho hoạt động cơ tim là các acid béo chuỗi dài, chủ yếu là oleate và palmitate, các acid béo này cung cấp 60% đến 80% cơ chất cho sự tổng hợp ATP.3 Tác nhân điều hòa sự oxy hóa acid béo trong cơ tim là nồng độ acid béo tự do trong huyết tương máu động mạch, nồng độ này càng cao thì sự bắt giữ và oxy hóa acid béo ở cơ tim càng tăng.1 Bình thường, nồng độ acid béo tự do tăng ở trạng thái đói và giảm nhanh khi có phóng thích insulin sau ăn.4 Nồng độ acid béo tự do cũng tăng trong nhồi máu cơ tim cấp, sau mổ tim và khi có hoạt hóa hệ giao cảm.4,5 Trong tế bào chất, acid béo chuỗi dài được ester hóa thành acyl-CoA. Acyl-CoA được chuyển thành acylcarnitine bởi enzyme carnitine palmityl transferase I (CPT-I) để đi vào ty thể và trong ty thể acylcarnitine lại được chuyển ngược thành acyl-CoA. Trong ty thể xảy ra hiện tượng b-oxy hóa acyl-CoA để tạo acetyl-CoA và đồng thời sinh ra nicotinamide adenine dinucleotide (NADH). Acetyl-CoA được sử dụng trong chu trình Krebs để tổng hợp ATP, còn NADH có tác dụng điều hòa oxy hóa glucose trong cơ tim.
Oxy hóa carbohydrate (lactate và glucose) chiếm 20% đến 40% năng lượng cần thiết cho sự tổng hợp ATP trong điều kiện bình thường.3 Oxy hóa glucose và lactate tạo ra pyruvate trong tế bào chất. Trong cơ tim khỏe mạnh, sự tổng hợp pyruvate từ 2 nguồn oxy hóa glucose và oxy hóa lactate là ngang nhau. Cơ tim khỏe mạnh tiêu thụ lactate mạnh khi có gắng sức thể lực hoặc kích hoạt hệ giao cảm.6 Trong chất nền của ty thể, pyruvate được oxy hóa bởi phức hợp pyruvate dehydrogenase (PDH) tạo ra acetyl-CoA. PDH bị bất hoạt qua đường phosphoryl hóa bởi PDH kinase và được hoạt hóa qua đường khử phosphoryl bởi PDH phosphatase. Khi sự oxy hóa acid béo tăng, tỉ lệ NADH/NAD+ trong ty thể tăng gây hoạt hóa PDH kinase và ức chế phức hợp PDH dẫn đến ức chế oxy hóa pyruvate (hình 1).
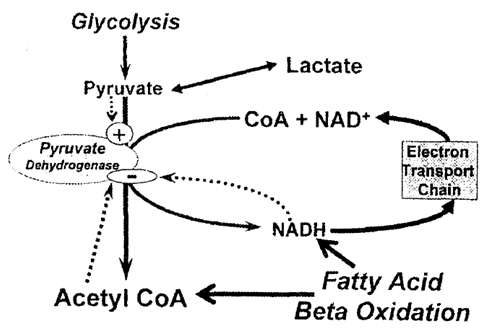
Hình 1: Sự b-oxy hóa acid béo (fatty acid beta oxidation) gây ức chế pyruvate dehydrogenase dẫn đến ức chế oxy hóa pyruvate.
CHUYỂN HÓA TY THỂ TRONG ĐIỀU KIỆN THIẾU MÁU CỤC BỘ CƠ TIM
Thiếu máu cục bộ cơ tim gây trở ngại lớn cho hệ thống tổng hợp ATP trong tế bào: Sự cung cấp oxy không đủ để duy trì vận tốc tái tổng hợp ATP bình thường, lượng ATP trong tế bào giảm, đồng thời lượng ADP, phosphate vô cơ và adenosine tăng lên. Nhìn trên khía cạnh sinh hóa, hệ quả chính của thiếu máu cục bộ là sự giảm tổng hợp ATP từ phosphoryl-oxy hóa trong ty thể do thiếu cung cấp oxy. Giảm tổng hợp ATP theo đường hiếu khí dẫn đến giảm phân giải ATP cần thiết cho chức năng co cơ tim và hoạt động của bơm Ca2+ của mạng lưới nội cơ tương. Giảm tỉ lệ ATP/ADP và tăng AMP vòng (cAMP) cùng với tăng phosphate vô cơ và Ca2+ trong tế bào chất kích hoạt ly giải glucose, bắt giữ glucose và phân giải glycogen. Các nghiên cứu trên động vật thí nghiệm cho thấy trong điều kiện thiếu máu cục bộ cơ tim, acid béo trở thành nhiên liệu chính.4,7 Như đã đề cập ở trên, oxy hóa acid béo ức chế oxy hóa pyruvate. Như vậy, khi có thiếu máu cục bộ cơ tim, pyruvate sinh ra từ ly giải glucose không được oxy hóa trong ty thể mà được chuyển thành lactate trong tế bào chất, hệ quả là lactate tích tụ trong mô và pH nội bào giảm. Giảm pH nội bào ức chế khả năng của cơ tim duy trì sự hằng định nội môi Ca2+, đồng thời góp phần ức chế khả năng sử dụng năng lượng phóng thích từ phân giải ATP để phục vụ cho hoạt động co cơ tim.
Một chỉ số quan trọng đánh giá hiệu năng của việc sử dụng nhiên liệu tổng hợp ATP là tỉ số P/O. Tỉ số P/O được định nghĩa là số phân tử ATP sinh ra từ một phân tử oxy được khử bởi chuỗi vận chuyển electron trong ty thể.3 Tỉ số P/O của acid béo thấp hơn so với tỉ số P/O của glucose, có nghĩa là acid béo có hiệu năng thấp hơn glucose như là một nhiên liệu tổng hợp ATP trong tế bào. Điều này giải thích vì sao hậu quả của thiếu cung cấp oxy trở nên trầm trọng hơn khi trong điều kiện thiếu máu cục bộ cơ tim quá trình oxy hóa glucose ở ty thể gần như bị triệt tiêu bởi sự tăng b-oxy hóa các acid béo.
CHỐNG THIẾU MÁU CỤC BỘ QUA ỨC CHẾ OXY HÓA ACID BÉO TRONG CƠ TIM
Xét trên khía cạnh sinh hóa, ức chế oxy hóa acid béo trong cơ tim có lợi trong tình trạng thiếu máu cục bộ vì sẽ giúp phục hồi oxy hóa carbohydrate (có tỉ số P/O cao hơn) và giảm sự tích tụ lactate trong mô. Có thể ức chế oxy hóa acid béo trong cơ tim ở 3 mức: mức thứ nhất là giảm lượng acid béo vận chuyển đến cơ tim bằng cách giảm nồng độ acid béo tự do lưu hành, mức thứ hai ức chế CPT-I để ngăn vận chuyển acid béo từ tế bào chất vào ty thể và mức thứ ba là ức chế quá trình b-oxy hóa acid béo trong ty thể (hình 2).
Có 2 liệu pháp giúp giảm nồng độ acid béo tự do lưu hành là chẹn thụ thể bvà glucose-insulin-kali (GIK). Từ lâu các thuốc chẹn bđã được dùng điều trị bệnh tim thiếu máu cục bộ dựa vào tác dụng giảm co bóp cơ tim và giảm tần số tim, qua đó giảm nhu cầu oxy của cơ tim. Thuốc chẹn bgiảm trương lực giao cảm nên cũng giảm nồng độ acid béo tự do lưu hành. Nghiên cứu của các tác giả Igarashi và Wallhaus cho thấy thuốc chẹn bcarvedilol giảm hơn 50% sự bắt giữ acid béo tự do trong cơ tim.8,9 Insulin cũng giảm nồng độ acid béo lưu hành, nhưng insulin gây hạ đường huyết và hạ kali/máu nên được dùng chung với glucose và kali truyền tĩnh mạch, gọi là liệu pháp GIK. Về mặt lý thuyết, liệu pháp GIK hấp dẫn vì rẻ tiền và tương đối dễ thực hiện. Tuy nhiên các thử nghiệm lâm sàng với GIK trong nhồi máu cơ tim (NMCT) cấp cho kết quả không như mong đợi. Nếu như trong nghiên cứu DIGAMI thực hiện trên bệnh nhân NMCT cấp có đái tháo đường, liệu pháp GIK giảm tử vong sau 1 năm, trong nghiên cứu DIGAMI 2 cũng thực hiện trên những đối tượng này nhưng có cỡ mẫu lớn hơn, liệu pháp GIK không giảm tử vong lẫn biến cố tim mạch nặng.10,11 Nghiên cứu CREATE-ECLA với cỡ mẫu rất lớn (n = 20.201) thực hiện trên bệnh nhân NMCT cấp với ST chênh lên trong 12 giờ đầu cho thấy liệu pháp GIK hoàn toàn không có ảnh hưởng gì trên tử vong và biến chứng của NMCT (ngưng tim, choáng tim, tái NMCT).12
Một số hoạt chất có tác dụng ức chế CPT-I và ngăn vận chuyển acid béo vào ty thể: etomoxir, oxfenicin và perhexiline. Các hoạt chất này chưa được nghiên cứu nhiều trên lâm sàng, hơn nữa độc tính của chúng làm hạn chế việc áp dụng vào điều trị (etomoxir có độc tính trên gan, perhexiline có độc tính trên gan và thần kinh).1,3
Trên thực tế, ức chế b-oxy hóa acid béo trong ty thể là biện pháp được áp dụng rộng rãi nhất trong thực hành điều trị bệnh tim thiếu máu cục bộ. Có 2 thuốc ức chế trực tiếp các enzyme cần thiết cho quá trình b-oxy hóa acid béo trong ty thể là trimetazidine (ức chế enzyme 3-ketoacyl-coA thiolase – 3-KAT) và ranolazine. Ranolazine chỉ lưu hành ở Bắc Mỹ và chưa có mặt ở Việt Nam nên trong phạm vi bài này chỉ đề cập đến trimetazidine.
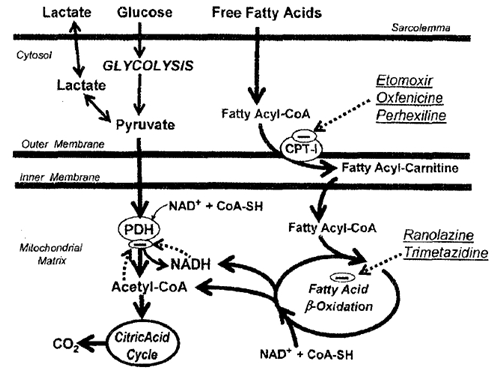
Hình 2: Cơ chế tác dụng của các thuốc ức chế oxy hóa acid béo trong cơ tim: Ngăn vận chuyển acid béo vào ty thể qua ức chế CPT-I và ức chế quá trình b-oxy hóa acid béo trong ty thể.
TRIMETAZIDINE TRONG ĐIỀU TRỊ THIẾU MÁU CỤC BỘ CƠ TIM
Nghiên cứu có qui mô lớn đầu tiên đánh giá hiệu quả của trimetazidine trong điều trị đau thắt ngực ổn định là TRIMPOL II (Trimetazidine in Poland II). Đối tượng nghiên cứu gồm 426 người có đau thắt ngực ổn định xuất hiện khi gắng sức, bệnh mạch vành đã được xác định (hẹp hơn 70% một động mạch vành lớn ở thượng tâm mạc trên phim chụp mạch vành cản quang hoặc tiền sử nhồi máu cơ tim) và đang được điều trị bằng thuốc chẹn bêta metoprolol.13 Bệnh nhân được phân một cách ngẫu nhiên, mù đôi cho dùng trimetazidine hoặc placebo trong 12 tuần. Lúc mới vào nghiên cứu và sau 12 tuần điều trị tất cả bệnh nhân được cho làm nghiệm pháp gắng sức trên thảm lăn theo qui trình Bruce. Tiêu chí đánh giá chính là thay đổi thời gian đến khi xuất hiện ST chênh xuống 1 mm trên điện tim gắng sức (tuần 12 so với lúc mới vào nghiên cứu). Kết quả TRIMPOL II cho thấy sau 12 tuần thời gian đến khi ST chênh xuống 1 mm trên điện tim gắng sức của nhóm trimetazidine dài hơn có ý nghĩa so với nhóm placebo. Các tác giả còn ghi nhận sau 12 tuần tổng thời gian gắng sức, thời gian đến khi xuất hiện đau thắt ngực khi gắng sức và tổng công thực hiện được (tính bằng MET) của nhóm trimetazidine tăng nhiều hơn có ý nghĩa so với nhóm placebo (bảng 1). Trên lâm sàng, số cơn đau thắt ngực mỗi tuần cũng như số lần dùng nitrate để cắt cơn đau thắt ngực mỗi tuần của nhóm trimetazidine giảm nhiều hơn có ý nghĩa so với nhóm placebo (bảng 1).
Bảng 1: Thay đổi các chỉ số điện tim gắng sức và lâm sàng sau 12 tuần điều trị 9.
|
|
Tuần 1 |
Tuần 12 |
Trị số p* |
|
Thời gian đến khi ST ¯1 mm (giây) PL TMZ |
357 ±116 341 ±114 |
381 ±148 427 ±134 |
< 0,01 |
|
Tổng thời gian gắng sức (giây) PL TMZ |
432 ±111 420 ±108 |
458 ±134 485 ±122 |
< 0,05 |
|
Tổng công thực hiện được (MET) PL TMZ |
8,65 ±2,02 8,43 ±1,90 |
8,99 ±2,50 9,65 ±2,22 |
< 0,05 |
|
Thời gian đến khi đau thắt ngực (giây) PL TMZ |
383 ±117 372 ±116 |
423 ±150 465 ±124 |
< 0,01 |
|
Số cơn đau thắt ngực/tuần PL TMZ |
4,2 ±4,3 4,0 ±3,2 |
3,3 ±4,2 2,1 ±2,4 |
< 0,01 |
|
Số lần dùng nitrate /tuần PL TMZ |
3,1 ±3,3 2,8 ±2,5 |
2,3 ±3,9 1,5 ±1,9 |
< 0,05 |
Ghi chú:TMZ = trimetazidine; PL = placebo; *p so sánh TMZ với PL ở tuần 12.
Trong số những người bệnh mạch vành có một nhóm đối tượng rất khó điều trị để kiểm soát triệu chứng đau thắt ngực. Đó là những người có giải phẫu học các động mạch vành không phù hợp cho việc tái tưới máu bằng cả can thiệp qua da lẫn phẫu thuật bắc cầu (thường là những người bệnh đái tháo đường, một bệnh có đặc điểm là gây tổn thương lan tỏa hệ mạch vành). Gần đây Ribeiro và cộng sự đã thực hiện một thử nghiệm lâm sàng phân nhóm ngẫu nhiên, mù đôi, kiểu bắt chéo để đánh giá lợi ích của trimetazidine ở nhóm đối tượng này. 10 người bệnh mạch vành kèm đái tháo đường týp 2 có triệu chứng đau thắt ngực không được kiểm soát bởi phối hợp ít nhất 2 thuốc chống đau thắt ngực qui ước và giải phẫu học động mạch vành không phù hợp cho việc tái tưới máu được lần lượt cho dùng trimetazidine 6 tuần rồi placebo 6 tuần 14. Nhóm nghiên cứu nhận thấy trong thời gian dùng trimetazidine phân độ chức năng theo CCS (Canadian Cardiovascular Society) của bệnh nhân giảm rõ rệt và số cơn đau thắt ngực cũng như số lần dùng nitrate để cắt cơn đau mỗi tuần của bệnh nhân giảm có ý nghĩa. Sau 6 tuần dùng trimetazidine thời gian đến khi ST chênh xuống 1 mm trên điện tim gắng sức tăng có ý nghĩa so với sau 6 tuần dùng placebo.
Năm 2011 Danchin và Marzilli thực hiện một phân tích gộp số liệu của 218 thử nghiệm lâm sàng trên một số lượng bệnh nhân khổng lồ là 19.028 người nhằm đánh giá hiệu quả chống đau thắt ngực/thiếu máu cục bộ tim của trimetazidine ở bệnh nhân đau thắt ngực ổn định.15 Kết quả phân tích gộp này cho thấy trimetazidine có hiệu quả chống thiếu máu cục bộ tim (biểu hiện qua các thông số của nghiệm pháp gắng sức: tổng thời gian gắng sức, thời gian đến khi xuất hiện ST chênh xuống 1 mm và thời gian đến khi xuất hiện đau thắt ngực) cũng như hiệu quả chống đau thắt ngực (biểu hiện qua số cơn đau thắt ngực và số lần dùng nitrate ngậm để cắt cơn mỗi tuần) tương đương các thuốc qui ước là nitrate tác dụng dài, chẹn canxi dihydropyridine và nicorandil.
Một câu hỏi được y giới đặt ra là liệu trimetazidine có cải thiện tiên lượng của bệnh nhân hay không. Bảng 2 tổng hợp kết quả của một số nghiên cứu đoàn hệ và phân tích gộp đánh giá ảnh hưởng của trimetazidine trên tử vong và các biến cố lâm sàng quan trọng. Các dữ liệu này gợi ý trimetazidine có ảnh hưởng thuận lợi trên tiên lượng của người bệnh tim thiếu máu cục bộ và người bệnh suy tim.
Bảng 2: Các nghiên cứu đánh giá ảnh hưởng của trimetazidine trên tiên lượng.
|
Nghiên cứu |
Cỡ mẫu |
Đối tượng |
Kết quả |
|
Fragasso16 |
720 |
Suy tim mạn |
Tử vong do mọi nguyên nhân ¯11% (P = 0,015) Tử vong tim mạch ¯8,5% (P = 0,050) Nhập viện sau 5 năm ¯10,4% (P < 0,0005) |
|
Gao17 |
955 |
Suy tim mạn |
Tử vong do mọi nguyên nhân ¯(RR 0,29; P < 0,0001) Biến cố tim mạch & nhập viện ¯(RR 0,42; P < 0,001) |
|
Zhang18 |
884 |
Suy tim mạn |
Tử vong do mọi nguyên nhân ¯(RR 0,47; P = 0,27) Nhập viện do nguyên nhân tim ¯(RR 0,43; P = 0,03) |
|
METRO19 |
353 |
Sau NMCT |
Tử vong do mọi nguyên nhân ¯(OR 0,36; P = 0,022) |
|
KAMIR20 |
13.733 |
Sau NMCT |
Tử vong do mọi nguyên nhân ¯59% (P < 0,05) Biến cố tim nặng sau 12 tháng ¯76% ( P = 0,001) |
Ghi chú:NMCT = nhồi máu cơ tim; RR = nguy cơ tương đối; OR = tỉ số chênh.
Tại hội nghị khoa học thường niên 2014 của Hội Tim mạch Châu Âu tổ chức tại Barcelona, GS Nicolas Danchin, nguyên chủ tịch Hội Tim mạch Pháp, đã công bố việc chuẩn bị một nghiên cứu lớn mang tên ATPCI (The efficAcy and safety of Trimetazidine in Patients with angina pectoris having been treated by percutaneous Coronary Intervention) có mục tiêu là đánh giá hiệu quả cải thiện tiên lượng dài hạn của trimetazidine ở những bệnh nhân đã được can thiệp mạch vành qua da nhằm điều trị ít nhất một chỗ hẹp của động mạch vành nguyên gốc hoặc cầu nối động mạch vành. ATPCI là một thử nghiệm lâm sàng phân nhóm ngẫu nhiên, mù đôi, dự kiến sẽ tuyển 5.800 bệnh nhân từ 432 trung tâm ở 27 quốc gia. Bệnh nhân sẽ được phân vào một trong 2 nhóm: Trimetazidine MR 35 mg 1 viên x 2/ngày hoặc placebo (được thêm vào trên nền điều trị chuẩn). Tiêu chí đánh giá chính là phối hợp các biến cố chết do nguyên nhân tim, nhập viện vì một biến cố tim, tái xuất hiện hoặc tồn tại triệu chứng đau thắt ngực dẫn đến phải thêm/chuyển đổi/tăng liều một trong số các thuốc chống đau thắt ngực và tái xuất hiện hoặc tồn tại triệu chứng đau thắt ngực dẫn đến phải chụp mạch vành. ATPCI dự kiến sẽ chấm dứt tháng 11/2017. Nếu ATPCI cho kết quả dương tính, y giới sẽ được trang bị thêm một tiếp cận mới trong điều trị bệnh tim thiếu máu cục bộ, không những giúp kiểm soát triệu chứng mà còn cải thiện tiên lượng dài hạn của bệnh nhân.
TÀI LIỆU THAM KHẢO
1) Stanley WC. Myocardial energy metabolism during ischemia and the mechanisms of metabolic therapies. J Cardiovasc Pharmacol Therapeutics 2004;9(suppl I):S31-S45.
2) Suga H. Ventricular energetic. Physiol Rev 1990;70:247-277.
3) Jaswal JS, Keung W, Wang W, et al. Targeting fatty acid and carbohydrate oxidation – A novel therapeutic intervention in the ischemic and failing heart. Biochimica et Biophysica Acta 2011;1813:1333-1350.
4) Lopaschuk GD, Belke DD, Gamble J, et al. Regulation of fatty acid oxidation in the mammalian heart in health and disease. Biochim Biophys Acta 1994;1213:263-276.
5) Lopaschuk GD, Collins-Nakai R, Olley PM, et al. Plasma fatty acid levels in infants and adults after myocardial ischemia. Am Heart J 1994;128:61-67.
6) Massie BM, Schwartz GG, Garcia J, et al. Myocardial metabolism during increased work states in the porcine left ventricle in vivo. Circ Res 1994;74:64-73.
7) Opie LH. The heart: Physiology and metabolism. 1991. Raven Press, New York.
8) Igarashi N, Nozawa T, Fujii N, et al. Influence of beta-adrenoceptor blockade on the myocardial accumulation of fatty acid tracer and its intracellular metabolism in the heart after ischemia-reperfusion injury. Circ J 2006;70:1509-1514.
9) Wallhaus TR, Taylor M, DeGrado TR, et al. Myocardial free fatty acid and glucose use after carvedilol treatment in patients with congestive heart failure. Circulation 2001;103:2441-2446.
10) Malmberg K, Ryden L, Efendic S, et al. Randomized trial of insulin-glucose infusion followed by subcutaneous insulin treatment in diabetic patients with acute myocardial infarction (DIGAMI study): effects on mortality at 1 year. J Am Coll Cardiol 1995;26:57-65.
11) Malmberg K, Ryden L, Wedel H, et al. Intense metabolic control by means of insulin in patients with diabetes mellitus and acute myocardial infarction (DIGAMI 2): effects on mortality and morbidity. Eur Heart J 2005;26:650-661.
12) Mehta SR, Yusuf S, Diaz R, et al. Effect of glucose-insulin-potassium infusion on mortality in patients with acute ST-segment elevation myocardial infarction: the CREATE-ECLA randomized controlled trial. JAMA 2005;26:437-446.
13) Szwed H, Sadowski Z, Elikowski W, et al. Combination in stable effort angina using trimetazidine and metoprolol. Results of a randomized, double-blind, multicentre study (TRIMPOL II). Eur Heart J 2001; 22: 2267-2274.
14) Ribeiro LW, Ribeiro JP, Stein R, et al. Trimetazidine added to combined hemodynamic antianginal therapy in patients with type 2 diabetes: a randomized crossover trial. Am Heart J 2007; 154: 78.e1-78.e7.
15) Danchin N, Marzilli M, Parkhomenko A, Ribeiro JP. Efficacy comparison of trimetazidine with therapeutic alternatives in stable angina pectoris: a network meta-analysis. Cardiology 2011;120:59-72.
16) Fragasso G, Rosano G, Baek SH, et al. Effect of partial fatty acid oxidation inhibition with trimetazidine on mortality and morbidity in heart failure: results from an international multicentre retrospective cohort study. Int J Cardiol 2013;163:320-325.
17) Gao D, Ning N, Niu X, et al. Trimetazidine: a meta-analysis of randomized controlled trials in heart failure. Heart 2011;97:278-286.
18) Zhang L, Lu Y, Jiang H, et al. Additional use of trimetazidine in patients with chronic heart failure: a meta-analysis. J Am Coll Cardiol 2012;59:913-922.
19) Iyengar SS, Rosano GM. Effect of antianginal drugs in stable angina on predicted mortality risk after surviving a myocardial infarction: a preliminary study (METRO). Am J Cardiovasc Drugs 2009;9:293-297.
20) Kim JS, Kim CH, Jeong MH. Effects of trimetazidine in patients with acute myocardial infacrtion: data from the Korean acute myocardial infarction registry. Clin Res Cardiol 2013;102:915-922.







