BS. TRẦN ĐĂNG KHƯƠNG*
BS. NGUYỄN THANH HIỀN
*Khoa Nội TM –BV ĐHYD Tp Hồ Chí Minh
Gần đây người ta nhận ra rằng có một nhóm bệnh nhân suy tim phân suất tống máu giảm (HFrEF) qua thời gian được điều trị nội khoa tối ưu theo guideline, trong một số trường hợp có kèm thêm máy tái đồng bộ thất (CRT), đã có sự hồi phục phân suất tống máu đáng kể. Điều này thu hút sự chú ý của các bác sĩ lâm sàng, nhiều câu hỏi được đặt ra ví dụ như việc điều trị, tiên lượng ở nhóm bệnh nhân này có gì khác biệt với những thể suy tim đã biết hay so với nhóm không có sự cải thiện đáng kể về phân suất tống máu (nhóm không đáp ứng tốt với điều trị nội khoa theo guideline).
Để dễ dàng trong việc bàn luận, các tác giả gọi nhóm bệnh nhân này là suy tim có phân suất tống máu hồi phục (Heart failure with recovered left ventricular ejection fraction: HFrecEF. Theo định nghĩa mới về suy tim của ESC 2021, thể này gọi là suy tim phân suất tống máu cải thiện: Heart failure with improved left ventricular ejection fraction). HFrecEF có thể được chia ra làm hai loại, EF cải thiện trong khoảng 40 – 50% gọi là hồi phục một phần, EF > 50% gọi là hồi phục hoàn toàn (Hình 1). Các nghiên cứu cho thấy tỉ lệ bệnh nhân suy tim EF hồi phục dao động trong khoảng từ 10 – 40%, sở dĩ mức độ dao động khá rộng là do sự khác nhau về định nghĩa cũng như kiểu thiết kế giữa các nghiên cứu.
Đến nay vẫn chưa rõ ràng rằng liệu đây có phải là một thể suy tim hoàn toàn mới. Hay chẳng qua chỉ là quá trình chuyển từ suy tim phân suất tống máu giảm sang phân suất tống máu bảo tồn và suy tim phân suất tống máu trung gian (hay giảm nhẹ: HFmrEF) chính là giai đoạn trung gian trong quá trình chuyển đổi này. Những nghiên cứu trước đây cho thấy rằng suy tim phân suất tống máu trung gian là nhóm bệnh nhân có bệnh cảnh lâm sàng và đặc điểm khá đang dạng, pha trộn đặc điểm của HFrEF có EF đang hồi phục và HFpEF có EF đang bắt đầu giảm. Tuy nhiên trong một bài báo đề nghị phân nhóm suy tim mới của ESC 2021, hiệp hội đã chỉ ra điểm khác biệt quan trọng nhất giữa HFrecEF so với HFpEF và HFmrEF là tiên lượng ở bệnh nhân HFrecEF sẽ xấu hơn, EF giảm tái phát nếu ta ngưng các điều trị nội khoa tối ưu, trong khi đó ở HFpEF và HFmrEF không có đặc điểm này. Hơn nữa tỉ lệ tử vong, tái nhập viện và cơ chế sinh bệnh học của HFrecEF cũng khác biệt so với HFpEF [40]. Từ đó hiệp hội nghĩ HFrecEF xứng đáng được xếp thành một nhóm riêng.
Hiện tượng EF hồi phục có thể xảy ra tự nhiên ở một số thể bệnh cơ tim dãn nở, tuy nhiên đa số các trường hợp EF hồi phục ghi nhận được đều nhờ vào điều trị nội khoa theo phác đồ và máy tái đồng bộ thất[42]. Hơn nữa, rất khó phân biệt được trường hợp nào là EF hồi phục tự nhiên vì đa số bệnh nhân hiện nay đều dù ít hay nhiều cũng được điều trị với các thuốc theo guideline. Nếu không có dữ liệu EF trước đây, sẽ rất khó cho bác sĩ lâm sàng biết được EF này là đang trên đà hồi phục hay giảm xuống, vì vậy việc theo dõi EF là rất quan trọng.
Chính vì sự phức tạp và đa dạng của những bệnh nhân suy tim trong nhóm HFrecEF, hiện nay vẫn còn ít hoặc thậm chí chưa có đồng thuận nào về việc định nghĩa, chẩn đoán và điều trị nhóm bệnh nhân này.
- Cơ chế sinh học của quá trình đảo ngược tái cấu trúc và sự hồi phục chức năng thất trái.
Đường kính cuối tâm trương thất trái là một phần trong công thức tính LVEF, vì vậy sự cải thiện về EF thường đi kèm với hiện tượng giảm đường kính tâm trương thất trái, hiện tượng này còn được gọi là quá trình đảo ngược tái cấu trúc thất trái. Trong nội dung bài viết này, đảo ngược tái cấu trúc thất trái được định nghĩa là sự hồi phục gần bình thường về kích thước của các tế bào cơ tim cũng như hình dạng của thất trái, kết quả là áp lực thất trái cuối kỳ tâm trương cũng được hồi phục về giá trị xấp xỉ bình thường[15]. Quan trọng hơn, quá trình này làm cải thiện khả năng co bóp của cơ tim cũng như của buồng thất trái. Quá trình đảo ngược tái cấu trúc thất trái có mối liên quan với giảm biến cố nhập viện vì suy tim cũng như giảm tử vong do tim mạch, thậm chí giữa hai vấn đề này có mối liên quan về mức độ, quá trình đảo ngược diễn ra càng mạnh mẽ thì tỉ lệ sống còn càng được cải thiện[16].
Mặc dù hiện nay cơ chế về mặt sinh học phân tử của quá trình đảo ngược tái cấu trúc thất trái và sự hồi phục khả năng co bóp thất trái vẫn còn chưa được hiểu hết, tuy nhiên đã có một số giả thuyết ban đầu được đề xuất. Giả thuyết nổi bật nhất là tái cấu trúc thất trái là một quá trình động, nó diễn ra theo cả hai hướng và chịu sự chi phối đa cơ chế ở mức độ tế bào và phân tử, quá trình này ảnh hưởng đến kích thước, hình dáng và chức năng của tim. Nhiều sự thay đổi ở mức độ tế bào và giải phẫu xảy ra do tái cấu trúc thất trái sẽ quay trở về bình thường trong giai đoạn hồi phục.
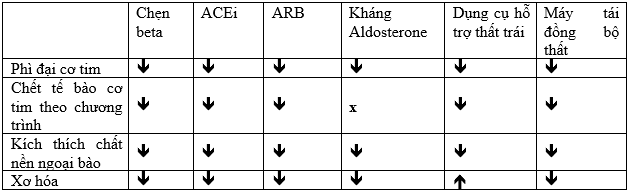
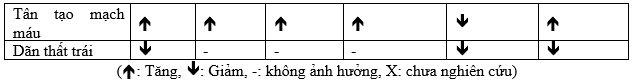
Tham khảo qua nhiều nghiên cứu, bảng 1 cho chúng ta cái nhìn cụ thể về tác dụng tích cực của các phương pháp điều trị suy tim lên từng thành phần của thất trái (tế bào cơ tim, chất nền ngoại bào và đặc điểm của buồng thất trái). Những nghiên cứu về sự thay đổi biểu hiện gen trong quá trình đảo ngược tái cấu trúc thất trái đã cho ra kết luận rằng, sự phiên mã của những gen liên quan đến co bóp cơ tim sẽ hồi phục trước những gen liên quan đến chất nền ngoại bào, điều này nói lên sự hồi phục ở cơ tim là yếu tố chủ chốt trong hồi phục hình dáng thất trái[39]. Tuy nhiên chúng ta cần nhớ, mặc dù khi xét tổng quát đã có sự cải thiện về cấu trúc và chức năng của tim, nhưng nhiều yếu tố về mặt phân tử vẫn còn mang những đặc điểm bất thường. Khi nghiên cứu sâu hơn về sự phiên mã của gen, người ta nhận thấy ở bệnh nhân suy tim có EF hồi phục vẫn còn xuất hiện sự phiên mã của gen liên quan đến quá trình tân sinh (gen bất thường), mà những gen này không hề xuất hiện ở bệnh nhân không suy tim. Có thể nói rằng quá trình đảo ngược tái cấu trúc thất trái không phải là tấm gương phản chiếu ngược lại những gì xảy ra khi thất trái từ bình thường tiến triển thành suy tim, mà đây chỉ là sự thích ứng mới của thất trái, giúp đưa mọi thứ từ mặt phân tử cho tới cấu trúc về trạng thái gần như bình thường, kết quả của quá trình này là sự hồi phục chức năng tống máu và cải thiện dự hậu.Tóm lại, EF hồi phục không phải là hiện tượng chữa khỏi hẳn suy tim, mà chỉ là đưa trái tim trở về trạng thái ít bệnh lý hơn mà thôi.
Từ những tham luận ở trên chúng ta đã biết quá trình hồi phục chức năng thất trái diễn ra ở nhiều cấp độ và nhiều cơ chế, nhưng liệu có một yếu tố nào đó là động lực chính cho quá trình hồi phục, tức là nếu tác động vào yếu tố này, quá trình hồi phục sẽ tự động diễn ra như một dòng thác. May mắn thay, ngày nay chúng ta đã xác định được nó với những bằng chứng mạnh mẽ, đó là hiện tượng tăng gánh thất trái. Lấy ví dụ một bệnh lý chỉ gây tăng gánh thất trái đơn thuần là hẹp van động mạch chủ, buồng thất trái phì đại trong hẹp van động mạch chủ sẽ kích hoạt một loạt tín hiệu sinh lý bệnh về mặt phân tử, cuối cùng dẫn đến biến đổi chức năng và cấu trúc thất trái. Chính vì vậy yếu tố quan trọng nhất, động lực chính cho quá trình hồi phục chức năng thất trái và đảo ngược quá trình tái cấu trúc là làm giảm áp lực lên cơ tim[20]. Điều này đã được kiểm chứng trong một số nghiên cứu về các dụng cụ hỗ trợ tống máu thất trái và đặc biệt là trong nghiên cứu về máy tái đồng bộ cơ tim, trong các nghiên cứu này người ta nhận thấy hiện tượng giảm phì đại tế bào cơ tim và thất trái có mối liên hệ mạnh mẽ với việc cải thiện biểu hiện của các gen, các gen này sẽ tác động đến các quá trình như co bóp, chuyển hóa của tế bào cơ tim, khung xương tế bào, sarcomere, đáp ứng của các thụ thể beta.
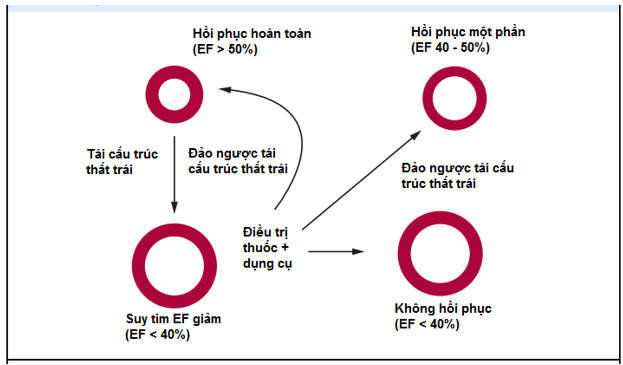
Hình 1: Lưu đồ biến đổi EF ở bệnh nhân suy tim EF giảm được điều trị theo guideline[41]
Bảng 1: Các yếu tố ảnh hưởng lên quá trình hồi phục thất trái ở mức độ tế bào và phân tử.[41]
- Dịch tễ của quá trình đảo ngược và hồi phục chức năng thất trái.
Quá trình đảo ngược tái cấu trúc và phục hồi chức năng thất trái có thể diễn ra một cách tự nhiên ở nhiều trường hợp. Nhờ việc quan sát chúng, ta đã có được những gợi ý biến đổi về mặt sinh học của quá trình đảo ngược. Điều đáng nói hơn là nhiều trường hợp chức năng thất trái vẫn hồi phục ngay cả khi thất trái đã suy nặng. Hiện tượng hồi phục chức năng thất trái tự nhiên thường xảy ra sau khi đã chấm dứt được những yếu tố làm mất bù chức năng cơ tim. Có 3 nhóm nguyên nhân gây suy tim có tỉ lệ hồi phục và đảo ngược tái cấu trúc thất trái tự nhiên cao nhất: bất thường trong sử dụng năng lượng, nhiễm độc và phản ứng viêm. Trong đó nhóm suy tim do bất thường sử dụng năng lượng hoặc do bất thường về chuyển hóa (ví dụ như nhịp nhanh kéo dài, cường giáp, nhược giáp) có tỉ lệ hồi phục tự nhiên cao nhất[9],[12]. Nhóm có khả năng hồi phục cao thứ hai là bệnh cơ tim giãn nở có liên quan đến phản ứng miễn dịch như bệnh cơ tim chu sinh, viêm cơ tim lympho bào thể hoạt động và suy tim có liên quan đến phản ứng viêm hệ thống. Sự hồi phục chức năng thất trái cũng được quan sát ở những trường hợp ngưng phơi nhiễm với các hóa chất độc tế bào cơ tim như rượu và các thuốc điều trị ung thư như anthracyclines, tyrosine kinase inhibitors và các kháng thể đơn dòng[12]. Đối với bệnh cơ tim dãn nở, người ta còn ghi nhận có sự khác biệt về khả năng hồi phục chức năng tim giữa người da trắng và da đen, giữa nam và nữ, theo đó thì khả năng hồi phục chức năng thất trái và tỉ lệ thoát khỏi gánh nặng triệu chứng sẽ cao hơn ở nữ giới và người da trắng[23].
Có nhiều bằng chứng cho thấy ở bệnh nhân suy tim sau khi được điều trị nội khoa tối ưu, được đặt các thiết bị hỗ trợ và/hoặc can thiệp phẫu thuật có thể xuất hiện quá trình đảo ngược tái cấu trúc và phục hồi chức năng thất trái. Nhiều nghiên cứu đã cho thấy tỉ lệ hồi phục khá cao sau khi được can thiệp mạch vành ở bệnh nhân có bệnh tim thiếu máu cục bộ[24]. Mặc dù vai trò của việc tầm soát sống còn cơ tim ở những bệnh nhân này còn chưa rõ, tuy nhiên đã có nhiều nghiên cứu cho thấy ở những bệnh nhân cơ tim còn sống, họ có khả năng cao hồi phục được chức năng thất trái, tăng khả năng gắng sức và giảm tỉ lệ tử vong sau khi được tái thông mạch vành.
Điều trị nội khoa bằng cách ức chế hệ thần kinh giao cảm và hệ renin-angiotensin-aldosterone cũng cho thấy có mối liên quan với việc hồi phục chức năng thất trái, đảo ngược quá trình tái cấu trúc và cải thiện tiên lượng. Trong những thuốc tác động lên cơ chế thần kinh thể dịch, thì ức chế beta là loại thuốc có mối liên quan mạnh mẽ nhất với quá trình đảo ngược tái cấu trúc thất trái. Đối với các thuốc ức chế hệ RAA nói chung, mặc dù có rất nhiều bằng chứng ủng hộ nhóm này ngăn ngừa quá trình tái cấu trúc tiến triển xấu đi, nhưng ở chiều ngược lại (đảo ngược quá trình tái cấu trúc) lại không được ủng hộ bởi những bằng chứng mạnh mẽ[30]. Riêng đối với nhóm thuốc ức chế thụ thể angiotensin (ARB) có nghiên cứu cho thấy làm giảm đường kính tâm trương thất trái và làm tăng LVEF[7]. Gần đây, điều trị với sacubitril/valsartan đã cho thấy làm cải thiện chức năng và đảo ngược quá trình tái cấu trúc thất trái ở bệnh nhân suy tim có EF giảm[14]. Tổng kết lại các nghiên cứu này, chúng ta có thể rút ra hệ thần kinh giao cảm và RAA chính là những tín hiệu chính trong cơ chế sinh lý bệnh của quá trình tái cấu trúc thất trái, và điều trị làm giảm gánh nặng của những yếu tố này tạo điều kiện thuận lợi cho quá trình đảo ngược tái cấu trúc thất trái diễn ra. Bảng 2 cung cấp những yếu tố thuận lợi cho quá trình đảo ngược tái cấu trúc.
HFrecEF lần đầu tiên được lưu ý đến là trong các nghiên cứu hồi cứu đơn trung tâm. Tác giả Punnoose và cộng sự đã viết bài báo cáo đầu tiên về những trường hợp này, họ chỉ rõ đặc điểm của những bệnh nhân thuộc nhóm suy tim EF cải thiện và báo cáo tỉ lệ khoảng 34%, trong báo cáo này có đặc điểm đáng chú ý là tới 70% bệnh nhân được chẩn đoán suy tim EF bảo tồn có bằng chứng suy tim EF giảm trước đó. Những bệnh nhân có EF cải thiện thường trẻ hơn, có ít bệnh nền hơn, tỉ lệ mắc bệnh mạch vành thấp hơn[28]. Một nghiên cứu khác của Basuray và cộng sự có quy mô lớn hơn và thời gian theo dõi lên tới 9 năm, định nghĩa HFrecEF trong nghiên cứu là bệnh nhân trước đây có EF < 50%, hiện tại EF > 50%. Kết quả chỉ khoảng 10% bệnh nhân có EF cải thiện và chỉ số EF chênh lệch trước và sau điều trị khoảng 28% trong vòng 29 tháng, đặc điểm những bệnh nhân này cũng tương tự với nghiên cứu của Punnoose là trẻ tuổi, ít bệnh đi kèm và tỉ lệ bệnh mạch vành thấp[4]. Khi so sánh tiên lượng giữa bệnh nhân HFrecEF và HFrEF đang được điều trị nội khoa theo phác đồ, người ta nhận thấy HFrEF làm tăng gấp 4 lần nguy cơ tử vong do mọi nguyên nhân, ghép tim và phải sử dụng các công cụ hỗ trợ thất trái so với HFrecEF, trong khi con số tương tự ở bệnh nhân HFpEF là 2,3 lần. Có một điều thú vị là tỉ lệ tái nhập viện vì suy tim, tỉ lệ tổn thương cơ tim và bất thường các dấu ấn viêm ở bệnh nhân HFrecEF và HFpEF là như nhau.
Những nghiên cứu lớn hơn sau đó cũng đã xác nhận những phát hiện này. Các yếu tố thuận lợi cho quá trình hồi phục EF ngoài nữ giới, tuổi trẻ, nguyên nhân suy tim không phải do thiếu máu cục bộ, các nhà nghiên cứu đã tìm ra thêm các yếu tố khác như thời gian suy tim ngắn, không có block nhánh trái trên điện tim[19]. Gần đây các thử nghiệm lâm sàng lớn đa trung tâm đã cho cái nhìn khách quan hơn về HFrecEF. Trong nghiên cứu Val-HeFT với 3517 bệnh nhân đã cho thấy có khoảng 9% bệnh nhân có EF < 35% đã cải thiện EF >40% sau 1 năm theo dõi[7]. Bảy biến số có liên quan đến khả năng hồi phục của bệnh nhân là BMI, nguyên nhân suy tim, tỉ lệ đường kính thất trái/ diện tích bề mặt cơ thể, điều trị với valsartan, huyết áp tâm trương, có điều trị với chẹn beta và giới tính. Tuy nhiên có một tỉ lệ lớn bệnh nhân hiện diện cả bảy yếu tố trên theo xu hướng có lợi vẫn không thể cải thiện EF. Các nghiên cứu về máy tái đồng bộ cơ tim cho thấy có một vài bệnh nhân HFrEF cải thiện ngoạn mục khi được cấy máy vào cơ thể. Những bệnh nhân này có đặc điểm suy tim không phải do thiếu máu cục bộ, block nhánh trái với QRS rất dãn rộng, giới nữ, siêu âm tim có bằng chứng mất đồng bộ. Các nghiên cứu nhỏ về sau chỉ ra trong nhóm bệnh nhân cải thiện ngoạn mục này, nếu chúng ta tắt máy tái đồng bộ đi thì tỉ lệ HFrEF tái phát lên tới 78% trong vòng 12 tháng[5].
Tóm lại, dù định nghĩa về HFrecEF có ra sao đi nữa thì đa số các dữ liệu đều thống nhất tuổi trẻ, giới nữ, suy tim không do nguyên nhân thiếu máu cục bộ, ít bệnh đồng mắc là những yếu tố thuận lợi cho tiến trình cải thiện chức năng thất trái. Hơn nữa, kết cục lâm sàng của HFrecEF tốt hơn so với HFrEF và HFpEF khi so sánh về tử vong. Tuy nhiên chúng ta cần nhớ là những đợt nhập viện vì suy tim và triệu chứng suy tim vẫn còn ở bệnh nhân HFrecEF mặc dù không ở tần suất thường xuyên như bệnh nhân HFrEF
Bảng 2: Những yếu tố dự đoán khả năng hồi phục chức năng thất trái
| Yếu tố thuận lợi của quá trình đảo ngược tái cấu trúc thất trái | |
| Yếu tố về lâm sàng | Suy tim không do nguyên nhân thiếu máu cơ tim
Thời gian mắc bệnh suy tim ngắn Giới nữ Không có block nhánh trái Block nhánh trái có đặt máy tái đồng bộ |
| Siêu âm tim và MRI tim | EF thấp nhưng strain tốt
Đường kính thất trái lớn Không có hiện tượng tăng tín hiệu muộn trên MRI |
| Dấu ấn sinh học | NT-proBNP thấp
Troponin thấp sST2 thấp |
- Diễn tiến tự nhiên của quá trình hồi phục EF
Mặc dù quá trình đảo ngược và hồi phục chức năng thất trái thường sẽ đi kèm với việc cải thiện kết cục lâm sàng, tuy nhiên ngày càng có nhiều bằng chứng cho thấy ngay cả ở những bệnh nhân có chức năng và cấu trúc thất trái hồi phục hoàn toàn sau khi được điều trị nội khoa theo guideline, thì một tỉ lệ lớn vẫn có nguy cơ suy giảm chức năng thất trái tái phát và phải nhập viện vì suy tim. Câu trả lời tại sao một số bệnh nhân có chức năng và cấu trúc thất trái cải thiện có thể thoát khỏi các triệu chứng và nhập viện vì suy tim trong khi một số bệnh nhân có sự cải thiện tương tự vẫn bị tái phát tình trạng suy tim đến giờ vẫn chưa rõ. Hiện nay có một giải thích tạm thời cho vấn đề này là các đặc điểm cấu trúc phân tử ở một trái tim bị suy vẫn không mất đi hoàn toàn, có nghĩa là quá trình đảo ngược tái cấu trúc thất trái này chỉ đưa thất trái về trạng thái ít bệnh lý hơn, ổn định hơn và có thể duy trì được chức năng thất trái tốt trong những điều kiện bình thường. Tuy nhiên, những bệnh nhân này có khả năng dự trữ sinh lý tim mạch kém hơn so với người khỏe mạnh, vì vậy triệu chứng suy tim và suy giảm chức năng thất trái rất dễ tái phát khi xuất hiện các stress về huyết động, thần kinh thể dịch hay môi trường. Mặc dù cơ chế cụ thể làm suy giảm khả năng dự trữ tim mạch ở những bệnh nhân này chưa rõ ràng, người ta cho rằng có thể do sự mất các tế bào cơ tim, bất thường trong việc điều hòa quá trình phiên mã, chuyển hóa tế bào, chuyển hóa protein và sự bất thường trong cấu trúc ba chiều của chất nền ngoại bào làm ảnh hưởng đến vấn đề thất trái có hồi phục bền vững hay không[5]. Người ta nhận thấy quá trình suy giảm chức năng thất trái càng kéo dài thì sự hồi phục càng khó được duy trì. Minh chứng cho việc này là chức năng thất trái thường hồi phục tốt và bền vững hơn ở những trường hợp tổn thương thoáng qua như cơ tim bị nhiễm độc, còn đối với những trường hợp tổn thương kéo dài hoặc vĩnh viễn như do gen, do nhồi máu cơ tim thì sự hồi phục không được bền vững, dễ tái phát.
- Nguyên nhân của bệnh cơ tim có ý nghĩa quan trọng trong vấn đề hồi phục chức năng thất trái
Hiểu rõ cơ chế sinh lý bệnh của suy tim là yếu tố tiên quyết để hiểu được tiên lượng và điều trị bệnh nhân HFrecEF. Thật vậy, điều trị một số thể bệnh cơ tim cụ thể đang là lĩnh vực phát triển mạnh, đặc biệt trong lĩnh vực tim mạch liên quan ung thư, chẳng hạn như rối loạn chức năng thất do trastuzumab, phản ứng viêm trong liệu pháp ức chế chốt kiểm miễn dịch. Các kháng thể đơn dòng chẹn thụ thể ErbB2 làm rối loạn quá trình cân bằng và tự hồi phục của cơ tim, từ đó gây ra suy giảm chức năng cả tâm thu và tâm trương. Tác giả Narayan và cộng sự đã báo cáo 277 bệnh nhân ung thư bị suy giảm chức năng thất trái khi điều trị với transtuzumab và sự hồi phục sau ngưng thuốc là không hoàn toàn ở thời điểm sau 3 năm[25].
Bệnh cơ tim takotsubo trước đây được xem là một tình trạng giảm nặng chức năng thất trái thoáng qua do các biến cố lớn về cảm xúc và thường hồi phục hoàn toàn sau đó. Tuy nhiên, Scally và cộng sự gần đây đã chỉ ra rằng chỉ có các dấu ấn sinh học và EF là trở về bình thường, khảo sát sâu hơn chúng ta thấy sức căng cơ tim theo chu vi ở vùng mỏm và sức căng cơ tim theo chiều dọc không hề hồi phục trên siêu âm tim đánh dấu mô, MRI mô cơ tim cho thấy tăng tín hiệu trên T1 hơn so với bình thường. Những đặc điểm này là bằng chứng cho thấy quá trình viêm cơ tim vẫn âm thầm tiếp diễn, các đại thực bào vẫn tiếp tục thâm nhập và hoạt động, các cytokin trong đáp ứng viêm hệ thống vẫn tiếp tục tăng[32],[31]. Hơn nữa, các dữ liệu gần đây đã cho thấy gánh nặng bệnh tật của Takotsubo về lâu dài tương đương với hội chứng vành cấp. Tuy nhiên, đến thời điểm hiện tại vẫn chưa có bằng chứng cho thấy liệu các bệnh nhân này có được hưởng lợi từ việc điều trị suy tim theo phác đồ hay không.
Bệnh cơ tim do rượu thường có EF hồi phục sau khi ngưng tiêu thụ rượu. Một nghiên cứu quan sát trong vòng 15 năm đã cho thấy rằng suy tim do rượu một khi đã hồi phục thường bền vững và ít tái phát hơn hẳn so với suy tim do các bệnh cơ tim khác. Ware và cộng sự tìm ra bệnh cơ tim do rượu và bệnh cơ tim dãn nở có những đặc điểm chung về di truyền học[38]. Một số nghiên cứu khác cho thấy tiên lượng giữa bệnh cơ tim do rượu và bệnh cơ tim dãn nở khá tương đồng nhau, vì vậy chúng tôi khuyến cáo các điều trị suy tim theo phác đề nên được tiếp tục ở các bệnh nhân bệnh cơ tim do rượu có EF hồi phục
Viêm cơ tim tối cấp là thể bệnh khá hiếm gặp tuy nhiên tiên lượng rất tốt, các nghiên cứu cho thấy tỉ lệ sống còn lên tới > 90% sau 11 năm theo dõi nếu họ có thể vượt qua được đợt cấp (thường trong đợt này họ cần phải sử dụng các máy hỗ trợ điều trị choáng tim). Nghiên cứu từ bệnh viện Johns Hopkins chỉ ra biến cố viêm cơ tim càng nặng nề, thì tỉ lệ hồi phục hoàn toàn sẽ càng cao ở những bệnh nhân có thể sống sót được qua đợt cấp[18]. Cơ chế bệnh sinh của viêm cơ tim tối cấp và viêm cơ tim cấp có thể có sự khác biệt, đó là lý do tại sao hai nhóm bệnh nhân này có sự khác biệt rõ ràng về tiên lượng. Ở những bệnh nhân viêm cơ tim cấp tỉ lệ sống còn sau 11 năm chỉ khoảng 45%. Tuy nhiên vẫn có những nghiên cứu cho ra kết quả ngược lại, một nghiên cứu khác tìm ra tiên lượng về lâu dài của viêm cơ tim tối cấp lympho bào thể hoạt động lại xấu hơn so với viêm cơ tim cấp với tỉ lệ tử vong hoặc ghép tim ở thời điểm 60 ngày là 19,5% và 0%, còn ở thời điểm 7 năm là 41,4% và 3,1%[3]. Bởi vì sự mâu thuẫn giữa các bằng chứng về tiên lượng của hai thể viêm cơ tim này, chúng tôi khuyến cáo nên tiếp tục các điều trị nội khoa theo hướng dẫn ở những bệnh nhân HFrecEF do viêm cơ tim dù ở thể nào đi nữa.
- Định nghĩa suy tim có phân suất tống máu hồi phục.
Bệnh nhân suy tim có phân suất tống máu hồi phục là những bệnh nhân suy tim phân suất tống máu giảm có đáp ứng điều trị, họ có thể có những yếu tố về sinh học và đặc điểm lâm sàng khác với với bệnh nhân HFrEF và HfpEF. Vì vậy chúng tôi đề nghị nên có một tên gọi riêng cho nhóm bệnh nhân này, đó là suy tim phân suất tống máu hồi phục, thuật ngữ này chỉ ra rằng họ đã từng là những bệnh nhân suy tim có tái cấu trúc thất trái (ví dụ như thất trái giãn). Thuật ngữ này cũng làm tránh sự nhầm lẫn với những bệnh nhân HFpEF (có EF > 50%, cũng như những bệnh nhân có phân suất tống máu trung gian (LVEF từ 40 đến 50%). Như đã đề cập phía trên, một trong những rào cản chính của việc tìm hiểu về thể bệnh này là sự không đồng thuận trong tiêu chuẩn chẩn đoán. Giới hạn thứ hai là chưa có hướng dẫn nào hiện nay chỉ dẫn việc theo dõi thể bệnh này. Vì vậy, chúng tôi xin đưa ra định nghĩa và hướng dẫn của hội đồng các chuyên gia được đăng trên tạp chí Trường Môn Tim Mạch Hoa Kỳ vào năm 2020 [41]:
– Khi phát hiện một bệnh nhân HFrecEF, điều quan trọng là phải khai thác được quá trình cải thiện EF của bệnh nhân, song song đó cần khai thác thêm các biến số quan trọng khác như mức độ tổn thương cơ tim, mức độ tái cấu trúc thất trái và tình trạng này đã diễn ra trong bao lâu, các điều trị đã có trước đó.
– Sau đây chúng tôi trình bày định nghĩa về HFrecEF tương đồng trong đa số các nghiên cứu: 1) có bằng chứng LVEF < 40% khi chưa điều trị; 2) EF sau điều trị – EF trước điều trị> 10%; 3) có bằng chứng cho thấy LVEF cải thiện > 40%. Những sự cải thiện về EF thường đi kèm với giảm thể tích thất trái.
– Siêu âm tim đo EF lại nên được thực hiện ít nhất mỗi 3 đến 6 tháng, lúc bệnh nhân đang ổn định về huyết động để tránh những thay đổi về EF do nhịp tim hay do tiền tải hoặc hậu tải.
- Điều trị bệnh nhân có bệnh cơ tim hồi phục.
Mặc dù có sự cải thiện về mặt kết cục, những bệnh nhân HFrecEF vẫn có nguy cơ tái nhập viện và tử vong cao hơn so với người không có suy tim, vì vậy những bệnh nhân này không thể gọi là hoàn toàn bình thường hay chữa khỏi hoàn toàn suy tim[4],[28]. Như đã bàn luận trước đây, mặc dù quá trình tái cấu trúc thất trái được đảo ngược lại ở một số bệnh nhân, thậm chí EF và kích thước thất trái trở về bình thường, nhưng thực chất đây chỉ là sự thoái lui của quá trình bệnh lý chứ không phải là suy tim được chữa khỏi hoàn toàn. Việc điều trị nội khoa tối ưu cho nhóm bệnh nhân này hiện vẫn chưa rõ ràng do thiếu các bằng chứng từ các nghiên cứu tiến cứu đáng tin cậy. Thật ra, chỉ có một nghiên cứu phân nhóm ngẫu nhiên có nhóm chứng gồm 50 bệnh nhân HFrecEF không do thiếu máu cơ tim, mục tiêu là khảo sát đáp ứng sau ngưng điều trị nội khoa theo hướng dẫn ở nhóm dân số bệnh nhân này[11]. Từ kết quả nghiên cứu và các bằng chứng tốt nhất ở thời điểm hiện tại, chúng tôi đưa ra những khuyến cáo liên quan tới theo dõi, đánh giá và điều trị dưới đây:
Khám lâm sàng, triệu chứng và điện tim.
Tĩnh mạch cổ nổi và dấu hiệu quá tải dịch là những triệu chứng thường gặp ở bệnh nhân HFrecEF. Nhóm bệnh nhân HFrecEF cần phải sử dụng lợi tiểu quai để kiểm soát triệu chứng là nhóm có nguy cơ cao rơi vào suy tim mất bù trong tương lai. Ngoài ra, triệu chứng khó thở khi gắng sức vẫn thường xuyên xuất hiện, mặc dù không quá nặng, triệu chứng này phản ánh những bất thường vẫn còn tồn tại như tăng áp lực mao mạch phổi bít khi gắng sức hoặc khi nghỉ, mất khả năng tăng nhịp thích hợp, tăng áp phổi, mất khả năng dự trữ dãn mạch và rối loạn vi tuần hoàn.
Điện tim là một phương tiện xét nghiệm ít tốn kém để phân tầng nguy cơ bệnh nhân HFrecEF. Block nhánh trái là một biểu hiện cho thấy khả năng đáp ứng với điều trị nội khoa kém và dấu hiệu sẽ đáp ứng với máy tái đồng bộ thất[36]. Hơn nữa, những thông số nói lên khả năng tái cực thất trên ECG như góc của phức bộ QRST, độ phân tán của QT có mối liên quan với khả năng hồi phục của cơ tim ở những bệnh nhân suy tim cấp và bệnh cơ tim không thiếu máu[27]. Nếu ECG không hồi phục bình thường hoàn toàn, điều này cho thấy bệnh cơ tim vẫn còn hiện diện.
Các vấn đề liên quan đến tiền căn và di truyền
Ở bệnh nhân có bệnh cơ tim dãn không do thiếu máu cục bộ thì việc khai thác tiền sử bệnh lý qua 3 thế hệ là điều rất quan trọng. Trong chừng mực nào đó, nó đóng vai trò gợi ý tiên lượng, khả năng hồi phục của bệnh nhân, khả năng mắc bệnh của thế hệ sau, và đặc điểm này hoàn toàn độc lập với EF. Tất cả người thân trong vòng 1 thế hệ với người bệnh đều được khuyến cáo nên thực hiện siêu âm tim, đo ECG và khám lâm sàng để tầm soát bệnh tim. Ngoài ra, bác sĩ lâm sàng nên cân nhắc thực hiện các xét nghiệm về di truyền ở bệnh nhân bệnh cơ tim dãn (DCM) có EF hồi phục, bởi vì kết quả di truyền học có thể dự đoán được thời gian hồi phục sẽ kéo dài bao lâu, nguy cơ tái phát HFrEF, nguy cơ đột tử, nguy cơ rối loạn nhịp trên thất và nguy cơ mắc bệnh của các thành viên khác trong gia đình. Herman và cộng sự đã báo cáo khoảng 15 – 25% bệnh nhân DCM có đột biến mất đoạn ở gen TTN[13]. Ware và cộng sự cũng tìm thấy đột biến tương tự ở phụ nữ có bệnh cơ tim chu sinh với tỉ lệ 15%[37]. Người ta nhận thấy ở những bệnh nhân DCM có dạng đột biến này thường hồi phục khi được điều trị nội khoa tối ưu theo guideline.
Ngoài ra có một vấn đề cũng cần quan tâm là nguy cơ đột tử ở bệnh nhân HFrecEF, người ta nhận thấy nguy cơ này vẫn còn hiện diện và dai dẳng khi bệnh nhân có bệnh cơ tim liên quan đến di truyền mặc dù EF có hồi phục đi chăng nữa. Ví dụ, đột biến các gen DSP, SCN5A, LMNA và FLNC làm tăng đáng kể nguy cơ rối loạn nhịp so với các bệnh nhân có bệnh cơ tim dãn không do gen hoặc do đột biến các loại gen khác, mặc dù EF có hồi phục sau khi được điều trị nội khoa tối ưu[8],[22].
Siêu âm tim 2D
Bên cạnh việc thăm khám lâm sàng thì đáp ứng của bệnh nhân với điều trị nội khoa theo phác đồ phải được đánh giá trên siêu âm tim 2D. Những dấu hiệu trên siêu âm của HFrecEF là giảm thể tích cuối tâm thu và tâm trương thất trái, cải thiện dòng hở chức năng van hai lá và không có dấu hiệu của rối loạn chức năng thất phải. Mặc dù về tổng quan thì có sự cải thiện chức năng tế bào cơ tim, nhưng chức năng tâm trương và sức căng cơ tim theo chiều dọc được đo lường bằng siêu âm tim đánh dấu mô thì không hoàn toàn trở về bình thường ở bệnh nhân HFrecEF. Tuy nhiên, sức căng cơ tim theo chiều dọc càng cao (ví dụ >16%) là yếu tố tiên lượng bệnh nhân có khả năng cao duy trì được EF hồi phục trong một khoảng thời gian cỡ 2 năm[2]. Tác giả Swat và cộng sự khi nghiên cứu trên bệnh nhân trong đợt cấp suy tim do bệnh cơ tim dãn đã tìm ra rằng sức căng cơ tim theo chiều dọc càng cao thì tỉ lệ EF hồi phục sẽ càng cao (ví dụ > 8%), điều này đúng cả ở những bệnh nhân có thất trái dãn lớn[35].
Chụp cộng hưởng từ tim
Chụp cộng hưởng từ là công cụ tốt nhất để đánh giá cơ tim và chất nền ngoại bàotừ đó giúp chúng ta có cái nhìn ban đầu về nguyên nhân suy tim. Ví dụ, hình ảnh tăng quan muộn rất gợi ý một số loại bệnh cơ tim, ví dụ như sarcoidosis và loạn dưỡng cơ. Sự có hay không hình ảnh tăng quang muộn là yếu tố tiên lượng khả năng đáp ứng của bệnh nhân với các điều trị về thần kinh thể dịch trong suy tim và tiên đoán nguy cơ tim mạch ở cả bệnh tim thiếu máu cục bộ và các loại bệnh tim không do thiếu máu cục bộ. Cụ thể hơn, ở bệnh cơ tim không do thiếu máu cục bộ, không có hình ảnh tăng quan muộn là yếu tố dự đoán mạnh cơ tim có thể hồi phục và tiên lượng tốt[21]. Hình ảnh trên T1 có thể đánh giá được thể tích chất nền ngoại bào và xơ hóa mô kẽ, đây là biện pháp đầy hứa hẹn có thể dự đoán đáp ứng với điều trị và tiên lượng lâu dài của suy tim.
Các dấu ấn sinh học
Hiện nay có nhiều dấu ấn sinh học khác nhau bao gồm troponin, ST2, peptide lợi niệu, galectin – 3, mỗi loại dấu ấn sẽ liên quan đến những quá trình và cơ chế riêng biệt ví dụ như quá trình tổn thương cơ tim hoặc sửa chữa tế bào cơ tim. Chính vì vậy mỗi dấu ấn sinh học có ý nghĩa tiên lượng không phụ thuộc vào nhau và có tác động cộng gộp để tiên lượng bệnh nhân. Ví dụ đối với NTproBNP, nồng độ trong máu càng giảm nhanh và nhiều sẽ tiên lượng chức năng thất trái cải thiện tốt hơn, đường kính thất trái giảm rõ hơn cũng như kết cục lâm sàng tốt hơn[6]. Một nghiên cứu khác cũng đã khẳng định sử dụng phối hợp càng nhiều dấu ấn sinh học sẽ làm tăng đáng kể khả năng tiên đoán kết cục của bệnh nhân suy tim[17]. Bởi vì vẫn có một tỉ lệ bệnh nhân HFrecEF bị tái phát EF giảm, nên việc theo dõi sát các dấu ấn sinh học và các xét nghiệm về hình ảnh học là cần thiết ở mỗi lần bệnh nhân tái khám.
- Các vấn đề cần quan tâm ở bệnh nhân HFrecEF
- Có thể ngưng được một số loại hoặc toàn bộ thuốc điều trị suy tim ở bệnh nhân suy tim có phân suất tống máu hồi phục? Có những bằng chứng nào cho thấy có sự chữa khỏi hoàn toàn suy tim.
Trong một nghiên cứu nhãn mở TRED-HF, những nhà nghiên cứu đã thử nghiệm giả thuyết liệu điều trị nội khoa suy tim theo phác đồ có thể ngưng ở bệnh nhân HFrecEF không triệu chứng và có EF tăng từ < 40% lên > 50%, thể tích cuối tâm trương thất trái bình thường, NT-proBNP < 250ng/l sau điều trị. Sau khi xem xét hồ sơ của 936 bệnh nhân, 51 trường hợp đã được phân nhóm ngẫu nhiên thành hai nhóm, nhóm một ngưng các điều trị suy tim theo hướng dẫn, nhóm hai vẫn tiếp tục các điều trị suy tim đang sử dụng; sau đó các bệnh nhân trong nhóm hai cũng được ngưng thuốc. Trong vòng 6 tháng, 11 (44%) trong số 25 bệnh nhân ở nhóm một và 9 trong số 25 bệnh nhân từ nhóm thứ hai xuất hiện lại các triệu chứng suy tim với bằng chứng là EF giảm xuống trong khoảng từ 10 – 50%, thể tích thất trái cuối tâm trương tăng lên 10% và thậm chí một số trường hợp tăng cao hơn chỉ số bình thường, chỉ số NT-proBNP tăng gấp đôi > 400 ng/l, hoặc có bằng chứng của suy tim. Quan trọng là không có trường hợp nào tử vong xảy ra. Dựa vào bằng chứng của nghiên cứu thử nghiệm lâm sàng có phân nhóm ngẫu nhiên này, chúng tôi khuyến cáo không nên ngưng các thuốc điều trị suy tim theo guideline ở bệnh nhân HFrecEF ngoại trừ bệnh nhân đang chăm sóc giảm nhẹ. Điều đáng lưu ý hơn là trong nghiên cứu TRED-HF, triệu chứng và dấu hiệu suy tim tái phát xảy ra sau nhiều tháng ngưng điều trị chứ không phải là trong vài ngày hay vài tuần[11]. Từ đó chúng ta có thể rút ra, ở những bệnh nhân HFrecEF nếu cần ngưng điều trị suy tim trong vài ngày do có những bệnh cấp tính khác mới xuất hiện thì khả năng bệnh nhân tái phát triệu chứng suy tim trong khoảng thời gian này là khá thấp.
Dừng lợi tiểu được ủng hộ ở những bệnh nhân HFrecEF, thật vậy, việc một bệnh nhân suy tim không cần phải phụ thuộc vào lợi tiểu là chỉ dấu cho thấy khả năng tái phát suy tim EF giảm là khá thấp. Chúng tôi khuyến cáo rằng ở bệnh nhân HFrecEF còn phụ thuộc vào lợi tiểu thì việc chỉnh liều các thuốc GDMT đến liều đích nên được tiếp tục. Hơn nữa, nên cân nhắc sử dụng ARNI thay vì ức chế men chuyển ở nhóm bệnh nhân này. Những phân tích gộp gần đây của nghiên cứu PARADIGM-HF và PARAGON-HF cho thấy rằng hiệu quả vượt trội của nhóm sacubitril/valsartan so với các thuốc ức chế hệ RAS không những xuất hiện ở nhóm có EF giảm mà còn có hiệu quả ở nhóm có EF giảm nhẹ[34]. Giải thích cho điều này có thể trong nhóm bệnh nhân suy tim HFmrEF có những bệnh nhân suy tim HFrecEF và đây là lý do tại sao các thuốc ức chế thần kinh thể dịch lại có hiệu quả. Kinh nghiệm của chúng tôi quan sát trên lâm sàng cho thấy việc tiếp tục các thuốc suy tim theo guideline là cần thiết, vì ở những bệnh nhân tái phát HFrEF thì nguy cơ tổn thương cơ tim và khả năng hồi phục lại EF lần nữa rất thấp
- Những bệnh nhân này nên được theo dõi như thế nào và tần suất là bao lâu một lần?
Bảng 3 tóm tắt những đồng thuận hiện tại về vấn đề tần suất theo dõi và tái khám ở bệnh nhân HFrecEF. Khi bệnh nhân đã được điều trị ổn định trong khoảng thời gian ít nhất một năm, chúng tôi đề nghị nên được theo dõi mỗi 6 tháng một lần trong ít nhất 3 năm, sau đó tối thiểu mỗi năm một lần để phòng ngừa nguy suy tim tái phát và nhập viện vì suy tim[4],[28]. Ở mỗi lần khám, bệnh nhân nên được kiểm tra các dấu ấn sinh học liên quan đến tình trạng tim mạch, đánh giá lại triệu chứng và dấu hiệu suy tim, động viên bệnh nhân tuân thủviệc uống thuốc, điều trị và chẩn đoán sớm các bệnh đồng mắc khác.
Các xét nghiệm về hình ảnh học là một phần quan trọng trong quá trình theo dõi để đánh giá liệu sự hồi phục này có bền vững hay không, tần suất đánh giá sẽ phụ thuộc vào người bệnh và nguy cơ của họ. Hiện nay chưa có các tiêu chuẩn siêu âm thích hợp dành riêng cho nhóm bệnh nhân này. Dựa trên những bằng chứng hiện tại và kinh nghiệm lâm sàng, chúng tôi đề nghị siêu âm tim nên được thực hiện ít nhất 2 năm một lần để khảo sát khả năng duy trì sự hồi phục của cơ tim hoặc có thể thực hiện sớm hơn nếu có triệu chứng của suy tim bắt đầu xuất hiện[2]. Thậm chí tần suất kiểm tra lại siêu âm tim có thể thưa hơn nữa nếu bệnh nhân ổn định qua một thời gian dài. Tuy nhiên đến hiện nay thì khả năng duy trì hồi phục của cơ tim vẫn chưa được hiểu rõ, vì vậy chúng tôi khuyến cáo thời gian theo dõi bằng hình ảnh học nên được thực hiện ít nhất là 3 đến 5 năm, liệu khoảng thời gian này có thể kéo dài hơn không cần có những nghiên cứu theo dõi dọc trong tương lai. Ở những bệnh nhân có nguy cơ cao (ví dụ như block nhánh trái dai dẳng, bệnh cơ tim dãn nở do di truyền, giá trị của các dấu ấn sinh học còn cao, có nhiều bệnh đồng mắc) nên được theo dõi với quãng thời gian ngắn hơn. Hơn nữa, những bệnh nhân HFrecEF ổn định một thời gian dài có thể tái phát EF giảm nếu mắc phải những biến cố khác về tim mạch ví dụ như bệnh mạch vành, các rối loạn nhịp mới hay rung nhĩ mới xuất hiện. Bệnh nhân HFrecEF nếu có nguy cơ cao tái phát HFrEF nên được theo dõi sát hơn, và các bác sĩ lâm sàng nên lưu ý rằng không phải mọi trường hợp tái phát đều là hậu quả của vấn đề không đáp ứng với điều trị nội khoa theo phác đồ, mà nguyên nhân có thể là do sự xuất hiện của những bệnh tim mạch khác. Hình 3 thể hiện lịch theo dõi đối với một bệnh nhân HFrecEF có nguy cơ cao tái phát HFrEF.
| Khám lâm sàng và ECG | Theo dõi holter 24 giờ
|
NT-proBNP | Siêu âm tim có đánh dấu mô | MRI | |
| Mỗi 6 tháng (trong giai đoạn mới chẩn đoán HFrecEF đến tháng thứ 12 – 18) | x | x | x | ||
| Sau 1 năm từ lúc chẩn đoán HFrecEF | x | ||||
| Mỗi 6 – 12 tháng | x | x | |||
| Mỗi 1 – 3 năm | x | ||||
| Mỗi 1 – 2 năm nếu bệnh cơ tim do gen có nguy cơ rối loạn nhịp (vd: TTN) | x |
Bảng 3: Theo dõi bệnh nhân suy tim EF hồi phục.[41]
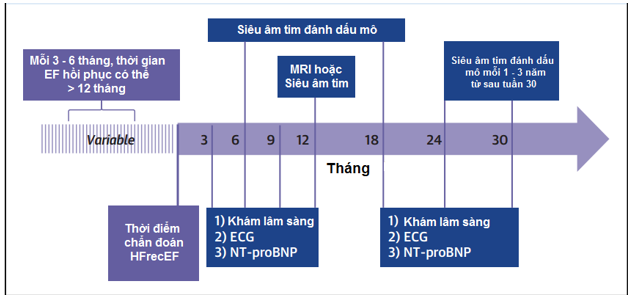
Hình 3: Kế hoạch theo dõi bệnh nhân HFrecEF có nguy cơ cao tái phát EF giảm (bao gồm bệnh nhân có nhiều bệnh đồng mắc, block nhánh trái, bệnh cơ tim dãn do di truyền, dấu ấn sinh học còn cao)[41]
- Máy phá rung có mang lại lợi ích ở những bệnh nhân HFrecEF?
Ở một số bệnh nhân HFrEF đã được đặt máy ICD, sau đó khi tình trạng EF cải thiện các bệnh nhân này sẽ trở thành HFrecEF có đặt máy ICD từ trước, hiện nay người ta vẫn chưa trả lời được liệu ICD này còn có lợi khi EF đã cải thiện. Tuy nhiên, người ta thấy rằng ở những bệnh nhân có thời gian hồi phục EF càng lâu (thường những bệnh nhân này sẽ được đặt máy ICD) sẽ có nguy cơ đột tử cao hơn so với những bệnh nhân có EF hồi phục chỉ trong một thời gian ngắn (những bệnh nhân này thường không đạt tiêu chuẩn để đặt máy)[29]. Một phân tích gộp gần đây đã cho bằng chứng ủng hộ quan điểm nguy cơ rối loạn nhịp vẫn còn dai dẳng ở bệnh có EF hồi phục, khoảng 3,3% trường hợp rối loạn nhịp nguy hiểm mỗi năm ở những bệnh nhân có LVEF ³ 45% và đã được đặt máy ICD[33]. Nghiên cứu SCD HeFT (Sudden Cardiac Death in Heart Failure Trial) cho thấy ICD đem lại lợi ích về mặt tử vong cho bệnh nhân có EF hồi phục ³ 35% tương tự như ở bệnh nhân có EF giảm[1].
Những phương pháp điều trị bằng dụng cụ cho bệnh nhân HFrEF vẫn chưa được nhắc tới trong các hướng dẫn hiện tại. Tuy nhiên, các guideline có đề cập cấy máy khử rung nên được thực hiện cho một số bệnh nhân mang gen đột biến có nguy cơ cao rối loạn nhịp bất chấp LVEF nếu trên lâm sàng có triệu chứng suy tim. Bởi vì những rối loạn nhịp nguy hiểm tính mạng có thể xảy ra ở những bệnh nhân có LVEF bình thường, nên việc cấy máy khử rung được khuyến cáo cho những đột biến gen đặc biệt như LMNA, SCN5A và FLNC bất chấp chỉ số EF[10],[26].
Hiện không có nghiên cứu tiến cứu về máy ICD trong dân số bệnh nhân HFrecEF; tuy nhiên dựa trên những bằng chứng khoa học mới nhất ở thời điểm hiện tại vẫn ủng hộ việc tiếp tục duy trì máy ICD ở bệnh nhân HFrecEF, đặc biệt là ở những bệnh nhân có gen đột biến có nguy cơ rối loạn nhịp cao, có tiền căn đã từng sốc điện chuyển nhịp hoặc ECG vẫn còn bất thường. Cũng tương tự vậy, CRT cũng nên được tiếp tục bởi vì sự mất đồng bộ về điện học và quá trình tái cấu trúc thất trái có thể tái phát nếu các phương pháp tái đồng bộ bị dừng lại.
- Kết luận:
Mặc dù hiện nay sinh bệnh học, diễn tiến tự nhiên và tiên lượng của HFrecEF chưa rõ ràng. Tuy nhiên với những bằng chứng hiện tại, ta có thể thấy ở bệnh nhân có đặc điểm trẻ tuổi, nguyên nhân suy tim không phải bệnh tim thiếu máu cục bộ, ít bệnh đồng mắc sẽ có khả năng hồi phục EF khi được điều trị tối ưu theo phác đồ.
HFrecEF có tỉ lệ tử vong thấp hơn và tiên lượng tốt hơn so với HFrEF và HFpeEF, nhưng có tới 40% bệnh nhân HFrecEF bị tái phát EF giảm. Vì vậy điều trị nội khoa tối ưu cũng như dụng cụ hỗ trợ nên được tiếp tục ở nhóm bệnh nhân này.
Chính vì có bệnh nhân HFrecEF có thể tái phát EF giảm trong tương lai, do đó các nhà nghiên cứu trên thế giới cho rằng nên gọi đây là thể suy tim EF cải thiện sẽ chính xác hơn là suy tim EF hồi phục.
TÀI LIỆU THAM KHẢO
- Adabag Selcuk, Patton Kristen K., Buxton Alfred E., Rector Thomas S., Ensrud Kristine E., et al., “Association of Implantable Cardioverter Defibrillators With Survival in Patients With and Without Improved Ejection Fraction: Secondary Analysis of the Sudden Cardiac Death in Heart Failure Trial”.JAMA cardiology,(2017) 2 (7), pp. 767-774.
- Adamo L., Perry A., Novak E., Makan M., Lindman B. R., et al., “Abnormal Global Longitudinal Strain Predicts Future Deterioration of Left Ventricular Function in Heart Failure Patients With a Recovered Left Ventricular Ejection Fraction”.Circ Heart Fail,(2017) 10 (6).
- Ammirati E., Veronese G., Brambatti M., Merlo M., Cipriani M., et al., “Fulminant Versus Acute Nonfulminant Myocarditis in Patients With Left Ventricular Systolic Dysfunction”.J Am Coll Cardiol,(2019) 74 (3), pp. 299-311.
- Basuray A., French B., Ky B., Vorovich E., Olt C., et al., “Heart failure with recovered ejection fraction: clinical description, biomarkers, and outcomes”.Circulation,(2014) 129 (23), pp. 2380-7.
- Cay S., Ozeke O., Ozcan F., Aras D., Topaloglu S., “Mid-term clinical and echocardiographic evaluation of super responders with and without pacing: the preliminary results of a prospective, randomized, single-centre study”.Europace,(2016) 18 (6), pp. 842-50.
- Daubert M. A., Adams K., Yow E., Barnhart H. X., Douglas P. S., et al., “NT-proBNP Goal Achievement Is Associated With Significant Reverse Remodeling and Improved Clinical Outcomes in HFrEF”.JACC Heart Fail,(2019) 7 (2), pp. 158-168.
- Florea V. G., Rector T. S., Anand I. S., Cohn J. N., “Heart Failure With Improved Ejection Fraction: Clinical Characteristics, Correlates of Recovery, and Survival: Results From the Valsartan Heart Failure Trial”.Circ Heart Fail,(2016) 9 (7).
- Gigli M., Merlo M., Graw S. L., Barbati G., Rowland T. J., et al., “Genetic Risk of Arrhythmic Phenotypes in Patients With Dilated Cardiomyopathy”.J Am Coll Cardiol,(2019) 74 (11), pp. 1480-1490.
- Givertz M. M., Mann D. L., “Epidemiology and natural history of recovery of left ventricular function in recent onset dilated cardiomyopathies”.Curr Heart Fail Rep,(2013) 10 (4), pp. 321-30.
- Halliday B. P., Cleland J. G. F., Goldberger J. J., Prasad S. K., “Personalizing Risk Stratification for Sudden Death in Dilated Cardiomyopathy: The Past, Present, and Future”.Circulation,(2017) 136 (2), pp. 215-231.
- Halliday Brian P., Wassall Rebecca, Lota Amrit S., Khalique Zohya, Gregson John, et al., “Withdrawal of pharmacological treatment for heart failure in patients with recovered dilated cardiomyopathy (TRED-HF): an open-label, pilot, randomised trial”.The Lancet,(2019) 393 (10166), pp. 61-73.
- Hellawell J. L., Margulies K. B., “Myocardial reverse remodeling”.Cardiovasc Ther,(2012) 30 (3), pp. 172-81.
- Herman Daniel S., Lam Lien, Taylor Matthew R.G., Wang Libin, Teekakirikul Polakit, et al., “Truncations of Titin Causing Dilated Cardiomyopathy”.New England Journal of Medicine,(2012) 366 (7), pp. 619-628.
- Januzzi J. L., Jr., Prescott M. F., Butler J., Felker G. M., Maisel A. S., et al., “Association of Change in N-Terminal Pro-B-Type Natriuretic Peptide Following Initiation of Sacubitril-Valsartan Treatment With Cardiac Structure and Function in Patients With Heart Failure With Reduced Ejection Fraction”.Jama,(2019) 322 (11), pp. 1085-1095.
- Kass D. A., Baughman K. L., Pak P. H., Cho P. W., Levin H. R., et al., “Reverse remodeling from cardiomyoplasty in human heart failure. External constraint versus active assist”.Circulation,(1995) 91 (9), pp. 2314-8.
- Kramer D. G., Trikalinos T. A., Kent D. M., Antonopoulos G. V., Konstam M. A., et al., “Quantitative evaluation of drug or device effects on ventricular remodeling as predictors of therapeutic effects on mortality in patients with heart failure and reduced ejection fraction: a meta-analytic approach”.J Am Coll Cardiol,(2010) 56 (5), pp. 392-406.
- Ky B., French B., Levy W. C., Sweitzer N. K., Fang J. C., et al., “Multiple biomarkers for risk prediction in chronic heart failure”.Circ Heart Fail,(2012) 5 (2), pp. 183-90.
- Lieberman Eric B., Herskowitz Ahvie, Rose Noel R., Baughman Kenneth L., “A Clinicopathologic Description of Myocarditis”.Clinical Immunology and Immunopathology,(1993) 68 (2), pp. 191-196.
- Lupón J., Díez-López C., de Antonio M., Domingo M., Zamora E., et al., “Recovered heart failure with reduced ejection fraction and outcomes: a prospective study”.Eur J Heart Fail,(2017) 19 (12), pp. 1615-1623.
- Mann D. L., Bristow M. R., “Mechanisms and models in heart failure: the biomechanical model and beyond”.Circulation,(2005) 111 (21), pp. 2837-49.
- Masci P. G., Schuurman R., Andrea B., Ripoli A., Coceani M., et al., “Myocardial fibrosis as a key determinant of left ventricular remodeling in idiopathic dilated cardiomyopathy: a contrast-enhanced cardiovascular magnetic study”.Circ Cardiovasc Imaging,(2013) 6 (5), pp. 790-9.
- McNally E. M., Mestroni L., “Dilated Cardiomyopathy: Genetic Determinants and Mechanisms”.Circ Res,(2017) 121 (7), pp. 731-748.
- McNamara D. M., Starling R. C., Cooper L. T., Boehmer J. P., Mather P. J., et al., “Clinical and demographic predictors of outcomes in recent onset dilated cardiomyopathy: results of the IMAC (Intervention in Myocarditis and Acute Cardiomyopathy)-2 study”.J Am Coll Cardiol,(2011) 58 (11), pp. 1112-8.
- Mrosek M., Labeit D., Witt S., Heerklotz H., von Castelmur E., et al., “Molecular determinants for the recruitment of the ubiquitin-ligase MuRF-1 onto M-line titin”.Faseb j,(2007) 21 (7), pp. 1383-92.
- Narayan H. K., Finkelman B., French B., Plappert T., Hyman D., et al., “Detailed Echocardiographic Phenotyping in Breast Cancer Patients: Associations With Ejection Fraction Decline, Recovery, and Heart Failure Symptoms Over 3 Years of Follow-Up”.Circulation,(2017) 135 (15), pp. 1397-1412.
- Ortiz-Genga M. F., Cuenca S., Dal Ferro M., Zorio E., Salgado-Aranda R., et al., “Truncating FLNC Mutations Are Associated With High-Risk Dilated and Arrhythmogenic Cardiomyopathies”.J Am Coll Cardiol,(2016) 68 (22), pp. 2440-2451.
- Prenner Stuart B., Swat Stanley A., Ng Jason, Baldridge Abigail, Wilcox Jane E., “Parameters of repolarization heterogeneity are associated with myocardial recovery in acute heart failure”.International Journal of Cardiology,(2020) 301, pp. 147-151.
- Punnoose L. R., Givertz M. M., Lewis E. F., Pratibhu P., Stevenson L. W., et al., “Heart failure with recovered ejection fraction: a distinct clinical entity”.J Card Fail,(2011) 17 (7), pp. 527-32.
- Russo A. M., Stainback R. F., Bailey S. R., Epstein A. E., Heidenreich P. A., et al., “ACCF/HRS/AHA/ASE/HFSA/SCAI/SCCT/SCMR 2013 appropriate use criteria for implantable cardioverter-defibrillators and cardiac resynchronization therapy: a report of the American College of Cardiology Foundation appropriate use criteria task force, Heart Rhythm Society, American Heart Association, American Society of Echocardiography, Heart Failure Society of America, Society for Cardiovascular Angiography and Interventions, Society of Cardiovascular Computed Tomography, and Society for Cardiovascular Magnetic Resonance”.J Am Coll Cardiol,(2013) 61 (12), pp. 1318-68.
- Saraon T., Katz S. D., “Reverse Remodeling in Systolic Heart Failure”.Cardiol Rev,(2015) 23 (4), pp. 173-81.
- Scally C., Rudd A., Mezincescu A., Wilson H., Srivanasan J., et al., “Persistent Long-Term Structural, Functional, and Metabolic Changes After Stress-Induced (Takotsubo) Cardiomyopathy”.Circulation,(2018) 137 (10), pp. 1039-1048.
- Scally C., Abbas H., Ahearn T., Srinivasan J., Mezincescu A., et al., “Myocardial and Systemic Inflammation in Acute Stress-Induced (Takotsubo) Cardiomyopathy”.Circulation,(2019) 139 (13), pp. 1581-1592.
- Smer A., Saurav A., Azzouz M. S., Salih M., Ayan M., et al., “Meta-analysis of Risk of Ventricular Arrhythmias After Improvement in Left Ventricular Ejection Fraction During Follow-Up in Patients With Primary Prevention Implantable Cardioverter Defibrillators”.Am J Cardiol,(2017) 120 (2), pp. 279-286.
- Solomon S. D., Vaduganathan M., B L. Claggett, Packer M., Zile M., et al., “Sacubitril/Valsartan Across the Spectrum of Ejection Fraction in Heart Failure”.Circulation,(2020) 141 (5), pp. 352-361.
- Swat S. A., Cohen D., Shah S. J., Lloyd-Jones D. M., Baldridge A. S., et al., “Baseline Longitudinal Strain Predicts Recovery of Left Ventricular Ejection Fraction in Hospitalized Patients With Nonischemic Cardiomyopathy”.J Am Heart Assoc,(2018) 7 (20), pp. e09841.
- Sze Edward, Samad Zainab, Dunning Allison, Campbell Kristen Bova, Loring Zak, et al., “Impaired Recovery of Left Ventricular Function in Patients With Cardiomyopathy and Left Bundle Branch Block”.Journal of the American College of Cardiology,(2018) 71 (3), pp. 306-317.
- Ware J. S., Seidman J. G., Arany Z., “Shared Genetic Predisposition in Peripartum and Dilated Cardiomyopathies”.N Engl J Med,(2016) 374 (26), pp. 2601-2.
- Ware J. S., Amor-Salamanca A., Tayal U., Govind R., Serrano I., et al., “Genetic Etiology for Alcohol-Induced Cardiac Toxicity”.J Am Coll Cardiol,(2018) 71 (20), pp. 2293-2302.
- Weinheimer C. J., Kovacs A., Evans S., Matkovich S. J., Barger P. M., et al., “Load-Dependent Changes in Left Ventricular Structure and Function in a Pathophysiologically Relevant Murine Model of Reversible Heart Failure”.Circ Heart Fail,(2018) 11 (5), pp. e004351.
- Wilcox Jane E., Yancy Clyde W., “Heart Failure—A New Phenotype Emerges”.JAMA Cardiology,(2016) 1 (5), pp. 507-509.
- Wilcox Jane E., Fang James C., Margulies Kenneth B., Mann Douglas L., “Heart Failure With Recovered Left Ventricular Ejection Fraction: JACC Scientific Expert Panel”.Journal of the American College of Cardiology,(2020) 76 (6), pp. 719-734.
- Yancy C. W., Jessup M., Bozkurt B., Butler J., Casey D. E., Jr., et al., “2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation/American Heart Association Task Force on practice guidelines”.Circulation,(2013) 128 (16), pp. e240-327.







