“Tăng huyết áp được đặc trưng bởi sự mất cân bằng nội mô giữa angiotensin II và bradykinin. Trong điều kiện bình thường, bradykinin có thể trung hòa hết các tác dụng có hại trên mạch máu của angiontensin II, bradykinin là 1 chất giãn mạch mạnh, nhưng nó cũng có tác dụng kháng viêm và chống tạo thành mảng xơ vữa giúp bảo vệ thành mạch. Ngoài ra, bradykinin thúc đẩy việc trao đổi nước và điện giải qua thận, làm giảm cung lượng tim và hạ huyết áp.” ssss
N. Clavreu
Cộng hòa Pháp
Dịch thuật: BS CKI Trịnh Thị Bích Hà
Bệnh viện Đại học Y Dược
Khi bắt đầu điều trị tăng huyết áp(THA), các hướng dẫn điều trị THAđều chú ý đến mục tiêu ngăn ngừa bệnh tim mạch. Tuy nhiên, khi điều trị THA, ngay cả khi huyết áp được kiểm soát tốt bệnh nhân (BN) đều có nguy cơ bệnh tim mạch, nói cách khác, hạ áp thôi là chưa đủ. Mỗi thuốc khác nhau có cơ chế tác dụng khác nhau. Perindopril có bằng chứng thuyết phục trong điều trị BN mới được chẩn đoán THA vì có khả năng làm giảm angiotensin II trong khi vẫn giữ bradykinin, bảo vệ BN không bị xơ vữa mạch máu. Sự bảo tồn bradykinin có thể giúp giải thích về sự khác biệt với thuốc chẹn hệ renin-angiotensin-aldosterone trong việc giảm huyết áp và bảo vệ mạch vành. Tuy nhiên, nhiều BN THA đã bị xơ vữa mạch máu khi mới chẩn đoán. Điều trị phối hợp với thuốc giãn mạch như lợi tiểu thiazide và chẹn kênh calci (CCB), ví dụ indapamide và amlodipine, làm giảm áp lực trong mạch máu ngoại vi và làm giảm huyết áp. Như vậy, CCB/lợi tiểu có hiệu quả giảm nguy cơ đột quỵ, một nguy cơ thường gặp ở người cao tuổi. Tìm hiểu kỹ tiến triển của bệnh là rất cần thiết để lựa chọn thuốc điều trị THA cho BN.
Medicographia. 2015;37:440-448
Ngoại trừ một số nước ở châu Phi và Đông Âu, tỷ lệ tử vong do các bệnh tim mạch trên thế giới đã giảm trong những thập kỷ gần đây [1]. Tuy vậy, THA vẫn còn là 1 trong những nguyên nhân gây tử vong nhiều nhất [2]. Thật vậy, một nghiên cứu gần đây ở Anh nhấn mạnh rằng mặc dù có cải thiện từ năm 1994, tỷ lệ BN kiểm soát được huyết áp (HA) ở mức <140/90mmHg chỉ đạt 37% [3]. Giải thích điều này có thể do ngưỡng HA để bắt đầu điều trị, như vậy chỉ có 58% BN được điều trị THA. Nhưng phương pháp điều trị thường không toàn diện, và 2 yếu tố chính không được quan tâm đầy đủ: các nguy cơ của BN THA và thời gian để kiểm soát HA. Một phân tích nhỏ của nghiên cứu PRIME (Nghiên cứu tiến cứu về dịch tễ học của nhồi máu cơ tim) cho thấy rằng BN đang dùng thuốc hạ áp ở mức cơ bản, mặc dù HA vẫn kiểm soát tốt nhưng vẫn tăng đáng kể nguy cơ bị các biến cố tim mạch (+50%, p<0,001) và tử vong do nguyên nhân tim mạch (+62%, p<0,05) [4]. Nghiên cứu này cho thấy điều trị THA không chỉ là hạ chỉ số HA mà còn điều trị toàn diện, cụ thể cho từng BN.
Các chỉ số khác có thể có ích hơn huyết áp đo tại phòng khám, giúp lựachọn phương pháp điều trị, đánh giá độ cứng động mạch cụ thể. Đánh giá độ cứng của động mạch đã được đề cập trong hướng dẫn của Châu Âu trong việc quản lý THA từ năm 2007 [5]. Một số nghiên cứu đã thực sự thể hiện rằng độ cứng của động mạch tương quan độc lập với biến cố tim mạch và tỷ lệ tử vong, chủ yếu thông qua việc đo vận tốc xung. Hiện nay có nhiều phương pháp điều trị phối hợp với perindopril, amlodipine và indapamide với bằng chứng mạnh mẽ về lợi ích tim mạch…
Bảng viết tắt tên các nghiên cứu
|
Viết tắt |
Tên đầy đủ |
|
ACE |
Angiotensin-converting enzyme |
|
ADVANCE |
Action in Diabetes and Vascular disease: PreterAx and DiamicroN MR Controlled Evaluation |
|
ADVANCE-ON |
Action in Diabetes and Vascular disease: PreterAx and DiamicroN MR Controlled Evaluation–ObservatioNal study |
|
ASCOT |
Anglo-Scandinavian Cardiac Outcomes Trial
|
|
CAFE |
Conduit Artery Function Evaluation |
|
EFFICIENT |
EFfects of a FIxed Combination of Indapamide sustained-release with amlodipine on blood prEssure iN hyperTension |
|
EUROPA |
EUropean trial on Reduction Of cardiac events with Perindopril in stable coronary Artery disease |
|
HYVET |
HYpertension in the Very Elderly Trial |
|
PEACE |
Prevention of Events with Angiotensin Converting Enzyme inhibition |
|
PERTINENT |
PERindopril-Thrombosis InflammatioN,Endothelial dysfunction and Neurohormonal activation Trial |
|
PRIME |
Prospective Epidemiological Study of Myocardial Infarction |
|
PROGRESS |
Perindopril pROtection aGainst Recurrent Stroke Study |
|
QUIET |
QUinapril Ischemic Event Trial |
|
RAAS |
renin-angiotensin-aldosterone system |
|
REASON |
pREterax in regression of Arterial Stiffness in a contrOlled double-bliNd study |
Các nguyên tắc cơ bản của cá thể hóa trong điều trị THA
THA là kết quả của quá trình lão hóa hệ tim mạch. Như vậy nó cần được xem là một bệnh tiến triển với nhiều giai đoạn khác nhau dựa trên sự biến đổi của mạch máu và các cơ quan.
Biến đổi cấu trúc các mạch máu thể hiện quá trình tiến triển của bệnh THA. Biến đổi đó diễn ra ở 2 nơi: mạch máu lớn và mạch máu nhỏ (vi mạch) [6].
Động mạch lớn nhận máu bơm ra từ tim trong thì tâm thu và tâm trương, cung cấp máu cho các cơ quan trong cơ thể. Chức năng của mạch máu phụ thuộc vào độ đàn hồi, sợi collagen (còn gọi là bộ xương của mạch máu) [7]. Trong quá trình lão hóa các sợi đàn hồi giảm chức năng, các sợi collagen cũng bị giảm số lượng. Điều này làm cho lớp nội mạc mạch máu dầy lên, điều này xảy ra chủ yếu ở các động mạch trung tâm hơn là động mạch ngoại biên (có nhiều cơ trơn hơn sợielastin và collagen).
Như vậy, quá trình lão hóa làm cho động mạch bị mất sự đàn hồi và trở nên cứng hơn. Yếu tố nguy cơ như béo phì, rối loạn mỡ máu, đường huyết cao làm tăng nguy cơ viêm nhiễm và rối loạn chức năng lớp nội mạc, sẽ tạothành các chất oxy hóa gây giảm tác dụng của các thuốc giãn mạch nội sinh như nitric oxide. Ngoài thay đổi cấu trúc, động mạch cũng mất cơ chế giãn mạch. Nhiều cơ chế đã được đề ra để giải thích quá trình xơ cứng động mạch, nhưng hệ renin-angiotensin-aldosteron (RAAS) dường như đặc biệt tham gia hiện tượng này.
Hậu quả đầu tiên của tái cấu trúc và rối loạn chức năng nội mạc mạch máu lớn là tăng áp lực lên thành mạch trong thì tâm thu [6]. Ngoài ra, sự giãn nở của động mạch chủ tạo ra sóng di chuyển toàn bộ hệ thống mạch máu [9]. Vận tốc của sóng này sẽ giúp đo được độ bền thành mạch, đang được sử dụng rộng rãi như một marker độc lập quan trọng đánh giá biến cố tim mạch và tỷ lệ tử vong [5].
Ở đầu kia của hệ thống mạch máu, các mao mạch, đặc biệt là trong tim, não, thận, là những nơi chính điều chỉnh huyết áp, chịu trách nhiệm chính trong sức cản ngoại vi: khoảng 50% động mạch nhỏ và tiểu động mạch (đường kính >350mcm) và khoảng 30% mao mạch (đường kính >7mcm). Chúng hoạt động như một bộ lọc để bảo vệ các cơ quan không bị tổn thương bằng cách ngăn chặn sự biến động lớn của huyết áp xâm nhập vi tuần hoàn. Tuy nhiên, khi huyết áp trung tâm tăng lên do xơ vữa mạch máu thì các tiểu động mạch cũng tái cấu trúc cho phù hợp để bảo toàn chức năng của mình. Sự tái cấu trúc làm cho lớp nội mạc dày lên dẫn đến giảm lưu lượng máu [11]. Quá trình tiếp diễn làm vỡ một số cấu trúc yếu của vi tuần hoàn, tạo thành các cục huyết khối làm giảm lưu lượng máu.
Hậu quả là làm tăng sức cản ngoại vi vì giảm các mạch máu nhỏ hấp thu dòng máu chảy từ trung tâm và do đó làm tăng HA. Ngoài ra, do tăng sức cản ngoại vi nên sóng phản xạ trở về tim lớn hơn về biên độ và cường độ. Tưới máu mô giảm dẫn đến thiếu máu cục bộ. Cần chú ý là tại tim, máu cung cấp cho mạch vành chủ yếu trong thời kỳ tâm trương.
Một nghiên cứu gần đây của nhóm dân số Framingham đã cho thấy xơ cứng động mạch dẫn đến THA. Điều này nghĩa là khi chẩn đoán, phải xem xét đến cấu trúc mạch máu trước khi bắt đầu điều trị cho BN. Hơn nữa, các thuốc hạ áp có vẻ chưa giảm được yếu tố nguy cơ cho BN trong những trường hợp THA phức tạp.
Điều này cho thấy rằng, ngoài giảm huyết áp, chiến lược điều trị còn phải giảm độ cứng thành mạch (giảm vận tốc sóng) hoặc dãn mạch (ngăn chặn sóng phản hồi) để bảo vệ hiệu quả khỏi bệnh tim mạch.
Thuốc hạ áp
Các phân tích gộp cho thấy các tác dụng khác nhau của thuốc hạ áp:
Thuốc ức chế men chuyển angiotensin có tác dụng bảo vệ biến cố mạch vành ngay cả khi không làm giảm huyết áp [15].
Thuốc chẹn kênh calci có tác dụng tốt để ngừa đột quỵ.
Một phân tích gộp của Thomopoulos và cộng sự cho thấy cùng hạ huyết áp ở mức 10/5 mmHg, ức chế men chuyển làm giảm 35% biến cố bệnh mạch vành, giảm 48% nguy cơ đột quỵ và giảm suy tim 53% trong khi ức chế thụ thể chỉ phòng ngừa đột quỵ và suy tim 20 và 25% (Hình 1) [16]
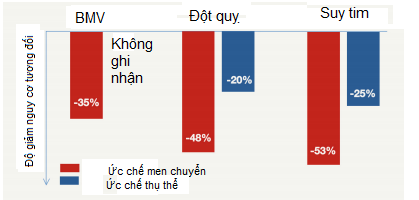
Hình 1:Lợi ích tim mạch ước tính được cung cấp với các thuốc ức chế men chuyển và thuốc ức chế thụ thể ở bệnh nhân tăng huyết áp hạ huyết áp đến mức 10/5mm Hg.
Trong phân tích này, ngoại trừ việc hạ áp, thuốc ức chế thụ thể làm tăng tỷ lệ biến cố bệnh mạch vành 13%, trong khi thuốc ức chế men chuyển làm giảm 9% (perindopril làm giảm 13%). Trong một phân tích gộp khác với hơn 10000 bệnh nhân, Savarese đã cho thấy perindopril thực sự phòng ngừa nhồi máu cơ tim tốt hơn các thuốc khác cùng nhóm, giảm nguy cơ hơn 43% so với ramipril [19].
Trong 1 phân tích trước đây về tỷ lệ tử vong do THA, perindopril cho thấy làm giảm đáng kể tỷ lệ tử vong do mọi nguyên nhân 13% và tử vong do bệnh tim mạch 22% trong khi lợi ích của các thuốc ức chế men chuyển khác và thuốc ức chế thụ thể là không rõ ràng [20]. Thực tế, trong 1 nghiên cứu trên 15000 BN, kết quả cho thấy BN khi mới được chẩn đoán THA nếu điều trị bằng perindopril thì giảm tỷ lệ tử vong 8%, giảm tỷ lệ do tim mạch 15% so với lisinopril [21]. Tỷ lệ nhập viện của đái tháo đường cũng giảm với điều trị perindopril [22]. Điều này cho thấy không chỉ các nhóm thuốc khác nhau cho hiệu quả khác nhau mà ngay cả các thuốc khác nhau trong cùng 1 nhóm thuốc cũng cho hiệu quả điều trị khác nhau.
Dựa trên mô tả trước đó về tiến triển của bệnh lý mạch máu, chiến lược điều trị có thể làm ngăn chặn thậm chí đảo ngược quá trình cứng mạch máu lớn và giảm sóng phản hồi ở mạch máu nhỏ.
Ức chế hệ thống Renin-Angiotensin-Aldosterone (RAA)
Ở phần trên ta đã thấy hệ RAA là những chất làm cứng động mạch lớn cũng như tái cấu trúc động mạch nhỏ (Hình 2). Chính Renin đã thúc đẩy quá trình oxy hóa qua NADPH oxidase bằng cách gắn vào thụ thể renin. Tuy nhiên, angiotensin II đến nay vẫn là chất quan trọng phục hồi chức năng mạch máu [23]. Gắn kết Angiotensin II với thụ thể AT1 cũng làm tăng quá trình oxy hóa, tăng quá trình viêm và kích thích sự xâm nhập của bạch cầu đơn nhân và đại thực bào, 1 giai đoạn của quá trình xơ vữa động mạch [24].
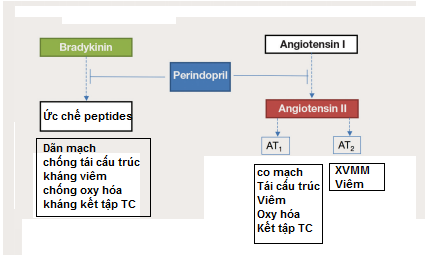
Hình 2:Chế độ tác động kép của Perindopril. Bradykinin được bảo tồn và có thể gây giãn mạch và bảo vệ tế bào nội mô. Ngoài ra, ức chế chuyển hóa angiotensin I thành angiotensin II, ngăn chặn tác dụng có hại khi angiotensin II kết hợp thụ thể AT1 và AT2.
Ức chế hệ RAA đã được chứng minh cải thiện độ cứng thành mạch bằng cách khôi phục sự đàn hồi và sức bền thành mạch. Trong nghiên cứu REASON, điều trị với perindopril/idapamide có hiệu quả trong việc giảm áp lực mạch máu trung tâm hơn so với atenol ở 147 BN theo dõi suốt 12 tháng, mặc dù mức giảm huyết áp tâm trương là như nhau [25]. Độ cứng thành mạch được cải thiện đáng kể, qua việc giảm vận tốc xung và sóng động mạch cảnh. Trong nghiên cứu CAFE, một phân tích trong nghiên cứu ASCOT, perindopril/amlodipine có hiệu quả hơn trong giảm huyết áp trung tâm lâu dài (theo dõi 5,5 năm) so với atenolol/thiazide, mặc dù độ giảm huyết áp cánh tay là như nhau [26].Tiên lượng giá trị giảm vận tốc sóng xung với perindopril cũng được chứng minh ở những BN suy thận giai đoạn cuối trong 10 năm theo dõi. Trong 2 nhóm BN giảm huyết áp cánh tay như nhau, những người có vận tốc sóng xung cao liên tục mặc dù đang điều trị sẽ có nguy cơ tử vong cao hơn [27].
Ngoài ra việc điều trị với thuốc ức chế RAA cũng cải thiện mật độ mao mạch cơ tim ở chuột. Perindopril thúc đẩy sự hình thành mạch máu mới, dẫn đến sự gia tăng mật độ vi mạch và cải thiện tưới máu mô [11].
Thuốc ức chế men chuyển cũng được cho rằng cải thiện độ cứng thành mạch và tái cấu trúc thành mạch do angiotensin gắn với thụ thể AT1 chuyển hóa thành chất hoạt hóa thụ thể AT2. AT2 được hoạt hóa làm tế bào phát triển, phì đại và xơ hóa [17]. Ví dụ trong tế bào cơ tim, kích thích thụ thể AT2 sẽ làm phì đại cơ tim. Đặc điểm này có thể giúp giải thích việc không thấy tiêu chí giảm biến cố mạch vành liên quan với sử dụng thuốc ức chế men chuyển, được báo cáo trong các phân tích gộp năm 2006 tiết lộ những nghịch lý của nhồi máu cơ tim. Điều thú vị là nghiên cứu đã chỉ ra ích lợi của thuốc chẹn men chuyển đối với độ cứng thành mạch và tái cấu trúc mạch máu nhờ vào tế bào nội mô [28]. Cơ chế tác động chính của thuốc ức chế men chuyển là bảo tồn nitric oxide, 1 chất chống viêm và giãn mạch mạnh. Nitric oxide bị tiêu thụ bởi quá trình oxy hóa, do kích thích angiotensin II ở bệnh nhân THA. Dự trữ nitic oxide ở các tế bào cơ trơn giúp giãn mạch và kháng viêm. Trong máu, thuốc ức chế men chuyển chuyển hóa thành dạng hoạt động và giảm trong lắng đọng collagen. Trong nghiên cứu ở chuột bị THA, người ta thấy rằng việc điều trị kéo dài perindopril có thể làm cải thiện chức năng mạch máu bằng cách giảm vận tốc sóng, giảm quá trình oxide hóa, chống tái cấu trúc mạch máu [29].
Bradykinin, chất quan trọng trong bảo vệ hệ tim mạch [24].
Bradykinin được tổng hợp bởi các tế bào nội mô và được dự trữ bằng 1 tiền thân ở bề mặt tế bào nội mô, khi bị kích thích, chúng gắn với thụ thể bradykinin tại chỗ và hoạt hóa sự tổng hợp các chất giãn mạch nitric oxide và prostacylin [30]. Ở những BN THA, nồng độ bradykinin thường thấp và chức năng mạch máu của họ thường giảm [31].
Do đó có vẻ hợp lý khi thành lập phương pháp phục hồi bradykinin nội sinh và nitric oxide để làm chậm hoặc đảo ngược quá trình làm xơ cứng động mạch. Hiện tại, sử dụng thuốc ức chế men chuyển có tác dụng giảm quá trình kích thích thủ thể bradykinin [30]. Thuốc ức chế men chuyển đã được chứng minh tăng cường tiết bradykinin ở liều thấp hơn và trước khi có tác dụng điều trị liênquan đến việc giảm angiotensin II xảy ra. Sự khác biệt này xảy ra giữa các thuốc trong cùng một nhóm. Ceconi và cộng sự đã cho thấyperindopril có hiệu quả cao nhất đối với tăng cường tiết bradykinin so với các thuốc ức chế men chuyển khác [32]. Thực tế, với cùng một mức độ giảm angiotensin II thì perindopril có tác dụng bảo vệ bradykinin nhiều hơn. Ưu thế ái mỡ của thuốc sẽ giúp thuốc có khả năng thấm vào mô cao, giúp phát huy tác dụng bảo vệ bradykinin.
Trong nghiên cứu EUROPA, sử dụng perindopril có hiệu quả tốt trên mạch máu, đặc biệt là chức năng nội mạc [33]. Bởi vì HA chỉ giảm nhẹ trong dân số bị bệnh mạch vành nhưng quan trọng đã giảm được 20% tỷ lệ mắc và tử vong do tim mạch phải được giải thích bằng nguyên nhân khác, trong đó bradykinin là một trong những nguyên nhân đầu tiên. Trong nghiên cứu PERTINENT, điều trị perindopril 1 năm ở BN bệnh mạch vành làm tăng đáng kể nồng độ bradykinin so với giả dược (tăng 17%, p<0,05), tăng sản xuất nitric oxide trực tiếp từ các từ hoạt động của tế bào nội mô (tăng 27%, p<0,05) [34]. Ngược lại, các thuốc ức chế men chuyển khác đều không đạt tác dụng như vậy với dân số nghiên cứu tương tự [35, 36]. Nghiên cứu tiền lâm sàng cho thấy perindopril có khả năng bảo vệ các tế bào nội mô của chuột có HA bình thường trong quá trình chết theo chương trình, trong khi quinaril và trandolapril thì không có ảnh hưởng đáng kể. Như đã đề cập trước đó, một nghiên cứu gần đây thực hiện trên một dân số lớn hơn 15000 BN theo dõi trên 15 năm cũng cho thấy điều trị perindopril cho BN mới được chẩn đoán THA có tỷ lệ tử vong do mọi nguyên nhân thấp hơn lisinopril 8% và tỷ lệ tử vong do bệnh tim mạch thấp hơn 15%.
Các nghiên cứu tiền lâm sàng kiểm tra hiệu quả của việc tăng liều perindopril đối với angiotensin II và bradykinin đã cho thấy sau khi sử dụng thuốc ức chế men chuyển thì nồng độ angiotensin II giảm hẳn và gần như không thể phát hiện ngay cả với liều thấp. Nghĩa là nồng độ bradykinin sẽ tăng dần theo liều perindopril [37]. Nghiên cứu trên những người tình nguyện khỏe mạnh thì angiotensin II trong huyết tương bị ức chế 80% với liều thấp nhất là 2.5mg.
Từ cơ chế tác dụng cho thấy thuốc ức chế men chuyển có hiệu quả hạ áp và bảo vệ mạch máu tốt hơn thuốc ức chế thụ thể. Mặc dù cả hai thuốc đều làm giảm angiotensin II nhưng chỉ có thuốc ức chế men chuyển bảo tồn được nồng độ bradykinin, một ưu thế về tác dụng bảo vệ tim mạch của nhóm thuốc này (Hình 3).
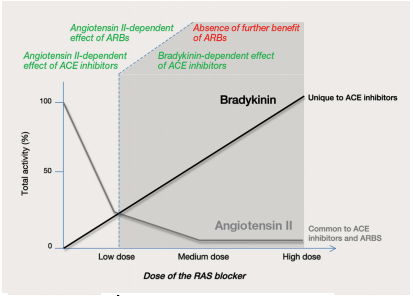
Hình 3:Sơ đồ biểu diễn sự khác biệt về hiệu quả của thuốc ức chế men chuyển và ức chế thụ thể theo liều. Sự ức chế angiotensin II nhanh chóng bão hòa ở liều thấp ở cả 2 thuốc, hạn chế tác động của cơ chế này. Ngoài ra, tăng liều thuốc ức chế ACE liều làm tăng bradykinin sinh học, cơ chế chính của việc giảm huyết áp và bảo vệ tim mạch của thuốc này ở liều lượng cao.
Sử dụng sớm thuốc ức chế men chuyển làm tăng nồng độ bradykinin là điều kiện tiên quyết để đạt hiệu quả điều trị. Perindopril ở liều cao làm hạ HA tốt và bảo vệ tim mạch tốt hơn so với các thuốc chẹn hệ RAA khác dựa vào đặc điểm chống tái cấu trúc mạch máu của nó (Hình 4)
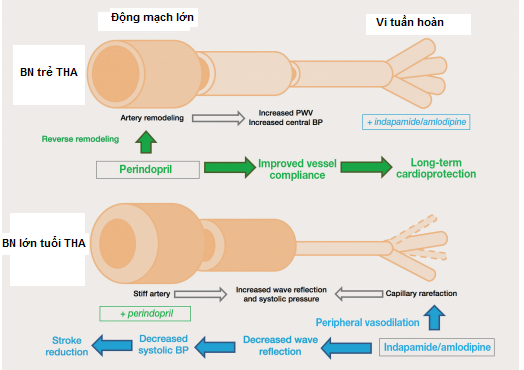
Hình 4:Sơ đồ minh họa tác động của perindopril trên các giai đoạn tăng huyết áp. Trong THA ở người trẻ, perindopril (kết hợp với amlodipine và indapamide khi cần thiết) sẽ tránh tái cấu trúc động mạch sớm và hậu quả của xơ cứng động mạch và tăng huyết áp mao mạch. Trong bệnh nhân cao tuổi tăng huyết áp, đặc biệt là người có nguy cơ đột quỵ, kết hợp indapamide và amlodipine tích cực làm giảm phản xạ sóng thông qua giãn mạch ngoại vi là chiến lược hiệu quả nhất trong việc giảm huyết áp tâm thu.
Tính giãn mạch của các tiểu động mạch: khi xảy ra đột quỵ…
Như đã mô tả, THA cơ bản là kết quả của quá trình lão hóa, và được chẩn đoán ở bất cứ giai đoạn nào của bệnh. Ở các nước đang phát triển, THA vẫn còn bị bỏ sót và chưa được điều trị sớm với thuốc bảo vệ mạch máu như ức chế men chuyển.
Khi các mạch máu lớn cứng hơn, HA tâm thu bắt đầu tăng cao do sự phản hồi sóng xung [10]. Do đó BN sẽ có nguy cơ độ quỵ, nguy cơ này tỷ lệ thuận với HA và tuổi [39]. Đối với những BN này, điều cần thiết nhất là hạ HA tâm thu bằng cách làm giãn mạch. Điều này sẽ làm giảm tức khắc sóng xung (Hình 4). Thuốc lợi tiểu và chẹn kệnh calci là 2 thuốc giãn mạch mạnh. Trong 2 nhóm thuốc hạ áp, indapamide và amlodipine được chứng minh là 1 trong các thuốc có hiệu quả làm giảm huyết áp tâm thu và áp lực mạch máu [41]. Một phân tích gộp gần đây cho thấy kết hợp hai thuốc này có hiệu quả giảm độ quỵ (giảm 23%) [42].
Kết hợp indapamide và hoặc amlodipine với perindopril đã được chứng minh làm giảm đột quỵ và tỷ lệ tử vong. Trong nghiên cứu HYVET, kết hợp perindopril và indapamide ở BN lớn tuổi đã làm giảm 39% tỷ lệ tử vong do đột quỵ (p=0,046), cũng như giảm 21% tỷ lệ tử vong do mọi nguyên nhân (p=0,02) [43]. Ở những BN có nguy cơ cao, các phân tích nhóm của ADVANCE cho thấy nguy cơ tương đối của tử vong do mọi nguyên nhân giảm 28% ở những BN dùng thuốc chẹn kênh calci phối hợp them với amlodipine/indapamide [44, 45].
Càng sớm càng tốt.
Việc công bố gần đây của nghiên cứu ADVANCE-ON, 1 nghiên cứu kéo dài thêm 10 năm của ADVANCE về việc kết hợp thêm perindopril/idapamide với điều trị đái tháo đường cơ bản, cho thấy lợi ích lâu dài của điều trị thuốc ức chế men chuyển [46]. Thực vậy, cả 2 nhóm BN đều được điều trị như nhau, đạt mức HA như nhau, sau khi kết thúc cuộc thử nghiệm, tỷ lệ tử vong do mọi nguyên nhân giảm 9% sau 4.5 năm ở những BN có điều trị perindopril/indapamide. Những kết quả này cho thấy lợi ích lâu dài của perindopril trên mạch máu: bảo vệ tế bào nội mô, bảo vệ mạch máu nhỏ ở các cơ quan, làm giảm quá trình xơ cứng mạch máu. Trong nghiên cứu lâm sàng, các thử nghiệm lớn như EUROPA, ADVANCE, PROGRESS, BN được điều trị sớm với perindopril có hiệu quả bảo vệ tim mạch cao, giảm tỷ lệ tử vong ở những BN dưới 60 tuổi [48].
Thời gian để kiểm soát huyết áp là một khía cạnh quan trọng của điều trị. Một phân tích của một nghiên cứu hồi cứu gần đây ở 1762 BN điều trị THA theo dõi trong 1 năm cho thấy phối hợp điều trị giúp kiểm soát HA tốt hơn (thời gian kiểm soát được HA là 9.7 tháng so với 11.9 tháng nếu là đơn trị liệu, p=0.004) và giảm nguy cơ tim mạch 34% (Hình 5) [49]. Thuốc ức chế men chuyển, mặc dù là phương pháp điều trị THA tốt cho những BN mới phát hiện THA, có thể cần phải được kết hợp từ đầu để đạt mục tiêu. Một nghiên cứu gần đây so sánh trên BN mới được chẩn đoán THA 1 nhóm được điều trị kết hợp perindopril 3.5mg và amlodipine 2.5mg, sau đó tăng gấp đôi liều trên còn 1 nhóm được điều trị kết hợp valsartan và amlodipine. Kết quả cho thấy tỷ lệ kiểm soát HA trong nhóm perindopril/amlodipine cao hơn nhóm valsartan/amlodipine sau 1 tháng và 2 tháng điều trị là 23% và 27% [50].
Trong nghiên cứu ADVANCE-ON, cho thấy tối ưu hóa điều trị bằng kết hợp perindopril giúp đạt HA mục tiêu và bảo vệ mạch máu cho BN khỏi quátrình tái cấu trúc mạch máu. Một vấn đề quan trọng của thuốc ức chế men chuyển là mức độ dung nạp cao và ít gây tác dụng phụ. Thuốc ức chế thụ thể cho thấy tăng nguy cơ suy thận (+48%, p<0,001), tăng kali máu (+57%, p= 0,008) và hạ huyết áp (+56%, p<0,001).
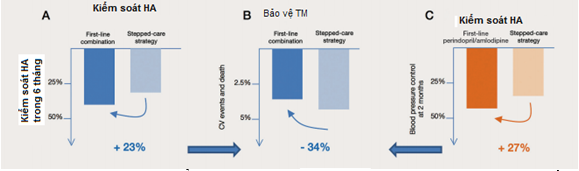
Hình 5:Lợi ích của việc kiểm soát nhanh HA. Dữ liệu nghiên cứu đã chứng minh rằng việc kiểm soát huyết áp nhanh hơn 23% sau 6 tháng (A) làm giảm 34% nguy cơ tim mạch (B). Trong dân số lớn, sự kết hợp mới của perindopril/amlodipine với liều đầu tiên 3,5/ 2,5mg và sau đó 7/5mg làm kiểm soát HA nhanh hơn 27% trong vòng 2 tháng so với valsartanamlodipine, và do đó đạt lợi ích bảo vệ (C).
Kết luận
Những bằng chứng thuyết phục đã hỗ trợ việc giải quyết các nguy cơ của BN THA. Kết hợp thuốc sẽ làm tối ưu hóa điều trị cho BN. Vấn đề bảo vệ tim mạch của perindopril đã được chứng minh.
Bắt đầu điều trị sớm cho BN mới phát hiện THA sẽ đạt hiệu quả bảo vệ mạch máu cao hơn, chống xơ cứng mạch máu trong đó có cả mạch vành.
Kết hợp perindopril và amlodipine ngay từ đầu cho phép kiểm soát HA nhanh hơn.
Ở những BN có nguy cơ xơ cứng mạch máu cao, ví dụ như BN cao tuổi, sự kết hợp idapamide và amlodipine giúp giảm nguy cơ đột quỵ vì làm giảm huyết áp tâm thu, giảm vận tốc sóng xung.
TÀI LIỆU THAM KHẢO
1.Wang H, Dwyer-Lindgren L, Lofgren KT, et al. Age-specific and sex-specific mortality in 187 countries, 1970-2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet. 2012;380:2071-2094.
2. Ezzati M, Riboli E. Behavioral and dietary risk factors for noncommunicable diseases. N Engl J Med. 2013;369:954-964.
3. Falaschetti E, Mindell J, Knott C, Poulter N. Hypertension management in England: a serial cross-sectional study from 1994 to 2011. Lancet. 2014;383:1912- 1919.
4. Blacher J, Evans A, Arveiler D, et al; PRIME Study Group. Residual cardiovascular risk in treated hypertension and hyperlipidaemia: the PRIME study. J Hum Hypertens. 2010;24:19-26.
5. Mancia G, Fagard R, Narkiewicz K, et al. 2013 ESH/ESC guidelines for the management of arterial hypertension: the Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). Eur Heart J. 2013;34:2159-2219.
6. Laurent S, Boutouyrie P. The structural factor of hypertension: large and small artery alterations. Circ Res. 2015;116:1007-1021.
7. Lam CS, Xanthakis V, Sullivan LM, et al. Aortic root remodeling over the adult life course: longitudinal data from the Framingham Heart Study. Circulation. 2010;122:884-890.
8. Sun Z. Aging, arterial stiffness and hypertension. Hypertension. 2015;65:252- 256.
9. Westerhof N, Sipkema P, van den Bos GC, Elzinga G. Forward and backward waves in the arterial system. Cardivasc Res.1972;6:648-656.
10. Laurent S, Boutouyrie P. Recent advances in arterial stiffness and wave reflection in human hypertension. Hypertension. 2007;49:1202-1206.
11. Levy BI, Schiffrin EL, Mourad JJ, et al. Impaired tissue perfusion: a pathology common to hypertension, obesity, and diabetes mellitus. Circulation. 2008;118: 968-976.
12. Yannoutsos A, Levy BI, Safar ME, Slama G, Blacher J. Pathophysiology of hypertension: interactions between macro and microvascular alterations through endothelial dysfunction. J Hypertens. 2014;32:216-224.
13. Kaess BM, Rong J, Larson MG, et al. Aortic stiffness, blood pressure progression, and incident hypertension. JAMA. 2012;308:875-881.
14. DiNicolantonio J, OKeefe JH. Perindopril for improving cardiovascular events. Vasc Health Risk Manag. 2014;10:539-548.
15. Verdecchia P, Reboldi G, Angeli F, et al. Angiotensin-converting enzyme inhibitors and calcium channel blockers for coronary heart disease and stroke prevention. Hypertension. 2005;46:386-392.
16. Thomopoulos C, Parati G, Zanchetti A. Effects of blood pressure lowering on outcome incidence in hypertension: 4. Effects of various classes of antihypertensive drugs–overview and meta-analyses. J Hypertens. 2015;33:195-211.
17. Strauss MH, Hall HS. Angiotensin receptor blockers may increase risk of myocardial infarction: unraveling the ARB-MI paradox. Circulation. 2006;114;838- 854.
18. Manolis AJ, Taddei S. Angiotensin-converting enzyme inhibitors confer myocardial infarction protection when blood pressure reduction is modest. http://www.esh2015.org/wordpress/wp-content/uploads/2015/05/ ESH2015_final-programme_scientific_website.pdf. 25th European Meeting on Hypertension and Cardiovascular Protection. Accessed July 27, 2015. Poster.
19. Savarese G, Costanzo P, Cleland JCF, et al. Meta-analysis reporting effects of angiotensin-converting enzyme inhibitors and angiotensin receptor blockers in patients without heart failure. J Am Coll Cardiol. 2013;61:131-142.
20. Ferrari R, Boersma E. The impact of ACE inhibition on all-cause and cardiovascular mortality in contemporary hypertension trials: a review. Expert Rev Cardiovasc Ther. 2013;11:705-717.
21. Tsoi KK, Wong Mc, Tam WW, et al. Cardiovascular mortality in hypertensive patients newly prescribed perindopril vs. lisinopril: A 5-year cohort study of 15,622 Chinese subjects. Int J Cardiol. 2014;176:703-709.
22. Wong MC, Tam WW, Wang HH, et al. The effectiveness of perindopril vs. lisinopril on reducing the incidence of diabetes and renal diseases: A cohort study of 20,252 patients. Int J Cardiol. 2015;190:384-388.
23. Clavreul N, Sansilvestri-Morel P, Magard D, Verbeuren TJ, Rupin A. (Pro)renin promotes fibrosis gene expression in HEK cells through a Nox4-dependent mechanism. Am J Physiol Renal Physiol. 2011;300:F1310-F1318.
24. Ferrari R, Rosano GM. Not just numbers, but years of science: Putting the ACE inhibitor—ARB meta-analyses into context. Int J Cardiol. 2013;166:286-288.
25. Asmar RG, London GM, ORourke ME, Safar ME; REASON Project Coordinators and Investigators. Improvement in blood pressure, arterial stiffness and wave reflections with a very-low-dose perindopril/indapamide combination in hypertensive patient :a comparison with atenolol. Hypertension. 2001;38: 922-926.
26. Williams B, Lacy PS, Thom SM, et al; CAFE Investigators; Anglo-Scandinavian Cardiac Outcomes Trial Investigators; CAFE Steering Committee and Writing Committee. Differential impact of blood pressure-lowering drugs on central aortic pressure and clinical outcomes. Principal results of the Conduit Artery Function Evaluation (CAFE) study. Circulation. 2006;113:1213-1225.
27. Guerin AP, Blacher J, Pannier B, Marc hais SJ, Safar ME, London GM. Impact of aortic attenuation on survival of patients in end-stage renal failure. Circulation. 2001;103:987-992.
28. Levy B, Benessiano J, Poitevin P, Safar ME. Endothelium-dependent mechanical properties of the carotid artery in WKY and SHR. Role of angiotensin converting enzyme inhibitors. Circ Res. 1990;66:321-328.
29. Isabelle M, Simonet S, Ragonnet C, et al. Chronic reduction of nitric oxide level in adult spontaneously hypertensive rats induces aortic stiffness similar to old hypertensive rats. J Vasc Res. 2012;49:309-318.
30. Regoli D, Gobeil F Jr. Critical insight into the beneficial and protective actions of the kallikrein-kinin system. Vascul Pharmacol. 2015.64:1-10.
31. Sharma JN. Hypertension and the bradykinin system. Curr Hypertens Rep. 2009;11:178-181.
32. Ceconi C, Francolini G, Olivares A, Comini L, Bachetti T, Ferrari R. Angiotensinconverting enzyme (ACE) inhibitors have different selectivity for bradykinin sites of human somatic ACE. Eur J Pharmacol. 2007;577:1-6.
33. Fox KM; EURopean trial On reduction of cardiac events with Perindopril in stable coronary Artery disease Investigators. Efficacy of perindopril in reduction of cardiovascular events among patients with stable coronary artery disease: randomised, double-blind, placebo-controlled, multicentre trial (the EUROPA study). Lancet. 2003;362:782-788.
34. Ceconi C, Fox KM, Remme WJ, et al; EUROPA Investigators; PERTINENT Investigators and the Statistical Committee. ACE inhibition with perindopril and endothelial function. Results of a substudy of the EUROPA study: PERTINENT. Cardiovasc Res. 2007;73:237-246.
35. Braunwald E, Domanski MJ, Fowler SE, et al; PEACE Trial Investigators. Angiotensin-converting-enzyme inhibition in stable coronary artery disease. N Engl J Med. 2004;351:2058-2068.
36. Pitt B, ONeill B, Feldman R, et al; QUIET Study Group. The QUinapril Ischemic Event Trial (QUIET): evaluation of chronic ACE inhibitor therapy in patients with ischemic heart disease and preserved left ventricular function. Am J Cardiol. 2001;87:1058-1063.
37. Campbell DJ, Kladis A, Duncan AM. Effects of converting enzyme inhibitors on angiotensin and bradykinin peptides. Hypertension. 1994;23:439-449.
38. Servier. Internal company files of the study on the development of Coversyl.
39. Lewington S, Clarke R, Qizilbash N, Peto R, Collins R; Prospective Studies Collaboration. Age-specific relevance of usual blood pressure to vascular mortality: a meta-analysis of individual data for one million adults in 61 prospective studies. Lancet. 2002;360:1903-1913.
40. Baguet JP, Legallicier B, Auquier P, Robitail S. Updated meta-analytical approach to the efficacy of antihypertensive drugs in reducing blood pressure. Clin Drug Investig. 2007;27:735-753.
41. Jadhav U, Hiremath J, Namjoshi DJ, et al. Blood pressure control with a singlepill combination of indapamide sustained-release and amlodipine in patients with hypertension: the EFFICIENT study. PLoS One. 2014;9:e92955.
42. Rimoldi SF, Messerli FH, Chavez P, Stefanini GG, Scherrer U. Efficacy and safety of calcium channel blocker/diuretics combination therapy in hypertensive patients: a meta-analysis. J Clin Hypertens (Greenwich). 2015;17:193-199.
43. Beckett NS, Peters R, Fletcher AE, et al; HYVET Study Group. Treatment of hypertension in patients 80 years of age or older. N Engl J Med. 2008;358:1887- 1898.
44. Chalmers J, Arima H, Woodward M, et al. Effects of combination of perindopril, indapamide, and calcium channel blockers in patients with type 2 diabetes mellitus: results from the Action in Diabetes and Vascular Disease: Preterax and Diamicron Controlled Evaluation (ADVANCE) trial. Hypertension. 2014;63:259- 264.
45. Yamout H, Bakris GL. Evidence-based triple antihypertensive therapy yields lower mortality in older patients with diabetes mellitus. Hypertension. 2014;63: 220-221.
46. Zoungas S, Chalmers J, Neal B, et al; ADVANCE-ON Collaborative Group. Follow-up of blood-pressure lowering and glucose control in type 2 diabetes. N Engl J Med. 2014;371:1392-1406.
47. Ng K, Hildreth CM, Avolio AP, Phillips JK. Angiotensin-converting enzyme inhibitor limits pulse-wave velocity and aortic calcification in a rat model of cystic renal disease. Am J Physiol Renal Physiol. 2011;301:F959-F966.
48. Brugts JJ, Ninomiya T, Boersma E, et al. The consistency of the treatment effect of an ACE-inhibitor based treatment regimen in patients with vascular disease or high risk of vascular disease: a combined analysis of individual data of ADVANCE, EUROPA, and PROGRESS trials. Eur Heart J. 2009;30:1385- 1394.
49. Gradman AH, Parisé H, Lefebvre P, Falvey H, Lafeuille MH, Duh MS. Initial combination therapy reduces the risk of cardiovascular events in hypertensive patients: a matched cohort study. Hypertension. 2013;61:309-318.
50. Mancia G, Asmar R, Amodeo C, et al. Comparison of single-pill strategies first line in hypertension: perindopril/amlodipine versus valsartan/amlodipine. J Hypertens. 2015;33:401-411.
51. Elgendy IY, Hua T, Chik V, Pepine CJ, Bavry AA. Efficacy and safety of angiotensin receptor blockers in older patients: a meta-analysis of randomized trials. Am J Hypertens. 2015;28:576-585.







