TÓM TẮT
Mục tiêu:Đánh giá mối quan hệ giữa chức năng thận với nguy cơ thiếu máu cục bộ cơ tim, chảy máu, đồng thời khảo sát hiệu quả, an toàn của ticagrelor ở bệnh nhân ổn định sau nhồi máu cơ tim trước đó (MI).
ThS. BS. Nguyễn Thiên Hào
Phương pháp và kết quả: Bệnh nhân có tiền sử nhồi máu cơ tim từ 1-3 năm trước khi tham gia vào nghiên cứu PEGASUS-TIMI 54 được phân tầng dựa trên độ lọc cầu thận ước lượng (eGFR). Phân tích hiệu quả kết cục chính của Ticagrelor bao gồm tử vong do tim mạch, nhồi máu cơ tim hoặc đột quỵ (biến cố tim mạch bất lợi lớn: MACE) và kết cục an toàn chảy máu nặng theo phân loại TIMI ở bệnh nhân có GFR < 60 ml/phút /1,73 m2. Trong số 20 898 bệnh nhân, có 4849 (23,2%) bệnh nhân có eGFR < 60. Ở thời điểm 3 năm, nguy cơ MACE của nhóm bệnh nhân có eGFR < 60 cao hơn nhóm bệnh nhân có eGFR ≥ 60. Biến cố MACE vẫn có ý nghĩa sau khi hiệu chỉnh đa biến (HRadj 1,54, 95% CI 1,27-1,85, P< 0.001). Ticagrelor làm giảm nguy cơ tương đối MACE của nhóm bệnh nhân có eGFR< 60 (ticagrelor gộp so với giả dược: HR 0,81; 95% CI 0,68-0,96) tương đương với nhóm bệnh nhân có eGFR ≥60 (HR 0,88; 95% CI 0,77-1,00, Pinteraction = 0,44). Tuy nhiên, do nguy cơ tuyệt đối lớn hơn ở nhóm có eGFR < 60, nên điều trị Ticagrelor ở nhóm này làm giảm nguy cơ tuyệt đốicao hơn: 2,7 so với 0,63%. Chảy máu thường có xu hướng xảy ra ở nhóm bệnh nhân rối loạn chức năng thận. Gia tăng tuyệt đối về chảy máu nặng theo TIMI tương đương giữa nhóm có và không có eGFR< 60(1,19 so với 1,43%), trong khi đó chảy máu nhỏ có xu hướng rõ rệt hơn (1,93 so với 0,69%).
Kết luận: Nguy cơ xảy ra MACE cao hơn ở bệnh nhân có tiền sử NMCT kèm rối loạn chức năng thận và giảm nguy cơ tuyệt đối mạnh hơn khi điều trị lâu dài với ticagrelor.
GIỚI THIỆU
Gần một phần ba bệnh nhân nhồi máu cơ tim có ST chênh lên (MI) và hơn 40% bệnh nhân nhồi máu cơ tim không ST chênh lên có rối loạn chức năng thận kèm theo1. Dân số mắc bệnh tim thiếu máu cục bộ mạn tính kèm rối loạn chức năng thận được dự đoán gia tăng đáng kể2,3 dodân số lão hóa và tỷ lệ mắc các loại bệnh lý liên quan đến tim mạch và rối loạn chức năng thận (đái tháo đường)tăng. Bệnh nhân nhồi máu cơ tim kèm rối loạn chức năng thận có kết cục xấu hơn, cùng với nghịch đảo về điểm qui chiếu mối liên quan giữa độ lọc cầu thận (eGFR) và biến cố tim mạch lớn4 (MACE). Mối quan hệ giữa rối loạn chức năng thận và nguy cơ thiếu máu cục bộ cơ tim phức tạp do xơ vữa động mạch tiến triển, viêm nhiễm, stress oxy hóa, và trạng thái tăng đông5. Bên cạnh đó, một số yếu tố nguy cơ tim mạch bao gồm tuổi, tăng huyết áp và đái tháo đường làm thay đổi chức năng thận. Ảnh hưởng của rối loạn chức năng thận trên bệnh nhân có tiền sử nhồi máu cơ tim còn phức tạp hơn nữa bởi mối quan hệ của nó với nguy cơ chảy máu. Có mối tương quan xấu giữa chức năng thận và chảy máu6 do rối loạn chức năng tiểu cầu (hoạt hóa khiếm khuyết, bám dính, kết tập),do tăng nguy cơ quá liều gây bởi một số loại thuốc chống huyết khối.
Lợi ích – nguy cơ của điều trị chống huyết khối kéo dài ở bệnh nhân có tiền sử nhồi máu cơ tim kèm theo rối loạn chức năng thận là phức tạp, một số nghiên cứu cho rằng ức chế tiểu cầu tích cực hơn có thể có ít lợi ích hơn7,8, trong khi các nghiên cứu khác cho thấy lợi ích tương tự hoặc thậm chí lớn hơn ở bệnh nhân có giảm chức năng thận9-11. Ticagrelor gắn kết có hồi phục với thụ thể P2Y12. Ticagrelor có tác dụng mạnh hơn và hằng định hơn so với clopidogrel. Ticagrelor đã được chứng minh giảm đáng kể tử vong, NMCT, đột quỵ (MACE) so với clopidogrel ở bệnh nhân hội chứng mạch vành cấp (ACS), giảm hằng định nguy cơ tương đối ở bệnh nhân có và không có rối loạn chức năng thận, nhưng giảm nguy cơ tuyệt đối lớn hơn ở bệnh nhân có rối loạn chức năng thận9. Thử nghiệm PEGASUS-TIMI 54, ticagrelor giảm MACE ở bệnh nhân ngoại trú ổn định với nhồi máu cơ tim trước đó12 . Giảm các biến cố thiếu máu cục bộ này đi kèm với gia tăng chảy máu nặng theo phân loại TIMI. Chúng tôi đánh giá mối quan hệ của nguy cơ thiếu máu cục bộ cơ tim, chảy máu với chức năng thận và xem xét hiệu quả và an toàn của ticagrelor có thay đổi hay không khi córối loạn chức năng thận.
PHƯƠNG PHÁP
Dân số nghiên cứu
PEGASUS-TIMI 54 phân ngẫu nhiên bệnh nhân bị NMCT trước đó vào nhóm sử dụng ticagrelor 90mg hai lần mỗi ngày, ticagrelor 60mg hai lần mỗi ngày, hoặc giả dược và tất cả bệnh nhân trong nghiên cứu đều uống aspirin liều thấp. Thiết kế13 và kết quả chính của thử nghiệm đã được đăng tải12. Tóm lại, thử nghiệm thu dung 21.162 bệnh nhân NMCT tự phát xảy ra 1-3 năm trước khi tham gia vào nghiên cứu và có ít nhất một trong những đặc điểm nguy cơ cao sau đây: ≥ 65 tuổi, đái tháo đường cần điều trị thuốc, NMCT tự phát lần 2 trước khi vào nghiên cứu, bệnh nhiều nhánh động mạch vành, hoặc rối loạn chức năng thận mạn tính được xác định khi độ thanh thải creatinine < 60mL/phút theo công thức Cockroft-Gault. Loại trừ bệnh thận giai đoạn cuối cần phải lọc máu. Không cần hạn chế hoặc điều chỉnh liều theo chức năng thận nếu không có lọc máu. Bệnh nhân bị loại bỏ nếu đã được lên kế hoạch sử dụng chất đối kháng thụ thể P2Y12 hoặc điều trị thuốc chống đông trong thời gian nghiên cứu; bệnh nhân đã có rối loạn chảy máu hoặc có tiền sử đột quỵ thiếu máu cục bộ hoặc chảy máu nội sọ, u hệ thống thần kinh trung ương, hay bất thường mạch máu nội sọ; hoặc bệnh nhân đã có xuất huyết tiêu hóa trong vòng 6 tháng hoặc phẫu thuật lớn trong vòng 1 tháng.
KẾT CỤC
Kết cục hiệu quả chính là tổng hợp của tử vong do tim mạch, NMCT hoặc đột quỵ (MACE). Kết cục an toàn chính là chảy máu nặng theo TIMI13. Kết cục an toàn bổ sung là chảy máu TIMI nhẹ, xuất huyết nội sọ (ICH), chảy máu gây tử vong. Một ủy ban biến cố lâm sàng độc lập với phân bổ điều trị xem xét hiệu quả và biến cố chảy máu. Biến cố nguy hại được báo cáo và phân nhóm biến cố nguy hại theo chức năng thận.
Xét nghiệm và định nghĩa rối loạn chức năng thận
Mẫu máu tĩnh mạch được lấy ngẫu nhiên, trong quá trình theo dõi, và 14-28 ngày sau khi kết thúc điều trị. Sau khi quay ly tâm, huyết thanh được đông lạnh ở -200C và được gửi đến phòng thí nghiệm trung tâm để đo creatinine huyết thanh. Độ lọc cầu thận ước lượng dựa trên công thức MDRD (Modification of Diet in Renal Disease Study Group)14. eGFR được sử dụng để phân tích độ nhạy nguy cơ thiếu máu cục bộ cơ tim và chảy máu. Công thức CKD-EPI (Chronic Kidney Disease EPI-demiology collaboration)15 được sử dụng để đánh giá hiệu quả điều trị.
Ở nhóm dùng giả dược, chức năng thận được mô tả theo hai cách để đánh giá mối quan hệ của nguy cơ thiếu máu cục bộ và chảy máu. Đầu tiên, eGFR được xem xét như một biến số liên tục và Cubic spline được sử dụng để đánh giá mối quan hệ của nó với MACE và chảy máu. Thứ hai, eGFR được chia thành các nhóm phù hợp với định nghĩa và phân loại bệnh thận mạn của tổ chức Thận học quốc gia16. Do chỉ có vài bệnh nhân có eGFR< 30 mL/min/1,73 m2, nên bệnh nhân được chia thành bốn nhóm: (≥ 90), (60 – < 90), (45 – < 60) và (< 45)ml/phút/1,73 m2. Khi đánh giá hiệu quả và an toàn của ticagrelor so với giả dược, điểm cắt 60 ml/phút/1,73m2 được sử dụng để phân tích nhóm bệnh nhân rối loạn chức năng thận (eGFR ban đầu < 60 mL/phút) và bệnh nhân có chức năng thận bình thường (eGFR ≥ 60).
Thống kê
Đặc điểm cơ bản được tóm tắt bằng trung vị, tứ phân vị đối với biến số biến liên tục và tần số, tỷ lệ phần trăm đối với biến số phân loại. Kiểm định phi tham số Wilcoxon được sử dụng cho biến liên tục và kiểm định Ki bình phương cho biến phân loại. Mô hình Cox (cox proportional hazard model) được sử dụng để đánh giá nguy cơ MACE và chảy máu theo phân nhóm chức năng thận và được hiệu chỉnh theo đặc điểm lâm sàng cơ bản khác nhau đáng kể giữa nhóm bệnh nhân có và không có rối loạn chức năng thận (tuổi, giới, tăng huyết áp, đang hút thuốc, đái tháo đường, tiền sử can thiệp động mạch vành qua da, bắc cầu động mạch vành, bệnh nhiều nhánh động mạch vành, tiền sử nhồi máu cơ tim > 1 lần, bệnh động mạch ngoại biên, đột quỵ, suy tim, và loại biến cố). Mối tương quan giữa chức năng thận với mối nguy hiểm của MACE và chảy máu TIMI nặng được đánh giá bằng cách sử dụng phân tích cubic spline17. Phân tích hiệu quả và an toàn của ticagrelor đã không được điều chỉnh do điều trị được chọn ngẫu nhiên và do đặc điểm cơ bản, yếu tố gây nhiễu tiềm năng cân bằng xấp xỉ. Phân tích hiệu quả được thực hiện dựa trên ITT (intention-to-treat) cùng với phân tích độ nhạy để đánh giá tác động của sự khác biệt trong ngưng thuốc. Phân tích an toàn bao gồm tất cả các bệnh nhân đã được chọn ngẫu nhiên và có creatinine ban đầu ở bệnh nhân nhận được ít nhất một liều thuốc nghiên cứu và bao gồm tất cả các biến cố xảy ra sau khi nhận được liều đầu tiên và trong vòng 7 ngày sau khi ngừng thuốc nghiên cứu.
KẾT QUẢ
20.898 bệnh nhân có xét nghiệm creatinin huyết thanh ban đầu (99% dân số thử nghiệm), trong đó có 3.251 (15,6%), 12.798 (61,2%), 3.536 (16,9%), và 1.313 (6,3%), tương ứng với eGFR ≥ 90, 60 – < 90, 45 – < 60, và < 45 ml/phút/1,73 m2, (eGFR ≥ 60, N = 16.049, 76,8%; eGFR < 60, N = 4849; 23,2%). Đặc điểm cơ bản của từng nhóm eGFR được thể hiện ở bảng 1 và phân tầng với < 60 và ≥ 60 mL/phút/1,73 m2. eGFR thấp có liên quan với người cao tuổi, giới nữ, và các yếu tố nguy cơ tim mạch bao gồm tăng huyết áp, đái tháo đường và bệnh tim mạch bao gồm tiền sử nhồi máu cơ tim, bệnh động mạch ngoại biên, và suy tim.
Bảng 1: Đặc điểm cơ bản của từng nhóm eGFR (mL/min/1,73m2)
|
Characteristic |
eGFR (mL/min/1,73 m2) |
||||
|---|---|---|---|---|---|
|
≥90, N = 3251, n(%) |
60 to <90, N = 12 798, n (%) |
45 to <60, N = 3536, n (%) |
<45, N = 1313, n (%) |
P-value |
|
|
eGFR, median (IQR) |
97,7 (93,3, 105,4) |
74,1 (67,5, 81,0) |
54,2 (50,6, 57,4) |
38,8 (33,3, 42,3) |
n.a. |
|
Demographics |
|||||
|
Age (years), median (IQR) |
60 (55; 66) |
65 (59; 70) |
69 (64; 75) |
72 (66; 78) |
<0,0001 |
|
Female |
478 (14,7) |
2736 (21,4) |
1198 (33,9) |
580 (44,2) |
<0,0001 |
|
BMI (kg/m2), median (IQR) |
27,7 (24,7; 31,0) |
27,8 (25,2; 31,1) |
27,9 (25,3; 31,3) |
28,4 (25,3; 32,0) |
<0,0001 |
|
Clinical characteristics |
|||||
|
Hypertension |
2430 (74,8) |
9607 (75,1) |
2973 (84,1) |
1185 (90,3) |
<0,0001 |
|
Hypercholesterolaemia |
2443 (75,2) |
9908 (77,4) |
2705 (76,5) |
998 (76,0) |
0,04 |
|
Current smoker |
851 (26,2) |
2125 (16,6) |
400 (11,3) |
122 (9,3) |
<0,0001 |
|
Diabetes mellitus |
1246 (38,3) |
3732 (29,2) |
1157 (32,7) |
581 (44,3) |
<0,0001 |
|
Multivessel coronary disease |
2112 (65,0) |
7655 (59,8) |
1915 (54,2) |
715 (54,5) |
<0,0001 |
|
History of PCI |
2800 (86,1) |
10 776 (84,2) |
2792 (79,0) |
979 (74,6) |
<0,0001 |
|
History of CABG |
101 (3,1) |
511 (4,0) |
228 (6,5) |
118 (9,0) |
<0,0001 |
|
History of >1 prior MI |
505 (15,5) |
2037 (15,9) |
617 (17,5) |
296 (22,5) |
<0,0001 |
|
Peripheral artery disease |
178 (5,5) |
595 (4,7) |
223 (6,3) |
132 (10,1) |
<0,0001 |
|
History of stroke |
10 (0,3) |
50 (0,4) |
21 (0,6) |
14 (1,1) |
0,002 |
|
History of HF |
487 (15,0) |
2375 (18,6) |
875 (24,8) |
451 (34,4) |
<0,0001 |
|
Qualifying event |
|||||
|
Years from MI, median (IQR) |
1,7 (1,2; 2,3) |
1,7 (1,2; 2,3) |
1,7 (1,3; 2,3) |
1,7 (1,2; 2,4) |
0,20 |
|
STEMI |
1831 (56,4) |
7005 (54,8) |
1767 (50,0) |
590 (45,1) |
<0,0001 |
|
NSTEMI |
1236 (38,1) |
5068 (39,6) |
1543 (43,7) |
624 (47,7) |
<0,0001 |
|
MI type unknown |
181 (5,6) |
713 (5,6) |
221 (6,3) |
95 (7,3) |
<0,0001 |
|
Medications at enrolment |
|||||
|
Aspirin |
3247 (99,9) |
12 779 (99,9) |
3534 (99,9) |
1311 (99,9) |
0,60 |
|
β-Blocker |
2641 (81,2) |
10 525 (82,2) |
2973 (84,1) |
1120 (85,3) |
0,0006 |
|
ACEI or ARB |
2604 (80,1) |
10 219 (79,9) |
2923 (82,7) |
1070 (81,5) |
0,002 |
Chức năng thận ban đầu và nguy cơ thiếu máu cục bộ cơ tim
Ở nhánh giả dược tại thời điểm 3 năm có sự nghịch đảo về điểm qui chiếu mối quan hệ giữa các nhóm phân tầng eGFR và nguy cơ MACE khi eGFR giảm dưới 60ml/phút/1,73m2 (P xu hướng < 0,0001, hình 1A) cùng với mối quan hệ phù hợp cho từng thành phần riêng lẻ (P xu hướng ≤ 0,001 đối với tử vong tim mạch, nhồi máu cơ tim và đột quỵ). Sau khi hiệu chỉnh khác biệt lâm sàng ban đầu, eGFR vẫn là yếu tố dự báo độc lập đối với nguy cơ thiếu máu cục bộ cơ tim, đặc biệt là khi eGFR giảm dưới 60 mL/phút/1,73 m2 (Hình 1B). Khi phân đôi, bệnh nhân eGFR < 60ml/phút/1,73m2 có HR hiệu chỉnh đối với MACE là 1,54 (95% CI 1,27-1,85; P < 0,001). Hiệu chỉnh nguy cơ theo phân loại loại eGFR vẫn có ý nghĩa đối với mỗi thành phần của kết cục chính.
Mối quan hệ giữa eGFR và nguy cơ thiếu máu cục bộ cơ tim tương tự nhau khi sử dụng công thức CKD-EPI để tính eGFR (tương quan hệ số giữa eGFR được tính theo MDRD và CKD-EPI là 0,99; P < 0,0001) và tương tự ở bệnh nhân sử dụng ngẫu nhiên giả dược hoặc gộp tất cả nhánh điều trị.
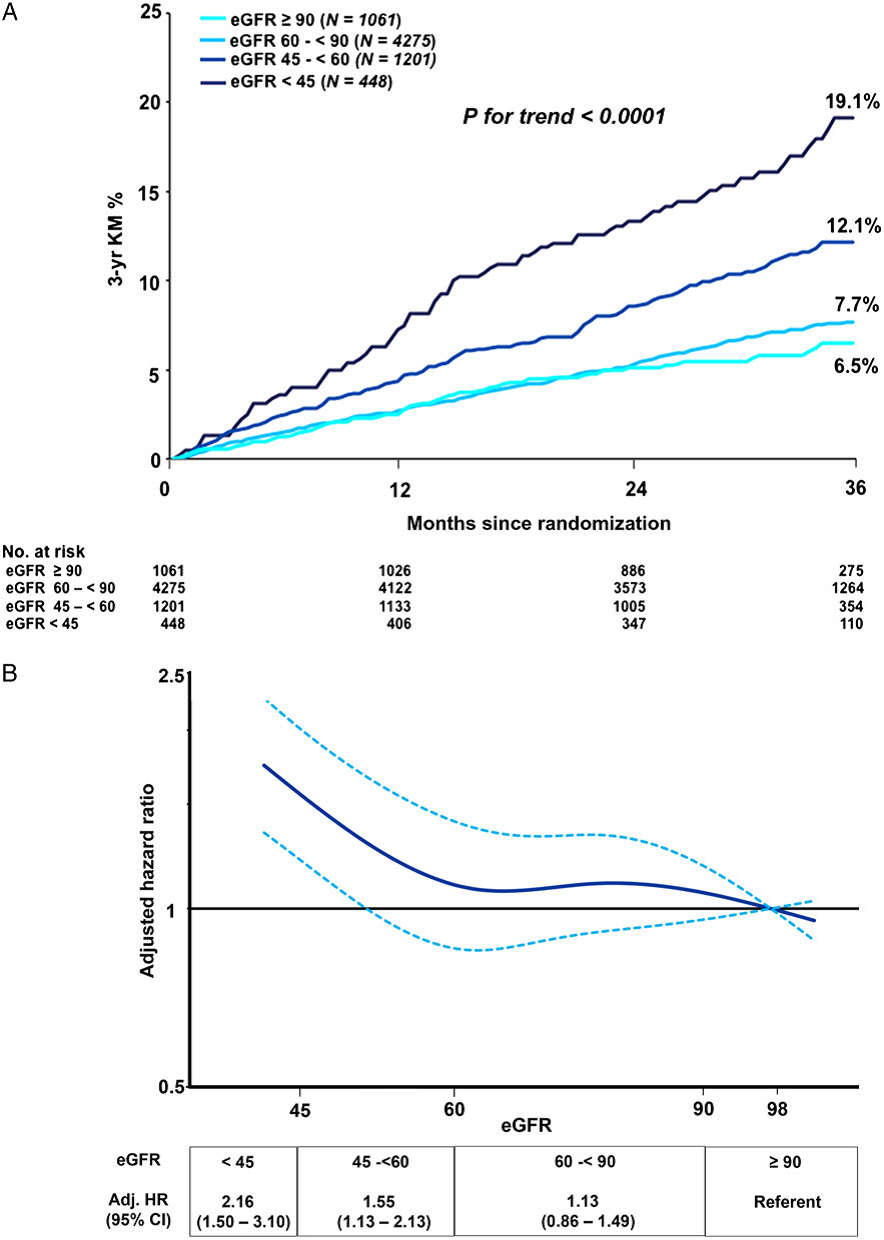
Hình 1: Đường cong KM về kết cục chính của tử vong tim mạch, nhồi máu cơ tim, đột quỵ theo eGFR (ml/phút/1,73m2) (A) và đường cong spline hiệu chỉnh đa biến HR của kết cục chính, so với mô hình độ lọc cầu thận ước tính được sử dụng như một biến số liên tục (B) nhóm dùng giả dược. Bệnh nhân được phân tầng vào bốn nhóm (eGFR ≥ 90), (60 – < 90), (45 – < 60) và (< 45)ml/phút/1,73m2
Hình 1B, đường chấm đại diện cho 95% dải tin cậy theo từng điểm. Giá trị qui chiếu 98 là eGFR trung bình ở nhóm ≥ 90 từ dân số tổng. Mô hình Cox hiệu chỉnh khác biệt đáng kể đặc điểm lâm sàng ban đầu giữa bệnh nhân có và không có rối loạn chức năng thận (tuổi, giới tính, tăng huyết áp, đang hút thuốc, đái tháo đường, tiền sử can thiệp động mạch vành qua da, bắc cầu động mạch vành, bệnh nhiều nhánh động mạch vành, tiền sử > 1 lần nhồi máu cơ tim, bệnh động mạch ngoại biên, đột quỵ, suy tim, và loại biến cố).
Chú thích: eGFR = độ lọc cầu thận ước tính; yr = năm; KM = Kaplan-Meier; N = tổng số; Adj = hiệu chỉnh. HR = hazard ratio; CI = khoảng tin cậy.
Chức năng thận ban đầu và nguy cơ chảy máu
Có xu hướng gia tăng mức độ chảy máu TIMI nặng, chảy máu TIMI nhẹ, và chảy máu nội sọ hoặc chảy máu tử vong ở nhóm có eGFR thấp thuộc nhánh giả dược (hình 2A). Sau khi hiệu chỉnh khác biệt ban đầu, không có mối quan hệ đáng kể giữa eGFR và chảy máu TIMI nặng (hình 2B), nhưng có mối quan hệ đối với chảy máu nhẹ. Khi phân đôi GFR ở mức 60ml/phút/1,73m2, HR hiệu chỉnh đối với chảy máu TIMI nặng ở bệnh nhân có eGFR < 60 so với bệnh nhân có eGFR ≥ 60 là 1,19 (95% CI 0,64-2,24, P = 0,58) và HR hiệu chỉnh đối với chảy máu TIMI nhẹ là 3,02 (95% CI 1,07-8,48, P = 0,04). Mối quan hệ giữa eGFR và chảy máu tương tự ở nhóm giả dược hoặc gộp tất cả điều trị.
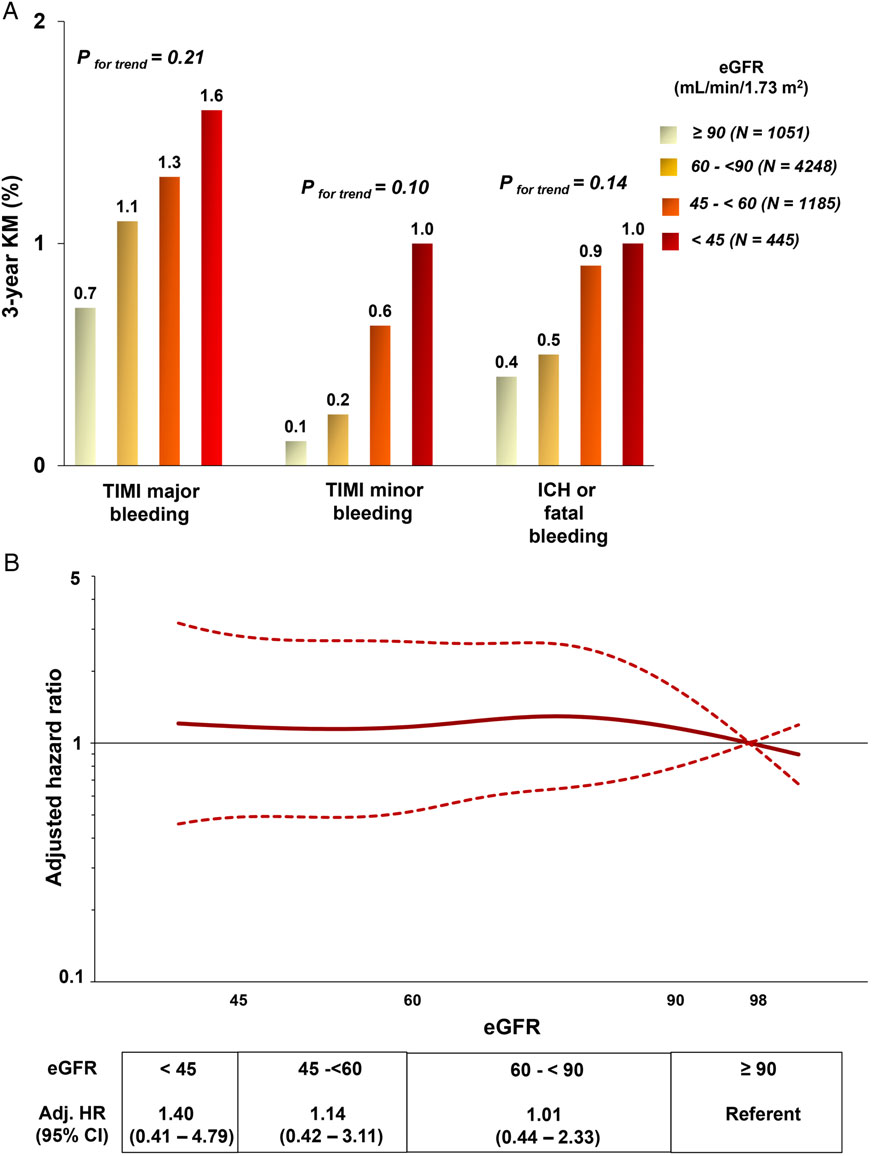
Hình 2: Nguy cơ chảy máu theo độ lọc cầu thận (ml/phút/1,73 m2) (A) và đường cong spline hiệu chỉnh đa biến về hiệu quả kết cục chính vs tốc độ lọc cầu thận ước lượng mô hình hóa như một biến số liên tục (B) nhóm dùng giả dược. Bệnh nhân được phân tầng vào bốn nhóm (eGFR ≥ 90), (60 – < 90), (45 – < 60) và (< 45)ml/phút/1,73m2
Mô hình Cox hiệu chỉnh đặc điểm khác biệt đáng kể lâm sàng ban đầu giữa bệnh nhân có và không có rối loạn chức năng thận (tuổi, giới tính, tăng huyết áp, đang hút thuốc, đái tháo đường, tiền sử can thiệp động mạch vành qua da, bắc cầu động mạch vành, bệnh nhiều nhánh động mạch vành, tiền sử > 1 lần nhồi máu cơ tim, bệnh động mạch ngoại biên, đột quỵ, suy tim, và loại biến cố).
Chú thích: eGFR = độ lọc cầu thận ước tính; yr = năm; KM = Kaplan-Meier; N = tổng số; Adj = hiệu chỉnh. HR = hazard ratio; CI = khoảng tin cậy; ICH = chảy máu nội sọ; TIMI = thrombolysis in myocardial infraction. Đường chấm đại diện cho 95% dải tin cậy theo từng điểm. Giá trị qui chiếu 98 là eGFR trung bình ở nhóm ≥ 90 từ dân số tổng.
Hiệu quả của ticagrelor ở bệnh nhân rối loạn chức năng thận
Giảm nguy cơ tương đối MACE đạt được với ticagrelor (liều gộp) tương tự ở bệnh nhân có rối loạn chức năng thận (eGFR < 60 ml/phút/1,73 m2, n = 4849; HR 0,81; 95% CI 0,68-0,96) khi so sánh với bệnh nhân không có rối loạn chức năng thận (eGFR ≥ 60ml/phút/1,73 m2, n = 16.049; HR 0,88; 95% CI 0,77-1,00, Pinteraction = 0,44, hình 3) và tương tự khi eGFR được sử dụng như là biến liên tục. Tuy nhiên, do nguy cơ MACE cao ở bệnh nhân có rối loạn chức năng thận, giảm thiểu nguy cơ MACE tuyệt đối 3 năm cao hơn bốn lần ở nhóm có rối loạn chức năng thận: 2,70% (95% CI 0,49-4,93) so với 0,63% (95% CI 0,32-1,57) ở nhóm không có rối loạn chức năng thận. Mô hình hiệu quả phần lớn phù hợp với từng nhóm liều lượng và từng thành phần riêng lẻ của tiêu chí chính. Kết quả phù hợp bất kể eGFR được tính theo công thức MDRD hay CKD-EPI. Tỷ lệ nguy cơ tử vong do bất kỳ nguyên nhân không khác biệt đáng kể đối với một trong hai liều ticagrelor khi so sánh với giả dược, bất kể chức năng thận.
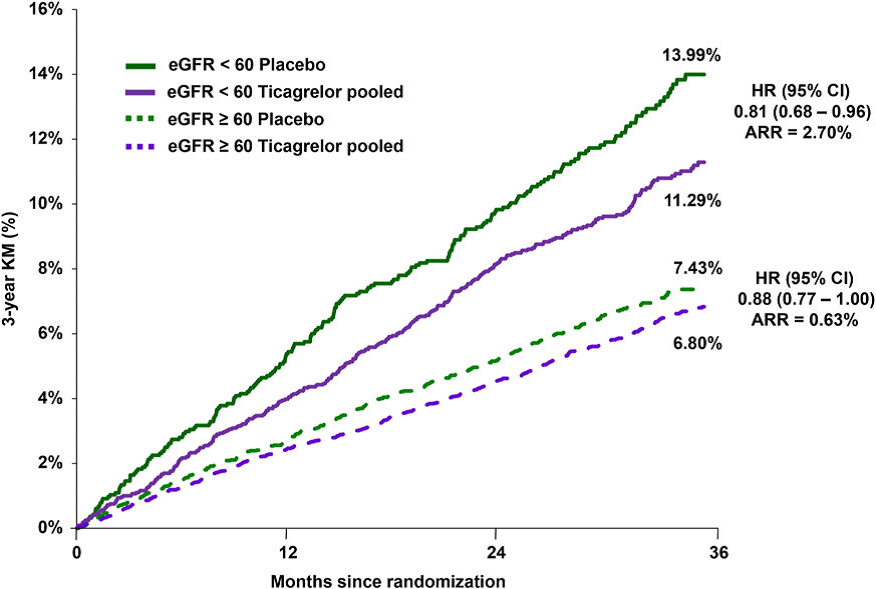
Hình 3:Kaplan-Meier ước tính xảy ra tử vong tim mạch, nhồi máu cơ tim, hoặc đột quỵ theo độ lọc cầu thận. Kaplan-Meier của kết cục chính trong 3 năm, theo nhóm nghiên cứu, theo điểm cắt eGFR 60ml/phút/1,73m2. P-interaction = 0,44.
Chú thích: eGFR = độ lọc cầu thận; yr = năm; KM = Kaplan-Meier; HR = hazard ratio; CI = khoảng tin cậy; ARR = giảm nguy cơ tuyệt đối.
An toàn ticagrelor ở bệnh nhân rối loạn chức năng thận
Nguy cơ tương đối của chảy máu TIMI nặng do ticagrelor tương tự ở bệnh nhân có và không có rối loạn chức năng thận (ticagrelor gộp so với giả dược, eGFR < 60: HR 1,98; 95% CI 1,13-3,46; eGFR ≥ 60: HR, 2,65; 95% CI 1,87-3,76; Pinteraction = 0,38; Bảng 2). Tương tự như vậy, nguy cơ tuyệt đối của chảy máu TIMI nặng do ticagrelor (gộp) tương tự theo từng phân loại eGFR (1,19%, 95% CI 0,21-2,16 cho bệnh nhân có eGFR < 60 và 1,42%, 95% CI 0,92-1,91 cho bệnh nhân có eGFR ≥ 60). Nguy cơ tương đối của chảy máu TIMI nhẹ gia tăng hằng định với ticagrelor bất kể chức năng thận (Pinteraction = 0,98 cho ticagrelor gộp); Tuy nhiên, mức tăng tuyệt đối cao hơn ở bệnh nhân có eGFR < 60 (1,93%, 95% CI 1,05-2,81) so với bệnh nhân có eGFR ≥ 60 (0,68%, 95% CI 0,42-0,95). Kết hợp của chảy máu nội sọ hoặc chảy máu gây tử vong tăng không đáng kể bất kể chức năng thận. Kết quả phù hợp bất kể eGFR được tính theo công thức MDRD hay CKD-EPI.
Bảng 2
Tiêu chí an toàn chính tại thời điểm 3 năm của từng nhóm eGFR (mL/min/1,73m2)
|
Endpoint |
eGFR |
% 3-year KM |
Ticagrelor pooled vs. placebo |
P-int |
Ticagrelor 90 vs. placebo |
P-int |
Ticagrelor 60 vs. placebo |
P-int |
|||
|
Ticagrelor pooled |
Ticagrelor 90 |
Ticagrelor 60 |
Placebo |
||||||||
|
Bleeding |
|||||||||||
|
TIMI major |
≥60 |
2,41 |
2,74 |
2,09 |
0,99 |
2,65 (1,87–3,76) |
0,38 |
3,05 (2,10–4,43) |
0,11 |
2,29 (1,56–3,36) |
0,998 |
|
<60 |
2,53 |
2,13 |
2,94 |
1,34 |
1,98 (1,13–3,46) |
1,69 (0,89–3,19) |
2,29 (1,25–4,19) |
||||
|
TIMI minor |
≥60 |
0,89 |
0,95 |
0,84 |
0,21 |
4,05 (2,02–8,12) |
0,98 |
4,51 (2,17–9,37) |
0,95 |
3,63 (1,73–7,62) |
0,997 |
|
<60 |
2,62 |
2,65 |
2,59 |
0,69 |
4,00 (1,90–8,40) |
4,36 (2,00–9,51) |
3,62 (1,62–8,05) |
||||
|
ICH or fatal |
≥60 |
0,64 |
0,65 |
0,62 |
0,52 |
1,38 (0,81–2,86) |
0,27 |
1,50 (0,72–2,51) |
0,15 |
1,28 (0,70–2,35) |
0,65 |
|
<60 |
0,79 |
0,60 |
0,98 |
0,95 |
0,82 (0,38–2,78) |
0,64 (0,24–2,74) |
1,00 (0,42–2,43) |
||||
Biến cố an toàn khác và khả năng dung nạp
Ở nhánh giả dược, biến cố thận bất lợi thường xảy ra ở những bệnh nhân có eGFR < 60 so với bệnh nhân có eGFR ≥ 60 (8,53 so với 1,23%, HRadj 7,14; 95% CI 5,00-10,0; P < 0,001). Tuy nhiên, ticagrelor không làm tăng nguy cơ biến cố thận bất lợi thận toàn bộ và không có sự không đồng nhất về thống kê theo phân loại eGFR (Pinteraction = 0,22). Tương tự như vậy, bệnh gút xảy ra thường xuyên hơn ở những bệnh nhân có eGFR < 60 (HRadj 3,62; 95% CI 2,21-5,94; P < 0.001), nhưng nguy cơ tương đối của gút do ticagrelor ít rõ ở bệnh nhân rối loạn chức năng thận. Ở bệnh nhân điều trị ngẫu nhiên với giả dược, tăng không có ý nghĩa biến cố khó thở ở bệnh nhân có eGFR< 60 so với bệnh nhân có eGFR ≥ 60 (7,5 so với 6,0%, HRadj 1,18; 95% CI 0,92-1,51; P = 0,19). Cả hai liều ticagrelor tăng biến cố khó thở so với giả dượcbất kể chức năng thận. Ở nhánh giả dược, ngưng thuốc sớm thường cao hơn ở nhóm bệnh nhân có eGFR< 60 so với bệnh nhân có eGFR ≥60 (28,9 so với 20,9%, HRadj 1,27; 95% CI 1,12-1,43; P< 0.001). Tương tự, tỷ lệ ngưng thuốc sớm ở nhánh ticagrelor có rối loạn chức năng thận thường cao hơn. Bởi vì ngừng thuốc sớm cao hơn ở bệnh nhân có rối loạn chức năng thận, phân tích độ nhạy phát hiện tầm quan trọng của hiệu quả ở bệnh nhân “on treatment” theo phân tầng theo eGFR. Giảm nguy cơ tương đối rõ rệt với ticagrelor, đặc biệt là ở bệnh nhân có thận rối loạn chức năng (HR 0,72; 95% CI 0,59-0,89; với eGFR < 60; HR 0,83; 95% CI 0,72-0,96; với eGFR ≥ 60).
BÀN LUẬN
Bệnh nhân ngoại trú ổn định với nhồi máu cơ tim trước đó được phân ngẫu nhiên vào thử nghiệm PEGASUS-TIMI54, chức năng thận xấu đi là một yếu tố dự báo độc lập xảy ra MACE. Giảm nguy cơ tương đối MACE với ticagrelor tương tự nhau bất kể chức năng thận. Tuy nhiên, do nguy cơ thiếu máu cục bộ ở bệnh nhân có rối loạn chức năng thận cao hơn (chiếm khoảng một phần tư dân số thử nghiệm) nên nhóm bệnh nhân này nguy cơ tuyệt đối MACE giảm nhiều hơn khi điều trị bằng ticagrelor.
Các nghiên cứu trước đây đã mô tả mối quan hệ nghịch đảo giữa eGFR và biến cố thiếu máu cục bộ, chảy máu ở bệnh nhân có nhồi máu cơ tim gần đây4,9,18. Nghiên cứu hiện tại được xây dựng dựa trên những quan sát này nhưng được mở rộng cho bệnh nhân ngoại trú ổn định có thời gian xảy ra nhồi máu cơ tim trung bình 1,7 năm và thời gian theo dõi trung bình 33 tháng. Đáng chú ý là tỷ lệ MACE xấp xỉ khoảng 14% trong 3 năm ở bệnh nhân có rối loạn chức năng thận, tỷ lệ này gấp đôi so với bệnh nhân có chức năng thận bình thường. Dấu hiệu rối loạn chức năng thận là chỉ dấu lâm sàng hữu ích về nguy cơ cao thiếu máu cục bộ cơ tim. Hơn nữa, nguy cơ này độc lập với các đặc điểm lâm sàng khác. Nguy cơ chảy máu có xu hướng tăng khi có rối loạn chức năng thận. Tuy nhiên, sau khi hiệu chỉnh đa biến, mối quan hệ này chỉ cóở chảy máu TIMI nhẹ. Phát hiện này rõ nhất ở bệnh nhân có eGFR < 60 (N = 4849, 23%), tuy nhiên chỉ có một tỷ lệ nhỏ bệnh nhân trong thử nghiệm này (N = 3251, 15%) có chức năng thận bình thường (Ví dụ: eGFR ≥ 90) và hơn một nửa (N = 12.798, 60%) giảm nhẹ chức năng thận (eGFR 60 – < 90). Mặc dù rối loạn chức năng thận mạn tính không thuộc giai đoạn cuối là một tiêu chí chọn lựa của thử nghiệm, nhưng tỷ lệ bệnh nhân có bệnh thận mạn tính mà chúng ta quan sát thấy là phù hợpvới quan sát dịch tễ học trước đây1,4.
Giảm nguy cơ tương đối MACE với ticagrelor có xu hướng hơi lớn hơn ở bệnh nhân có rối loạn chức năng thận (19% so với 12%), nhưng khác biệt không có ý nghĩa thống kê. Quan trọng hơn tỷ lệ biến cố thiếu máu cục bộ cơ tim lớn hơn ở bệnh nhân có rối loạn chức năng thận dịch chuyển sang giảm nguy cơ tuyệt đối lớn hơn với ticagrelor ở những bệnh nhân này. Cụ thể, giảm nguy cơ tuyệt đối MACE với ticagrelor là 2,7%, dịch chuyển thành số người cần điều trị là 37 để ngăn chặn một biến cố MACE ngay khi bắt đầu pha ổn định. Giảm nguy cơ mạnh mẽ này xảy ra mặc dù tỷ lệ ngưng thuốc cao, cùng với phân tích “on treatment” cho thấy biên độ lợi ích lớn hơn.
Những phát hiện về hiệu quả này được chứng thực bởi quan sát ticagrelor ở nhóm bệnh nhân hội chứng mạch vành cấp. Có xu hướng giảm nguy cơ tương đối MACE cao hơn và giảm nguy cơ tuyệt đối MACE lớn hơn gấp bốn lần ở bệnh nhân có rối loạn chức năng thận9. Khi tích hợp các phát hiện này từ hai bộ dữ liệu, bệnh nhân hội chứng mạch vành cấp và rối loạn chức năng thận giảm nguy cơ tuyệt đối mạnh mẽ với ticagrelor và tiếp tục hiện diện ở giai đoạn ổn định trong phòng ngừa thứ phát dài hạn.
Gia tăng nguy cơ tương đối và tuyệt đối của chảy máu TIMI nặng do ticagrelor tương tự ở 2 nhóm bệnh nhân có và không có thận rối loạn chức năng. Tuy nhiên, mức dư thừa tuyệt đối của chảy máu TIMI nhẹ (Hemoglobin giảm từ 3 – 5g/dL) do ticagrelor lớn hơn ở bệnh nhân có rối loạn chức năng thận. Không có tăng nguy cơ tương đối hoặc tuyệt đối chảy máu nội sọ hoặc tử vong do chảy máu với ticagrelor ở toàn thể bệnh nhân hoặc ở bệnh nhân có và không có rối loạn chức năng thận. Phù hợp với phát hiện từ các thử nghiệm lớn khác, không có tăng biến cố thận bất lợi do ticagrelor trong thử nghiệm hiện tại. Gút là thường gặp ở bệnh nhân có rối loạn chức năng thận và tăng lên vớiticagrelor ở cùng một mức độ tương tự bất kể eGFR.
HẠN CHẾ
Nghiên cứu này cũng có một số giới hạn nhất định. Thứ nhất, mặc dù được xác định trước, quan sát của chúng tôi dựa trên các phân nhóm trong tổng thể thử nghiệm. Quan trọng hơn, có sự khác biệt cơ bản có ý nghĩa giữa bệnh nhân có và không có rối loạn chức năng thận. Bệnh thận mạn là một yếu tố thường gặp trong thử nghiệm PEGASUS-TIMI 54 và bệnh nhân không có bệnh thận mạn có thể có các yếu tố nguy cơ xơ vữa huyết khối hơn là bệnh thận mạn, quan sát khác với thực hành lâm sàng bệnh nhân bệnh thận mạn có nhiều bệnh đi kèm hơn so với bệnh nhân không có bệnh thận mạn3. Mặc dù khi đánh giá mối quan hệ của MACE và chảy máu với chức năng thận, chúng tôi đã hiệu chỉnh các khác biệt này bằng phân tích đa biến, nhưng số nhiễu có thể vẫn còn. PEGASUS-TIMI 54 là một thử nghiệm ngẫu nhiên, các khác biệt này đã được cân bằng giữa hai nhóm ticagrelor và nhóm giả dược và do đó không có ảnh hưởng đến so sánh điều trị. Ngoài ra, một số bệnh nhân tương đối nhỏ bị rối loạn chức năng thận nặng và bệnh nhân cần được lọc máu bị loại trừ khỏi thử nghiệm. Phân tích của chúng tôi là dựa trên eGFR tính bằng công thức MDRD sử dụng huyết thanh creatinine ban đầu. Tuy nhiên, thử nghiệm PEGASUS-TIMI 54 thu nhận dân số ổn định và do đó có thể không có biến động lớn về giá trị creatinine ban đầu, như có thể được quan sát ở dân số cấp.
KẾT LUẬN
Ở bệnh nhân ổn định có tiền sử nhồi máu cơ tim, rối loạn chức năng thận là yếu tố độc lập liên quan với tăng nguy cơ MACE. Mặc dù giảm nguy cơ tương đối MACE với ticagrelor tương tự nhau bất kể chức năng thận, bệnh nhân rối loạn chức năng thận giảm nguy cơ tuyệt đối MACE lớn hơn khi điều trị bằng ticagrelor. Phát hiện này có ý nghĩa quan trọng trong điều trị do tỷ lệ bệnh nhân bị bệnh mạch vành có rối loạn chức năng thận ngày càng tăng.
Tài liệu tham khảo
1. Fox CS, Muntner P, Chen AY, Alexander KP, Roe MT, Cannon CP, Saucedo JF,Kontos MC, Wiviott SD. Use of evidence-based therapies in short-term outcomes of ST-segment elevation myocardial infarction and non-ST-segment elevation myocardial infarction in patients with chronic kidney disease: a report from the National Cardiovascular Data Acute Coronary Treatment and Intervention Outcomes Network registry. Circulation 2010;121:357–365.
2. Coresh J, Selvin E, Stevens LA, Manzi J, Kusek JW, Eggers P, Van Lente F, Levey AS. Prevalence of chronic kidney disease in the United States. JAMA 2007;298: 2038–2047.
3. Dumaine RL, Montalescot G, Steg PG, Ohman EM, Eagle K, BhattDL; REACHRegistry Investigators. Renal function, atherothrombosis extent, and outcomes in high-risk patients. Am Heart J 2009;158:141–148.
4. Anavekar NS, McMurray JJ, Velazquez EJ, Solomon SD, Kober L, Rouleau JL, White HD, Nordlander R, Maggioni A, Dickstein K, Zelenkofske S, Leimberger JD, Califf RM, Pfeffer MA. Relation between renal dysfunction and cardiovascular outcomes after myocardial infarction. N Engl J Med 2004;351:1285–1295.
5. Cheung AK, Sarnak MJ, Yan G, Dwyer JT, Heyka RJ, Rocco MV, Teehan BP, Levey AS; The Hemodyalysis (HEMO) Study. Atherosclerotic cardiovascular disease risks in chronic hemodialysis patients. Kidney Int 2000;58:353–362.
6. Capodanno D, Angiolillo DJ. Antithrombotic therapy in patients with chronic kidney disease. Circulation 2012;125:2649–2661.
7. Best PJ, Steinhubl SR, Berger PB, Dasgupta A, Brennan DM, Szczech LA, Califf RM, Topol EJ. The efficacy and safety of short- and long-term dual antiplatelet therapy in patients withmild ormoderate chronic kidney disease: results from theClopidogrel for the Reduction of EventsDuringObservation (CREDO) trial. Am Heart J 2008;155:687–693.
8. Dasgupta A, Steinhubl SR, Bhatt DL, Berger PB, Shao M, Mak KH, Fox KA, Montalescot G,Weber MA, Haffner SM, Dimas AP, Steg PG, Topol EJ; CHARISMA Investigators. Clinical outcomes of patients with diabetic nephropathy randomized to clopidogrel plus aspirin versus aspirin alone (a post hoc analysis of the Clopidogrel for High Atherothrombotic Risk and Ischemic Stabilization, Management, and Avoidance [CHARISMA] Trial). Am J Cardiol 2009;103:1359–1363.
9. James S, Budaj A, Aylward P, Buck KK, Cannon CP, Cornel JH, Harrington RA, Horrow J, Katus H, Keltai M, Lewis BS, Parikh K, Storey RF, Szummer K, Wojdyla D, Wallentin L. Ticagrelor versus clopidogrel in acute coronary syndromes in relation to renal function: results from the platelet inhibition and patient outcomes (PLATO) trial. Circulation 2010;122:1056–1067.
10. Hamm CW, Bassand JP, Agewall S, Bax J, Boersma E, Bueno H, Caso P, Dudek D, Gielen S, Huber K,Ohman M, Petrie MC, Sonntag F, Uva MS, Storey RF, WijnsW, Zahger D; ESC Committee for Practice Guidelines. ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: the Task Force for the management of acute coronary syndromes (ACS) in patients presenting without persistent ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J 2011;32: 2999–3054.
11. Task Force on the Management of ST-Segment Elevation Acute Myocardial Infarctionof the European Society of Cardiology (ESC), Steg PG, James SK, Atar D, Badano LP,Blo¨mstrom-Lundqvist C, Borger MA, Di Mario C, Dickstein K, Ducrocq G, Fernandez-Aviles F, Gershlick AH, Giannuzzi P, Halvorsen S, Huber K, Juni P, Kastrati A, Knuuti J, Lenzen MJ, Mahaffey KW, Valgimigli M, vant Hof A, Widimsky P, Zahger D. ESC guidelines for themanagement of acutemyocardial infarction in patients presenting with ST-segment elevation. EurHeart J 2012;33:2569–2619.
12. Bonaca MP, Bhatt DL, Cohen M, Steg PG, Storey RF, Jensen EC, Magnani G, Bansilal S, Fish MP, Im K, Bengtsson O, Oude Ophuis T, Budaj A, Theroux P, Ruda M, Hamm C, Goto S, Spinar J, Nicolau JC, Kiss RG, Murphy SA, Wiviott SD, Held P, Braunwald E, Sabatine MS; PEGASUS-TIMI 54 Steering Committee and Investigators. Long-term use of ticagrelor in patients with prior myocardial infarction. N Engl J Med 2015;372:1791–1800.
13. Bonaca MP, Bhatt DL, Braunwald E, Cohen M, Steg PG, Storey RF, Held P, Jensen EC, Sabatine MS. Design and rationale for the prevention of cardiovascular events in patients with prior heart attack using ticagrelor compared to placebo on a background of aspirin-thrombolysis in myocardial infarction 54 (PEGASUS-TIMI 54) trial. Am Heart J 2014;167:437–444.
14. Levey AS, Coresh J, Greene T, Marsh J, Stevens LA, Kusek JW, Van Lente F; Chronic Kidney Disease Epidemiology Collaboration. Expressing the modification of diet in renal disease study equation for estimating glomerular filtration rate with standardized serum creatinine values. Clin Chem 2007;53:766–772.
15. Levey AS, Stevens LA, Schmid CH, Zhang YL, Castro AF III, Feldman HI, Kusek JW, Eggers P, Van Lente F, Greene T, Coresh J; CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration). A new equation to estimate glomerular filtration rate. Ann Intern Med 2009;150:604–612.
16. National Kidney Foundation. K/DOQI clinical practice guidelines for chronic kidneydisease: evaluation, classification, and stratification. Am J Kidney Dis 2002; 39 (Suppl.1):S1–S266.
17. Heinzl H, Kaider A. Gaining more flexibility in Cox proportional hazards regression models with cubic spline functions. Comput Methods Programs Biomed 1997;54: 201–208.
18. Vasaiwala S, Cannon CP, Fonarow GC, Peacock WF, Laskey W, Schwamm LH, Liang L, Hernandez AF, Peterson ED, Rosas SE, Bhatt DL; Get with the Guidelines Steering Committee and Investigators. Quality of care and outcomes among patients with acute myocardial infarction by level of kidney function at admission: report from the get with the guidelines coronary artery disease program. Clin Cardiol 2012;35:541–547.







