Người dịch: ThS. BS LÊ VÕ KIÊN
Khoa Q3A, Viện Tim mạch quốc gia Việt Nam
TÓM TẮT
Mục tiêu:
Đánh giá hiệu quả của dạng phối hợp perindopril 3,5 mg/amlodipine 2,5 mg mỗi lần một ngày – một dạng phối hợp liều cố định mới cho khởi đầu điều trị bệnh nhân tăng huyết áp. Dạng liều phối hợp cố định này tương đương với liều amlodipine 5 mg về mặt hiệu quả hạ áp nhưng được kỳ vọng có tính dung nạp tốt hơn. Chúng tôi tiến hành chọn ra 2 loại dược chất có tác động bù trừ nhau, hàm lượng đã được xác định sẵn, với kỳ vọng mỗi thuốc sẽ đóng góp vai trò tương đương nhau vào hiệu quả hạ áp nói chung.
Phương pháp:
Đây là một nghiên cứu quốc tế, phân nhóm ngẫu nhiên, mù đôi, có giả dược, với 6 nhánh nghiên cứu song song và thời gian điều trị phân nhóm ngẫu nhiên là 8 tuần. Thiết kế nghiên cứu, ý nghĩa lâm sàng và tiêu chuẩn không kém hơn tuân thủ chặt chẽ hướng dẫn của Châu Âu.
Kết quả:
1581 bệnh nhân có tăng huyết áp không biến chứng mức độ nhẹ đến trung bình (tuổi trung bình 51,7 năm) được phân nhóm ngẫu nhiên. Có 94,7% bệnh nhân hoàn thành nghiên cứu. Dạng thuốc phối hợp có hiệu quả về mặt lâm sàng và thống kê vượt trội hơn so với giả dược (khác biệt giữa 2 nhóm: huyết áp tâm thu: -7,22 mmHg, huyết áp tâm trương: -4,12 mmHg, p < 0,001 cho cả hai). So với nhóm dùng giả dược, tốc độ đáp ứng với điều trị và tốc độ hạ áp xuống mức bình thường ở nhóm dùng thuốc phối hợp nhanh hơn (p < 0,001 cho cả hai) và mức hạ số đo huyết ápthể hiện rõ rệt ngay sau 2 tuần điều trị. Dạng thuốc phối hợp có hiệu quả hơn hẳn mỗi thuốc dùng đơn lẻ (p < 0,001 cho cả hai thuốc, đối với cả huyết áp tâm thu và huyết áp tâm trương), và không kém hơn khi so sánh với từng thuốc thành phần với liều thấp nhất được chấp thuận trên lâm sàng. Các thành phần của dạng thuốc phối hợp có tác dụng như nhau trên huyết áp tâm thu (perindopril 3,5 mg: -16,3 mmHg; amlodipine 2,5 mg: -16,0 mmHg). Tác dụng phụ phù mạch ngoại biên ở nhóm dùng dạng phối hợp ít gặp hơn ở nhóm dùng amlodipine 5 mg.
Kết luận:
Các bằng chứng rõ ràng về hiệu quả hạ áp, sự nhanh chóng đạt hiệu quả hạ áp và ưu điểm về tính an toàn của dạng phối hợp cố định perindopril 3,5 mg/amlodipine 2,5 mg cho thấy sự khả dụng của dạng thuốc này trong điều trị đầu tay tăng huyết áp.
Từ khóa: amlodipine, thuốc hạ huyết áp, dạng thuốc phối hợp, tăng huyết áp/cách thức điều trị, perindopril.
ĐẶT VẤN ĐỀ
Từ lâu người ta đã ước tính rằng có xấp xỉ 26% người trưởng thành trên toàn thế giới mắc tăng huyết áp vào năm 2000 [1] và số bệnh nhân bị tăng huyết áp ở Hoa Kỳ tăng 30% trong giai đoạn 1988 – 1994 và 1999 – 2000 [2]. Toàn thế giới có 7,6 triệu người tử vong sớm (khoảng 13,5% tổng số tử vong) do căn nguyên tăng huyết áp vào năm 2001 [3]. Tỷ lệ dân số hiểu biết về bệnh tăng huyết áp, cách điều trị và con số huyết áp mục tiêu (< 140/90 mmHg) đã tăng rõ rệt trong những năm gần đây [4,5] nhưng chỉ có khoảng một nửa trong số những người uống thuốc hạ huyết áp đạt được con số huyết áp mục tiêu [5,6].
Phần lớn bệnh nhân tăng huyết áp cần nhiều hơn một thuốc để kiểm soát huyết áp hiệu quả [7-10]. Trong một nghiên cứu toàn cầu gần đây bao gồm 26 nước tham gia, chỉ khoảng 30% số bệnh nhân sử dụng đơn trị liệu [11]. Việc phối hợp nhiều thuốc mang lại nhiều lợi ích tiềm năng hơn so với liều cao của một thuốc. Có rất nhiều cơ chế và con đường tham gia vào việc điều hòa huyết áp và tác động của một loại thuốc huyết áp nào đó có thể bị hao hụt đi do các cơ chế bù trừ. Một phân tích gộp cho thấy việc phối hợp hai loại thuốc có nguồn gốc từ hai nhóm thuốc khác nhau với các cơ chế tác động khác nhau có thể đạt hiệu quả hạ áp gấp 5 lần việc gấp đôi liều của một thuốc [12]. Vì vậy, việc phối hợp thuốc có thể tạo ra tác dụng hạ áp tốt hơn chỉ với liều thấp hơn của từng thành phần, và nhờ đó giảm bớt tác dụng phụ [7,13]. Hiệu quả của dạng phối hợp liều cố định có thể còn tiện lợi hơn nữa, đó là làm đơn giản hóa việc uống thuốc và tối ưu hóa sự tuân thủ trị liệu của bệnh nhân [7,9,14]. Khuyến cáo điều trị tăng huyết áp mới của Châu Âu khuyên rằng một viên thuốc dạng phối hợp liều cố định nên được ưu tiên chỉ định bất cứ khi nào có thể [9].
Trước đây, việc phối hợp nhiều thuốc tăng huyết áp được xem là bước thứ hai cần thiết sau khi đã thử bước một đơn trị liệu. Tuy nhiên, các khuyến cáo mới đây đều nhấn mạnh lợi ích của phối hợp thuốc ngay từ bước khởi trị, đặc biệt ở nhóm bệnh nhân nguy cơ cao đòi hỏi phải kiểm soát được huyết áp sớm, hoặc trong trường hợp cần phải hạ đáng kể huyết áp [7-10]. Việc dùng thuốc phối hợp ngay từ đầu có thể giúp tránh được cảm giác thất vọng của bác sỹ khi mãi không tìm ra được cách đơn trị liệu nào có hiệu quả [9].
Mục tiêu chính của chúng tôi là tìm ra một dạng phối hợp mới trong một viên thuốc duy nhất, phù hợp với điều trị đầu tay, ít nhất có hiệu quả hạ áp tương đương với amlodipine 5mg, cải thiện được những tác dụng phụ phổ biến, đặc biệt là phù mạch ngoại biên. Chúng tôi đã lựa chọn 2 loại thuốc với cơ chế hoạt động hài hòa trên cả mặt hiệu quả và tính an toàn, với mức liều ít nhất có hiệu quả ngang với amlodipine 5 mg. Trong bài báo này, chúng tôi trình bày kết quả của một nghiên cứu về dạng phối hợp perindopril 3,5 mg/amlodipine 2,5 mg. Đây là một nghiên cứu pha II, ngẫu nhiên, mù đôi, được thiết kế theo quy chuẩn của các hướng dẫn Châu Âu [15]. Kết quả nghiên cứu này được công bố nhằm mục đích hoàn thành bước cuối cùng của dự án phát triển dạng thuốc phối hợp perindopril/amlodipine mới, vốn đã kết thúc vào tháng 10 năm 2013.
ĐỐI TƯỢNG VÀ PHƯƠNG PHÁP NGHIÊN CỨU
Đối tượng nghiên cứu
Đối tượng nghiên cứu là những bệnh nhân ngoại trú nam hoặc nữ trong lứa tuổi từ 18 đến 79 tuổi, có tăng huyết áp mức độ nhẹ đến trung bình, không có bệnh lý đi kèm hoặc tổn thương cơ quan đích, chưa được điều trị hoặc được điều trị nhưng chưa kiểm soát được huyết áp, hoặc đang cần phải thay đổi thuốc huyết áp. Tiêu chuẩn số đo huyết áp để được tuyển bệnh là huyết áp tâm thu (HATTh) ít nhất 150 mmHg và thấp hơn 180 mmHg; huyết áp tâm trương (HATTr) ít nhất 95 mmHg và thấp hơn 110 mmHg. Tiêu chuẩn loại trừ chính bao gồm: béo phì (BMI > 30 kg/m2); tiền sử tai biến mạch não, bệnh tim thiếu máu cục bộ, suy tim, rối loạn nhịp tim, suy thận, bệnh võng mạc nặng hoặc phù mạch; đang có bệnh mạch máu ngoại biên, phì đại thất trái, có vi đạm niệu, đái tháo đường type 1 hoặc type 2; bệnh gan, dễ xúc cảm, có chống chỉ định hoặc tăng huyết áp kháng với ức chế men chuyển dạng angiotensin hoặc chẹn kênh canxi loại dihydropyridine. Các bệnh nhân được tuyển bệnh có mức nguy cơ tim mạch từ thấp đến cao theo các khuyến cáo hiện hành.
Thiết kế nghiên cứu
Mục tiêu chính của nghiên cứu là đánh giá hiệu quả và tính an toàn của dạng thuốc phối hợp perindopril 3,5 mg/amlodipine 2,5 mg với mục đích dùng cho điều trị đầu tay tăng huyết áp. Dựa theo các hướng dẫn của Châu Âuvề cách đánh giá các dạng thuốc phối hợp liều cố định trong điều trị tăng huyết áp [15], ba tiêu chí so sánh hiệu quả điều trị hạ áp được đặt ra:
- Mức độ vượt trội của dạng thuốc phối hợp khi so sánh với giả dược.
- Mức độ vượt trội của dạng thuốc phối hợp khi so sánh với riêng từng thành phần nếu sử dụng riêng lẻ.
- Tính không kém hơn của dạng phối hợp khi so sánh với liều thấp nhất đã được chuẩn thuận của từng thành phần thuốc khi sử dụng riêng lẻ (amlodipine 5 mg và perindopril 5 mg).
Tốc độ hạ huyết áp về mức bình thường cũng được đánh giá và hiệu quả hạ áp của từng thành phần khi sử dụng riêng rẽ cũng được so sánh với nhau. Khuyến cáo của Châu Âu cũng cho rằng, dạng thuốc phối hợp nên được chứng minh có xu hướng tốt hơn xét về tính an toàn khi so sánh với từng thuốc thành phần riêng rẽ.
Để đáp ứng được tất cả các mục tiêu, nghiên cứu đã được thiết kế dưới dạng một nghiên cứu quốc tế, ngẫu nhiên, mù đôi, có so sánh với giả dược, với cách thức nghiên cứu đa yếu tố và bao gồm 6 nhánh nghiên cứu. Nghiên cứu được chia thành 2 giai đoạn. Đầu tiên là giai đoạn khởi động (run-in) với giả dược kéo dài 2 tuần, nhưng không quá 3 tuần. Sau đó là giai đoạn 8 tuần mù đôi với các thuốc điều trị. Ở lần khám chính thức chọn vào nghiên cứu (W0), các bệnh nhân sẽ được phân bổ ngẫu nhiên vào 1 trong số 6 nhóm điều trị:
- Phối hợp cố định Perindopril 3,5 mg/amlodipine 2,5 mg
- Perindopril 3,5 mg
- Amlodipine 2,5 mg
- Perindopril 5 mg
- Amlodipine 5 mg
- Giả dược
Việc phân nhóm điều trị được thực hiện bằng một hệ thống điện thoại có khả năng giao tiếp, tương tác bằng giọng nói, và được kiểm soát tập trung, không tự thích ứng, phân bổ cân đối và được phân cấp bởi trung tâm nghiên cứu. Các nghiên cứu viên và bệnh nhân đều được “làm mù”, không biết bệnh nhân được chia vào nhánh điều trị nào. Các viên thuốc và cách đóng gói đều giống hệt nhau. Trong trường hợp khẩn thiết, thuốc sẽ được mở mã hóa theo quy trình kiểm soát bởi trung tâm nghiên cứu. Các lần tái khám được sắp xếp vào thời điểm 2, 4, 8 tuần sau giai đoạn bệnh nhân tham gia chính thức vào nghiên cứu (W2, W4 và W8). Bệnh nhân được hướng dẫn uống 1 viên thuốc mỗi ngày trước ăn sáng, kèm với nước. Trong ngày tái khám, bệnh nhân sẽ uống thuốc sau khi đo huyết áp và thăm khám lâm sàng. Trong thời gian nghiên cứu, thuốc không hề được chỉnh liều.
Nghiên cứu đã được tiến hành tại 188 trung tâm ở 6 nước Châu Âu (Pháp, Nga, Ucraina, Latvia, Lithuania và Hungary) trong thời gian từ tháng 5 – 2007 đến tháng 12 – 2008. Trong số 164 trung tâm tuyển ít nhất 1 bệnh nhân, có 115 trung tâm tại Pháp (tất cả nghiên cứu viên là bác sỹ đa khoa), và các trung tâm còn lại là các phòng khám ở bệnh viện công hoặc phòng khám tư ở 5 quốc gia còn lại (nghiên cứu viên là bác sỹ chuyên khoa tim mạch).
Đánh giá hiệu quả điều trị
Mỗi lần tái khám, bệnh nhân được đo huyết áp trước khi uống thuốc. Thời điểm gặp bác sỹ để tái khám nằm trong khoảng 24 ± 3 giờ sau lần uống thuốc gần nhất. Huyết áp được đo bằng một loại máy đo tự động (Microlife BP3AC1), đã được kiểm định và quy trình đo tuân theo tiêu chuẩn quốc tế của Hội Tăng huyết áp Châu Âu [16]. Loại máy đo huyết áp này được sử dụng thống nhất cho mỗi bệnh nhân ở tất cả các lần tái khám và tùy vào kích thước bắp tay của từng bệnh nhân mà chọn cỡ băng cuốn phù hợp. Khi bệnh nhân đến tái khám, huyết áp sẽ được đo sau 10 phút nghỉ ngơi và sẽ lấy con số trung bình của 3 lần đo liên tiếp, mỗi lần cách nhau 1 phút. Thông số của các lần đo đều được in ra và lưu trữ. Máy huyết áp lưu động được lắp cho một số nhóm bệnh nhân ở thời điểm tuần thứ 8 của tiến trình nghiên cứu (nhóm perindopril 3,5 mg/amlodipine 2,5 mg (n = 174), nhóm perindopril 5 mg (n = 187) và nhóm amlodipine 5 mg (n = 173)).
Đánh giá hiệu quả điều trị tập trung chủ yếu vào số đo huyết áp tâm trương ở tư thế nằm ngửa và tập trung phân tích chính vào sự thay đổi từ giá trị nền ban đầu (khi bắt đầu tham gia nghiên cứu) đến giá trị của lần đo cuối cùng trong nghiên cứu. Một số tiêu chí đánh giá hiệu quả khác là huyết áp tâm thu ở tư thế nằm ngửa, áp lực mạch đập (được xác định bằng huyết áp tâm thu trừ đi tâm trương), huyết áp trung bình (được xác định bằng 2/3 huyết áp tâm thu + 1/3 huyết áp tâm trương), sự hạ huyết áp về mức bình thường (được xác định bằng huyết áp tâm thu < 140 mmHg và huyết áp tâm trương < 90 mmHg), và khả năng đáp ứng với điều trị (xác định bằng huyết áp tâm thu < 140 mmHg và huyết áp tâm trương < 90 mmHg và/hoặc huyết áp tâm thu giảm ≥ 20 mmHg so với mức ban đầu và/hoặc huyết áp tâm trương giảm ≥ 10 mmHg so với mức ban đầu).
Đánh giá tính an toàn
Tính an toàn được lượng giá bằng cách truyền thống là thu thập các dữ liệu về phản ứng bất lợi, thăm khám thực thể, ghi điện tâm đồ 12 chuyển đạo và làm xét nghiệm máu. Các phản ứngbất lợi mới xuất hiện được định nghĩa là phản ứng bất lợi xảy ra hoặc diễn biến xấu hơn trong khoảng thời gian tính từ khi bắt đầu uống viên thuốc đầu tiên của nghiên cứu cho đến 7 ngày sau khi uống viên thuốc cuối cùng của nghiên cứu. Ngoài ra, các nhà nghiên cứu cũng tiến hành đánh giá tính an toàn đặc thù của từng loạithuốc cụ thể. Mỗi bệnh nhân được phát một máy đo huyết áp tự động và tự ghi chép vào sổ theo dõi số đo HATTh và HATTr mỗi tuần 2 lần (lấy số trung bình của 3 lần đo vào buổi sáng). Bất kỳ lúc nào HATTr từ 100 mmHg trở lên và/hoặc HATTh từ 160 mmHg trở lên, bệnh nhân cần phải thông báo cho bác sỹ phụ trách trong nghiên cứu. Ở thời điểm W2, W4, W8, ngoài đo huyết áp ở tư thế nằm ngửa, bác sỹ sẽ đo huyết áp vào thời điểm 1 đến 3 phút sau khi đứng thẳng dậy để đánh giá xem có hạ huyết áp tư thế hay không. Số đo huyết áp lần cuối cùng ở tư thế nằm ngửa sẽ được đem so sánh với số đo huyết áp lúc đứng thẳng dậy. Mức giảm HATTh ít nhất 20 mmHg và/hoặc HATTr ít nhất 10 mmHg ở cả thời điểm 1 phút và 3 phút sau khi đứng dậy được coi là hạ huyết áp tư thế và được ghi nhận là phản ứng bất lợi.
Ở thời điểm W0, W2, W4 và W8, các nhà nghiên cứu tiến hành thăm khám lâm sàng để đánh giá các tính chất của triệu chứng phù chân, cụ thể là vị trí, mức độ mạn tính, mức độ nặng,có giảm khi nằm ngửa hay không đối với phù một chân hoặc cả hai chân, cảm giác đau kèm theo, cảm giác tức nặng chân và mức độ nóng tại chỗ phù. Ngoài ra, ở các lần thăm khám này, bệnh nhân sẽ tự đánh giá mức độ tức nặng chân và mức độ phù bằng cách trả lời một thang điểm đánh giá trực quan (Visual Analogue Scale – VAS) và bác sỹ sẽ dùng một thước dây chuyên dụng đo chu vi cổ chân ở vị trí 2 cm trên xương mắt cá.
Thuật toán thống kê
Phân tích hiệu quả điều trị chính được thực hiện với tập hợp bệnh nhân hoàn thiện để phân tích (Full Analysis Set –FAS), được định nghĩa là tất cả các bệnh nhân đã được phân nhóm ngẫu nhiên, dùng ít nhất 1 liều thuốc nghiên cứu và có ít nhất 1 thông số HATTr nền ban đầu và ít nhất 1 thông số HATTr đo trong quá trình nghiên cứu sau đó, không tính thông số nền ban đầu.
Các phân tích thống kê cũng được thực hiện với tập hợp bệnh nhân tuân thủ đề cương nghiên cứu (Per-Protocol Set – PPS), bao gồm các bệnh nhân thuộc tập hợp FAS và có toàn bộ thời gian điều trị ít nhất 45 ngày, có thông số HATTh và HATTr ở tuần thứ 8 (W8) và không có sự vi phạm lớn đề cương nghiên cứu nào khác.
Phân tích tính an toàn được thực hiện với tất cả bệnh nhân uống ít nhất một liều thuốc nghiên cứu.
So sánh mức độ vượt trội được thực hiện dựa trên mô hình tuyến tính, bằng cách so sánhsự biến đổi từ số đo nền ban đầu đếnsố đo cuối cùng thu thập được, với số đo nền và trung tâm nghiên cứu là các đồng tham số. Để so sánh mức độ vượt trội so với giả dược, mốc đánh giá sự khác biệt là 2 mmHg đối với HATTr và 3 mmHg đối với HATTh. So sánh tính không kém hơn được thực hiện dựa trên cơ sở lấy mốc không kém hơn trong khoảng 2 mmHg đối với HATTr và 3 mmHg đối với HATTh, theo tinh thần của khuyến cáo Châu Âu [15]. Tốc độ đáp ứng với điều trị và tốc độ hạ huyết áp về mức bình thường được so sánh bằng kiểm định Khi bình phương (Chi – square test). Xác suất sai lầm loại I được quy ước là 5% đối với kiểm định 2 phía và 2,5% đối với kiểm định 1 phía.
Đối với cỡ mẫu, để thực hiện so sánh sự vượt trội, một cỡ mẫu tối thiểu 224 bệnh nhân cho mỗi nhóm sẽ mang lại lực mẫu danh nghĩa là 94%, nếu lấy mức khác biệt giữa các nhóm đúng bằng 3 mmHg đối với HATTr và độ lệch chuẩn 9 mmHg. Nếu lấy mức khác biệt đúng bằng 5 mmHg, cỡ mẫu tương tự sẽ mang lại lực mẫu 94% và một khoảng tin cậy không chứa 2 mmHg (là mức khác biệt có thể nhận biết khả thi trên lâm sàng). Để so sánh tính không kém hơn, cỡ mẫu 224 bệnh nhân mỗi nhóm sẽ mang lại lực mẫu 94% nếu lấy mốc không kém hơn là 2 mmHg, sự khác biệt giữa các nhóm đúng bằng 1 mmHg đối với HATTr và độ lệch chuẩn là 9 mmHg. Với ước tính khoảng 5% bệnh nhân sẽ rút khỏi nghiên cứu, các tác giả đã lựa chọn cỡ mẫu xấp xỉ 250 bệnh cho mỗi nhóm.
KẾT QUẢ NGHIÊN CỨU
Số lượng và sự biến động bệnh nhân nghiên cứu
Tổng số 2053 bệnh nhân được tiến hành tuyển lựa ở 188 trung tâm trong đó có 1581 bệnh nhân tham gia chính thức và được phân nhóm ngẫu nhiên vào các nhánh điều trị. 84 bệnh nhân sau khi phân nhóm ngẫu nhiên đã rút khỏi nghiên cứu, còn lại 1497 bệnh nhân (94,7%) hoàn thành nghiên cứu (xem hình 1, bảng 1). Số bệnh nhân rút khỏi nhóm dùng dạng thuốc phối hợp là 9 ca, chiếm 3,6%, tương tự số bệnh nhân rút khỏi nhóm dùng giả dược (11 ca, chiếm 4,4%) và nếu tính về số tuyệt đối thì ít hơn số bệnh nhân rút lui khỏi các nhánh điều trị khác (14 – 19 bệnh nhân, chiếm 5,3 – 6,9%).
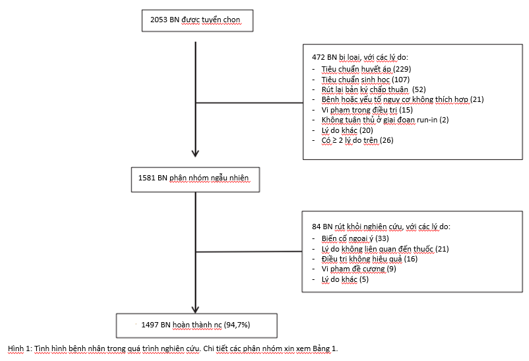
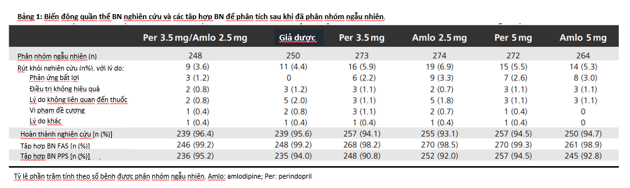
Phân bố và đặc điểm lâm sàng đối tượng nghiên cứu
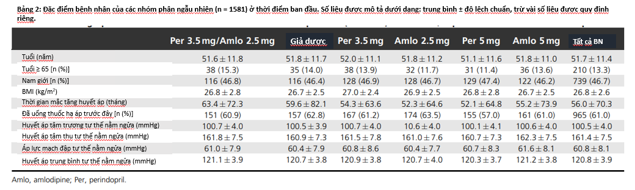
Tuổi trung bình của đối tượng nghiên cứu là 51,7 tuổi; trong đó 13,3% bệnh nhân từ 65 tuổi trở lên. Hầu hết bệnh nhân là người da trắng, tỷ lệ nam nữ khá cân bằng, với 46,7% bệnh nhân nam và 53,3% bệnh nhân nữ. BMI trung bình là 26,8 kg/m2. Thời gian trung bình từ khi bắt đầu được chẩn đoán tăng huyết áp là 4 năm 8 tháng và 61% số bệnh nhân dùng thuốc hạ áp trong thời gian một năm trước khi được tuyển bệnh. Số đo trung bình của HATTr và HATTh lần lượt là 100,5 mmHg và 161,4 mmHg. Về đặc điểm chung của đối tượng nghiên cứu, không có sự khác biệt có ý nghĩa thống kê giữa các nhóm (xem bảng 2).
Tất cả các bệnh nhân đều có tăng huyết áp. Phần lớn bệnh nhân bị tăng huyết áp giai đoạn 2 (76%) và có thêm các yếu tố nguy cơ tim mạch khác, trừ đái tháo đường và tổn thương cơ quan đích có triệu chứng. Các yếu tố nguy cơ thu thập được trong nhóm bệnh nhân nghiên cứu là hút thuốc lá (15%), nam giới trên 55 tuổi (16,4%), nữ giới trên 65 tuổi (8,4%), rối loạn lipid máu (84,1%), đường máu đói trên 5,6 mmol/l (40,9%), BMI từ 30 trở lên và béo bụng (37,5%). Vì vậy hầu hết các đối tượng được ghi nhận có nguy cơ tim mạch trung bình đến cao.
Hiệu quả điều trị:
Mức độ vượt trội của dạng thuốc phối hợp so với giả dược
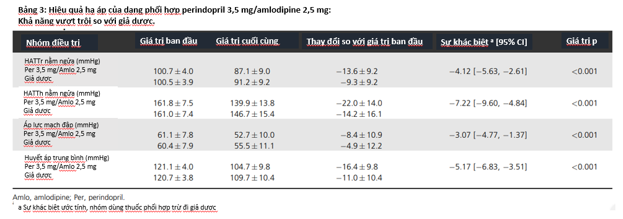
Khi phân tích tập hợp bệnh nhân hoàn thiện (tập hợp FAS), trong suốt 8 tuần điều trị, huyết áp tâm thu giảm nhiều hơn ở nhóm sử dụng dạng phối hợp perindopril 3,5 mg/amlodipine 2,5 mg (22,0 mmHg) so với nhóm sử dụng giả dược (14,2 mmHg), với sự khác biệt giữa hai nhóm là -7,22 mmHg [KTC 95% (-9,6 ; -4,84), p < 0,001]. Huyết áp tâm trương tư thế nằm ngửa cũng giảm 13,6 mmHg ở nhóm sử dụng dạng phối hợp trong khinhóm sử dụng giả dược giảm 9,3 mmHg; sự khác biệt giữa hai nhóm là -4,12 mmHg [KTC 95% (-5,63 ; -2,61), p < 0,001] (xem bảng 3). Các số liệu thể hiện sự khác biệt trong hiệu quả hạ áp này, khi so với giả dược thì vượt nhiều hơn mốctối thiểu có ý nghĩa lâm sàng đã được xác định trước là 3 mmHg đối với HATTh và 2 mmHg đối với HATTr. Kết quả tương tự cũng được rút ra sau khi phân tích tập hợp bệnh nhân tuân thủ đề cương (tập hợp PPS), với giá trị p < 0,001 cho cả hai cách so sánh trên (không đưa dữ liệu ở đây). Ngoài ra, dạng thuốc phối hợp cũng làm giảm áp lực mạch đập và huyết áp trung bình có ý nghĩa thống kê so với giả dược (p < 0,001 cho cả hai) (xem bảng 3).
Tỷ lệ bệnh nhân hạ huyết áp xuống mức bình thường ở cuối giai đoạn điều trị ở nhóm dùng dạng phối hợp là 43,5%, cao hơn rõ rệt so với 26,6% ở nhóm dùng giả dược, với mức chênh lệch giữa hai nhóm là 16,9% (p < 0,001). Ngay ở lần khám thứ 2 (W2), đã có sự khác biệt giữa hai nhóm nếu chỉ so sánh về số liệu đơn thuần (dạng phối hợp: 30,6% , giả dược: 16,2%).
So sánh dạng phối hợp với từng thành phần đơn lẻ
Trước hết là so sánh hiệu quả hạ áp của dạng phối hợp so với perindopril 3,5 mg dùng đơn lẻ và amlodipine 2,5 mg dùng đơn lẻ. Khi phân tích tập hợp FAS, mức hạ HATTh so với nền ban đầu nếu dùng dạng phối hợp là 22,0 mmHg, nếu dùng perindopril 3,5 mg là16,3 mmHg và nếu dùng amlodipine 2,5 mg là 16,0 mmHg. Sự khác biệt lần lượt khi so sánh giữa các nhóm là -5,01 mmHg (p < 0,001) và -5,20 mmHg (p < 0,001). Đối với HATTr, mức hạ so với nền ban đầu khi uống dạng phối hợp là 13,6 mmHg, nhiều hơn rõ rệt so với uống perindopril 3,5 mg (hạ 9,3 mmHg) và uống amlodipine 2,5 mg (hạ 10,3 mmHg) (xem bảng 4). Sự khác biệt lần lượt giữa các nhóm sau khi hiệu chỉnh là -3,64 mmHg (p < 0,001) và -2,97 mmHg (p < 0,001). Khi so sánh về số tuyệt đối, áp lực mạch đập ở nhóm dùng dạng phối hợp cũng giảm (-8,4 mmHg), nhiều hơn so với nhóm perindoprol 3,5 mg (-6,7 mmHg) và nhóm amlodipine 2,5 mg (-5,7 mmHg). Tương tự, đối với huyết áp trung bình, mức hạ ở nhóm dùng dạng phối hợp là 16,4 mmHg, nhiều hơn mức 11,9 mmHg ở nhóm perindoprol 3,5 mg và mức 12,2 mmHg ở nhóm amlodipine 2,5 mg.
Mục tiêu thứ hai là so sánh tính không kém hơn của dạng phối hợp so với từng thành phần đơn lẻ dùng với liều thấp nhất đã được chuẩn thuận (perindopril 5 mg và amlodipine 5 mg). Dạng phối hợp làm giảm HATTh 22,0 mmHg, còn perindopril 5 mg làm giảm 18,2 mmHg và amlodipine 5 mg làm giảm 21,8 mmHg. Sự khác biệt giữa các nhóm lần lượt là -2,78 và -0,29 mmHg, với các khoảng tin cậy trên 95% đều nằm trong mốc 3 mmHg được quy ước là không kém hơn (xem bảng 4). Dạng phối hợp vì vậy đều không kém hơn có ý nghĩa thống kê khi so với cả 2 thành phần thuốc riêng lẻ được dùng với liều thấp nhất đã được chuẩn thuận (p < 0,001 khi so với perindopril 5 mg và p = 0,003 khi so với amlodipine 5 mg). Tương tự, dạng phối hợp cũng làm hạ HATTr 13,6 mmHg, so với 10,5 mmHg nếu dùng perindopril 5 mg và 12,6 mmHg nếu dùng amlodipine 5 mg. Mức khác biệt ước tính giữa các nhóm lần lượt là -2,59 mmHg và -0,76 mmHg, với các khoảng tin cậy trên 95% đều nằm trong giới hạn 2 mmHg được quy ước là không kém hơn (xem bảng 4). Như vậy, dạng thuốc phối hợp không kém hơn một cách có ý nghĩa thống kê khi so với cả 2 thành phần đơn lẻ dùng với liều thấp nhất trên lâm sàng (p < 0,001 cho cả 2 so sánh). Huyết áp được hạ về mức bình thường ở 43,5% bệnh nhân dùng dạng phối hợp,ở 33,3% bệnh nhân dùng perindopril 5 mg và ở 37,9% bệnh nhân uống amlodipine 5 mg. Mức hạ áp lực mạch đập của dạng thuốc phối hợp là -8,4 mmHg, tương tự ở nhóm perindopril 5 mg (-7,8 mmHg) và nhóm amlodipine 5 mg (-9,2 mmHg). Mức chênh lệch áp lực mạch đập giữa các nhóm lần lượt chỉ là -0,22 mmHg và 0,45 mmHg (xem bảng 4). Huyết áp trung bình cũng tương tự, với mức hạ ở nhóm dùng dạng phối hợp là 16,4 mmHg, so với 13,1 mmHg ở nhóm perindopril 5 mg và 15,7 mmHg ở nhóm amlodipine 5 mg. Sự khác biệt ước tính giữa các nhóm lần lượt là-2,7 mmHg và -0,6 mmHg.
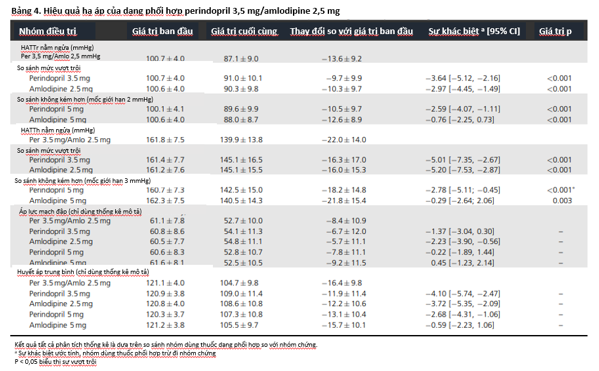
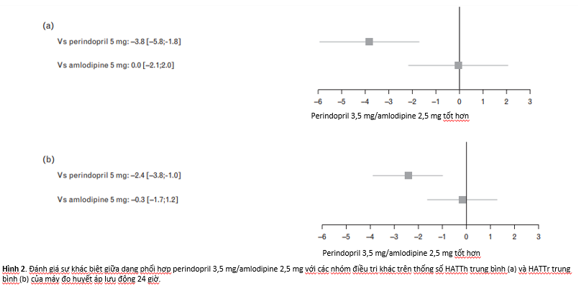
Mức hạ HATTh/HATTr trung bình 24 giờ nhiều hơn ở nhóm dùng dạng phối hợp khi so với perindopril 5 mg [-3,8/-2,4 ; KTC 95% (-5,8 ; -1,8)/(-3,8 ; – 1,0)] và tương đương khi so với amlodipine 5 mg [0,0/-0,3 ; KTC 95% (-2,1 ; 2,0)/(-1,7 ; 1,2) (xem hình 2).
So sánh hiệu quả điều trị giữa từng thành phần dùng riêng rẽ
Các tác giả so sánh hiệu quả hạ HATTh khi nằm ngửa của từng thành phần dùng riêng rẽ với liều giống như liều ở trong dạng phối hợp (perindopril 3,5 mg và amlodipine 2,5 mg). Mức hạ HATTh ở nhóm perindopril 3,5 mg là 16,3 mmHg và nhóm amlodipine 2,5 mg là 16,0 mmHg – tương tự nhau. Mức khác biệt ước tính giữa 2 nhóm chỉ là -0,19 mmHg. Nếu lấy khoảng giới hạn 3 mmHg để quy ước là tương đương, cả 2 thành phần dùng riêng lẻ cho thấy có giá trị tương tự nhau (p = 0,008) (dùng kiểm định tương đương Schuirman).
Phân tích tính an toàn:
Trong bảng 5, các tác giả tóm tắt các phản ứng bất lợi xuất hiện hoặc diễn biến xấu hơn trong suốt quá trình nghiên cứu. Tỷ lệ mắc các phản ứng bất lợi ở nhóm dùng dạng phối hợp là 18,9%, hơi cao hơn nhóm giả dược (15,9%), tương đương với nhóm perindopril 3,5 mg (18,7%) và nhóm amlodipine 2,5 mg (18,6%). Nhóm amlodipine 5 mg có tỷ lệ gặp phản ứng bất lợi cao nhất (21,6%). Trong suốt nghiên cứu, không có trường hợp phù mạch nào mặc dù có 2 bệnh nhân được báo cáo là có phù ở mặt (một bệnh nhân ở nhóm perindopril 3,5 mg và một bệnh nhân ở nhóm amlodipine 5 mg). Phản ứng bất lợi nghiêm trọng rất hiếm gặp trong nghiên cứu, cụ thể là không có ca nào ở nhóm thuốc phối hợp, 1 ca ở nhóm giả dược; so với 4 ca ở nhóm perindopril 5 mg và 3 ca ở nhóm amlodipine 5 mg. Có 1 ca tử vong trong giai đoạn nghiên cứu. Đây là một bệnh nhân nam 47 tuổi thuộc nhóm perindopril 5 mg tử vong do đuối nước 15 ngày sau khi uống viên thuốc đầu tiên của nghiên cứu. Tai nạn này bất ngờ xảy ra và không liên quan đến thuốc nghiên cứu. Về mặt xét nghiệm sinh hóa máu và huyết học tế bào, không có bất kỳ sự biến đổi hoặc khác biệt nào có ý nghĩa lâm sàng giữa các nhóm bệnh nhân.
Các tác giả đã tiến hành một phân tích đặc biệt đánh giá mối liên hệ giữa các phản ứng bất lợi với amlodipine hoặc perindopril. Các phân tích so sánh quy chuẩn khác cũng được tiến hành để so sánh dạng thuốc phối hợp với từng thành phần riêng lẻ dùng với liều thấp nhất được chuẩn y (perindopril 5 mg và amlodipine 5 mg). Nhóm dùng thuốc phối hợp có tỷ lệ phù chi dưới được báo cáo là phản ứng bất lợi hoặc ghi chú trong hồ sơ khám lâm sàng thấp hơn nhóm dùng amlodipine 5 mg (xem bảng 6).
Trong 3 nhóm bệnh nhân (nhóm thuốc phối hợp, nhóm perindopril 5 mg và nhóm amlodipine 5 mg), không thấy có trường hợp nào được ghi nhận tụt huyết áp trong mục phản ứng bất lợi. Chỉ có 1 bệnh nhân ở nhóm amlodipine 5 mg được ghi nhận gặp phản ứng bất lợi là hạ huyết áp tư thế. Hạ huyết áp tư thế gặp thường xuyên hơn ở nhóm amlodipine 5 mg (15 ca, chiếm 5,7%), trong khi nhóm dùng dạng phối hợp là 10 ca, chiếm 4,1%. Tuy nhiên, sự khác biệt này không có ý nghĩa thống kê. Tỷ lệ đau đầu và ho khan tương tự ở ba nhóm bệnh nhân (xem bảng 6).
Kết quả xét nghiệm các mẫu máu cho thấy khả năng gặp ca bệnh có biểu hiện lâm sàng rõ rệt của tăng kali máu (> 5,8 mmol/l) và mức thanh thải creatinin giảm (< 60 ml/phút) là tương đương nhau ở 3 nhóm (xem bảng 6).
BÀN LUẬN
Kết quả chính của nghiên cứu này cho thấy dạng thuốc phối hợp perindopril 3,5 mg/amlodipine 2,5 mg có hiệu lực đáng kể và rất thích hợp trên lâm sàng trong việc hạ huyết áp khi so sánh với giả dược ở bệnh nhân tăng huyết áp không biến chứng mức độ nhẹ đến trung bình. Dạng thuốc phối hợp cũng tỏ ra ưu việt hơn so với từng thành phần dùng riêng lẻ và cho thấy không kém hơn khi so với từng thành phần dùng riêng rẽ ở liều thấp nhất được chuẩn thuận. Phép so sánh không kém hơn này tuân theo quy chuẩn được đề ra trong các khuyến cáo hướng dẫn cách thức lượng giá sự không kém hơn phù hợp với thực tế lâm sàng [15]. Thêm vào đó, 2 thành phần trong dạng thuốc phối hợp này có đóng góp tương đương nhau vào hiệu quả hạ áp nhờ sự lựa chọn hàm lượng tối ưu. Phù chi dưới vốn đã được xác định là tác dụng bất lợi phụ thuộc mức liều của amlodipine. Dạng thuốc phối hợp có nhiều ưu điểm hơn xét về tính an toàn cho bệnh nhân, thể hiện ở tỷ lệ phù chi dưới thấp hơn khi so sánh với từng thành phần riêng lẻ dùng với liều thấp nhất cho phép. Các kết quả này chỉ ra rằng, dạng thuốc phối hợp rất tiềm năng cho điều trị đầu tay bệnh nhân tăng huyết áp.
Các khuyến cáo hiện hành nhấn mạnh lợi ích tiềm tàng của việc khởi đầu điều trị tăng huyết áp bằng viên thuốc phối hợp liều cố định, với ý nghĩa làm đơn giản hóa việc uống thuốc và giúp cải thiện khả năng kiểm soát huyết áp [7, 9, 10]. Bằng chứng là có nhiều bệnh nhân đạt được huyết áp mục tiêu khi khởi trị bằng thuốc phối hợp liều thấp hơn so với thử đơn trị liệu lần lượt từng thuốc hoặc điều trị từng bậc [17]. Tương tự, nếu xét về khía cạnh đạt huyết áp mục tiêu, một lược đồ tiếp cận điều trị đơn giản hóa với khởi đầu bằng thuốc phối hợp liều cố định sẽ có hiệu quả hơn nhiều cách tiếp cận truyền thống khác với đơn trị liệu [18]. Kể từ khi khuyến cáo điều trị về vấn đề này ra đời, có hai nghiên cứu gần đây cung cấp thêm nhiều bằng chứng. Thứ nhất là một Nghiên cứu sổ bộ về Tăng huyết áp của Mạng lưới kết nối Nghiên cứu Tim mạch (Cardiovascular Research Network Hypertension Registry) bao gồm 160.000 bệnh nhân tăng huyết áp mới được chẩn đoán. Nghiên cứu này cho thấy việc khởi đầu điều trị bằng thuốc dạng phối hợp có liên quan đến tăng tỷ lệ kiểm soát được huyết áp ở thời điểm 12 tháng khi so sánh với khởi trị bằng đơn trị liệu [19]. Ngoài ra, một nghiên cứu khác thu thập dữ liệu của 106.000 bệnh nhân từ 180 trung tâm chỉ ra rằng, khởi trị với thuốc phối hợp liều cố định mang lại khả năng kiểm soát huyết áp vượt trội trong năm đầu tiên khi so với đơn trị liệu hoặcphối hợp thuốc dạng rời [20]. Việc nhanh chóng kiểm soát được huyết áp có thể giúp cải thiện kết cục lâm sàng. Nghiên cứu VALUE (Valsartan Antihypertensive Long-term Use Evaluation) cho thấy, bất kể cách thức điều trị như thế nào, việc kiểm soát được huyết áp trong vòng 6 tháng mang lại những lợi ích rõ rệt trong cải thiện dự hậu cho bệnh nhân [21].
Kiểu phối hợp giữa một loại thuốc ức chế men chuyển dạng angiotensin và một loại thuốc chẹn kênh canxi là một cách thức hợp lý do kết hợp được nhiều cơ chế hạ áp. Khuyến cáo của Hội Tim mạch Châu Âu ưu tiên kiểu phối hợp này [9]. Mặc dù lợi ích chủ yếu của điều trị tăng huyết áp có được nhờ vào việc hạ số đo huyết áp [9], tuy nhiên, có những bằng chứng cho thấy một kiểu phối hợp thuốc nào đó có thể mang lại kết cục tim mạch tốt hơn so với các kiểu phối hợp khác. Một phân tích gộp quy mô lớn bao gồm 20 thử nghiệm lâm sàng về điều trị tăng huyết áp được tiến hành trong giai đoạn 2000 – 2011 chỉ ra rằng, điều trị tăng huyết áp với một thuốc ức chế men chuyển dạng angiotensin có liên quan đến giảm rõ rệt tỷ lệ tử vong do mọi nguyên nhân khoảng 10% khi so với các nhóm thuốc hạ áp khác; trong khi đó thuốc ức chế thụ thể angiotensin không có bằng chứng giảm tỷ lệ tử vong [22]. Trong thử nghiệm ASCOT-BPLA (Anglo-Scandinavian Cardiac Outcomes Trial – Blood Pressure Lowering Arm) [23], điều trị với amlodipine và perindopril giúp giảm nhiều biến cố tim mạch nặng và tỷ lệ tử vong chung do mọi nguyên nhân hơn khi so với kiểu phối hợp atenolol và lợi tiểu thiazide. Lợi ích trên kết cục tim mạch này được một nghiên cứu chứng minh lần đầu tiên và được củng cố nhờ những bằng chứng thể hiện mức giảm rõ rệt huyết áp hệ thống khi phối hợp amlodipine và perindopril, đồng thời huyết áp đo tại phòng khám cũng hạ tương đươngở cả hai tay[24]. Theo kết quả thử nghiệm ACCOMPLISH (Avoiding Cardiovascular Events in Combination Therapy in Patients Living with Systolic Hypertension), kiểu phối hợp một ức chế men chuyển (benazepril) và amlodipine tỏ ra có hiệu quả hơn hẳn trong việc giảm biến cố tim mạch so với kiểu phối hợp cùng loại ức chế men chuyển đó với hydrochlorothiazide, mặc dù xét về mặt số đo, mức hạ huyết áp là tương đương. Vì lý do này, thử nghiệm ACCOMPLISH đã được kết thúc trước thời hạn [25].
Khuyến cáo điều trị tăng huyết áp của Hội Tim mạch Châu Âu nhấn mạnh rằng, cần phải tìm mọi cách để giảm thiểu tác dụng phụ của thuốc, một phần bởi vì tác dụng bất lợi của thuốc là một trong các nguyên nhân làm giảm sự tuân thủ điều trị của bệnh nhân [9]. Trong nghiên cứu này, dạng thuốc phối hợp có khả năng dung nạp rất tốt và an toàn. Ở nhóm bệnh nhân uống dạng thuốc phối hợp, không có bất kỳ phản ứng bất lợi nghiêm trọng nào xảy ra, đồng thời, tỷ lệ gặp phản ứng bất lợi là tương đương giữa các nhóm nghiên cứu. Một ngoại lệ là tỷ lệ tác dụng phụ phù chi dưới ở nhóm uống dạng phối hợp thấp hơn nhóm amlodipine 5 mg. Phù chi dưới vốn được biết đến là tác dụng bất lợi phụ thuộc liều lượng của amlodipine [13]. Lý do dạng thuốc phối hợp có tỷ lệ phù chi dưới thấp có lẽ chủ yếu do hàm lượng amlodipine trong dạng phối hợp thấp hơn so với hàm lượng amlodipine đơn trị liệu. Tuy nhiên, cơ chế tác động qua lại giữa chất chẹn kênh canxi và chất ức chế men chuyển cũng có thể là nguyên nhân làm giảm phù. Trong hai nghiên cứu về vấn đề này, các tác giả cho thấy việc thêm ức chế men chuyển cho một bệnh nhân vốn đang uống chẹn kênh canxi từ trước giúp chống lại sự thay đổi vi tuần hoàn tại chỗ – là nguyên nhân gây phù, đồng thời làm giảm tỷ lệ phù và ngăn chặn sự gia tăng thể tích dịch vùng mắt cá chân và làm giảm áp lực mô dưới da ở mặt trước xương chày, mặc dù liều chẹn kênh canxi không hề thay đổi [27]. Phản ứng bất lợi của thuốc ức chế men chuyển đã được chứng minh là không phụ thuộc liều [13], và trong nghiên cứu này, tỷ lệ gặp ho khan và tăng kali máu đều thấp và tương đương giữa các nhóm. Ngoài ra, một tác dụng phụ khác có thể xảy ra khi khởi đầu điều trị tăng huyết áp là phản ứng tụt huyết áp. Tuy nhiên, trong nghiên cứu này, đối với nhóm dùng thuốc phối hợp, không có trường hợp nào gặp phản ứng bất lợi liên quan đến tụt huyết áp hoặc hạ huyết áp tư thế. Tình trạng hạ huyết áp tư thế được tính toán dựa trên các số đo huyết áp gặp ít hơn ở nhóm dùng thuốc phối hợp so với nhóm amlodipine 5 mg, nhưng sự khác biệt không có ý nghĩa thống kê.
Điểm hạn chế chủ yếu của nghiên cứu này là giai đoạn điều trị phân nhóm ngẫu nhiên tương đối ngắn (8 tuần) và loại trừ những bệnh nhân nguy cơ tim mạch cao như béo phì, hoặc bệnh nhân có biến chứng của tăng huyết áp như có vi đạm niệu, tiền sử biến cố tim mạch hoặc đái tháo đường. Tuy nhiên, việc loại trừ những bệnh nhân này cũng cần thiết vì đây là một nghiên cứu có nhóm sử dụng giả dược. Những bệnh nhân có tình trạng kháng chất ức chế men chuyển và chẹn kênh canxi không được tuyển vào nghiên cứu vì một khi đã có tình trạng này, bệnh nhân cũng không nên được chỉ định các nhóm thuốc này trong thực hành lâm sàng.
Tựu chung lại, dạng thuốc phối hợp perindopril 3,5 mg/amlodipine 2,5 mg cho thấy hiệu quả hạ áp vượt trội hơn so với giả dược và không kém hơn liều thấp nhất dùng trên lâm sàng đã được chuẩn thuận của perindopril là 5 mg và amlodipine là 5 mg. Ngoài ra, cả hai thành phần của dạng thuốc phối hợp có đóng góp tương đương nhau vào tác dụng hạ áp. Đây là lý do giải thích tại sao dạng thuốc phối hợp được dung nạp rất tốt và ít gặp tác dụng bất lợi phụ thuộc liều khiso sánh với amlodipine 5 mg. Vì vậy, dạng thuốc phối hợp tỏ ra rất thích hợp cho điều trị khởi đầu bệnh nhân tăng huyết áp.
SỰ THỪA NHẬN
Nghiên cứu được tài trợ bởi Servier
Xung đột lợi ích
Các tác giả đã được nhận thù lao và tài trợ nghiên cứu bởi Servier. Các tác giả không có bất kì liên quan tài chính tới tổ chức nào có xung đột lợi ích với chủ đề nghiên cứu trong bài báo này.
TÀI LIỆU THAM KHẢO
- Kearney PM, Whelton M, Reynolds K, Muntner P, Whelton PK, He J.Global burden of hypertension: an analysis of worldwide data.Lancet2005; 365:217–223.
- Fields LE, Burt VL, Cutler JA, Hughes J, Roccella EJ, Sorlie P. The burdenof adult hypertension in the United States 1999 to 2000: a rising tide.Hypertension 2004; 44:398–404.
- Lawes CM, Vander Hoorn S, Rodgers S, International Society ofHypertension. Global burden of blood-pressure-related disease,2001. Lancet 2008; 371:1513–1518.
- Primatesta P, Poulter NR. Improvement in hypertension managementin England: results from the Health Survey for England 2003. J Hypertens2006; 24:1187–1192.
- Falaschetti E, Chaudhury M, Mindell J, Poulter N. Continued improvementin hypertension management in England: results from the HealthSurvey for England 2006. Hypertension 2009; 53:480–486.
- Costanzo S, Di Casatelnuovo A, Zito F, Krogh V, Siani A, Arnout J, et al.,European Collaborative Group of the IMMIDIET project.Prevalence,awareness, treatment and control of hypertension in healthy unrelatedmale-female pairs of European regions: the dietary habit profile inEuropean communities with different risks of myocardial infarctiontheimpact of migration as a model of geneenvironment interactionproject. J Hypertens 2008; 26:2303–2311.
- Chobanian AV, Bakris GL, Black HR, Cushman WC, Green LA, Izzo JLJr, et al., Joint National Committee on Prevention, Detection, Evaluation,and Treatment of High Blood Pressure. National Heart, Lung,and Blood Institute; National High Blood Pressure Education ProgramCoordinating Committee. Seventh report of the Joint National Committeeon Prevention, Detection, Evaluation, and Treatment of HighBlood Pressure. Hypertension 2003; 42:1206–1252.
- Mancia G, De Backer G, Dominiczak A, Cifkova R, Fagard R, GermanoG, et al. 2007 Guidelines for the management of arterial hypertension:the Task Force for the Management of Arterial Hypertension of theEuropean Society of Hypertension (ESH) and of the European Societyof Cardiology (ESC). Eur Heart J 2007; 28:1462–1536.
- Mancia G, Fagard R, Narkiewicz K, Redon J, Zanchetti A, Bo¨hm M, et al.2013 ESH/ESC guidelines for the management of arterial hypertension:The Task Force for the Management of Arterial Hypertension of theEuropean Society of Hypertension (ESH) and of the European Societyof Cardiology (ESC). Eur Heart J 2013; 34:2159–2219.
- Khan NA, Hemmelgarn B, Herman RJ, Bell CM, Mahon JL, Leiter LA,et al. The 2009 Canadian Hypertension EducationProgramrecommendations for the management of hypertension: part 2:therapy. Can J Cardiol 2009; 25:287–298.
- Thoenes M, Neuberger HR, Volpe M, Khan BV, Kirch W, Bo¨hm M.Antihypertensive drug therapy and blood pressure control in men andwomen: an international perspective. J Hum Hypertens 2010; 24:336–344.
- Wald DS, Law M, Morris JK, Bestwick JP, Wald NJ. Combination therapyversus monotherapy in reducing blood pressure: meta-analysis on11 000 participants from 42 trials. Am J Med 2009; 122:290–300.
- Law MR, Wald NJ, Morris JK, Jordan RE. Value of low dose combinationtreatment with blood pressure lowering drugs: analysis of 354 randomisedtrials. Br Med J 2003; 326:1427–1431.
- Bangalore S, Kamalakkannan G, Parkar S, Messerli FH. Fixed-dosecombinations improve medication compliance: a meta-analysis. Am JMed 2007; 120:713–719.
- Committee for Medicinal Products for Human Use (CHMP). Note forguidance on clinical investigation of medicinal products in the treatmentof hypertension. CPMP/EWP/238/95 Rev 2. London; 2004.
- Topouchian JA, El Assaad MA, Orobinskaia LV, El Feghali RN, AsmarRG. Validation of two devices for self-measurement of brachial bloodpressure according to the International Protocol of the EuropeanSociety of Hypertension: the SEINEX SE-9400 and the Microlife BP3AC1-1. Blood Press Monit 2005; 10:325–331.
- Mourad JJ, Waeber B, Zannad F, Laville M, Duru G, Andre´jak: investigatorsof the STRATHE trial. Comparison of different therapeutic
strategies in hypertension: a low-dose combination of perindopril/indapamide versus sequential monotherapy of a stepped-careapproach. J Hypertens 2004; 22:2379–2386.
- Feldman RD, Zou GY, Vandervoort MK, Wong CJ, Nelson SA, FeaganBG. A simplified approach to the treatment of uncomplicated hypertension:a cluster randomized, controlled trial. Hypertension 2009;53:646–653.
- Byrd JB, Zeng C, Tavel HM, Magid DJ, O’Connor PJ, Margolis KL, et al.Combination therapy as initial treatment for newly diagnosed hypertension.Am Heart J 2011; 162:340–346.
- Egan BM, Bandyopadhyay D, Shaftman SR, Wagner CS, Zhao Y,Yu-Isenberg KS. Initial monotherapy and combination therapy and
hypertension control the first year. Hypertension 2012; 59:1124–1131.
- Weber MA, Julius S, Kjeldsen SE, Brunner HR, Ekman S, Hansson L,et al. Blood pressure dependent and independent effects of antihypertensivetreatment on clinical events in the VALUE trial. Lancet 2004;363:2049–2051.
- van Vark LC, Bertrand M, Akkerhuis KM, Brugts JJ, Fox K, Mourad JJ,Boersma E. Angiotensin-converting enzyme inhibitors reduce mortalityin hypertension: a meta-analysis of randomized clinical trials of reninangiotensin-aldosterone system inhibitors involving 158 998 patients.Eur Heart J 2012; 33:2088–2097.
- Dahlo¨f B, Sever PS, Poulter NR, Wedel H, Beevers DG, Caulfield M,et al., ASCOT Investigators. Prevention of cardiovascular events withan antihypertensive regimen of amlodipine adding perindopril asrequired versus atenolol adding bendroflumethiazide as required, inthe Anglo-Scandinavian Cardiac Outcomes Trial-Blood Pressure LoweringArm (ASCOT-BPLA): a multicentre randomised controlled trial.Lancet 2005; 366:895–906.
- Williams B, Lacy PS, Thom SM, Cruickshank K, Stanton A, Collier D, etal. Differential impact of blood pressure-lowering drugs on centralaortic pressure and clinical outcomes: principal results of the ConduitArtery Function Evaluation (CAFE) study. Circulation 2006;113:1213–1225.
- Jamerson K, Weber MA, Bakris GL, Dahlo¨f B, Pitt B, Shi V, et al.,ACCOMPLISH Trial Investigators. Benazepril plus amlodipine or
hydrochlorothiazide for hypertension in high-risk patients. N Engl JMed 2008; 359:2417–2428.
- Miranda RD, Mion D Jr, Rocha JC, Kohlmann O Jr, Gomes MA, SaraivaJF, et al. An 18-week, prospective, randomized, double-blind, multicenterstudy of amlodipine/ramipril combination versus amlodipinemonotherapy in the treatment of hypertension: the Assessment ofcombination Therapy of Amlodipine/Ramipril (ATAR) study. Clin Ther
2008; 30:1618–1628.
- Fogari R, Malamani G, Zoppi A, Mugellini A, Rinaldi A, Fogari E,Perrone T. Effect on the development of ankle edema of addingdelapril to manidipine in patients with mild to moderate essentialhypertension: a three-way crossover study. Clin Ther 2007; 29:413–418.







