Tác động của việc kiểm soát đường huyết tích cực trên các kết cục chính về thận ở bệnh nhân Đái tháo đường típ 2 vẫn chưa được biết rõ.
Người dịch: ThS.BS. Trần Ngọc Hoàng
Khoa Nội tiết BV. Chợ Rẫy
Hiệu chỉnh: ThS.BS. Lâm Văn Hoàng
Trưởng khoa Nội tiết BV. Chợ Rẫy
Vlado Perkovic1, Hiddo Lambers Heerspink2, John Chalmers1, Mark Woodward1,3, Min Jun1, Qiang Li1,
Stephen MacMahon1,4, Mark E. Cooper5, Pavel Hamet6, Michel Marre7, Carl Erik Mogensen8, Neil Poulter9,
Giuseppe Mancia10, Alan Cass1, Anushka Patel1 and Sophia Zoungas1,11, Nhóm cộng sự nghiên cứu ADVANCE
1Viện Sức Khỏe Toàn Cầu George, Đại học Sydney, Sydney, New South Wales, Úc; 2 Khoa Dược Lâm sàng, Trung Tâm Đại Học Y Dược, Groningen, Hà Lan;
3 Bộ Môn Dịch Tễ Học, Đại học John Hopkins, Baltimore, Maryland, Hoa Kỳ; 4 Trung tâm George, Đại học Oxford, Oxford, Vương Quốc Anh; 5
Viện Tim và Đái tháo đường Baker IDI, Melbourne, Victoria, Úc; 6 Bệnh viện Đại học Montreal, Montreal, Canada; 7
Bệnh viện Bichat-Claude Bernard, Đại học Paris 7, Paris, Pháp; 8 Khoa Y, Bệnh viện Đại học Aarhus, Aarhus, Đan Mạch; 9
Trường Cao đẳng Hoàng gia và Bệnh viện St Mary, Luân Đôn, Vương Quốc Anh; 10 Đại học Milan-Bicocca và Bệnh viện Gerardo, Milan, Ý và 11
Trường Y tế Công cộng và Y học Dự phòng, Đại học Monash, Melbourne, Victoria, Úc.
Để nghiên cứu về vấn đề này, thử nghiệm ADVANCE đã phân nhóm ngẫu nhiên 11,140 đối tượng vào 2 nhóm: kiểm soát đường huyết tích cực (mục tiêu HbA1c ≤6.5%) hay nhóm kiểm soát đường huyết thường quy. Tác động của việc điều trị trên bệnh thận mạn giai đoạn cuối ((ESRD), tình trạng cần lọc thận hay ghép thận), tổng hợp các biến cố về thận, tử vong do bệnh thận, tăng gấp đôi creatinin huyết thanh trên 200 μmol/l, tiểu albumin đại thể hoặc vi thể mới mắc, và sự tiến triển hoặc thoái triển của albumin niệu được đánh giá. Sau thời gian theo dõi trung vị 5 năm, nồng độ HbA1c trung bình là 6.5% ở nhóm điều trị tích cực, và 7.3% ở nhóm điều trị thường quy. Việc kiểm soát đường huyết tích cực giúp làm giảm có ý nghĩa nguy cơ bệnh thận mạn giai đoạn cuối lên đến 65% (20 so với 7 biến cố), tiểu albumin vi thể giảm 9% (1298 so với 1410 bệnh nhân), và tiểu albumin đại thể giảm 30% (162 so với 231 bệnh nhân). Tiến triển của tình trạng tiểu albumin niệu giảm có ý nghĩa 10% và sự thoái triển của tình trạng albumin niệu tăng 15%. Các kết quả này gần như không thay đổi khi phân tích cùng các yếu tố nguy cơ khác. Số đối tượng tham gia cần điều trị hơn 5 năm để phòng ngừa 1 biến cố bệnh thận mạn giai đoạn cuối dao động từ 410 trong toàn nghiên cứu đến 41 ở những trường hợp tiểu albumin đại thể ở thời điểm ban đầu. Vì vậy, cải thiện việc kiểm soát đường huyết sẽ giúp cải thiện các kết cục chính về thận ở bệnh nhân đái tháo đường típ 2.
Kidney International(2013) 83, 517-523; doi: 10.1038/ki.2012.401; ấn bản trực tuyến 9 – 01 – 2013
TỪ KHÓA: huyết áp, các biến cố tim mạch; bệnh thận mạn; thử nghiệm lâm sàng; dịch tễ học và các kết cục.
Số lượng người cần lọc thận để điều trị bệnh thận mạn giai đoạn cuối (ERSD) đang gia tăng nhanh chóng trên toàn thế giới. 1 Tình trạng gia tăng này luôn song hành với tình trạng gia tăng tỷ lệ bệnh đái tháo đường, 2 và hiện tại đái tháo đường là nguyên nhân thường gặp nhất của bệnh thận mạn giai đoạn cuối ở những nước phát triển.1 Cùng với sự gia tăng của bệnh suất, tình trạng tử vong sớm và giảm chất lượng cuộc sống ở những người bị bệnh thận mạn giai đoạn cuối, dự liệu cho việc lọc thận sẽ tạo ra một gánh nặng khổng lồ về mặt xã hội và tài chính. Hàng năm, Hoa Kỳ phải chi hơn 40 triệu đô la chỉ cho việc lọc thận, tương đương khoảng 6% ngân sách cho toàn bộ y tế , với số lượng bệnh nhân cần lọc thận chiếm khoảng 0.1% dân số Hoa Kỳ.1
Thử nghiệm ADVANCE cho thấy việc kiểm soát đường huyết tích cực giúp làm giảm nguy cơ hỗn hợp của bệnh thận mới mắc hay bệnh thận nặng hơn, giảm sự xuất hiện tiểu albumin đại thể, bệnh thận mạn giai đoạn cuối, tử vong do bệnh thận, và tăng gấp đôi creatinin máu trên 200 μmol/l.9 Gần đây, có những mối quan tâm về độ tin cậy của các kết cục đại diện như sự thay đổi albumin niệu hay sự gia tăng gấp đôi nồng độ creatin máu, như là những dấu chỉ cho bệnh thận mạn giai đoạn cuối. Vì vậy, trong phân tích này, chúng tôi khảo sát các tác động của việc kiểm soát đường huyết tích cực trên các kết cục thận đặc trưng, bao gồm bệnh thận mạn giai đoạn cuối và số lượng các kết cục thận đã được xác định từ trước và mới xuất hiện để có thể đạt được mức độ chính xác và hằng định cao hơn cũng như để hiểu rõ hơn về tác động của việc kiểm soát đường huyết tích cực trên thận.
|
Bảng 1| Các đặc điểm cơ bản của nhóm phân bố ngẫu nhiên |
||
|
Các đặc điểm cơ bản |
Thường quy (n = 5569) |
Tích cực (n = 5571) |
|
Tuổi (năm; trung bình, độ lệch chuẩn.) |
65.8 (6.4) |
65.7 (6.4) |
|
HbA1c(%; trung bình, độ lệch chuẩn.) |
7.5(1.5) |
7.5(1.6) |
|
Huyết áp tâm thu(mmHg; trung bình, độ lệch chuẩn.) |
145.0(21.4) |
145.0(21.7) |
|
Huyết áp tâm trương(mmHg; trung bình, độ lệch chuẩn.) |
80.5(10.8) |
80.8(11.0) |
|
Creatinin huyết thanh(μmol/l; trung bình, độ lệch chuẩn.) |
86.8(26.8) |
86.3(23.8) |
|
Tỷ lệ albumin/creatinin niệu (trung bình, độ lệch chuẩn.) |
53.0 (117) |
52.0(113) |
|
Tỷ lệ albumin/creatinin niệu (trung vị, khoảng tứ phân vị) |
14.9 (7.1 – 39.8) |
15.0 (7.1 – 39.0) |
|
eGFR (ml/phút/1.73m2; trung bình, độ lệch chuẩn.) |
78.0(24.7) |
78.3(24.8) |
|
eGFR (trung vị, khoảng tứ phân vị) |
75.7 (63.0 – 89.3) |
75.8 (63.8 – 89.7) |
|
Mức eGFR ≥ 60 (n,%) |
4479(80.4) |
4513 (80.9) |
|
Mức eGFR <60 (n,%) |
1090 (19.6) |
1058 (19.1) |
|
Tiểu albumin vi thể (n,%) |
1423 (26.7) |
1434 (27.0) |
|
Tiểu albumin đại thể (n,%) |
215 (4.0) |
189 (3.6) |
|
Không bệnh thận mạn |
3052 (54.8) |
3065 (55.0) |
|
Bệnh thận mạn giai đoạn 1 |
383 (6.9) |
421 (7.6) |
|
Bệnh thận mạn giai đoạn 2 |
855 (15.4) |
803 (14.4) |
|
Bệnh thận mạn giai đoạn 3 |
1060 (19.0) |
1034 (18.6) |
|
Với tiểu albumin vi thể hoặc tiểu albumin đại thể |
368 (6.6) |
379 (6.8) |
|
Không có tiểu albumin vi thể và tiểu albumin đại thể |
692 (12.4) |
655 (11.8) |
|
Bệnh thận mạn giai đoạn 4 |
28 (0.5) |
23 (0.4) |
|
Bệnh thận mạn giai đoạn 5 |
3 (0.05) |
1 (0.02) |
|
Viết tắt: eGFR: độ lọc cầu thận ước đoán |
||
Tác động trên các biến cố chính về thận
Đường cong Kaplan-Meier về tác động của việc kiểm soát đường huyết tích cực trên các kết cục thận riêng lẻ được thể hiện trong hình 1, và tỷ số nguy cơ (HRs) qua toàn bộ thời gian theo dõi được tóm tắt trong hình 2. Nguy cơ bệnh thận mạn giai đoạn cuối ở nhóm được điều trị tích cực thấp hơn 65% so với nhóm điều trị thường quy (khoảng tin cậy 95% 17 – 85%, P=0.017), với đường cong được tách biệt rõ từ thời điểm sau 2 năm trở đi (Hình 1),
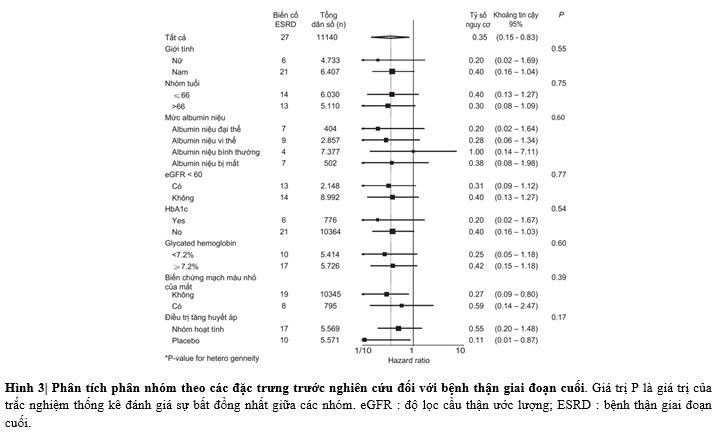
Phân tích phân nhóm (Hình 3) gợi ý rằng tác động này tương tự cho cả các đối tượng có mức HbA1c trên hoặc dưới mức trung vị, và cho cả những người có hoặc không có bằng chứng của tình trạng tổn thương thận hay bệnh võng mạc. Lợi ích tương tự cũng được thấy ở những đối tượng có thời gian mắc bệnh đái tháo đường từ hoặc trên mức trung vị 7 năm (HR 0.52, khoảng tin cậy 95% 0.21 – 1.33
Trị số tuyệt đối và số đối tượng cần điều trị (NNT) trong vòng 5 năm để phòng ngừa 1 biến cố bệnh thận mạn giai đoạn cuối được thể hiện trong hình 2. Qua toàn bộ dân số nghiên cứu, 410 người cần được điều trị kiểm soát đường huyết tích cực để phòng ngừa 1 biến cố bệnh thận mạn giai đoạn cuối. Trong phân nhóm dân số có nguy cơ cao bị bệnh thận, số đối tượng cần điều trị (NNT) trong vòng 5 năm để phòng ngừa 1 biến cố bệnh thận mạn giai đoạn cuối là 85 ở những đối tượng có lọc cầu thận ước đoán dưới 60 ml/phút/m2 có kèm tiểu albumin vi thể hoặc tiểu albumin đại thể, và khoảng 41 ở những đối tượng có tiểu albumin đại thể.
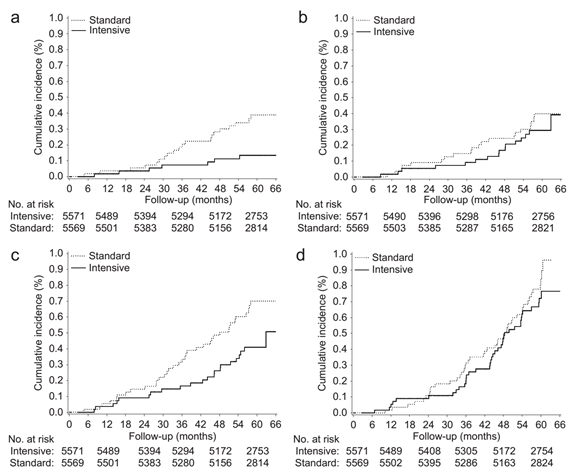
Hình 1: Biến cố bệnh thận phân chia ngẫu nhiên: đường cong Kaplan – Meier mô tả sự tác động đến (a) bệnh thận mạn giai đoạn cuối (ERSD), (b) tử vong do bệnh thận, (c) bệnh thận mạn giai đoạn cuối hoặc tử vong do bệnh thận, và (d) tăng gấp đôi lượng creatinin máu lên ít nhất 200 μmol/l bởi sự phân chia ngẫu nhiên nhóm (tạm thời hoặc kéo dài). (a) Bệnh thận mạn giai đoạn cuối. Tỷ số nguy cơ ở nhóm tích cực so với nhóm chứng: 0.35, khoảng tin cậy 95% 0.15 – 0.83, P = 0.01. (b) Tử vong do bệnh thận. Tỷ số nguy cơ ở nhóm tích cực so với nhóm chứng: 0.85, khoảng tin cậy 95% 0.45 – 1.63, P = 0.63. (c) Kết hợp bệnh thận mạn giai đoạn cuối và tử vong do bệnh thận. Tỷ số nguy cơ ở nhóm tích cực so với nhóm chứng: 0.64, khoảng tin cậy 95% 0.38 – 1.08, P = 0.09. (d) Tăng gấp đôi nồng độ creatinin máu kéo dài. Tỷ số nguy cơ ở nhóm tích cực so với nhóm chứng: 0.83, khoảng tin cậy 95% 0.54 – 1.27, P = 0.38.
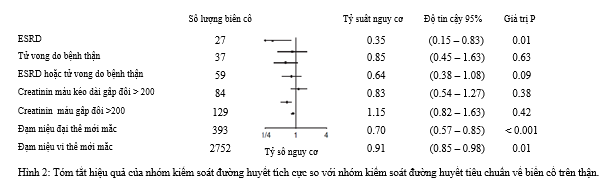
Tác động trên albumin niệu
Tác động của kiểm soát đường huyết tích cực trên tình trạng tiểu albumin được thể hiện ở bảng 3. Trong số các đối tượng có tình trạng albumin niệu bình thường ở thời điểm ban đầu, nguy cơ tiến triển tiểu albumin vi thể giảm được 9% (khoảng tin cậy 95% 2 – 25%, P = 0.01). Nguy cơ tiến triển tiểu albumin đại thể giảm được 30% trong số các đối tượng có tình trạng albumin niệu bình thường hoặc tiểu albumin vi thể ở thời điểm ban đầu (khoảng tin cậy 95% 15 – 43%, P < 0.001). Khả năng tiến triển của tình trạng albumin niệu giảm trong khi khả năng thoái triển và bình thường hóa sự tiết albumin trong nước tiểu được gia tăng ở nhóm kiểm soát đường huyết tích cực.
Phân tích độ nhạy cảm phân tầng theo quốc gia và hiệu chỉnh với nhánh huyết áp không làm thay đổi những kết quả này (Phụ lục bảng S1 trực tuyến).
BÀN LUẬN
Những dữ liệu mới được trình bày ở đây cung cấp bằng chứng mạnh mẽ nhất rằng việc kiểm soát đường huyết tích cực có thể bảo vệ chống lại tình trạng tiến triển đến bệnh thận mạn giai đoạn cuối, một trong những biến chứng nặng nề và tốn chi phí nhiều nhất của bệnh đái tháo đường. Các kết quả này hằng định theo các mức độ HbA1c, chức năng thận và tình trạng tiểu albumin khác nhau. Các thành viên trong ban nghiên cứu đề nghị rằng các hướng dẫn về điều trị hạ đường huyết nên đưa những tác động này vào, và việc kiểm soát đường huyết tích cực bằng cách dùng các thuốc giống như trong nghiên cứu ADVANCE có thể mang lại lợi ích cho nhiều bệnh nhân đái tháo đường.
|
Bảng 2| Tác động của việc kiểm soát tích cực so với kiểm soát đường huyết thường quy trên albumin niệu |
||||
|
Kết cục |
Tích cực, n(%) |
Thường quy, n(%) |
Tỷ số nguy cơ (khoảng tin cậy 95%) |
P |
|
Tiểu albumin vi thể mới mắc |
1318 (33.5) |
1434 (36.3) |
0.91(0.85 – 0.98) |
0.012 |
|
Tiểu albumin đại thể mới mắc |
162 (3.0) |
231(4.3) |
0.70(0.57 – 0.85) |
0.0004 |
|
Tiến triển albumin niệu ≥ 1 giai đoạna |
1298 (23.3) |
1410 (25.3) |
0.90 (0.84 – 0.97) |
0.0077 |
|
Thoái triển albumin niệu ≥ 1 giai đoạnb |
1003 (61.2) |
914 (56.3) |
1.15 (1.05 – 1.26) |
0.0020 |
|
Thoái triển tới albumin niệu bình thường |
922 (56.3) |
814 (50.2) |
1.20 (1.09 – 1.31) |
0.0002 |
|
a:từ albumin niệu bình thường tới tiểu albumin vi thể hoặc tiểu albumin đại thể hay từ tiểu albumin vi thể tới tiểu albumin đại thể b: từ tiểu albumin đại thể hoặc tiểu albumin vi thể tới albumin niệu bình thường hay từ tiểu albumin đại thể tới tiểu albumin vi thể |
||||
|
Bảng 3| NNT trong 5 năm để phòng ngừa 1 biến cố bệnh thận mạn giai đoạn cuối |
||||
|
|
|
Tỷ lệ các biến cố hàng năm |
|
|
|
Dân số tham gia |
|
|
|
NNT để phòng ngừa 1 biến cố bệnh thận mạn giai đoạn cuối trong 5 năm |
|
Các đối tượng (%) |
Thường quy (%) |
Tích cực (%) |
||
|
Tất cả |
11,140 (100) |
0.075 |
0.026 |
410 |
|
Tiểu albumin (vi thể hoặc đại thể) |
3261(29.3) |
0.17 |
0.039 |
152 |
|
Tiểu albumin đại thể |
404 (3.6) |
0.61 |
0.12 |
41 |
|
eGFR < 60 |
2148 (19.3) |
0.20 |
0.061 |
147 |
|
eGFR < 60 và tiểu albumin |
776 (7.0) |
0.29 |
0.056 |
85 |
|
Viết tắt: eGFR: độ lọc cầu thận ước đoán, NNT: số lượng cần điều trị NNT = 1/ (tỷ lệ biến cố trong nhóm chuẩn x 5 – tỷ lệ biến cố trong nhóm chuẩn x (1 – tỷ số nguy cơ) x 5). |
||||
TÀI LIỆU THAM KHẢO
1. U.S. Renal Data System (2011). USRDS 2011 Annual Data Report: Chapter: Incidence, Prevalence, Patient Charateristics and Treatment Modalities. National Institutes of Health, National Institute of Diabetes and KidneyDiseases: Bethesda, MD, 2011.
2. Wild S, Roglic G, Green A et al. Global prevalence of diabetes: estimates for the year 2000 and projections for 2030. Diabetes Care 2004; 27: 1047–1053.
3. Strippoli GF, Craig M, Deeks JJ et al. Effects of angiotensin converting enzyme inhibitors and angiotensin II receptor antagonists on mortality and renal outcomes in diabetic nephropathy: systematic review. BMJ 2004; 329: 828.
4. Brenner BM, Cooper ME, de Zeeuw D et al. Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy. N Engl J Med 2001; 345: 861–869.
5. Lewis EJ, Hunsicker LG, Clarke WR et al. Renoprotective effect of the angiotensin-receptor antagonist irbesartan in patients with nephropathy due to type 2 diabetes. N Engl J Med 2001; 345: 851–860.
6. Ruggenenti P, Fassi A, Ilieva AP et al. Preventing microalbuminuria in type 2 diabetes. N Engl J Med 2004; 351: 1941–1951.
7. UKPDS Study Group. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). UK Prospective Diabetes Study (UKPDS) Group. Lancet 1998; 352: 837–853.
8. DCCT Group. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulindependent diabetes mellitus. The Diabetes Control and Complications Trial Research Group. N Engl J Med 1993; 329: 977–986.9. ADVANCE Study Group. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. N Engl J Med 2008; 358: 2560–2572.
10. ACCORD Study Group. Effects of intensive glucose lowering in type 2 diabetes. N Engl J Med 2008; 358: 2545–2559.
11. VADT Investigators. Glucose control and vascular complications in veterans with type 2 diabetes. N Engl J Med 2009; 360: 129–139.
12. Calvo G, de Andres-Trelles F. Albuminuria as a surrogate marker for drug development: a European Regulatory perspective. Kidney Int Suppl 2004; 92: S126–S127.
13. Levey AS, Cattran D, Friedman A et al. Proteinuria as a surrogate outcome in CKD: report of a scientific workshop sponsored by the National Kidney Foundation and the US Food and Drug Administration. Am J Kidney Dis 2009; 54: 205–226.
14. Messerli FH, Staessen JA, Zannad F. Of fads, fashion, surrogate endpoints and dual RAS blockade. Eur Heart J 2010; 31: 2205–2208.
15. Macisaac RJ, Jerums G. Diabetic kidney disease with and without albuminuria. Curr Opin Nephrol Hypertens 2011; 20: 246–257.
16. Colagiuri S, Dickinson A, Girgis S, Colagiuri R. National Evidence Based Guideline for Blood Glucose Control in Type 2 Diabetes. Diabetes Australia and the NHMRC: Canberra, 2009.
17. American Diabetes Association. Standards of medical care in diabetes— 2011. Diabetes Care 2011; 34(Suppl 1): S11–S61.
18. Nathan DM, Buse JB, Davidson MB et al. Medical management of hyperglycemia in type 2 diabetes: a consensus algorithm for the initiation and adjustment of therapy: a consensus statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care 2009; 32: 193–203.
19. Ismail-Beigi F, Craven T, Banerji MA et al. Effect of intensive treatment of hyperglycaemia on microvascular outcomes in type 2 diabetes: an analysis of the ACCORD randomised trial. Lancet 2010; 376: 419–430.
20. UK Prospective Diabetes Study Group. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). UK Prospective Diabetes Study (UKPDS) Group. Lancet 1998; 352: 837–853.
21. de Boer IH, Sun W, Cleary PA et al. Intensive diabetes therapy and glomerular filtration rate in type 1 diabetes. N Engl J Med 2011; 365: 2366–2376.
22. Holman RR, Paul SK, Bethel MA et al. 10-year follow-up of intensive glucose control in type 2 diabetes. N Engl J Med 2008; 359: 1577–1589.
23. Fioretto P, Steffes MW, Sutherland DE et al. Reversal of lesions of diabetic nephropathy after pancreas transplantation. N Engl J Med 1998; 339: 69–75.
24. Berl T, Hunsicker LG, Lewis JB et al. Cardiovascular outcomes in the Irbesartan Diabetic Nephropathy Trial of patients with type 2 diabetes and overt nephropathy. (Summary for patients in Ann Intern Med. 2003;138(7):I43; PMID: 12667050). Ann Intern Med 2003; 138: 542–549.
25. GISEN Group. Randomised placebo-controlled trial of effect of ramipril on decline in glomerular filtration rate and risk of terminal renal failure in proteinuric, non-diabetic nephropathy. The GISEN Group (Gruppo Italiano di Studi Epidemiologici in Nefrologia). Lancet 1997; 349: 1857–1863.
26. Yusuf S, Teo KK, Pogue J et al. Ontarget Investigators. Telmisartan, ramipril, or both in patients at high risk for vascular events. N Engl J Med 2008; 358: 1547–1559.
27. Jamerson K, Weber MA, Bakris GL et al. Benazepril plus amlodipine or hydrochlorothiazide for hypertension in high-risk patients. N Engl J Med 2008; 359: 2417–2428.
28. Heerspink HJL, Perkovic V, De Zeeuw D. Is doubling of serum creatinine a valid clinical hard endpoint in clinical nephrology trials? Nephron Clin Pract 2011; 119: 195–199.
29. Hattori S. Sitagliptin reduces albuminuria in patients with type 2 diabetes. Endocr J 2011; 58: 69–73.
30. ADVANCE Study Group. Study rationale and design of ADVANCE: actionin diabetes and vascular disease—preterax and diamicron MR controlled evaluation. Diabetologia 2001; 44: 1118–1120.
31. Gray RJ. A class of K-sample tests for comparing the cumulative incidence of a competing risk. Ann Stat 1988; 16: 1141–1154







